PRODUKSI XILOOLIGOSAKARIDA DARI TONGKOL
JAGUNG MENGGUNAKAN BAKTERI AKTINOMISETES
WIDA SALUPI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Produksi Xilooligosakarida dari Tongkol Jagung Menggunakan Bakteri Aktinomisetes adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2014
Wida Salupi
RINGKASAN
WIDA SALUPI. Produksi Xilooligosakarida dari Tongkol Jagung Menggunakan Bakteri Aktinomisetes. Dibimbing oleh ANJA MERYANDINI dan YOPI
Produksi jagung Indonesia dari tahun ke tahun mengalami peningkatan. Meningkatnya produksi jagung seiring dengan meningkatnya produk samping yang dihasilkan seperti tongkol jagung. Tongkol jagung mengandung ± 30% dari bobot total, jika dikonversi terhadap angka produksi pada tahun 2013 maka ketersediaan tongkol jagung sebesar 5.6 juta ton. Pemanfaatan tongkol jagung selama ini kurang efektif sehingga perlu pengembangan pemanfaatan untuk mengatasi permasalahan limbah dan meningkatkan nilai jual. Tongkol jagung merupakan biomassa prospektif yang mempunyai kandungan xilan tinggi sebesar 12.4% sehingga dapat dijadikan sebagai substrat hidrolisis xilan oleh bakteri menghasilkan xilooligosakarida (XOS). Salah satu bakteri yang dapat menghidrolisis substrat xilan menjadi xilooligosakarida yaitu dari kelompok Aktinomisetes. Xilooligosakarida yang dihasilkan dari produk hidrolisis Aktinomisetes ini dapat digunakan sebagai serat alami/prebiotik untuk membantu kesehatan saluran pencernaan. Tujuan dari penelitian ini adalah memproduksi XOS dari xilan tongkol jagung melalui proses enzimatis bakteri dari kelompok Aktinomisetes. Penelitian ini dilakukan dengan tahapan (1) ekstraksi xilan dari tongkol jagung menggunakan metode alkali untuk digunakan sebagai substrat pertumbuhan Aktinomisetes dan substrat hidrolisis (2) penapisan bakteri potensial dan identifikasi dengan 16S rRNA (3) penentuan waktu optimum produksi xilanase (4) pengaruh pH, suhu terhadap aktivitas dan stabilitas enzim xilanase dan (5) hidrolisis menggunakan xilanase dan analisis produk gula.
Hasil ekstraksi xilan tongkol jagung menggunakan metode alkali menghasilkan rendemen xilan sebesar 7.93%. Aktinomisetes dalam penelitian ini diisolasi dari tanah Taman Nasional Bukit Duabelas Jambi, Indonesia. Satu dari delapan isolat yang diuji menghasilkan zona bening tertinggi dan aktivitas xilanase tertinggi yaitu isolat BF 3.10 sebesar 0.713 U/mL. Isolat BF 3.10 teridentifikasi berdasarkan analisa 16S rRNA sebagai Streptomyces violascens
dengan index similaritas 99%.
Produksi enzim xilanase Streptomyces violascens BF 3.10 dari substrat xilan tongkol jagung 0.5% menggunakan metode DNS menghasilkan aktivitas enzim sebesar 6.4 U/mL pada suhu optimum 60 ˚C dalam bufer fosfat pH 5.5. Enzim ini digunakan untuk menghidrolisis xilan tongkol jagung pada konsentrasi 1%, 3%, dan 9% selama 24 jam. Hasil hidrolisis substrat xilan tongkol jagung pada konsentrasi 9% menghasilkan produk xilooligosakarida dengan kandungan gula pereduksi tertinggi sebesar 18.0 mg/mL dan Derajat polimerasi (DP) pada kisaran 2.6. Hasil hidrolisis xilan secara kuantitatif dengan nilai DP dapat diperkuat dengan data kualitatif pada Thin layer chromatography (TLC) dan High performance liquid chromatography (HPLC). Pada plat TLC menunjukkan produk hidrolisis xilooligosakarida karena spot yang terbentuk berada dibawah monomer standar xilosa.
SUMMARY
WIDA SALUPI. Production of xylooligosaccharides from corncob using
Streptomyces violascens BF 3.10 . Under supervision of ANJA MERYANDINI and YOPI
Corn production in Indonesian has been increasing each year, lead to the increase of corn by products such as corncob. Amounted to 30% of the total weight, the availability of corncob had been calculated to be 5.6 million tons in 2013. However, the corncobs were still marginally utilized, demanding a creativity and development in utilization process to increase the value of corncob. Corncob has high xylan content of 12.4% so that it could be the carbon source for xylooligosaccharide producing bacterias, one of them is Actinomycetes. Xylooligosaccharide produced can be used as natural fibers/prebiotics to support the health of digestive tract. The aims of this study was to enzymatically hydrolyze xylan corncob to be the substrate for Actinomicetes to produce xylooligosaccharides. This study was conducted in stages (1) extraction of xylan from corncob using alkaline method (2) screening and identification of 16S rRNA potential bacterial (3) determination of the optimum time of xylanase production (4) observation of the effect of pH and temperature to the xylanase enzyme stability and (5) hydrolys is using xylanase and the analysis of sugar products.
The yield of corncob xylan extracted using alkali method was 7.93%. Actinomycetes used in this study were isolated from the soil of Bukit Duabelas National Park, Jambi, Indonesia. One of eight isolates tested had the largest clear zone and the highest xylanase activity, which was isolate BF 3.10 (0.713 U / mL). BF 3.10 was identified as Streptomyces violascens by 16S rRNA analysis with similarity index of 99%.
Xylanase production of Streptomyces violascens BF 3.10 for the substrate
of 0.5% corncob xylan was 6.4 U/mL at the optimum temperature 60 ˚C in
phosphate buffer pH 5.5 using DNS method. The enzyme was used to hydrolyze xylan corncob at the concentration of 1%, 3% and 9% for 24 hours. Xylan corncob hydrolysis at the concentration of 9% resulted in xylooligosaccharide with the highest content of reducing sugar, which were 18.0 mg/mL and the degree of polymerization (DP) of 2.6. Quantitative data of xylan hydrolysis with DP values wasreinforced by the qualitative data on thin layer chromatography (TLC) and thin layer chromatography (HPLC). TLC plate showed that the hydrolysis products was xylooligosaccharide due to the spots were formed under standard xylose monomer spot.
©Hak CiptaMilik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
i
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Bioteknologi
PRODUKSI XILOOLIGOSAKARIDA DARI TONGKOL
JAGUNG MENGGUNAKAN BAKTERI AKTINOMISETES
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
ii
v
PRAKATA
Puji dan syukur penulis sampaikan kepada Allah SWT sang pencerah dan sang pemberi kesempatan bagi penulis untuk menyusun dan menyelesaikan tesis ini sebagai syarat untuk memperoleh gelar Magister Sains Jurusan Bioteknologi Institut Pertanian Bogor. Penelitian ini dilaksanakan sejak bulan Oktober 2013-Maret 2014 dengan tema pemanfaatan produk samping tongkol jagung untuk produksi xilooligosakarida.
Dalam penyusunan tesis ini, penulis menyadari banyak menemui hambatan dan masalah. Namun atas kritikan, saran dan dorongan serta semangat dari berbagai pihak penulis menyadari bahwa semua ini merupakan proses membekali diri menuju masa yang lebih indah. Oleh karena itu, penulis ingin menyampaikan terima kasih kepada pihak-pihak yang telah membantu penulis.
Terima kasih penulis ucapkan kepada Prof Anja Meryandini selaku ketua komisi pembimbing dan Dr Yopi atas bimbingan, arahan, saran, kritik dan kesabaran dalam menyelesaikan penelitian ini.
Ucapan terima kasih dan penghormatan penulis ucapkan kepada bapak Supriyanto dan ibu Sunarti tercinta atas ridlo, doa, dan kasih sayang tak terhingga, kakak terhebat Camelia Agustina dan Misbakhul Munir atas bimbingan dan motivasinya serta keluarga Cikakak tercinta Om Uja,Om Iwan, Emak dan Abah, keluarga Salatiga Mbah Kung dan Mbah Putri. Ponakan terganteng mas Hilal terima kasih atas semangatnya.
Disamping itu penghargaan penulis sampaikan kepada Azizah Hikma Safitri, M. Nur Kholis dan Ariandi selaku teman seperjuangan yang telah menjadi tim yang kompak dan solid, seluruh staf dan keluarga Laboratorium Biokatalis dan Fermentasi, Mbak Gading, Ayun, Mbak Lia, Mbak Alip, Mas Diki, Pak Awan, dan teknisi Laboratorium Bioteknologi Hewan dan Biomedis, PPSHB Institut Pertanian Bogor Bu Dewi yang telah memberikan bimbingan, petuah, nasihat, fasilitas, pelayanan serta suasana yang sangat kekeluargaan.
Penulis mengucapkan terima kasih kepada Keluarga Bioteknologi 2012, terima kasih atas cerita indahnya semoga silaturahmi kita selalu terjaga, Ibu bapak Kos Bata Merah, Dea Sylva, Mbak Dewi, Kakak faisal dan semua pihak yang tidak dapat penulis tuliskan satu persatu yang telah memberikan bantuannya.
Penulis menyadari bahwa penelitian dan penyusunan tesis ini masih jauh dari sempurna, sehingga membutuhkan saran dan kritik yang membangun dari para pembaca. Namun terlepas dari itu, semoga pembaca mendapatkan manfaat setelah membaca tesis ini.
Bogor, Agustus 2014
vii
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vii
DAFTAR LAMPIRAN vii
1 PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
2 METODE 3
Tempat dan Waktu Penelitian 3
Bahan 3
Alat 3
Prosedur Kerja 3
3 HASIL DAN PEMBAHASAN 7
Ekstraksi Xilan Tongkol Jagung 7
Seleksi Isolat Penghasil Xilanase 8
Waktu Optimum Aktivitas Enzim Xilanase dan Pertumbuhan Biomassa
Streptomyces violascens BF 3.10 10
Pengaruh pH dan Suhu Enzim Xilanase Streptomyces violascens
BF 3.10 12
Stabilitas Enzim Xilanase Streptomyces violascens BF 3.10 13
Hidrolisis Xilan 14
Thin layer chromatography (TLC) dan High performance liquid
chromatography (HPLC) 16
4 SIMPULAN DAN SARAN 19
Simpulan 19
Saran 19
DAFTAR PUSTAKA 20
LAMPIRAN 23
viii
DAFTAR TABEL
1 Perbandingan komposisi serat tongkol jagung sebelum dan sesudah
delignifikasi 7
2 Isolat potensial penghasil xilanase 9
3 Nilai derajat polimerasi hasil hidrolisis xilan tongkol jagung oleh
Streptomyces violascens BF 3.10 15
DAFTAR GAMBAR
1 Tepung tongkol jagung varietas SD3 dan xilan hasil ekstraksi
menggunakan NaOH 15% 8
2 Pertumbuhan isolat terpilih pada media agar-agar xilan. 9 3 Aktivitas xilanase isolat terpilih BF 3.1 dan BF 3.10 10 4 Kurva pertumbuhan sel Streptomyces violascens BF 3.10 11 5 Pengaruh pH terhadap aktivitas xilanase Streptomyces violascens BF
3.10 pada inkubasi suhu ruang 12
6 Pengaruh suhu aktivitas xilanase Streptomyces violascens BF 3.10
pada bufer fosfat 50 mM pH 5.5 13
7 Stabilitas enzim xilanase Streptomyces violascens BF 3.10 14 8 Analisis TLC dari produk hidrolisis tongkol jagung dengan enzim
xilanase Streptomyces violascens BF 3.10 17
9 Kromatogram hasil analisa HPLC 18
DAFTAR LAMPIRAN
1 Proses ekstraksi xilan dari tongkol jagung 23
2 Komponen serat pada proses delignifikasi 25
3 Komposisi media 26
4 Morfologi isolat penghasil enzim xilanase 27
5 Kurva standar pengukuran aktivitas enzim 28
1 meningkatnya produk samping yang dihasilkan seperti tongkol jagung. Tongkol jagung merupakan produk samping pertanian yang dihasilkan dari proses pemipilan jagung. Menurut Koswara (1991) bobot tongkol jagung sekitar ±30% dari bobot total yang besarnya dipengaruhi oleh varietas jagungnya, sedangkan sisanya adalah kulit dan biji jagung. Berdasarkan produksi jagung tahun 2013 jika dikonversikan terhadap bobot tongkol jagung maka ketersediaan produk samping tongkol jagung sebesar 5.6 juta ton. Produk samping tongkol jagung yang melimpah memberi peluang yang luas dalam pemanfaatanya. Sejauh ini pemanfaatan produk samping tongkol jagung hanya dibakar atau dijadikan bahan bakar briket dan sebagai bahan baku kerajinan. Pemanfaatan ini belum sepenuhnya mengatasi permasalahan produk samping tongkol jagung. Produk samping tongkol jagung juga belum termanfaatkan sebagai bahan baku pada skala industri, sehingga pengembangan pemanfaatan produk samping tongkol jagung perlu terus dikembangkan untuk mengatasi permasalahan keberlimpahan dan meningkatkan nilai jual dalam skala industri.
Tongkol jagung merupakan produk samping pertanian yang secara kimiawi mengandung lignin, hemiselulosa dan selulosa. Berdasarkan komposisi gulanya, hemiselulosa diklasifikasikan sebagai xilan, manan, arabinoxilan dan arabinan. Tongkol jagung merupakan bahan berlignoselulosa (kadar serat 38.99%) yang mengandung xilan tertinggi (12.4%) di antara produk samping pertanian lainnya (Richana et al. 2004) seperti jerami padi, tandan kelapa sawit, bagase, tangkai kapas, sorgum, batang tembakau, dan kulit kedelai. Ekstrak xilan dari tongkol jagung dapat dimanfaatkan di antaranya sebagai sumber karbon dalam medium kultivasi bakteri penghasil xilanase.
Xilanase merupakan kelompok enzim yang menghidrolisis xilan atau polimer dari xilosa dan xilooligosakarida. Xilanase dapat diklasifikasikan berdasarkan substrat yang dihidrolisis yaitu β-xilosidase, eksoxilanase, dan endoxilanase. Xilanase dapat dihasilkan dari berbagai organisme seperti jamur, bakteri dan salah satu contohnya yaitu Aktinomisetes (Rifaat 2005). Aktinomisetes adalah bakteri Gram positif yang ditemukan dalam berbagai habitat antara lain tanaman yang membusuk. Aktinomisetes berperan penting dalam degradasi bahan lignoselulosa yang mengandung selulosa, hemiselulosa, dan lignin (Anindyawati 2010). Aktinomisetes yang telah dibuktikan menghasilkan enzim xilanase yaitu Streptomyces roseiscleroticus (Grabski 1991), Streptomyces thermoviolaceus (Tsujibo et al. 1992), Streptomyces halstedii (Ruiz Arribas et al. 1995), Streptomyces viridosporus (Magnuson dan Crawford 1997), Streptomyces actuosus (Wang et al. 2003), Streptomyces galbus (Kansoh & Nagieb 2004),
Streptomyces albus, Streptomyces chromofuscus (Rifaat 2005), dan Streptomyces
2
Produk hidrolisis enzim xilanase dari substrat produk samping pertanian dapat berupa xilooligosakarida yang dapat dimanfaatkan sebagai prebiotik. Prebiotik dapat didefinisikan sebagai makanan yang tidak dapat dicerna oleh saluran pencernaan tetapi dapat mempengaruhi inang dengan merangsang pertumbuhan sejumlah bakteri dalam usus untuk meningkatkan kesehatan inang. Prebiotik merupakan suplemen yang memungkinkan perubahan fisik baik dalam komposisi atau kegiatan mikroflora saluran cerna yang memberikan manfaat lebih baik (Gibson dan Roberfroid 1995). Selanjutnya Gibson dan Roberfroid (1995) menjelaskan kriteria prebiotik yaitu dapat menurunkan asam lambung, tidak dihidrolisis oleh enzim saluran pencernaan, tidak diserap di saluran pencernaan bagian atas, difermentasi oleh mikroorganisme usus, dan menginduksi pertumbuhan selektif atau aktivitas bakteri usus, yang berpotensi meningkatkan kesehatan.
Jenis prebiotik komersial yaitu Inulin, Frukto-oligosakarida (FOS), Galakto-oligosakarida (GOS), dan XiloGalakto-oligosakarida (XOS). XOS sebagai salah satu bentuk oligosakarida yang berperan sebagai prebiotik dan dapat menstimulasi secara selektif pertumbuhan dan atau aktivitas probiotik didalam usus besar seperti Lactobacillus dan atau Bifidobacterium juga membantu penyerapan kalsium pada usus (Wang et al. 2009) sehingga dapat meningkatkan kesehatan inang.
Berdasarkan latar belakang diatas penggunaan Aktinomisetes untuk menghasilkan enzim xilanase dalam menghasilkan xilooligosakarida sebagai prebiotik dari tongkol jagung mempunyai peluang yang sangat besar dalam upaya pemanfaatan dan peningkatan nilai tambah dari tongkol jagung. Produksi prebiotik dalam skala industri di masa yang akan datang diharapkan akan menjadi usaha prospektif untuk memanfaatkan produk samping pertanian dalam menghasilkan produk tambahan untuk kesehatan saluran pencernaan.
Tujuan Penelitian
Tujuan dari penelitian ini adalah memproduksi xilooligosakarida (XOS) dari xilan tongkol jagung melalui proses enzimatis bakteri dari kelompok Aktinomisetes.
Manfaat Penelitian
3
2 METODE
Tempat dan Waktu Penelitian
Penelitian dilakukan di Laboratorium Biokatalis dan Fermentasi, Pusat Penelitian Bioteknologi LIPI Cibinong, Penelitian dilakukan dari Bulan Oktober 2013 sampai dengan Mei 2014.
Bahan
Bahan yang digunakan dalam penelitian ini adalah isolat bakteri Aktinomisetes koleksi Laboratorium Bioteknologi Hewan dan Biomedis, PPSHB Institut Pertanian Bogor yaitu BO 2.1; BO 3.2; BO 3.3; BO 4.1;BF 3.1; BF 3.10; BF 4.1, dan YM 4.2, tepung tongkol jagung varietas Silangan Dramaga 3 (SD 3), media pertumbuhan yang mengandung substrat xilan beechwood 0.5%, media dengan substrat xilan dari tongkol jagung 0.5%, MgSO4 0.5%, K2HPO4 0.05%,
KNO3 0.075%, FeSO4.7H2O 0.000.5%, CaCl2 0.004%, glukosa 0.1%, pewarnaan
menggunakan merah kongo 0.5%, dan NaCl 2 M. Ekstraksi xilan dari tongkol jagung menggunakan NaOCl 1%, NaOH 15%, aquades, HCl 37%, etanol 95%. Uji aktivitas dan produksi enzim menggunakan reagen dinitrosalisilat (DNS), Bufer sitrat 50 mM (pH 3.0-4.5 ), bufer fosfat 50 mM (pH 5.0-6.5 ), dan bufer glisin-NaOH 50 mM (pH 7.0-10.0), aquades. Identifikasi 16S rRNA bahan elektroforesis terdiri atas gel agarose 1%, Go taq, primer 9F (5’GGCTACCTT
GTTACGACTT3’), primer 1051R (5’GAGTTTGATCCTGGCTCAG-3’),
ddH2O, bufer TAE 1X, marker, loading dye, parafilm, dan EtBr.
Alat
Alat yang digunakan dalam penelitian ini adalah pengaduk, gelas ukur, oven, saringan, sentrifus, pH meter, timbangan, ose, erlenmeyer, corckborer, autoclave, water bath, laminar air flow, shaker, spektrofotometer, dry blot,
magnetic styrer, vortex, kertas thin layer chromatography (TLC), HPLC, pipet ukur, microtube eppendord, minispin, thermometer, kertas saring, botol corning, cawan petri, gelas ukur, tabung reaksi, stopwatch, alat elektroforesis, UV, dan PCR.
Prosedur Kerja
4
dilakukanmeliputi kadar air, abu, kadar hemiselulosa, selulosa dan lignin. Tahap selanjutnya dilakukan penapisan isolat potensial dengan uji kualitatif dengan merah kongo 0.5%, uji kuantitatif aktivitas enzim dan identifikasi 16S rRNA. Tahap ketiga produksi enzim dan hidrolisis xilan serta analisis produk hidrolisis menggunakan analisis gula, thin layer chromatography (TLC) dan HPLC.
Penggilingan
Tongkol jagung digiling hingga menjadi tepung berukuran 80 mesh dan dilakukan analisis komposisi kimia yang meliputi kadar air, abu, protein, lemak, serta komponen serat kasar (lignin, selulosa, dan hemiselulosa).
Ekstraksi Xilan
Tepung tongkol jagung direndam dalam larutan NaOCl 1% selama 5 jam pada suhu ruang, kemudian tepung tongkol jagung dibilas dengan akuades dan disaring untuk diambil bagian padatannya, yaitu tongkol jagung yang terdelignifikasi. Pengeringan dilakukan di bawah sinar matahari selama 48 jam. Analisis yang dilakukan meliputi kadar air, kadar lignin, dan bobot kering hemiselulosa-selulosa.
Padatan yang diperoleh dari proses delignifikasi direndam dalam larutan NaOH 15% selama 24 jam pada suhu ruang dan kemudian disaring. Filtrat yang mengandung xilan diukur pH-nya lalu dinetralkan dengan HCl 37% kemudian disentrifugasi selama 30 menit pada kecepatan 2683 xg. Endapan yang mengandung xilan diendapkan dengan penambahan etanol 95% dengan perbandingan 1 : 3 kemudian disentrifugasi selama 30 menit pada kecepatan 2683 xg untuk memperoleh xilan murni. Xilan dikeringkan dalam oven 50 ˚C selama 48 jam dan dihaluskan hingga berukuran 80 mesh.
Peremajaan Isolat dan Penapisan Bakteri Potensial
5 Identifikasi Isolat Bakteri Potensial Penghasil Xilanase dengan 16S rRNA
Amplifikasi DNA bakteri dilakukan dengan 1 μL primer 9’F, 1 μL primer 1051’R dan campuran reaksi terdiri atas 12.5 μL Go Taq, 10.5 μL mili-Q steril dan DNA sampel sebanyak satu ose yang ditotolkan pada larutan sampai volume total 25 µL. Tahapan selanjutnya yaitu proses amplifikasi yang dilakukan pada mesin PCR yang terdiri atas 30 siklus. Kondisi PCR berlangsung pada tahapan berikut: denaturasi 2 menit pada suhu 95˚C, annealing 1 menit pada suhu 55˚C,
elongation 2 menit pada suhu 72˚C, dan terakhir penyimpanan pada suhu 4˚C.
Produk PCR divisualisasikan pada gel agarosa 1 % dalam buffer TAE 1x pada 50 volt selama 45 menit. Hasil elektroforesis kemudian direndam dalam larutan EtBr selama 10 menit, setelah itu dibilas dengan akuades dan pita DNA dilihat dengan bantuan sinar Ultra violet (UV).
Penentuan Waktu Produksi Xilanase
Sebanyak satu corckborer isolat berumur 4 hari dengan diameter masing-masing 1 cm diinokulasikan ke dalam 100 mL media cair xilan tongkol jagung 0.5% (Lampiran 2). Kultur diinkubasi selama 24 jam dengan agitasi 100 xg selama 144 jam pada suhu ruang. Untuk mengetahui aktivitas enzim dan pengukuran biomassa kultur diambil sebanyak satu Erlenmeyer setiap hari sampai hari ke 6 dan disentrifugasi pada kecepatan 8050 xg selama 15 menit. Supernatan (ekstrak enzim kasar) diukur aktivitasnya dengan metode DNS. Pelet digunakan untuk menghitung bobot biomassa kering. Pelet dikeringkan dalam oven pada suhu 50 ˚C hingga mempunyai bobot kering biomassa yang konstan. Pelet kemudian ditimbang dan digunakan sebagai kurva pertumbuhan bakteri. Satu unit aktivitas xilanase didefinisikan sebagai jumlah enzim yang menghasilkan 1 µmol xilosa dalam waktu 1 menit.
Uji aktivitas enzim diukur dengan mengukur pembentukan gula pereduksi hasil hidrolisis enzim xilanase berdasarkan metode DNS (Miller 1959). Uji aktifitas enzim xilanase pada sampel dilakukan dengan cara mereaksikan enzim ekstrak kasar xilanase sebanyak 250 µL dengan 250 µL xilan beechwood 0.5% kemudian dihomogenisasi dengan vortek dan diinkubasi pada suhu ruang selama 30 menit. Larutan tersebut kemudian ditambahkan dengan 750 µL pereaksi DNS, diaduk hingga homogen kemudian dipanaskan dalam air mendidih selama 15 menit dan didinginkan dalam air. Uji aktivitas enzim xilanase pada kontrol dilakukan dengan cara mencampurkan 250 µL xilan beechwood 0.5% dengan pereaksi DNS dan 250 µ L enzim ekstrak kasar xilanase, dihomogenisasi dengan vortex kemudian dipanaskan pada air mendidih selama 15 menit dan didinginkan dalam air. Blangko dibuat dengan cara mencampurkan 250 µL substrat xilan
6
Pengaruh pH, suhu terhadap aktivitas dan Stabilitas enzim Xilanase
Untuk mengetahui pengaruh pH terhadap aktivitas enzim dilakukan dengan mengujikan enzim ekstrak kasar pada bufer sitrat 50 mM (pH 3.0-4.5), bufer fosfat 50 mM (pH 5.0-6.5) dan bufer glisin NaOH 50 mM (pH 7.0-10.0). Pengujian pengaruh suhu terhadap aktivitas xilanase diuji dengan cara mereaksikan larutan enzim dengan substrat selama 30 menit pada berbagai suhu 30 ˚C, 40 ˚C, 50 ˚C, 60 ˚C, 70 ˚C, 80 ˚C, 90 ˚C dan 100 ˚C. Kestabilan enzim ekstrak kasar xilanase diuji dengan menginkubasi enzim xilanase tanpa substrat pada suhu ruang, suhu 4°C dan suhu optimum. Ekstrak enzim kasar xilanase pada pH dan suhu optimum diuji dengan substrat xilan beechwood 0.5% pada jam ke-0, ke-3, ke-24, ke-48, ke-72, dan ke-96.
Hidrolisis Xilan menggunakan Xilanase dan Analisis Gula
7
3 HASIL DAN PEMBAHASAN
Ekstraksi Xilan Tongkol Jagung
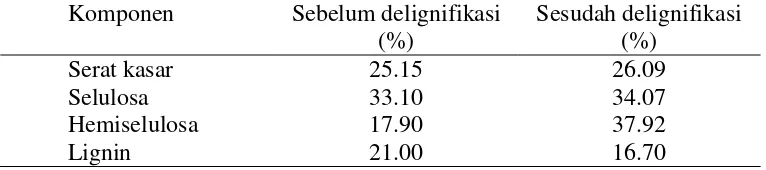
Ekstraksi xilan diperlukan untuk mengurangi komponen-komponen hemiselulosa selain pada dinding sel tepung tongkol. Tahapan ekstraksi xilan ditampilkan pada Lampiran 1. Penggilingan tongkol jagung menjadi tepung dengan ukuran 80 mesh (Gambar 1) akan memutus ikatan dinding sel sehingga diharapkan dapat mempermudah proses ekstraksi. Lignin merupakan salah satu komponen dinding sel yang memberikan struktur kaku yang dapat mempengaruhi proses hidrolisis enzim. Ikatan silang dari struktur aromatik lignin dapat memperlambat penetrasi enzim, oleh karena itu diperlukan adanya preparasi kimia untuk mengurangi kadar lignin sehingga mempermudah kontak antara enzim dengan substrat (Sun 2002). Natrium hipoklorit (NaOCl) merupakan oksidator kuat yang mengandung ion-ion hipoklorit yang mampu memecah ikatan karbon dalam struktur lignin (Lehninger 1982). Perendaman tepung tongkol jagung dengan NaOCl 1% dapat mempengaruhi prosentase komposisi serat tepung tongkol jagung (Tabel 1).
Richana et al. 2007 dalam penelitiannya menyebutkan kandungan serat hemiselulosa tongkol jagung berkisar antara 25% hingga 39% dan kadar lignin sebesar 16% (Irawadi 1999). Hal ini sesuai dengan hasil analisis komponen serat tongkol jagung varietas jagung SD3 dalam penelitian ini dengan prosentase hemiselulosa sebesar 37% dan prosentase lignin sebesar 16%. Berbeda dengan hasil penelitian Moko (2010), hasil delignifikasi pada tepung tongkol jagung varietas SD 3 kadar hemiselulosa sebesar 10.30% dan kadar lignin 14.38 %. Perbedaan ini menunjukkan bahwa proses ekstraksi memberikan pengaruh besar pada hasil kandungan serat tongkol jagung pasca delignifikasi meskipun pada varietas yang sama.
NaOCl tidak dapat menghilangkan semua komponen lignin dalam proses delignifikasi. Lignin sulit didegradasi karena mempunyai struktur yang kompleks dan heterogen yang berikatan dengan selulosa dan hemiselulosa (Anindyawati 2010), serta mempunyai fungsi utama sebagai penguat struktur tanaman dalam menahan tekanan oksidasi (Hendriks dan Zeeman 2009). Hasil delignifikasi menurunkan komposisi lignin sebsesar 4.3% dengan derajat delignifikasi sebesar 5.97%. Nilai presentase komponen serat sesudah delignifikasi merupakan selisih
8
antara presentase sesudah dan sebelum delignifikasi terhadap nilai bobot mutlak (Apriyani 2013). Komposisi komponen serat dan bobot susut pada proses delignifikasi dapat dilihat pada Lampiran 2.
Ekstraksi xilan dapat dilakukan dengan berbagai pelarut seperti air panas, air dingin, NH4OH, KOH (Hespell 1998), HCl (Richana et al. 2007), dan NaOH
(Richana et al. 2007; Hespell 1998). Menurut Richana et al. 2007 diantara berbagai pelarut yang paling baik digunakan adalah NaOH karena xilan yang dihasilkan relatif bersih dari pengotor mempunyai warna yang lebih putih dibandingkan dengan pelarut lainnya dan mudah larut dalam air. NaOH merupakan alkali yang paling kuat dalam mendegradasi dinding sel dan meningkatkan kelarutan hemiselulosa. Prinsip kerja alkali adalah memutuskan sebagian ikatan antara selulosa dan hemiselulosa dengan lignin, esterifikasi gugus asetil dengan membentuk asam uronat dan merombak struktur dinding sel melalui pengembangan jaringan serat dan memudahkan penetrasi molekul enzim mikroorganisme (Murni et al. 2008). Ekstraksi xilan tongkol jagung menghasilkan rendemen xilan sebesar 39.65 g dari berat awal ekstraksi sebesar 500 g. Tongkol jagung dengan ukuran 80 mesh ditampilkan pada Gambar 1.
Seleksi Isolat Penghasil Xilanase
Uji Kualitatif dengan Pewarnaan Merah Kongo 0.5 %.
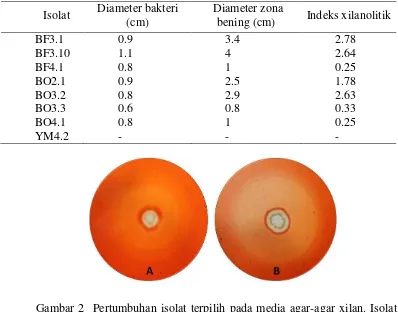
Isolat Aktinomisetes koleksi Laboratorium Bioteknologi Hewan dan Biomedis, PPSHB Institut Pertanian Bogor diidentifikasi aktivitas xilanasenya dengan menumbuhkannya pada media selektif xilan beechwood 0.5%. Aktivitas xilanase 8 isolat aktinomisetes ditunjukkan pada Tabel 3. Morfologi 8 isolat yang akan diidentifikasi berdasarkan pewarnaan merah kongo 0.5% dapat dilihat pada lampiran 4. Kemampuan bakteri dalam mendegradasi xilan ditandai dengan terbentuknya zona bening disekitar koloni. Zona bening ini menurut Theather dan Wood (1982) terbentuk karena tidak adanya ikatan antara merah kongo dengan polisakarida yang mengandung ikatan β, 1-4-glucopyranocyl yaitu xilan pada substrat tongkol jagung SD3. Hidrolisis pada substrat xilan menyebabkan tidak terjadi pengikatan merah kongo pada saat pewarnaan, dengan demikian pada
9 polisakarida yang terhidrolisis terbentuk warna bening karena tidak ada ikatan antara polisakarida dengan merah kongo.
Tabel 2 Isolat potensial penghasil xilanase
Isolat Diameter bakteri (cm)
Diameter zona
bening (cm) Indeks xilanolitik
BF3.1 0.9 3.4 2.78
BF3.10 1.1 4 2.64
BF4.1 0.8 1 0.25
BO2.1 0.9 2.5 1.78
BO3.2 0.8 2.9 2.63
BO3.3 0.6 0.8 0.33
BO4.1 0.8 1 0.25
YM4.2 - - -
Gambar 2 Pertumbuhan isolat terpilih pada media agar-agar xilan. Isolat ditumbuhkan pada suhu ruang selama 4 hari dan diwarnai dengan merah kongo 0.5 %.
A.Zona beningyang terbentuk oleh isolat BF 3.1 B. Zona bening yang terbentuk oleh isolat BF 3.10
Isolat BF 3.1 dan BF 3.10 merupakan isolat yang mempunyai kemampuan enzim xilanase tertinggi. Zona bening kedua isolat ini dapat dilihat pada Gambar 2. Isolat yang tidak menghasilkan zona bening menunjukkan bahwa isolat ini tidak mampu menghasilkan enzim xilanase untuk mendegradasi xilan seperti isolat YM 4.2.
Uji Kuantitatif Aktivitas Enzim
10
untuk analisis lebih lanjut yaitu identifikasi 16S rRNA, karakterisasi enzim dan kemampuannya dalam hidrolisis xilan tongkol jagung untuk memproduksi xilooligosakarida.
Gambar 3 Aktivitas xilanase isolat terpilih BF 3.1 ( ) dan BF 3.10 ( ) . Isolat ditumbuhan pada media xilan tongkol jagung dan diuji pada substratxilan beechwood 0.5%.
Identifikasi hasil sekuensing parsial gen penyandi 16S rRNA dari isolat BF 3.10 dibandingkan dengan database menggunakan analisis BLASTn (Lampiran 6). Hasil pensejajaran 1528 bp sekuen isolat BF 3.10 memiliki kemiripan dengan
Streptomyces violascens dengan indeks similaritas sebesar 99%.
Streptomyces violascens merupakan bakteri asal tanah yang dapat digunakan sebagai agen antibiotik dan biokontrol ( El-Tarabily et al.1996). Bisht et al (2012) dalam publikasinya menyebutkan Streptomyces violascens dan mempunyai toleransi pada rentang pH 4-10. Koloni Streptomyces violascens strain BF 3.10 nampak berwarna putih ke abu-abuan dengan permukaan diujung menggulung, koloni tidak lengket dengan media. Warna abu-abu semakin pekat seiring dengan lamanya waktu inkubasi. Spora yang dihasilkan Streptomyces violascens strain BF 3.10 mempunyai bau yang khas yaitu bau tanah.
Waktu Optimum Aktivitas Enzim Xilanase dan Pertumbuhan Biomassa Streptomyces violascens BF 3.10
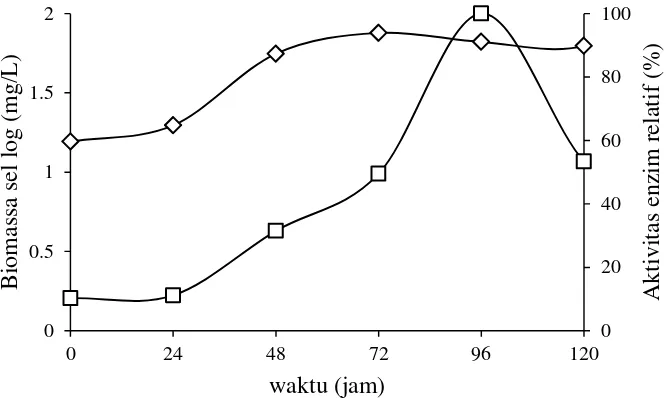
Hubungan aktivitas enzim dan biomassa sel isolat Streptomyces violascens
BF 3.10 dapat dilihat pada Gambar 4. Waktu optimum aktivitas enzim diperlukan untuk mengetahui waktu produksi enzim xilanase tertinggi dan hubungannya dengan berat biomassa sel bakteri. Aktivitas enzim hingga jam ke-24 jam tidak mengalami peningkatan karena bakteri masih dalam proses adaptasi dari media pertumbuhan padat yang mengandung agar-agar ke media produksi berupa media cair. Adaptasi sel dengan jumlah biomassa sel yang masih sedikit mengakibatkan aktivitas enzim yang dihasilkan kecil sehingga degradasi xilan oleh xilanase juga masih rendah. Fase adaptasi dapat disebut juga fase lag, yaitu fase dimana bakteri baru mengalami pengenalan pada kondisi yang baru dalam hal ini kultur cair dan penyesuaian pada agitasi. Agitasi pada kultur cair dapat membantu pertumbuhan
11 bakteri dengan memberikan intensitas kontak bakteri terhadap substrat lebih banyak sehingga diharapkan degradasi xilan oleh xilanase dari substrat tongkol jagung lebih tinggi. Peningkatan kecepatan agitasi akan menaikkan difusi oksigen ke dalam media sehingga mendorong peningkatan absorpsi oksigen (Priyatno et al. 1999). kenaikan biomassa sel bakteri seiring dengan kenaikan aktivitas enzim. Fase eksponensial pada bakteri merupakan fase pembentukan sel Streptomyces violascens BF 3.10 yang sangat cepat hingga mencapai puncaknya pada jam ke 72 dengan biomassa sel sebesar 1.87 log (mg/L). Karakter Streptomyces violascens
BF 3.10 yang memiliki biomassa optimum pada jam ke-72 sama dengan
Staphylococcus aureus (Wijayanti 2009).
Biomassa sel pada jam 96 mengalami penurunan tetapi aktivitas enzim mengalami kenaikkan hingga puncaknya sebesar 0.99 U/mL. Waktu optimum untuk menghasilkan aktivitas xilanase tertinggi pada setiap bakteri bermacam-macam. Penelitian Kansoh dan Nagieb (2004) menunjukkan produksi xilanase
Streptomyces galbus NR memiliki waktu optimum selama 120 jam dengan aktivitas xilanase sebesar 8 U/mL.
12
mengalami puncaknya saat berat biomassa telah menurun, hal ini dimungkinkan karena sel telah mengalami lisis sehingga enzim dapat berada pada luar sel.
Pengaruh pH dan Suhu Enzim Xilanase Streptomyces violascens
BF 3.10
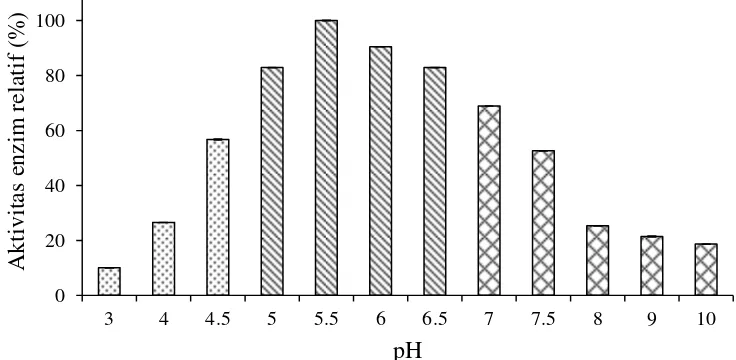
Enzim xilanase Streptomyces violascens BF 3.10 cenderung mempuyai aktivitas yang tinggi pada pH asam dengan aktivitas tertinggi pada pH 5.5 (Gambar 5). Xilanase yang diperoleh dalam penelitian ini memiliki keunggulan karena mempunyai aktivitas tinggi pada rentang pH 4.5- pH 7.5 dengan aktivitas enzim relatif sebesar 50-100%.
Gambar 5 Pengaruh pH terhadap aktivitas xilanase Streptomyces violascens
BF 3.10 pada inkubasi suhu ruang. Bufer sitrat 50 mM( ), bufer fosfat 50 mM ( ) dan bufer glisin-NaOH 50 mM ( ) Xilanase merupakan enzim yang dapat aktif pada berbagai kondisi pH tergantung pada organisme penghasilnya. Menurut Thomas et al. (2013) xilanase dari Aktinomisetes mempunyai rentang pH 3.0- pH 10.0 dan optimum pada pH 4.0- pH 7.0, xilanase Streptomyces galbus NR mempunyai aktivitas pada rentang pH 5.0-8.0 dan optimum pada pH 6.5 (Kansoh dan Nagieb 2004), xilanase
Streptomyces sp SKK1-8 optimum pada pH 6.0 (Meryandini et al. 2006). Keanekaragaman kondisi pH xilanase telah banyak diteliti, umumnya xilanase dari bakteri memiliki rentang pH optimum lebih luas dibandingkan dengan xilanase dari cendawan. Xilanase dari cendawan seperti Aspergillus kawachi
(Iwahita et al.1998) dan Penicillium herque (Funaguma 1991) memiliki pH optimum pada pH asam pH 2.0- pH 6.0.
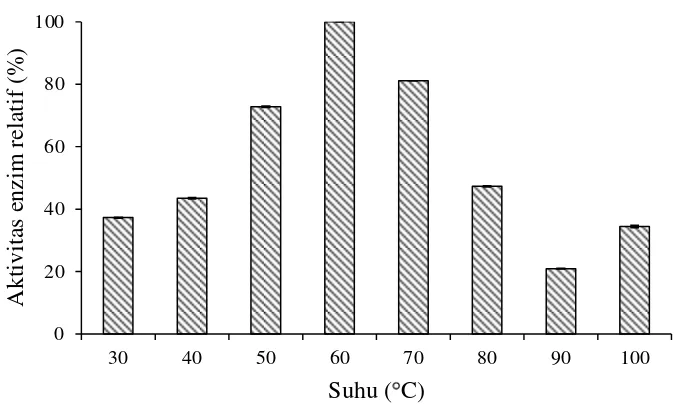
Xilanase Streptomyces violascens BF 3.10 mempunyai aktivitas relatif pada inkubasi suhu 30 ˚C hingga suhu 100 ˚C dengan aktivitas tertinggi pada suhu 60 ˚C (Gambar 6). Menurut Kulkarni et al. (1999), suhu optimum dari kerja xilanase pada bakteri dan cendawan berkisar pada suhu 40-60 ˚C. Ratanachomsri
et al. (2006) telah mengkarakterisasi enzim xilanase dari cendawan Marasmius sp. yang mempunyai aktivitas optimum pada suhu 90 ˚C.
13
Gambar 6 Pengaruh suhu terhadap aktivitas xilanase Streptomyces violascens BF 3.10 pada bufer fosfat 50 mM pH 5.5
Penelitian lain menunjukkan xilanase Streptomyces sp SKK1-8 optimum pada suhu 50 ˚C (Meryandini et al. 2006 ) dan xilanase Streptomuces galbus NR mempunyai rentang suhu 20 ˚C-70 ˚C dengan suhu optimum 50 ˚C (Kansoh dan Nagieb 2004) . Xilanase yang diproduksi dari bakteri umumnya lebih tahan pada suhu tinggi jika dibandingkan dengan cendawan (Thomas et al. 2013). Adanya perbedaan aktivitas enzim terhadap suhu dan pH yang digunakan dapat terjadi karena adanya perbedaan interaksi kimia yang terjadi pada protein. Interaksi kimia tersebut menyebabkan perubahan konformasi protein yang berpengaruh terhadap stabilitas dan aktivitas suatu protein (Bataillon et al. 2000).
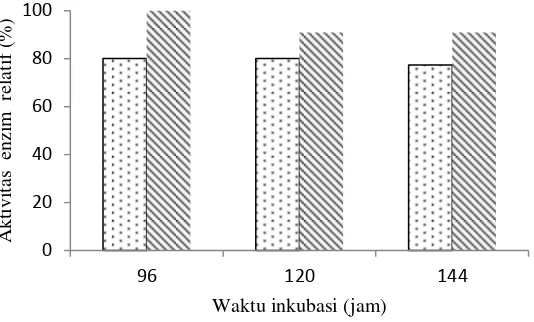
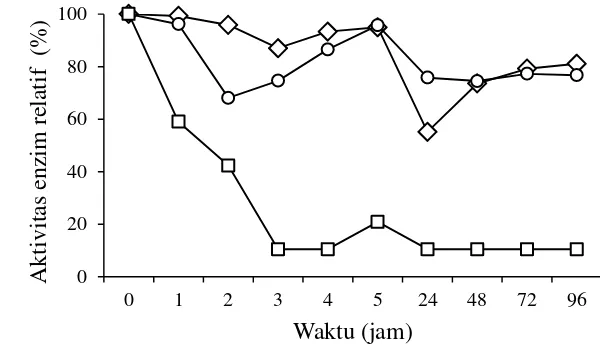
Stabilitas Enzim Xilanase Streptomyces violascens BF 3.10
Stabilitas enzim penting dalam karakterisasi suatu enzim. Enzim xilanase
Streptomyces violascens BF 3.10 diukur stabilitasnya pada inkubasi suhu 4 ˚C, 30 ˚C, dan 60 ˚C (Gambar 7). Aktivitas xilanase pada inkubasi suhu 4 ˚C, dan 30 ˚C relatif stabil hingga jam ke-96 dengan aktivitas relatif diatas 60%. Enzim yang diinkubasi pada suhu 60 ˚C telah mengalami denaturasi pada jam ke-3 sehingga aktivitas relatifnya menurun hingga 10%. Menurut Chapla et al. (2010), penurunan aktivitas disebabkan inaktivasi enzim yang terjadi pada suhu tinggi dengan jangka waktu yang panjang. Stabilitas dan aktivitas suatu protein enzim dipengaruhi oleh keadaan lingkungan mikro protein enzim dan distribusi asam amino bermuatan pada permukaan protein enzim. Adanya modifikasi pada protein enzim tersebut dapat meningkatkan interaksi pada protein enzim sehingga protein enzim tersebut menjadi lebih rigid dan stabil pada suhu dan pH tinggi, sehingga enzim tidak terdenaturasi (Nath dan Rao 2001).
14
Gambar 7 Stabilitas enzim xilanase Streptomyces violascens BF 3.10 pada bufer fosfat 50mM pH 5.5 inkubasi 4 C (‒◊‒), 30 °C (‒○‒), dan 60 °C (‒ ‒)
Hidrolisis Xilan
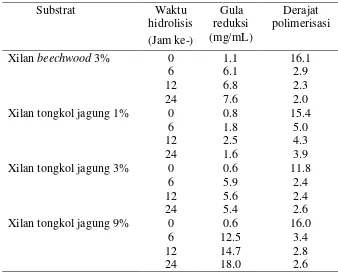
Hidrolisis merupakan proses pemecahan polimer menjadi oligomer atau monomer. Untuk mempercepat proses hidrolisis dilakukan dengan enzim sebagai katalis yaitu enzim xilanase Streptomyces violascens BF 3.10. Hidrolisis dengan enzim menghasilkan produk hidrolisis yang lebih spesifik. Hidrolisis substrat xilan tongkol jagung oleh Streptomyces violascens BF 3.10 dapat diketahui dengan menghitung gula pereduksi dan derajat polimerasi yang dihasilkan. Hasil dari hidrolisis xilan dapat berupa xilosa, xilooligosakarida ataupun polimer xilosa. Produk hidrolisis ini memiliki struktur gugus karbonil yang berada pada ujung rantai karbonnya dan gugus aldehid bebas yang reaktif sehingga masuk dalam kategori gula pereduksi (Yang et al. 2005). Proses hidrolisis menggunakan konsentrasi substrat yang berbeda pada interval waktu yang berbeda dilakukan untuk mengetahui pengaruh konsentrasi dan interval waktu terhadap produk gula yang dihasilkan. Interval waktu hidrolisis yang digunakan dalam penelitian ini yaitu jam ke-0, ke-6, ke-12, dan ke-24 dengan konsentrasi substrat xilan tongkol jagung sebesar 1%, 3%, dan 9%, xilan Beechwood 3% digunakan sebagai data pembanding (Tabel 3).
Besar gula reduksi yang dihasilkan meningkat seiring dengan meningkatnya konsentrasi substrat xilan dan waktu hidrolisis. Pada inkubasi 12 jam dengan kondisi substrat yang meningkat menujukkan peningkatan jumlah pada gula pereduksi yang dihasilkan. Hal ini menunjukkan bahwa kerja enzim xilanase
15 Tabel 3 Nilai derajat polimerisasi hasil hidrolisis xilan tongkol jagung oleh
Streptomyces violascens BF 3.10
Peningkatan konsentrasi substrat hingga 9% tidak mengakibatkan enzim xilanase berhenti bekerja, enzim xilanase masih dapat berikatan dengan substrat xilan tongkol jagung yang ditandai dengan meningkatnya gula reduksi yang dihasilkan. Enzim xilanase yang dapat bekerja pada konsentrasi substrat yang tinggi menjadi keuntungan dalam degradasi substrat xilan tongkol jagung. Xilan tongkol jagung sebagai substrat hidrolisis dapat ditambahkan dengan konsentrasi tinggi sehingga pemanfaatan produk samping pertanian semakin maksimal. Penambahan konsentrasi substrat yang tinggi berpengaruh dalam kelarutan saat hidrolisis sehingga diperlukan konsentrasi yang optimal supaya kerja enzim xilanase juga optimal.
16
menghasilkan nilai DP 4.8. Nilai DP xilooligosakarida rantai pendek berkisar antara 2-20 (Chen et al. 1997) dan yang digunakan untuk prebiotik pangan memiliki nilai DP berkisar antara 2-4 (Vazquez et al. 2000).
Waktu hidrolisis substrat xilan tongkol jagung berhubungan dengan stabilitas enzim xilanase. Setiap enzim xilanase dari tiap organisme memiliki stabilitas yang berbeda. Enzim xilanase Streptomyces violascens BF 3.10 stabil untuk waktu relatif lama yaitu hingga jam ke-96 pada inkubasi suhu 4 ˚C dan 30 ˚C sampai jam ke-96 (Gambar 7). Hal ini sesuai dengan waktu hidrolisis substrat xilan tongkol jagung yang menghasilkan gula reduksi yang masih meningkat hingga jam ke-24 pada konsentrasi xilan tongkol jagung 9%. Xilanase
Streptomyces violascens BF 3.10 memiliki keunggulan stabil pada suhu 4 ˚C dan 30 ˚C inkubasi selama 96 jam dibandingkan dengan xilanase Penicillium scerotiorum yang stabil pada suhu 40 C selama 72 menit (Knob & Carmona 2008), xilanase Marasmius sp stabil pada suhu 50 C selama 3 jam (Ratanachomsri et al. 2006) dan xilanase komersial Buzyme 2511 stabil pada suhu 50 C selama 35 menit (Tabosa-Vaz et al. 2011).
Analisis Thin Layer Chromatography (TLC) dan High Performance
Liquid Chromatography (HPLC)
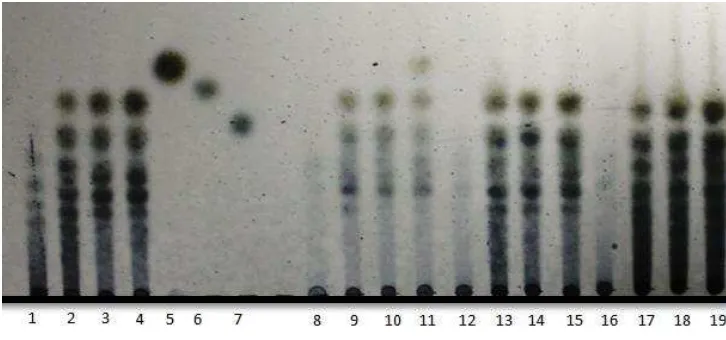
Pola hasil hidrolisis xilan secara kuantitatif dengan nilai DP dapat diperkuat dengan data kualitatif pada thin layer chromatography (TLC). Standar gula yang digunakan yaitu xilosa (spot 5), glukosa (spot 6) dan selobiosa (spot 7). Hasil hidrolisis xilan tongkol jagung dengan xilanase Streptomyces violascens BF 3.10 pada konsentrasi dan interval waktu yang berbeda menunjukkan sebagian besar produk hidrolisis adalah xilooligosakarida karena spot yang terbentuk berada dibawah spot monomer standar xilosa (Gambar 8). Xilooligosakarida yang dihasilkan dimungkinkan dalam bentuk xilobiosa, xilotriosa dan xilooligosakarida lainnya berdasarkan nilai DP yang dihasilkan.
Pada konsentrasi substrat xilan tongkol jagung yang berbeda (1%, 3%, dan 9%) dihasilkan spot xilooligosakarida yang seragam. Hasil ini serupa dengan Akpinar et al (2007) pada produk hidrolisis xilan tangkai kapas (1-10%), perbedaan konsentrasi substrat tidak berpengaruh pada nilai DP sehingga visualisasi produk hidrolisis pada TLC menghasilkan spot xilooligosakarida yang seragam.
17
Gambar 8 Analisis TLC dari produk hidrolisis tongkol jagung dengan enzim xilanase Streptomyces violascens BF 3.10
Keterangan : 10: xilan tongkol jagung 1% jam ke-12 11: xilan tongkol jagung 1% jam ke-24 12: xilan tongkol jagung 3% jam ke-0 13: xilan tongkol jagung 3% jam ke-6 14: xilan tongkol jagung 3% jam ke-12
15: xilan tongkol jagung 3% jam ke-24 16: xilan tongkol jagung 9% jam ke-0 17: xilan tongkol jagung 9% jam ke-6 18: xilan tongkol jagung 9% jam ke-12 19: xilan tongkol jagung 9% jam ke-24
Menurut Wang et al. (2009) xilooligosakarida merupakan produk utama yang dihasilkan dari proses hidrolisis menunjukkan bahwa enzim sangat aktif memotong rantai xilose. Sifat ini merupakan ciri khas dari enzim xilanase tipe endo (endoxilanase). Karakter xilanase dari berbagai mikroorganisme beragam, pada xilanase Bacillus sp. X13 menghasilkan selobiosa (Aygan & Arikan 2009).
Kerangka xilan dihidrolisis secara acak oleh endoxilanase (endo-1.4-β -D-xilan -D-xilanohidrolase, EC 3.2.1.8) dan memutus rantai bagian dalam gugus utama xilan untuk melepaskan ikatan dari beberapa gugus xilooligosakarida.Analisis proses hidrolisis xilanase berdasarkan derajat polimerasi dan analisis kualitatif TLC menunjukkan bahwa enzim xilanase mampu menghidrolisis xilan tongkol jagung pada semua konsentrasi (1%, 3%, dan 9%) hingga pada jam ke-24.
18
Gambar 9 Kromatogram hasil analisis HPLC
Hasil dari analisis HPLC produk hidrolisis menghasilkan lima puncak kromatogram yaitu dengan retention time a: 4.795 menit, b: 5.115 menit, c: 6.229 menit, d: 6.685 menit dan e: 8.045 menit dan puncak kromatogram tertinggi pada kromatogram b (Gambar 9). Puncak kromatogram c tertinggi ini menunjukkan konsentrasi dan produk yang paling banyak dibandingkan dengan kromatogram lainnya. Kromatogram seluruh sampel tidak memiliki kesamaan nilai retention time dengan standar xilosa, hal ini menunjukkan proses hidrolisis yang dihasilkan tidak menghasilkan xilosa sebagai produknya dan dapat diasumsikan seluruh produk yang dihasilkan berupa xilooligosakarida. Selain itu, produk yang dihasilkan tidak memiliki kesamaan dengan retention time glukosa dan arabinosa sebagai rantai samping xilan. Hal ini menguatkan bahwa enzim xilanase memiliki sifat tidak dapat memotong rantai samping dari struktur xilan.
1 c 1 a
1 b
d d
1 e
19 4 SIMPULAN DAN SARAN
Simpulan
Pemanfaatan xilan sebagai substrat hidrolisis enzim xilanase menghasilkan xilooligosakarida sangat menarik diteliti. Xilanase dari Streptomyces violascens
BF 3.10 mempunyai aktivitas optimum pada pH 5.5 dan pada suhu 60 ˚C. Xilanase Streptomyces violascens BF 3.10 mampu menghidrolisis xilan tongkol jagung 1%, 3%, dan 9% menghasilkan xilooligosakarida dengan derajat polimerasi 2-5. Hal ini diperkuat dengan data pada TLC dan hasil analisis HPLC yang menunjukkan semua produk hidrolisis yang dihasilkan berupa xilooligosakarida, sehingga dapat diasumsikan enzim xilanase yang dihasilkan mempunyai karakter endoxilanase.
Saran
20
DAFTAR PUSTAKA
Akpinar O, Ak O, Kavas A, Bakir U, Yilmaz L. 2007. Enzymatic production of xylooligosaccharides from Cotton Stalks. J. Agric. Food Chem. 55: 5544-5551. Anindyawati T. 2010. Potensi selulase dalam mendegradasi lignoselulosa produk
samping pertanian untuk pupuk organik. Berita Selulosa, 45:70 – 77.
Apriani I. 2013. Seleksi isolat Aktinomiset untuk degradasi biomassa lignoselulosa. Tesis. Bogor. Sekolah Pascasarjana. Institut Pertanian Bogor. Aygan A, Arikan B. 2009. Production and characterization of multifunctional
endoxylanase by Bacillus sp. X13. Turk J. Biol. 33: 231-237.
Bataillon M, Cardinali APN, Castillon N, Duchiron F. 2000. Purification and characterization of a moderately thermostable xylanase from Bacillus sp strain SPS-O. Enzyme Microb. Technol. 26:187-192.
Bisht GS , Bharti A, Kumar V, Gusain O. Isolation. 2012. Purification and partial, characterization of an antifungal agent produced by salt-tolerant alkaliphilic
Streptomyces violascens IN2-10. Proceedings of the National Academy of Sciences, India Section B: Biological Sciences 83(1):109-117. DOI:10.1007/s40011-012-0086-1.
Chapla D, Divecha J, Madamwar D, Shah A. 2010. Utilization of agro-industrial waste for xylanase production by Aspergillus foetidus MTCC 4898 under solid state fermentation and its application in saccharification. Biochem. Eng. J. 49:361–369.
Chen C, Chen JL, Lin TY. 1997. Purification and characterization of xylanase from Trichoderma longibrachium for xilooligosakarida production. Enzyme Microb. Technol. 21:91-96.
Collins T, Gerday C, Feller G. 2005. Xylanases, xylanase families and extremophilic xylanases. FEMS Microbiol. Reviews 29:3–23.
Dubois M, Gilles KA, Hamilton J.K. 1956. Colorimetric method for determination of sugar and related substances. Anal. Chem. 28:350-6.
El-Tarabily KA,Sykes ML, Kurtboke lD, Giles E,Hardy SJ,Barbosa A, Dekker RFH. 1996. Synergistic effects of a cellulase-producing Micromonospora carbonacea and an antibiotic-producing Streptomyces violascens on I the suppression of Phytophthora cinnamomi root rot of Banksia grandis. Can. J. Bot. 74: 618-624.
Funaguma T, Naito S, Morita M, Okumara M, Sugiura M, Hara A.1991. Purification and some properties of xylanase from Penicillium herquei Banier and Sartory. Agric. Biol. Chem. 55:1163-1165.
Gibson GR, Roberfroid MB. 1995. Dietary modulation of the human colonic mikrobiota:introducing the concept of prebiotics. Jurnal Nutrisi 125:1401-1412 Grabski AC, Jeffries TW. 1991. Production, purification characterisation of B- (1-4) endoxylanase of Streptomyces roseiscleroticus. App.Environ. Microbiol.
57: 987-992.
Hendriks ATWM, Zeeman G. 2009. Pretreatments to enhance the digestibility of lignocellulose biomass. Biores. Technol. 8: 10-18.
21 Irawadi TT. 1999. Selulase. Pusat Antar Universitas-Bioteknologi. Bogor: Institut
Pertanian Bogor.
Iwashita K, Todoroki K, Kimura H, Shimoi H, Ito K. 1998. Purification and characterization of extraceller and cell wall bound β-glucosidase from
Aspergillus kawachii. Biosci. Biotevhnol. Biochem. 62 (10): 1946-1998.
Kansoh AL, Nagieb ZA. 2004. Xylanase and mannanase enzyme from
Strptomyces galbus NR and their use in biobleaching of softwood kraft pupl.
Antonie van Leeuwenhoek 85:103-114.
Knob A , Carmona E C. 2008. Xylanase production by Penicillium sclerotiorum
and its characterization. World App. Sci. J.4 (2): 277-283.
Koswara J. 1991. Budidaya jagung. Jurusan budidaya pertanian. Fakultas Pertanian. Institut Pertanian Bogor.
Kulkarni N, Shendye A, Rao M. 1999. Molecular and biotechnological aspects of xylanases. FEMS. Microbiol. Rev.23: 411-456.
Lehninger A. 1982. Dasar-Dasar Biokimia. Volume ke-1. Suhartono MT,penerjemah; Jakarta: Erlangga. Terjemahan dari Principles of Biochemistry.
Magnuson TS, Crawford DIC. 1997. Purification and characterization of an alkaline xylanase from Streptomyces viridosporus T7A.Enzyme Microb Technol 21:164-167.
Meryandini A, Hendarwin T, Saprudin D, Lestari Y. 2006. Characterization of xylanase Streptomyces spp. SKK1-8. Hayati 13(4): 151-155.
Meryandini A, Saprudin D, Prihandono PA, Akhdiya A, Hendarwin T. 2007. Characterization of Streptomyces spp. 45I-3 Xylanase. Biotropia. 14: 32-42. Meryandini A, Sunarti TC, Naomi A, Mutia F. 2008 Using Streptomyces
xylanase to produce xylooligosacharide from corncob. Biotropia. 15: 119-128 Miller GL. 1959. Use of dinitrosalicylic acid reagent for determination of
reducting sugar. Anal Chem. 31: 426-428.
Moko EM. 2010. Produksi xilooligosakarida dari xilan tongkol jagung menggunakan enzim bakteri Streptomyces costaricanus 451-3. Tesis. Bogor. Sekolah Pascasarjana. Institut Pertanian Bogor. antagonistik penyebab lisis miselia Phakopsora pachyrhizi Syd. Prosiding Kongres Nasional XIV dan Seminar Ilmiah PFI. Palembang, 27-29 Oktober 1997.
Ratanachomsri U, Sriprang R, Sornlek W, Buaban B, Champreda V, Tanapongpipat S, Eurwilaichitr L. 2006. Thermostable xylanase from
Marasmius sp.: purif. character. J. of Biochem. Mol. Bio. 39(1): 105-110. Richana N, Irawati TT, Anwar NM, Illah S, Khaswar S, Yandra A. 2007.
22
Richana N, Lestina P, Irawadi TT. 2004. Karakterisasi lignoselulosa dari produk samping tanaman pangan dan pemanfaatannya untuk pertumbuhan bakteri RXA III-5 penghasil xilanase. J.Pen. Pert. Tan. Pang. 23: 171-176.
Rifaat H, Nagieb MZA, Ahmed YM.2005. Production of xylanases by
Streptomyces species and their bleaching effect on rice straw pulp. App. Eol and Environ. Res. 4(1) : 151-160.
Ruiz-Arribas A, Fernandes-Abalos J. M, Sanches A, Gardu, Santamaria R I. 1995. Over production, purification and biochemical characterization of xylanase I (xys 1 ) from Streptomyces halstedii JM8. Appl Environ Microbiol
61:2414-2419.
Suhartono MT. 1989. Enzim dan bioteknologi. Bogor. PAU. Bioteknologi IPB. Sun HJ, Yoshida S, Park NH, Kusakabe I. 2002. Preparation of (1,4)-b
dxylooligosaccharides from an acid hydrolysate of cotton-seed xylan: suitability of cotton-seed xylan as a starting material for the preparation of (1?4)-b-Dxylooligosaccharides: note. Carbohydr. Res. 337:657–661.
Tabosa-Vaz S, Kumar A, Permaul K, Singh S. 2011. Purification and biochemical characterization of a xylanase purified from a crude enzyme extract for the determination of active site residues. Afric. J. of Biochem. Res. 5(2): 43-56. Teather RM, Wood P J. 1982. Use of Merah kongo polysaccharides interactions
in enumeration and characterization of cellulolytic bacteria from the bovine rumen. Appl. Environ. Microbiol. 43: 777-780.
Thomas L, Abhilash J, Muthu A, Ashok P. 2013. Production, purification, characterization and over-expression of xylanase from Actinomycetes. Ind. J. of Exp. Biol. 51:875-884.
Tsujibo H, Miyomoto K, Kuda T, Minami K, Sakamoto T, Hasegawa T, Lanamori Y. 1992.Purification, properties and partial amino acid sequences of thermostable xylanase from Streptomyces termoviolaceus OPC-520.Appl.Environ. Microbiol. 58:371-375.
Vazquez MJ, Alonso JL, Dominguez H. 2000. Xylooligo-saccharides: manufacture and applications. Trends in Food Scie. and Technol. 11: 387–393 Wang J, Sun B, Cao Y, Tian Y, Wang C. 2009. Enzymatic preparation of wheat
bran xylooligosaccharides and their stability during pasteurization and autoclave sterilization at low pH. J. of Carbo. Pol. 77 : 816–821.
Wang SL, Yen SH, Shih IL, Chang AC, Chang WT, Wu WC, Chai YD.2003. Prouction of xylanase from rice bran by Streptomyces actuosus A-151.
Wijayanti Indah. 2009. Produksi, karakterisasi dan pemurnian xilanase dari
Staphylococcus aureus MBXi-K4. Tesis. Bogor. Sekolah Pascasarjana IPB. Yang R, Xu S, Wang Z, Yang W. 2005. Aqueous extraction of corncob xylan and
23 Lampiran 1 Proses ekstraksi xilan dari tongkol jagung
1 Tepung tongkol jagung ukuran 80 mesh
2 Perendaman dengan NaOCl 1 % selama 5 jam (Proses delignifikasi)
3 Pengeringan pasca delignifikasi dibawah sinar matahari selama 48 jam
4 Perendaman dengan NaOH 15% selama 24 jam
5 Supernatan hasil perendaman NaOH 15%, dinetralkan dengan penambahan HCl 37 %
24
7 Sentrifuse hasil presipitasi dengan penambahan ethanol pada supernatan rasio 3:1
8 Pellet hasil sentrifugasi kering
25 Lampiran 2 Komponen serat pada proses delignifikasi
1 Analisis proksimat
Karbohidrat(by different) 60.5 63.81
2 Analisis Van Soest 1991
Senyawa ekstraktif 28 11.31
Penurunan bobot komponen = x- [ y ( ] Keterangan :
X : Ʃ komponen serat awal
Y : komponen serat setelah kultivasi Z : % susut bobot
Z : % susut bobot = x 100%
= ( x 100% = 10 %
Dengan basis bobot substrat 100 g, maka :
26
Lampiran 3 Komposisi media
1 Media pertumbuhan bakteri Streptomyces violascens BF 3.10
Komposisi bahan Konsentrasi (g/100 mL)
beechwood xylan 0.5
ekstrak khamir 0.2
MgSO4. 7 H2O 0.02
K2HPO4 0.05
KNO3 0.075
FeSO4. 7H2O 0.002
CaCl2 0.004
glukosa 0.1
agar-agar 1,5
1 Komposisi media produksi xilan tongkol jagung 0.5%
Komposisi Bahan Konsentrasi (g/100 mL)
xilan tongkol jagung 0.5
ekstrak khamir 0.2
MgSO4. 7 H2O 0.02
K2HPO4 0.05
KNO3 0.075
FeSO4. 7H2O 0.002
CaCl2 0.004
glukosa 0.1
27 Lampiran 4 Morfologi isolat penghasil enzim xilanase pada media xilan tongkol
jagung 0.5% inkubasi selama 72 jam
Isolat BF 3.10
Isolat BO 2.1
Isolat BO 3.3 Isolat BF 3.1
Isolat BF 4.1
Isolat YM 4.2
28
Lampiran 5 Kurva standar pengukuran aktivitas enzim 1. Kurva standar gula pereduksi
Konsentrasi/ppm (mg/mL) absorbansi
0 0
20 0.003
40 0.028
60 0.098
80 0.177
100 0.252
150 0.429
200 0.591
250 0.755
300 0.917
350 1.09
Gambar Kurva standar xilosa y = 0.0033x - 0.0676
R² = 0.9952
0 0.2 0.4 0.6 0.8 1 1.2
0 100 200 300 400
absorba
nsi
29
2. Kurva standar total gula
konsentrasi/ ppm (mg/mL) absorbansi
0 0
20 0.314
40 0.493
60 0.734
80 1.014
100 1.256
Gambar kurva standar gula total y = 0.012x + 0.019
R² = 0.996
0 0.2 0.4 0.6 0.8 1 1.2 1.4
0 20 40 60 80 100 120
Absor
ba
nsi
30
Lampiran 6 Hasil analisis 16S rRNA 1. Hasil Contiq
>BF3.10
TGCAGTCGACGATGAACCACTTCGGTGGGGATTAGTGGCGAACGGGTGAGTAACACGTGGGCAA
TCTGCCCTGCACTCTGGGACAAGCCCTGGAAACGGGGTCTAATACCGGATACTGATTGTCTTGGG CATCCTTGATGATCGAAAGCTCCGGCGGTGCAGGATGAGCCCGCGGCCTATCAGCTTGTTGGTG AGGTAACGGCTCACCAAGGCGACGACGGGTAGCCGGCCTGAGAGGGCGACCGGCCACACTGGGA
CTGAGACACGGCCCAGACTCCTACGGGAGGCAGCAGTGGGGAATATTGCACAATGGGCGCAAGC CTGATGCAGCGACGCCGCGTGAGGGATGACGGCCTTCGGGTTGTAAACCTCTTTCAGCAGGGAA GAAGCGAAAGTGACGGTACCTGCAGAAGAAGCGCCGGCTAACTACGTGCCAGCAGCCGCGGTAA TACGTAGGGCGCAAGCGTTGTCCGGAATTATTGGGCGTAAAGAGCTCGTAGGCGGCTTGTCGCG
TCGGTTGTGAAAGCCCGGGGCTTAACCCCGGGTCTGCAGTCGATACGGGCAGGCTAGAGTTCGG TAGGGGAGATCGGAATTCCTGGTGTAGCGGTGAAATGCGCAGATTAGAGTTCGGTAGGGGAGAT CGGAATTCCTGGTGTAGCGGTGAAATGCGCAGATATCAGGAGGAACACCGGTGGCGAAGGCGGA TCTCTGGGCCGATACTGACGCTGAGGAGCGAAAGCGTGGGGAGCGAACAGGATTAGATACCCTG
GTAGTCCACGCCGTAAACGGTGGGCACTAGGTGTGGGCAACATTCCACGTTGTCCGTGCCGCAG CTAACGCATTAAGTGCCCCGCCTGGGGAGTACGGCCGCAAGGCTAAAACTCAAAGGAATTGACG GGGGCCCGCACAAGCGGCGGAGCATGTGGCTTAATTCGACGCAACGCGAAGAACCTTACCAAGG
CTTGACATACACCGGAAACGTCTGGAGACAGGCGCCCCCTTGTGGTCGGTGTACAGGTGGTGCA TGGCTGTCGTCAGCTCGTGTCGTGAGATGTTGGGTTAAGTCCCGCAACGAGCGCAACCCTTGTCC CGTGTTGCCAGCAGGCCCTTGTGGTGCTGGGGACTCACGGGAGACCGCCGGGGTCAACTCGGAG
GAAGGTGGGGACGACGTCAAGTCATCATGCCCCTTATGTCTTGGGCTGCACACGTGCTACAATG GCCGGTACAAAGAGCTGCGATACCGTGAGGTGGAGCGAATCTCAAAAAGCCGGTCTCAGTTCGG ATTGGGGTCTGCAACTCGACCCCATGAAGTCGGAGTCGCTAGTAATCGCAGATCAGCATTGCTGC
GGTGAATACGTTCCCGGGCCTTGTACACACCGCCCGTCACGTCACGAAAGTCGGTAACACCCGAA GCCGGTGGCCCAACCCCTTGTGGGAGGAGCTTCGAACGTGAGGGACTTC
2. Analisis BLASTn
31
RIWAYAT HIDUP
Penulis dilahirkan di Brebes tanggal 29 Juli 1989 dari pasangan Bapak Supriyanto dan Ibu Sunarti. Penulis merupakan anak terakhir dari dua bersaudara dengan kakak bernama Camelia Agustina. Penulis menyelesaikan pendidikan Sekolah Dasar di SDN Cikakak IV, Sekolah Menengah Pertama di SMP Al Muayyad Surakarta dan Sekolah Menengah Atas di SMAN 3 Salatiga dan lulus pada tahun 2007. Penulis meneruskan ke jenjang sarjana melalui program SPMB di jurusan Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sebelas Maret Surakarta. Penulis menyelesaikan studi strata 1 pada tahun 2011. Pada tahun 2012 penulis meneruskan studi strata 2 di Jurusan Bioteknologi Program Pascasarjana Institut Pertanian Bogor dari sumber dana Beasiswa Unggulan DIKTI. Bagian dari penelitian ini dalam proses publikasi pada jurnal Media Peternakan dengan judul “Xylanase activity of Streptomyces violascences