UJI KEAMANAN LINGKUNGAN VAKSIN DNA ANTI-KHV:
UJI
IN VIVO
DENGAN BAKTERI
Aeromonas hydrophila
PADA PERIODE INTERAKSI BERBEDA
SEPRIADI YUSRA
DEPARTEMEN BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul “Uji Keamanan Lingkungan Vaksin DNA Anti-KHV: Uji In Vivo dengan Bakteri Aeromonas hydrophila pada Periode Interaksi Berbeda” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan dan tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
SEPRIADI YUSRA. Uji Keamanan Lingkungan Vaksin DNA: Uji In Vivo dengan Aeromonas hydrophila pada Periode Interaksi Berbeda. Dibimbing oleh SRI NURYATI dan ALIMUDDIN.
Vaksin DNA anti-KHV perlu diuji keamanannya secara in vivo sebelum diaplikasikan secara luas. Tujuan penelitian ini adalah menguji potensi interaksi plasmid vaksin DNA di dalam tubuh ikan mas dengan waktu interaksi sampai dengan hari ke-20. Plasmid vaksin konsentrasi 12,5 µg/100 µL dan bakteri Aeromonas hydrophila kepadatan 106 cfu/mL disuntikkan ke ikan mas ukuran panjang total 6-8 cm. Perlakuan A vaksin disuntikkan terlebih dahulu, setelah 24 jam berikutnya disuntikkan bakteri. Perlakuan B vaksin dan bakteri disuntik bersama-sama. Perlakuan C bakteri disuntikkan terlebih dahulu, setelah 24 jam berikutnya disuntikkan vaksin. Perlakuan D sebagai kontrol ikan hanya disuntikkan bakteri. Pada hari ke-1, ke-7, sampai hari ke-20, bakteri diisolasi dari darah dan ginjal ikan menggunakan media TSA mengandung ampisilin (0,05 ppt). Hasil isolasi menunjukkan beberapa isolat tumbuh pada media mengandung ampisilin. Namun demikian, hasil analisis DNA menunjukkan tidak ada isolat yang mengandung vaksin DNA. Sehingga bisa disimpulkan pada perlakuan periode interaksi hingga hari ke-20 pascainteraksi tidak terjadi transfer DNA di dalam tubuh ikan uji ke bakteri A.hydrophila dan vaksin DNA anti-KHV aman digunakan. Kata kunci: Aeromonas hydrophila, in vivo, vaksin DNA, waktu interaksi
ABSTRACT
SEPRIADI YUSRA. Environmental Safety Assesment of Anti-KHV DNA Vaccine: In Vivo Test by Different Period of Interaction with Aeromonas hydrophila. Supervised by SRI NURYATI and ALIMUDDIN.
Environmental safety assessment of the DNA vaccine Anti-KHV is required before it applied widely. This research aimed to examine interaction possibility of anti-KHV DNA vaccine and bacteria in fish body within 1, 7, and 20 days post interaction subsequently. DNA vaccine (12.5 µg/100 µL PBS) and bacteria Aeromonas hydrophila (106 cfu/mL) were injected to common carp (6-8 cm in total body length). Treatment A fish was injected with vaccine first and 24 hours afterward with bacteria. Treatment B fish were injected vaccine and bacteria simultaneously. Treatment C fish was injected bacteria first and 24 hours afterward with vaccine. Treatment D fish was injected with bacteria only. At day 1, 7, and 20, bacteria were isolated from blood and kidney using TSA media containing ampicilin (0.05 ppt). The results showed that several isolates grew in the bacterial culture media. However, DNA analysis revealed that no isolates contained DNA vaccine. Those indicates that no DNA vaccine transferred to A. hydrophila; hence it concluded that DNA vaccine is safe for environment.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada
Departemen Budidaya Perairan
UJI KEAMANAN LINGKUNGAN VAKSIN DNA ANTI-KHV:
UJI
IN VIVO
DENGAN BAKTERI
Aeromonas hydrophila
PADA PERIODE INTERAKSI BERBEDA
SEPRIADI YUSRA
DEPARTEMEN BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
PRAKATA
Puji dan syukur kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan dengan tema yang dipilih adalah uji keamanan lingkungan terhadap vaksin DNA anti-KHV. Sholawat dan salam semoga terlimpah curah pada teladan manusia sepanjang masa Rasulullah Muhammad SAW beserta kepada keluarga, sahabat, dan para pengikut beliau hingga akhir zaman insya Allah.
Penelitian ini dilakukan sejak bulan Januari hingga Februari 2015 di Laboratorium Kesehatan Ikan dan Laboratorium Reproduksi dan Genetika Organisme Akuatik, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Terima kasih penulis sampaikan kepada Ibu Dr. Sri Nuryati dan Bapak Dr. Alimuddin selaku pembimbing, Ibu Dr. Munti Yuhana sebagai Penguji Tamu, Ibu Dr. Mia Setiawati sebagai perwakilan KPS, Bapak Dr. Sukenda sebagai ketua Departemen, Bapak Prof Enang Harris sebagai pembimbing akademik, Bapak Prof. Dr. Hadi Soesilo Arifin sebagai konselor TPB, Ayah, Ibu, adik-adikku, Kakak tersayang Wibrahim dan Gerry serta keluarga atas pengorbanannya selama ini. Terima kasih juga kepada semua sivitas BDP khususnya dan IPB pada umumnya. Semoga Allah SWT, Tuhan Yang Maha Esa membalasnya dengan kebaikan berlipat ganda.
Semoga karya ilmiah ini bermanfaat.
Bogor, Mei 2015
DAFTAR ISI
DAFTAR TABEL ... x
DAFTAR GAMBAR ... x
DAFTAR LAMPIRAN ... x
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan Penelitian ... 2
METODE PENELITIAN ... 2
Rancangan Penelitian ... 2
Prosedur Penelitian ... 2
Parameter Penelitian... 3
Analisis Data ... 5
HASIL DAN PEMBAHASAN ... 5
Hasil ... 5
Pembahasan ... 7
KESIMPULAN ... 10
DAFTAR PUSTAKA ... 10
LAMPIRAN ... 13
DAFTAR TABEL
1 Rincian perlakuan dalam penelitian ... 2
2 Pertumbuhan bakteri dari ginjal dan darah pada media TSA+ampisilin ... 5
DAFTAR GAMBAR
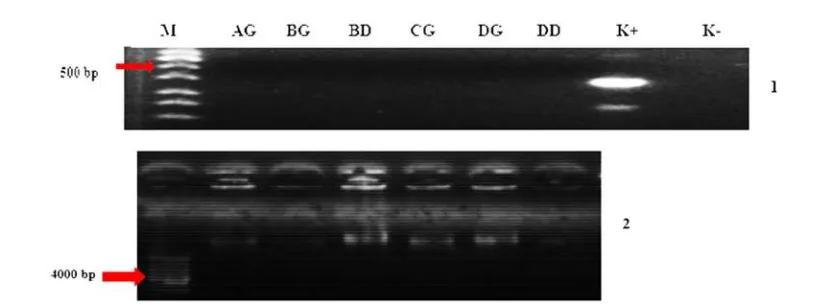
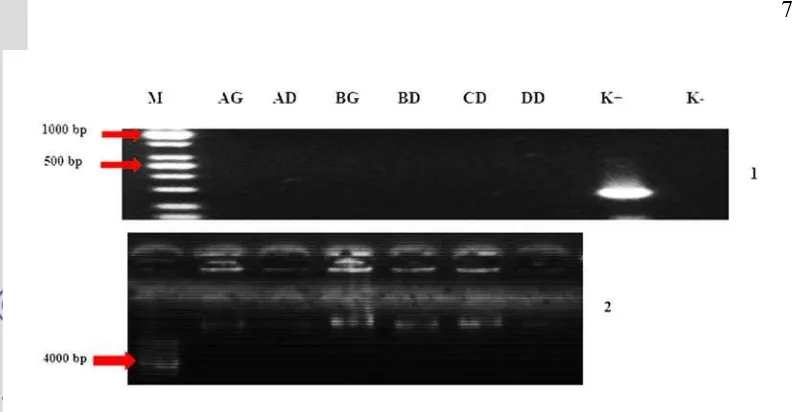
1 Konfirmasi keberadaan vaksin DNA dalam isolat bakteri pada hari interaksi ke-1 menggunakan metode PCR dan elektroforesis. AG= perlakuan A dari ginjal, AD= perlakuan A dari darah, BG= perlakuan B dari ginjal, BD= perlakuan B dari darah, CG= perlakuan C dari ginjal, DD= perlakuan D dari darah. Angka 1 menunjukkan hasil PCR, angka 2 menunjukkan elektroforesis hasil cracking ... . 2 Konfirmasi keberadaan vaksin DNA dalam isolat bakteri pada hari interaksi ke-7 menggunakan metode PCR dan elektroforesis. AG= perlakuan A dari ginjal, BG= perlakuan B dari ginjal, BD= perlakuan B dari darah, CG= perlakuan C dari ginjal, DG= perlakuan D dari ginjal, DD= perlakuan D dari darah. Angka 1 menunjukkan hasil PCR, angka 2 menunjukkan elektroforesis hasil cracking ... . 3 Konfirmasi keberadaan vaksin DNA dalam isolat bakteri pada hari interaksi ke-20 menggunakan metode PCR dan elektroforesis. AG= perlakuan A dari ginjal, AD= perlakuan A dari darah, BG= perlakuan B dari ginjal, BD= perlakuan B dari darah, CD= perlakuan C dari darah, DD= perlakuan D dari darah. Angka 1 menunjukkan hasil PCR, angka 2 menunjukkan elektroforesis hasil cracking ... .DAFTAR LAMPIRAN
1 Komposisi larutan 1 pada proses pemurnian plasmid ... 132 Komposisi larutan 2 pada proses pemurnian plasmid ... 13
3 Komposisi larutan 3 pada proses pemurnian plasmid ... 13
4 Komposisi larutan cracking buffer ... 13
5 Komposisi larutan loading cracking buffer ... 13
6 Komposisi larutan premix PCR ... 13
7 Tabel Cowan dan Steel (dimodifikasi dari Cowan dan Steel 2003) ... 14
8 Karakterisasi Gram dan uji biokimia bakteri hasil isolasi ikan uji ... 14
9 Hasil identifikasi isolat menggunakan KIT API 20 E ... 15 6
6
1
PENDAHULUAN
Latar Belakang
Riset tentang vaksin DNA anti-KHV sudah mengalami kemajuan signifikan. Riset yang sudah dilakukan memberikan bukti efektivitas vaksin anti-KHV. Vaksin DNA anti-KHV mampu meningkatkan imunitas pada ikan mas (Cyprinus carpio) dan ikan koi dalam menghadapi infeksi koi herpesvirus (KHV). Penelitian Nuryati et al. (2010) menghasilkan konstruksi gen penyandi glikoprotein kapsid isolat KHV asli Indonesia yang diberi kode GP25. Beberapa penelitian lainnya telah mengemukakan dosis, metode pemberian, efektivitas frekuensi, dan uji keamanan lingkungan secara in vitro pada vaksin DNA anti-KHV (Nuswantoro et al. 2012; Nuryati et al. 2013; Soraya 2013; Zubaidah 2013; Ariyanti 2014; Nuryati et al. 2015).
Vaksin DNA anti-KHV merupakan produk rekayasa genetika (PRG). Foss dan Rogne (2003) mengemukakan bahwa pengembangan dan penggunaan PRG harus memenuhi regulasi yang berlaku. Pemerintah Republik Indonesia mengatur penggunaan PRG dalam Peraturan Pemerintah nomor 21 tahun 2005 tentang Keamanan Hayati Produk Rekayasa Genetik. Salah satu indikator yang harus diperhatikan untuk pengembangan PRG adalah isu keamanan terhadap lingkungan dan terhadap manusia.
Keamanan lingkungan menjadi perhatian utama dalam setiap pengembangan PRG termasuk vaksin DNA anti-KHV. Titik kritis keamanan vaksin DNA pada industri akuakultur salah satunya adalah potensi kontak langsung sisa vaksin DNA ke perairan umum (Myhr dan Dalmo 2005). Masuknya vaksin DNA ke perairan umum dan rantai makanan menimbulkan kekhawatiran terjadinya transfer gen dan integrasi plasmid vaksin DNA ke mikroorganisme yang ada di perairan umum, objek vaksinasi, bahkan interaksi ke manusia.
Beberapa riset tentang potensi transfer gen secara horizontal sudah dipublikasikan. Loftus et al. (2005) membuktikan terjadi transfer gen secara horizontal dari bakteri di dalam saluran pencernaan hewan ke dalam genom parasit Entamoeba histolytica. Velineni et al. (2014) membuktikan terjadinya transfer gen antar spesies Streptococcus zooepidemicus dalam inang alaminya dan menimbulkan pembentukan koloni yang menyebabkan penyakit epizootik pada hewan anjing dan kuda. Meskipun demikian, fakta keamanan vaksin DNA sudah terbukti pada beberapa produk vaksin DNA. Hingga tahun 2007 sudah terdapat 2 jenis vaksin DNA untuk tujuan preventif dan satu jenis vaksin DNA terapi kanker yang sukses memperoleh persetujuan pihak berwenang di negaranya untuk beredar secara luas di pasar (Salonius et al. 2007). Hal ini mengindikasikan bahwa secara ilmiah disertai upaya yang ketat, vaksin DNA berpotensi aman untuk digunakan secara luas.
2
secara horizontal dari plasmid vaksin anti-KHV kepada bakteri flora normal yang hidup di media budidaya ikan mas. Namun, uji secara in vivo di dalam tubuh ikan belum dilakukan. Ikan sebagai objek vaksinasi merupakan organisme yang paling banyak mendapatkan plasmid vaksin sehingga risiko uptake plasmid berpeluang besar terjadi di dalam tubuh ikan dan bakteri flora normal yang ada di dalamnya. Oleh karena itu, penelitian ini diharapkan bisa memberikan bukti untuk memenuhi penerimaan publik terhadap keamanan penggunaan vaksin DNA anti-KHV.
Tujuan Penelitian
Penelitian ini bertujuan untuk menguji potensi interaksi vaksin DNA anti-KHV secara in vivo di dalam tubuh ikan mas (C.carpio) yang disuntik bakteri Aeromonas hydrophila sebagai bakteri model dalam waktu interaksi hari 1, ke-7, dan ke-20 pascainteraksi.
METODE PENELITIAN
Rancangan Penelitian
Penelitian ini menggunakan metode eksperimental pendekatan kualitatif dengan 4 perlakuan (Tabel 1). Perlakuannya adalah perbedaan periode interaksi vaksin DNA dan bakteri, dan setiap perlakuan diberi tiga ulangan. Pengambilan isolat (waktu interaksi) dilakukan pada hari ke-1, ke-7 dan ke-20 pascainteraksi.
Tabel 1 Rincian perlakuan dalam penelitian Kode perlakuan Urutan penyuntikan
A Ikan disuntik vaksin DNA terlebih dahulu, setelah 24 jam diikuti penyuntikan bakteri
B Ikan disuntik vaksin dan bakteri secara bersama-sama C Ikan disuntik bakteri terlebih dahulu, setelah 24 jam
diikuti penyuntikan vaksin DNA D Ikan hanya disuntik bakteri
Prosedur Penelitian Kultur Plasmid Vaksin DNA Anti-KHV
3 menambahkan 1 mL etil-alkohol (EtOH) dingin 100% kemudian dihomogenasi dan disimpan pada suhu -20 ºC selama 30 menit. Sentrifugasi dilakukan kembali pada kecepatan 12.000 rpm selama 5 menit dan suhu 4ºC. Supernatan dibuang dan ditambahkan 700 µL EtOH 70% dingin dan dilakukan sentrifugasi pada kecepatan 12.000 rpm selama 5 menit pada suhu 4ºC. Supernatan dibuang dan DNA dikeringkan di udara terbuka. DNA dicampur dengan ion exchange water dengan volume 50 µL dan disimpan pada suhu -20 ºC.
Kultur Bakteri Aeromonas hydrophila
Isolat bakteri A. hydrophila dari stok murni (Lab. Kesehatan Ikan IPB) dilarutkan dalam media tryptic soy broth (Merck, Germany) (dosis 30 g/1000 mL) sebanyak 50 mL kemudian diinkubasi dalam waterbath shaker suhu 27ºC selama 24 jam. Bakteri dikumpulkan dengan melakukan sentrifugasi dan dicuci menggunakan phosphate buffer saline (PBS) steril sebanyak 3 kali. Bakteri diencerkan hingga mencapai kepadatan 106 cfu/mL lalu siap digunakan. Bakteri yang akan digunakan untuk penyuntikan disiapkan secara segar.
Penyuntikan Vaksin dan Bakteri Aeromonas hydrophila
Vaksin yang sudah dimurnikan diatur kepadatannya terlebih dahulu yaitu sebanyak 12,5 µg/100 µL vaksin (Nuryati et al.2010). Vaksin disuntikkan ke ikan secara intramuskuler sebanyak 0,1 mL/ekor ikan. Jumlah ikan yang disuntik sebanyak 10 ekor ikan mas (panjang total 6-8 cm) pada masing-masing perlakuan. Ikan mas yang digunakan untuk uji pengambilan darah dan ginjal berjumlah 3 ekor, sebanyak 7 ekor masing-masing perlakuan disiapkan sebagai cadangan.
Pengambilan Isolat Pascainjeksi
Isolasi bakteri dari ikan pascainjeksi diambil dari darah mengikuti metode yang dilakukan Nuryati et al. (2010). Pengambilan isolat dari ginjal dilakukan dengan mengambil satu ekor ikan secara acak pada masing-masing perlakuan. Darah dan ginjal diambil sebanyak satu ose kemudian digores kuadran dalam media tryptic soy agar/TSA (Merck, Germany) komposisi 4 g TSA untuk 100 mL akuades dicampur dengan antibiotik ampisilin (konsentrasi akhir 0,05 ppt). Goresan diinkubasi dalam suhu 27ºC selama 24 jam dan diamati pertumbuhan koloni. Isolat yang tumbuh dimurnikan kembali dengan gores kuadran sampai 2 kali penggoresan. Setelah bakteri menjadi murni digoreskan di media agar miring TSA untuk diinkubasi (27ºC, 24 jam) kemudian disimpan di dalam lemari pendingin bakteri. Pengambilan isolat dilakukan pada hari ke-1, hari ke-7, dan hari ke-20 pascainteraksi.
Parameter Penelitian Pertumbuhan Isolat Bakteri
4
tumbuh diamati dan dihitung. Koloni tunggal yang tumbuh dihitung jumlah koloni, diamati bentuk koloni dan bentuk tepian koloninya untuk memastikan keseragaman bakteri hasil isolasi. Koloni tunggal dikultur ulang pada media TSA+ampisilin dengan gores kuadran.Bakteri yang sudah murni kemudian digores pada agar miring TSA+ampisilin untuk digunakan pada proses karakterisasi bakteri.
Pewarnaan Gram dan Karakterisasi Biokimia Isolat Bakteri
Isolat bakteri diuji jenis Gram dan karakter biokimianya. Metode uji Gram menggunakan acuan Chapin dan Lauderdale (2007). Uji biokimia yang digunakan meliputi uji oksidase, katalase, O/F, dan motilitas. Hasilnya dikonfirmasi menggunakan tabel Cowan (Cowan dan Steel 2003). Jika hasil uji menunjukkan keseragaman yang baik antar bakteri isolat, dilakukan pengambilan satu sampel untuk diuji lebih lanjut menggunakan KIT API 20E (Biomeriaux, France).
Analisis DNA
Koloni tunggal isolat bakteri diambil menggunakan tusuk gigi steril, kemudian dioleskan pada dasar tabung mikro 1,5 mL. Tahap selanjutnya adalah penambahan EDTA 10 mM sebanyak 10 µl pada satu sisi dinding tabung mikro berisi bakteri dan cracking buffer (CB) (Lampiran 4) sebanyak 10 µL pada sisi dinding tabung mikro yang lain kemudian dihomogenkan menggunakan vorteks. Campuran kemudian ditambahkan loading cracking buffer (LCB) (Lampiran 5) sebanyak 1 µL pada bagian tutup tabung mikro. Larutan dihomogenkan kembali menggunakan vorteks dan diinkubasi pada suhu ruang selama 5 menit. Campuran dihomogenasi menggunakan vorteks hingga keruh lalu dimasukkan ke dalam wadah berisi es dan inkubasi selama 5 menit. Campuran bakteri dan larutan cracking kemudian disentrifugasi pada kecepatan 12.000 rpm selama 5 menit pada suhu 4 ºC sampai terbentuk pelet dan supernatan. Supernatan yang terbentuk digunakan untuk PCR, dan elektroforesis langsung tanpa dilakukan PCR.
Premix untuk PCR terlebih dahulu diformulasikan sesuai dengan banyaknya sampel (Lampiran 6) dalam kondisi on ice. Supernatan yang terbentuk pada proses cracking kemudian dibagi ke dalam tabung mikro yang lebih kecil dan telah berisi premix PCR. Volume sampel yang dimasukkan adalah 1 µL dan premix sebanyak 9 µL. Kontrol positif yang digunakan adalah plasmid vaksin DNA yang sudah dibuat pada awal penelitian sebelum perlakuan dimulai sebanyak 1 µL.
Program PCR dirancang sesuai dengan acuan Nuryati et al. (2010). Susunan primer forward (F) sebagai berikut TTGTCGACATGACGGGTTGTGGG-GTTTG dan primer reverse (R) sebagai berikut TTAGGGCCTCCGGGAAAC-CTGG. Kondisi reaksi polimerasi yang digunakan adalah prakondisi pada suhu 95ºC selama 7 menit, denaturasi pada suhu 95 ºC selama 30 detik, annealing pada suhu 64 ºC selama 30 detik, ekstensi pada suhu 72 ºC selama dua menit, dan tahap akhir pada suhu 72 ºC selama tujuh menit. Siklus amplifikasi dilakukan sebanyak 35 siklus.
5 listrik 200 volt, kuat arus 75 mA, selama 45 menit. Hasil elektroforesis diamati di dalam ruang ultraviolet menggunakan kamera digital.
Analisis Data
Data penelitian diolah secara deskriptif berupa tabel dan gambar menggunakan perangkat lunak pengolah huruf Microsoft Word 2013 dan perangkat lunak pengolah gambar Adobe Photoshop CS6.
HASIL DAN PEMBAHASAN
Hasil Isolasi Bakteri dari Perlakuan
Bakteri isolasi dari darah dan ginjal masing-masing perlakuan ditumbuhkan dalam media TSA mengandung antiobiotik ampisilin. Hasilnya pada masing-masing perlakuan ada bakteri yang tumbuh (Tabel 2).
Pewarnaan Gram dan Uji Biokimia
Hasil pewarnaan Gram dan uji biokimia menunjukkan konsistensi pada masing-masing isolat (Lampiran 8). Semua bakteri hasil isolasi adalah kelompok Gram negatif dengan bentuk bakteri basil. Hasil uji O/F semua isolat menunjukkan reaksi fermentatif. Hasil uji keberadaan enzim oksidase dan katalase semua isolat menunjukkan hasil positif. Uji motilitas menunjukkan bahwa semua isolat bakteri adalah kelompok bakteri yang motil. Bakteri isolat diduga merupakan bakteri Chromobacterium, Vibrio,Plesiomonas, dan Aeromonas (Cowan dan Steel 2003) seperti terdapat dalam Lampiran 7. Hasil verifikasi dengan Kit API 20E menunjukkan hasil bakteri isolat sampel 99,8% adalah spesies A.hydrophila dengan rincian hasil uji KIT API 20E terdapat pada Lampiran 9.
Tabel 2 Pertumbuhan bakteri dari ginjal dan darah pada media TSA + ampisilin
Isolasi hari ke- Kode sampel
AG AD BG BD CG CD DG DD
1 + + + + + - - +
7 + - + + + - + +
20 + + + + - + - +
6
Analisis DNA
Analisis DNA bakteri menunjukkan hasil negatif pada setiap sampel uji (Gambar 1, 2 dan 3). Semua bakteri yang tumbuh dalam media TSA mengandung antibiotik ampisilin tidak membawa plasmid vaksin anti-KHV.
Gambar 1 Konfirmasi keberadaan vaksin DNA dalam isolat bakteri hari interaksi ke-1 menggunakan metode PCR dan elektroforesis. AG= perlakuan A dari ginjal, AD= perlakuan A dari darah, BG= perlakuan B dari ginjal, BD= perlakuan B dari darah, CG= perlakuan C dari ginjal, DD= perlakuan D dari darah. Angka 1 menunjukkan hasil PCR, angka 2 menunjukkan visualisasi elektroforesis hasil cracking.
7
Pembahasan
Bakteri yang tumbuh hasil isolasi dan uji karakterisasi adalah jenis yang sama, yaitu A. hydrophila (Lampiran 9). Bakteri A. hydrophila merupakan patogen yang umum terdapat pada lingkungan air tawar, tanaman air, ikan, dan telur ikan (Austin dan Austin 2012). Bakteri A. hydrophila dilaporkan memiliki resistensi yang kuat terhadap beberapa jenis antibiotik antara lain ampisilin, chloramphenicol, erythromycin, nitrofurantoin, novobiocin, streptomycin, sulphonamide, dan tetracycline (Aoki 1988; De Paola et al. 1994; Austin dan Austin 2012).
Bakteri yang tumbuh pada media TSA mengandung ampisilin (Tabel 1) mengindikasikan fenotipe resisten ampisilin. Ampisilin merupakan antibiotik kelompok betalactam. Kelompok betalactam memiliki mekanisme penghambatan reaksi transpeptidasi dinding sel bakteri dan menggantinya dengan sebuah struktur analog yang menyerupai D-alanyl-D-alanine dipeptida. Penghambatan oleh betalactam membuat dinding sel bakteri yang terdiri atas peptidoglikan menjadi tidak stabil dan dinding sel menjadi lisis (Sköld 2011).
Berdasarkan hasil karakterisasi, isolat bakteri merupakan kelompok bakteri Gram negatif. Isolat bakteri diduga memiliki enzim β-lactamase sehingga memunculkan fenotipe resistensi terhadap ampisilin. Nikaido (1996) menyebutkan bahwa bakteri Gram negatif mempunyai kemampuan resistensi antibiotik terutama terhadap kelompok betalactam yang lebih baik daripada bakteri Gram positif karena terdapat senjata utama yang dimiliki oleh bakteri Gram negatif yaitu enzim β-lactamase. Enzim β-lactamase bereaksi dengan menyerang ikatan gugus amin pada cincin β-lactam yang merupakan bagian sensitif penisilin dan cephalosporins kemudian menginaktifasi senyawa antibakteri tersebut (Sykes dan Matthew 1976). Cincin β-lactam yang terdapat pada penisilin dihidrolisis oleh enzim β-lactamase, Gambar 3 Konfirmasi keberadaan vaksin DNA dalam isolat bakteri hari
8
kemudian diproduksi asam penisiloik yang sesuai menurut kesetimbangan reaksi stoikiometri.
Isolat bakteri menjadi resisten ampisilin juga diduga akibat terjadinya transfer gen secara horizontal (horizontal gene transfer) antara plasmid vaksin dan bakteri yang ada di dalam tubuh ikan serta bakteri kontrol yang disuntikkan ke ikan uji. Hal ini sesuai dengan pernyataan Hoffman (2001) yang menyebutkan setidaknya ada dua mekanisme yang menyebabkan resistensi antibiotik pada bakteri Gram negatif, yaitu mutasi dan akuisisi gen asing yang menyandikan sifat resistensi antibiotik. Resistensi terhadap ampisilin (kelompok betalactam) lebih dominan terjadi akibat mediasi plasmid penyandi resistensi yang lebih umum dikenal dengan istilah R-factor (Hoffman 2001).
Akuisisi gen asing dengan mekanisme horizontal gene transfer (HGT) patut diduga menjadi salah satu penyebab resistensi isolat dari ikan uji terhadap ampisilin. Konstruksi vaksin DNA anti-KHV mengandung sekuen penyandi resistensi spesifik ampisilin mungkin mengalami uptake oleh bakteri di dalam tubuh ikan dan memunculkan fenotipe resistensi. Namun, hasil analisis DNA (Gambar 1, 2 dan 3) mengkonfirmasi tidak ada uptake vaksin DNA anti-KHV di dalam isolat bakteri. HGT diduga tidak terjadi antara plasmid dan bakteri di dalam tubuh ikan uji.
Hasil analisis DNA (Gambar 1, 2 dan 3) membuktikan tidak terdapat sekuen DNA vaksin anti-KHV di dalam isolat bakteri yang diperoleh. Hal ini diduga karena HGT merupakan mekanisme yang tidak mudah terjadi. HGT merupakan proses alami yang cukup sulit untuk terjadi. Thomas dan Nielsen (2005) telah menjabarkan mekanisme HGT pada bakteri. Bakteri donor harus melepaskan DNA polos (naked DNA) terlebih dahulu ke lingkungan. Molekul DNA bakteri bisa lepas dan berada di lingkungan melalui tiga mekanisme yaitu kematian sel, sel yang rusak, atau ekskresi aktif oleh bakteri. Bakteri resipien harus melakukan penyesuaian fisiologi terhadap struktur dinding selnya sehingga kompeten untuk menerima molekul DNA bebas. DNA yang sudah masuk ke dalam bakteri kompeten harus masuk dengan terlebih dahulu diubah menjadi untai tunggal. DNA yang sudah masuk diubah menjadi untai ganda kembali dan diintegrasikan dengan genom bakteri inangnya melalui rekombinasi homolog atau rekombinasi bebas. Pada isolat bakteri hasil penelitian, diduga tidak mengalami HGT karena tidak memenuhi mekanisme yang disampaikan oleh Thomas dan Nielsen (2005). Secara umum gen yang diperoleh secara horizontal akan menyebabkan efek perubahan dalam kromosom bakteri resipiennya. Beberapa akuisisi gen secara horizontal mungkin terjadi dan disimpan selama hidupnya. Beberapa DNA kromosom ada yang bisa memberikan manfaat tertentu kepada resipiennya. Jika hal itu bisa dilakukan, maka material genetikyang masuk tersebut punya potensi untuk menyebar secara cepat dalam populasi bakteri (Thomas dan Nielsen 2005).
9 regulasi dan proses fisiologis yang sudah stabil pada inang. Meski demikian, risiko negatif HGT bisa saja mengalami perbaikan seiring berjalannya waktu dengan penyeleksian region yang mencapai posisi yang sesuai di dalam genom inang sehingga bisa mengakomodasi DNA asing untuk diekspresikan.
Peluang integrasi dan uptake plasmid pada kenyataannya sangat kecil. Plasmid vaksin yang disuntikkan akan mengalami beberapa proses sebelum akhirnya bertahan di dalam tubuh organisme target. Proses tersebut antara lain (i) plasmid di-uptake oleh sel di lokasi penyuntikan, (ii) plasmid tetap berada di luar sel yang berada di lokasi penyuntikan, (iii) plasmid mengalami degradasi oleh enzim endonuklease, (iv) plasmid terdistribusi melalui darah, sel, dan limfoid pada beragam jaringan (Gillund et al. 2008; Dolter et al. 2011). Sebagian besar plasmid (sekitar 95-99%) akan didegradasi dalam rentang waktu 90 menit pascavaksinasi (Barry et al. 1999). Namun demikian, sisa plasmid vaksin yang tersisa tetap bisa memberikan efek imunitas yang diharapkan (Gillund et al. 2008). Sementara itu menurut Nuryati et al. (2010) keberadaan plasmid vaksin DNA anti-KHV masih dapat diidentifikasi sampai dengan hari ke-14 pascainjeksi. Hal ini terjadi karena sifat promotor yang digunakan yaitu β-aktin aktif di semua jaringan. Hal serupa didukung juga oleh Dolter et al. (2011) yang menyampaikan hasil bahwa residu plasmid vaksin pada hari ke-60 pascavaksinasi sudah tidak ditemukan lagi. Selain itu, mekanisme masuknya plasmid ke dalam bakteri umumnya terjadi dengan proses konjugasi yang melibatkan dua sel bakteri hidup. Pada kenyataannya, vaksin DNA anti-KHV yang diinjeksikan adalah plasmid murni yang tidak disisipkanke dalam sel bakteri hidup. Oleh karena itu, diduga vaksin DNA anti-KHV menggunakan pemurnian plasmid sangat aman untuk diaplikasikan di lapangan ditinjau dari aspek keamanan lingkungan dan perlindungan keragaman genetika alam.
Huang et al. (2014) melaporkan tidak ada integrasi genom oleh vaksin DNA Streptococcus agalactiae menggunakan bakteri Salmonella typhimurium yang dilemahkan sebagai pembawa vaksin ke ikan nila dan disimpulkan vaksin DNA aman digunakan untuk mencegah infeksi S. agalactiae pada ikan nila. Oleh karena itu, potensi integrasi plasmid dengan genom organisme target baik dengan penyuntikan intramuskuler maupun elektroforasi sangat rendah. Oleh karena itu, kekhawatiran terhadap potensi integrasi semakin kecil peluangnya.
10
KESIMPULAN
Berdasarkan hasil penelitian ini telah dibuktikan bahwa tidak ada interaksi antara plasmid vaksin DNA anti-KHV dengan bakteri A.hydrophila secara in vivo di dalam tubuh ikan mas hingga periode 20 hari pascainteraksi.
DAFTAR PUSTAKA
Aoki T. 1988. Drug-resistant plasmids from fish pathogens. Microbiological Sciences. 5:219-223.
Ariyanti N. 2014. Analisis gambaran darah terhadap kelangsungan hidup relatif ikan mas yang diberi vaksin DNA anti-KHV melalui pakan dengan frekuensi berbeda [skripsi]. Bogor(ID) : Institut Pertanian Bogor.
Austin B, Austin DA. 2012. Bacterial Fish Pathogens: Disease of Farmed and Wild Fish 4th Edition. London (GB) :Springer Inc.
Baltrus DA. 2013. Exploring the cost of horizontal gene transfer. Trends in Ecology & Evolution. 28 (8) : 489-495. doi: 10.1016/j.tree.2013.04.002.
Barry ME, Pinto-Gonzalez D, Orson FM, McKenzie GJ, Petry GR, Barry MA. 1999. Role of endogenous endonucleases and tissue site in transfection and CpG-mediated immune activation after naked DNA injection. Human Gene Therapy. 10:2461-2480. doi: 10.1089/10430349950016816.
Chapin KC, Lauderdale TL. 2007. Reagents, Stains, and Media : Bacteriology. Di dalam: Murray PR, Baron EJ, Landry ML, Jorgensen JH, Pfaller MA, editor. Manual of Clinical Microbiology 9th Edition. Volume 1. General Issues in Clinical Microbiology. Washington DC (US) : ASM Press.
Cowan IST, Steel KJ. 2003. Cowan and Steel’s Manual for The Identification of Medical Bacteria. Barrow GI, Feltham RKA, editor. Cambridge (GB). Cambridge University Press.
De Paola A, Capers GM, Alexander D. 1994. Densities of Vibrio vulnificus in the intestines of fish from the U.S. Gulf-Coast. Applied and Environmental Microbiology. 60: 984-988.
Dolter KE, Evans CF, Ellefsen B, Song J, Boente-Carrera M, Vittorino R, Rosenberg TJ, Hannaman D, Vasan S. 2011. Immunogenicity, safety, biodistribution and persistance of ADVAX, a prophylactic DNA vaccine for HIV-1, delivered by in vivo electroporation. Vaccine 29 : 795-803. doi: 10.1016/j.vaccine.2010.11.011.
Foss GS, Rogne S. 2003. Gene medication or genetic modification? The devil is in the details. Nature Biotechnology. 21(11):1280-1281.
Gillund F, Dalmo R, Tonheim TC, Seternes T, Myhr AI. 2008. DNA vaccination in aquaculture- Expert judgements of impacts on environment and fish health. Aquaculture. 284 : 25-34. doi: 10.1016/j.aquaculture.2008.07.044.
Hoffman SB. 2001. Mechanisms of antibiotic resistance. Compendium. 23:464-473. Huang LY, Wang KY, Xiao D, Chen DF, Geng Y, Wang J, He Y, Wang EL, Huang
11 niloticus delivered by live attenuated Salmonella typhimurium. Fish & Shellfish Immunology. 38 : 34-41. doi: 10.106/j.fsi.2014.017.
Juliadiningtyas AD. 2013. Uji potensi transmisi vaksin GP25 pada bakteri flora normal media budidaya ikan mas Cyprinus carpio secara in vitro [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Loftus B, Anderson L, Davies R, Alsmark UCM, Samuelson J, Amedeo P, Roncaglia P, Berriman M, Hirt RP, Mann BJ et al. 2005. The genome of the protist parasite Entamoeba histolytica. Nature. 433:865-868.
Luke JM, Carnes AE, Williams JA. 2014. Development of antibiotic-free selection system for safer DNA vaccination. DNA Vaccines: Methods and Protocols. 1143 :91-112. doi: 10.1007/978-1-4939-0410-5_6.
Myhr AI, Dalmo RA. 2005. Review: Introduction of genetic engineering in aquaculture: Ecological and etichal implications for science and governance. Aquaculture. 250:542-554. doi: 10.1016/j.aquaculture.2004.12.032.
Nikaido H. 1996. Multidrug efflux pumps of Gram-negative bacteria. Journal of Bacteriology. 178(20): 5853-5859.
Nuryati S, Alimuddin, Sukenda, Soejoedono RD, Santika A, Pasaribu FH, Sumantadinata K. 2010. Contruction of a DNA vaccine using glycoprotein gene and its expression towards increasing survival rate of KHV-infected common carp (Cyprinus carpio). Jurnal Natur Indonesia. 13 (1) : 47-52. Nuryati S, Hadiwibowo SS, Alimuddin. 2013. Potensi Artemia sp. sebagai vektor
pembawa plasmid vaksin DNA untuk benih ikan mas Cyprinus carpio. Jurnal Akuakultur Indonesia. 12 (1) : 59-67.
Nuryati S, Khodijah S, Alimuddin, Setiawati M. 2015. Efektivitas penggunaan vaksin DNA dalam pakan pada ikan mas yang diinfeksi koi herpesvirus. Jurnal Kedokteran Hewan. 9 (1) : 33-37.
Nuswantoro S, Alimuddin, Yuhana M, Santika A, Nuryati S, Zainun Z, Mawardi M. 2012. Efikasi vaksin DNA penyandi glikoprotein koi herpesvirus GP-25 pada ikan mas stadia benih melalui perendaman. Jurnal Akuakultur Indonesia. 11 (1) : 76-85.
Salonius K, Simard N, Harland R, Ulmer JB. 2007. The road to licensure of a DNA vaccine. Current Opinion in Investigational Drugs. 8 (8) : 635-641.
Sköld O. 2011. Antibiotics and Antibiotic Resistance. New Jersey (US) : John Wiley & Sons, Inc.
Soraya S. 2013. Efektivitas vaksin DNA anti-KHV pada benih ikan mas Cyprinus carpio melalui metode perendaman dan perlakuan hiperosmotik [skripsi]. Bogor (ID) : Institut Pertanian Bogor.
Sykes RB, Matthew M. 1976. The β-lactamase of Gram-negative bacteria and their role in resistance to β-lactam antibiotics. Journal of Antimicrobial Chemotherapy. 2: 115-157.
Thomas CM, Nielsen KM. 2005. Mechanisms of, and barriers to, horizontal gene transfer between bacteria. Nature Reviews Microbiology. 3:711-721. doi: 10.1038/nrmicrol1234.
12
Zubaidah S. 2013. Vaksinasi ikan koi menggunakan vaksin DNA anti-KHV dengan dosis berbeda [skripsi]. Bogor(ID) : Institut Pertanian Bogor.
13 LAMPIRAN
Lampiran 1 Komposisi larutan 1 pada proses pemurnian plasmid
Bahan Konsentrasi
Glucose 50 mM
Tris. Cl (pH 8.0) 25 mM
EDTA (pH 8.0) 10 mM
Lampiran 2 Komposisi larutan 2 pada proses pemurnian plasmid
Bahan Volume bahan untuk 1 ml
NaOH 5M 40 µL
SDS 10% 100 µL
Ion Exchange Water 860 µL
Lampiran 3 Komposisi larutan 3 pada proses pemurnian plasmid
Bahan Volume bahan untuk 100 ml
Asam asetat glacial 11,5 mL
SDW 28,5 mL
Potasium asetat 5M 60 mL
Lampiran 4 Komposisi larutan cracking buffer
Bahan Volume bahan
Sacharose(BDC, USA) 0,2 g
NaOH 5 M 40 µL
SDS 10% 50µL
Lampiran 5 Komposisi larutan loading cracking buffer
Bahan Volume bahan
KCL 4 M 50 µL
Loading dye(KAPA Biosystem, USA) 50 µL Lampiran 6 Komposisi larutan premix PCR
Bahan Volume bahan untuk 1 sampel
Ion Exchange Water 3,95µL MgCl2 25 mM (Takara, Japan) 1 µL
dNTP mix 1 µL
Taq Extra Hot Start (KAPA, USA) 0,05 µL
Primer Forward 1 µL
Primer Reverse 1 µL
14
Lampiran 7 Tabel Cowan dan Steel (dimodifikasi dari Cowan dan Steel 2003)
Lampiran 8 Karakterisasi Gram dan uji biokimia bakteri hasil isolasi ikan uji Hari
interaksi ke-
Kode
sampel Gram O/F Oksidase Katalase Motilitas Bentuk Parameter
16
RIWAYAT HIDUP
Penulis dilahirkan di Pariaman, 25 September 1992, merupakan anak pertama dari tiga bersaudara pasangan Bapak Ramli dan Ibu Ali Yusni keluarga petani di Pariaman. Penulis menyelesaikan pendidikan SMA Program IPA dari SMA Negeri 1 Nan Sabaris pada tahun 2010 dan melanjutkan studi Sarjana di Program Studi Teknologi dan Manajemen Perikanan Budidaya pada tahun yang sama melalui jalur Undangan Seleksi Masuk IPB (USMI).
Selama studi di IPB, penulis tercatat sebagai penerima beasiswa Bidik Misi dari Kementerian Pendidikan dan Kebudayaan Republik Indonesia hingga semester delapan. Penulis juga pernah menjadi asisten praktikum matakuliah Pendidikan Agama Islam, Dasar-dasar Mikrobiologi Akuatik, dan Manajemen Kesehatan Organisme Akuatik. Kegiatan kemahasiswaan yang diikuti penulis antara lain Dewan Perwakilan Mahasiswa Fakultas Perikanan sebagai ketua komisi 2, Majelis Permusyawaratan Mahasiswa IPB sebagai Ketua Badan Konstitusi pada tahun 2011/2012, dan sebagai ketua Badan Pengawas Himpunan Mahasiswa Akuakultur IPB 2013/2014.