(Oreochromis niloticus)
DESY SUGIANI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa disertasi Vaksin Bivalen untuk Pencegahan Penyakit Motile Aeromonas Septicemia dan Streptococcosis pada Ikan Nila (Oreochromis niloticus) adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, September 2012
Desy Sugiani
Streptococcocis in Nile Tilapia (Oreochromis niloticus). Under direction of SUKENDA, ENANG HARRIS, and ANGELA M. LUSIASTUTI.
Etiological agents of common fish diseases are the Gram-negative
Aeromonas hydrophila and the Gram-positive Streptococcus agalactiae, both are considered severe fish pathogens on account of their ability to cause damaging disease outbreaks in Nile Tilapia (Oreochromis niloticus). The occurence of co-infections between A. hydrophila and S. agalactiae at Waduk Cirata was about 20% per populations. Clinical signs appeared soon after infection, and include depression or excitability, anorexia, C-shaped body posturing, erratic swimming and whirling, and death. Aeromonas hydrophila and S. agalactiae cultures were not able to inhibit each other and showed negative results from antimicrobial activity, both are succeptible to antibitoics Tetracycline and Chloramphenicol. Nile Tilapia also were clinically examined and necropsied for histopathology, samples were taken from kidney, brain, liver, and spleen. Histopathological lesions were grouped into two characteristic patterns. The first pattern consisted focal lesion and inflammation. The second pattern consisted of multifocal lesion, necrotic, and inflammatory lesions resulting organ deformation. The mortality patterns of Nile Tilapias showed acute and chronic infections to Motile Aeromonas Septicemia, sub-acute infection to Streptococcocis. There was a homeostatic balances on hematological respons during co-infection. Aeromonas hydrophila AHL0905-2 and Streptococcus agalactiae N14G, were used as an inactivated A. hydrophila and S. agalactiae vaccine. Different vaccine preparations and formulations for vaccination of Nile Tilapia species were tried by adding neutral buffered formalin 3% to the bacterial culture (bacterin). The safety of formalin inactivated vaccine is still questionable by some aquaculture practitioners, but the sterility and safety test results of the bivalent vaccine was safe to use through intraperitoneal injection route. An antibody response was detected at the 1st week that rose significantly (p<0.05) at the 3th week post immunization in all the immunized groups. Similarly, there were significant difference (p<0.05) in the humoral immune response between groups immunized with single and mixed bacterial antigens. Upon challenge with single pathogen, a high relative percent survival was recorded in the group immunized with mixed bacterial antigens and was comparable to those fish immunized with the single bacteria. The value of relative per cent survival from bivalent vaccine mixed whole cell+ECP was 100% and 86.2% to single infections and 56.7% to co-infections, indicate that this vaccine was eficient in Nile Tilapia.
Septicemia dan Streptococcosis pada Ikan Nila (Oreochromis niloticus). Dibimbing oleh SUKENDA, ENANG HARRIS, dan ANGELA M. LUSIASTUTI.
Kasus kematian ikan akibat infeksi bakteri Aeromonas sp. dan
Streptococcus sp. menjadi penghambat keberhasilan produksi budidaya ikan Nila (Oreochromis niloticus) di Indonesia. Timbulnya penyakit akibat infeksi Motile Aeromonas Septicemia (MAS) dan Streptococcosis tersebut dapat terjadi karena rendahnya ketahanan tubuh ikan, lingkungan pemeliharaan yang buruk, serta manajemen pemberian pakan yang tidak baik. Kedua jenis penyakit ini menyebabkan masalah pada budidaya ikan dan mengakibatkan kerugian ekonomi karena terjadi kematian ikan yang tinggi dan menurunnya kualitas produk perikanan. Penelitian ini bertujuan untuk menganalisis karakteristik masing-masing antigen secara in vitro, menganalisis patogenesis secara in vivo, serta mengkaji efektifitas dan efikasi vaksin bivalen gabungan dari bakterin Aeromonas hydrophila dan Streptococcus agalactiae dalam menghasilkan respons imun pada ikan Nila. Lima tahapan penelitian dirancang untuk membantu pengambilan keputusan.
Pertama, melakukan kajian ko-infeksi A. hydrophila dan S. agalactiae: keberadaan, daya tumbuh in-vitro, sensitifitas antibiotik, dan gambaran histopatologi. Hasil pengujian menunjukkan bahwa bakteri A. hydrophila dan
Streptococcus sp. menyebabkan wabah penyakit MAS dan Streptococcosis yang menjadi penghambat keberhasilan produksi budidaya ikan Nila di Indonesia. Keberadaan kejadian ko-infeksi antara bakteri A. hydrophila dengan S. agalactiae
pada ikan Nila di KJA Waduk Cirata sebesar 20%. Uji kerentanan ikan Nila terhadap kedua jenis penyakit ini dilakukan secara in-vitro dan in-vivo untuk melihat kompetisi antigen dan ko-infeksi dari kedua jenis bakteri penyebab penyakit. Hasil uji pertumbuhan bakteri untuk melihat kompetisi antigen pada media cair maupun media padat menunjukkan bahwa kedua jenis bakteri ini dapat tumbuh bersinergi (tidak saling menghambat). Bakteri A. hydrophila dan S. agalactiae bersifat rentan terhadap antibiotik Tetrasiklin dan Kloramfenikol. Hasil histopatologi organ ginjal, otak, hati, dan limpa memperlihatkan dua pola karakter luka. Pola pertama, luka yang fokal sampai terlihat adanya inflamasi dan perdarahan. Pola kedua, luka yang multifokal, luka parah, nekrotik, dan luka inflamasi yang mengakibatkan deformasi sel-sel organ.
tinggi dibandingkan dengan kontrol, level hematokrit dan level neutrofil lebih rendah dibandingkan dengan kontrol, dan level monosit dan indeks fagositik fluktuatif selama masa perlakuan memperlihatkan adanya homeostasi gambaran darah ikan terhadap serangan infeksi antigen.
Ketiga, membuat sediaan vaksin inaktif dari isolat bakteri A. hydrophila
AHL0905-2 dan S. agalactiae N14G dengan menambahkan 3% bufer formalin kedalam biakan broth bakterin dan diinkubasi selama 24 jam. Kualitas produk vaksin dikontrol dengan melakukan uji keamanan, sterilitas, dan karakter protein penyusun dari sediaan vaksin. Hasil karakterisasi protein menggunakan SDS-PAGE menunjukkan bahwa bakteri A. hydrophila sel utuh memiliki empat belas pita, dua pita dari produk ektraselular, tiga pita pada sediaan crude supernatan, dan tujuh pita dari sediaan broth. Sediaan sel utuh S. agalactiae memiliki sepuluh pita, dua pita produk ekstraselular, tiga pita sediaan crude supernatan, dan empat pita sediaan broth. Residu formalin pada sediaan vaksin sel utuh sebesar 0,147 ppm, produk ekstraselular (ECP) 1,01 ppm, dan campuran sel utuh+ECP 0,702 ppm. Inaktifasi sediaan vaksin menggunakan formalin masih dipertanyakan keamanannya oleh beberapa praktisi akuakultur, akan tetapi hasil uji sterilitas dan keamanan vaksin bivalen dari penelitian ini aman untuk digunakan melalui injeksi intra peritoneal pada ikan Nila.
Keempat, menganalisis respons imun terhadap campuran sel utuh dan ekstraselular antigen A. hydrophila dan S. agalactiae sebagai ukuran keberhasilan vaksinasi ikan Nila dengan vaksin monovalen dan bivalen. Analisis imunologi dan respons imun dalam aktifitas bakterisidal serum dapat dijadikan komponen untuk melihat viabilitas patogen dalam inang yang ditunjukkan melalui aktifitas
respiratory burst, lisosim, komplemen, dan antibodi. Ikan Nila divaksin dengan vaksin monovalen A. hydrophila, monovalen S. agalactiae, bivalen sel utuh, bivalen ECP, bivalen sel utuh+ECP, bivalen crude supernatan, bivalen broth, dan kontrol. Parameter respons imun diukur setiap minggu selama 3 minggu pemeliharaan setelah vaksinasi. Titer antibodi terdeteksi setelah satu minggu pemeliharaan pascavaksinasi, nilai titer antar perlakuan vaksin bivalen dengan vaksin monovalen dan kontrol berbeda nyata (P<0,05). Vaksin monovalen dapat meningkatkan respons imun spesifik dan non spesifik lebih baik jika dibandingkan dengan vaksin bivalen untuk proteksi bakteri homolog. Sedangkan untuk proteksi terhadap bakteri heterolog vaksin bivalen sel utuh dan sel utuh+ECP memberikan respons imun spesifik maupun non spesifik terbaik jika dibandingkan dengan vaksin monovalen A. hydrophila maupun vaksin monovalen
S. agalactiae.
hasil deteksi respons hematologi. Nilai RPS vaksin bivalen campuran sel utuh+ECP mencapai 100 untuk uji tantang dengan A. hydrophila dan 56,7 pada uji tantang ko-infeksi. Vaksin monovalen A. hydrophila maupun S. agalactiae
hanya mampu memproteksi terhadap bakteri homolog, tidak terjadi proteksi silang diantara keduanya.
©
Hak Cipta milik IPB, tahun 2012 Hak Cipta dilindungi Undang-UndangDilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
(
Oreochromis niloticus
)
DESY SUGIANI
Disertasi
Sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Ilmu Akuakultur
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Penguji pada Ujian Tertutup : Prof. Dr. drh. I Wayan Teguh Wibawan Dr. Sri Nuryati, S.Pi, M.Si.
Penguji pada Ujian Terbuka : Dr. Ir. I Nyoman Adiasmara Giri, M.Sc. Dr. Munti Yuhana, S.Pi, M.Si.
Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Maret 2011 - Februari 2012 ini adalah Vaksin Bivalen untuk Pencegahan Penyakit Motile Aeromonas Septicemia dan Streptococcosis pada Ikan Nila (Oreochromis niloticus).
Desertasi ini memuat 5 bab yang merupakan pengembangan dari naskah artikel yang diajukan ke jurnal ilmiah. Bab 1-2 berjudul Pengaruh ko-infeksi bakteri Aeromonas hydrophila dengan Streptococcus agalactiae terhadap gambaran hematologi dan histopatologi ikan Nila (Oreochromis niloticus) akan diterbitkan (Jurnal Riset Akuakultur – JRA Vol. 7 No. 1 Tahun 2012) dan Bab 3-5 Vaksinasi ikan Nila (Oreochromis niloticus) menggunakan vaksin monovalen dan bivalen untuk pencegahan penyakit MAS dan Streptococcosis akan diterbitkan (Jurnal Riset Akuakultur – JRA).
Terimakasih penulis ucapkan kepada Dr. Ir. Sukenda, M.Sc; Prof. Dr. Ir. Enang Harris, MS; Dr. drh. Angela Mariana Lusiastuti, M.Si selaku pembimbing yang memberi saran dan masukan. Terimakasih penulis ucapkan kepada Kementrian Kelautan dan Perikanan yang telah memberikan beasiswa periode Agustus 2009 – Juli 2012. Disamping itu, penghargaan penulis sampaikan kepada Ir. Oman Komarudin, MSc; Ir. Taukhid, MSc; drh. Uni Purwaningsih; Tuti Sumiati, SPi; Reza Samsudin, SPi, MSi; Bambang Priadi; Edy Farid Wadjdy; Mikdarullah; Ahmad Wahyudi; serta seluruh staf peneliti dan karyawan-karyawati lingkup Balai Penelitian dan Pengembangan Budidaya Air Tawar yang telah membantu selama pengumpulan data dan memberi masukan dalam penulisan ilmiah. Terimakasih untuk teman AKU 2009 semoga kerjasama kita tetap terjalin, selamat kembali bertugas ke institusi masing-masing. Ungkapan terimakasih juga disampaikan kepada Bapak H. Inan; Ibu Hj. Supriati Warno; Sutikno SE; Putri Aqila Fathiyah; Queena Azka Mazaya; serta seluruh keluarga atas doa dan motivasi yang selalu memberikan semangat.
Semoga karya ilmiah ini bermanfaat.
Bogor, September 2012
tunggal dari pasangan H. Inan dan Hj. Supriati Warno. Pendidikan sarjana ditempuh di Program Studi Budidaya Perairan, Jurusan Perikanan, Fakultas Perikanan dan Ilmu Kelautan Universitas Diponegoro pada tahun 1997 dan lulus pada tahun 2001. Pendidikan Magister ditempuh di Program Studi Ilmu Perairan, Sekolah Pascasarjana Institut Pertanian Bogor pada tahun 2002 dan lulus pada tahun 2004. Kesempatan untuk melanjutkan ke Program Doktor pada Program Studi Ilmu Akuakultur IPB diperoleh dari program beasiswa KKP pada tahun 2009.
Penulis bekerja sebagai Peneliti Pertama di Badan Penelitian dan Pengembangan Kelautan dan Perikanan, Kementrian Kelautan dan Perikanan sejak tahun 2005, ditempatkan di Balai Penelitian dan Pengembangan Budidaya Air Tawar, Bogor. Bidang penelitian yang menjadi tanggung jawab peneliti adalah kesehatan ikan.
Karya ilmiah berjudul Kerentanan Ikan Nila (Oreochromis niloticus) terhadap serangan ko-infeksi Streptococcosis dan MAS telah disajikan dan masuk makalah Prosiding Seminar Nasional di Universitas Gajahmada Yogyakarta pada bulan Juli 2011. Artikel berjudul Pengaruh ko-infeksi bakteri Aeromonas hydrophila dengan Streptococcus agalactiae terhadap gambaran hematologi dan histopatologi ikan Nila (Oreochromis niloticus) telah disajikan di Seminar Forum Inovasi dan Teknologi Akuakultur FITA Bali pada bulan Juli 2011, dan akan diterbitkan pada Jurnal Riset Akuakultur Vol. 7 No. 1 Tahun 2012. Artikel berjudul Vaksinasi ikan Nila (Oreochromis niloticus) menggunakan vaksin monovalen dan bivalen untuk pencegahan penyakit MAS dan Streptococcosis akan diterbitkan pada Jurnal Riset Akuakultur JRA. Sedangkan artikel dengan judul Respons imun ikan Nila, Oreochromis niloticus, terhadap vaksin bivalen sel utuh dan ekstraselular antigen Aeromonas hydrophila dan Streptococcus agalactiae telah disajikan pada Seminar Forum Inovasi dan Teknologi Akuakultur FITA-Indoaqua Makasar pada bulan Juni 2012.
xiii
DAFTAR TABEL ... xv
DAFTAR GAMBAR ... xvii
DAFTAR LAMPIRAN ... xxi
1. PENDAHULUAN Latar Belakang ... 1
Tujuan Penelitian ... 4
Manfaat Penelitian ... 5
Hipotesis ... 5
Kebaruan (novelty) ... 5
Kerangka Berfikir Penelitian ... 5
2. TINJAUAN PUSTAKA Penyakit Motile Aeromonas Septikemia(MAS) ... 8
Penyakit Streptococcosis ... 9
Bakteri Aeromonas hydrophila ... 10
Bakteri Streptococcus agalactiae ... 11
Imunologi Ikan ... 12
Vaksin pada Ikan ... 15
Vaksin Polivalen ... 17
Pembentukan Respons Imun Pascavaksinasi... 18
3. BAHAN DAN METODE Waktu dan Tempat Penelitian ... 19
Ikan Uji ... 19
Isolat Bakteri ... 19
Vaksin ... 19
Parameter yang Diukur ... 20
Analisis Data ... 21
Alur Pelaksanaan Penelitian ... 22
4. KO-INFEKSI Aeromonas hydrophila DAN Streptococcus agalactiae: KEBERADAAN, DAYA TUMBUH in-vitro, SENSITIFITAS ANTIBIOTIK, DAN GAMBARAN HISTOPATOLOGI Abstrak ... 23
Abstract ... 23
Pendahuluan ... 24
Bahan dan Metode ... 24
Hasil dan Pembahasan ... 27
xiv
Abstract ... 39
Pendahuluan ... 40
Bahan dan Metode ... 41
Hasil dan Pembahasan ... 42
Simpulan dan Saran ... 50
6. VAKSIN BIVALEN Aeromonas hydrophila dan Streptococcus agalactiae: KEAMANAN, STERILITAS DAN KARAKTER PROTEIN Abstrak ... 51
Abstract ... 51
Pendahuluan ... 52
Bahan dan Metode ... 53
Hasil dan Pembahasan ... 58
Simpulan dan Saran ... 65
7. HEMATOLOGI DAN RESPONS IMUN IKAN NILA (Oreochromis niloticus) YANG DIIMUNISASI DENGAN VAKSIN MONOVALEN DAN BIVALEN : Aeromonas hydrophila dan Streptococcus agalactiae Abstrak ... 66
Abstract ... 66
Pendahuluan ... 67
Bahan dan Metode ... 67
Hasil dan Pembahasan ... 71
Simpulan dan Saran ... 82
8. EFIKASI VAKSIN BIVALEN TERHADAP PENYAKIT MOTILE AEROMONAS SEPTICEMIA DAN STREPTOCOCCOSIS PADA IKAN NILA (Oreochromis niloticus) Abstrak ... 83
Abstract ... 83
Pendahuluan ... 84
Bahan dan Metode ... 85
Hasil dan Pembahasan ... 87
Simpulan dan Saran ... 99
9. PEMBAHASAN UMUM ……… 100
10. SIMPULAN DAN SARAN ………. 107
DAFTAR PUSTAKA ………... 109
xv
1. Komponen vaksin bivalen ... 20
2. Sensitifitas terhadap beberapa jenis antibiotik ... 35
3. Perlakuan infeksi LD100 ... 41
4. Perlakuan infeksi LD50 ... 42
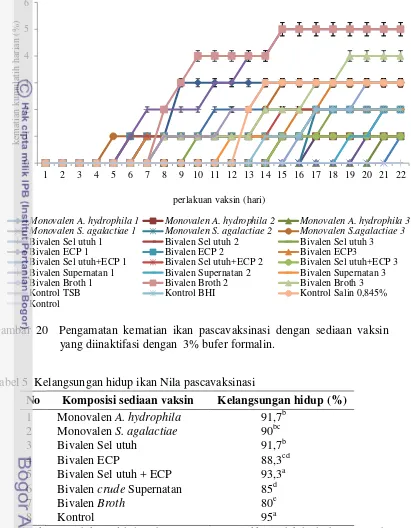
5. Kelangsungan hidup ikan Nila pascavaksinasi ... 60
6. Hasil uji kadar formalin sediaan vaksin yang diinaktifasi dengan bufer formalin 3% ... 61
7. Berat protein sediaan vaksin yang diinaktifasi dengan bufer formalin 3% ... 62
8. Karakter berat molekul protein hasil SDS-PAGE bakteri A. hydrophila dan S. agalactiae yang diinaktifasi dengan bufer formalin 3% ... 64
9. Perlakuan proteksi vaksin monovalen A. hydrophila dan S. agalactiae ... 85
10. Perlakuan vaksin bivalen ... 86
11. Perlakuan kontrol ... 86
12. Parameter hematologi dan respon imun efikasi vaksin monovalen dan bivalen setelah uji tantang dengan A. hydrophila ... 90
13. Parameter hematologi dan respons imun efikasi vaksin monovalen dan bivalen setelah uji tantang dengan S.agalactiae. 91 14. Parameter hematologi dan respon imun efikasi vaksin monovalen dan bivalen setelah uji tantang dengan ko-infeksi A. hydrophila dan S. agalactiae... 91
15. Tingkat RPS ikan yang di vaksin monovalen dan bivalen A. hydrophila dan S. agalactiae... 93
xvii
1. Kerangka berfikir penelitian vaksin bivalen gabungan bakterin
A. hydrophilaS. dan agalactiae untuk pencegahan wabah penyakit Motile Aeromonas Septicemia (MAS) dan
Streptococcosis pada ikan Nila (Oreochromis niloticus) ... 7 2. Alur pelaksanaan penelitian Vaksin Bivalen untuk pencegahan
penyakit Motile Aeromonas Septicemia dan Streptococcosis
pada ikan Nila (Oreochromis niloticus) ... 22 3. Ikan Nila (O. niloticus) yang terinfeksi. (a) MAS, (b)
Streptococcosis, (c) ko-infeksi MAS dan Streptococcosis. (u)
ulcer, (h) haemorhage, (exo) eksoptalmi, (op) opaque...... 28 4. Deformasi C-shaped ikan Nila yang terinfeksi Streptococcosis... 28 5. Gerakan renang berputar (whirling) ikan Nila yang terinfeksi
Streptococcosis... 29 6. Organ dalam ikan Nila yang terserang ko-infeksi MAS dan
Streptococcosis. (a) ikan sehat, (b) ikan terserang kronis, (c)
ikan terserang akut.………... 30 7. Pertumbuhan bakteri A. hydrophila dan S. agalactiae pada
media agar. (a) dan media cair, (b) dengan kepadatan tanam
awal 1 koloni ... 32 8. Uji kompetisi daya tumbuh bakteri A. hydrophila dan S.
agalactiae pada media agar BHIA dengan masa inkubasi 48 jam 32 9. Uji kompetisi daya tumbuh bakteri A. hydrophila dan S.
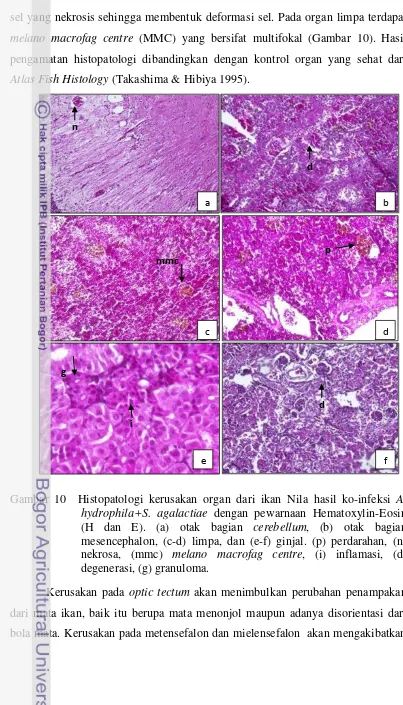
agalactiae pada media cair dengan masa inkubasi 24 jam ... 33 10. Histopatologi kerusakan organ dari ikan Nila hasil ko-infeksi
A.hydrophila + S. agalactiae dengan pewarnaan Hematoxylin-Eosin (H dan E). (a) otakbagian cerebellum, (b) otak bagian mesencephalon, (c-d) limpa, dan (e-f) ginjal. (p) perdarahan, (n) nekrosa, (mmc) melano macrofag centre, (i) inflamasi, (d)
degenerasi, (g) granuloma... 36 11. Total hematokrit ikan Nila hasil ko-infeksi A. hydrophila dan S.
agalactiae ... 43 12. Total monosit ikan Nila hasil ko-infeksi A. hydrophila dan S.
agalactiae ... 44 13. Total neutrofil ikan Nila hasil ko-infeksi A. hydrophila dan S.
xviii
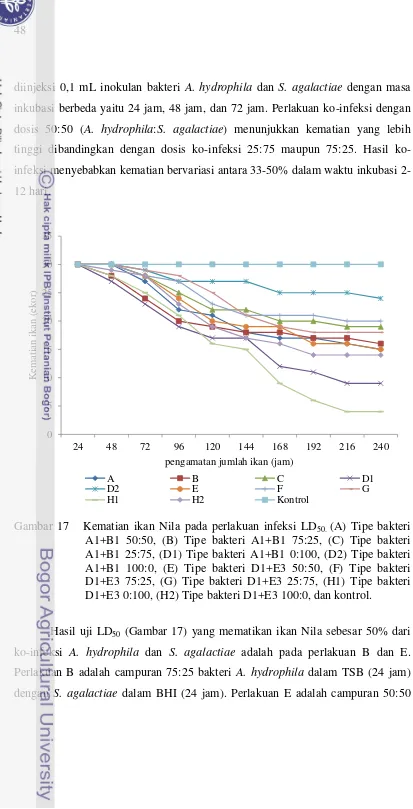
agalactiae ... 46 16. Kematian ikan pada perlakuan infeksi LD100 ... 47 17. Kematian ikan pada perlakuan infeksi LD50 ... 48 18. Sediaan vaksin hasil inaktifasi dengan 3% bufer formalin. (a)
sediaan hasil sentrifuse : pelet di bagian bawah dan supernatant, (b) sediaan pelet yang dilarutkan dalam salin (sediaan vaksin sel utuh), ( ) pelet bakteri. ... 58 19. Sediaan vaksin monovalen dan bivalen sel utuh “siap pakai”
yang diinaktifasi dengan 3% bufer formalin ... 59 20. Pengamatan kematian ikan pascavaksinasi dengan sediaan
vaksin yang diinaktifasi dengan 3% bufer formalin ... 60 21. SDS-PAGE sediaan vaksin bakteri Aeromonas hydrophila
AHL0905-2 ... 63 22. SDS-PAGE sediaan vaksin bakteri Streptococcus agalactiae
N14G ... 63 23. Kadar hemoglobin ikan Nila pascavaksinasi dengan vaksin
monovalen dan bivalen ... 71 24. Persen hematokrit darah ikan Nila pascavaksinasi dengan vaksin
monovalen dan bivalen ... 72 25. Persentase fagosit darah ikan Nila pascavaksinasi dengan vaksin
monovalen dan bivalen ... 73 26. Indek fagositik darah ikan Nila pascavaksinasi dengan vaksin
monovalen dan bivalen ... 74 27. NBT-assay dari ikan Nila hasil vaksinasi menggunakan vaksin
monovalen dan bivalen ... 75 28. Aktifitas lisosim serum ikan Nila pascavaksinasi ... 77 29. Aktifitas komplemen serum ikan Nila pascavaksinasi dengan
vaksin monovalen dan bivalen yang diinaktifasi menggunakan
3% bufer formalin ... 79 30. Titer antibodi serum ikan Nila (O. niliticus) pascavaksinasi yang
di tantang dengan bakterin A. hydrophila ... 81 31. Titer antibodi serum ikan Nila (O. niliticus) pascavaksinasi yang
xix
monovalen secara intraperitoneal dan diuji tantang selama 15
hari ... 88
34. Kematian harian ikan Nila (O. niloticus) setelah diuji tantang dengan bakteri A. hydrophila yang dipelihara selama 16 hari. (a)
perlakuan vaksin bivalen, (b) kontrol……… 89 35 Kematian harian ikan Nila (O. niloticus) setelah diuji tantang
dengan bakteri S.agalactiae yang dipelihara selama 16 hari. (a)
perlakuan vaksin bivalen, (b) kontrol……… 90 36 Kematian harian ikan Nila (O. niloticus) setelah diuji tantang
dengan ko-infeksi bakteri A. hydrophila+S.agalactiae yang dipelihara selama 16 hari. (a) perlakuan vaksin bivalen, (b)
xxi
PENDAHULUAN
Latar Belakang
Ikan Nila (Oreochromis niloticus) merupakan komoditas unggulan budidaya air tawar di Indonesia. Kementrian Kelautan dan Perikanan (KKP) menargetkan produksi ikan Nila tahun 2012 sebanyak 639.300 ton. Jumlah ini naik sekitar 36,26% dari total produksi tahun 2011 yang sebanyak 469.173 ton. Guna mencapai target tersebut telah dibuat beberapa strategi diantaranya pengadaan bibit unggul (jenis Wanayasa, Larasati, dan BEST) dan upaya pencegahan penyakit dengan penggunaan imunostimulan dan pemberian vaksinasi.
Kasus kematian ikan akibat infeksi bakteri Aeromonas hydrophila dan
Streptococcus sp. menjadi penghambat keberhasilan produksi budidaya ikan Nila di Indonesia. Timbulnya penyakit akibat infeksi Motile Aeromonas Septicemia (MAS) dan Streptococcosis tersebut dapat terjadi karena rendahnya ketahanan tubuh ikan, lingkungan pemeliharaan yang buruk, serta manajemen pemberian pakan yang tidak baik (Ibrahem et al. 2008; Harikrishnan et al. 2010). Kedua jenis penyakit ini menyebabkan masalah pada budidaya ikan dan mengakibatkan kerugian ekonomi karena terjadi kematian ikan yang tinggi dan menurunnya kualitas produk perikanan.
Aeromonas hydrophila merupakan bakteri yang paling umum terdapat di habitat perairan tawar. Genus Aeromonas meliputi mikroba prominen di dalam reservoir air tawar bersama-sama dengan jasad renik yang lain bertindak sebagai biofilter alami dan berfungsi untuk memurnikan perairan dan diperlukan sebagai mikroflora normal. Penyakit biasanya timbul dalam tipe infeksi akut dengan kondisi klinis munculnya peradangan yang sistemik dan mengakibatkan kematian dalam waktu 24 sampai 48 jam. Tipe infeksi kronis ditandai dengan kerusakan pada bagian sirip, lesi pada kulit, gerakan renang lemah, dan menyebabkan kematian 10% sampai 70% dari total populasi di kolam budidaya (Ibrahem et al.
dengan nama penyakit Hemorrhagic Septicaemia atau Aeromonas Septicemia (Ismail et al. 2010).
Bakteri patogen Streptococcus agalactiae dan Streptococcus iniae
menyebabkan penyakit Streptoccoccosis pada ikan Nila (Klesius et al. 2006, 2007; Hernandez et al. 2009; Toranzo 2009; Zilberg et al. 2010). Studi patologi anatomi secara makroskopis dan mikroskopis akibat infeksi Streptococcosis diteliti pada ikan Nila di daerah Jawa Barat dan Jawa Tengah dengan gejala klinis yang tampak adalah eksoptalmus, dermal hemoragi dan warna kehitaman pada tubuh. Pada tes bakteriologi menggunakan pewarnaan Gram, agar darah dan API 20 STREP sistem, bakteri penyebab diidentifikasi sebagai Streptococcus sp. (Lusiastuti et al. 2008). Lebih lanjut Lusiastuti et al. (2009) melakukan survei di daerah Waduk Cirata – Jawa Barat dan dari analisis sekuen DNA terhadap jenis bakteri yang menginfeksi ikan Nila tersebut diketahui merupakan spesies bakteri
S. agalactiae dan S. iniae. Dinas Kelautan dan Perikanan Provinsi DIY (2010) melaporkan adanya infeksi bakteri A. hydrophila dan Streptococcus sp. pada ikan Nila dari hasil pemantauan penyakit ikan yang dilakukan di wilayah DIY.
Penanggulangan penyakit MAS dan Streptoccoccosis akibat infeksi A. hydrophila dan S. agalactiae dengan metode vaksinasi monovalen telah banyak dilakukan. Ismail et al. (2010) meneliti vaksin A. hydrophila yang dibuat dalam bentuk sediaan sel utuh yang diinaktifasi menggunakan formalin untuk menghasilkan bakterin A. hydrophila. Vaksin tersebut diaplikasikan melalui oral pada ikan Nila (O. niloticus)dan menghasilkan relative level of protection (RLP) sebesar 86,8%. Respons antibodi humoral pada ikan Nila yang divaksinasi dilihat melalui uji mikro-aglutinasi. Hasil level titer antibodi terendah dengan log 2 pada nilai 2 dan 3 pada minggu pertama dan empat minggu setelah divaksinasi, sementara ikan Nila yang diberi pakan tanpa divaksin, level titer antibodi yang diperoleh adalah log 2 pada nilai 1.
perendaman, menghasilkan relative percent survival (RPS) sebesar 98,75% dengan level titer antibodi log 2 pada nilai 4 setelah divaksinasi selama 21 hari.
Lusiastuti et al. (2010) melakukan penelitian pendahuluan untuk melihat efek vaksin sel utuh S. agalactiae dengan formalin killed untuk ikan Nila, lebih lanjut Hardi et al. (2011) mengemukakan bahwa diperoleh RPS>90% pada ikan Nila yang diberi vaksin kombinasi extracellular product (ECP) dan sel utuh bakteri S. agalactiae isolat N14G. Hal ini sesuai dengan hasil riset penggunaan vaksin S. agalactiae untuk penanggulangan Streptococcosis yang telah dikembangkan dari extracellular product (ECP) dan sel utuh yang dimatikan dengan formalin-killed (Pasnik et al. 2006). Evans et al. (2004) mengemukakan bahwa ikan Nila yang diimunisasi dengan modifikasi vaksin S. agalactiae yang dilemahkan (inactivated) mampu memberikan respons imun spesifik terhadap jenis bakteri S. agalactiae yang sama dan mampu memproteksi terhadap jenis bakteri S. iniae, sedangkan ikan Nila yang divaksin S. iniae tidak mampu memproteksi terhadap infeksi jenis bakteri S. agalactiae atau tidak memiliki kemampuan proteksi silang terhadap jenis bakteri berbeda.
Vaksinasi ikan untuk melindungi ikan dalam melawan berbagai infeksi bakteri patogen secara serempak dapat dilakukan dengan menggunakan vaksin bivalen atau polivalen. Strategi vaksinasi diperlukan keputusan seperti penyakit spesifik apa yang akan dipapar, jenis vaksin, metoda vaksinasi, pemilihan waktu vaksinasi dan perlakuan vaksinasi ulang (booster). Perumusan vaksin yang ideal dapat diambil dalam bentuk vaksin polivalen untuk melindungi secara serempak terhadap penyakit tertentu. Vaksin polivalen harus mampu melindungi dari semua serotipe dari tiap patogen penyebab penyakit tertentu. Akan tetapi, harus diperhatikan kompetisi antigen spesifik yang mungkin terjadi terutama ketika vaksin diaplikasikan melalui suntik (Toranzo et al. 2009).
Beberapa penelitian mengenai vaksin bivalen dan polivalen pada ikan menunjukkan hasil yang bervariasi, dikarenakan setiap strain bakteri memiliki kemampuan antigenik yang berbeda. Osman et al. (2009) melakukan penelitian vaksinasi pada ikan Nila terhadap infeksi Aeromonas dan Pseudomonas
bivalen dengan RPS 74%, dan polivalen gabungan Aeromonas spp. (A. hydrophila, A. sobria dan A. caviae) dan Pseudomonas fluorescens dengan RPS 81%. Silva et al. (2009) melakukan penelitian hematologi dan respons immunologi ikan Nila setelah divaksin menggunakan vaksin polivalen bakterin A. hydrophila, P. aeruginosa dan Enterococcus durans, diketahui bahwa titer antibodi tertinggi diperoleh pada hari ke-21 setelah vaksinasi. Vaksin campuran antara sel utuh antigen A. hydrophila, E. tarda dan P. fluorescens, merupakan patogen dari kelompok bakteri Gram negatif yang diperoleh dari hasil isolasi pada
Indian major carps ternyata dapat merangsang respons antibodi pada Rohu (Labeo rohita Ham.) (Swain et al. 2007).
Pembentukan vaksin bivalen dan polivalen akan dipengaruhi oleh banyak proses imunologi seperti reaksi silang antigen, kompetisi antigen, waktu pematangan dan penghilangan sifat antigenik yang akan mempengaruhi efektifitas, kemampuan menghasilkan respons imun dan level antibodi. Nikoskelainen et al. (2007) melaporkan bahwa terdapat hambatan respons imun spesifik terhadap vaksin polivalen Aeromonas salmonicida, Listonella anguillarum dan serotipe Th+Fd dari antigen Flavobacterium psychrophilum. Penggunaan beberapa antigen bakteri di dalam vaksin polivalen harus hati-hati dalam mencampurkannya untuk menghindari sifat saling hambat dari antigen yang akan mempengaruhi tanggap kebal spesifik pada ikan.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui beberapa respons berikut ini : 1. Menganalisis karakteristik masing-masing antigen, waktu pematangan, uji
kultur bersama antigen secara in vitro.
2. Menganalisis patogenesis masing-masing antigen dan gabungan keduanya secara in vivo pada ikan Nila.
Manfaat Penelitian
Penelitian ini diharapkan dapat menghasilkan produk vaksin bivalen gabungan A. hydrophila dan S. agalactiae untuk pencegahan wabah penyakit MAS dan Streptococcosis pada ikan Nila (O. niloticus).
Hipotesis
Hipotesis yang diajukan dalam penelitian ini adalah sebagai berikut : 1. Bakteri A. hydrophila dan S. agalactiae memiliki perbedaan karakteristik
dalam sifat patogenesis terhadap ikan Nila.
2. Vaksin bivalen gabungan bakterin A. hydrophila dan S. agalactiae dapat memberikan proteksi lebih baik dibandingkan dengan vaksin monovalen A. hydrophila maupun vaksin monovalen S. agalactiae pada ikan Nila yang terinfeksi A. hydrophila dan S. agalactiae (penyakit MAS dan Streptococcosis).
Kebaruan (novelty)
Kebaruan dari penelitian ini yaitu, pertama diketahuinya kompetensi kedua antigen A. hydrophila dan S. agalactiae untuk dijadikan kandidat vaksin bivalen. Kedua, dihasilkan vaksin yang dapat mencegah infeksi A. hydrophila
dan S. agalactiae pada ikan Nila yaitu vaksin bivalen gabungan antara bakterin A. hydrophila dan S. agalactiae.
Kerangka Berfikir Penelitian
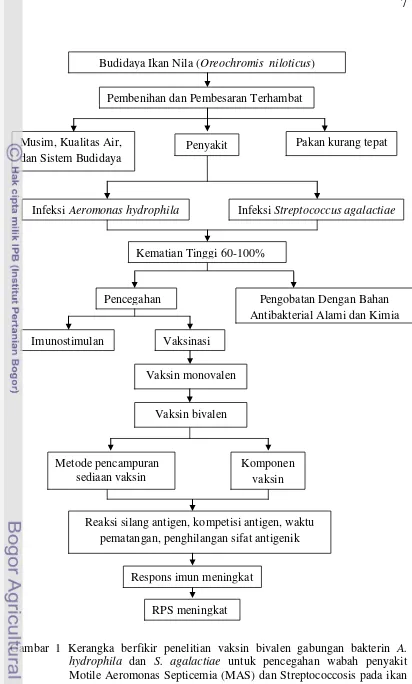
Latar belakang dan kerangka berfikir penelitian vaksin bivalen gabungan bakterin A. hydrophila dan S. agalactiae untuk pencegahan wabah penyakit MAS dan Streptococcosis pada ikan Nila (O. niloticus) dijabarkan pada Gambar 1.
Gambar 1 Kerangka berfikir penelitian vaksin bivalen gabungan bakterin A. hydrophila dan S. agalactiae untuk pencegahan wabah penyakit Motile Aeromonas Septicemia (MAS) dan Streptococcosis pada ikan Nila (O. niloticus).
Pengobatan Dengan Bahan Antibakterial Alami dan Kimia Budidaya Ikan Nila (Oreochromis niloticus)
Infeksi Streptococcus agalactiae
Kematian Tinggi 60-100%
Pembenihan dan Pembesaran Terhambat
Pencegahan
Vaksinasi
RPS meningkat Infeksi Aeromonas hydrophila
Musim, Kualitas Air, dan Sistem Budidaya
Pakan kurang tepat Penyakit
Imunostimulan
Vaksin monovalen
Vaksin bivalen
Komponen vaksin
Respons imun meningkat Metode pencampuran
sediaan vaksin
[image:35.595.103.515.60.744.2]TINJAUAN PUSTAKA
Penyakit Motile Aeromonas Septicemia (MAS)
Gejala klinis dari ikan Nila yang terinfeksi Motile Aeromonas Septicemia (MAS) ditandai dengan adanya septisemia, luka, cacat tulang, eksoptalmi dan nekrosis otot. Pada kondisi posmortem ditemukan adanya luka fokal pada organ hati, limpa, dan ginjal, serta terdapat cairan yang mengisi rongga abdominal. Hasil isolasi dan identifikasi didapat jenis bakteri A. hydrophila dari bagian organ intestinal ikan yang sakit maupun ikan yang sudah sehat, hal ini dapat terjadi pada kondisi invasi penyakit ataupun kondisi MAS yang akut dengan adanya lokalisasi koloni bakteri A. hydrophila yang teridentifikasi dari jaringan hematopoetik (Ibrahem et al. 2008).
Menurut Toranzo et al. (1986) sebagai tambahan hasil identifikasi dilakukan reaksi voges-proskauer (VP), citrate utilization, lysine decarboxylase
(LDC), arabinosa dan tes fermentasi amygadalin untuk melihat tingkat virulensi dari bakteri. Reaksi biokimia berkorelasi dengan tingkat virulensi. Variasi tingkat virulensi dari spesies penyebab Motile Aeromonas dapat dilihat dengan uji karakteristik biokimia dari bakteri A. hydrophila. Burke et al. (1981) mengemukakan hubungan yang signifikan antara tingkat virulensi A. hydrophila
pada ikan dengan produksi asam dari arabinosa dan sukrosa, tes VP dan LDC, penambahan elastase dan aktifitas hemolitik.
Tingkat virulensi dari mikroorganisme berasosiasi dengan produksi enzim tertentu. Hal ini mengindikasikan bahwa tes yang bersifat enzimatik dapat digunakan untuk mengidentifikasi bakteri A. hydrophila. Uji aktifitas hemolitik isolat A. hydrophila pada media TSA yang diberi 5% Red Blood Cells (RBCs) domba, menunjukkan hasil bahwa 72% bakteri A. hydrophila dengan 2 tipe aktifitas hemolitik, isolat A. hydrophila ß hemolitik dan strain A. hydrophila non hemolitik. Ada suatu korelasi antara hemolisin dan virulensi isolat A. hydrophila.
hemolitik dan tes patogenisitas dari isolat A. hydrophila dengan tingkat virulensinya. Sangat direkomendasikan untuk melakukan serangkaian uji tersebut untuk melihat tingkat bahaya dari isolat A. hydrophila (Ibrahem et al. 2008).
Penyakit Streptococcosis
Infeksi Streptococcal pada ikan merupakan infeksi bakteri yang dapat mempengaruhi patologi dari varietas budidaya ikan di seluruh dunia (Romalde & Toranzo 2002; Toranzo et al. 2005). Ikan Nila (Oreochromis niloticus) sangat rentan terhadap infeksi Streptococcosis dan menimbulkan wabah yang sangat mematikan (Pretto-Giardano et al. 2010). Akan tetapi, ikan channel catfish tidak peka terhadap Group B Streptococcus (GBS) terutama terhadap infeksi S. iniae
dan S. agalactiae (Evans et al. 2007).
Streptococcosis pada ikan merupakan infeksi dari beberapa jenis bakteri
Streptococcus sp. dengan gejala penyakit yang hampir sama pada setiap spesies bakteri dan dapat mengakibatkan kerusakan sistem saraf pusat yang terkarakterisasi dari gejala klinis berupa adanya eksoptalmi (pop-eye) dan meningoensefalitis. Klasifikasi Gram positif bentuk kokus berdasarkan pasangan hibridisasi DNA-DNA menggunakan sekuen 16S terhadap bakteri patogen pada ikan diperoleh jenis bakteri: Lactococcus garvieae (syn. Enterococcus seriolicida), L. piscium, Streptococcus iniae (syn. S. shiloi), S. agalactiae (syn. S. difficile), S. parauberis, dan Vagococcus salmoninarum (Toranzo 2009).
Menurut Toranzo (2009) pada kondisi perairan yang hangat (warm water) Streptococcosis (menyebabkan kematian pada suhu di atas 15 ºC) disebabkan oleh
L. garvieae, S. iniae, S. agalactiae dan S. parauberis, sedangkan pada perairan dingin cold water Streptococcosis (menyebabkan kematian pada suhu di bawah 15 ºC) disebabkan oleh L. piscium dan V. salmoninarum. Agen penyebab penyakit Streptococcosis pada ikan di daerah perairan hangat seperti di Indonesia merupakan bakteri yang potensial bersifat zoonotik pada manusia.
Bagian internal tubuh mengalami perubahan, bagian otak menjadi lembek dan berair, serta hati membengkak dan berwarna pucat. Gejala lain yang teramati pada ikan seabream (Sparus auratus L.) dan ikan mullet (Liza klunzingeri) terinfeksi Streptococcosis berupa tubuh yang melengkung membentuk huruf C, mata berwarna putih (ocular opacity), perdarahan di periorbital dan intraokular, bernanah (purulence) dan eksoptalmi (Musa et al. 2009).
Bakteri Aeromonas hydrophila
Cipriano (2001) mengemukakan bahwa isolat A. hydrophila berbentuk batang pendek dan Gram negatif, oxidase-positif, mampu menfermentasi glukosa dan resisten terhadap cakram Vibrostatic 0129, mampu tumbuh dalam media agar MacConkay, bersifat motil, dan koloni berbentuk bulat halus dengan diameter 2-3 mm, ukuran lebar sel 0,3-1 μm dan panjang sel 2-4,5 μm. Identifikasi juga dapat dilakukan menggunakan sistem tes kit API 20 NE. Media identifikasi selektif Rhimler-Shotts (media R-S) dibuat oleh Shotts dan Rhimler (1973) untuk mempermudah identifikasi jenis bakteri Aeromonads yang akan membentuk koloni berwarna kuning pada media.
Isolat A. hydrophila menunjukkan hasil reaksi positif pada sitokrom oksidase, hidrolisis gelatin, produksi indol, glukosa, sukrosa, fermentasi manitol, arginin dehidrolase dan tes ß- galaktosidase. Sebagian isolat positif pada media
Voges Proskauer, lisin dekarboksilase, tripsin, fermentasi tes arabinosa, ß-glukosidase, ß-glaktosidase, ß-glukuronidase, ∞-glukosidase, dan valin arilamidase. Identifikasi enzimatik menggunakan sistem tes kit API ZYM menunjukkan bahwa isolat bereaksi positif pada alkalin fosfatase, butirat esterase (C4), caprilat esterase (C8), Miristate lipase (C14), leusin arilamidase dan N-asetil- ß-glukosaminidase, Asam fosfatase dan fosfomidase. Beberapa isolat menunjukkan hasil negatif pada sistein arilamidase, Chimotripsin, α-Mannosidase
Bakteri Streptococcus agalactiae
Streptococcus agalactiae adalah bakteri Gram-positif, tidak membentuk spora, tidak bersifat asam, non motil, oksidase-negatif, katalase-negatif, kokus
dengan diameter sekitar 2 μm. Biasanya berbentuk berpasangan atau membentuk
rantai pendek (Rattanachaikunsopon & Phumkhachorn 2009). Kohler (2007) mengelompokkan bakteri S. agalactiae termasuk ke dalam golongan kelompok antigen Lancefield B dengan tipe haemolitik β (α, -). Bentuk koloni bakteri S. agalactiae berwarna putih abu-abu, bening, koloni berbentuk bulat, dan
menghasilkan β-haemolitik pada media agar darah (Musa et al. 2009).
Streptococcus agalactiae (Group B streptococcus, GBS) merupakan patogen yang dapat menginfeksi pada manusia dan hewan termasuk beberapa spesies ikan. Tahun 2003, bakteri S. agalactiae diisolasi dari red Tilapia Oreochromis sp. dan Nila (O. Niloticus) pada budidaya ikan di Thailand. Identifikasi bakteri GBS menggunakan API 20 STREP, polymerase chain reaction (PCR) dan multiplex PCR-based reverse line blot hybridization
(mPCR/RLB) (Suanyuk et al. 2008). Identifikasi S. agalactiae juga dapat menggunakan BioStar STREP B (STREP B OIA) BioStar1OIA1 Strep B Assay Kit (Evans et al. 2010). Untuk melihat genotipe bakteri S. agalactiae, Olivares-Fuster et al. (2008) menggunakan metode Single-Stranded Conformation Polymorphism (SSCP) dengan analisis Intergenic Spacer Region (ISR), dan menggunakan fingerprint Amplified Fragment Length Polymorphism (AFLP).
Bakteri S. agalactiae memiliki kemampuan aktifitas kemotaktik dan kemokinetik yang memegang peranan penting dalam respons proinflamasi dari makrofag terhadap infeksi yang ditimbulkannya. Aktifitas kemotaktik dan kemokinetik teramati dari ECP S. agalactiae dengan berat molekul 7,54 kDa. Berat molekul ECP diperoleh dari hasil fraksinasi menggunakan High-pressure liquid chromatography terhadap ECP S. agalactiae semi-purifikasi (Klesius et al.
2007).
Imunologi Ikan
Sel spesifik dan jaringan dari sistem imun pada teleost terletak pada organ limfomeiloid primer, sekunder, dan tersier. Organ limfoid primer pada teleost adalah timus dan ginjal bagian depan yang berfungsi untuk hematopoiesis dan pembentukan sel baru. Organ sekunder adalah limpa dan kelenjar getah bening yang berfungsi untuk regenerasi pada respons imun dengan melibatkan interaksi antara beberapa tipe sel dan respons imun spesifik untuk melawan serangan antigen (Lin et al. 2005). Organ limpa pada teleost juga berperan sebagai sistem limpatik (belum terbentuk sempurna) untuk menfilter cairan tubuh. Organ tersier pada teleost adalah berupa struktur mukosa yang membawa sel-sel limfoid (Pellane 2002).
Tanggap kebal alami terjadi seketika apabila ada patogen masuk ke dalam inang, faktor humoral bawaan yang terdapat di serum dan mukus ikan akan melakukan perlawanan pasif dengan menghancurkan patogen. Apabila terjadi suatu serangan patogen atau benda asing pada ikan maka akan terjadi respons imun alami yang melibatkan sirkulasi dan perbaikan jaringan melalui respons fagosit granulosit (neutrofil, eosinofil sel granular) monosit, dan sel makrofag (Danerson 1974).
tersebut sangat penting untuk pertahanan penyakit maupun lingkungan yang tidak menguntungkan (Iwama & Nakanishi 1996).
Ellis (2001) mengemukakan bahwa respons dan faktor humoral terdiri dari serum amiloid protein, antibodi, lisosim, transferin, interferon, antiprotease, lektin, lisin, protease, protein C-reaktif, dan komplemen. Sedangkan respons dan faktor seluler antara lain adalah makrofag, killer cell, neutrofil, reaksi penolakan
allograft dan hipersensitifitas. Ikan mempunyai kemampuan dalam sistem imun non-spesifik berupa barier mekanik dan kimiawi yang terdiri dari permukaan kulit, sisik, dan mukus pada permukaan tubuh dan insang (Iwama & Nakanishi 1996).
Sistem kekebalan tubuh ikan terhadap antigen melalui mekanisme fagosit dengan perantara makrofag dan granular leukosit, sebagai contoh neutrofil menyerang mikroorganisme yang masuk melalui jaringan kulit ikan atau mukus. Selain itu ada lisosim dan komplemen lain yang merusak patogen. Komponen spesifik dalam sistem imun, terdiri dari humoral dan respons sel terhadap memori imunologi, walaupun memori imun pada ikan secara umum sangat kurang berkembang dibandingkan hewan tingkat tinggi lainnya. Tingkat induksi dan respons imun ikan sangat dipengaruhi oleh suhu perairan (Danerson 1999).
Pada respons imun spesifik, makrofag bertindak melawan sel antigen, sedangkan B-limfosit terlibat dalam produksi antibodi. T-limfosit berperan dalam imunitas melalui diferensiasi dan proliferasi dari B-limfosit. Antibodi akan diproduksi terhadap patogen spesifik yang akan mengikat membran patogen dan merusak melalui aktivasi sistem komplemen dengan cara klasik (Li et al. 2006).
ikan dan IgM kemungkinan diproduksi secara lokal bukan berasal dari serum. Ellis (1981) menduga bahwa sistem imun pada ikan dapat terlihat dan terus dihasilkan sebagai bagian dari sistem respons imun yang sistemik dan bagian dari mukus.
Imunitas dapatan (acquired immunity) pada ikan sama dengan respons alaminya. Akan tetapi, respons imun dapatan lebih lama terbentuk setelah terinfeksi penyakit yang akut dan setelah proses vaksinasi, karena pada imun dapatan bersifat spesifik dan memiliki memori sedangkan imun alami bersifat non-spesifik dan tidak memiliki memori. Respons imun alami terhadap infeksi bakteri dapat melalui aktifitas fagositosis dengan komponen internal berupa
cytokine (interferon), lytic enzyme (lisosim), serum protein, komplemen, dan kinin. Respons imun buatan melibatkan B-limfosit dan sel plasma dalam menghasilkan antigen-spesifik antibodi, serta cytokine dari T-limfosit (Stuart 1999). Proliferasi limfosit pada ikan memerlukan waktu relatif lama untuk mencapai puncak setelah ditantang dengan patogen, respons sekunder yang muncul yaitu berupa titer antibodi (Ellis 1981).
Tanggapan kebal adaptif dapat terbentuk pada kelompok teleost seperti ikan dan dapat dideteksi dalam hitungan hari bahkan minggu (4-6 minggu) dari infeksi atau peradangan awal tergantung dari suhu lingkungan. Tanggap kebal adaptif terdiri dari jaringan sel protein komplek, pengantar pesan biokimia (sitokin), dan gen yang bekerja sama untuk menghasilkan suatu induksi tanggap kebal spesifik yang memerlukan Abs (antibodi spesifik) dan Ags (antigen spesifik) (Press & Evenson 1999).
komplek. Jika cukup besar, makromolekular komplek ini akan mempercepat perlekatan antigen oleh sel untuk selanjutnya terjadi proses fagositosis penghancuran antigen (Pilstrom & Bengten 1996).
Vaksin pada Ikan
Preparasi antigen vaksin dibuat dari organisme patogen yang telah dibuat menjadi non-patogen dengan berbagai macam metode. Tujuan melakukan vaksinasi adalah untuk menstimulasi sistem imun dengan cara meningkatkan resistensi ikan terhadap jenis patogen tertentu. Vaksin pada industri budidaya ikan biasanya menggunakan formula dari bakterin (yang diinaktifasi dengan formalin atau pemanasan bakteri sel utuh), sel bakteri hidup yang tidak virulen, toksin bakteri, vektor rekombinan, dan menggunakan asam nukleat dari bakteri (Skinner 2009).
Imunologi dan analisis transkripsi menunjukkan bahwa dengan vaksinasi dapat: (i) menginduksi respons chemiluminescence yang lebih kuat dan lebih tinggi dalam produksi nitrit oksida dan aktifitas asam fosfatase pada makrofag ginjal anterior, (ii) memproduksi serum antibodi spesifik, yang akan memberikan immunoproteksi ketika diberikan imunisasi pasif pada ikan, (iii) regulasi ekspresi gen pengkode protein yang berperan dalam respons imun bawaan dan respons imun dapatan. Ketiga faktor tersebut akan memegang peranan dalam membuktikan bahwa vaksinasi pada ikan dapat mengontrol penyakit Streptococcosis pada lingkungan budidaya (Sun et al. 2010).
alur penyerapan antigen dan presentasi antigen setelah diserap (Gudding et al. 1999).
Enzim ekstraselular, kapsul polisakarida, lipopolisakarida (LPS), membran luar bakteri menjadi faktor penentu virulensi bakteri yang kemudian digunakan sebagai kandidat sediaan vaksin untuk menanggulangi infeksi bakteri yang homolog maupun heterolog. Preparasi mikroorganisme dan produk sisa metabolismenya dapat digunakan sebagai agen yang dapat menstimulasi pembentukan antibodi dan penghancuran antigen melalui efektor makrofag dalam perlakuan uji tantang (Shoemaker & Klesius 1997).
Proteksi melawan A. hydrophila pada ikan Carp melalui vaksinasi dengan
crude lipopolisakarida (LPS) lebih baik dibanding dengan sel utuh yang diinaktifasi menggunakan formalin. Vaksin LPS yang diberikan melalui perendaman pada ikan selama 2 jam pada suhu 25 oC lebih efektif dalam mengurangi stres perlakuan dibanding ketika diberikan melalui injeksi, akan tetapi vaksinasi dengan crude LPS tidak dapat melihat respons imun humoral melalui pengukuran reaksi aglutinasi bakteri, hemaglutinasi pasif dan tes difusi agar gel (Baba et al. 1988).
Kunci keberhasilan vaksinasi pada ikan menurut Toranzo et al. (2009) adalah sebagai berikut :
- Tidak menggunakan vaksin sebagai satu alat pemecahan masalah manajemen budidaya. Kepadatan ikan yang tinggi, ikan dalam keadaan stres, kualitas air yang jelek dapat menyebabkan terhambatnya pembentukan proteksi respons imun.
- Hanya memvaksin ikan yang sehat. Performa vaksin sangat tergantung pada status kesehatan ikan. Vaksin tidak dapat diharapkan memberi proteksi yang tinggi jika ikan yang divaksin dalam keadaan sakit atau karier terhadap patogen sejenis dengan vaksin.
- Ketat dalam memberikan rekomendasi penggunaan vaksin. Jangan memperpendek waktu pemaparan yang disarankan, tidak memodifikasi dosis maupun solusi vaksin, tidak melebihi kepadatan ikan yang diperbolehkan dalam penggunaan melalui perendaman, mencampurkan vaksin ke dalam larutan dengan suhu yang sama dengan media pemeliharaan.
Vaksin Polivalen
Formula vaksin ideal adalah dalam bentuk sediaan vaksin polivalen yang dapat memproteksi secara simultan terhadap beberapa patogen penting penyebab suatu penyakit dan efektif digunakan untuk spesies ikan yang luas. Vaksin polivalen juga harus dapat melindungi dari semua serotipe bakteri yang berasal dari area geografis berbeda. Formula vaksin polivalen harus dibuat dengan teliti karena masalah kompetisi antigen dapat muncul terutama ketika vaksin tersebut diaplikasikan melalui injeksi (Toranzo et al. 2009).
Karena sifat antigenik yang beragam antara kelompok organisme yang komplek, maka diperlukan strategi penggunaan vaksinasi, apakah dengan menggunakan vaksin polivalen, imunisasi menggunakan inaktifasi ekstraselular toksin (toxoid), atau vaksin yang berisi selular antigen dan toxoid. Vaksinasi dengan larutan antigen ekstraselular lebih efektif dalam memberikan perlindungan melawan serotipe yang heterolog dibandingkan dengan vaksin yang hanya terdiri dari satu jenis sel utuh dari antigen (Baba et al. 1988).
Untuk menanggulangi penyakit furunkulosis pada ikan Atlantic salmon
(Salmo salar L.) akibat infeksi bakteri Aeromonas salmonicida maka Hoel et al.
(1997) membuat vaksin polivalen yang berisi bakteri A. salmonicida, Vibrio salmonicida, dan V. anguillarum. Respons imun humoral Atlantic salmon yang divaksin dengan vaksin polivalen lebih baik dalam memberikan proteksi terhadap antigen A. salmonicida dibandingkan dengan vaksin monovalen.
injeksi (intra peritoneal atau IP), intubasi melalui mulut, dan intubasi melalui anus. Intubasi melalui mulut dan injeksi (IP) memberikan level proteksi lebih tinggi dibandingkan dengan intubasi melalui anus maupun perendaman dengan rerata RPS 80–100%. Vaksinasi dapat meningkatkan antibodi plasma maupun
mucus (lendir), akan tetapi tidak meningkatkan produksi lisosim pada plasma maupun lendir.
Pembentukan Respons Imun Pascavaksinasi
Vektor vaksin memiliki kemampuan untuk menstimulasi mediasi sel, antibodi humoral, dan imunitas mukosa. Vektor vaksin juga harus mampu bertahan dan bereplikasi dalam tubuh inang, menghasilkan respons imunitas selular yang kuat sehingga dapat memberikan proteksi dengan durasi waktu lebih lama. Induksi imun selular (respons CD4+ dan CD8+ sel-T) berperan dalam memberikan proteksi terhadap infeksi intraselular (Skinner 2009).
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian ini dilakukan di laboratorium kesehatan ikan Balai Penelitian dan Pengembangan Budidaya Air Tawar (BPPBAT) Bogor, Laboratorium Kesehatan Ikan Departemen Budidaya Perairan - Fakultas Perikanan dan Ilmu Kelautan IPB, Laboratorium Terpadu PAU IPB, dan Laboratorium Uji Balai Besar Pengolahan Produk Perikanan dan Bioteknologi (BBP3B) Jakarta. Penelitian dilakukan pada bulan Maret 2011 - Februari 2012.
Ikan Uji
Ikan uji menggunakan ikan Nila (Oreochromis niloticus) berukuran 15±0,5 g. Ikan yang digunakan harus memenuhi asumsi Spesifik Pathogen Free
(SPF) bebas dari karakteristik yang akan muncul ketika terinfeksi penyakit Motile Aeromonas Septicemia dan Streptococcosis, melewati masa aklimatisasi selama 14 hari. Pengamatan dilakukan dengan melihat gejala klinis serta dilakukan pengambilan sampel isolat untuk melakukan identifikasi bakteri target (A. hydrophila dan S. agalactiae).
Isolat Bakteri
Bakteri Aeromonas hydrophila dan Streptococcus agalactiae
menggunakan isolat koleksi BPPBAT Kementrian Kelautan dan Perikanan, Bogor. Aeromonas hydrophila diinokulasi dalam media Tryptic Soy Agar (TSA) menggunakan A. hydrophila isolat AHL0905-2, dan S. agalactiae diinokulasi dalam media Brain Heart Infussion Agar (BHIA) menggunakan S. agalactiae
isolat N14G.
Vaksin
bivalen gabungan bakterin A. hydrophila dan S. agalactiae. Perlakuan kontrol sesuai dengan media solusi sediaan vaksin.
Tabel 1 Komponen vaksin bivalen
Perlakuan Komponen vaksin Komponen uji tantang 1
2 3 4 5
(su AH) : (su SA) (ECP AH) : (ECP SA) (cS AH) : (cS SA)
(su+ECP AH) : (su+ECP SA) (br AH) : (br SA)
Setiap perlakuan vaksin diuji tantang dengan bakteri AH, SA, dan ko-infeksi AH+SA
AH (Aeromonas hydrophila), SA (Streptococcus agalactiae), ECP (produk ekstraseluler), su (sel utuh), cS (crude supernatan), br (broth).
Parameter yang Diamati
Beberapa parameter uji yang diamati pada penelitian ini diantaranya adalah kematian ikan, gejala klinis, dan gambaran sistem imun ikan.
Gejala klinis
Gejala klinis ikan diamati dengan melihat tingkah laku makan, berenang, respons terhadap kejutan, dan perubahan anatomi bagian luar tubuh ikan maupun organ dalam ikan.
Hematologi dan gambaran sistem imun
Pengamatan hematologi dan gambaran sistem imun dilakukan dengan mengamati sampel darah yang diambil dari ikan perlakuan kemudian diukur kadar haemoglobin menurut metode Sahli (Wedenmeyer & Yasutake 1977). Kadar hematokrit menurut metode Anderson dan Siwicki (1995). Aktifitas fagositosis meliputi indek fagositik dan persen fagositosis dievaluasi menggunakan metode Zhang et al. (2008).
Histopatologi
Pengamatan gambaran histopatologi dilakukan untuk mengetahui efek dari penyakit MAS (infeksi A. hydrophila) dan Streptococcosis (infeksi S. agalactiae) terhadap ikan Nila.
Relative Percent Survival (RPS)
Tingkat kelangsungan hidup (SR) setelah uji tantang kemudian dihitung menjadi nilai Relative Percent Survival (RPS) untuk melihat efektifitas vaksinasi dengan menggunakan rumus Ellis (1988) :
Analisis Data
Alur Pelaksanaan Penelitian
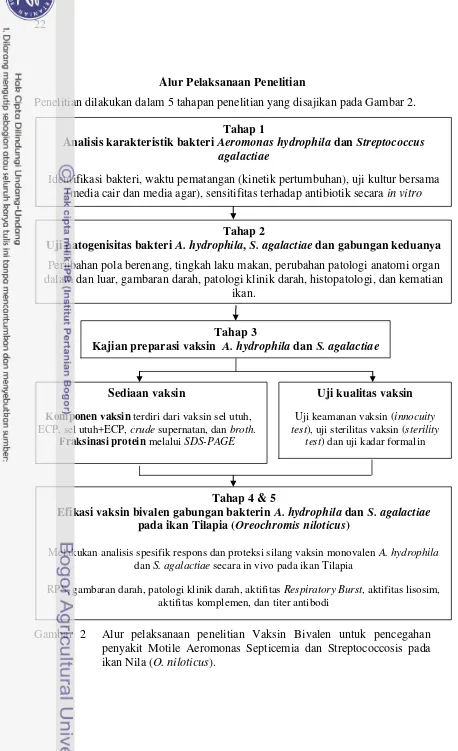
Penelitian dilakukan dalam 5 tahapan penelitian yang disajikan pada Gambar 2.
Gambar 2 Alur pelaksanaan penelitian Vaksin Bivalen untuk pencegahan penyakit Motile Aeromonas Septicemia dan Streptococcosis pada ikan Nila (O. niloticus).
Tahap 1
Analisis karakteristik bakteri Aeromonas hydrophila dan Streptococcus agalactiae
Identifikasi bakteri, waktu pematangan (kinetik pertumbuhan), uji kultur bersama (media cair dan media agar), sensitifitas terhadap antibiotik secara in vitro
Tahap 2
Uji patogenisitas bakteri A. hydrophila, S. agalactiae dan gabungan keduanya
Perubahan pola berenang, tingkah laku makan, perubahan patologi anatomi organ dalam dan luar, gambaran darah, patologi klinik darah, histopatologi, dan kematian
ikan.
Tahap 3
Kajian preparasi vaksin A. hydrophila dan S. agalactiae
Sediaan vaksin
Komponen vaksin terdiri dari vaksin sel utuh, ECP, sel utuh+ECP, crude supernatan, dan broth.
Fraksinasi protein melalui SDS-PAGE
Uji kualitas vaksin
Uji keamanan vaksin (innocuity test), uji sterilitas vaksin (sterility
test) dan uji kadar formalin
Tahap 4 & 5
Efikasi vaksin bivalen gabungan bakterin A. hydrophila dan S. agalactiae pada ikan Tilapia (Oreochromis niloticus)
Melakukan analisis spesifik respons dan proteksi silang vaksin monovalen A. hydrophila dan S. agalactiae secara in vivo pada ikan Tilapia
[image:50.595.51.509.39.790.2]KO-INFEKSI
Aeromonas hydrophila
DAN
Streptococcus
agalactiae
: KEBERADAAN, DAYA TUMBUH
in-vitro
,
SENSITIFITAS ANTIBIOTIK, DAN GAMBARAN
HISTOPATOLOGI
Abstrak
Bakteri Aeromonas hydrophila dan Streptococcus sp. menyebabkan wabah penyakit MAS (Motile Aeromonas Septicemia) dan Streptococcosis yang menjadi penghambat keberhasilan produksi budidaya ikan Nila (Oreochromis niloticus) di Indonesia. Keberadaan kejadian ko-infeksi antara bakteri A. hydrophila dengan S. agalactiae pada ikan Nila di KJA Waduk Cirata sebesar 20% dari populasi di karamba. Uji kerentanan ikan Nila terhadap kedua jenis penyakit ini dilakukan secara in-vitro dan in-vivo untuk melihat kompetisi antigen dan ko-infeksi dari kedua jenis bakteri penyebab penyakit. Hasil uji pertumbuhan bakteri pada media cair maupun media padat menunjukkan bahwa kedua jenis bakteri ini dapat tumbuh bersinergi (tidak saling menghambat). Bakteri A. hydrophila dan S. agalactiae bersifat rentan terhadap antibiotik Tetrasiklin dan Kloramfenikol. Hasil histopatologi organ ginjal, otak, hati, dan limpa memperlihatkan dua pola karakter luka. Pola pertama, luka yang fokal sampai terlihat adanya inflamasi dan perdarahan. Pola kedua, luka yang multifokal, luka parah, nekrotik, dan luka inflamasi yang mengakibatkan deformasi sel-sel organ.
Kata kunci : Aeromonas hydrophila, S. agalactiae , kompetisi antigen, histopatologi
Abstract
Etiological agents of common fish diseases are the Gram-negative A. hydrophila and the Gram-positive S. agalactiae, both are considered severe fish pathogens on account of their ability to cause damaging disease outbreaks in Nile Tilapia (O. niloticus). The occurence of co-infections between A. hydrophila and
S. agalactiae at Waduk Cirata was about 20% per populations. Pathogenesis in fish involved septicaemia and colonization of numerous organs, such as the liver, brain, and kidney. Clinical signs appeared soon after infection, and include depression or excitability, anorexia, C-shaped body posturing, erratic swimming, whirling, and death. Aeromonas hydrophila and S. agalactiae cultures were not able to inhibit each other and showed negative results from antimicrobial activity, both are succeptible to antibiotics Tetracycline and Chloramphenicol. Nile Tilapia also were clinically examined and necropsied for histopathology, samples were taken from kidney, brain, liver, and spleen. Histopathological lesions were grouped into two characteristic patterns. The first pattern consisted focal lesion and inflammation. The second pattern consisted of multifocal lesion, necrotic, and inflammatory lesions resulting organ deformation.
Pendahuluan
Kasus kejadian suatu wabah penyakit pada ikan dapat melibatkan banyak faktor. Patogen infeksius (virus, bakteri, dan parasit) sering dianggap sebagai penyebab utama dari perjangkitan penyakit, sedangkan perubahan faktor lingkungan, mutu air yang jelek, dan manajemen budidaya yang salah menjadi penyebab infeksi sekunder yang akan memperparah kondisi sakit. Keterikatan kedua faktor ini akan mempengaruhi keseimbangan fisiologis normal dari suatu organisme, yaitu jika ada interupsi maka akan menyebabkan tekanan fisiologis yang dapat menyebabkan perubahan fungsional sel dan tanggap kebal (Wedemeyer et al. 1990).
Penyakit ikan akibat infeksi Aeromonas hydrophila dan Streptococcus agalactiae dapat menginfeksi ikan Nila yang ada di alam maupun pada sistem budidaya. Kedua bakteri ini berasal dari dua tipe Gram bakteri yang berbeda yaitu Gram negatif (A. hydrophila) dan Gram positif (S. agalactiae) dengan karakter infeksi dan gejala klinis yang berbeda pula. Penelitian ini bertujuan untuk melihat karakteristik tipe ko-infeksi dan karakter pertumbuhan bakteri penyebab penyakit MAS dan Streptococcosis, sensitifitas terhadap antibiotik, dan pengaruh infeksi terhadap sel-sel organ dengan melakukan serangkaian uji secara in vivo maupun
in vitro di laboratorium. Penelitian dilakukan dengan metode infeksi tunggal dan ko-infeksi untuk membedakan gejala klinis dan perubahan patologi organ ikan Nila (O. niloticus).
Bahan dan Metode
1 Survei Lapang
Kegiatan survei dilakukan di sentra budidaya ikan Nila (O. niloticus) pada karamba jaring apung daerah Cirata-Cianjur. Pengamatan keberadaan penyakit MAS dan Streptococosis di ikan Nila diambil pada beberapa lokasi karamba, dilakukan pengamatan gejala klinis, melakukan pembedahan (sectio) untuk melihat kondisi organ yang teramati dari ikan sehat maupun ikan sakit, dan membuat preparasi isolat bakteri dengan metode gores pada media tumbuh TSA (Triptic Soy Agar), R-S agar (Rhimler-Shott), Streptococcus medium, dan BHIA (Brain Heart Infusion Agar). Hasil inokulasi bakteri diidentifikasi menggunakan API 20 NE untuk identifikasi bakteri A. hydrophila dan API Strep 20 untuk identifikasi bakteri S. agalactiae.
2 Analisis Waktu Pematangan
Bakteri A. hydrophila dan S. agalactiae ditumbuhkan pada media TSA dan BHIA diinkubasi selama 24 jam dengan suhu 28 oC. Diambil satu koloni terpisah (102 cfu/mL) darimasing-masing isolat kemudian ditumbuhkan dalam media cair (Tryptic Soy Broth TSB dan Brain Heart Infusion BHI broth) dan media agar (TSA dan BHIA) diinkubasi selama 24, 48, dan 72 jam dengan suhu 28 oC. Pengamatan pertumbuhan bakteri dilakukan dengan menghitung koloni bakteri yang tumbuh pada media TSA dan BHIA hasil pengenceran seri.
3 Uji Kultur bersama di Media Cair dan Media Agar
dengan bakteri A. hydrophila (0,2 mL 104 cfu/mL). Inokulan diinkubasi selama 24 jam kemudian dihitung diameter zona hambat yang dihasilkan.
Uji pertumbuhan pada media cair dengan melakukan kultur bersama di media TSB dan BHI untuk melihat IC (Inhibitor Concentration). Metoda yang digunakan dalam uji IC adalah dengan uji pengenceran seri (Dilution Test). Bakteri A. hydrophila dan S. agalactiae diencerkan hingga didapat konsentrasi perlakuan yang berbeda (1012, 1010, 108, 106, 104, dan 102 cfu/mL). Ke dalam masing-masing konsentrasi perlakuan kemudian diinokulasikan dengan bakteri yang berbeda sebanyak 50 µL sehingga total bakteri yang diinokulasikan adalah 100 µL kedalam 10 mL media cair. Pertumbuhan bakteri dari masing- masing perlakuan dilihat melalui jumlah koloni yang tumbuh pada TSA dan BHIA.
4 Sensitifitas Terhadap Antibiotik
Sensitifitas bakteri terhadap beberapa jenis antibiotik dilakukan dengan menumbuhkan isolat A. hydrophila dalam media TSA, sedangkan S. agalactiae
ditumbuhkan dalam media BHIA. Kertas cakram yang telah mengandung antibiotik diletakkan pada inokulan bakteri uji, diinkubasi selama 24 jam pada suhu 28 oC, zona hambat (zona bening) yang terbentuk diukur diameternya. Antibiotik yang diujikan meliputi : 1) Eritromisin; 2) Nalidixic acid; 3) Novobiosin; 4) Klindamisin; 5) Sefalotin; 6) Tetrasiklin; 7) Furazolidon; 8) Kloramfenikol; 9) Gentamisin; 10) Metisilin; 11) Ampisilin.
5 Pengamatan Gambaran Histopatologi
Hasil dan Pembahasan
1 Keberadaan Penyakit dan Gejala Klinis Ikan Terinfeksi MAS dan Streptococcosis di KJA Cirata
Survei kerentanan ikan Nila terhadap infeksi MAS dan Streptococcosis dilakukan pada budidaya ikan Karamba Jaring Apung (KJA) di Waduk Cirata yaitu Blok Jangari-Mande dan Blok Pasir Pogor-Bobojong. Hasil identifikasi menunjukkan bahwa keberadaan Aeromonas hydrophila sebesar 100% dan ko-infeksi Streptococcus sp. sebesar 20% yang merupakan hasil isolasi bakteri pada organ ginjal, otak, dan luka dari 10 ekor ikan sakit dan 5 ekor ikan sehat dari populasi di setiap KJA. Ikan Nila secara alami pada karamba tersebut dapat terindikasi terjadi ko-infeksi dari penyakit MAS dan Streptococcosis sebesar 20% dari sampel ikan yang menunjukkan gejala sakit. Gejala klinis yang teramati ditandai dengan adanya eksoptalmi, warna tubuh gelap, bola mata menonjol dan berwarna putih (opaque), perut gembung apabila dibedah terdapat cairan berwarna bening pada rongga perut (asites), perdarahan (hemorrhage), sirip gripis dan pangkal sirip berwarna pucat, ginjal dan hati berwarna pucat, serta saluran intestin kosong.
Identifikasi dilakukan pada isolat hasil inokulasi pada media TSA, BHIA, dan media R-S (Rhimler-Shott) dari luka, ginjal, dan hati ikan Nila yang menunjukan gejala sakit. Pengujian identifikasi dilakukan di laboratorium menggunakan API 20 NE diperoleh hasil positif A. hydrophila dan menggunakan API Strep 20 diperoleh hasil positif S. agalactiae (Lampiran 1).
2 Gejala Klinis Ikan Nila Terserang Ko-infeksi MAS dan Streptococcosis Hasil Infeksi Buatan
2001). Bakteri S. agalactiae termasuk ke dalam golongan kelompok antigen Lancefield B dengan tipe haemolitik β (α, -), kemampuan hemolitik terhadap sel eritrosit tersebut merupakan salah satu penentu faktor virulensinya (Kohler 2007).
Gambar 3 Ikan Nila (O. niloticus) yang terinfeksi. (a) MAS, (b) Streptococcosis, (c) ko-infeksi MAS dan Streptococcosis. (u) ulcer, (h) hemorrhage, (exo) eksoptalmi, (op) opaque.
Hasil pengamatan gejala klinis pada ikan Nila yang terinfeksi bakteri A. hydrophila ditandai dengan adanya perdarahan (hemorrhage), borok (ulcer), dan mata berwarna putih (opaque) (Gambar 3). Ikan Nila yang terinfeksi bakteri S. agalactiae menunjukkan gejala pergerakan renang berputar (whirling), membentuk huruf C (C-shaped) (Gambar 4), dan mata menonjol (eksoptalmi).
Gambar 4 Deformasi C-shaped ikan Nila yang terinfeksi Streptococcosis. Gejala klinis yang nampak pada ko-infeksi A. hydrophila dan S. agalactiae
menunjukkan gabungan dari karakter penyakit MAS dan Streptococcosis yaitu dengan adanya perdarahan pada permukaan tubuh dan eksoptalmi di mata. Karakter gejala klinis akibat serangan bakteri dari kedua jenis penyakit ini menjadi lebih dikenal dengan