ENTOMOPATOGEN ISOLAT LOKAL
DESYANTI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
ii
PERNYATAAN MENGENAI DISERTASI DAN SUMBER
INFORMASI
Dengan ini saya menyatakan bawah disertasi Kajian Pengendalian Rayap Tanah Coptotermes spp. (Isoptera: Rhinotermitidae) dengan Menggunakan Cendawan Entomopatogen Isolat Lokal adalah karya saya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir disertasi ini.
Bogor, Juli 2007
Desyanti
ABSTRAK
DESYANTI. Kajian Pengendalian Rayap Tanah Coptotermes spp. (Isoptera: Rhinotermitidae) dengan Menggunakan Cendawan Entomopatogen Isolat Lokal. Dibimbing oleh YUSUF SUDO HADI, SULAEMAN YUSUF dan TEGUH SANTOSO
Rayap tanah Coptotermes spp. adalah salah satu dari banyak hama yang menyebabkan kerusakan serius pada produk hasil kayu khususnya sebagai material bangunan. Beberapa metode pengendalian rayap telah berhasil dilaksanakan di Indonesia, di antaranya penggunaan termitisida yang diaplikasikan melalui tanah, impregnasi ke dalam kayu dan metode pengumpanan serta penghalang fisik. Namun pengendalian hayati menggunakan cendawan entomopatogen belum banyak dilakukan di Indonesia.
Cendawan diisolasi dari berbagai sumber inokulum di alam seperti ulat krop kubis (Crocidolomia pavonana F.), ulat grayak (Spodoptera litura F.), walang sangit (Leptocorisa oratorius F.), penghisap polong kedele (Riptortus linearis L.), rayap tanah (Coptotermes curvignathus Holmgren.), tanah dan pasir. Beauveria bassiana (Bals.) Vuill., Metarhizium anisopliae (Metsch.) Sorok., Metarhizium brunneum Petch, Myrothecium roridum Tode EXFR., Paecilomyces fumosoroseus
(Wize) Brown dan Smith, Penicillium citrinum Thom., Verticilium lecanii
(Zimmermann), Aspergillus flavus Link., Fusarium oxysporum Link, dan
Fusarium solani Link telah ditemukan dari berbagai sumber inokulum di alam.
B. bassiana merupakan spesies yang paling dominan ditemukan.
Uji tapis mengindikasikan bahwa cendawan yang ditemukan umumnya bersifat patogen terhadap rayap dan dapat menyebabkan mortalitas rayap
Coptotermes gestroi Wasmann lebih dari 60% setelah 6 hari diinokulasi. Bahkan
M. anisopliae dari inang penghisap polong kedele, M. brunneum dari pasir,
M. roridum dari tanah, B. bassiana dari walang sangit, F. oxysporum dari ulat grayak dan A. flavus dari inang rayap tanah dapat membunuh rayap 100% setelah 6 hari inokulasi. Berkenaan dengan kerapatan konidia, hasil penelitian memperlihatkan bahwa semakin tinggi kerapatan konidia menyebabkan mortalitas rayap lebih tinggi. Nilai lethal concentration (LC) dari masing-masing spesies berbeda. Dalam hal ini M. brunneum dari pasir memiliki LC50 terendah, yaitu 1,8 x 105 konidia/ml. Aplikasi dengan metode kontak menyebabkan mortalitas dalam waktu yang lebih singkat (LT50 = 2,01 hari) dibandingkan dengan metode pengumpanan (LT50 = 4,83 hari).
Uji penularan patogen di laboratorium terhadap rayap C. gestroi, mengindikasikan korelasi antara mortalitas dengan proporsi vektor: mortalitas rayap meningkat dengan meningkatnya proporsi vektor. Pada penggunaan proporsi vektor 10%, mortalitas yang disebabkan oleh B. bassiana, M.anisopliae
dan M. brunneum pada LC95 tidak berbeda nyata (>90%). Pada uji terhadap rayap tanah C. curvignathus, spesies cendawan M. brunneum hanya menyebabkan 60% mortalitas (mortalitas rayap pada kontrol 13,25%) dan penurunan berat contoh uji 11,27% (kontrol 47,82%) 15 hari setelah inokulasi. Sebagai kesimpulan penelitian ini, rayap yang diperlakukan (vector) dapat menyebarkan penyakit yang disebabkan cendawan terhadap individu rayap sehat lainnya.
iv
ABSTRACT
DESYANTI. Study on Bio-control of Subterranean Termites Coptotermes
spp. (Isoptera: Rhinotermitidae) using indigenous Isolates of Entomopathogenic Fungi. Under the Direction of YUSUF SUDO HADI, SULAEMAN YUSUF and TEGUH SANTOSO
Subterranean termite Coptotermes spp.is one of the important pests causing serious damage of wood product especially as building material. Some methods for termite control currently practiced in Indonesia are the use of termiticides as soil treatment, impregnation in to the wood, baiting and physical barrier. The use of bio-control agent such entomopathogenic fungi is only at the beginning stage.
The fungi were isolated from various hosts in nature such as cabbage heart caterpillar (Crocidolomia pavonana F.), army worm (Spodoptera litura F.), rice bug (Leptocorisa oratorius F.), pod-sucking bug (Riptortus liniaris L.), subterranean termite (Coptotermes curvignathus Holmgren.), soil and sand.
Beauveria bassiana (Bals.) Vuill, Metarhizium anisopliae (Metsch.) Sorok, Metarhizium brunneum Petch, Myrothecium roridum Tode EXFR, Paecilomyces fumosoroseus (Wize) Brown and Smith, Penicillium citrinumThom., Verticilium lecanii (Zimmermann), Aspergillus flavus Link, Fusarium oxysporum Link, and
Fusarium solani Link have been found from various hosts. B. bassiana was the most commonly fungus species found.
The screening test indicated that the fungi are generally pathogenic to termite Coptotermes gestroi Wasmann and could cause termite mortality more
than 60% within 6 days. M. anisopliae from infected pod-sucking bug,
M. brunneum from sand, M. roridum from soil, B. bassiana from infected rice bug, F. oxysporum from infected army worm and A. flavus from infected subterranean termite could kill 100% termites within 6 days. Regarding the density of conidia, the result revealed that the higher level of density of conidia caused higher mortality of termite. The value of lethal concentration (LC) of each species are different. In this case M. brunneum from sand had the lowest LC50, i.e. 1.8 x 105 conidia/ml. For application purpose, the contact method caused mortality in few days (LT50 2.01 days) as compared with baiting method (LT50 4,83 days).
Transmission tests of pathogen indicated that on C. gestroi in the laboratory, there was correlation between termite mortality with vector proportion, the mortality of termite increased as vector proportion increased. By using 10% termite vector, mortality caused by B. bassiana, M.anisopliae and M. brunneum
at LC95, termite mortality was not significantly different (>90%). Against subterranean termites of C. curvignathus, fungi M. brunneum only caused 60% mortality of termites within 15 days after application, while termite mortality in control was observed as 13.25% and specimens weight loss 11,27% (control 47,82%). It is concluded that in this study, treated termites (vector) could transmit the fungal disease to other healthy ones.
© Hak cipta milik Institut Pertanian Bogor, tahun 2007 Hak cipta dilindungi
vi
KAJIAN PENGENDALIAN RAYAP TANAH
COPTOTERMES Spp. (ISOPTERA: RHINOTERMITIDAE)
DENGAN MENGGUNAKAN CENDAWAN
ENTOMOPATOGEN ISOLAT LOKAL
DESYANTI
Disertasi
Sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Ilmu Pengetahuan Kehutanan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Penguji Luar Komisi Ujian Tertutup: Dr.Ir. Idham Sakti Harahap, MSi. Penguji Luar Komisi Ujian Terbuka: 1. Prof. Dr. Dodi Nandika, MS
viii
Judul Disertasi : Kajian Pengendalian Rayap Tanah Coptotermes spp. (Isoptera: Rhinotermitidae) dengan Menggunakan Cendawan Entomopatogen Isolat Lokal
Nama : Desyanti
NIM : E 061020081
Disetujui
Komisi Pembimbing
Prof. Dr. Ir Yusuf Sudo Hadi, M.Agr. Ketua
Dr. Sulaeman Yusuf, M.Agr. Dr. Ir. Teguh Santoso, DEA Anggota Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Ilmu Pengetahuan Kehutanan
Dr. Ir. Rinekso Soekmadi, M.Sc. Prof. Dr. Ir. Khairil A. Notodiputro, M.S
PRAKATA
Puji syukur penulis panjatkan kehadirat Allah SWT atas segala karunia-Nya sehingga disertasi dengan judul ” Kajian Pengendalian Rayap Tanah Coptotermes
spp. (Isoptera: Rhinotermitidae) dengan Menggunakan Cendawan Entomopatogen Isolat Lokal” dapat diselesaikan.
Pada kesempatan ini penulis ucapkan penghargaan dan terima kasih yang
setulus-tulusnya kepada Bapak Prof. Dr. Ir. Yusuf Sudo Hadi, M. Agr. Bapak Dr. Sulaeman Yusuf. M. Agr. dan Bapak Dr. Ir. Teguh Santoso, DEA selaku
pembimbing yang telah memberikan bimbingan, arahan, motivasi, kritik, saran dan fasilitas sarana maupun prasarana selama penulisan rancangan penelitian, pelaksanaan penelitian dan penulisan disertasi hingga selesai. Semoga amal kebaikan yang disertai keikhlasan dari Bapak akan senantiasa dilimpahkan rahmat dan karunia Allah SWT, Amin. Ucapan yang sama juga penulis ucapkan ke pada Bapak Dr. Ir. Idham Sakti Harahap, MSi, Bapak Prof. Dr. Ir. Dodi Nandika, MS dan Ibu Dr. Yanni Sudiyani, MAgr. yang telah berkenan sebagai penguji luar komisi, terima kasih atas saran dan masukannya pada penyempurnaan disertasi ini.
Seterusnya penulis juga mengucapkan terima kasih Kepada Bapak Rektor Universitas Muhammadiyah Sumatera Barat, Bapak Koordinator KOPERTIS wilayah X dan Bapak Rektor Institut Pertanian Bogor (IPB) yang telah memberi kesempatan kepada penulis untuk dapat melanjutkan pendidikan pada Sekolah Pascasarjana IPB, dan ucapan yang sama juga penulis sampaikan kepada, Dekan Sekolah Pascasarjana IPB, Ketua Program Studi Ilmu Pengetahuan Kehutanan dan seluruh staf pengajar, pengelola BPPS Direktorat Jendral Pendidikan Tinggi Departemen Pendidikan Nasional, Pemerintah Daerah Sumatera Barat, atas kesempatan dan dukungan dana yang telah diberikan hingga penyelesaian studi yang penulis jalankan dapat terlaksana dengan baik.
Kepada Bapak Dr. Ir. Edi Suhaimi Bakar M.Agr, Ibu Dr. Yanni Sudiyani M.Agr., Didi Tarmadi S.Hut. diucapkan terima kasih atas pengarahan awal tentang materi penelitian, dan bantuan diawal penelitian sehingga dapat menapaki keberhasilan di dalam pelaksanaan penelitian ini.
Kepada orang tua (Alm) terima kasih atas kasih sayang, motifasi untuk selalu mementingkan pendidikan yang senantiasa diberikan didalam menjalani kehidupan ini, doa, dan dorongan moril maupun material yang telah diberikan pada ananda dengan penuh keikhlasan dan pengorbanan yang tiada berahir sampai ahir hayat. Selanjutnya kepada Ibu dan Ayah mertua, teristimewa buat Suami tercinta yang senantiasa memberi semangat serta telah dengan ikhlas mendampingi dengan suka maupun duka selama menjalani studi, seterusnya buat Adik-adikku, keponakan, keluargaku di Padang dan Solo, kakak dan adik Ipar serta semua keluarga di Jakarta, terimakasih atas semua bantuannya moril maupun material.
x
RIWAYAT HIDUP
Penulis dilahirkan di Tanjung Bonai Kec. Lintau Buo, Kab. Tanah Datar Sumatera Barat 17 Desember 1964, anak pertama dari 3 bersaudara dari Bunda Rahma (almarhuma) dan Bapak Kaliman (almarhum). Beliau telah memberikan bekal pendidikan yang baik sehingga penulis dapat meraih pendidikan ini dan hidup mandiri. Pendidikan dari Taman kanak-kanak sampai dengan SMA penulis selesaikan di Lintau, kemudian tahun 1984 penulis melanjutkan ke Fakultas Pertanian Univ. Muhammadiyah Sumatera Barat dan pada tahun 1991 sampai dengan 1997 penulis bekerja sebagai asisten dosen pada Fakultas yang sama. Pada tahun 1997 penulis diberi kesempatan melanjutkan pendidikan di Program Studi Ilmu Pengetahuan Kehutanan Program Pascasarjana Institut Pertanian Bogor (IPB) dan memperoleh Magister of Science pada tahun 2000, kemudian pada tahun 2002 penulis mendapatkan kesempatan melanjutkan pendidikan S3 pada Program Studi yang sama Sekolah Pascasarjana IPB dan menyelesaikannya pada tahun 2007. Penulis bekerja sebagai staf pengajar pada Fakultas Kehutanan Universitas Muhammadiyah Sumatera Barat dari tahun 2000 sampai sekarang.
xii
DAFTAR ISI
halaman
DAFTAR TABEL... .... xiii
DAFTAR GAMBAR... xiv
BAB I. PENDAHULUAN... 1
Latar Belakang ... 1
Perumusan Masalah... 3
Tujuan dan Kegunaan Khusus……... 3
Hasil yang Diharapkan... 4
BAB II. TINJAUAN PUSTAKA... 5
Rayap... 5
Pengendalian Rayap... 7
Cendawan Entomopatogen... 9
BAB III. BAHAN DAN METODE... 13
Tahap Persiapan... 13
Uji Tapis dan Keefektifan Beberapa Spesies Cendawan Entomo- patogen Terhadap Rayap Tanah Coptotermes gestroi Wasmann 15 Metode Kontak dan Umpan………...………..…... 15
Uji Aplikasi dengan Penularan di Laboratorium... 16
Analisis Data... 18
BAB IV. ISOLASI, IDENTIFIKASI DAN UJI TAPIS CENDAWAN ENTOMOPATOGEN DARI BERBAGAI INANG DI ALAM DAN PATOGENISITASNYA TERHADAP RAYAP TANAH COPTOTERMES GESTROI WASMANN... 19
Abstrak... 19
Pendahuluan... 20
Bahan dan Metode... 21
Hasil dan Pembahasan... 24
Isolasi dan Identifikasi... 24
Patogenisitas dan Virulensi... 29
Sporulasi in Vivo... 36
Karakterisasi Fisiologi Cendawan Entomopatogen Terseleksi pada Media SDAY (in vitro): Daya Kecambah, Diameter Koloni dan Sporulasi... 38
BAB V. KEEFEKTIFAN BEBERAPA SPESIES CENDAWAN ENTOMO- PATOGEN TERHADAP RAYAP TANAH COPTOTERMES
GESTROI WASMANN DENGAN METODE KONTAK DAN
UMPAN ... 44
Abstrak... 44
Pendahuluan... 44
Bahan dan Metode... 46
Hasil dan Pembahasan... 49
Uji Patogenisitas... 49
Uji Metode Kontak dan Umpan di Laboratorium... 57
Kesimpulan... 60
BAB VI APLIKASI CENDAWAN ENTOMOPATOGEN DENGAN TEKNIK PENULARAN UNTUK MENGENDALIKAN RA- YAP TANAH COPTOTERMES Spp. DI LABORATORIUM. 61 Abstrak... 61
Pendahuluan... 61
Bahan dan Metode... 63
Hasil dan Pembahasan... 66
Penularan Cendawan Entomopatogen Antar Individu di Dalam Suatu Koloni Rayap Tanah Coptotermes gestroi Wasmann... 66
Penularan Cendawan Entomopatogen M. brunneum Antar Individu Rayap Tanah Coptotermes curvignathus (Holmgren)……… 75
Kesimpulan... 78
BAB VII. PEMBAHASAN UMUM... 79
BAB VIII. KESIMPULAN DAN SARAN... 88
Kesimpulan... 88
Saran... 89
DAFTAR PUSTAKA... 90
xiv
DAFTAR TABEL
Tabel halaman
4.1. Cendawan entomopatogen yang ditemukan pada berbagai inang
atau sumber inokulum di alam... 28
4.2 Karakterisasi fisiologi beberapa spesies cendawan entomopatogen terseleksi: diameter koloni, daya kecambah konidia dan sporulasi... 39
5.1. Spesies cendawan entomopatogen yang ditemukan dari berbagai inang atau sumber inokulum lainnya di Pulau Jawa, dan digunakan
dalam penelitian... 47
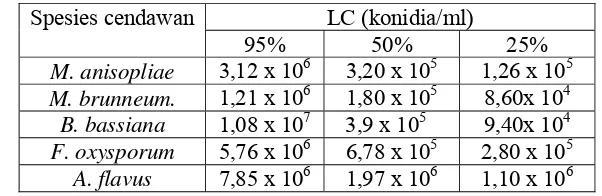
5.2. Lethal Concentration (LC) beberapa spesies cendawan
entomopatogen terhadap rayap tanah C. gestroi... 53
5.3. Lethal Time (LT) cendawan entomopatogen M. brunneum dengan metode kontak dan pengumpanan... 59
6.1. Spesies cendawan entomopatogen yang ditemukan dari berbagai
inang atau sumber inokulum di alam... 63
6.2. Penurunan berat contoh uji oleh serangan rayap C. curvignathus pada perlakuan 10% vektor diinokulasi dengan cendawan
DAFTAR GAMBAR
Gambar halaman
3.1. Diagram cakupan penelitian proses pemanfaatan cendawan entomopatogen sebagai patogen untuk pengendalian rayap tanah
Coptotermes gestroi dan Coptotermes curvignathus di laboratorium. 17 4.1. Persentase isolat cendawan entomopatogen yang berhasil
diisolasi dari berbagai sumber inokulum di alam... 25
4.2. Koloni cendawan entomopatogen dari konidia tunggal berumur
3 minggu pada media SDAY kecuali F. Oxysporum (13 hari)... 27
4.3. Cendawan B. bassiana pada media SDAY dengan
perbesaran 1000 x... 29
4.4. Laju mortalitas rayap C. gestroi oleh cendawan entomopatogen (107 konidia/ml) dari berbagai inang 6 hari setelah inokulasi
(kontrol 11,25%)... 30
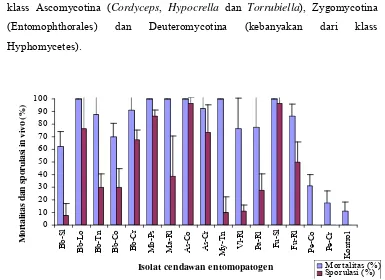
4.5. Sporulasi cendawan entomopatogen pada tubuh rayap (in vivo) dan mortalitas rayap C. gestroi 6 hari setelah diinokulasi dengan
suspensi cendawan entomopatogen (107 konidia/ml)... 37 4.6. Sporulasi in vivo beberapa spesies cendawan entomopatogen pada tubuh rayap 9 hari setelah diinokulasi... 38
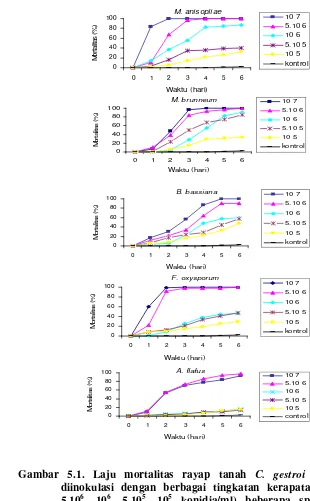
5.1. Laju mortalitas rayap tanah Coptotermes gestroi Wasmann setelah 6 hari diinokulasi dengan berbagai tingkatan kerapatan konidia (107, 5.106, 106, 5.105, 105 konidia/ml) beberapa spesies cendawan entomopatogen... 51
5.2. Rayap tanah C. gestroi yang dikolonisasi oleh
B. bassiana (A) dan M. brunneum (B)... 54
5.3. Mortalitas rayap tanah C. gestroi oleh cendawan entomopatogen M. brunneum pada perlakuan metode aplikasi kontak dan pengum- panan (7 hari setelah aplikasi)... 57
xvi
Gambar halaman
6.2 Penularan cendawan entomopatogen dari rayap yang terkonta- minasi (vektor) terhadap individu rayap sehat di dalam unit
percobaan……….… 68
6.3 Korelasi antara mortalitas rayap C. gestroi (%) dengan tingkatan proporsi vektor (%) yang diinokulasi dengan beberapa spesies
cendawan entomopatogen (5 hari setelah inokulasi)... 71 6.4 Korelasi antara mortalitas rayap C. gestroi (%) dengan tingkatan
proporsi.vektor (%) yang diinokulasi dengan beberapa spesies
cendawan entomopatogen (15 hari setelah inokulasi)... 73
6.5. Rayap C. gestroi dikolonisasi oleh F. oxysporum ... 73
6.6. Mortalitas rayap C. curvignathus dan penurunan berat contoh uji pada perlakuan 10 % vektor diinokulasi dengan cendawan
entomopatogen M. brunneum setelah 15 hari pengamatan ... 76
6.7. Tingkat serangan contoh uji oleh rayap C. curvignathus pada perlakuan 10% vektor diinokulasi dengan cendawan entomopatogen M. brunneum setelah 15 hari pengamatan……… 78
7.1. Potensi cendawan entomopatogen yang diisolasi dari sumber inokulum di alam sebagai agens pengendalian hayati rayap tanah
DAFTAR LAMPIRAN
Lampiran halaman
1. Koloni dan Deskripsi Mikroskopik Cendawan Entomopatogen pada Media Saboraud Dextrose Agar with Yeast Extract (SDAY) yang
BAB I
PENDAHULUAN
Latar BelakangIndonesia sebagai negara tropik dengan iklim dan cuaca yang hangat sepanjang tahun merupakan tempat hidup yang sesuai bagi berbagai organisme perusak kayu seperti rayap, cendawan maupun serangga lainnya dengan keragaman yang tinggi. Diperkirakan hampir 80 – 85% dari luas daratan di Indonesia merupakan habitat yang sesuai bagi kehidupan rayap (Nandika 1999).
Hingga saat ini di dunia terdapat lebih dari 2300 spesies rayap yang dapat diklasifikasikan ke dalam kelompok ekologi yang berbeda: kayu lembab, kayu kering, tanah (subterranean), arboreal/mound builder dan pohon. Kurang 15% dari keragaman spesies rayap tersebut berada pada tata ruang yang dikelola oleh manusia, dan sekitar 150 spesies diketahui menyerang struktur berbahan baku kayu. Dari sekian banyak spesies rayap 10% atau 200 spesies lebih ditemukan di Indonesia, dan sekitar 20 spesies berperan sebagai hama perusak kayu dan tanaman (Tarumingkeng 2001; Nandika et al. 2003; Yusuf 2004; Lewis 2006).
Diperkirakan berbagai spesies rayap perusak kayu dan bangunan akan terus menjadi bagian integral dari ekosistem Indonesia. Meluasnya pembangunan gedung dan pemukiman ke seluruh pelosok daerah cenderung meningkatkan integrasi antara koloni rayap dengan bangunan, yang berarti ancaman bahaya serangan rayap terhadap kayu dan bangunan di Indonesia semakin tinggi.
Di Indonesia, rayap tanah Coptotermes spp, merupakan spesies rayap perusak kayu bangunan yang paling banyak menyebabkan kerugian. Kerusakan yang diakibatkan oleh serangan spesies rayap ini paling mencolok dibandingkan dengan kerusakan oleh serangan organisme perusak yang lain, dan keadaan ini diperburuk dengan penggunaan spesies-spesies kayu yang keawetannya rendah. Oleh karena itu pengendalian rayap tanah sangat diperlukan untuk mempertahankan masa pakai kayu pada suatu bangunan.
bangunan dan 3) Teknologi pengumpanan (baiting), untuk mengeliminasi koloni rayap.
Pemanfaatan bahan kimia seperti organochlorine sangat efektif untuk pengendalian rayap namun membahayakan kesehatan manusia dan lingkungan. Persistensinya yang bertahan lama di lingkungan menyebabkan jenis pestisida ini masuk ke dalam rantai makanan manusia. Sebagai alternatif lain penggunaan organophosphates dan synthetic pyrethroids selain efektif dianggap mempunyai resiko rendah terhadap mammalia dan lingkungan. Di samping penggunaan penghalang fisik seperti penggunaan granit, pasir, koral dan termite mesh untuk pengendalian rayap, perkembangan termitisida saat ini telah mengarah pada penggunaan bahan kimia dengan reaksi lambat seperti hexaflumuron dan
bistrifluron (Sornnuwat 1996; Tarumingkeng 2000; Kubota et al. 2007).
Pengendalian rayap secara biologi menggunakan agens hayati dari golongan cendawan, nematoda, virus dan bakteri entomopatogen merupakan alternatif lain pengendalian rayap tanah (Pearce 1997). Penggunaan agens hayati tersebut untuk pengendalian rayap merupakan suatu wacana baru yang belum digunakan di Indonesia (Yusuf et al. 2005). Namun dari beberapa publikasi di negara-negara maju seperti Jepang, Australia, Amerika Serikat dan Perancis, penggunaan agens hayati dari golongan cendawan entomopatogen tampak lebih berhasil untuk pengendalian rayap.
Pemanfaatan cendawan entomopatogen untuk pengendalian hayati rayap dengan proses atau metode penularan secara langsung maupun tidak langsung, merupakan suatu pilihan teknologi yang tepat dan menarik dikembangkan. Selain mempunyai arti strategis karena dapat memberikan nilai tambah tinggi bagi perkembangan ilmu pengetahuan khususnya tentang pengendalian rayap secara hayati, juga tidak berbahaya bagi lingkungan maupun pemakainya. Studi pemakaian cendawan entomopatogen untuk pengendalian rayap tanah spesies
Coptotermes spp. telah dilakukan (Suzuki 1991; Jones et al. 1996; Delate et al. 1995). Cendawan Metarhizium anisopliae (Metsch.) Sorokin dan Beauveria
bassiana (Bals.) Vuillemin yang termasuk kelas Hyphomycetes merupakan
3
M. anisopliae adalah: 25-30 0C dengan kelembaban 70-95%, dengan demikian kondisi Indonesia merupakan habitat yang sangat cocok.
Pada penelitian ini dipelajari cendawan entomopatogen yang diisolasi dari beberapa sumber inokulum yang terdapat di alam dan dikaji potensinya sebagai bahan pengendalian rayap yang ramah lingkungan.
Perumusan Masalah
Kerusakan kayu bangunan yang diakibatkan oleh rayap di Indonesia sudah sangat besar, apalagi kayu-kayu bangunan pada masa kini hanya ditunjang oleh kayu-kayu yang mempunyai kualitas awet rendah. Bahan kimia yang digunakan untuk mengawetkan kayu kebanyakan berasal dari bahan kimia yang sangat berbahaya bukan hanya terhadap penghuninya melainkan juga terhadap lingkungan. Penggunaan mikrob untuk menekan laju perkembangan rayap adalah salah satu cara pengendalian yang sangat ideal agar keseimbangan lingkungan dapat tercapai dan tidak membahayakan terhadap pemakainya.
Cendawan yang bersifat entomopatogen banyak ditemukan pada berbagai spesies hama tanaman yang telah mati di lapangan, diduga cendawan-cendawan tersebut mempunyai peranan besar atas kematian hama tersebut. Apabila cendawan dapat diisolasi dari tubuh serangga tersebut, maka hal ini akan membuka wacana baru dalam dunia pengawetan kayu, sehingga perkembangan rayap dapat dikendalikan dengan penggunaan cendawan entomopatogen.
Tujuan dan Kegunaan Khusus
Penelitian ini bertujuan untuk mengetahui keragaman dan tingkat keefektifan masing-masing spesies atau isolat cendawan entomopatogen terhadap rayap tanah Coptotermes spp.. Selain hal ini juga bertujuan untuk mengetahui metode penginfeksian serta penularan cendawan di dalam koloni rayap tanah.
masalah pencemaran lingkungan, termasuk pencemaran akibat penggunaan bahan kimia anti rayap yang terus meningkat. Dengan demikian penelitian ini dapat mendukung perkembangan dan daya saing industri pengendalian rayap di masa mendatang. Secara umum penelitian ini terkait dengan pendayagunaan sumberdaya alam hayati yang lebih mengefisienkan pemanfaatan mikrob.
Hasil yang Diharapkan Penelitian ini diharapkan dapat menghasilkan:
1. Informasi tentang keragaman spesies atau isolat cendawan entomopatogen yang efektif dimanfaatkan sebagai pengendalian rayap tanah Coptotermes spp.
2. Tingkat keefektifan cendawan dan persentase vektor efektif untuk pengendalian koloni rayap tanah Coptotermes spp.
3. Menemukan metode yang cocok untuk pemanfaatan cendawan entomopatogen sebagai pengendalian rayap tanah Coptotermes spp. di laboratorium.
BAB II
TINJAUAN PUSTAKA
RayapIndonesia merupakan wilayah sebaran rayap yang penting di dunia, baik ditinjau dari keragaman jenis serangga tersebut yang mencapai tidak kurang dari 200 jenis atau kurang lebih 10% dari keragaman jenis rayap di dunia, maupun ditinjau dari luasnya sebaran geografis dari Aceh sampai Papua. Kondisi iklim dan tanah serta keragaman jenis tumbuhan di Indonesia yang tinggi sangat mendukung kehidupan rayap, dan 80% daratan Indonesia merupakan habitat yang baik bagi kehidupan berbagai jenis serangga ini (Nandika et al. 2003). Beberapa faktor dapat menyebabkan rayap menyerang bangunan, antara lain kayu yang tertimbun tanah pada waktu pembangunan, ada celah pada pondasi tembok, sistem ventilasi kurang baik, kayu yang berhubungan langsung dengan tanah dan kondisi biofisik tapak bangunan itu sendiri yang menguntungkan kehidupan rayap.
Menurut Lewis (2006) perkiraan kerugian yang ditimbulkan oleh rayap secara global sulit ditemukan pada referensi tetapi pasti mencapai milyaran dollar Amerika setiap tahun. Di Indonesia, pada tahun 2000 kerugian ekonomi yang disebabkan oleh serangan rayap pada bangunan diperkirakan mencapai 200 – 300 juta dollar Amerika (Yusuf 2004).
Rayap merupakan serangga sosial yang tergolong ke dalam ordo Isoptera yang hidup dalam satu koloni dengan organisasi individu yang secara morfologi dibedakan menjadi bentuk dan kasta yang berlainan. Kasta yang terdapat di dalam koloni rayap meliputi kasta pekerja, kasta prajurit dan kasta reproduktif, masing-masing kasta melakukan fungsi yang berbeda satu dengan lainnya (Pearce 1997).
dengan mandibel yang dapat menusuk, mengiris dan menjepit. Biasanya gigitan kasta prajurit pada tubuh musuhnya sukar dilepaskan sampai prajurit itu mati sekalipun (Nandika et al. 2003)
Kasta reproduktif terdiri dari individu-individu seksual yaitu betina (ratu) yang tugasnya bertelur dan jantan (raja) yang tugasnya membuahi betina. Kasta ini dibedakan menjadi kasta reproduktif primer dan kasta reproduktif suplementer atau neoten. Kasta reproduktif primer terdiri dari serangga-serangga dewasa yang bersayap dan merupakan pendiri koloni. Menurut Richard dan Davies (1996) neoten muncul segera setelah kasta reproduktif primer mati atau hilang setelah pemisahan koloni. Neoten dapat terbentuk beberapa kali dalam jumlah yang besar sesuai dengan perkembangan koloni. Selanjutnya, neoten menggantikan fungsi kasta reproduktif primer untuk perkembangan koloni.
Krishna dan Weesner (1969) menyatakan rayap adalah serangga sosial yang dapat diklasifikasikan ke dalam 6 famili dan 15 sub famili. Famili tersebut adalah: Mastotermitidae, Kalotermitidae, Hodotermitidae, Rhinotermitidae, Serritermitidae dan Termitidae. Rayap tanah genus Coptotermes termasuk ke dalam sub famili Coptotermitinae famili Rhinotermitidae. Menurut Tambunan dan Nandika (1987), Coptotermes spp. merupakan salah satu rayap tanah paling luas serangannya di Indonesia, dan diklasifikasikan sebagai berikut:
Filum : Arthropoda
Kelas : Insecta
Sub-klas : Pterigota
Ordo : Isoptera
Famili : Rhinotermitidae Sub-famili : Coptotermitinae Genus : Coptotermes
7
tanpa mandibel 1,56 mm – 1,68 mm. Lebar kepala 1,40 mm – 1,44 mm. Bagian abdomen yang bewarna putih kekuning-kuningan ditutupi rambut menyerupai duri. Suratmo (1974) menyatakan panjang badan kasta reproduktif 7,5 mm – 8,0 mm, kasta pekerja 4,5 mm – 5,0 mm dan prajurit 5,0 mm – 5,3 mm.
Tarumingkeng (2004) menyatakan, di Indonesia jenis Coptotermes yang telah teridentifikasi adalah a). Coptotermes curvignathus Holmgren merupakan jenis terbesar dengan ciri, jumlah ruas antena prajurit 14 -16, panjang kepala prajurit (termasuk mandibel) 2,4 - 2,6 mm. b). Coptotermes travians Holmgren dengan ciri, jumlah ruas antena prajurit 13 - 15; panjang kepala prajurit 1,8 - 2,1 mm mandibel relatif pendek, kira-kira sepanjang setengah panjang kepala c). Coptotermes havilandi Holmgren (C. javanicus
Kemner) dengan ciri, jumlah ruas antena prajurit 15 - 18; panjang kepala prajurit 2,0 - 2,2. Mandibel lebih panjang dari pada C. travians d).
Coptotermes kalshoveni Kemner dengan ciri, jumlah ruas antena prajurit 13 - 14 panjang kepala prajurit 1,6 - 1,7 mm. Jenis ini merupakan yang terkecil di antara genus Coptotermes.
Pengendalian Rayap
Pengendalian rayap tanah di Indonesia telah banyak dilakukan dengan cara mengimpregnasikan bahan pengawet (termitisida) ke dalam kayu, melakukan penyemprotan ke dalam tanah (soil treatment), sistim pengumpanan dan kontak langsung. Yusuf (2001b), menyatakan bahwa sampai saat ini upaya pengendalian rayap yang populer di Indonesia adalah melalui penggunaan insektisida, baik metode perlakuan kayu maupun perlakuan tanah (soil treatment); dengan cara tersebut akan terbentuk rintangan kimiawi (chemical barrier) baik di kayu maupun tanah sekeliling bangunan.
Garam metal dan oksida, seperti merkuriklorida, copper sulphate, merkuri, zinc
oksida dapat efektif untuk 3-5 tahun. Chlorpyrifos, permethrin, bifenthrin, cypermethrin dan deltamethrin juga efektif, tetapi lebih mahal dan kegunaannya dibatasi untuk bangunan yang bernilai tinggi.
Pearce (1997) menyatakan bahwa, teknik pengumpanan lebih meng-untungkan karena tanah tidak lagi terkontaminasi oleh bahan kimia, dan dapat meringankan pekerjaan dari perlakuan yang intensif. Caranya yaitu menempatkan umpan yang tidak beracun dekat koloni rayap dan kemudian mengulangi penempatan umpan yang mengandung racun. Keefektifan umpan tergantung pada perilaku rayap, yang penting rayap harus dapat menemukan umpan dan dengan reaksi racun yang lambat rayap dapat menyebarkan ke koloninya. Hal tersebut dapat terlaksana jika umpan lebih menarik dari pada makanan di sekeli-lingnya. Gula, madu, penambahan jamur pelapuk, asam amino, sumber nitrogen bahkan feromon dapat meningkatkan laju konsumsi.
Yusuf (2001a), melakukan penelitian pengendalian terhadap rayap tanah
Coptotermes sp. dengan menggunakan chlorpenapyr pada berbagai konsentrasi dengan sistem pengumpanan, hasil penelitiannya menunjukan bahwa waktu aplikasi dan konsentrasi perlakuan sangat mempengaruhi mortalitas yang terjadi. Chlorpenapyr juga dapat diaplikasikan dengan metode duster (Yusuf, 2001b).
Perlakuan pada kayu yang juga penting adalah fumigasi, baik dengan
sulphuryl fluoride atau methyl bromides. Perlindungan museum, perpustakaan dan tempat penyimpanan dokumen cocok menggunakan cara fumigasi ini terutama untuk serangan rayap kayu kering. Selain ini juga digunakan
electroguns yang mengandalkan gas galleries. Metode lebih baru yang sedang dicobakan adalah membakar propane (gas metan) dekat kayu yang terinfeksi rayap dengan menaikan suhu sampai 66 oC; cara ini bermanfaat untuk perlakuan khusus pada rayap kayu kering (Pearce 1997).
9
Cendawan Entomopatogen
Cendawan adalah organisme multi seluler yang berfilamen dan memiliki khitin, khitosan, glukan dan mannan dalam dinding selnya. Klasifikasinya didasarkan pada produksi konidia atau spora, struktur morfologi, alat reproduksi, ciri-ciri koloni dan sifat hifanya (Lay & Hastowo 1992).
Cendawan entomopatogen pertama kali dilaporkan lebih dari 2000 tahun yang lalu, teridentifikasi di China pada cendawan Cordyceps (Ascomycota) yang menginfeksi larva Lepidoptera (Boucias & Pendland 1998). Carruthers dan Hurar 1990 dalam Oliveira et al. (2003) menyatakan bahwa cendawan entomopatogen merupakan cendawan yang dapat dimanfaatkan sebagai bahan pengendalian hayati penting untuk banyak serangga hama. Pengendalian hayati lebih berhasil bila dilengkapi dengan pemanfaatan cendawan entomopatogen.
Keragaman antar jenis cendawan entomopatogen sangat tinggi. Menurut klasifikasi yang dikemukakan oleh Ainsworth 1963 dalam Butt et al. (2001), cendawan terdiri dari dua Divisi yaitu Myxomycota dan Eumycota. Cendawan entomopatogen ditemukan pada Divisi Eumycota yang terdiri dari sub-divisi: Mastigomycotina, Zygomycotina, Ascomycotina, Basidiomycotina dan Deuteromycotina. Menurut Tanada dan Kaya (1993) Kebanyakan cendawan entomopatogen ditemukan pada sub-divisi Zygomycotina, klas Zygomycetes, ordo Entomophthorales; sub-divisi Ascomycotina, klas Pyrenomycetes, ordo Sphaeriales, klas Laboulbeniomycetes, ordo Laboulbeniales; dan pada sub-divisi Deuteromycotina, klas Hyphomycetes, ordo Moniliales.
Beberapa genus cendawan entomopatogen yang tergolong ke dalam sub-divisi Deuteromycotina, klas Hyphomycetes, ordo Moniliales dan famili Moniliaceae, misalnya: Aspergilus, Beauveria, Fusarium, Metarhizium, Paecilomyces dan Verticilium (Boucias & Pendland 1998).
cendawan patogen yang diisolasi dari satu jenis inang lebih virulen untuk inang tersebut dibandingkan dengan strain yang diisolasi dari inang yang lain. Seperti yang dikemukakan oleh Boucias dan Pendland (1998), cendawan B. bassiana
yang diisolasi dari lingkungan koloni rayap lebih tinggi virulensinya jika diinfeksikan terhadap rayap.
Boucias dan Pendland (1998) mengemukakan, cendawan entomopatogen dicirikan oleh kemampuannya untuk menempel dan menembus kutikula inang dan dapat tumbuh ke bahagian internal inang (hemocoel) dan mengkonsumsinya sehingga nutrisi di dalam hemolymph habis oleh pertumbuhan cendawan yang begitu cepat, sehingga menyebabkan inang akan mati. Di samping itu cendawan dapat menghancurkan jaringan lainnya atau dengan melepaskan zat beracun yang mengganggu perkembangan inang secara normal. Beberapa zat beracun (toxin) yang dihasilkan cendawan yang dapat membunuh serangga adalah: beauvericin oleh B. bassiana, Paecilomyces, Fusarium dan bassianolide oleh B. bassiana, cyclosporin A oleh B. bassiana, Verticillium, Fusarium, Tolypocladium dan oosporein oleh B. bassiana, asam oksalat oleh Beauveria brongniartii, destruxins oleh M. anisopliae dan Aspergillus ochraceus, cytochalasins oleh M. anisopliae, swainsonine oleh M. anisopliae, aflatoxins oleh Aspergillus, asam kojic oleh
Aspergilus flavus dan restrictocin oleh Aspergillus fumigatus.
Ferron 1981 di dalam Scholte et al. (2004), menyatakan bahwa di dalam studi histopathological pada jaringan elaterid yang diinfeksi M. anisopliae
memperlihatkan bahwa toxin (destruxin) membunuh serangga inang dengan merangsang atau memacu terjadinya kemerosotan jaringan serangga inang. Hal ini mengakibatkan keutuhan struktural membran hilang, kemudian terjadi dehidrasi sel akibat kehilangan cairan. Dalam hal ini memungkinkan terjadinya penyumbatan spiracles dan dapat menyebabkan kematian sebelum penyerbuan pada hemocoel terlihat nyata dan pembentukan tubuh hifa masih sedikit.
11
genetika dan perlakuan. Salah satu faktor yang berperan penting dalam keberhasilan penggunaan cendawan entomopatogen adalah stadia perkembangan serangga karena tidak seluruh stadia dalam perkembangan serangga rentan terhadap infeksi cendawan. Dari segi lingkungan, berbagai faktor lingkungan seperti radiasi matahari, suhu, kelembaban relatif, curah hujan dan tanah sangat mempengaruhi efikasi cendawan entomopatogen terhadap serangga hama. Semua faktor lingkungan saling berinteraksi, dan interaksi yang komplek dan dinamik ini menentukan efikasi cendawan (Inglis et al. 2001).
Di antara cendawan entomopatogen yang dimanfaatkan untuk mengendalikan rayap Coptotermes sp., Reticulitermes flavipes atau Odontotermes adalah M. anisopliae dan B. bassiana. Kedua jenis cendawan ini telah diuji keefektifannya oleh Zoberi 1995 dalam Bayon et al. (2000) di laboratorium dengan sistem pengumpanan dan kontak secara langsung. Percobaan ini mengkontaminasi rayap R. flavipes dengan M. anisopliae yaitu menempatkan konidia cendawan pada rayap pekerja. Hal ini menghasilkan 100% mortalitas dalam waktu 5 hari, dan 12 hari pada metode pengumpanan. Penelitian lainnya yaitu dengan cara pemindahan rayap kasta pekerja yang terkontaminasi sebagai vektor penyakit cendawan ke rayap yang sehat di dalam cawan petri. Dengan cara ini rayap yang sehat mati setelah 8 hari.
Dengan metode pengumpanan selembar kertas saring, Suzuki (1991) membuktikan keefektifan patogen M. anisopliae terhadap Coptotermes formosanus dan Reticulitermes speratus dengan hasilLT50 11 hari. Selain hal ini,
kertas terkontaminasi spora M. anisopliae juga berperan penting untuk laju mortalitas rayap Cryptotermes brevis (Nash & Moein 1997 dalam Bayon et al.
2000). Milner et al. (1996) menyatakan spesies cendawan M. anisopliae dan
tergantung pada temperatur. Viabilitas cendawan menurun pada temperatur tinggi dan virulensi cendawan menurun pada temperatur rendah.
BAB III
BAHAN DAN METODE
Penelitian ini dilakukan di Laboratorium Pengawetan Kayu UPT Balai Litbang Biomaterial Lembaga Ilmu Pengetahuan Indonesia (LIPI) dan Laboratorium Patologi Serangga Departemen Proteksi Tanaman Institut Pertanian Bogor (IPB), sejak Februari 2004 sampai dengan Desember 2005. Secara umum tahapan prosedur pelaksanaan diringkas pada Bab ini dan secara rinci dibahas pada bab-bab berikutnya.
Tahap Persiapan
Spesies Rayap yang Digunakan
Rayap yang digunakan terdiri dari kasta pekerja dan prajurit rayap tanah spesies Coptotermes gestroi Wasmann (Benson 2005) yang dipelihara di UPT Balai Litbang Biomaterial LIPI Cibinong, dan spesies Coptotermes curvignathus
Holmgren yang dipelihara di Laboratorium Biologi Hasil Hutan Pusat Studi Ilmu Hayati IPB.
Sumber Isolat
Isolat cendawan entomopatogen diperoleh dari serangga hama tanaman (inang) terinfeksi yaitu ulat krop kubis (Crocidolomia pavonana F.), ulat grayak (Spodoptera litura F.), penghisap polong kedele (Riptortus linearis L.), walang sangit(Leptocorisa oratorius F), rayap tanah (C. curvignathus), tanah dan pasir.
Prosedur Isolasi
Dalam tabung reaksi, sumber isolat cendawan entomopatogen ditambah air steril yang mengandung 0,05% triton X-100 dan diaduk selama 5 menit sehingga terbentuk suspensi konidia. Suspensi konidia tersebut diambil 0,5 ml, kemudian ditambahkan dengan 4,5 ml akuades steril di dalam tabung reaksi. Suspensi sebanyak 0,1 ml diinokulasikan pada media Saboraud Dextrose Agar with Yeast extract (SDAY) di dalam cawan petri. Komposisi media SDAY adalah dekstrosa 10 g, pepton 2,5 g, ekstrak khamir 2,5 g, agar-agar 20 g dalam akuades 1 liter yang mengandung 250 ppm chloramphenicol (Samuels et al. 2002), dan diinkubasi pada suhu 24 0C dan kelembaban relatif 95% selama 4-6 hari. Koloni yang membesar dengan bentuk berbeda atau warna berbeda pada media biakan, diambil dan masing-masing koloni tersebut diinokulasi secara terpisah pada media SDAY baru. Kultur murni didapatkan dengan suksesi inokulasi suatu koloni pada media SDAY. Kemudian stok kultur isolat disimpan pada suhu 4 0C sampai waktu penggunaan (Sudiyani et al. 2002).
Prosedur Identifikasi
Identifikasi dilakukan secara visual terhadap pertumbuhan koloni isolat pada media SDAY dalam cawan petri. Untuk pengamatan mikroskopik terlebih dahulu isolat tersebut ditumbuhkan pada kaca objek cekung dengan metode slide culture
(Becnel 1997). Identifikasi cendawan mengacu pada prosedur yang diurai oleh Barneet dan Hunter (1972), Domsch et al. (1980), Singh et al. (1991) dan Ellis (1993), yaitu dengan melihat ciri morfologi khas yang dimiliki oleh masing-masing cendawan.
Persiapan Suspensi Konidia
Sebelum digunakan, isolat hasil isolasi dibiakan kembali pada media SDAY di cawan petri berdiameter 9 cm dan diinkubasi dalam inkubator dengan suhu 24 0
15
konidia/ml, 5.105 konidia/ml, 106 konidia/ml, 5.106 konidia/ml dan 107 konidia/ml untuk uji keefektifan (bioassay) terhadap rayap, c) LC95 dari cendawan terseleksi pada uji keefektifan untuk uji metode kontak dan umpan.
Uji Tapis dan Keefektifan Beberapa Spesies Cendawan Entomopatogen Terhadap Rayap Tanah Coptotermes gestroi Wasmann
Suspensi konidia dari masing-masing isolat disiapkan seperti diterangkan sebelumnya. Pada setiap unit percobaan sebanyak 20 ekor rayap pekerja dan 2 ekor prajurit C. gestroi dicelupkan ke dalam suspensi konidia selama 4 detik sesuai perlakuan dan langsung ditempatkan pada cawan petri Ø 9 cm yang telah diberi alas kertas saring sebagai sumber makanan rayap. Seluruh unit percobaan dipelihara pada kondisi gelap pada suhu ruangan dan mortalitas rayap dihitung setiap hari selama 6 hari setelah inokulasi.
Metode Kontak dan Umpan
Kontak (Contact method)
Suspensi konidia cendawan disiapkan seperti diterangkan sebelumnya. Pada setiap unit percobaan 50 ekor rayap pekerja dan 5 ekor prajurit dicelupkan ke dalam LC95 suspensi cendawan Metarhizium brunneum Petch, kemudian ditempatkan pada cawan petri Ø 9 cm yang telah diberi alas kertas saring sebagai sumber makanan. Nilai LC95 diketahui dari percobaan sebelumnya (uji keefektifan).
Umpan (Baiting method)
Uji Aplikasi dengan Penularan di Laboratorium
Uji Penularan di dalam koloni rayap tanah C. gestroi
Dalam percobaan ini sebagian populasi rayap (vektor) diinokulasi dengan cendawan pada konsentrasi LC95. Persentase populasi vektor yang digunakan adalah 10%, 20%, 30%, 40%, 50% terhadap populasi total. Populasi total yang digunakan adalah 20 ekor rayap pekerja dan dua ekor rayap prajurit. Cendawan entomopatogen yang digunakan adalah isolat yang menunjukkan patogenisitas tinggi pada uji tapis. Vektor dipelihara bersama-sama dengan rayap sehat pada unit percobaan (cawan petri Ø 9 cm) yang telah dialasi kertas saring sebagai sumber makanan. Pengamatan dilakukan setiap hari sampai 2 minggu.
Uji Penularan di dalam koloni rayap tanah C. curvignathus
Pada penelitian ini digunakan spesies cendawan entomopatogen dan proporsi vektor (%) terseleksi pada uji penularan koloni rayap tanah C. gestroi.
17
III
Koleksi Lab. Peremajaan
Pemeliharaan Rayap Koleksi
Cendawan
Nile blue 0,05%
Perbanyakan Diisolasi dari Inang
I
Isolat murni
Pemurnian
Suspensi (107 konidium/ml )
Variabel: Mortalitasi, Sporulasi Rayap uji Variabel: Identifikasi Rayap Vektor: 10% 20% 30% 40% 50%
Keragaman isolat (spesies)
Isolat (spesies) terpilih
Variabel: Mortalitas
Lethal Time & Metode terpilih
Variabel: Mortalitas
Spesies cendawan entomopatogen dengan LC, metode dan % vektor efektif untuk pengendalian rayap tanah
C. gestroi dan C curvignathus di Laboratorium
III
II
Keterangan:
1. Keragaman spesies atau isolat cendawan entomopatogen yang digunakan:
diisolasi dari sumber inang di alam dan koleksi Laboratorium Patologi Serangga Departemen HPT Fak. Pertanian IPB
2. I, II & III: Tahapan penelitian ke I, II & III
3. Vektor: Rayap terkontaminasi cendawan entomopatogen
Gambar 3.1. Diagram cakupan penelitian proses pemanfaatan cendawan entomopatogen sebagai patogen untuk pengendalian rayap tanah
C. gestroi dan C. curvignathus di laboratorium
Variabel: Karakterisasi fisiologi cendawan
Variabel: Mortalitas Metode:
Kontak dan umpan Kerapatan
0, 10 5, 5.10 5, 15.106,
107konidium/ml
Analisis Data
Untuk setiap tahapan penelitian, data hasil penelitian dianalisis berdasarkan rancangan penelitian sebagai berikut:
1. Tahap penelitian I, data hasil penelitian variabel mortalitas rayap
C. gestroi dan sporulasi in vivo dengan perlakuan 16 isolat cendawan entomopatogen, karakterisasi fisiologis cendawan (viabilitas, diameter koloni dan sporulasi in vitro) spesies cendawan entomopatogen
Metarhizium anisopliae (Metsch.) Sorok., Metarhizium brunneum Petch., Beauveria bassiana (Bals) Vuill., Fusarium oxysporum Link., Aspergillus flavus Link., Myrothecium roridum Tode EXFR dan kontrol dianalisis berdasarkan Rancangan Acak Lengkap satu faktor dengan uji ragam (ANOVA) dan dilanjutkan dengan uji Duncan’s Multiple Range Test (Steel & Torrie 1993).
2. Tahap penelitian II, untuk mendapatkan korelasi antara masing-masing spesies cendawan (M. anisopliae, M. brunneum, B. bassiana, F. oxysporum dan A. flavus) dengan tingkatan kerapatan konidia (105, 5.105,
106, 5.106, 107 konidia/ml dan kontrol) terhadap mortalitas rayap
C. gestroi, lethal concentrations (LC) untuk uji keefektifan berbagai spesies cendawan dan lethal time (LT) pada uji metode kontak dan umpan adalah bersasarkan analisis probit (Finney 1971).
3. Tahap penelitian III, untuk mendapatkan korelasi antara masing-masing spesies cendawan (M. anisopliae, M. brunneum, B. bassiana dan F.
oxysporum ) dengan proporsi vektor (10%, 20%, 30%, 40%, 50% dan
BAB IV
ISOLASI, IDENTIFIKASI DAN UJI TAPIS CENDAWAN
ENTOMOPATOGEN DARI BERBAGAI INANG DI ALAM
DAN PATOGENISITASNYA TERHADAP RAYAP TANAH
COPTOTERMES GESTROI WASMANN
Abstrak
Cendawan entomopatogen dari berbagai inang atau inokulum di alam yaitu dari ulat krop kubis (Crocidolomia pavonana F.), ulat grayak (Spodoptera litura
F.), walang sangit (Leptocorisa oratorius F.), penghisap polong (Riptortus linearis L.), rayap tanah (Coptotermes curvignathus Holmgren.), tanah dan pasir telah diisolasi dan identifikasi untuk menentukan patogenisitasnya terhadap rayap tanah Coptotermes gestroi Wasmann, kemudian masing-masing isolat ditempatkan pada suhu 4 0C. Sebelum digunakan, semua isolat dikulturkan kembali pada media agar Sabouraud Dextrose Agar with Yeast Extract (SDAY) dan data yang diperoleh dianalisis berdasarkan Rancangan Acak Lengkap satu faktor dengan uji sidik ragam. Perbedaan antara isolat diuji lanjut menggunakan Duncan's Multiple Range Test. Hasil isolasi mengindikasikan keragaman spesies cendawan lebih tinggi pada inang yang berasal dari hama tanaman terinfeksi dibandingkan dari sumber inokulum yang berasal dari tanah dan pasir, setelah diidentifikasi beberapa spesies cendawan yang ditemukan adalah: Beauveria bassiana (Bals.) Vuill., Metarhizium anisopliae (Metsch.) Sorok, Metarhizium
brunneum Petch, Paecilomyces fumosoroseus (Wize) Brown dan Smith,
Penicillium citrinum Thom. Verticilium lecanii (Zimmermann), Aspergillus flavus Link., Myrothecium roridum Tode ExFR, Fusariumoxysporum Link., dan
Fusarium solani Link., spesies B. bassiana paling dominan. Uji patogenisitas mengindikasikan bahwa umumnya isolat bersifat patogen terhadap rayap dan dapat menyebabkan mortalitas lebih dari 60% setelah 6 hari inokulasi. Mortalitas rayap tertinggi disebabkan oleh M. anisopliae dari inang penghisap polong, M. brunneum dari pasir, M. roridum dari tanah, B. bassiana dari inang walang sangit, F.oxysporum dari inang ulat grayak, dan A.flavus dari inang rayap tanah yaitu dapat menyebabkan mortalitas rayap 100%, dan diikuti oleh kemampuan bersporulasi secara in vivo yang cukup tinggi (76,25% - 96,25%) kecuali spesies
M. anisopliae dan M. roridum. Kemudian isolat-isolat terseleksi disiapkan untuk dipelajari karakterisasi fisiologisnya, hasilnya mengindikasikan: kemampuan berkecambah tertinggi oleh M. brunneum dari pasir, diameter koloni tertinggi oleh F. oxysporum dari inang ulat grayak dan kemampuan bersporulasi secara in vitro tertinggi oleh B. bassiana dari inang walang sangit.
Pendahuluan
Cendawan entomopatogen termasuk genera cendawan yang berasosiasi
dengan serangga dan beberapa spesies arthropoda lainnya (seperti laba-laba dan
kutu) dengan berbagai cara, yaitu sebagai saprofit, kommensalistik, parasit atau
patogen (Boucias & Pendland 1998). Di pertanian dan perkebunan di Indonesia
juga banyak ditemukan serangga terinfeksi oleh cendawan entomopatogen.
Diharapkan cendawan tersebut dapat diisolasi dan dibiakkan pada media sintetik
untuk dimanfaatkan sebagai agens pengendalian rayap secara hayati. Untuk
tujuan ini diperlukan koleksi dan uji tapis cendawan entomopatogen dari berbagai
inang atau sumber inokulum di alam untuk mengetahui tingkat keragaman
spesies dan keefektifannya terhadap rayap. Menurut Keller dan Zimmermann
(1989), cendawan entomopatogen hanya dapat menginfeksi satu atau beberapa
jenis serangga saja, karena jenis serangga secara umum jarang ditemukan
mempunyai tingkat kerentanan yang serupa.
Di samping hal tersebut juga perlu dipelajari kemampuan cendawan
bersporulasi secara in vivo dan in vitro serta informasi tentang karakter fisiologis
lainnya. Hal ini penting dilakukan karena cendawan entomopatogen bersifat
spesifik dalam hubungannya dengan inang dan potensinya untuk dapat
diperbanyak secara massal, serta dapat tersebar luas setelah bersporulasi pada
inang sasaran di dalam koloni. Menurut Behle et al. (1999), cendawan
entomopatogen mempunyai keuntungan-keuntungan dibanding migro organisme
patogen lainnya diantaranya: cendawan cenderung mempunyai sebaran inang
yang lebih luas, beberapa cendawan entomopatogen menghasilkan spora yang
toleran terhadap proses pengawetan lewat pengeringan dan menghasilkan
stabilitas yang bagus dalam masa penyimpanan.
Pada penelitian pendahuluan, penggunaan cendawan entomopatogen yang
diperoleh dari hama tanaman dengan kerapatan konidia 108 konidia/ml dapat
menyebabkan mortalitas rayap C. gestroi 6 hari setelah inokulasi. Pada penelitian
berikut, dicoba penggunaan cendawan entomopatogen dari berbagai inang atau
21
dengan tujuan untuk mendapatkan isolat cendawan entomopatogen yang efektif
dimanfaatkan sebagai pengendali rayap C. gestroi.
Bahan dan Metode
Penelitian ini telah dilakukan di Laboratorium Pengawetan Kayu UPT Balai
Litbang Biomaterial Lembaga Ilmu Pengetahuan Indonesia (LIPI) Cibinong dan
Laboratorium Patologi Serangga Departemen Proteksi Tanaman Fakultas
Pertanian Institut Pertanian Bogor (IPB).
Jenis Rayap yang Digunakan
Rayap yang digunakan terdiri dari kasta pekerja dan kasta prajurit spesies
rayap tanah C. gestroi (Benson 2005) yang dipelihara di UPT Balai Litbang
Biomaterial LIPI Cibinong selama 2 tahun.
Persiapan Isolat Cendawan
Sumber isolat cendawan entomopatogen dikoleksi dan diisolasi dari hama
tanaman terinfeksi, tanah dan pasir mengacu pada Bab III.
Prosedur Isolasi
Prosedur isolasi telah dijelaskan pada Bab III.
Prosedur Identifikasi
Prosedur identifikasi telah dijelaskan pada Bab III.
Prosedur Perbanyakan
Perbanyakan dilakukan pada media SDAY dengan cara menginokulasikan
konidia kultur murni cendawan di dalam cawan petri. Biakan diinkubasikan
selama 3 minggu dalam inkubator dengan suhu 24 0C dan kelembaban relatif
95%. Untuk menjaga tingkat virulensinya sebelum perlakuan cendawan
yang terinfeksi cendawan dibiarkan selama 2 minggu sampai bersporulasi (Ansari
et al. 2004), kemudian cendawan dari tubuh rayap diisolasi lagi sampai
didapatkan lagi kultur murni. Kultur murni tersebut dibiarkan bersporulasi
sempurna kurang lebih 3 minggu sehingga siap digunakan sebagai bahan uji.
Pada percobaan ini cendawan yang digunakan untuk pengujian adalah pada
perbanyakan kedua (F2). Keberhasilan peremajaan ditentukan oleh berhasilnya
cendawan menginfeksi dan bersporulasi pada tubuh rayap.
Penyediaan Suspensi Konidia
Suspensi konidia disiapkan dengan menambahkan 2 ml akuades steril yang
telah mengandung 0,05% Triton X-100 ke dalam cawan petri berisi biakan
cendawan yang telah berumur 3 minggu. Cawan digoyang-goyang, kemudian
dengan bantuan kuas kecil steril konidia dapat terlepas. Konidia tersebut disaring
dengan kain kasa dan dilakukan 4 kali pengenceran, selanjutnya dilakukan
pengenceran dengan air sampai diperoleh konsentrasi yang diinginkan dengan
kerapatan sebagai berikut: a). 107 konidia/ml untuk uji patogenisitas dan uji
sporulasi in vivo, b). 106 konidia/ml untuk uji daya kecambah dan diameter
koloni, c). 105 konidia/ml untuk uji sporulasi in vitro. Konidia dihitung dengan
menggunakan haemocytometer.
Uji Patogenisitas
Suspensi konidia masing-masing isolat disiapkan seperti diterangkan di
atas. Sebanyak 80 ekor kasta pekerja dan delapan ekor kasta prajurit rayap C.
gestroi dicelupkan kedalam 0,50 ml suspensi konidia yang telah diaduk. Kontrol
hanya dicelupkan dalam larutan 0,05% Triton X-100. Kertas saring Whatman no.
40 ditempatkan kedalam cawan petri sebagai sumber makanan kemudian rayap
(20 ekor pekerja dan dua ekor prajurit) yang telah diinokulasi cendawan
ditempatkan ke dalamnya. Semua perlakuan dipelihara pada ruangan dengan
kondisi gelap dan mortalitas dihitung setiap hari selama satu minggu. Rayap yang
mati diinkubasi pada suhu 24 0C dan kelembaban relatif 95% selama 5-7 hari
untuk melihat sporulasi cendawan pada tubuh rayap yang telah mati. Percobaan
23
Sporulasi in Vivo
Cendawan yang menyerang serangga akan bersporulasi yaitu miselianya
tumbuh di permukaan tubuh rayap yang mati. Data untuk pengujian sporulasi in
vivo diambil dari data rayap yang mati pada uji patogenisitas yang diinkubasi
pada suhu 24 0C dan RH 95% selama 5-7 hari. Setiap perlakuan diulang 4 kali.
Persentasi sporulasi dihitung dengan rumus:
Sporulasi = Rayap terkolonisasi X 100% Jumlah rayap perlakuan
Karakterisasi Fisiologi Cendawan Entomopatogen in Vitro
Evaluasi daya kecambah konidia
Pengamatan daya kecambah konidia menggunakan metode yang dilakukan
oleh Junianto dan Sukamto 1995 dalam Trizelia (2005). Media SDAY (Ø 0,5 cm
tebal 1-2 mm) yang telah ditetesi suspensi konidia berkerapatan 106 konidia/ml
diletakkan di atas objek gelas steril, kemudian dimasukkan kedalam cawan petri
dan diinkubasi pada suhu 24 0C selama 12 - 24 jam. Masing-masing perlakuan
diulang 4 kali. Pengamatan dilakukan dibawah mikroskop dengan perbesaran 400
kali. Persentase konidia yang berkecambah dihitung dari 100 konidia. Konidia
dinyatakan telah berkecambah apabila tabung kecambah (germ tubes) telah
muncul lebih panjang dari diameter konidia.
Diameter koloni
Media SDAY yang telah ditumbuhi miselia masing-masing isolat berumur
5 hari dengan dimeter 0,8 cm ditumbuhkan pada media SDAY baru di dalam
cawan petri dan diinkubasi dalam inkubator dengan suhu 24 0C. Diameter koloni
dari masing-masing isolat diukur setelah hari ke 15.
Sporulasi in vitro
Untuk menghitung sporulasi masing-masing isolat pada media SDAY,
disiapkan kerapatan suspensi konidia cendawan 105 konidia/ml. Suspensi konidia
cawan petri (Ø 9 cm), dan diinkubasi selama 15 hari pada suhu 24 0C. Kemudian
biakan cendawan dimasukkan ke dalam wadah erlenmeyer dan ditambahkan 40
ml aquades steril, dikocok dengan vortex selama 5 menit, disaring dan dilakukan
pengenceran sampai 4 kali. Kerapatan konidia dihitung menggunakan
haemocytometer dan rata-rata konidia untuk setiap cawan petri dibandingkan
antar isolat.
Analisis Data
Data mortalitas, sporulasi in vivo dan karakterisasi fisiologis in vitro di
analisis berdasarkan Rancangan Acak Lengkap (Completely Randomize Design)
satu faktor (keragaman isolat atau spesies cendawan entomopatogen yang terdiri
dari 16 isolat untuk uji mortalitas dan sporulasi in vivo, 6 spesies untuk uji
karakterisasi fisiologis in vitro) dengan 4 x ulangan menggunakan analisis ragam
(ANOVA), kemudian dilanjutkan dengan uji Duncan's Multiple Range Test.
Bentuk umum dari persamaannya adalah sebagai berikut:
Dimana: i = 1,2,....17, t dan j= 1, 2, ....4, r
Yij = pengamatan pada perlakuan ke-i dan ulangan ke-j
µ = rataan umum
i = pengaruh perlakuan ke-i
ij = pengaruh acak pada perlakuan ke-i ulangan ke-j
Hasil dan Pembahasan
Isolasi dan Identifikasi
Hasil isolasi cendawan entomopatogen dari berbagai inang atau sumber
inokulum di alam (Gambar 4.1) mengindikasikan keragaman spesies cendawan
entomopatogen lebih tinggi pada inang yang berasal dari hama tanaman (ulat
krop kubis, ulat grayak, penghisap polong, walang sangit dan rayap tanah
sebanyak 81%) dibandingkan dengan yang berasal dari tanah (13%) dan pasir
25
entomopatogen lebih mudah dilakukan dengan cara mengisolasi dari serangga
inang yang terinfeksi di alam dibandingkan dengan mengisolasi dari sumber
lainnya (tanah dan pasir). Diperkirakan spesies cendawan yang ada pada inang
yang berasal dari hama tanaman umumnya bersifat sebagai cendawan
entomopatogen. Menurut MacLeod dan Muller-Kogler 1973 dalam Butt et al.
(2001), serangga inang dari cendawan entomopatogen dijumpai pada lebih dari
32 famili yang tersebar pada ordo Hemiptera, Homoptera, Diptera, Lepidoptera,
Coleoptera, Orthoptera, dan Hymenoptera. Beberapa spesies mempunyai
rentangan inang yang luas, dan yang lainnya terbatas pada satu spesies atau
[image:42.612.164.421.270.415.2]terbatas pada kelompok spesies tertentu saja.
Gambar 4.1. Persentase isolat cendawan entomopatogen yang berhasil diisolasi dari berbagai sumber inokulum di alam.
Cendawan entomopatogen dari sumber inokulum tanah dan pasir
mempunyai keragaman spesies yang lebih rendah. Hal ini dimungkinkan karena
cendawan entomopatogen selain hidup sebagai patogen obligat juga banyak yang
hidup sebagai patogen fakultatif yaitu disamping dapat meneruskan siklus
hidupnya sebagai patogen pada serangga inang juga mampu bertahan hidup
sebagai sapropit pada berbagai media di alam. Tanada dan Kaya (1993)
menyatakan bahwa beberapa cendawan entomopatogen hidup sebagai patogen
obligat yang siklus hidupnya selalu pada serangga inang namun kebanyakan
cendawan entomopatogen juga sebagai patogen fakultatif dan mampu hidup
tanpa inang dan melanjutkan siklus hidupnya sebagai sapropit
Menurut Keller dan Zimmermann (1989) cendawan entomopatogen juga
dapat dikoleksi dari tanah dengan menggunakan serangga umpan. Metode ini
terbukti sangat bermanfaat untuk mendeteksi cendawan entomopatogen Serangga
Hama 81%
Tanah 13%
khususnya untuk mempelajari sejarah penyebarannya. Walaupun tanah
merupakan habitat yang sangat menguntungkan untuk interaksi serangga dan
cendawan entomopatogen, hanya sedikit spesies cendawan entomopatogen yang
ditemukan pada tanah. Beberapa spesies cendawan penting yang ditemukan pada
tanah tercatat sebagai genera: Conidiobolus, Beauveria, Metarhizium dan
Paecilomyces.
Lebih lanjut dinyatakan keberhasilan cendawan entomopatogen di dalam
tanah telah berkembang dengan melakukan adaptasi khusus, dimana siklus
kehidupan cendawan entomopatogen terdiri dari fase parasit dan sapropit. Bila
serangga terinfeksi cendawan mati dan secara umum siklus hidup cendawan akan
berahir bila fase vegetatif atau organ reproduksi seksual terbentuk di luar inang.
Namun fase kehidupan selanjutnya sebagai sapropit akan mengkolonisasi inang
mati dan untuk sementara waktu berhenti pada pembentukan pseudosclerotium;
tingkatan dormansi yang memungkinkan cendawan bertahan pada kondisi yang
tidak menguntungkan. Jika faktor eksternal telah menguntungkan, hifa akan
muncul lewat kutikula serangga.
Beberapa spesies cendawan seperti Paecilomyces spp., B. bassiana, B.
brongniartii atau Cordyceps spp. memproduksi untaian hifa, synnemata atau
stromata di luar serangga inang. Elemen-elemen hifa ini sebagai adaptasi
morfologi terhadap kondisi tanah yang memungkinkannya menginfeksi inang
baru.
Hasil isolasi cendawan entomopatogen dari masing-masing inang atau
sumber inokulum di alam dikoleksi untuk selanjutnya diidentifikasi berdasarkan
warna, pertumbuhan secara in vivo dan in vitro serta bentuk organ seksual
masing-masing spesies. Berdasarkan hasil identifikasi pada penelitian ini
ditemukan 16 isolat (10 spesies) (Gambar 4.2 dan Table 4.1).
Keragaman antar spesies cendawan entomopatogen sangat luas sekali.
Cendawan terdiri dari dua Divisi yaitu Myxomycota dan Eumycota. Cendawan
entomopatogen ditemukan pada Divisi Eumycota yang terdiri dari sub-divisi:
Mastigomycotina, Zygomycotina, Ascomycotina, Basidiomycotina dan
Deuteromycotina. Umumnya mikroorganisme ini ada pada semua habitat tingkat
27
Pendland (1998) menyatakan beberapa genus cendawan entomopatogen yang
tergolong ke dalam divisi Eumycota, sub-divisi Deuteromycota, klas
Hyphomycetes dan ordo Moniliales adalah: Aspergilus, Beauveria, Fusarium,
Metarhizium, Paecilomyces dan Verticilium.
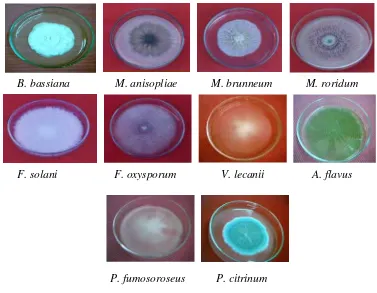
B. bassiana M. anisopliae M. brunneum M. roridum
F. solani F. oxysporum V. lecanii A. flavus
[image:44.612.131.508.180.473.2]P. fumosoroseus P. citrinum
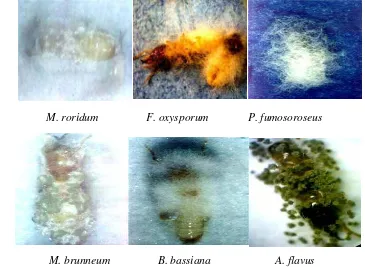
Gambar 4.2. Koloni cendawan entomopatogen dari konidia tunggal ber-umur 3 minggu pada media SDAY kecuali F. oxysporum (13 hari)
Spesies B. bassiana adalah spesies cendawan entomopatogen yang paling
dominan ditemukan. Menurut Scholte et al. (2004), cendawan entomopatogen
B. bassiana mempunyai sebaran inang yang luas dan mudah diperbanyak secara
in vitro pada media sintetik, penyebarannya hampir di semua lokasi di dunia dan
mempunyai spesies serangga inang lebih banyak dibandingkan spesies cendawan
entomopatogen lainnya; kebanyakan inangnya berasal dari ordo Lepidoptera,
Coleoptera, Hemiptera, Diptera dan Hymenoptera.
Spesies B. bassiana menunjukkan pertumbuhan yang tidak cepat tetapi
dan bewarna putih, cendawan ini menginfeksi rayap dengan penyebaran yang
tidak teratur, kemudian mengalami penyempurnaan yang tidak menyebar rata.
Setelah kematian inang konidiofora tumbuh keluar dari tubuh rayap dan diiringi
dengan munculnya konidia.
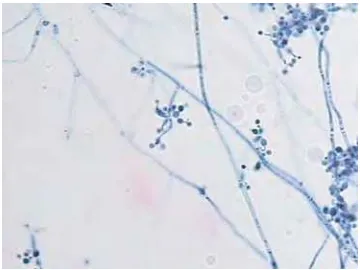
Barron (1968) menjelaskan tentang deskripsi dari B. bassiana sebagai
berikut: konidiofora tidak begitu jelas; sel sporogenous sympodulae, muncul
langsung dari hipa vegetatif, sederhana, hyaline - sub hyaline, secara berulang
menghasilkan kuntum konidia berkelompok atau zigzag, terdiri dari satu sel basal
yang sering mengembung, dan menghasilkan sympodulospores pada suksessi
acropetal; muncul spora pada ujung, seperti rachis, kadang-kadang berliku; spora
[image:45.612.105.557.343.678.2]sangat kecil, bundar atau oval, hyaline - sub hyaline (Gambar 4.3)
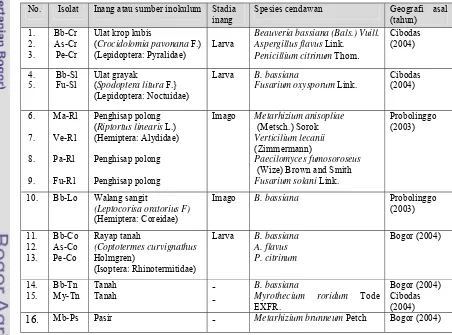
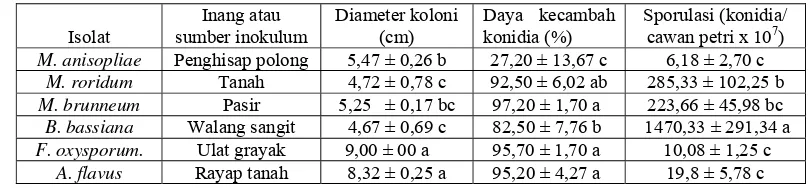
Tabel 4.1 Cendawan entomopatogen yang ditemukan pada berbagai inang atau sumber inokulum di alam
No. Isolat Inang atau sumber inokulum Stadia inang
Spesies cendawan Geografi asal
(tahun) 1. 2. 3. Bb-Cr As-Cr Pe-Cr
Ulat krop kubis
(Crocidolomia pavonana F.) (Lepidoptera: Pyralidae)
Larva
Beauveria bassiana (Bals.) Vuill. Aspergillus flavus Link.
Penicillium citrinum Thom.
Cibodas (2004) 4. 5. Bb-Sl Fu-Sl Ulat grayak
(Spodoptera litura F.} (Lepidoptera: Noctuidae)
Larva B. bassiana
Fusarium oxysporum Link.
Cibodas (2004) 6. 7. 8. 9. Ma-Rl Ve-Rl Pa-Rl Fu-Rl Penghisap polong (Riptortus linearis L.) (Hemiptera: Alydidae)
Penghisap polong
Penghisap polong
Imago Metarhizium anisopliae
(Metsch.) Sorok
Verticilium lecanii
(Zimmermann)
Paecilomyces fumosoroseus
(Wize) Brown and Smith
Fusarium solani Link.
Probolinggo (2003)
10. Bb-Lo Walang sangit
(Leptocorisa oratorius F)
(Hemiptera: Coreidae)
Imago B. bassiana Probolinggo
(2003) 11. 12. 13. Bb-Co As-Co Pe-Co Rayap tanah (Coptotermes curvignathus Holmgren) (Isoptera: Rhinotermitidae)
Larva B. bassiana A. flavus P. citrinum Bogor (2004) 14. 15. Bb-Tn My-Tn Tanah
Tanah - -
B. bassiana
Myrothecium roridum Tode EXFR.
Bogor (2004) Cibodas (2004)
29
Isolat lainnya yang diisolasi dari inang atau sumber inokulum di alam
seperti terlihat pada Tabel 4.1. juga diidentifikasi berdasarkan bentuk organ
seksual, warna massa konidia secara in vitro dan in vivo, dan tipe
[image:46.612.235.415.185.320.2]pertumbuhannya (Deskripsi selengkapnya pada Lampiran 1).
Gambar 4.3. Cendawan B. bassiana pada media SDAY dengan perbesaran 1000 x
Patogenisitas dan Virulensi
Tingkat patogenisitas antar spesies cendawan entomopatogen dan tingkat
virulensi antar isolat di dalam satu spesies cendawan yang ditemukan pada
penelitian ini umumnya berbeda nyata pada uji DUNCAN pada tingkat
keragaman 5%. Spesies cendawan M. anisopliae dari inang penghisap polong,
M. brunneum dari pasir, M. roridum dari tanah, B. bassiana dari inang walang
sangit, F. oxysporum dari ulat grayak, dan A. flavus dari rayap tanah dapat
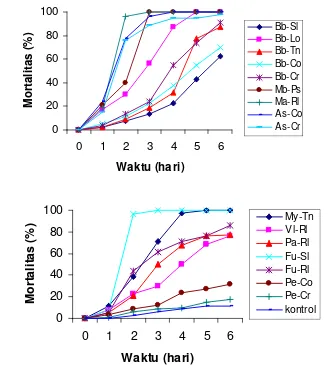
menyebabkan mortalitas 100% setelah 6 hari inokulasi (Gambar 4.4). Hal ini
berarti beberapa isolat cendawan entomopatogen bersifat sangat patogen dan
berpotensi dijadikan sebagai agens hayati untuk pengendalian rayap tanah
C. gestroi.
Perbedaan tingkat patogenisitas antar spesies dan perbedaan virulensi antar
isolat cendawan entomopatogen diperkirakan disebabkan oleh perbedaan sifat
dasar internal (genetik) antar spesies dan perbedaan sumber inang asal isolat.
Selain hal ini juga disebabkan oleh pengaruh lingkungan sebagai faktor eksternal
yang dapat berpengaruh terhadap kemampuan cendawan tumbuh dan
0 20 40 60 80 100
0 1 2 3 4 5 6
Waktu (hari) M o rt a lit a s ( % ) Bb-Sl Bb-Lo Bb-Tn Bb-Co Bb-Cr Mb-Ps Ma-Rl As-Co As-Cr
0
20
40
60
80
100
0
1
2
3
4
5
6
Waktu (hari)
M
o
rt
a
lit
a
s
(
%
)
My-TnVl-RlPa-Rl Fu-Sl Fu-Rl Pe-Co Pe-Cr kontrol
Tanada dan Kaya (1993) biasanya cendawan menyebabkan mortalitas dengan
satu atau lebih cara seperti: defisiensi nutrisi, menyerang dan merusak jaringan,
dan melepaskan toksin. Beberapa di antaranya bersifat virulen dan membunuh
serangga dalam waktu yang singkat dan yang lainnya menghasilkan infeksi
kronik yang lama.
[image:47.612.145.473.186.557.2]
Gambar 4.4. Laju mortalitas rayap C. gestroi oleh cendawan entomopatogen (107 konidia/ml) dari berbagai inang 6 hari setelah inokulasi (kontrol 11,25%).
Keterangan:
31
Isolat cendawan entomopatogen yang ditemukan dari berbagai inang
umumnya bersifat patogen terhadap rayap, dan dapat menyebabkan mortalitas
lebih dari 60%. Yoshimura dan Takahashi (1998), menjelaskan bahwa
penggunaan cendawan entomopatogen sebagai pengendalian rayap telah 25 tahun
lebih menjadi target penelitian dan banyak spesies cendawan telah diuji tingkat
patogenisitasnya terhadap rayap. Setelah tahun 1960-an banyak peneliti memulai
investigasi patogenisitas cendawan terhadap rayap menggunakan A. flavus,
Absidia coerulea Bainier, B. bassiana, Entomophthora sp. M. anisopliae,
Conidiobolus coronatus dan Penicillium sp.
Setiap spesies cendawan entomopatogen mempunyai sifat dan kemampuan
spesifik untuk tumbuh dan berkembang pada rayap. Perbedaan ini juga terlihat
pada karakterisasi fisiologisnya secara in vivo dan in vitro terutama pada
kemampuan berkecambah, laju pertumbuhan koloni dan konidiogenesis (Tabel
4.2). Diduga setiap spesies juga menghasilkan jenis metabolit sekunder (toxin)