UIN SYARIF HIDAYATULLAH JAKARTA
UJI AKTIVITAS EKSTRAK ETANOL 96% DAUN
SAMBILOTO (Andrographis paniculata (Burm.f.) Nees)
TERHADAP KUALITAS SPERMA PADA TIKUS
JANTAN GALUR SPRAGUE-DAWLEY SECARA IN
VIVO DAN AKTIVITAS SPERMISIDAL SECARA IN
VITRO
SKRIPSI
NURHAFIZA
1111102000059
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
JAKARTA
UIN SYARIF HIDAYATULLAH JAKARTA
UJI AKTIVITAS EKSTRAK ETANOL 96% DAUN
SAMBILOTO (Andrographis paniculata (Burm.f) Nees)
TERHADAP KUALITAS SPERMA PADA TIKUS
JANTAN GALUR SPRAGUE-DAWLEY SECARA IN
VIVO DAN AKTIVITAS SPERMISIDAL SECARA IN
VITRO
SKRIPSI
Diajukan sebagai salah satu syarat memperoleh gelar Sarjana Farmasi
NURHAFIZA
1111102000059
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
JAKARTA
Nama : Nurhafiza Program Studi : Farmasi
Judul : Uji Aktivitas Ekstrak Etanol 96% Daun Sambiloto
(Andrographis paniculata (Burm.f.) Nees) Terhadap Kualitas Sperma Pada Tikus Jantan Galur Sprague-Dawley Secara In Vivo dan Aktivitas Spermisidal Secara In Vitro
Daun sambiloto (Andrographis paniculata (Burm.f.) Nees) dilaporkan mempunyai aktivitas sebagai agen antifertilitas. Penelitian ini merupakan penelitian eksperimental. Ekstrak etanol 96% daun sambiloto (Andrographis paniculata (Burm.f.) Nees) diberikan secara oral selama 48 hari yang terdiri dari 25 ekor tikus jantan galur Sprague-Dawley dan dibagi menjadi lima kelompok yaitu kelompok kontrol (Tween 80 2%), kelompok perlakuan dosis 100, 200, dan 400 mg/kg BB serta satu kelompok untuk uji spermisidal secara in vitro. Parameter antifertilitas yang diuji adalah bobot testis, motilitas spermatozoa, diameter tubulus seminiferus dan aktivitas spermisidal. Data yang diperoleh dianalisis secara statistik menggunakan analisis one way ANOVA dan Kruskal Wallis yang dilanjutkan dengan uji LSD jika hasil dari uji one way ANOVA dan Kruskal Wallis menunjukkan perbedaan yang bermakna (p ≤ 0,05). Dari hasil analisis bobot testis tidak terdapat perbedaan yang bermakna (p ≥ 0,05) antara kelompok perlakuan dosis dengan kelompok kontrol negatif. Motilitas spermatozoa terdapat perbedaan yang bermakna (p ≤ 0,05) antara kelompok perlakuan dosis dengan kontrol negatif. Diameter tubulus seminiferus menunjukkan penurunan pada ketiga kelompok perlakuan dosis, namun yang mengalami perbedaan secara bermakna (p ≤ 0,05) terhadap kelompok kontrol negatif hanya pada kelompok perlakuan dosis 200 mg/kg BB. Konsentrasi efektif minimum yang dapat mematikan 100% sperma dalam waktu 20 detik adalah 200 mg/mL. Semakin besar konsentrasi ekstrak semakin besar efek spermisidalnya. Berdasarkan data diatas ekstrak etanol 96% daun sambiloto (Andrographis paniculata (Burm.f.) Nees) berpotensi sebagai agen antifertilitas yang dapat dikembangkan sebagai bahan kontrasepsi.
Major : Pharmacy
Title : Study of Activity of 96% Ethanol Extract of Sambiloto
Leaves (Andrographis paniculata (Burm.f)Nees) Against Sperm Quality inMale Sprague-Dawley Rats by In Vivo Method and Spermicidal Activity by In Vitro Method
Andrographis paniculata (Burm.f.) Ness is known as antifertility agent. This was an experimental research. The 96% ethanol extract of sambiloto leaves (Andrographis paniculata (Burm.f.) Ness) was given orally for 48 days. This research used 25 rats which were divided five groups such as control (Tween 80 2%), 100, 200, 400 mg/kgBW, and spermicidal activity by using in vitro method. Each group consisted of five male Sprague-Dawley rats. Antifertility parameters that were being examined are testes weight, sperm motility, semniferous tubule diameter, and spermicidal activity. Data was analyzed by using ANOVA, Kruskal-Wallis and LSD. The result of testes weight was not significant compared to the control group (p ≥ 0,05). Sperm motility result showed significant difference between treatment groups and control group (p ≤ 0,05). The semniferous tubule diameter did not significantly decrease at 100mg/kgBW and 400mg/kgBW, but it signficantly decreased at 200mg/kgBW against control group (p ≤ 0,05). Minimum effective concentration (MEC) which could be lethal to 100% of sperm within 20 seconds was 200 mg/mL. The greater concentration of the extract had the greater effect of spermicidal. Based on the results, the 96% ethanol extract of sambiloto leaves (Andrographis paniculata (Burm.f) Ness) is a potential antifertility agent which can be developed as contraception material.
melimpahkan rahmat, taufik dan hidayah-Nya sehingga penulis dapat
menyelesaikan penelitian dan menyusun skripsi ini dengan judul “Uji Aktivitas Ekstrak Etanol 96% Daun Sambiloto (Andrographis paniculata (Burm.f.)
Nees) Terhadap Kualitas Sperma Pada Tikus Jantan Galur Sprague-Dawley
Secara In Vivo dan Aktivitas Spermisidal Secara In Vitro.”
Penulis menyadari bahwa dalam penelitian dan penyusunan skripsi ini tidak
akan terwujud tanpa adanya bantuan, bimbingan, dan dukungan dari berbagai
pihak. Oleh karena itu penulis mengucapkan terimkasih kepada :
1. Dr. Azrifitria M. Si., Apt dan Syaikhul Aziz M. Si., Apt sebagai dosen
pembimbing yang dengan sabar telah memberikan banyak masukan,
bimbingan dan dukungan kepada penulis.
2. Drs. Arif Sumantri, M. Kes selaku Dekan Fakultas Kedokteran dan
Ilmu Kesehatan UIN Syarif Hidayatullah Jakarta.
3. Yardi, Ph.D., Apt selaku Ketua Program Studi Farmasi Fakultas
Kedokteran dan Ilmu Kesehatan UIN Syarif Hidayatullah Jakarta.
4. Ayahanda tercinta Dasrul dan ibunda tercinta Rita Herni yang selalu memberikan kasih sayang, do’a, dukungan baik moril maupun materi serta semangat yang tak terhingga di setiap langkah penulis.
5. Kakakku tersayang Nofita, Nova Mardian, Desi Yanti dan adikku
tersayang Nurul Fadhilah yang telah memberikan do’a dan dukungan kepada penulis.
6. Bapak dan Ibu Dosen yang telah memberikan ilmu dan pengetahuan
hingga penulis dapat menyelesaikan studi di Program Studi Farmasi
FKIK UIN Syarif Hidayatullah Jakarta.
7. Dosen Matematika bapak Suhendra yang telah membantu dalam
menjelaskan cara analisis menggunakan SPSS kepada penulis.
9. Teman-teman yang sudah membantu selama proses penelitian dan
skripsi Sry Wardiyah, Brasti Eka P., Fitri Apriani, Athiyah, Evi, Sheila,
Sutar, Rhesa Ramadhan, Dini Fauzana, Rizky Hidayanti Rambe, Rahmi
Sertiana, Ageng, Ices, Elsa Elfrida, Charinna Agus P., dan Khoirunnisa
Robbani.
10. Teman – teman Farmasi 2011 atas persaudaraan, kebersamaan telah banyak membantu penulis baik selama pengerjaan skripsi ini maupun
selama di bangku perkuliahan.
11. Kakak kelas ku Mayta Ravika, Jaga Pramudita, dan Nisfit yang telah
memberikan bantuan dan pengetahuan tentang penelitian antifertilitas
kepada penulis.
12. Laboran Farmasi UIN Syarif Hidayatullah Jakarta yang telah membantu
mempersipkan alat dan bahan selama penelitian.
13. Semua pihak yang telah membantu selama penelitian dan penyelesaian
skripsi baik secara langsung maupun tidak langsung yang namanya
tidak dapat disebutkan satu persatu.
Semoga Allah SWT memberikan balasan yang berlipat ganda atas semua
bantuan, dan dukungan yang diberikan.
Akhir kata, penulis menyadari bahwa penyusunan skripsi ini masih belum
sempurna dan banyak kekurangan. Oleh karena itu saran serta kritik yang
membangun sangat diharapkan. Semoga skripsi ini dapat bermanfaat bagi penulis dan pembaca. Amiin Ya Rabbal’alamiin.
Jakarta, Juni 2015
HALAMAN JUDUL ... iii
HALAMAN PERNYATAAN ORISINILITAS ... iiii
HALAMAN PERSETUJUAN PEMBIMBING ... iv
HALAMAN PENGESAHAAN ... v
ABSTRAK ... vii
ABSTRACT ... viii
KATA PENGANTAR ... viiii
HALAMAN PERSETUJUAN PUBLIKASI KARYA ILMIAH... xi
DAFTAR ISI ... xi
DAFTAR TABEL ... xiv
DAFTAR GAMBAR ... xv
DAFTAR LAMPIRAN ... xvii
BAB 1 PENDAHULUAN ... 1
1.1. Latar Belakang ... 1
1.2. Rumusan Masalah ... 4
1.3. Tujuan Penelitian ... 4
1.4. Hipotesis ... 4
1.5. Manfaat Penelitian ... 4
BAB 2 TINJAUAN PUSTAKA ... 5
2.1. Tinjauan Botani Sambiloto ... 5
2.1.1. Sejarah Sambiloto ... 5
2.1.2. Nama Lokal dan Nama Asing ... 5
2.1.3. Klasifikasi Tanaman... 5
2.1.4. Deskripsi Tanaman ... 6
2.1.5. Kandungan Kimia Daun Sambiloto ... 7
2.1.6. Khasiat dan Kegunaan ... 8
2.3.2. Ekstraksi ... 11
2.4. Tinjauan Hewan Percobaan ... 13
2.4.1. Klasifikasi Tikus Putih ... 13
2.4.2. Karakteristik Tikus Putih (Rattus norvegicus) ... 13
2.5. Sistem Reproduksi Tikus Jantan ... 15
2.5.1. Spermatozoa ... 17
2.5.2. Spermatogenesis pada Tikus ... 18
2.5.3. Hormon yanng Mengontrol Spermatogenesis ... 20
BAB 3 METODE PENELITIAN ... 23
3.1. Waktu dan Tempat Penelitian ... 23
3.2. Alat dan Bahan ... 23
3.2.1. Alat Penelitian ... 23
3.2.2. Bahan Penelitian... 23
3.2.3. Bahan Kimia ... 24
3.2.4. Hewan Uji ... 24
3.3. Rancangan Penelitian ... 24
3.3.1. Besar Sampel ... 24
3.3.2. Dosis Perlakuan ... 24
3.4. Kegiatan Penelitian ... 25
3.4.1. Pembuatan Ekstrak ... 25
3.4.2. Penapisan Fitokimia ... 26
3.4.3. Pengujian Parameter Spesifik dan Non Spesifik ... 28
3.4.4. Uji Kualitatif Andrographolide ... 29
3.4.5. Persiapan Hewan Uji ... 29
3.4.6. Pemberian Perlakuan ... 30
3.4.7. Pembuatan Preparat ... 30
3.4.8. Pengukuran Parameter ... 30
3.5. Analisis Data ... 32
BAB 4 HASIL DAN PEMBAHASAN ... 33
4.1.3. Penapisan Fitokimia Ekstrak ... 33
4.1.4. Pengujian Parameter Ekstrak ... 34
4.1.5. Uji Kualitatif Andrographolide dengan KLT ... 35
4.1.6. Pengukuran Bobot Testis ... 37
4.1.7. Perhitungan Motilitas Spermatozoa ... 39
4.1.8. Pengukuran Diameter Tubulus Seminiferus ... 40
4.1.9. Pengujian Aktivitas Spermisidal ... 42
4.2. Pembahasan ... 43
BAB 5 KESIMPULAN DAN SARAN ... 56
5.1. Kesimpulan ... 56
5.2. Saran ... 56
DAFTAR PUSTAKA ... 57
Tabel Halaman
2.1. Karakteristik Tikus Putih ... 15
3.1. Rancangan Percobaan ... 25
4.1. Hasil Penapisan Fitokimia Ekstrak Etanol 96% Daun Sambiloto ... 34
4.2. Hasil Pengujian Parameter Spesifik dan Non Spesifik Ekstrak ... 34
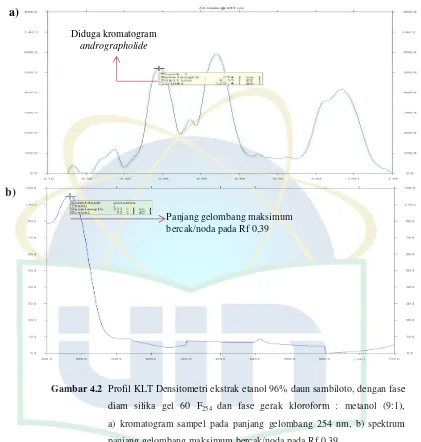
4.3. Rerata Bobot Testis ... 37
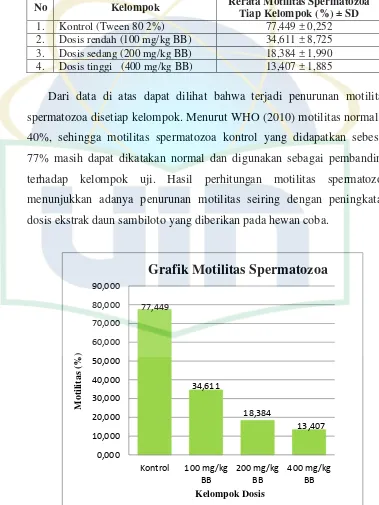
4.4. Rerata Motilitas Spermatozoa ... 39
4.5. Rerata Diameter Tubulus Seminiferus ... 41
4.6. Hasil Pengujian Aktivitas Spermisidal ... 42
5.1. Hasil Uji Normalitas Bobot Testis Tikus Jantan ... 77
5.2. Hasil Uji Homogenitas Bobot Testis Tikus Jantan ... 78
5.3. Hasil Uji ANOVA Bobot Testis Tikus Jantan ... 79
5.4. Hasil Uji Normalitas Motilitas Spermatozoa Tikus Jantan ... 80
5.5. Hasil Uji Homogenitas Motilitas Spermatozoa Tikus Jantan ... 81
5.6. Hasil Uji Kruskal-Wallis Motilitas Spermatozoa Tikus Jantan ... 82
5.7. Hasil Uji LSD Motilitas Spermatozoa Tikus Jantan ... 81
5.8. Hasil Uji Normalitas Diameter Tubulus Seminiferus Tikus Jantan ... 83
5.9. Hasil Uji Homogenitas Diameter Tubulus Seminiferus Tikus Jantan ... 84
5.10. Hasil Uji ANOVA Diameter Tubulus Seminiferus Tikus Jantan ... 85
5.11. Hasil Uji LSD Diameter Tubulus Seminiferus Tikus Jantan ... 85
2.1. Pohon, Bunga, Buah dan Daun Sambiloto (Andrographis paniculata) ... 6
2.2. Penampang ventral sistem urogenital tikus jantan ... 16
2.3. Sperma tikus Sprague-Dawley pada pembesaran 400 kali ... 17
2.4. Tahapan siklus sel dalam spermatogenesis tikus ... 18
4.1. Kromatogram Lapis Tipis ekstrak etanol 96% daun sambiloto ... 36
4.2. Profil TLC Scanner ... 37
4.3. Grafik bobot testis ... 38
4.4. Grafik motilitas spermatozoa ... 39
4.5. Grafik diameter tubulus seminiferus ... 41
4.6. Grafik aktivitas spermisidal ekstrak etanol 96% daun sambiloto ... 43
5.1. Tanaman sambiloto ... 72
5.2. Serbuk daun sambiloto ... 72
5.3. Proses maserasi daun sambiloto ... 72
5.4. Proses penyaringan maserat ... 72
5.5. Hasil penyaringan maserat ... 72
5.6. Pemekatan ekstrak dengan vacum rotary evaporator ... 72
5.7. Ekstrak kental ... 72
5.8. Ekstrak yang telah diemulsikan ... 72
5.9. Hewan uji ... 72
5.10. Penimbangan hewan uji sebelum disonde ... 72
5.11. Penyondean ekstrak ... 72
5.12. Penimbangan pakan yang akan diberikan ... 72
5.13. Hewan uji dikorbankan ... 72
5.14. Pembedahan hewan uji ... 72
5.15. Kauda (kiri) dan testis (kanan) ... 72
5.19. Kauda epididimis ... 73
5.20. Pembukaan kauda epididimis dengan spuit ... 73
5.21. Pengeluaran sperma dari kauda epididimis ... 73
5.22. Sperma diteteskan di atas Neubauer hematositometer ... 73
5.23. Pengamatan motilitas spermatozoa dengan perbesaran 40x10 ... 73
5.24. Bilik hitung Neubauer ... 73
5.25. Kauda epididimis ... 74
5.26. Pembukaan kauda epididimis dengan spuit ... 74
5.27. Pengeluaran sperma dari kauda epididimis ... 74
5.28. Seri konsentrasi ekstrak ... 74
5.29. Pengmatan motilitas spermatozoa dengan perbesaran 40x10 ... 74
5.30. Bilik hitung Neubauer ... 74
5.31. Testis yang akan digunakan dibuat preparat ... 74
5.32. Testis dalam formalin 10% ... 74
5.33. Histologi testis dilihat di bawah mikroskop ... 74
1. Hasil Determinasi Tanaman ... 64
2. Alur Penelitian ... 65
3. Perhitungan Dosis Ekstrak Daun Sambiloto ... 67
4. Hasil Penapisan Fitokimia Ekstrak Etanol 96% Daun Sambiloto ... 69
5. Perhitungan Rendemen, Kadar air, dan Kadar Abu ... 71
6. Gambar Kegiatan Penelitian ... 72
7. Hasil Pengukuran Berat Badan ... 75
8. Hasil Analisis Data Bobot Testis ... 77
9. Hasil Analisis Data Motilitas Spermatozoa ... 80
10. Hasil Analisis Data Diameter Tubulus Seminiferus ... 84
1 UIN Syarif Hidayatullah Jakarta BAB 1
PENDAHULUAN
1.1. Latar Belakang
Menurut World Population Data Sheet (2013; 2014) jumlah penduduk
Indonesia pada tahun 2013 mencapai 249 juta jiwa, dan tahun 2014
mencapai 251 juta jiwa. Berdasarkan data tersebut dapat terlihat bahwa
jumlah penduduk Indonesia dari tahun ke tahun terus meningkat.
Pertambahan jumlah penduduk ini merupakan salah satu masalah yang
dihadapi Indonesia dalam pembangunan nasional dan akan berdampak luas
terhadap fasilitas kesehatan, pendidikan, serta ketersediaan pangan.
Pertambahan penduduk yang terjadi secara terus menerus akan memicu
terjadinya kasus kemiskinan yang semakin tinggi dan akan berdampak pada
pemenuhan gizi bayi serta meningkatnya angka pengangguran (Fitria,
2010). Salah satu upaya yang dilakukan pemerintah dalam mengendalikan
pertambahan jumlah penduduk tersebut adalah menurunkan angka kelahiran
melalui program keluarga berencana (KB) yang sudah dilaksanakan sejak
tahun 1970. Melalui program ini angka kelahiran dapat dikendalikan. KB
memiliki dua program, yaitu KEI (Komunikasi, Edukasi, dan Informasi) dan
pelayanan kontrasepsi (Sulistio et al, 2010).
Pertumbuhan penduduk yang terus meningkat disebabkan oleh
rendahnya partisipasi suami dalam pelaksanaan program KB baik dalam
praktik KB, mendukung istri dalam pelaksanaan kontrasepsi, sebagai
motivator atau promotor dan merencanakan jumlah anak (Budisantoso,
2009). Menurut Badan Kependudukan dan Keluarga Berencana Nasional
(BKKBN) Juli 2014, jumlah partisipasi baru penggunaan KB di tahun 2014
yaitu pria 6,32% dan wanita 93,68%. Berdasarkan data tersebut dapat
terlihat bahwa partisipasi suami dalam melakukan KB masih rendah
daripada partisipasi istri. Hasil data di atas bila dibandingkan dengan
negara-negara islam lainnya, seperti Bangladesh dan Malaysia angka
partisipasi suami di Indonesia sebagai akseptor KB tersebut masih terbilang
rendah, Bangladesh sebesar 13,9% tahun 1997, dan Malaysia sebesar 16,8%
UIN Syarif Hidayatullah Jakarta Rendahnya kesertaan atau partisipasi pria dalam praktik KB
disebabkan oleh beberapa faktor diantaranya keterbatasan penerimaan dan
aksesibilitas (keterjangkauan) pelayanan kontrasepsi pria, serta adanya
anggapan, kebiasaan serta persepsi dan pemikiran yang salah yang masih
cenderung menyerahkan tanggung jawab KB sepenuhnya kepada para istri
atau perempuan (Budisantoso, 2009). Jenis kontrasepsi pria yang tersedia
sangat terbatas juga menjadi alasan rendahnya partisipasi pria dalam
melaksanakan KB. Hal tersebut menjadi landasan mengapa perkembangan
teknologi kontrasepsi perlu lebih mengarah pada pria. Bahan atau alat
kontrasepsi pria yang masih sangat terbatas, yaitu kondom dan vasektomi.
Upaya peningkatan keikutsertaan pria dalam program KB perlu dilakukan
melalui penelitian obat antifertilitas yang dapat digunakan oleh kaum pria
(Kaspul, 2007).
Badan Kesehatan Dunia (WHO) telah membentuk suatu kelompok
kerja untuk mencari dan mengembangkan pengaturan kesuburan pria yang
aman, efektif, dan dapat diterima. Strategi penelitian yang dilakukan oleh
kelompok kerja WHO adalah mengembangkan kontrasepsi pria melalui
bahan atau zat dari tumbuh-tumbuhan yang diduga mempunyai bahan aktif
yang bersifat antifertilitas (Yurnadi et al., 2002). Obat antifertilitas atau alat
kontrasepsi yang ideal untuk pria harus dapat mencegah terjadinya fertilitas,
aman, mempunyai kinerja cepat, tanpa efek samping, dan tidak
mempengaruhi libido. Para peneliti terus melakukan riset agar dapat
menemukan metode kontrasepsi ideal tersebut. (Priastini, Rina, 2007).
Tumbuhan obat sebagai kontrasepsi (KB) telah lama dikenal
masyarakat terutama di beberapa daerah di Indonesia, namun penelitian
mengenai obat tradisional atau bahan kimia yang berkhasiat sebagai obat
kontrasepsi untuk pria relatif belum berkembang. Usaha untuk meneliti dan
mengembangkan obat kontrasepsi pria diantaranya dengan meneliti khasiat
obat tradisional atau bahan dasarnya yang diduga mengandung zat yang
dapat digunakan sebagai kontrasepsi yang efektif (Susetyarini, 2009;
UIN Syarif Hidayatullah Jakarta Tanaman sambiloto (Andrographis paniculata) merupakan salah satu
bahan alam yang mempunyai khasiat antifertilitas. Sambiloto mengandung
tiga komponen utama diterpen lakton yaitu andrographolide,
neoandrographolide, dan 14-deoxyandrographolide. Ketiga komponen aktif
tersebut, senyawa andrographolide merupakan senyawa paling banyak
terdapat pada daun sambiloto dan paling berperan dalam pengobatan.
Senyawa yang diduga berperan sebagai antifertilitas adalah
andrographolide (Jadho et al, 2014). Menurut Akbarsha, M. A., dan P.
Murugaian (2000) andrographolide dapat mempengaruhi spermatogenesis
dengan mencegah terjadinya sitokinesis pada sel spermatogenik yang akan
membelah. Penelitian lain yang dilakukan oleh Santra, et al (2013) dengan
pemberian ekstrak air daun sambiloto kepada tikus rumah pada dosis 250
mg/kg berat badan selama 30 dan 45 hari dapat menurunkan diameter
tubulus seminiferus dan sel Sertoli secara signifikan, jumlah sperma kauda
epididimis berkurang, dan terjadi abnormalitas sperma. Berdasarkan
penelitian tersebut perlu adanya dilakukan penelitian sambiloto yang
tumbuh di Indonesia dan penelitian ini di Indonesia sendiri belum banyak
dilakukan.
Menurut Departemen Kesehatan RI (2005), pelarut yang
diperbolehkan untuk ekstrak tumbuhan obat adalah air dan etanol. Penelitian
lainnya yang dilakukan oleh Kumoro, et al (2009), andrographolide yang
terdapat dalam daun sambiloto lebih banyak tertarik dengan pelarut metanol
dan etanol serta sedikit larut dengan air. Semakin tinggi konsentrasi pelarut
yang digunakan maka andrographolide yang dihasilkan semakin banyak.
Berdasarkan hal tersebut, penelitian daun sambiloto terhadap antifertilitas
ini dilakukan dengan menggunakan pelarut etanol 96%. Ekstrak etanol 96%
daun sambiloto digunakan dengan variasi dosis yaitu 100, 200, dan 400
mg/kg berat badan selama 48 hari sesuai dengan siklus spermatogenesis
untuk melihat pengaruhnya terhadap penurunan bobot testis, motilitas
sperma, dan diameter tubulus seminiferus secara in vivo serta aktivitas
UIN Syarif Hidayatullah Jakarta 1.2. Rumusan Masalah
Berdasarkan latar belakang yang telah dipaparkan di atas maka dapat
diambil rumusan masalah sebagai berikut :
1. Apakah ada pengaruh pemberian ekstrak etanol 96% daun
sambiloto (Andrographis paniculata (Burm.f) Nees.) terhadap
kualitas sperma yang dinilai dari penurunan bobot testis, motilitas
sperma dan diameter tubulus seminferus, pada tikus jantan galur
Sprague-Dawley secara in vivo?
2. Apakah ekstrak etanol 96% daun sambiloto (Andrographis
paniculata (Burm.f) Nees.) mempunyai aktivitas spermisidal pada
tikus jantan galur Sprague-Dawley secara in vitro?
1.3. Tujuan Penelitian
Penelitian bertujuan untuk menguji ekstrak etanol 96% daun
sambiloto (Andrographis paniculata (Burm.f) Nees.) terhadap kualitas
spermatozoa yang dinilai dari penurunan bobot testis, motilitas sperma dan
diameter tubulus seminferus, pada tikus jantan galur Sprague-Dawley secara
in vivo dan aktivitas spermisidal secara in vitro.
1.4. Hipotesis
Pemberian ekstrak etanol 96% daun sambiloto (Andrographis
paniculata (Burm.f) Nees.) dapat berpengaruh terhadap kualitas
spermatozoa yang dinilai dari penurunan bobot testis, motilitas sperma dan
berkurangnya diameter tubulus seminiferus pada tikus jantan galur
Sprague-Dawley secara in vivo serta mempunyai aktivitas spermisidal secara in vitro.
1.5. Manfaat Penelitian
Manfaat penelitian adalah memberikan informasi kepada masyarakat
luas tentang manfaat daun sambiloto (Andrographis paniculata (Burm.f)
Nees.) sebagai agen antifertilitas yang telah dibuktikan dan memberikan
informasi yang bermanfaat dalam pengembangan ilmu reproduksi yang
5 UIN Syarif Hidayatullah Jakarta BAB 2
TINJAUAN PUSTAKA
2.1. Tinjauan Botani Sambiloto
2.1.1. Sejarah Sambiloto
Sambiloto merupakan salah satu tanaman diantara 20 jenis marga
Andrographis yang tumbuh di Asia tropika (Rahayu, et al, 1996).
Tanaman ini bukanlah tumbuhan asli Indonesia, tetapi diduga berasal dari
India. Menurut data spesimen yang ada di Herbarium Bogoriense di
Bogor, sambiloto sudah ada di Indonesia sejak 1893. Di India, sambiloto
adalah tumbuhan liar yang digunakan untuk mengobati penyakit disentri,
diare, atau malaria (Widyawati, 2007).
2.1.2. Nama Lokal dan Nama Asing
Di Indonesia sambiloto mempunyai berbagai macam nama lokal
seperti ampadu tanah (Minang), pepaitan (Melayu), sambiloto, bidara,
sadilata, takila (Jawa), ki oray, ki peurat, takilo (Sunda) (BPOM, 2012).
Sementara itu, nama-nama asing sambiloto diantaranya chuan xin
lian, yi jian xi, dan lan he lian (Cina), kalmegh, kirayat, dan kirata (India),
xuyen tam lien dan congcong (Vietnam), quasabhuva (Arab),
nainehavandi (Persia), green chiretta dan king of bitter (Inggris)
(Widyawati, 2007).
2.1.3. Klasifikasi Tanaman
Secara taksonomi, sambiloto dapat diklasifikasikan sebagai berikut :
Kingdom : Plant
Divisi : Spermatophyta
Subdivisi : Angiospermae
Class : Dicotyledoneae
Ordo : Solanales
Famili : Acanthaceae
Spesies : Andrographis paniculata Ness
(Zein, 2009., Harianja, 2011)
Gambar 2.1. a) Pohon, Bunga dan Buah Sambiloto (Andrographis paniculata (Burm.f.) Nees) (Pusat Penelitian dan Pengembangan Perkebunan)
b) Pohon Sambiloto (Koleksi pribadi) dan Daun Sambiloto (Jarukamjorn et al, 2008)
2.1.4. Deskripsi Tanaman
Habitus : Herba, terna semusim, tinggi dapat mencapai 90
cm
Batang : Berkayu, pangkal bulat, masih muda bentuk segi
empat dengan rusuk yang jelas, menebal di bagian
buku-buku batnag, setelah tua bulat, percabangan
monopodial, hijau.
Daun : Tunggal, bulat telur, bersilang berhadapan,
pangkal dan ujung runcing, tepi rata, panjang 3-12
cm, lebar 1-3 cm, pertulangan menyirip, panjang
tangkai 0,2-0,5 cm, permukaan atas hijau tua,
bagian bawah hijau muda.
Bunga : Majemuk malai rata, di ujung batang atau di ketiak
daun di bagian atas, kelopak bunga berlekatan
terbagi menjadi 5 helai, daun mahkota 5 berlekatan
membentuk tabung mahkota bunga, panjang
tabung 6 mm, panjang helai daun mahkota lebih
dari panjang tabung mahkota, 2 helai daun
mahkota di bagian atas (bibir atas) berwarna putih
dengan garis kuning di bagian ujungnya, panjang
helaian 7-8 mm, bibir bawah terdiri atas 3 helaian
daun mahkota, putih atau putih disertai warna
ungu, tangkai sari 5 ukuran tangkai sari sepanjang
mahkota bunga, tangkai sari melebar di bagian
pangkal, tangkai putik panjang, melebihi panjang
mahkota bunga. Berbunga sepanjang tahun.
Buah : Berbentuk kapsul, berkatup dan berisi 3-7 biji
berwarna coklat tua.
Biji : Kecil, bulat, masih muda putih kotor setelah tua
coklat.
Akar : Tunggang, putih kecoklatan.
(BPOM, 2012., Syafiati, 2007)
2.1.5. Kandungan Kimia Daun Sambiloto
Kandungan kimia herba sambiloto adalah saponin, flavonoid, tanin
serta senyawa aktifnya yaitu Andrographolide (Syafiati, 2007). Menurut
Tri widyawati (2007) kandungan yang dijumpai pada tanaman sambiloto
diantaranya diterpene lakton, dan glikosidanya, seperti andrographolide,
deoxyandrographolide, 11,12-didehydro-14-eoxyandro-grapholide, dan
tanaman ini. Daun dan percabangannya lebih banyak mengandung lakton
sedangkan komponen flavonoid dapat diisolasi dari akarnya, yaitu
polimetok-siflavon, androrafin, panikulin, mono-0-metilwithin dan
apigenin-7,4 dimetileter.
Selain komponen lakton dan flavonoid, pada tanaman sambiloto ini
juga terdapat komponen alkana, keton, aldehid, mineral (kalsium, natrium,
kalium), asam kersik dan damar. Di dalam daun, kadar senyawa
andrographolide sebesar 2,5-4,8% dari berat keringnya. Ada juga yang
mengatakan biasanya sambiloto distandarisasi dengan kandungan
andrographolide sebesar 4-6%. Senyawa kimia lain yang sudah diisolasi
dari daun yang juga pahit yaitu diterpenoid viz,
deoxyandro-grapholide-19β-D-glucoside, dan neo-andrographolide.
Aktivitas terapi sambiloto (Andrographis paniculata (Burm.f.) Nees)
berhubungan dengan senyawa aktif diterpen lakton yang dikandungnya.
Setiap senyawa menunjukkan aktivitas farmakologi yang berbeda.
Andrographolide memiliki akivitas antiinflamasi dan antikanker dengan
efek antikanker nya lebih kuat dari pada
14-deoxy-11,12-didehydroandrographolide dan 14-deoxyandrographolide.
14-deoxy-11,12-didehydroandrographolide efek hipotensinya lebih kuat dan
aktivitas antiplateletnya lebih tinggi dari pada andrographolide.
Neoandrographolide juga memiliki aktivitas antimalaria dan efek
hepatoprotektif terhadap karbon tetraklorida. 14-deoxyandrographolide
merupakan antagonis yang efektif dari proses platelet activating factor
mediated pada neutrofil sapi melalui efeknya terhadap kanal kalsium.
2.1.6. Khasiat dan Kegunaan
Menurut Harianja (2011) daun sambiloto memiliki beberapa khasiat,
diantaranya untuk mengatasi hepatitis, infeksi saluran empedu, disentri
basiler, tifoid, diare, influenza, radang amandel (tonsilitis), abses paru,
radang paru (pneumonia), radang saluran napas (Bronkitis), radang ginjal
manis (diabetes melitus), tumor trofoblas (trofoblas ganas), serta tumor
paru, batuk rejan (pertusis), sesak napas (asma), darah tinggi (hipertensi).
Selain itu sambiloto juga memiliki khasiat dan kegunaan sebagai
antiinflamasi, antitrombotik, antimalaria, immunostimulant, antioksidan,
antihiperglikemi, analgesik dan antipiretik serta antifertilitas pria dan
wanita (Anju, et al., 2012; Halim, 2004). Menurut Akbarsha et al (1990)
dalam Akbar (2011) pemberian serbuk daun sambiloto ke tikus putih
jantan (20 mg per hari selama 60 hari) dapat menghambat
spermatogenesis, mengalami perubahan degeneratif di tubulus seminiferus,
regresi pada sel Leydig, dan mengalami perubahan regresif dan/atau
degeneratif di epididimis, vesikula seminalis, prostat ventral, dan kelenjar
koagulasi. Pemberian andrographolide juga memberikan hasil yang sama
ketika diberikan secara oral pada tikus putih jantan galur Wistar selama 48
hari yaitu dapat menurunkan jumlah dan motilitas sperma serta terjadinya
abnormalitas sperma.
2.2. Simplisia
Simplisia adalah bahan alamiah yang dipergunakan sebagai obat yang
belum mengalami pengolahan apapun juga dan kecuali dikatakan lain,
berupa bahan yang telah dikeringkan (Depkes RI, 1979 ).
Untuk memperoleh simplisia berkualitas, maka harus memenuhi
persyaratan sebagai berikut :
1. Kadar air
Kadar air adalah pengukuran kandungan air yang berada di
dalam bahan, dilakukan dengan cara yang tepat diantara cara titrasi,
destilasi, atau gravimetri. Kadar air bertujuan untuk memberikan
batasan minimal atau rentang tentang besarnya kandungan air di
dalam bahan. Nilai maksimal atau rentang yang diperbolehkan
terkait dengan kemurnian dan kontaminasi (Depkes RI, 2000).
Menurut Keputusan Menteri Kesehatan RI tentang
Farmakope Herbal Indonesia Edisi Pertama (2009), kadar air
ekstrak kental herba sambiloto tidak lebih dari 10%. Menurut
2. Kadar abu
Kadar abu bertujuan memberikan gambaran kandungan
mineral internal dan eksternal yang berasal dari proses awal sampai
terbentuk ekstrak. Kadar abu total ekstrak kental herba sambiloto
tidak lebih dari 1,0% (Menkes RI, 2009).
3. Kadar abu tidak larut asam
Jumlah benda anorganik asing dalam simplisia dinyatakan
sebagai kadar abu yang tidak larut asam. Herba sambiloto memiliki
kadar abu tidak larut asam yaitu tidak lebih dari 1,7%. Ekstrak
kental herba sambiloto memiliki kadar abu tidak larut asam yaitu
tidak lebih dari 0,1% (Menkes RI, 2009).
4. Kadar sari larut air
Kadar sari larut air ini menunjukkan banyaknya senyawa di
dalam simplisia yang larut dalam air (Pratiwi, 2010). Herba
sambiloto memiliki persyaratan kadar sari larut air yaitu tidak
kurang dari 15,7% (Menkes RI, 2009). Dan menurut Materia
Medika Indonesi (1995), kadar sari larut air herba sambiloto tidak
kurang dari 18%.
5. Kadar sari larut etanol
Kadar sari larut etanol ini merupakan faktor utama yang
menentukan mutu simplisia. Kadar ini menunjukkan adanya
kandungan zat yang berkhasiat dalam simplisia (Manoi, 2006).
Selain itu, kadar sari larut etanol dilakukan untuk mengetahui
kandungan terendah zat yang larut dalam etanol tetapi mungkin
tidak larut dalam air (Farmakope Indonesia IV, 1995).
Menurut Keputusan Menteri Kesehatan RI tentang
Farmakope Herbal Indonesia Edisi Pertama (2009), herba
sambiloto memiliki kadar sari larut etanolnya yaitu tidak kurang
dari 9,2%. Sedangkan menurut Materia Medika Indonesia (1995)
Jika kadar sari larut etanol dan air tinggi, hal ini menunjukkan bahan
aktif yang terkandung dalam simplisia tidak banyak yang hilang selama
proses pengeringan. Secara umum daun herba dan bunga dapat dikeringkan
antara suhu 20oC – 40oC, sedangkan untuk kulit batang dan akar pada suhu 30oC – 65oCC (Manoi, 2006).
2.3. Ekstrak Dan Ekstraksi
2.3.1. Ekstrak
Ekstrak adalah sediaan pekat yang diperoleh dengan mengekstraksi
zat aktif dari simplisia nabati atau simplisia hewani menggunakan pelarut
yang sesuai, kemudian semua atau hampir semua pelarut diuapkan dan
massa atau serbuk yang tersisa diperlakukan sedemikian sehingga
memenuhi baku yang telah ditetapkan. Sebagaian besar ekstrak dibuat
dengan mengekstraksi bahan baku obat secara perkolasi. Seluruh perkolat
biasanya dipekatkan dengan cara destilasi dengan pengurangan tekanan,
agar bahan utama obat sesedikit mungkin terkena panas (Depkes RI,
1995).
2.3.2. Ekstraksi
Ekstraksi adalah suatu proses pemisahan kandungan senyawa kimia
dari jaringan tumbuhan maupun hewan. Sebelum ekstraksi dilakukan
biasanya bahan-bahan dikeringkan terlebih dahulu kemudian dihaluskan
pada derajat kehalusan tertentu (Sinaga, 2009).
Menurut Departemen Keshatan RI (2000), Ekstraksi adalah kegiatan
penarikan kandungan kimia yang dapat larut sehingga terpisah dari bahan
yang tidak dapat larut dengan pelarut cair. Ekstraksi juga merupakan
penarikan zat pokok yang diinginkan dari bahan mentah obat dengan
menggunakan pelarut yang dipilih dimana zat yang diinginkan larut.
Adapun beberapa metode ekstraksi dengan menggunakan pelarut yaitu :
1. Ekstraksi Cara Dingin
a) Maserasi
Maserasi adalah proses penyarian simplisia dengan cara
pada temperatur kamar. Maserasi yang dilakukan pengadukan
secara terus menerus disebut maserasi kinetik, sedangkan yang
dilakukan pengulangan penambahan pelarut setelah dilakukan
penyaringan terhadap maserat pertama dan seterusnya disebut
remaserasi.
b) Perkolasi
Perkolasi adalah proses penyarian simplisia dengan pelarut
yang selalu baru sampai terjadinya penyarian sempurna yang
umumnya dilakukan pada temperatur kamar. Proses perkolasi
terdiri dari tahap pelembaban bahan, tahap perendaman antara,
tahap perkolasi sebenarnya (penetesan/penampungan ekstrak)
terus menerus sampai diperoleh perkolat yang jumlahnya 1 – 5 kali bahan.
2. Ekstraksi Cara Panas
a) Refluks
Refluks adalah proses penyarian simplisia dengan
menggunakan alat pada temperatur titik didihnya, selama waktu
tertentu dan jumlah pelarut terbatas yang relatif konstan dengan
adanya pendingin balik.
b) Digesti
Digesti adalah proses penyarian dengan pengadukan
kontinu pada temperatur lebih tinggi dari temperatur ruangan,
yaitu secara umum dilakukan pada temperatur 40-50oC.
c) Sokletasi
Sokletasi adalah proses penyarian dengan menggunakan
pelarut yang selalu baru, dilakukan menggunakan alat soklet
sehingga terjadi ekstraksi kontinu dengan pelarut relatif konstan
d) Infus
Infus adalah ekstraksi dengan pelarut air pada temperatur
penangas air (bejana infus tercelup dalam penangas air
mendidih, temperatur terukur 96 – 98 oC selama waktu tertentu (15 – 20 menit).
e) Dekoktasi
Dekoktasi adalah proses penyarian dengan menggunakan
pelarut air pada temperatur 90oC selama 30 menit (Sinaga,
2009).
Menurut istiqomah, 2013 dekokta adalah infus pada waktu
yang lebih lama (suhu lebih dari 30oC) dan temperatur sampai
titik didih air.
2.4. Tinjauan Hewan Percobaan
2.4.1. Klasifikasi Tikus Putih
Menurut Krinke (2000) klasifikasi tikus putih (Rattus norvegicus)
adalah sebagai berikut :
Kingdom : Animalia
Phylum : Chordata
Subphylum : Vertebrata
Class : Mammalia
Order : Rodentia
Family : Muridae
Genus : Rattus
Species : norvegicus
2.4.2. Karakteristik Tikus Putih
Hewan laboratorium atau hewan percobaan adalah hewan yang
sengaja dipelihara dan diternakan untuk dipakai sebagai hewan model
guna mempelajari dan mengembangkan berbagai macam bidang ilmu
dalam skala penelitian atau pengamatan laboratorium (Hau dan Hoosier Jr,
Tikus termasuk hewan mamalia, oleh sebab itu dampaknya terhadap
suatu perlakuan mungkin tidak jauh berbeda dibandingkan dengan
mamalia lainnya. Selain itu, penggunaan tikus sebagai hewan percobaan
juga didasarkan atas pertimbangan ekonomis dan kemampuan hidup tikus
hanya 2 – 3 tahun dengan lama reproduksi 1 tahun.
Keunggulan tikus putih dibandingkan tikus liar antara lain lebih cepat
dewasa, tidak memperlihatkan perkawinan musiman, dan umumnya lebih
cepat berkembang biak. Kelebihan lainnya sebagai hewan laboratorium
adalah sangat mudah ditangani, dapat ditinggal sendirian dalam kandang
asal dapat mendengar suara tikus lain dan berukuran cukup sehingga
memudahkan untuk pengamatan.
Secara umum, berat badan tikus laboratorium lebih ringan
dibandingkan berat badan tikus liar. Biasanya pas umur empat minggu
beratnya 35 – 40 gram, dan berat dewasa rata-rata 200-250 gram, tetapi bervariasi tergantung pada galur.
Terdapat beberapa galur tikus yang sering digunakan dalam
penelitian. Galur-galur tersebut antara lain : Wistar, Sprague-Dawley,
Long Evans, dan Holdzman. Dalam penelitian ini digunakan galur
Sprague-Dawley, yang merupakan galur tikus yang paling besar diantara
galur yang lain. Berdasarkan The Laboratory Rats 1st Edition ukuran
minimum luas kandang tikus adalah :
1. Satu tikus dewasa ditempatkan secara individu : 350 cm2
2. Peternakan hewan : 800 cm2
3. Group (kelompok tikus dewasa) : 250 cm2
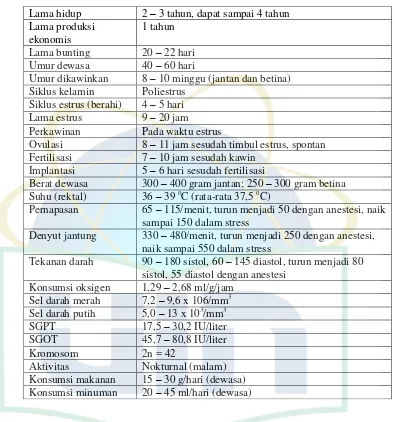
Tabel 2.1. Karakteristik tikus putih (Smith dan Mangkoewidjojo, 1988).
2.5. Sistem Reproduksi Tikus Jantan
Tikus adalah salah satu hewan penelitian yang paling banyak
digunakan dalam fisiologis reproduksi. Sistem reproduksi tikus jantan terdiri
dari testis dan skrotum, epididimis, duktus deferens, kelenjar aksesori
(kelenjar vesikulosa, prostat dan bulbouretralis), uretra dan penis (Suckow,
2006).
Testis tikus jantan terdapat pada dua kantung skrotum yang
dipisahkan oleh membran tipis yang terletak antara anus dan preputium.
Testis tersebut kemudian turun dari hari ke 30 – 40 masa hidupnya dari rongga perut ke kantung skrotum melalui kanalis inguinal terbuka. Jarak
Lama hidup 2 – 3 tahun, dapat sampai 4 tahun
Perkawinan Pada waktu estrus
Ovulasi 8 – 11 jam sesudah timbul estrus, spontan
Fertilisasi 7 – 10 jam sesudah kawin
Implantasi 5 – 6 hari sesudah fertilisasi
Berat dewasa 300 – 400 gram jantan; 250 – 300 gram betina Suhu (rektal) 36 – 39 oC (rata-rata 37,5 oC)
Pernapasan 65 – 115/menit, turun menjadi 50 dengan anestesi, naik sampai 150 dalam stress
Denyut jantung 330 – 480/menit, turun menjadi 250 dengan anestesi, naik sampai 550 dalam stress
Tekanan darah 90 – 180 sistol, 60 – 145 diastol, turun menjadi 80 sistol, 55 diastol dengan anestesi
dubur kelamin (anogenital) pada tikus jantan lebih jauh daripada betina
(Suckow, 2006).
Testis terdiri dari tubulus seminiferus yang panjang dan
berkelok-kelok. Ujung dari tubulus seminiferus ini kemudian bermuara menuju
epididimis (Barrett et al, 2010).
Testis mempunyai dua fungsi yaitu sebagai organ reproduksi dan
produksi androgen. Sebagai organ reproduksi berlangsung di tubulus
seminiferus, sedangkan sebagai organ produksi androgen testis bersifat
endokrin dan juga eksokrin. Fungsi endokrin terletak pada sel Leydig
(sel-sel interstisial) yang berfungsi mensintesis dan melepaskan hormon
testosteron, yang diperlukan dalam konsentrasi lokal tinggi untuk
meneruskan spermatogenesis dalam tubulus seminiferus. Produksi hormon
testosteron ini tergantung pada luteinizing hormon (LH) yang disekresi oleh
hipofisis anterior. Sedangkan fungsi eksokrin terletak pada epitelium
seminiferus yang menghasilkan spermatozoa (Rumahorbo, 1999., Bloom &
Fawcett, 2002).
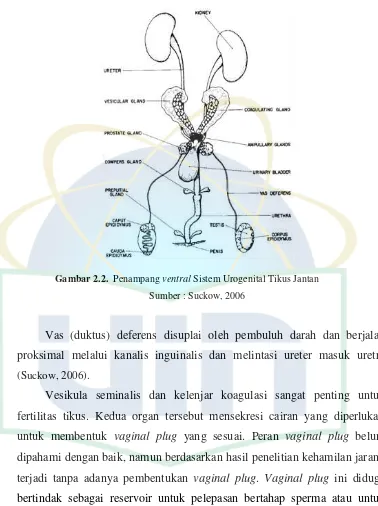
Epididimis merupakan suatu organ yang yang terletak pada
permukaan posterior testis yang terbentuk dari duktuli eferentes, yang
bergulung bersama duktus epididimis (Bloom & Fawcett, 2002). Epididimis
ini terdiri dari tiga bagian yaitu kepala (kaput epididimis yang membesar di
ujung proksimal pada testis, yang hampir seluruhnya terbenam ke dalam
lemak), badan (korpus epididimis yang terdapat di sekitar dorsomedial
testis) serta ekor (kauda epididimis pada ujung distal testis, yang merupakan
Gambar 2.2. Penampang ventral Sistem Urogenital Tikus Jantan
Sumber : Suckow, 2006
Vas (duktus) deferens disuplai oleh pembuluh darah dan berjalan
proksimal melalui kanalis inguinalis dan melintasi ureter masuk uretra
(Suckow, 2006).
Vesikula seminalis dan kelenjar koagulasi sangat penting untuk
fertilitas tikus. Kedua organ tersebut mensekresi cairan yang diperlukan
untuk membentuk vaginal plug yang sesuai. Peran vaginal plug belum
dipahami dengan baik, namun berdasarkan hasil penelitian kehamilan jarang
terjadi tanpa adanya pembentukan vaginal plug. Vaginal plug ini diduga
bertindak sebagai reservoir untuk pelepasan bertahap sperma atau untuk
mencegah keluarnya sperma dari vagina (Suckow, 2006).
2.5.1. Spermatozoa
Proses produksi spermatozoa di dalam testis disebut dengan
spermatogenesis. Spermatozoa hewan pengerat lebih panjang daripada jenis
sekitar 150 – 200 mm panjangnya pada tikus (Krinke, 2000). Kepala sperma tikus berbentuk kait, seperti pada hewan pengerat lainnya (Gambar 2.3.).
Gambar 2.3. Sperma tikus Sprague-Dawley pada pembesaran 400 kali
Sumber : Alias, 2009
Kualitas spermatozoa meliputi beberapa aspek, yaitu motilitas
spermatozoa yang dapat dibagi menjadi tiga kriteria (motilitas baik,
motilitas kurang baik dan tidak motil), morfologi spermatozoa meliputi
bentuknya (normal atau abnormal, abnormalitas dapat terjadi pada kepala,
midpiece atau ekor), konsentrasi atau jumlah spermatozoa dan viabilitas
(daya hidup) spermatozoa (Letis, 2012).
2.5.2. Spermatogenesis Pada Tikus
Spermatogenesis pada tikus terdiri dari 3 fase yaitu mitosis, meiosis,
dan spermiogenesis (Hess, A dan Franca, 2008). Spermatogenesis
merupakan proses pembentukan spermatozoa. Spermatozoa merupakan sel
hasil maturasi dari sel germinal primordial yang disebut dengan
spermatogonia. Spermatogonia berada pada dua atau tiga lapisan
permukaan dalam tubulus seminiferus (Guyton dan Hall, 2007).
Secara garis besar spermatogonia diklasifikasikan menjadi 3 tipe,
yaitu tipe A, tipe intermediet, dan tipe B. Spermatogonia tipe A dibagi lagi
menjadi tipe A0 (disebut juga dengan stem cells) dan tipe A1 – A4. Spermatogonium tipe A0 terdapat di membran basal pada tubulus
seminiferus dan mempunyai kemampuan untuk membelah menjadi 2 sel
anak, yang salah satunya menjadi A1 spermatogonium. Pada tikus, A1
spermatogonia kemudian mengalami 6 tahap mitosis dan kemudian
Spermatosit kemudian bermeiosis, dimana spematosit berkembang
dari leptotene, zygotene dan pakiten untuk menjadi spermatosit sekunder
pada komponen adluminal dari sel sertoli pada tubulus seminiferus.
Selama fase meiosis, setiap spermatosit membelah menjadi 4 spermatid
yang bersifat haploid (Krinke, 2000).
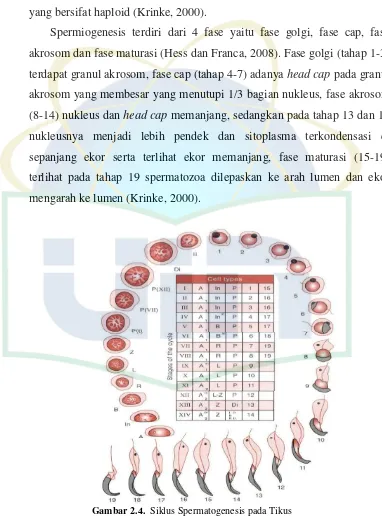
Spermiogenesis terdiri dari 4 fase yaitu fase golgi, fase cap, fase
akrosom dan fase maturasi (Hess dan Franca, 2008). Fase golgi (tahap 1-3)
terdapat granul akrosom, fase cap (tahap 4-7) adanya head cap pada granul
akrosom yang membesar yang menutupi 1/3 bagian nukleus, fase akrosom
(8-14) nukleus dan head cap memanjang, sedangkan pada tahap 13 dan 14
nukleusnya menjadi lebih pendek dan sitoplasma terkondensasi di
sepanjang ekor serta terlihat ekor memanjang, fase maturasi (15-19)
terlihat pada tahap 19 spermatozoa dilepaskan ke arah lumen dan ekor
mengarah ke lumen (Krinke, 2000).
Gambar 2.4. Siklus Spermatogenesis pada Tikus
diplotene; II, spermatosit sekunder; 1 – 19, langkah-langkah spermiogenesis. Tabel di tengah memberikan komposisi cellular tahapan siklus epitel seminiferus (I – XIV). M superscript mengindikasikan terjadinya mitosis. Diadaptasi dari Clermont dengan sedikit modifikasi (1962) (Krinke, 2000).
Pada tikus, 14 tahapan siklus spermatogenesis yang terjadi di dalam
tubulus seminiferus (Gambar 2.4.). Tubulus memiliki susunan segmental,
dan setiap potongan melintang tubulus menunjukkan tahapan yang
seragam yang melibatkan 4 atau 5 generasi di sel germinal dengan sesuai.
Pada tikus dibutuhkan 12 hari untuk menyelesaikan satu siklus yang terdiri
dari 14 tahapan. Spermatogonium tikus membutuhkan 4 siklus sampai
akhirnya membentuk spermatozoa, sehingga dibutuhkan 48 hari untuk
menyelesaikan seluruh tahap spermatogenesis (Krinke, 2000).
2.5.3. Hormon yang Mengontrol Spermatogenesis
Proses normal spermatogenesis diatur oleh sistem hormon yaitu FSH,
LH, dan testosteron, yang pengendaliannya melalui proses hipotalamus,
hipofisis, dan testis.
1. Testosteron
Testosteron adalah suatu hormon steroid yang berasal dari
molekul prekursor kolesterol, seperti halnya hormon seks wanita
estrogen dan progesteron. Sel-sel Leydig mengandung
enzim-enzim dengan konsentrasi tinggi yang diperlukan untuk
mengarahkan kolesterol mengikuti jalur yang menghasilkan
testosteron. Setelah dihasilkannya, sebagian testosteron
disekresikan ke dalam darah untuk di angkut terutama dengan
terikat ke protein plasma, ke jaringan sasaran. Sebagian testosteron
yang baru diproduksi mengalir ke lumen tubulus seminiferus,
tempat hormon ini memainkan peranan penting dalam
spermatogenesis (Sheerwood, 2001).
Menurut Nalbandov (1990) dalam Letis (2012), bahwa fungsi
testosteron ada 3 yaitu :
Mempertahankan sifat kelamin primer dan sekunder. Mempertahankan proses spermatogenesis untuk
Menjamin maturasi spermatozoa agar mampu mengadakan
fertilisasi.
2. Gonadotropin
Testis dikontrol oleh dua hormon gonadotropik yang
disekresikan oleh hipofisis anterior, Luteinuizing Hormon (LH)
Folikel Stimulating Hormone (FSH) (Sherwood, 2001).
Spermatogenesis dimulai pada saat pubertas karena adanya
peningkatan sekresi gonadotropin (FSH dan LH) dari hipofisis
anterior. FSH dianggap hormon penting untuk induksi
spermatogenesis dan merangsang secara langsung tubulus
seminiferus, karena spermatogenesis lengkap pada tikus
hypophysectomized dipulihkan oleh perlakuan FSH dalam
kombinasi dengan LH atau testosteron. Di sisi lain, efek
spermatogenesis dari LH, kadang-kadang disebut
Interstisial-Cell-Stimualating Hormon (ICSH) pada tikus jantan karena tindakan
androgenik pada sel Leydig di interstitium, dianggap dimediasi
oleh androgen, setidaknya pada tikus. Dalam konteks ini, sekresi
LH juga merangsang sintesis testosteron di sel Leydig pada testis
(Krinke, 2000).
Aksi FSH pada spermatogenesis mungkin dimediasi oleh sel
Sertoli, karena hormon peptida tidak dapat secara langsung
mencapai spermatosit dan spermatid melintasi sawar darah testis,
yang terbentuk selama 16-19 hari post partum (setelah kelahiran).
Sebaliknya, testosteron dapat dengan mudah melewati sawar darah
testis dengan difusi (dan mungkin juga oleh beberapa sistem
transportasi). Telah dilaporkan bahwa tingkat testosteron di dalam
cairan interstitial (lebih dari 50 ng/ml) pada tikus dewasa jauh lebih
tinggi dibandingkan pada testis (sekitar 30 ng/ml) atau cairan vena
perifer (kurang dari 10 ng/ml), menunjukkan aksi parakrin atau
autokrin dari testosteron pada spermatogenesis di tesis (Krinke,
Salah satu peran sel Sertoli adalah produksi androgen yang
mengikat protein, yang dirangsang oleh FSH dan testosteron. Hal
ini juga telah menunjukkan bahwa terdapat beberapa faktor yang
tidak diketahui dikeluarkan dari sel Sertoli, sebagai respon untuk
merangsang FSH dan testosteron, mungkin berkaitan dengan
23 UIN Syarif Hidayatullah Jakarta BAB 3
METODE PENELITIAN
3.1. WAKTU DAN TEMPAT PENELITIAN
Penelitian ini dilaksanakan dari bulan Februari 2015 sampai Mei
2015. Penelitian ini dilakukan di Laboratorium Farmakognosi dan
Fitokimia, pemeliharaan dan perlakuan hewan uji di Animal House (AH),
dan pengujian parameter di Laboratorium Penelitian II Fakultas Kedokteran
dan Ilmu Kesehatan, Universitas Islam Negeri Syarif Hidayatullah Jakarta.
3.2. ALAT DAN BAHAN
3.2.1. Alat Penelitian
Alat-alat yang digunakan dalam penelitian ini adalah timbangan
analitik (AND GH-202 dan Wiggen Hauser), botol maserasi, vacuum
rotary evaporator (EYELA), erlenmeyer, beaker glass, batang pengaduk,
spatula, kertas saring, kapas, corong gelas, tabung reaksi, pipet tetes,
cawan penguap, botol timbang, kurs silikat, oven (Memmert), tanur
(Thermo Scientific), aluminium foil, timbangan, kandang tikus beserta
tempat makan dan minum, sonde oral, syringe, wadah pembiusan, alat
bedah minor, kaca objek dan cover glass, mikropipet (Eppendorf Research
Plus), Eppendorf tube, vortex, mikroskop cahaya (Motic dan Epson),
waterbath, desikator, dan KLT Densitometri.
3.2.2. Bahan Penelitian
Bahan uji yang digunakan dalam penelitian ini adalah ekstrak etanol
96% dari daun sambiloto (Andrographis paniculata (Burm.f.) Ness) yang
diperoleh dari Balai Penelitian Tanaman Obat dan Aromatik (BALITRO).
Sebelum dilakukan penelitian, daun sambiloto terlebih dahulu
UIN Syarif Hidayatullah Jakarta 3.2.3. Bahan Kimia
Bahan kimia yang digunakan dalam penelitian ini adalah etanol 96%,
pereaksi untuk penapisan fitokimia (HCL 2 N; HCl 10%; H2SO4 P;
pereaksi Bouchardart LP, Mayer LP, Dragendorff LP; serbuk magnesium
P; asam asetat anhidrat; kloroform; Aquadest; FeCl3 1%; eter; NaOH 10%;
NaCl 10%; Cu2SO4 (tembagan asetat)). Tween 80 2% untuk penyiapan
emulsi zat aktif. Penyiapan sperma (normal saline water); NaCl fisiologis; dan larutan Baker’s buffer (glukosa 3%; Na2HPO4 2 H2O 0,31%; NaCl 0,2%; KH2PO4 0,01%).
3.2.4. Hewan Uji
Hewan uji yang akan digunakan dalam penelitian ini adalah tikus
jantan galur Sprague-Dawley yang sehat dan fertil berumur 6 - 7 bulan
dengan berat badan 250 - 400 gram yang diperoleh dari Home Industri
Animal Alamiah Bogor.
3.3. Rancangan Penelitian
3.3.1. Besar Sampel
Penelitian ini bersifat eksperimental yang terbagi dalam 5 kelompok
perlakuan yang masing – masing kelompok terdiri dari 5 ekor tikus jantan galur Sprague-Dawley (WHO,2000). Hewan uji yang digunakan sebanyak
25 ekor tikus.
3.3.2. Dosis Perlakuan
Acuan dosis yang digunakan berdasarkan penelitian yang dilakukan
oleh Sathiyaraj, K., et al (2011). Perhitungan dosis yang diberikan dapat
dilihat pada lampiran. Pemberian ekstrak dilakukan selama 48 hari sesuai
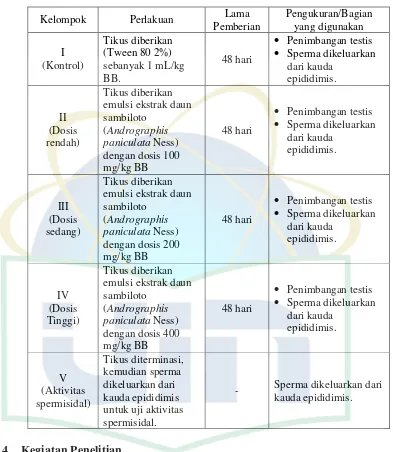
UIN Syarif Hidayatullah Jakarta Tabel 3.1 Rancangan Percobaan
Kelompok Perlakuan Lama
Pemberian
- Sperma dikeluarkan dari kauda epididimis.
3.4. Kegiatan Penelitian
3.4.1. Pembuatan Ekstrak
Sebanyak 15 kg daun sambiloto dikumpulkan, kemudian dicuci bersih
dengan air dan dikering anginkan. Daun sambiloto yang telah kering
dihaluskan dengan blender hingga menjadi serbuk. Selanjutnya, dilakukan
pengayakan dengan menggunakan ayakan mesh 40 untuk mendapatkan
serbuk simplisia.
Pembuatan ekstrak daun sambiloto menggunakan metode ekstraksi
cara dingin yaitu maserasi dengan menggunakan pelarut etanol 96%.
UIN Syarif Hidayatullah Jakarta 96% hingga sampel terendam. Hasil maserasi disaring sehingga diperoleh
filtrat.
Filtrat yang diperoleh dipekatkan menggunakan vacum rotary
evaporator sampai diperoleh ekstrak kental. Ekstrak kental yang
dihasilkan ditimbang dan dicatat beratnya selanjutnya disimpan di dalam
lemari pendingin atau freezer.
3.4.2. Penapisan Fitokimia
Pada penapisan fitokimia dilakukan pemeriksaan terhadap kandungan
golongan senyawa kimia dari simplisia dan ekstrak etanol 99% daun
sambiloto seperti terpenoid, lakton, glikosida, dan flavonoid.
1. Identifikasi Alkaloid
Beberapa mg ekstrak ditambah 1 mL asam klorida 2 N dan 9
mL aquades, dipanaskan dipenangas air selama 2 menit, dan
didinginkan. Kemudian disaring dan ditampung filtratnya. Filtrat
digunakan sebagai larutan percobaan selanjutnya.
a. Larutan percobaan ditambahkan 2 tetes Bouchardart LP,
terbentuk endapan coklat sampai dengan hitam positif
alkaloid.
b. Larutan percobaan ditambahkan 2 tetes Meyer LP, terbentuk
endapan menggumpal berwarna putih atau kuning yang larut
dalam metanol P positif alkaloid.
c. Larutan percobaan ditambahkan 2 tetes Dragendorf LP,
terbentuk endapan jingga coklat positif alkaloid (Depkes RI,
1995; Farnsworth, 1996).
2. Identifikasi Flavonoid
Sebanyak 0,5 mg ekstrak dilarutkan dalam NaOH 10% dan
ditambahkan HCl. Perubahan larutan dari warna kuning menjadi
tidak berwarna menunjukkan adanya flavonoid (Godghate, Asvin et
UIN Syarif Hidayatullah Jakarta 3. Identifikasi Diterpenoid
Sebanyak 0,5 mg ekstrak dilarutkan dalam air dan
ditambahkan 10 tetes tembaga asetat (Cu2SO4). Terbentuk warna
hijau emerald menunjukkan ekstrak mengandung diterpenoid
(Godghate, Asvin et al, 2012).
4. Identifikasi Tanin dan Polifenol
Sebanyak 3 g sampel diekstraksi aquades panas kemudian
didinginkan. Setelah itu ditambahkan 5 tetes NaCl 10% dan
disaring. Filtrat dibagi 3 bagian A, B, dan C. Filtrat A digunakan
sebagai blangko, ke dalam filtrat B ditambahkan 3 tetes pereaksi
FeCl3, dan ke dalam filtrat C ditambah garam gelatin. Kemudian
diamati perubahan yang terjadi (Marliana et al, 2005).
5. Identifikasi Saponin
Uji Saponin dilakukan dengan metode Forth yaitu dengan cara
memasukkan 2 mL sampel kedalam tabung reaksi kemudian
ditambahkan 10 mL akuades lalu dikocok selama 30 detik, diamati
perubahan yang terjadi. Apabila terbentuk busa yang mantap (tidak
hilang selama 30 detik) maka identifikasi menunjukkan adanya
saponin. Uji penegasan saponin dilakukan dengan menguapkan
sampel sampai kering kemudian mencucinya dengan heksana
sampai filtrat jernih. Residu yang tertinggal ditambahkan
kloroform, diaduk 5 menit, kemudian ditambahkan Na2SO4
anhidrat dan disaring. Filtrat dibagi menjadi menjadi 2 bagian, A
dan B. Filtrat A sebagai blangko, filtrat B ditetesi anhidrat asetat,
diaduk perlahan, kemudian ditambah H2SO4 pekat dan diaduk
kembali. Terbentuknya cincin merah sampai coklat menunjukkan
UIN Syarif Hidayatullah Jakarta 6. Identifikasi Steroid
Sebanyak 0,5 gram ekstrak ditambahkan 2 ml asam asetat
anhidrat. Kemudian ditambahkan 2 ml H2SO4 pekat. Adanya
steroid ditandai dengan terbentuknya warna hijau (Edeoga et al,
2005).
3.4.3. Pengujian Parameter Spesifik dan Non Spesifik
1. Parameter Spesifik
a. Identitas ekstrak dengan deskripsi tata nama sebagai berikut: nama ekstrak,
nama latin tumbuhan (sistematika botani), bagian tumbuhan yang digunakan,
nama Indonesia tumbuhan (Depkes RI, 2000).
b. Organoleptik diamati menggunakan panca indera untuk
mendeskripsikan bentuk, warna, bau, rasa sebagai berikut: bentuk : padat, serbuk-kering, kental, cair, warna : kuning, coklat dan lain-lain,
bau : aromatik, tidak berbau, dan lain-lain,
rasa : manis, pahit, khelat, dan lain-lain (Depkes RI,
2000).
2. Parameter Non Spesifik
a. Kadar air
Masukkan lebih kurang 10 gram ekstrak dan ditimbang
saksama dalam wadah yang telah ditara. Keringkan pada suhu
105oC selama 5 jam dan ditimbang. Lanjutkan pengeringan dan
timbang pada jarak 1 jam sampai perbedaan antara 2
penimbangan berturut-turut tidak lebih dari 0,25% (Depkes RI,
UIN Syarif Hidayatullah Jakarta b.Kadar abu
Sebanyak 2 gram ekstrak yang telah digerus dan timbang
secara seksama dimasukkan ke dalam krus silikat yang telah
dipijarkan dan ditara, ratakan. Pijarkan perlahan-lahan hingga
arang habis, dinginkan kemudian ditimbang. Jika dengan cara ini
arang tidak dapat dihilangkan, tambahkan air panas saring melalui
kertas saring bebas abu. Pijarkan sisa kertas dan kertas saring
dalam kurs yang sama. Masukkan filtrat ke dalam kurs, uapkan.
Kemudian pijarkan hingga bobot tetap, lalu ditimbang. Hitung
kadar abu terhadap bahan yang telah dikeringkan di udara
(Depkes RI, 2000).
3.4.4. Uji Kualitatif Andrographolide dengan KLT Densitometri
Pengujian secara kualitatif dengan KLT dilakukan dengan
menyiapkan larutan uji 100 mg/5mL dalam etanol. Sebagai fase gerak
adalah kloroform P : metanol P (9 : 1). Fase diam menggunakan plat KLT
silika gel 60 F254. Volume penotolan larutan uji sebanyak 20 μl. Pengamatan noda pada UV254. Setelah penotolan di plat KLT ditunggu
beberapa menit hingga plat KLT kering. Setelah kering spot atau bercak
yang terelusi dilihat dibawah lampu UV254 nm dan UV366 nm. Selanjutnya
dilakukan pengamatan dengan menggunakan KLT Densitometri (Menkes,
2009).
3.4.5. Persiapan Hewan Uji
Tikus jantan galur Sprague-Dawley diaklimatisasi di Animal House
Fakultas Kedokteran dan Ilmu Kesehatan selama tiga minggu agar dapat
menyesuaikan dengan lingkungannya yang baru. Selama proses adaptasi,
diberi makan dan minum ad libitum. Tikus yang digunakan adalah tikus
UIN Syarif Hidayatullah Jakarta 3.4.6. Pemberian Perlakuan
Penelitian ini menggunakan 25 ekor tikus jantan galur
Sprague-Dawley yang diberikan 5 perlakuan yang berbeda. Masing-masing
perlakuan terdiri dari 5 ekor tikus jantan. Ekstrak etanol 96% daun
sambiloto yang diperoleh didispersikan dalam pembawa (Tween 80 2%),
diberikan secara oralmenggunakan sonde sekali setiap hari selama 48 hari
dengan dosis seperti tertera pada tabel rancangan percobaan.
3.4.7. Pembuatan Preparat
Setelah 48 hari yaitu pada hari ke-49, masing-masing hewan coba
dikorbankan untuk diambil testisnya. Tikus dibius dengan eter, kemudian
dibedah. Diambil bagian kauda epididimis untuk pengamatan motilitas
sperma dan aktivitas spermisidal, dan bagian testis diambil untuk
ditimbang berat testis dan dibuat preparat histologi. Pembuatan preparat
histologi testis dilakukan di Laboratorium Patologi Anatomi Fakultas
Kedokteran Universitas Indonesia.
3.4.8. Pengukuran Parameter
1. Pengukuran Bobot Testis
Dilakukan dengan cara menimbang organ testis dengan
menggunakan timbangan analitik. Kemudian hasil bobot testis tikus
yang diberi perlakuan dibandingkan dengan bobot testis tikus kontrol.
2. Motilitas Spermatozoa
Pengamatan motilitas spermatozoa dilakukan dengan cara
mencampurkan satu tetes semen dari kauda epididimis dengan disayat
dan dipencet perlahan dengan 1 ml NaCl fisiologis 0,9% di atas kaca
arlojisecara merata. Kemudian dari campuran tersebut diambil sedikit
dan diteteskan di atas Neubauer untuk selanjutnya dilakukan
pengamatan di bawah mikroskop dengan pembesaran objektif 40 kali.
Motilitas sperma diamati dan dihitung dengan enam lapang pandang
UIN Syarif Hidayatullah Jakarta persentase spermatozoa yang motil dengan cara spermatozoa yang
bergerak ke depan dibandingkan dengan yang tidak bergerak atau
bergerak di tempat (Nurcholidah et al., 2013).
3. Pengukuran Diameter Tubulus Seminiferus
Dilakukan dengan membuat preparat histologi testis tikus terlebih
dahulu, menggunakan salah satu testis (bagian kanan) (Jain, Sachin.,
et all. 2012). Setelah itu, preparat histologi diamati dibawah
mikroskop dengan pembesaran 100x, 20 tubulus dipilih secara random
diukur menggunakan mikrometer okuler (Malihezaman, Monsefi dan
Pahlavan Sara. 2007). Tubulus seminiferus yang diukur diameternya
yaitu jarak antara dua titik yang berseberangan pada garis tengahnya,
titik tersebut berada pada membran basalis tubulus seminiferus
(Adriani, 2012).
4. Aktivitas Spermisidal Preparasi sperma
Tikus yang digunakan adalah tikus yang fertil. Tikus
kemudian dikorbankan untuk mengambil kauda epididimis
kemudian semen dikumpulkan dan diinkubasi dengan normal
saline water untuk uji in vitro dari sperma tikus. Sperma yang
digunakan mempunyai motilitas (≥50%) (Ashish Ranjan Singth, 2013).
Uji aktivitas spermisidal
Aktivitas spermisidal ditentukan dengan menggunakan
versi modifikasi dari protokol asli (Sander dan Metode
Cramer) yang mengukur konsentrasi minimum zat spermisida
yang dibutuhkan untuk membunuh 100 % sperma dalam 20
detik.
Ekstrak etanol 96% daun sambiloto dengan berbagai
konsentrasi dicampur dengan suspensi sperma. Campuran
UIN Syarif Hidayatullah Jakarta 40X dan diamati motilitas sperma. Konsentrasi dicatat jika ada sperma motil yang terlihat, lalu 250 μL buffer ditambahkan ke semua campuran dan diinkubasi pada suhu 37°C selama
minimal 60 menit. Larutan tersebut perlahan-lahan di vortex
dan diamati lagi setiap sperma yang motil. Konsentrasi dicatat
sebagai hasil yang efektif jika kedua tes menunjukkan tidak
adanya sperma motil. Titik akhir adalah konsentrasi terendah
dari ekstrak daun sambiloto yang menyebabkan imobilisasi
semua sperma dalam 20 detik pencampuran (Ashish Ranjan
Singth, 2013).
3.5. Analisis Data
Data percobaan dinyatakan sebagai mean ± SD. Data dianalisis untuk
melihat penurunan aktivitas spermisidal pada kelompok yang diberi
perlakuan. Analisis data secara statistik menggunakan program SPSS 16
meliputi uji normalitas, uji homogenitas, uji parametrik (one-way ANOVA)
33 UIN Syarif Hidayatullah Jakarta BAB 4
HASIL DAN PEMBAHASAN
4.1 HASIL PENELITIAN
4.1.1 Determinasi Tanaman
Determinasi tanaman dilakukan di Pusat Konservasi Tumbuhan
Kebun Raya Bogor – LIPI. Hasil determinasi menunjukkan bahwa tanaman uji adalah benar tanaman sambiloto (Andrographis paniculata
(Burm.f.) Nees) suku Acanthaceae. Surat pernyataan hasil determinasi
dapat dilihat pada lampiran 1.
4.1.2 Ekstraksi
Dari 15 kg daun segar sambiloto (Andrographis paniculata (Burm.f.)
Nees) diperoleh 1,1 kg simplisia daun kering dan ± 1 kg serbuk halus daun
sambiloto (Andrographis paniculata (Burm.f.) Nees). Serbuk daun
sambiloto dimaserasi sebanyak enam kali berulang dengan menggunakan
pelarut etanol 96% sebanyak 6,5 L hingga dihasilkan maserat yang
berwarna lebih bening daripada maserat awal. Filtrat yang diperoleh
dipekatkan dengan vacum rotary evaporator menghasilkan ekstrak kental
sebanyak 120,925 gram dengan rendemen sebesar 12,093%. Perhitungan
rendemen dapat dilihat pada lampiran 5.
4.1.3 Penapisan Fitokimia Ekstrak
Hasil penapisan fitokimia ekstrak etanol 96% daun sambiloto