UIN SYARIF HIDAYATULLAH JAKARTA
UJI AKTIVITAS ANTIFERTILITAS EKSTRAK
ETANOL 96% DAUN SAMBILOTO (
Andrographis
paniculata
Nees.) PADA TIKUS JANTAN
GALUR
SPRAGUE-DAWLEY
SECARA
IN VIVO
SKRIPSI
ASTRI DWI ZAHRINA
1111102000073
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
JAKARTA
ii
UIN SYARIF HIDAYATULLAH JAKARTA
UJI AKTIVITAS ANTIFERTILITAS EKSTRAK
ETANOL 96% DAUN SAMBILOTO (
Andrographis
paniculata
Nees.) PADA TIKUS JANTAN
GALUR
SPRAGUE-DAWLEY
SECARA
IN VIVO
SKRIPSI
Diajukan sebagai salah satu syarat memperoleh gelar Sarjana Farmasi
ASTRI DWI ZAHRINA
1111102000073
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
JAKARTA
vi UIN Syarif Hidayatullah Jakarta Nama : Astri Dwi Zahrina
Program Studi : Farmasi
Judul : Uji Aktivitas Antifertilitas Ekstrak Etanol 96% Daun Sambiloto (Andrographis paniculata Nees.) Pada Tikus Jantan Galur Sprague-Dawley Secara In Vivo
Sambiloto mempunyai kandungan senyawa aktif utama yaitu andrografolid yang dapat berpotensi sebagai agen antifertilitas. Penelitian ini bersifat eksperimental. Dua puluh ekor tikus jantan galur Sprague-Dawley dibagi menjadi 4 kelompok: kontrol Tween 80 2%, dosis 100 mg/kgBB, 200 mg/kgBB dan 400 mg/kgBB. Pemberian ekstrak etanol 96% daun sambiloto dilakukan secara oral selama 48 hari. Parameter yang diamati adalah konsentrasi spermatozoa, morfologi spermatozoa, jumlah spermatosit pakiten dan konsentrasi testosteron. Hasil yang diperoleh kemudian dianalisa dengan menggunakan analisa One Way ANOVA yang menunjukkan bahwa pada kelompok perlakuan dosis terjadi peningkatan konsentrasi spermatozoa secara tidak bermakna (p≥0,05) terhadap kontrol. Persentase morfologi spermatozoa yang abnormal mengalami peningkatan secara bermakna (p≤0,05) pada semua kelompok perlakuan dosis dibandingkan dengan kontrol. Jumlah spermatosit pakiten pada tahap VII-VIII mengalami penurunan secara bermakna (p≤0,05) antara kontrol dengan kelompok dosis. Hasil analisa data konsentrasi testosteron dengan Paired-Sample T-Test menunjukkan penurunan pada kelompok dosis 200 mg/kgBB dan peningkatan pada kelompok 100 mg/kgBB dan 400 mg/kgBB, namun yang mengalami perbedaan bermakna (p≤0,05) antara hari ke-0 dan hari ke-49 hanya pada kelompok dosis 100 mg/kgBB. Peningkatan dan penurunan konsentrasi testosteron yang terjadi masih dalam rentang normal konsentrasi testosteron tikus, kecuali pada kelompok dosis 100 mg/kg yang melebihi rentang normal. Berdasarkan hasil penelitian tersebut ekstrak etanol 96% daun sambiloto berpotensi sebagai agen antifertilitas yang dapat dikembangkan.
vii UIN Syarif Hidayatullah Jakarta Name : Astri Dwi Zahrina
Major : Pharmacy
Title : Study of Antifertility Activity of 96% Ethanolic Extract of Sambiloto Leaves (Andrographis paniculata Nees.) in Male Sprague-Dawley Rats In Vivo
Sambiloto contains a main active compound, called andrographolide, a compund which is potential as antifertility agent. This research was an experimental study. Twenty male Sprague-Dawley rats were divided into 4 groups randomly, they were control group (Tween 80 2%), 100 mg/kg body weight; 200 mg/kg body weight; and 400 mg/kg body weight. Male Sprague-Dawley ratswere given 96% ethanolic extract of sambiloto leaves orally for 48 days. Antifertility parameters which were being analyzed in this study were spermatozoa concentration, spermatozoa morphology, the number of pachytene spermatocytes and testosterone concentration. The data resulted from the experiment then being analyzed by using One Way ANOVA. There were unsignificant increase (p≥0.05) in all treatment groups of spermatozoa concentration compared to the control. The results showed significant difference between the control and the treatment, which existed as the significant increase (p≤0.05) of abnormal spermatozoa’s morphology. While the numbers of pachytene spermatocytes in stage VII-VIII decreased significantly (p≤0.05) in all treatment groups compared to the control. The testosterone concentration data were analyzed by using Paired-Sample T-Test and the results showed an unsignificant decrease (p≤0.05) in 200 mg/kg body weight dosage between day-0 and day-49 and in another hand showed a significant increase in 100mg/kg body weight dosage and unsignificant increase in 400 mg/kg body weight dosage between day-0 and day-49. The decreasing and increasing effect of testosterone concentration occurred within the normal range, except for 100 mg/kg body weight dosage which exceeded the normal range. Based on the results, 96% ethanolic extract of sambiloto leaves is potentially as antifertility agent which can be developed further.
viii UIN Syarif Hidayatullah Jakarta
Alhamdulillahirabbil’alamin, segala puji dan syukur kehadirat Allah SWT atas segala rahmat, karunia, dan hidayah-Nya yang telah dilimpahkan kepada
penulis sehingga penulis dapat menyelesaikan penelitian dan penulisan skripsi dengan judul “Uji Aktivitas Antifertilitas Ekstrak Etanol 96% Daun Sambiloto (Andrographis paniculata Nees.) Pada Tikus Jantan Galur Sprague-Dawley Secara In Vivo”. Shalawat serta salam semoga selalu tercurah kepada junjungan Nabi Muhammad SAW, dan para sahabat serta pengikutnya.
Dalam penyelesaian penelitian dan penulisan skripsi ini penulis banyak
menerima bantuan maupun dukungan dari berbagai pihak. Oleh karena itu, pada
kesempatan ini dengan segala kerendahan hati, penulis ingin memberikan
penghargaan yang setinggi-tingginya dan menyampaikan terima kasih yang tulus
kepada :
1. Drs. Arif Sumantri, M.Kes selaku Dekan Fakultas Kedokteran dan Ilmu
Kesehatan
2. Yardi, Ph.D., Apt selaku Kepala Program Studi Farmasi Fakultas
Kedokteran dan Ilmu Kesehatan
3. Dr. Azrifitria, M.Si., Apt dan Syaikhul Aziz, M.Si., Apt sebagai dosen
pembimbing I dan II yang dengan kesabarannya telah memberikan waktu,
ilmu, arahan dan bimbingannya selama penelitian dan penulisan skripsi ini
4. Ayahanda tercinta Jojo Suwarjo dan Ibunda tercinta Ani Sulastriani yang
senantiasa selalu memberikan doa, kasih sayang, dan dukungan baik moral
maupun materi kepada penulis selama ini
5. Kakak dan Adikku tersayang Adhisty Pramanik Putri dan Rifa Tri
Shafhany yang senantiasa memberikan dukungan dan motivasi kepada
penulis.
6. Bapak dan Ibu Dosen yang telah memberikan ilmu dan pengetahuan
hingga penulis dapat menyelesaikan studi di Program Studi Farmasi
Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri (UIN)
ix UIN Syarif Hidayatullah Jakarta Monica, dan Rifda Nailil Muna atas kebersamaan, motivasi dan bantuan
selama penelitian hingga terselesaikannya skripsi ini.
8. Teman-teman yang telah membantu selama penelitian Sry Wardiyah,
Brasti Eka Pratiwi, Fitria Apriani, Rhesa Ramadhan, Sutar, Dini, Rizky
Hidayanti Rambe, Eca, Evi, Sheila, Athiyah, Rahmi.
9. Teman-teman Farmasi Angkatan 2011 atas segala kebersamaanya,
semangat, dan bantuan selama dibangku perkuliahan hingga selesai
pengerjaan skripsi ini.
10.Kak Eris, Kak Tiwi, Kak Lisna, Kak Rani, Kak Rachmadi sebagai laboran
Farmasi UIN Syarif Hidayatullah Jakarta yang telah membantu penulis melakukan penelitian di laboratorium.’
11.Dan kepada semua pihak yang telah membantu selama penelitian dan
penulisan skripsi baik secara langsung maupun tidak langsung yang tidak
bisa penulis sebutkan satu per satu.
Semoga segala bantuan yang telah diberikan kepada penulis mendapatkan
balasan dari Allah SWT.
Penulis menyadari bahwa skripsi ini masih jauh dari sempurna. Untuk itu
penulis mengaharapkan masukan berupa kritik dan saran yang membangun demi
kesempurnaan skripsi ini. Semoga skripsi ini dapat bermanfaat bagi kita semua.
Jakarta, Juni 2015
Penulis
xi UIN Syarif Hidayatullah Jakarta
HALAMAN JUDUL ... ii
HALAMAN PERNYATAAN ORISINALITAS ... iii
HALAMAN PERSETUJUAN PEMBIMBING ... iv
HALAMAN PENGESAHAN ... v
ABSTRAK ... vi
ABSTRACT ... vii
KATA PENGANTAR ... viii
HALAMAN PERSETUJUAN PUBLIKASI KARYA ILMIAH ... x
DAFTAR ISI ... xi
DAFTAR TABEL ... xiv
DAFTAR GAMBAR ... xv
DAFTAR LAMPIRAN ... xvii
BAB 1 PENDAHULUAN ... 1
1.1. Latar Belakang ... 1
1.2. Rumusan Masalah ... 4
1.3.Tujuan Penelitian ... 4
1.4. Hipotesis ... 4
1.5. Manfaat Penelitian ... 5
BAB 2 TINJAUAN PUSTAKA ... 6
2.1. Sambiloto (Andrographis paniculata Nees.) ... 6
2.1.1. Sejarah dan Sinonim ... 6
2.1.2. Klasifikasi ... 6
2.1.3. Morfologi ... 6
2.1.4. Kandungan Kimia ... 8
2.1.5. Andrografolid ... 8
2.1.6. Manfaat ... 9
2.2. Simplisia dan Ekstrak ... 9
xii UIN Syarif Hidayatullah Jakarta
2.3.1. Cara Dingin ... 11
2.3.2. Cara Panas ... 11
2.4. Tinjauan Hewan Percobaan ... 12
2.4.1. Klasifikasi Tikus Putih ... 12
2.4.2. Biologis Tikus Putih (Rattus norvegicus) ... 12
2.5. Sistem Reproduksi Tikus Jantan ... 14
2.5.1. Produksi Sperma ... 17
2.5.2. Spermatogenesis ... 18
2.5.3. Peran Hormon Pada Spermatogenesis ... 21
2.6. ELISA (Enzyme Linked Immunosorbent Assay) ... 22
BAB 3 METODE PENELITIAN ... 27
3.1. Waktu dan Tempat Penelitian ... 27
3.2. Alat dan Bahan ... 27
3.2.1. Hewan Uji ... 27
3.2.2. Bahan Uji ... 27
3.2.2. Bahan Kimia ... 27
3.2.4. Alat ... 28
3.3. Rancangan Penelitian ... 28
3.3.1. Besar Sampel ... 28
3.3.2. Dosis Perlakuan ... 28
3.4. Kegiatan Penelitian ... 29
3.4.1. Pemeriksaan Simplisia (Determinasi) ... 29
3.4.2. Penyiapan Simplisia dan Pembuatan Ekstrak ... 30
3.4.3. Penapisan Fitokimia ... 30
3.4.4. Parameter Spesifik dan Non Spesifik ... 32
3.4.5. Uji kualitatif Andrografolid dengan KLT ... 33
3.4.6. Persiapan Hewan Uji ... 33
3.4.7. Pemberian Perlakuan ... 34
3.4.8. Pembuatan Preparat ... 34
xiii UIN Syarif Hidayatullah Jakarta
4.1. Hasil Penelitian ... 38
4.1.1. Determinasi Tanaman ... 38
4.1.2. Ekstraksi ... 38
4.1.3. Penapisan Fitokimia ... 38
4.1.4. Pengujian Parameter Ekstrak ... 39
4.1.5. Uji Kualitatif Andrografolid dengan KLT ... 39
4.1.6. Perhitungan Konsentrasi Spermatozoa ... 42
4.1.7. Perhitungan Morfologi Spermatozoa ... 43
4.1.8. Pengukuran Konsentrasi Testosteron ... 44
4.1.9. Perhitungan Jumlah Spermatosit Pakiten ... 46
4.2. Pembahasan ... 47
BAB 5 KESIMPULAN DAN SARAN ... 61
5.1. Kesimpulan ... 61
5.2. Saran ... 61
DAFTAR PUSTAKA ... 62
xiv UIN Syarif Hidayatullah Jakarta
Tabel Halaman
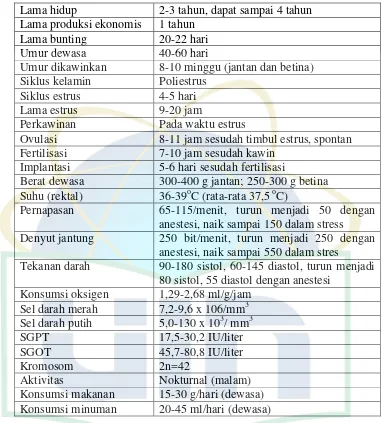
2.1. Data Biologis Tikus ... 14
3.1. Perlakuan Terhadap Kelompok Tikus ... 29
3.2. Pengenceran yang Dilakukan dan Kotak yang Dihitung ... 35
3.3. Cara Pengenceran ... ..36
3.4. Rumus Konsentrasi Spermatozoa ... 36
4.1. Hasil Penapisan Fitokimia Ekstrak ... 38
4.2. Pengujian Parameter Ekstrak ... 39
4.3. Konsentrasi Spermatozoa ... 42
4.4. Morfologi Spermatozoa ... 43
4.5. Konsentrasi Testosteron ... 45
4.6. Jumlah Spermatosit Pakiten ... 46
8.1. Rerata Berat Badan Kelompok Kontrol ... 84
8.2. Rerata Berat Badan Kelompok Dosis Rendah (100 mg/kgBB) ... 84
8.3. Rerata Berat Badan Kelompok Dosis Sedang (200 mg/kgBB) ... 84
xv UIN Syarif Hidayatullah Jakarta
Gambar Halaman
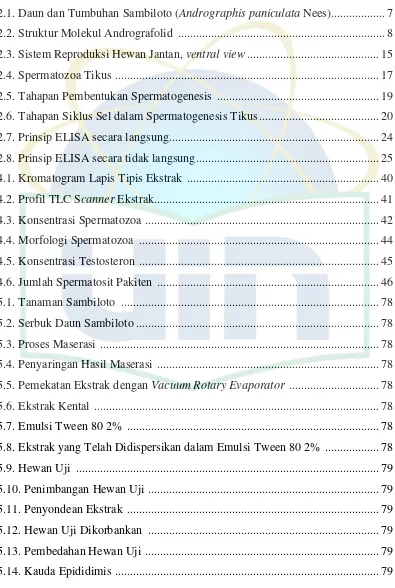
2.1. Daun dan Tumbuhan Sambiloto (Andrographis paniculata Nees)... 7
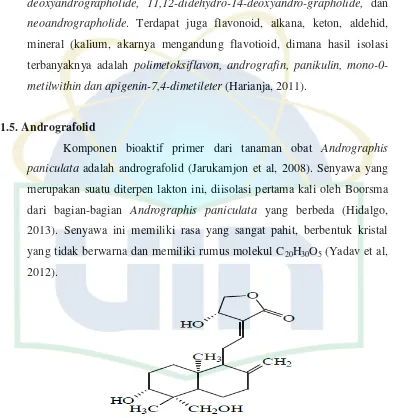
2.2. Struktur Molekul Andrografolid ... 8
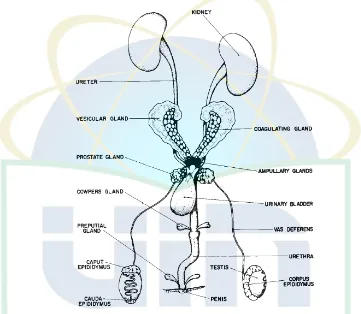
2.3. Sistem Reproduksi Hewan Jantan, ventral view ... 15
2.4. Spermatozoa Tikus ... 17
2.5. Tahapan Pembentukan Spermatogenesis ... 19
2.6. Tahapan Siklus Sel dalam Spermatogenesis Tikus ... 20
2.7. Prinsip ELISA secara langsung ... 24
2.8. Prinsip ELISA secara tidak langsung ... 25
4.1. Kromatogram Lapis Tipis Ekstrak ... 40
4.2. Profil TLC Scanner Ekstrak... 41
4.3. Konsentrasi Spermatozoa ... 42
4.4. Morfologi Spermatozoa ... 44
4.5. Konsentrasi Testosteron ... 45
4.6. Jumlah Spermatosit Pakiten ... 46
5.1. Tanaman Sambiloto ... 78
5.2. Serbuk Daun Sambiloto ... 78
5.3. Proses Maserasi ... 78
5.4. Penyaringan Hasil Maserasi ... 78
5.5. Pemekatan Ekstrak dengan Vacuum Rotary Evaporator ... 78
5.6. Ekstrak Kental ... 78
5.7. Emulsi Tween 80 2% ... 78
5.8. Ekstrak yang Telah Didispersikan dalam Emulsi Tween 80 2% ... 78
5.9. Hewan Uji ... 79
5.10. Penimbangan Hewan Uji ... 79
5.11. Penyondean Ekstrak ... 79
5.12. Hewan Uji Dikorbankan ... 79
5.13. Pembedahan Hewan Uji ... 79
xvi UIN Syarif Hidayatullah Jakarta
5.17. Serum yang Telah Dipisahkan ... 79
5.18. Pengeluaran Spermatozoa dari Kauda Epididimis ... 80
5.19. Penetesean Spermatozoa Pada Bilik Hitung Neubauer ... 80
5.20. Penghitungan Spermatozoa dalam Satu Kotak Besar ... 80
5.21. Pengenceran Spermatozoa dengan Larutan George ... 80
5.22. Hasil Pengenceran Spermatozoa Pada Bilik Hitung Neubauer ... 80
5.23. Perhitungan Konsentrasi Spermatozoa ... 80
5.24. Pengeluaran Spermatozoa dari Kauda Epididimis ... 81
5.25. Pewarnaan Spermatozoa dengan Larutan Eosin Y 1% ... 81
5.26. Preparat Apus ... 81
5.27. Spermatozoa Normal ... 81
5.28. Tanpa Kepala ... 81
5.29. Leher Patah ... 81
5.30. Ekor Patah ... 81
5.31. Serum Sampel Hari ke-0 dan ke-49 ... 82
5.32. Larutan Standar Testosteron ... 82
5.33. Penambahan Larutan Standar Testosteron ... 82
5.34. Penambahan Sampel ... 82
5.35. Penambahan Enzyme Conjugate ... 82
5.36. Pembuangan Isi Sumuran ... 82
5.37. Penambahan Wash Solution ... 82
5.38. Pembuangan Isi Sumuran ... 82
5.39. Penambahan Substrate Solution dan inkubasi 15 menit ... 82
5.40. Penambahan Stop Solution ... 83
5.41. Pembacaan Hasil Pengukuran Konsentrasi Testosteron ... 83
5.42. Testis Dipisahkan dari Kauda Epididimis ... 83
5.43. Testis Dimasukkan dalam Larutan Formalin 10% ... 83
5.44. Preparat Testis Tikus Dilihat Dibawah Mikroskop ... 83
xvii UIN Syarif Hidayatullah Jakarta
Lampiran Halaman
1. Hasil Determinasi Tanaman Sambiloto ... 70
2. Alur Kerja Pembuatan Ekstrak ... 71
3. Alur Kerja Uji Antifertilitas ... 72
4. Perhitungan Dosis Uji Ekstrak Daun Sambiloto ... 73
5. Hasil Penapisan Fitokimia Ekstrak Etanol 96% Daun Sambiloto ... 75
6. Perhitungan Rendemen, Kadar Air, dan Kadar Abu Eksrak ... 77
7. Gambar Kegiatan Penelitian ... 78
8. Rerata Berat Badan Tikus ... 84
9. Hasil Perhitungan Konsentrasi Spermatozoa ... 86
10. Analisa Statistik Data Konsentrasi Spermatozoa ... 87
11. Hasil Perhitungan Morfologi Spermatozoa ... 89
12. Analisa Statistik Data Morfologi Spermatozoa ... 90
13. Hasil Perhitungan Konsentrasi Testosteron ... 93
14. Analisa Statistik Data Konsentrasi Testosteron ... 95
15. Hasil Perhitungan Jumlah Spematosit Pakiten ... 101
1 UIN Syarif Hidayatullah Jakarta
BAB I PENDAHULUAN
1.1. Latar Belakang
Pertambahan penduduk yang pesat merupakan salah satu masalah
bagi negara-negara yang sedang berkembang, termasuk Indonesia.
Pertambahan penduduk yang cepat tidak saja mempersulit usaha
peningkatan dan pemerataan kesejahteraan rakyat di bidang pangan,
lapangan, kerja, pendidikan, kesehatan, dan perumahan, tetapi juga
pembangunan menjadi kurang berarti (Febriani, 2012). Menurut World Population Data Sheet 2014, Indonesia merupakan negara ke-4 di dunia dengan estimasi jumlah penduduk terbanyak, yaitu 251 juta.
Dalam rangka mengurangi laju pertumbuhan penduduk sejak tahun
1970. pemerintah telah melakukan program Keluarga Berencana (KB).
Program KB sebagai salah satu program pembangunan nasional yang
mempunyai arti sangat penting dalam upaya mewujudkan manusia
Indonesia yang sejahtera disamping program-program pembangunan
lainnya. Pembangunan ini diarahkan sebagai upaya pengendalian kuantitas
penduduk melalui Keluarga Berencana, serta pengembangan dan
peningkatan kualitas penduduk melalui perwujudan keluarga kecil yang
berkualitas. Pelaksanaan keluarga berencana ini salah satunya dengan
penggunaan alat kontrasepsi yang tersedia bagi laki-laki dan perempuan.
Kontrasepsi merupakan salah satu program keluarga berencana yang
bertujuan untuk meningkatkan kesejahteraan setiap keluarga (Hartanto,
2004 dan Febriani, 2012).
Menurut hasil survei dari Badan Kependudukan dan Keluarga
Berencana Nasional (BKKBN) tahun 2013, dilihat dari jenis kelamin,
metode kontrasepsi perempuan yang digunakan jauh lebih besar dibanding
dengan metode kontrasepsi laki-laki. Metode kontrasepsi perempuan
sebesar 93,66%, sementara metode kontrasepsi laki-laki hanya sebesar
6,34%. Hal ini menunjukkan bahwa partisipasi laki-laki dalam
UIN Syarif Hidayatullah Jakarta laki-laki dalam program KB dikarenakan oleh terbatasnya pilihan
kontrasepsi yang dapat digunakan. Metode kontrasepsi laki-laki dengan
menggunakan alat yang tersedia antara lain kondom dan vasektomi (Wati,
2012). Namun hasilnya belum sepenuhnya diterima masyarakat, karena
efek samping yang tidak dapat diabaikan dan belum 100% dapat
mencegah kehamilan (Priastini, 2014). Hal tersebut bisa dilihat dari
efektivitas masing-masing metode kontrasepsi pada pria. Metode
kontrasepsi kondom memiliki angka kegagalan berkisar antara 15-36%.
Efektivitas yang tidak terlalu tinggi terjadi karena pemakaian yang kurang
teliti dalam mematuhi petunjuk cara pemakaiannya (Setyaningsih, 2008).
Vasektomi adalah cara KB permanen bagi pria yang sudah memutuskan
tidak ingin mempunyai anak lagi (Desra, 2011). Efektivitas vasektomi
sangatlah tinggi, artinya kemungkinan gagal kecil sekali (0,15%) jika
tindakan medis dilakukan secara benar (Budisantoso, 2008).
Dalam upaya meningkatkan keikutsertaan kaum pria dalam
keluarga berencana perlu dilakukan penelitian obat antifertilitas yang
dapat digunakan oleh kaum pria. Metode KB untuk pria yang efektif
haruslah aman, reversible, bereaksi cepat, diterima oleh pemakai, dan tidak mempengaruhi kemampuan seksual atau libido. Bentuk
pengaturannya harus mudah dan harganya terjangkau. Badan Kesehatan
Dunia (World Health Organization / WHO) mencari dan mengembangkan metode pengaturan kesuburan pria. Salah satu cara yang dilakukan adalah
melalui bahan maupun zat dari tumbuhan, yang diduga mengandung
bahan antifertilitas, dan dianggap aman, efektif, dan dapat diterima
masyarakat (Febriani, 2012 dan Setia, 2012).
Penggunaan tumbuhan obat sebagai kontrasepsi telah lama dikenal
masyarakat terutama di berbagai daerah di Indonesia. Kontrasepsi
tradisional banyak ditemukan di daerah pedesaan, yang tradisi
masyarakatnya masih memegang teguh kebiasaan nenek moyangnya
(Febriani, 2012). Dari penelitian yang telah dilakukan oleh Muslichah et al (2014) bahwa pemberian fraksi n-heksana, fraksi kloroform, dan fraksi
UIN Syarif Hidayatullah Jakarta penurunan jumlah, viabilitas, motilitas, serta peningkatan abnormalitas
spsermatozoa yang signifikan dibandingkan dengan kontrol. Selain itu,
pada penelitian oleh Nuraini et al (2012) penyuntikan ekstrak biji papaya selama 21 hari dapat mempengaruhi terhadap penurunan motilitas,
viabilitas dan bentuk spermatozoa normal.
Salah satu tanaman tradisional yang diharapkan dapat menjadi
antifertilitas adalah tanaman Sambiloto (Andrographis paniculata Nees.) Dari sekian banyak senyawa kimia yang terdapat dalam sambiloto,
senyawa yang berperan sebagai antifertilitas adalah andrographolide. Andrographolide adalah zat aktif dalam sambiloto yang berfungsi untuk mencegah pembelahan sel (sitokenesis) pada tahapan spermatogenik.
Andrographolide dapat mempengaruhi sel-sel spermatogenesis dalam tubulus seminiferus dan berpengaruh pada kualitas spermatozoa yang
dihasilkan (Widyawati, 2007 dan Christijanti, 2007).
Penelitian tentang tanaman sambiloto yang berpotensi sebagai
antifertilitas secara tradisional belum banyak diteliti di Indonesia. Pada
penelitian sebelumnya oleh Kumar et al. (2011) dilaporkan bahwa aktivitas ekstrak air daun sambiloto dengan dosis 100 dan 200 mg/kg BB
pada tikus jantan dapat berpengaruh pada berkurangnya berat testis,
epididimis dan vesikula seminalis. Dan juga berpengaruh pada penurunan
serum testosteron, jumlah sperma testikular, jumlah sperma epididimis,
motilitas spermatozoa dan morfologi spermatozoa yang normal jika
dibandingkan dengan kontrol.
Hal ini kemudian melatarbelakangi perlunya penelitian lebih lanjut
untuk pengujian antifertilitas yang belum dilakukan oleh peneliti
sebelumnya dengan menggunakan pelarut etanol. Menurut Depkes RI
(2005), pelarut yang diperbolehkan untuk ekstrak tumbuhan obat adalah
air dan etanol. Menurut Kumoro, dkk (2009) dilaporkan bahwa senyawa
andrographolide akan lebih banyak tertarik pada pelarut seperti metanol dan etanol dibandingkan dengan air dan pelarut lainnya. Penelitian ini
dilakukan selama 48 hari dengan menggunakan dosis yang sama dengan
UIN Syarif Hidayatullah Jakarta dengan penambahan dosis yaitu 400 mg/kgBB. Pengujian dilakukan untuk
melihat pengaruh ekstrak etanol daun sambiloto (Andrographis paniculata Nees.) terhadap morfologi spermatozoa, jumlah spermatosit pakiten,
konsentrasi spermatozoa dan konsentrasi hormon testosteron serum pada
tikus putih jantan galur Sprague-Dawley secara in vivo.
1.2. Rumusan Masalah
Berdasarkan uraian dari latar belakang diatas, maka rumusan
masalahnya adalah sebagai berikut :
Apakah ada pengaruh pemberian ekstrak etanol 96% daun
sambiloto (Andrographis paniculata Nees.) terhadap konsentrasi spermatozoa, morfologi spermatozoa, konsentrasi testosteron dan jumlah
spermatosit pakiten pada tikus putih jantan galur Sprague-Dawley secara in vivo?
1.3. Tujuan Penelitian
Penelitian ini bertujuan untuk menguji efek antifertilitas ekstrak
etanol 96% daun sambiloto (Andrographis paniculata Nees.) terhadap konsentrasi spermatozoa, morfologi spermatozoa, konsentrasi testosteron
dan jumlah spermatosit pakiten tikus putih jantan galur Sprague-Dawley secara in vivo.
1.4. Hipotesis
Hipotesis dari penelitian ini adalah ekstrak etanol 96% daun
sambiloto (Andrographis paniculata Nees.) dapat menurunkan konsentrasi spermatozoa, konsentrasi testosteron dan jumlah spermatosit pakiten serta
meningkatkan abnormalitas morfologi spermatozoa tikus putih jantan
UIN Syarif Hidayatullah Jakarta
1.5. Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi bagi
masyarakat luas mengenai aktivitas dari bahan alami yang berasal dari
daun Sambiloto (Andrographis paniculata Nees.) sebagai agen antifertilitas dan memberikan informasi yang bermanfaat dalam
perkembangan ilmu reproduksi yang kemudian dapat digunakan sebagai
6 UIN Syarif Hidayatullah Jakarta
BAB 2
TINJAUAN PUSTAKA
2.1. Sambiloto (Andrographis paniculata Nees.) 2.1.1. Sejarah dan Sinonim
Tumbuhan Sambiloto bukanlah tumbuhan asli Indonesia, tetapi
diduga berasal dari India. Menurut data spesimen yang ada di Herbarium
Bogoriense di Bogor, sambiloto sudah ada di Indonesia sejak 1893.
Tumbuhan ini kemudian menyebar ke daerah tropis Asia hingga sampai di
Indonesia. Di beberapa daerah di Indonesia, tumbuhan sambiloto dikenal
dengan berbagai nama, yaitu : ampadu tanah (Minang); pepaitan (Melayu);
bidara, sambiroto, sandiloto, sadilata, takilo, paitan, sambiloto (Jawa); ki
oray, takila, ki peurat (Sunda); samiroto (Bali). Sementara itu nama asing
dari tumbuhan sambiloto adalah (Bahasa inggris) king of bitter, green chiretta (Widyawati, 2007).
2.1.2. Klasifikasi
Dalam Sistematika (taksonomi), tumbuhan sambiloto dapat
diklasifikasikan sebagai berikut :
Kingdom : Plantae
Divisi : Spermatophyta
Class : Dicotyledoneae
Ordo : Solanales
Famili : Acanthaceaae
Genus : Andrographis
Species : Andrographis paniculata Nees. (BPOM RI, 2012)
2.1.3. Morfologi
Tumbuhan berhabitus terna semusim, tumbuh tegak, tinggi dapat
mencapai 90 cm, batang berbentuk segi empat dengan rusuk yang jelas,
menebal di bagian buku-buku batang. Helaian daun merupakan daun
UIN Syarif Hidayatullah Jakarta panjang 3-12 cm, lebar 1 -3 cm, panjang tangkai daun 0,2-0,5 cm, pangkal
dan ujung helaian daun runcing, tepi daun rata, permukaan atas hijau tua,
bagian bawah hijau muda. Perbungaan berupa bunga majemuk malai rata,
di bagian ujung batang atau di bagian ketiak daun di bagian atas. Kelopak
bunga berlekatan terbagi menjadi 5 helai. Daun mahkota 5, berlekatan
membentuk tabung mahkota bunga, panjang tabung 6 mm, panjang
helaian daun mahkota lebih dari panjang tabung mahkota, 2 helai daun
mahkota di bagian atas (bibir atas) berwarna putih dengan garis kuning di
bagian ujungnya, panjang helaian 7-8 mm, bibir bawah terdiri atas 3
helaian daun mahkota, putih atau putih disertai warna ungu. Tangkai sari
5, ukuran tangkai sari sepanjang mahkota bunga, tangkai sari melebar di
bagian pangkal. Tangkai putik panjang, melebihi panjang mahkota bunga.
Buah berbentuk kapsul, berkatup dan berisi 3-7 biji berwarna coklat tua.
Berbunga sepanjang tahun, semua bagian tanaman terutama daun sangat
pahit (BPOM RI, 2012).
a.
b.
Gambar 2.1. a. Koleksi Pribadi Tumbuhan Sambiloto b.Daun dan Tumbuhan Sambiloto (Andrographis paniculata Nees.)
UIN Syarif Hidayatullah Jakarta
2.1.4. Kandungan Kimia
Daun tumbuhan sambiloto yang memiliki sifat kimiawi berasa
pahit, dingin, memiliki kandungan kimia sebagai berikut: daun dan
percabangannya mengandung lakton yang terdiri dari andrograpgolide, deoxyandrographolide, 11,12-didehydro-14-deoxyandro-grapholide, dan neoandrographolide. Terdapat juga flavonoid, alkana, keton, aldehid, mineral (kalium, akarnya mengandung flavotioid, dimana hasil isolasi
terbanyaknya adalah polimetoksiflavon, andrografin, panikulin, mono-0-metilwithin dan apigenin-7,4-dimetileter (Harianja, 2011).
2.1.5. Andrografolid
Komponen bioaktif primer dari tanaman obat Andrographis paniculata adalah andrografolid (Jarukamjon et al, 2008). Senyawa yang merupakan suatu diterpen lakton ini, diisolasi pertama kali oleh Boorsma
dari bagian-bagian Andrographis paniculata yang berbeda (Hidalgo, 2013). Senyawa ini memiliki rasa yang sangat pahit, berbentuk kristal
yang tidak berwarna dan memiliki rumus molekul C20H30O5 (Yadav et al,
2012).
Gambar 2.2 Struktur Molekul Andrografolid Sumber : Jadhao et al. 2014
Andrografolid larut dalam metanol, etanol, piridin, asam asetat,
dan aseton tetapi kurang larut dalam eter dan air. Titik lebur andrografolid
adalah 228-230oC (Jadhao et al, 2014). Kandungan maksimum
andrografolid dan diterpen lainnya terdapat dalam daun yang matang.
UIN Syarif Hidayatullah Jakarta daun 2.39%. Kandungan andrografolid bervariasi tergantung pada musim
pemanenan. Kandungan andrografolid dalam daun lebih dari 2% terdapat
pada saat sebelum tanaman berbunga, setelah itu kandungannya berkurang
hingga kurang dari 0.5% (Hidalgo et al, 2013). Panjang gelombang
maksimum senyawa andrografolid yaitu 230-235 nm (Awal, 2011;
Nugroho, 2014; Chamoli, 2013).
2.1.6. Manfaat
Tumbuhan ini rasanya sangat pahit akibat adanya zat andrografolid
dan bersifat dingin, masuk meridian jantung dan paru-paru. Bisa
digunakan untuk mencegah pembentukan radang, memperlancar air seni
(diuretik), menurunkan panas badan (piretik), obat sakit perut, kencing
manis dan keracunan (Afifah, 2005).
Tumbuhan sambiloto juga berkhasiat sebagai obat amandel, obat
asam urat, obat batuk rejan, obat diabetes melitus, obat hipertensi,
hepatitis, stroke, TBC, menguatkan daya tahan tubuh terhadap serangan
flu babi dan flu burung Daun tumbuhan sambiloto bermanfaat untuk
menurunkan demam tinggi dan malaria. Selain itu, daun tumbuhan
sambiloto berkhasiat untuk mengatasi: hepatitis, infeksi saluran empedu,
disentri basiler, tifoid, diare, influenza, radang amandel (tonsilitis), abses
paru, radang paru (pneumonia), radang saluran napas (Bronkitis), radang
ginjal akut (pielonefritis akut), radang telinga, kencing nanah (gonore),
kencing manis (diabetes melitus), tumor trofoblas (trofoblas ganas), serta
tumor paru, kanker: penyakit trofoblas seperti kehamilan anggur (mola
hidatidosa), batuk rejan (pertusis), sesak napas (asma), darah tinggi
(hipertensi) (Harianja, 2011).
2.2. Simplisia dan Ekstrak 2.2.1. Simplisia
Simplisia adalah bahan alamiah yang dipergunakan sebagai obat
yang belum mengalami pengolahan apapun juga dan kecuali dinyatakan
lain berupa bahan yang dikeringkan (Depkes RI, 1995). Simplisia dibagi
UIN Syarif Hidayatullah Jakarta simplisia pelican (mineral). Simplisia nabati adalah simplisia yang berupa
tanaman utuh, bagian tanaman atau eksudat tanaman. Eksudat tumbuhan
adalah isi sel yang secara spontan keluar dari tumbuhan atau isi sel yang
dengan cara tertentu dikeluarkan dari selnya atau senyawa nabati lainnya
yang dengan cara tertentu dipisahkan dari tumbuhannya dan belum berupa
zat kimia (Depkes RI, 2000).
2.2.2. Ekstrak
Ekstrak adalah sediaan kental yang diperoleh dengan
mengekstraksi senyawa aktif dari simplisia nabati atau simplisia hewani
menggunakan pelarut yang sesuai, kemudian semua atau hampir semua
pelarut diuapkan dan massa atau serbuk yang tersisa diperlakukan
sedemikian hingga memenuhi baku yang telah ditetapkan (Depkes RI,
2000)
Ada beberapa jenis ekstrak yakni : ekstrak cair, ekstrak kental dan
ekstrak kering. Ekstrak cair adalah sediaan dari simplisia nabati yang
mengndung etanol sebagai pelarut atau sebagai pengawet. Jika tidak
dinyatakan lain pada masing-masing monografi tiap mL ekstrak
mengandung senyawa aktif dari 1 g simplisia yang memenuhi syarat.
Ekstrak cair jika hasil ekstraksi masih bisa dituang biasanya kadar air lebih
30%. Ekstrak kental jika memiliki kadar air antara 5 – 30 %. Ekstrak
kering jika mengandung kadar air kurang dari 5% (Saifudin dkk, 2011).
2.3. Ekstraksi
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat
larut sehingga terpisah dari bahan yang tidak dapat larut dengan pelarut
cair. Senyawa aktif yang terdapat dalam berbagai simplisia dapat
digolongkan ke dalam golongan minyak atsiri, alkaloid, flavonoid dan
lain-lain. Diketahuinya senyawa aktif yang dikandung oleh simplisia akan
mempermudah pemilihan pelarut dan cara ekstraksi yang tepat. Simplisia
yang lunak seperti rimpang dan daun mudah diserap oleh pelarut, karena
UIN Syarif Hidayatullah Jakarta yang keras seperti biji, kulit kayu dan kulit akar susah diserap oleh pelarut,
karena itu perlu diserbuk sampai halus (Depkes RI, 2000).
2.3.1. Cara Dingin a. Maserasi
Maserasi adalah proses penyarian simplisia dengan perendaman
menggunakan pelarut dengan pengadukan pada temperatur kamar.
Maserasi yang dilakukan dengan pengadukan secara terus menerus disebut
maserasi kinetik sedangkan yang dilakukan pengulangan penambahan
pelarut setelah dilakukan penyarian terhadap maserat pertama dan
selanjutnya adalah remaserasi (Depkes RI, 2000).
b. Perkolasi
Perkolasi merupakan proses ekstraksi simplisia dengan menggunakan
pelarut yang selalu baru sampai sempurna yang umumnya dilakukan pada
temperatur ruangan. Proses terdiri dari tahapan pengembangan bahan,
tahap maserasi antara, tahap perkolasi sebenanya (penetesan atau
penampungan ekstrak), terus menerus sampai diperoleh ekstrak (perkolat)
yang jumlahnya 1-5 kali bahan (Depkes RI, 2000).
2.3.2 Cara Panas a. Refluks
Refluks merupakan ekstraksi simplisia menggunakan pelarut berdasarkan
titik didihnya, selama waktu tertentu yang jumlah pelarut terbatas yang
relatif konstan dengan adanya pendingin balik. Umumnya dilakukan
pengulangan proses pada residu pertama sampai 3-5 kali sehingga dapat
termasuk proses ekstraksi sempurna (Depkes RI, 2000).
b. Sokletasi
Sokletasi merupakan ekstraksi simplisia menggunakan pelarut yang selalu
baru yang umumnya dilakukan menggunakan alat khusus sehingga terjadi
ekstraksi kontinu dengan jumlah pelarut relatif konstan dengan adanya
UIN Syarif Hidayatullah Jakarta c. Digesti
Digesti merupakan maserasi kinetik pada temperatur yang lebih tinggi dari
temperatur ruangan (kamar), biasanya dilakukan pada temperatur 40-50⁰C.
(Depkes RI, 2000).
d. Infus
Infus merupakan ekstraksi simplisia menggunakan pelarut air pada
temperatur penangas air (bejana infus tercelup dalam penangas air
mendidih, temperatur terukur (96-98⁰C) selama waktu tertentu (15-20
menit) (Depkes RI, 2000).
e. Dekok
Dekok merupakan infus pada waktu yang lebih lama (≥ 30 menit) dan temperatur sampai titik didih air (Depkes RI, 2000).
2.4. Tinjauan Hewan Percobaan 2.4.1. Klasifikasi Tikus Putih
Menurut Krinke (2000) klasifikasi tikus putih (Rattus norvegicus) adalah sebagai berikut :
Kingdom : Animalia
Phylum : Chordata
Subphylum : Vertebrata
Class : Mammalia
Order : Rodentia
Family : Muridae
Genus : Rattus Species : norvegicus
2.4.2. Biologis Tikus Putih (Rattus norvegicus)
Hewan laboratorium atau hewan percobaan adalah hewan yang
sengaja dipelihara dan diternakkan untuk dipakai sebagai hewan model
guna mempelajari dan mengembangkan berbagai macam bidang ilmu
dalam skala penelitian atau pengamatan laboratorik. Tikus termasuk
UIN Syarif Hidayatullah Jakarta mungkin tidak jauh berbeda dibanding dengan mamalia lainnya. Selain itu,
penggunaan tikus sebagai hewan percobaan juga didasarkan atas
pertimbangan ekonomis dan kemampuan hidup tikus hanya 2 – 3 tahun
dengan lama produksi 1 tahun.
Kelompok tikus laboratorium pertama-tama dikembangkan di
Amerika Serikat antara tahun 1877 dan 1893. Keunggulan tikus putih
dibanidngkan tikus liar antara lain lebih cepat berkembang biak. Kelebihan
lainnya sebagai hewan laboratorium adalah sangat mudah ditangani, dapat
ditinggal sendirian dalam kandang asal dapat mendengar suara tikus lain
dan berukuran cukup besar sehingga memudahkan pengamatan. Secara
umum, berat badan tikus laboratorium lebih ringan dibandingkan berat
badan tikus liar. Biasanya pada umur empat minggu beratnya 35 – 40 g,
dan berat dewasa rata-rata 200-250 g, tetapi bervariasi tergantung pada
galur. Galur Sprague Dawley merupakan galur yang paling besar diantara galur yang lain.
Terdapat beberapa galur tikus yang sering digunakan dalam
penelitian. Galur-galur tersebut antara lain : Wistar, Sprague-Dawley, Long Evans, dan Holdzman. Dalam penelitian ini digunakna galur Sprague-Dawley dengan ciri-ciri berwarna putih, berkepala kecil dan
ekornya lebih panjang daripada badannya Tikus ini pertama kali
diproduksi oleh peternakan Sprague Dawley. Tikus Sprague Dawley merupakan jenis outbred tikus albino serbaguna secara ekstensif dalma
riset medis. Keuntungan utamanya adalah ketenangan dan kemudahan
UIN Syarif Hidayatullah Jakarta
Tabel 2.1. Biologis tikus putih (Smith dan Mangkoewidjojo, 1998) Lama hidup 2-3 tahun, dapat sampai 4 tahun
Lama produksi ekonomis 1 tahun
Lama bunting 20-22 hari
Umur dewasa 40-60 hari
Umur dikawinkan 8-10 minggu (jantan dan betina) Siklus kelamin Poliestrus
Siklus estrus 4-5 hari
Lama estrus 9-20 jam
Perkawinan Pada waktu estrus
Ovulasi 8-11 jam sesudah timbul estrus, spontan Fertilisasi 7-10 jam sesudah kawin
Implantasi 5-6 hari sesudah fertilisasi
Berat dewasa 300-400 g jantan; 250-300 g betina Suhu (rektal) 36-39oC (rata-rata 37,5 oC)
Pernapasan 65-115/menit, turun menjadi 50 dengan anestesi, naik sampai 150 dalam stress Denyut jantung 250 bit/menit, turun menjadi 250 dengan
anestesi, naik sampai 550 dalam stres
Tekanan darah 90-180 sistol, 60-145 diastol, turun menjadi 80 sistol, 55 diastol dengan anestesi
Konsumsi oksigen 1,29-2,68 ml/g/jam Sel darah merah 7,2-9,6 x 106/mm3 Sel darah putih 5,0-130 x 103/ mm3
SGPT 17,5-30,2 IU/liter
SGOT 45,7-80,8 IU/liter
Kromosom 2n=42
Aktivitas Nokturnal (malam)
Konsumsi makanan 15-30 g/hari (dewasa) Konsumsi minuman 20-45 ml/hari (dewasa)
2.5. Sistem Reproduksi Tikus Jantan
Sistem reproduksi tikus jantan terdiri atas testis dan skrotum,
epididimis dan vas deferens, sisa kelenjar ekskretori pada masa embrio
yang berfungsi untuk transport sperma, kelenjar asesoris, uretra dan penis.
Selain uretra dan penis, semua struktur ini berpasangan (Meldawati, 2011).
Testis dari tikus jantan terdapat pada dua kantung skrotum yang
dipisahkan oleh membran tipis yang terletak antara anus dan preputium.
Testis terdiri dari tubulus seminiferus yang panjang dan berkelok-kelok,
yang pada epitelnya merupakan tempat berlangsungnya spermatogenesis.
UIN Syarif Hidayatullah Jakarta Epididimis terdiri dari tiga bagian yaitu kapus epididimis yang membesar
di ujung proksimal pada testis, yang hampir seluruhnya terbenam ke dalam
lemak; korpus epididimis yang terdapat di sekitar dorsomedial testis serta
kauda epididimis pada ujung distal testis, merupakan tempat pematangan
spermatozoa yang kemudian bermuara ke vas deferens (Suckow, 2006).
Gambar 2.3. Sistem Reproduksi Hewan Jantan, ventral view
(Sumber : Suckow, 2006)
Pada hewan yang melakukan fertilisasi secara interna organ
reproduksinya dilengkapi dengan adanya organ kopulatori, yaitu suatu
organ yang berfungsi menyalurkan spermatozoa dari organisme jantan ke
betina. Peranan hewan jantan dalam hal reproduksi terutama adalah
memproduksi spermatozoa dan sejumlah kecil cairan untuk
memungkinkan sel spermatozoa masuk menuju rahim (William, 2005).
Tikus memiliki lima pasang kelenjar seks aksesori yang terletak
didalam panggul dan yang mengelilingi kandung kemih (Gambar 2.2)
UIN Syarif Hidayatullah Jakarta berada pada bagian dorsal dan ventral dari duktus deferens; sepasang
kelenjar vesikular yang membelit dan berbentuk sabit besar, serta satu
pasang kelenjar koagulasi yang terdapat dalam kelenjar vesikular.
Sepasang kelenjar bolbouretralis yang berada pada otot bolboglandular
(Suckow, 2006).
Vesikula seminalis dan kelanjar koagulasi merupakan bagian yang
penting untuk fertilisasi pada tikus. Kedua organ tersebut mensekresikan
cairan yang diperlukan untuk pembentukan sumbat vagina. Peran sumbat
vagina belum dipahami dengan baik dalam pengamatan mengenai
kehamilan yang jarang terjadi tanpa adanya pembentukan sumbat vagina
tersebut, tetapi diduga bertindak sebagai reservoir untuk pelepasan sperma
secara bertahap atau untuk mencegah keluarnya sperma dari vagina
(Suckow, 2006).
Testis memiliki dua fungsi, yaitu sebagai tempat spermatogenesis
dan produksi androgen. Oleh sebab itu, testis dapat juga dikatakan sebagai
kelenjar ganda karena secara fungsional bersifat endokrin dan juga
eksokrin. Fungsi endokrin terletak pada sel Leydig yang menghasilkan
androgen, terutama testosteron. Fungsi eksokrin terletak pada epitelium
seminiferus yang menghasilkan spermatozoa (Fawcett, D.W. 2002).
Spermatogenesis terjadi dalam suatu struktur yang disebut tubulus
seminiferus. Tubulus ini berlekuk-lekuk dalam lobus yang semuanya
duktusnya kemudian meninggalkan testis dan masuk ke dalam epididimis.
Produksi androgen terjadi dalam kantung dari sel khusus yang terdapat di
daerah interstitial antara tubulus. Tubulus seminiferus dilapisi oleh
epitelium yang dilapisi oleh epitelium bertingkat yang sangat kompleks
yang mengadung sel spermatogenik dan sel-sel yang menunjang. Sel-sel
penunjang berjenis tunggal disebut sel sertoli (Heffner, L.J. dan Schust,
D.J. 2005).
Tubulus seminiferus dikelilingi oleh membran basal. Didekat
membran basal ini terdapat sel progenitor untuk produksi spermatozoa.
Epitel yang mengandung spermatozoa yang sedang berkembang
UIN Syarif Hidayatullah Jakarta potongan melintang testis, spermatosit dalam tubulus berada dalam
berbagai tahap pematangan. Diantara spermatosit terdapat sel sertoli. Sel
ini secara metabolik dan struktural berguna untuk menjaga spermatozoa
yang sedang berkembang. Sel sertoli memiliki jari-jari sitoplasma yang
besar dan kompleks yang dapat mengelilingi banyak spermatozoa dalam
suatu waktu. Sel ini juga berfungsi pada proses merubah prekusor
androgen menjadi estrogen, suatu produk yang menghasilkan pengaturan
umpan balik lokal pada sel leydig yang memproduksi androgen. Selain itu,
sel sertoli juga menghasilkan protein pengikat androgen. Produksi sel
androgen sendiri terjadi di dalam kantong dari sel khusus (sel Leydig)
yang terdapat di daerah interstitial antara tubulus-tubulus seminiferous
(Heffner, L.J. dan Schust, D.J. 2005).
2.5.1. Produksi Sperma
Proses produksi spermatozoa di dalam testis disebut
spermatogenesis. Spermatozoa pada hewan pengerat lebih panjang dari
spesies mamalia lain, termasuk mamalia dan hewan domestik pada
umumnya (Krinke, 2000). Produksi sperma tiap hari pada tikus adalah
35,4 x 106/mL, tidak berbeda signifikan dengan manusia yakni 45,5 x
106/mL. Epitel seminiferus tikus mengandung 40% lebih sel
spermatogenik dari volumenya, dua kali lebih banyak dari epitel
seminiferus manusia (Ilyas, 2007).
UIN Syarif Hidayatullah Jakarta
2.5.2. Spermatogenesis
Dasar pengetahuan yang cukup telah dibangun tentang
spermatogenesis pada tikus. Sel primodial germinal yang telah berhenti
bermigrasi diliputi oleh sel Sertoli dan membran basal yang menonjol
dalam tubulus seminiferus pada alat kelamin tikus jantan. Sel kelamin
jantan tetap tidak aktif sampai sebelum masa pubertas, yaitu sekitar 50 hari
setelah kelahiran. Pada tahap itu mereka mulai membelah dan menjadi
spermatogonium, dan kemudian terus membelah sampai hewan kehilangan
kemampuan untuk memproduksi spermatozoa (Krinke, 2000).
Spermatogenesis merupakan proses pembentukan spermatozoa.
Proses ini dimulai dengan sel benih primitif, yaitu spermatogonium. Pada
saat terjadinya perkembangan sel kelamin, sel ini mulai mengalami
mitosis, dan menghasilkan generasi sel-sel yang baru. Sel-sel ini dapat
terus membelah sebagai sel induk, yang disebut spermatogonium tipe A,
atau dapat berdeferensiasi selama siklus mitosis yang progresif menjadi
spermatogonium B. Spermatogonium B merupakan sel progenitor yang
akan berdeferensiasi menjadi spermatosit primer. Segera setelah terbentuk,
sel-sel ini memasuki tahap profase dari pembelahan meiosis pertama.
Spermatosit primer merupakan sel terbesar dalam garis keturunan
spermatogenik ini dan ditandai dengan adanya kromosom dalam berbagai
UIN Syarif Hidayatullah Jakarta
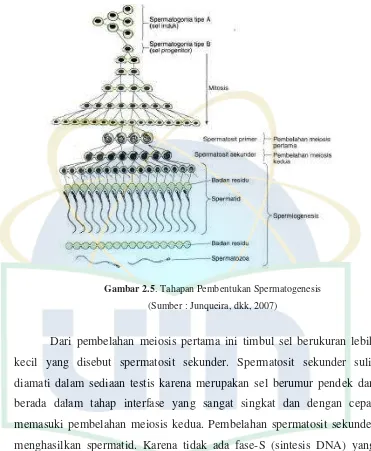
Gambar 2.5. Tahapan Pembentukan Spermatogenesis (Sumber : Junqueira, dkk, 2007)
Dari pembelahan meiosis pertama ini timbul sel berukuran lebih
kecil yang disebut spermatosit sekunder. Spermatosit sekunder sulit
diamati dalam sediaan testis karena merupakan sel berumur pendek dan
berada dalam tahap interfase yang sangat singkat dan dengan cepat
memasuki pembelahan meiosis kedua. Pembelahan spermatosit sekunder
menghasilkan spermatid. Karena tidak ada fase-S (sintesis DNA) yang
terjadi antara pembelahan meiosis pertama dan kedua pada spermatosit,
jumlah DNA per sel berkurang setengah selama pembelahan kedua ini,
yang menghasilkan sel haploid (n). Oleh karena itu, proses meiosis
menghasilkan sel dengan jumlah kromosom haploid. Dengan adanya
pembuahan, sel memperoleh kembali jumlah diploid yang normal
UIN Syarif Hidayatullah Jakarta
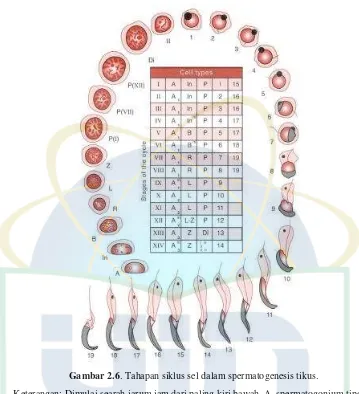
Gambar 2.6. Tahapan siklus sel dalam spermatogenesis tikus.
Keterangan: Dimulai searah jarum jam dari paling kiri bawah. A, spermatogonium tipe A;
In, spermatogonium tipe intermediate; B, spermatogonium tipe B; R, spermatosit primer
isitirahat; L, spermatosit leptoten; Z,spermatosit zigoten; P(I), P(VII), P(XII, awal,
pertengahan, dan akhir spermatosit pakiten. Angka romawi menunjukkan tahap siklus
dimana mereka ditemukan; Di, diploten; II, spermatosit sekunder; 1-19, tahapan
spermiogenesis. Tabel ditengah memberikan komposisi celular tahapan siklus epitel
seminiferus (I-XIV). M. Superscript mengindikasikan terjadinya mitosis. (Sumber:
Krinke,G.J. 2000)
Spermatogonium secara kasar diklasifikasikan menjadi tiga jenis:
Jenis A, intermediate dan B (Gambar 2.5). Pada tikus, spermatogonium
kemudian mengalami enam kali mitosis, dan kemudian menjadi sermatosit
UIN Syarif Hidayatullah Jakarta mengalami spermiogenesis menjadi: spermatid fase golgi (1-3),
terdapatnya granul kromosom; fase cap (4-7), adanya head cap pada granul akrosom yang membesar dan menutupi 1/3 bagian nukleus; fase
akrosom (8-14), nukleus dan head cap memanjang; fase maturasi (15-18) nukleusnya menjadi lebih pendek dan sitoplasma terkondensasi di
sepanjang ekor yang telah mulai memanjang; hingga dihasilkan
spermatozoa (19) yang dilepaskan ke lumen dengan ekor menghadap ke
lumen (Krinke, 2000).
Pada tikus, 14 tahap siklus spermatogenesis terjadi didalam tubulus
seminifeus. Tubulus memiliki pengaturan bertahap dan setiap bagian dari
tubulus menunjukkan tahapan yang melibatkan empat atau lima generasi
dari sel germinal yang selaras (Gambar 2.6). Pada tikus, dibutuhkan waktu
selama 12 hari untuk menyelesaikan satu siklus yang terdiri dari 14
tahapan. Sebuah spermatogonium tikus membutuhkan empat siklus untuk
akhirnya membentuk spermatozoa, sehingga diperlukan waktu 48 hari
untuk menyelesaikan langkah spermatogenesis secara keseluruhan
(Krinke, 2000).
2.5.3. Peran Hormon Pada Spermatogenesis
Dalam sistem reproduksi pria, regulasi hormonal memiliki peran
yang sangat penting. Hipotalamus, hipofisis anterior, dan testis adalah
suatu poros yang mengambil bagian terdepan di dalam proses regulasi
tersebut. Melalui sekresi hormon-hormon seks, organ-organ tersebut
mengatur proses spermatogenesis, spermiogenesis dan membentuk seks
sekunder pria (Pramudito, 2009).
GnRH hipotalamus, yang disekresi ke dalam system portal
hipofisis bekerja pada hipofisis pria untuk menstimulasi sintesis dan
pelepasan gonadotropin FSH (Folicle Stimulating Hormone) dan LH (Luteinizing Hormone). Kedua hormon ini mengatur aktivitas spermatogenik dan endokrin testis (Heffner, L.J. and Schust J.D, 2005).
Spermatogenesis tergantung pada testosteron yang dihasilkan oleh
UIN Syarif Hidayatullah Jakarta kelenjar hipofisis. Pelepasan LH oleh sel hipofisis diatur dengan negative feedback. Kadar sintesis testosteron yang meningkat oleh sel Leydig, menekan pelepasan LH dan sebaliknya kadar rendah testosteron
menyebabkan pelepasan LH meningkat (Fawcett, D.W., 2002).
Hormon gonadotropik lain, FSH melekat secara spesifik dengan sel
tubulus seminiferus, yang diperlukan untuk inisiasi spermatogenesis.
Tempat kerja utama FSH pada epitel seminiferus adalah di dalam sel
sertoli. Aktivasi reseptor FSH menyebabkan terjadinya sintesis reseptor
androgen intraseluler dan protein pengikat androgen (androgen binding protein). Peningkatan ABP ini menyebabkan tingginya konsentrasi testosteron yang penting bagi pembentukan dan pematangan spermatozoa
pada proses spermatogenesis. (Fawcett, D.W., 2002; Heffner, L.J. and
Schust J.D, 2005).
Produksi testosteron oleh sel Leydig tergantung pada LH yang
disekresi oleh hipofisis anterior. Hormon ini melekat pada reseptor
spesifik pada membran plasma sel Leydig. Testosteron diperlukan dalam
konsentrasi lokal untuk meneruskan spermatogenesis dalam tubulus
seminiferous. Dalam darah testosteron penting untuk mempertahankan
fungsi kelenjar asesoris reproduksi pria (vesikula smeinalis, prostat, daan
kelenjar bulbouretral) juga untuk pertahanan karakteristik seks sekunder
pria (pola rambut pubis pria, pertumbuhan jenggot, suara bernada rendah
dan pembentukan otot tubuh) (Fawcett, D.W., 2002).
.
2.6. ELISA (Enzyme Linked Immunosorbent Assay)
ELISA (Enzyme Linked Immunosorbent Assay) adalah suatu teknik deteksi dengan metode serologis yang berdasrkan atas reaksi spesifik
antara antigen dan atibodi, mempunyai sensitivitas dan spesifisitas yang
tinggi dengan menggunakan enzim sebagai indikator. ELISA adalah suatu
teknik biokimia yang terutama digunakan dalam bidang imunologi untuk
mendeteksi kehadiran antibodi atau antigen dalam suatu sampel. (Harti,
UIN Syarif Hidayatullah Jakarta Immunoassay melibatkan tes yang menggunakan antibodi sebagai
reagen. Immunoassays enzim menggunakan enzim yang melekat pada
salah satu reaktan dalam immunoassay untuk kuantifikasi melalui
pengembangan warna setelah penambahan substrat / kromogen yang
cocok. ELISA melibatkan adisi dan reaksi reagen terhadap zat yang terikat
fase padat, melalui inkubasi dan pemisahan reagen yang bebas dan terikat
menggunakan langkah-langkah pencucian. Reaksi enzimatik digunakan
untuk menghasilkan warna dan untuk mengukur reaksi, melalui
penggunaan suatu reaktan yang berlabel enzim (Walker, John M and
Ralph Rapey, 2008).
Prinsip dasar ELISA diantaranya (Walker, John M and Ralph Rapey,
2008) :
a. Perlekatan pasif protein pada fase padat plastik
b. Cuci bersih dari protein yang tak terikat
c. Penambahan antibodi spesifik
d. Penggunaan kompetisi protein inert untuk mencegah reaksi spesifik
dengan fase padat plastik
e. Langkah pencucian untuk memisahkan reagen yang bereaksi (terikat)
dari yang tidak bereaksi (bebas)
f. Penambahan substrat spesifik yang berubah warna pada katalisis enzim
atau substrat dan kromofor berwarna (larutan zat warna) yang berubah
warna karena katalisis enzim
g. langkah inkubasi dilakukan untuk reaksi imunologi
h. Menghentikan katalisis enzim
i. Pembacaan warna dengan spektrofotometer.
Teknik pengujian dengan metode ELISA dapat dilakukan dengan
beberapa metode diantaranya (Walker, John M and Ralph Rapey,
2008):
1. Direct ELISA
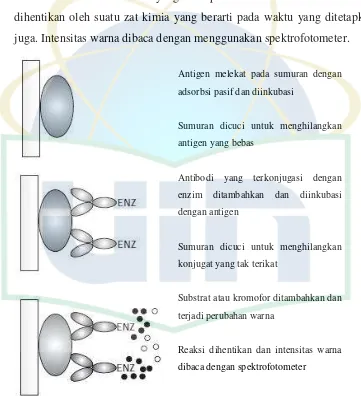
ELISA secara langsung merupakan bentuk yang paling sederhana dari
ELISA. Antigen secara pasif dilekatkan pada fase padat palstik selama
UIN Syarif Hidayatullah Jakarta sumuran plat mikrotiter. Setelah dilakukan tahapan pencucian sederhana,
antigen terdeteksi oleh adanya penambahan antibodi yang mana berikatan
secara kovalen pada suatu enzim. Setelah inkubasi dan pencucian, tes
dilanjutkan dengan penambahan kromogen atau substrat dimana adanya
aktivitas enzim akan menghasilkan perubahan warna. Semakin besar
jumlah enzim maka semakin cepat terjadi perubahan warna. Perubahan
warna dibaca setelah waktu yang ditetapkan atau setelah aktivitas enzim
dihentikan oleh suatu zat kimia yang berarti pada waktu yang ditetapkan
juga. Intensitas warna dibaca dengan menggunakan spektrofotometer.
Gambar 2.7. Prinsip ELISA secara langsung Sumber : (Walker, John M and Ralph Rapey, 2008)
2. Indirect ELISA
Pada metode ini menunjukan bahwa warna yang ditimbulkan tidak
langsung disebabkan oleh antigen dan antibodi yang bereaksi. Dibutuhkan
suatu antibodi antispesies yang dilabel dengan enzim. Antigen secara pasif Antigen melekat pada sumuran dengan
adsorbsi pasif dan diinkubasi
Sumuran dicuci untuk menghilangkan
antigen yang bebas
Antibodi yang terkonjugasi dengan
enzim ditambahkan dan diinkubasi
dengan antigen
Sumuran dicuci untuk menghilangkan
konjugat yang tak terikat
Substrat atau kromofor ditambahkan dan
terjadi perubahan warna
Reaksi dihentikan dan intensitas warna
UIN Syarif Hidayatullah Jakarta melekat pada sumuran selama inkubasi. Setelah pencucian, antibodi
spesifik untuk antigen diinkubasi dengan antigen. Sumuran dicuci dan
beberapa antibodi yang berikatan terdeteksi dengan adanya penambahan
antibodi antispesies yang berikatan secara kovalen pada enzim. Beberapa
antibodi spesifik untuk spesies tertentu. Setelah inkubasi dan pencucian,
tes dilanjutkan dengan perubahan warna dan pembacaan intensitas waran
dengan spektrofotometer.
Gambar 2.8. Prinsip ELISA secara tidak langsung Sumber : (Walker, John M and Ralph Rapey, 2008)
3. Sandwich ELISA
Teknik ELISA jenis ini menggunakan antibodi primer spesifik untuk
menangkap antigen yang diinginkan dan antibodi sekunder tertaut enzim
signal untuk mendeteksi keberadaan antigen yang diinginkan. Pada Sumuran dilapisi dengan antigen dan diinkubasi
Sumuran dicuci untuk menghilangkan antigen
yang bebas
Tambahkan antibody yang melawan antigen dan
diinkubasi
Pencucian antibody yang tak berekasi
Tambahkan konjugat anti spesies dan diinkubasi
Sumuran dicuci
Tambahkan substrat atau kromofor
Reaksi dihentikan dan intensitas warna dibaca
UIN Syarif Hidayatullah Jakarta dasarnya prinsip kerja dari sandwich ELISA mirip dengan direct ELISA. Namun, karena antigen yang diinginkan tersebut harus dapat berinteraksi
dengan antibodi primer spesifik dan antibodi sekunder spesifik tertaut
enzim signal, maka teknik ELISA ini cenderung dikhususkan pada antigen
memiliki minimal 2 sisi antigenik (sisi interaksi dengan antibodi) sehingga
setidaknya populasi antibody dapat berikatan atau antigen yang bersifat
27 UIN Syarif Hidayatullah Jakarta
BAB 3
METODE PENELITIAN
3.1. Waktu dan Tempat Penelitian
Penelitian dilakukan mulai dari bulan Februari 2014 sampai Mei
2014. Penelitian ini dilakukan di Laboratorium Kimia Obat, Laboratorium
Penelitian I, Laboratorium Penelitian II, Laboratorium Hewan (Animal House), Laboratorium Biokimia dan Laboratorium Riset Fakultas Kedokteran dan Ilmu Kesehatan, UIN Syarif Hidayatullah Jakarta.
3.2. Alat dan Bahan 3.2.1. Hewan Uji
Hewan uji yang akan digunakan dalam penellitian ini adalah tikus
putih jantan galur Sprague-Dawley yang sehat berumur 7 – 8 bulan dengan berat 300–400 g dan fertil yang diperoleh dari Home Industri Animal Alamiah Bogor.
3.2.2. Bahan Uji
Bahan uji yang akan digunakan adalah ekstrak etanol 96% daun
sambiloto (Andrographis paniculata Nees.). Daun sambiloto diperoleh dari Balai Penelitian Tanaman Obat dan Aromatik (BALITRO) Bogor.
Sebelum dilakukan penelitian, tanaman di determinasi terlebih dahulu di
Pusat Konservasi Tumbuhan Kebun Raya Bogor – LIPI Bogor.
3.2.3. Bahan Kimia
Bahan-bahan yang dipergunakan dalam penelitian ini adalah tween
80, aquadest, etanol 96%, Na CMC, eter, HCl 2N, NaOH 10%, Na2SO4
anhidrat, pereaksi tembaga asetat, kloroform, n-heksana, FeCl3, larutan
garam gelatin, pereaksi H2SO4 P, CH3COOH anhidrat, etil asetat, etanol
95%, HCl P, anhidrat asetat, pereaksi Bouchardat P, Pereaksi Mayer P,
UIN Syarif Hidayatullah Jakarta
3.2.4. Alat
Alat yang digunakan dalam penelitian ini meliputi : timbangan
analitik, gelas ukur, botol maserasi, ayakan mesh 40, corong, kertas saring,
kapas, perangkat vacuum rotary evaporator (EYELA), beaker glass, pipet tetes, tabung reaksi, spatula, cawan penguap, labu Erlenmeyer, hot plate, batang pengaduk, botol sampel, aluminium foil, plastic wrap, oven, tanur, botol timbang, krus silikat, krus tang, desikator, pinset, kandang tikus,
tempat makan dan minum tikus, timbangan hewan, alat pencekok oral
(sonde), syringe, kaca objek, cover glass, mikropipet, seperangkat alat bedah, wadah pembiusan, mikroskop optik, tube, centrifuge, vortex, Hemasitometer Improved Neubauer, freezer, waterbath, Kit ELISA, ELISA reader, plat KLT silika gel, chamber, lampu UV-Visible, dan TLC Scanner.
3.3. Rancangan Penelitian 3.3.1. Besar Sampel
Penelitian ini bersifat eksperimental yang terdiri atas 4 kelompok
dengan masing-masing terdiri dari 5 ekor tikus putih jantan galur Sprague-Dawley. Jumlah tikus yang digunakan pada setiap kelompok penelitian
berdasarkan pada Research Guidelines for Evaluating The Safety and Efficacy of Herbal Medicines (WHO, 2000) yaitu untuk pengujian pada
hewan pengerat masing-masing kelompok terdiri dari setidaknya lima
ekor. Hewan uji yang digunakan sebanyak 20 ekor tikus.
3.3.2. Dosis Perlakuan
Acuan dosis yang digunakan berdasarkan penelitian yang
dilakukan oleh Kumar, et al (2013). Perhitungan dosis yang diberikan
dapat dilihat pada lampiran. Pemberian ekstrak dilakukan selama 48 hari
sesuai dengan siklus spermatogenesis tikus (Krinke, 2000). Perlakuan
yang digunakan adalah kontrol (tanpa perlakuan) dan tikus yang diberi
UIN Syarif Hidayatullah Jakarta
Tabel 3.1 Perlakuan terhadap kelompok tikus
Kelompok Perlakuan Lama
Perlakuan
Diberi emulsi ekstrak daun sambiloto
Diberi emulsi ekstrak daun sambiloto
Diberi emulsi ekstrak daun sambiloto
Keterangan : [ ] Spermatozoa : konsentrasi spermatozoa
[ ] T : konsentrasi testosteron serum
3.4. Kegiatan Penelitian
3.4.1. Pemeriksaan Simplisia (Determinasi)
Sebelum dilakukan penelitian, daun sambiloto terlebih dahulu di
determinasi di Pusat Konservasi Tumbuhan Kebun Raya Bogor, LIPI
UIN Syarif Hidayatullah Jakarta
3.4.2. Penyiapan Simplisia dan Pembuatan Ekstrak
Sebanyak 15 kg daun sambiloto dikumpulkan kemudian dicuci
bersih dengan air dan dikering-anginkan. Daun sambiloto yang telah
kering dihaluskan dengan blender dan diayak menggunakan ayakan ukuran 40 mesh, sehingga diperoleh serbuk simplisia sebanyak 1 kg.
Serbuk simplisia kemudian dimaserasi menggunakan pelarut
etanol 96% dengan perbandingan 1:10. Hasil maserasi disaring sehingga
diperoleh filtrat. Filtrat yang diperoleh dipekatkan menggunakan vacuum rotary evaporator sampai diperoleh ekstrak kental. Ekstrak kental yang dihasilkan ditimbang dan dicatat beratnya selanjutnya disimpan di dalam
lemari pendingin atau freezer.
3.4.3. Penapisan Fitokimia
Pada penapisan fitokimia dilakukan pemeriksaan terhadap
kandungan golongan senyawa kimia dari ekstrak etanol daun sambiloto
seperti alkaloid, flavonoid, diterpenoid, steroid/triterpenoid, saponin, tanin
dan fenolik.
1. Identifikasi Alkaloid
0,5 mg ekstrak dalam tabung reaksi ditambahkan 1 mL asam klorida 2 N
dan 9 mL aquades, dipanaskan di penangas air selama 2 menit, dan
didinginkan. Kemudian disaring dan ditampung filtratnya. Filtrat
digunakan sebagai larutan percobaan selanjutnya.
a. Larutan percobaan ditambahkan 2 tetes Bouchardart LP, terbentuk
endapan coklat sampai dengan hitam positif alkaloid.
b. Larutan percobaan ditambahkan 2 tetes Mayer LP, terbentuk endapan
menggumpal berwarna putih atau kuning yang larut dalam metanol P positif alkaloid.
c. Larutan percobaan ditambahkan 2 tetes Dragendorf LP, terbentuk
endapan coklat sampai dengan hitam positif alkaloid (Depkes RI,
UIN Syarif Hidayatullah Jakarta 2. Identifikasi Flavonoid
0,5 mg ekstrak dalam tabung reaksi dilarutkan dalam NaOH 10% dan
ditambahkan HCl. Perubahan larutan dari warna kuning menjadi tidak
berwarna menunjukkan adanya flavonoid. (Godghate, Asvin et al dan Yadav, Jaideep Singh, et al, 2012 )
3. Identifikasi Diterpenoid
0,5 mg ekstrak dalam tabung reaksi dilarutkan dalam air dan ditambahkan
10 tetes tembaga asetat. Terbentuk warna hijau emerald yang
menunjukkan ekstrak mengandung diterpenoid. (Godghate, Asvin et al 2012 )
4. Identifikasi Steroid/Triterpenoid
Sebanyak 3 gram ekstrak dicampurkan dengan 2 ml kloroform. Kemudian
ditambahkan 2 ml asam asetat anhidrat dan 2 ml H2SO4 pekat dengan
hati-hati. Terjadinya perubahan warna menjadi violet menunjukkan adanya
triterpenoid, sementara jika terjadi perubahan warna menjadi biru/hijau
menunjukkan ekstrak mengandung steroid (Edeoga et al, 2005).
5. Identifikasi Saponin
Uji Saponin dilakukan dengan metode Forth yaitu dengan cara
memasukkan 2 mL sampel kedalam tabung reaksi kemudian ditambahkan
10 mL akuades lalu dikocok selama 30 detik, diamati perubahan yang
terjadi. Apabila terbentuk busa yang mantap (tidak hilang selama 30 detik)
maka identifikasi menunjukkan adanya saponin. Uji penegasan saponin
dilakukan dengan menguapkan sampel sampai kering kemudian
mencucinya dengan heksana sampai filtrat jernih. Residu yang tertinggal
ditambahkan kloroform, diaduk 5 menit, kemudian ditambahkan Na2SO4
anhidrat dan disaring. Filtrat dibagi menjadi menjadi 2 bagian, A dan B.
Filtrat A sebagai blangko, filtrat B ditetesi anhidrat asetat, diaduk
perlahan, kemudian ditambah H2SO4 pekat dan diaduk kembali.
Terbentuknya cincin merah sampai coklat menunjukkan adanya saponin
UIN Syarif Hidayatullah Jakarta 6. Identifikasi Tanin dan Polifenol
Sebanyak 3 g sampel diekstraksi akuades panas kemudian didinginkan.
Setelah itu ditambahkan 5 tetes NaCl 10% dan disaring. Filtrat dibagi 3
bagian A, B, dan C. Filtrat A digunakan sebagai blangko, ke dalam filtrat
B ditambahkan 3 tetes pereaksi FeCl3, dan ke dalam filtrat C ditambah
garam gelatin. Kemudian diamati perubahan yang terjadi (Marliana et al,
2005).
3.4.4. Parameter Spesifik dan Non Spesifik (Depkes RI, 2000) 1. Parameter Spesifik
a. Identitas ekstrak
Deskripsi tata nama sebagai berikut : Nama ekstrak
Nama latin tumbuhan (sistematika botani) Bagian tumbuhan yang digunakan
Nama Indonesia tumbuhan
b. Organoleptik
Dengan menggunakan panca indera mendeskripsikan bentuk, warna,
bau, rasa sebagai berikut :
Bentuk : padat, serbuk-kering, kental, cair Warna : kuning, coklat, dll.
Bau : aromatik, tidak berbau, dll. Rasa : pahit, manis, kelat, dll.
2. Parameter Non Spesifik a. Kadar Air
Masukkan lebih kurang 10 gram ekstrak dan timbang saksama
dalam wadah yang telah ditara. Keringkan pada suhu 105oC selama 5 jam
dan ditimbang. Lanjutkan pengeringan dan timbang pada jarak 1 jam
sampai perbedaan antara 2 penimbangan berturut-turut tidak lebih dari