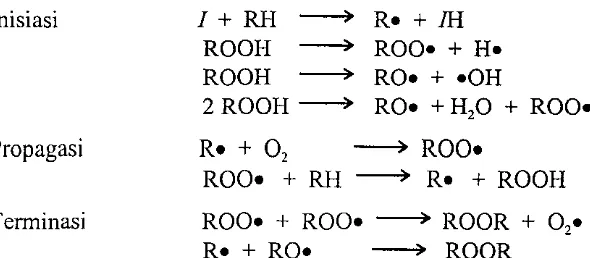baiIc.
8/=[1
セ@ 」ZイVセ@ c:r6t1ah, i§TuknFRAKSINASI ANTIOKSIDAN DAUN SIRIH (Piper betle Linn.)
DENGAN KROMATOGRAFI LAPIS TIPIS
Oleh
LAlLY FAJARIAH
F 29.0322
1997
FAKULTASTEKNOLOGIPERTANIAN
INSTITUT PERTANIAN BOGOR
dan Anton Apriyantono.
RINGKASAN
Penambahan antioksidan pada lemak dan minyak maupun baban pangan yang mengandung lemak dan minyak merupakan cara yang paling efektif untuk mencegah oksidasi lemak. Selama ini antioksidan yang digunakan secara luas dalam industri pangan adalah antioksidan sintetik yang banyak menimbulkan kekhawatiran akan efek toksiknya. Oleh karena itu, pencarian antioksidan dari
sumber alami giat dilakukan karena dianggap lebih aman untuk dikonsumsi. Salah satu bahan alami yang telah diketahui mengandung antioksidan adalah daun sirih.
Tujuan dari penelitian ini adalab mempelajari fraksinasi dan identifikasi dengan kromatografi lapis tipis terhadap ekstrak antioksidan daun sirih hijau yang
telah dihilangkan baunya dengan distilasi uap yang l11empunyai aktivitas antioksidan lebih tinggi dari BHA.
Penelitian ini dilakukan dalam tiga tahap. Pada tahap pertama, antioksidan dalam daun sirih hijau (yang sebelumnya dilakukan penghilangan bau dengan distilasi uap) diekstraksi dengan pelarut etanol dengan perbandingan daun sirih kering beku : etanol = 1 : 13.5. Setelah pelarutnya dihilangkan, diperoleh ekstrak antioksidan berwarna hijau pekat kehitaman dengan rendemen sebesar 11.38 persen.
Pada tahap kedua, ekstrak antioksidan daun sirih yang diperoleh pada tahap pertama difraksinasi dengan kromatografi lapis tipis silika dengan pengembangan satu dimensi yang dilakukan bertahap. Pertal11a, ekstrak antioksidan daun sirih dipisahkan dengan pelarut kloroform : etanol : asam asetat (98:2:2). Pemisahan ini menghasilkan 19 fraksi terpisah. Nilai Rf fraksi tersebut dibandingkan dengan nilai Rf-l dari penelitian terdahulu oleh Susanto (1995) (Rf-l adalah nilai Rf fraksi hasil pengembangan dimensi pertama ekstrak antioksidan daun sirih hijau-distilasi uap dengan pelarut kloroform:etanol:asam asetat (98:2:2) yang l11empunyai aktivitas antioksidan tinggi) sehingga dipilih fraksi C, D, E, F, N, 0, P, Q, R dan S. Terhadap sepuluh fraksi tersebut dilakukan pengembangan satu dimensi yang kedua dengan pelarut heksan:dietil eter (3:7) dan diperoleh 60 fraksi yang terpisah. Dari hasil pel11bandingan nilai Rf fraksi yang diperoleh dengan Rf-2 dari Susanto (1995)
Analisis spektral dilakukan pada fraksi-fraksi yang dipilih untuk mengetahui
panjang gelombang dimana terjadi penyerapan yang maksimum, kemudian aktivitas anlioksidan dari masing-masing fraksi (pada konscntrasi yang sama) diuji dengan metode tiosianat. Diperoleh hasil bahwa fraksi nomor 25, 20, 24 dan 31
menunjukkan aktivitas antioksidan yang lebih tinggi dan berbeda nyata dengan BHA
(a=0.05), sedangkan fraksi nomor 14, 28, 11, 22, 23, 16, 19, 21 dan 1
mempunyai aktivitas antioksidan sama dengan BHA (a= 0.05).
DENGAN KROMATOGRAFI LAPIS TIPIS
SKRIPSI
Sebagai Salah Satu Syarat untuk Memperoleh Gelar
SAIUANA TEKNOLOGI PERTANIAN
pada JUTUsan Teknologi Pangan dan Gizi
Faknltas Tekl101ogi Pertallial1
Institut Pertanian Bogor
Oleh
LAlLY FAJARIAH
F 29.0322
1997
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERT ANIAN BOGOR
FAKULTASTEKNOLOGIPERTANIAN
FRAKSINASI ANTIOKSIDAN DAUN SIRIH (Piper betle Linn.)
DENGAN KROMATOGRAFI LAPIS TIPIS
SKRIPSI
Sebagai Salah Satu Syarat untuk Memperoleh Gelar
SARJANA TEKNOLOGI PERTANIAN
pada Jurusan Teknologi Pangan dan Gizi
Fakultas Teknologi Pertanian
Institut Pertanian Bogor
Oleh
LAlLY FAJARIAH
F 29.0322
Dilahirkan pada tanggal 27 Mei 1973
diBANTEN
T anggal Lulus: 6 Mei 1997
Dosen Pembimbing II
Dengan segala kerendahan hati penulis menghaturkan puji synkur ke hadirat
Allah swt yang telah melimpahkan kanmiaNya sehingga skripsi ini dapat diselesaikan.
Sktipsi yang disnsun berdasarkan hasil penelitian ini merupakan salah satu syarat untuk
memperoleh gelar Saljalla Teknologi Peltaniall pada Jurusan Teknologi Pangan dan
Gizi, Faknltas Teknologi Pertanian, Institut Pertaniall Bogor.
Bersamaan dengan ini penulis ingin mengncapkan terimakasih kepada :
1. Ir. Nuri Andarwulan, MSi dan Dr. Ir. Anton Apriyantono, MS selakn Dosen
Pembimbing I dan Dosen Pernbirnbing II yang telah banyak rnemberikan
bimbingan, arahan dan duknngan kepada penulis
2. Dr. Ir. Fransiska Zakaria, MSc selaku dosen yang telah berkenan rnenguji penulis
3. Marna dan adik-adik tercinta: Ferni, Iman dan Ihsan atas bantuan moral, do'a dan
restunya
4. Mas Joko, Mbak Nana, Mbak Yani, Mbak Yenny dan Bu Effi yang telah banyak
memberi rnasnkan selarna penelitian
5. Pupung, Agnes, Alit; N'tet, Dede dan Bu Een sebagai teman-teman sepeIjuangan
dalarn sirih
6. Teman-ternan TPG 29 terutarna Julia, Vinza, Winoto, Tinah, Anton, Esti dan
Mbak Odha yang telah memberikan bantuan dan dukwlgan selama penelitian
7. Mbak Antin, Mas Taufik, Mbak Sli, Tuti, Mbak Ari, Pak Dunmlg dan Mas Yahya
atas segala bantuan yang diberikan selarna penelitian
8. Ternan-ternan di wisrna Nurul Fithri dan Az-Zahra : Nining, Santi, Ana, Tuti, Har,
Atie, lin, M'Era, Ina, Irma, Reni dan lain-lain atas duktmgarwya
sempurna ini dapat bermanfaat bagi yang memerlukan.
Bogar, Mei 1997
Penulis
halaman
KATAPENGANTAR... i
DAFTAR lSI ... ... iii
DAFTAR TABEL ... v
DAFTARGAMBAR... Vi DAFT AR LAMPIRAN ... ... ... ... ... ... .... ... ... viii
I. PENDAHULUAN .... ... ... ... ... ... ... ... ... ... ... ... ... .... .... 1
II. TINJAUAN PUSTAKA A. MEKANISME OKSIDASI LIPID 3 B. MEKANISME ANTIOKSIDASI ... ... ... ... ... ... ... 4
C. ANTIOKSIDAN ALAMI ... ... ... ... 7
D. ISOLASI DAN IDENTIFIKASI ANTIOKSIDAN ... ... 9
E. SIRIH (Piper betle Linn.) ... 10
lIl. BAHAN DAN METODE A. BAHANDANALAT ... 15
B. METODE PENELITIAN ... 16
I. Penelitian Tabap Pertama ... ... ... ... ... ... ... ... .... .... .... ... 16
2. Penelitian Tahap Kedua ... ... ... ... ... ... ... 17
3. Penelitian Tahap Ketiga ... 19
C. PENGAMATAN ... 20
1. Nilai Rf ... ... ... 20
2. Sifat Spektral ... ... ... ... ... .... ... ... ... ... 21
3. Aktivitas Antioksidan ...•.
<...
21IV. HASIL DAN PEMBAHASAN
A EKSTRAK ANTIOKSIDAN ... 23
B. FRAKSINASI ANTIOKSIDAN ... 25
1. Nilai RfFraksi Antioksidan dari Ekstrak Antioksidan Dallll Sirih
セ。ョNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNN@ 27
2. Aktivitas Antioksidan Fraksi-fraksi Antioksidan Dallll Sirih Hijau... 28
3. Sifat Spektral Fraksi-fi'aksi yang Potensial Sebagai Antioksidan ... 33
C. fDENTIFIKASI FRAKSI ANTIOKSIDAN DENGAN
PEWARNAAN KLT ... 42
V. KESIMPULAN DAN SARAN
A KESIMPULAN ... 47
B. SARAN ... 48
DAFTAR PUS TAKA
LAMPIRAN
halaman
Tabell. Nilai Rffraksi dari ekstrak antioksidan dallll sirih hijau yang diisolasi dengan KL T (pengembangan awal) ... 26
Tabel2. Nilai Rffraksi dari ekstrak antioksidan daun sirih hijau yang diisolasi dengan KL T (pengembangan lanjut) ... 30
Tabel3. Nilai periode indnksi dan ᆪセォエッイ@ protektiffraksi dari ekstrak
alltioksidall darnl sirih hijau yang diisolasi dengan KLT ... ... 32
Tabel4. Panjang gelombang penyerapan maksimum dari fraksi-fraksi yang
potensial sebagai antioksidan .... ... ... ... .... ... 34
Tabel5. Basil identifikasi fraksi antioksidan dengan pewamaan KLT ... 43
halaman
Gambar 1. Mekanisme reaksi autooksidasi lemak ... 3
Gambar 2. Mekanisme reaksi antioksidasi ... 5
Gambar 3. Kromatogram KL T fraksi ekstrak antioksidan daun sirih hijau
yang diperoleh dari pengembangan satu dimensi yang pertama 26 dengan pelamt k1oroform:etanol:asam asetat (98:2:2) ... .
Gambar 4. Kromatogram KLT fraksi ekstrak antioksidan daun sirih hijau
yang diperoleh dari pengembangan satu dimensi yang kedua 29 dengan pelamt heksan:dietil eter (3:7) ... .
Gambar 5. Histogram faktor protektif masing-masing fraksi antioksidan ... 31
Gambar 6. Spektrum absorbsi fraksi nomor 1 dari ekstrak antioksidan daUll
sirih hijau yang diisolasi dengan KLT ... 36
Gambar 7. Spektrum absorbsi fraksi nomor 11 dari ekstrak antioksidan daUll
sirih hijau yang diisolasi dengan KLT ... ... 36
Gambar 8. Spektmm absorbsi fraksi nomor 14 dari ekstrak antioksidan daun
sirib hijau yang diisolasi dengan KL T ... 37
Gambar 9. Spektrum absorbsi fi'aksi nomor 16 dari ekstrak antioksidan daUll
sirih hijau yang diisolasi dengan KL T ... ... ... 37
Gambar 10. Spektrum absorbsi fraksi nomor 19 dad ekstrak antioksidan daun
sirih hijau yang diisolasi dengan KLT ... 38
Gambar 11. Spektrum absorbsi fraksi nomor 20 dari ekstrak antioksidan daun
sirih hijan yang diisolasi dengan KLT ... 38
Gambar 12. Spektmm absorbsi fraksi nomor 21 dari ekstrak antioksidan daun
sirih hijau yang diisolasi dengan KL T ... 39
Gambar 13. Spektmm absorbsi fraksi nomor 22 dari ekstrak antioksidan daun
sirih hijau yang diisolasi dengan KL T ... ,... 39
Gambar 15. Spektrum ab sorb si fraksi nomor 24 dari. ekstrak antioksidan daUll
sirih hijan yang diisolasi dengan KLT ... 40
Gambar 16. Spektrnm absorbsi fraksi nomor 25 dal1 ekstrak antioksidan daUll sirih hijau yang diisolasi dengan KL T .... ... ... ... ... .... ... ... 41
Gambar 17. Spektrum absorbsi fraksi Ilomor 28 dari ekstrak antioksidan daUll sirih hijau yang diisolasi dengan KL T ... 41
Gambar 18. Spektrnm absorbsi fraksi nomor 31 dari ekstrak antioksidan daull sirih hijau yang diisolasi dengan KLT ... 42
[image:13.600.217.515.69.786.2]halaman
Lampiran 1. Rekapitulasi data kadar air daun sirih h.ijau kering beku dan
rendemen ekstrak antioksidan ... 56
Lampiran 2. Rekapitulasi nilai Rf fraksi yang terpisah dari ekstrak antioksidan daun sirih hijau (pengembangan awa! dengan pelamt kloroform : 56 etanol: asam asetat = 98: 2 : 2) ... ..
Lampiran 3. Kromatogram KLT fraksi yang terpisah dari ekstrak antioksidan daun shih hijau-destilasi uap (Susanto, 1995) ... 57
Lampiran 4. Nilai RfJ dan Rf2 fraksi yang terpisah dari ekstrak antioksidan daun shih hijau-destilasi uap yang tidak berbeda nyata dengan
BHA pada tarafnyata a = 0.05 (Susanto, 1995) ... 58
Lampiran 5. Rekapitulasi nilai periode induksi dan faktor protektif fraksi antioksidan dari ekstrak antioksidan dam) smh hijau yang diisolasi dengan KLT ... 59
Lampiran 6. Analisis ragam faktor protektifpada fraksi antioksidan dari
ekstrak antioksidan dallll smh hijan yang diisolasi dengan KL T .... 60
Lampiran 7. Uji wilayah berganda Duncan pada fraksi antioksidan dari ekstrak antioksidan daun smh hijau yang diisolasi dengan KLT ... 61
Lampiran 8. Berat residu fraksi antioksidan dari ekstrak antioksidan dallll sirih hijau yang dipisalJkan dengan KLT pada pengembangan lanjut 62 dengan pelamt heksan:dietil etef (3:7) yang diduga mempunyai
kt· 't ti' k'd t' .
a IVI as an 0 Sl an mggl ... .
Lampiran 9. Nilai periode induksi, faktof protektif, dan persamaan regresi linier dari fraksi antioksidan daun sirih hijau yang diisolasi dengan KL T (ulangan 1) ... 63
Lampiran 10. Nilai periode induksi, faktor protektif, dan persamaan regresi linier dari fraksi al1tioksidal1 dallll smh hijau yang diisolasi del1gan KL T (ulangan 2) ... 64
Lampiran 11. Panjang gelombal1g penyerapan inaksimum klorofil dan
turunannya (Canjura et aI., 1991) ... 65
Cara yang paling banyak digunakan untuk mencegah oksidasi lemak adalah
dengan penambahan antioksidan. Berdasarkan sumbernya antioksidan digolongkan
menjadi dua kelompok yaitu antioksidan alami dan antioksidan sintetik. Antioksidan
sintetik sangat efektif dalam menghambat reaksi oksidasi lemak, namun banyak
menimbulkan kekhawatiran akan efek negatif dari pemakaian antioksidan tersebut.
Seiring dengan itu penggunaan antioksidan alami makin ditingkatkan dengan anggapan
lebih aman karena diperoleh dari bahan-bahan alami. Sumber -sumber alami yang telah
diketahui mengandung antioksidan diantaranya rempah-rempah seperti jinten, lada,
kunyit dan jahe serta herba seperti daun I'Osemwy.
Andarwulan (1995) telah menyelidiki karakteristik antioksidan alami dari daun
sirih, terutama pemisahan komponen oleoresin dengan kromatografi lapis tipis. Salah
satu hasilnya adalah bahwa daun sirih yang terlebih dahulu dihilangkan baunya dengan
ekstraksi soxhlet dan kemudian residunya diekstrak dengan etanol menunjukkan
aktivitas antioksidan yang lebih tinggi bila dibandingkan dengan menggunakan pelarut
metanol langsung terhadap daunnya.
Susanto (J 995) telah melakukan isolasi antioksidan alami daun sirih dengan
kromatografi lapis tipis silika. Dari beberapa perlakuan yang berbeda yaitu bahan
(daun sirih kuning kering beku dan daun sirih hijau kering beku) dan cara penghilangan
bau (distilasi uap dan ekstraksi soxhlet), ternyata daun sirih hijau kering beku-distilasi
uap menghasilkan rendemen ekstrak antioksidan tertinggi (9.75 persen setelah
pelarutnya dihilangkan), total fenollebih tinggi dibandingkan dengan cara soxhlet, dan
mempunyai aktivitas antioksidan tertinggi dengan faktor protektif 13.09 (faktor
antioksidan daun sirih dilakukan pula dengan kromatografi kolom silika menggunakan
metanol dan heksan sebagai eluen. Ternyata bau daun sirih pada fraksi polar dan
nonpolar tidak ada lagi kecuali pada fraksi polar daun sirih hijau yang didestilasi uap.
Total fenol fraksi nonpolar jauh lebih sedikit dibandingkan pada fraksi polar.
Disimpulkan oleh peneliti tersebut bahwa fraksi nonpolar dari ekstrak antioksidan daun
sirih sangat miskin akan antioksidan fenolik, sebaliknya pada fraksi polar kandungan
antioksidan fenolik relatif banyak.
Selanjutnya oleh Susanto (1995) ekstrak antioksidan yang mempunyai aktivitas
tertinggi yaitu ekstrak antioksidan daun sirih hijau yang telah didistilasi uap dipisahkan
dengan kromatografi lapis tipis silika dua dimensi. Dari pemisahan tersebut diperoleh
57 fraksi yang terpisah. Pengukuran aktivitas antioksidan masing-masing fraksi
menunjukkan adanya 6 fraksi yang tidak berbeda nyata dengan BHA (a= 0.05). Dari
analisis sifat spektral diketahui bahwa hampir semua fraksi yang potensial sebagai
antioksidan menyerap pada daerah panjang gelombang sinar ultraviolet dan sinar
tampak, atau dengan kata lain fraksi-fraksi tersebut mengandung komponen berwarna.
Data-data mengenai antioksidan daun sirih diatas diperoleh secara kualitatif,
sehingga belum bisa diketahui efektivitas antioksidan dari masing-masing fraksi dan
apakah aktivitas antioksidan tersebut sebanding dengan jumlahnya. Penelitian lebih
lanjut perlu dilakukan terutama mengenai fraksinasi antioksidan daun sirih yang
mempunyai aktivitas antioksidan tinggi, aplikasinya pada produk pangan serta uji
keamanannya.
Penelitian ini bertujuan mempelajari fraksinasi ekstrak etanol antioksidan daun
sirih hijau yang telah dihilangkan baunya dengan distilasi uap dan identifikasi dengan
A. MEKANISME OKSIDASI LIPID
Oksidasi pada lipid sering disebut dengan autooksidasi karena reaksi
dapat terjadi walaupun tanpa adanya zat pengoksidasi. Oksidasi berlangsung
melalui mekanisme reaksi berantai radikal bebas (Dugan, 1985).
Reaksi autooksidasi terbagi menjadi tiga tahap yaitu inisiasi, propagasi
dan terminasi (Gordon, 1990). Pada inisiasi terjadi pembentukan radikal-radikal
bebas akibat reaksi antara inisiator I (logam Cu, Fe, Co dan Mn) dengan asam
lemak (RH) dan reaksi asam lemak dengan oksigen singlet CO,). Pada tahap
propagasi reaksi berantai radikal bebas berlangsung dengan cepat menghasilkan
radikal peroksil (ROO-), hidroperoksida (ROO H), radikal asam lemak (R -) dan
radikal alkoksil (RO-) (Dugan, 1985). Selanjutnya radikal-radikal yang
terbentuk akan bereaksi kembali dengan molekul oksigen yang baru sampai tidak
ada lagi radikal yang dapat bereaksi. Tahap terminasi atau tahap akhir oksidasi
ditandai dengan terbentuknya produk-produk nonradikal seperti aldehida, keton,
alkohol dan asam-asam dengan karakteristik dan citarasa tengik (Winarno, 1984).
Mekanisme reaksi autooksidasi dapat dilihat pada Gambar 1.
Inisiasi
Propagasi
Terminasi
1+ RH
ROOH ROOH
- R. + 1H
- ROO. + H.
- RO. + .OH
2 ROOH - RO. + H,O + ROO.
R.
+
0,
-
ROO.
ROO. + RH - R. + ROOH
ROO. + ROO. - ROOR + 0,.
[image:17.602.154.449.550.679.2]R. + RO. - ROOR
B. MEKANlSME ANTlOKSIDASI
Kochhar et al. (1992) menggolongkan antioksidan berdasarkan mekanisme
kerjanya menjadi lima macam yaitu :
1) Antioksidan primer, yaitu antioksidan yang dapat memecah rantai mekanisme
oksidasi dengan cara bereaksi dengan radikal-radikal lemak dan mengubahnya
menjadi produk yang lebih stabil. Beberapa contoh antioksidan primer adalah
butylated hydroxyanisol (BHA), butylated hydroxy toluene (BHT) dan
tokoferol.
2) Penangkap oksigen (oxygen scavenger), yaitu senyawa yang dapat bereaksi
dengan oksigen dan melepaskannya. Termasuk kelompok ini adalah asam
askorbat (vitamin C), asam erithorbat (D-isomer asam askorbat) dan garam
sodiumnya.
3) Antioksidan sekunder, yaitu antioksidan yang bekerja dengan cara bereaksi
dengan hidroperoksida lemak dan merubahnya menjadi produk yang lebih
stabil. Contoh antioksidan sekunder adalah dilauril tiopropionat.
4) Antioksidan berupa enzim, sebagai contoh glukosa oksidase, katalase dan
glutation peroxidase yang berfungsi memindahkan oksigen yang ada didalam
ataupun dipermukaan bahan pangan. Contoh lainnya adalah superoksida
dismutase yang berfungsi mengeillarkan zat yang bersifat oksidatif tinggi dari
bahan pangan.
5) Senyawa pengkelat atau sekllestran, yaitll antioksidan yang bekerja dengan
cara mengikat ion logam (seperti tembaga dan besi) yang dapat meningkatkan
reaksi oksidasi lemak secara katalitik. Senyawa yang termasuk dalam
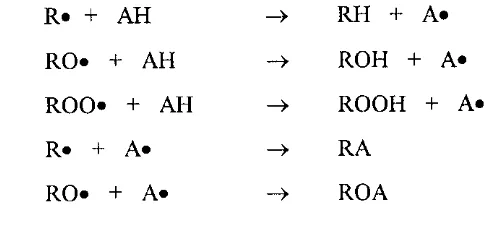
Dugan (1985) menerangkan bahwa suatu molekul antioksidan (AH) akan
menghambat autooksidasi dengan cara bereaksi dengan radikal-radikal bebas yang
terbentuk seperti dapat dilihat pada Gambar 2.
R. + AR RO. + AH ROO. + AR R. + A. RO. + A.
RH + A. ROH + A. ROOIi + A. RA
ROA
Gambar 2. Mekanisme reaksi antioksidasi (Dugan, 1985)
Lebih lanjut Dugan (1985) menyatakan bahwa sifat fungsional antioksidan
sangat beragam. Beberapa jenis antioksidan akan meningkat sifat protektifnya
sejalan dengan peningkatan konsentrasi, sebaliknya adapula yang mempunyai
tingkat konsentrasi tertentu dimana bila melebihi batas tersebut fungsinya akan
berubah menjadi prooksidan. Dengan demikian dibutuhkan suatu keseimbangan
antara jumlah antioksidan yang memberikan stabilitas lemak maksimum dengan
yang akan bereaksi untuk menghasilkan oksidasi yang intensif (Dugan, 1985).
Ranney (1979) mengklasifikasikan antioksidan menjadi 3 kelompok yaitu
antioksidan yang mempunyai gugus fenolik dan amina aromatik, antioksidan yang
mengandung atom sulfur, dan antioksidan yang dapat menginaktivasi logam.
Antioksidan yang paling umum digunakan adalah komponen fenolik tersubstitusi
seperti butylated hydroxyanisole (BRA), butylated hydroxy toluene (BRT) dan
tokoferol (vitamin E).
Menurut Wong (1989) antioksidan fenolik menghambat autooksidasi
lemak dengan cara menangkap radikal-radikal peroksi melalui dua tipe reaksi.
i
[image:19.599.139.382.175.288.2]Antioksidan bekerja dengan mcmindahkan atom H kepada radikal peroksil seperti
lampak pada skema berikul
,
looHi vo.
',(0, I I • •
セi@ '-'::
I
ii-.
"h
l
•
radikal aryloxy
Produk yang terbentuk yaitu radikal aryloxy dari anti ok sid an dapat
bereaksi lebih lanjut dengan radikal peroksil yang lain melalui penggabungan
radikal-radikal untuk menghasilkan suatu produk peroksida yaitu peroxydienone
menurut skema berikut :
lOO·
penJxJ'dien()ne
h.
-,-o
"V"·
" o·lO·
Radikal-radikal myloxy bersifat stabil karen a beresonansi dan relatif tidak
bereaksi dengan hidroperoksida lemak maupun oksigen sehingga tidak akan
menyebabkan inisiasi dan propagasi pada rcaksi oksidasi, seperti tampak skema
berikut:
• "H
.* ..
".
C. ANTIOKSIDAN ALAMI
Penambahan antioksidan pada lemak dan minyak maupun bahan pangan
yang mengandung lemak dan minyak merupakan cara yang paling efektif untuk
mencegah oksidasi lemak. Berdasarkan sumbernya antioksidan terbagi dua yaitu
antioksidan alami dan antioksidan sintetik.
Selama ini antioksidan yang paling luas digunakan di dunia industri adalah
antioksidan sintetik seperti BHA dan BHT. Namun penggunaannya semakin
dikhawatirkan oleh konsumen karena beberapa penelitian membuktikan adanya
efek toksik dan karsinogenik terhadap tubuh manusia (Branen (1975) seperti
dikutip oleh Osawa et aI., 1992). Akhir-akhir ini perhatian terhadap antioksidan
alami semakin meningkat karena dianggap lebih baik dari antioksidan sintetik,
khususnya bila ditinjau dari segi keamanan pangan. Antioksidan alami yang mulai
digunakan di industri adalah tokoferol, akan tetapi efektivitasnya lebih rendah
daripada BHA dan BHT sehingga biaya produksi menjadi lebih mahal (Osawa dan
Namiki,1981).
Antioksidan alami dari bahan pangan dapat dibagi menjadi tiga kelompok
yaitu antioksidan yang secara endogen terdapat dalam satu atau lebih komponen
pangan, antioksidan yang terbentuk akibat reaksi selama pengolahan dan
antioksidan yang diisolasi dari sumber alami (Pratt, 1992).
Menurut Dugan (1985) dan Larson (1988) komponen antioksidan yang
terdapat di alam pada umumnya adalah asam amino, asam askorbat, karotenoid,
asam sinamat, komponen fenolik, flavonoid, melanoidin, asam organik tertentu,
penelitian mengenai antioksidan alami lebih dititikberatkan pada masalah isolasi,
identifikasi, uji aktivitas pada lemak dan minyak serta llji keamanannya.
Weng dan Gordon (1992) melaporkan hasil isolasi antioksidan yang
terdapat dalam tanaman Tanshen yang diidentifikasi sebagai rosmariquinone,
dehydrorosmariqllinone, miltirone I, tanshinone IIA, cryptotanshinone dan
dihydrotanshinone. Haraguchi et al. (1992) menemukan komponen antioksidan
dari daun Polygonum hydropiper yaitu quercetin, 7,4'-dimetylquercetin,
3'-metylquercetin dan isoquercilrin. Antioksidan alami dalam dalln rosemary
diidentifikasi oleh Nakatani dan Inatani (1981) serta Schwarz dan Ternes (1992)
sebagai karnosol, rosmanol dan rosmadifenol, ketiganya merupakan senyawa fenol
diterpen.
Senyawa antioksidan telah berhasil diisolasi dari daun Eucalyptus dan
diidentifikasi sebagai n-tritriacontan-J6-J8-dione oleh Osawa dan Namiki (1981).
Cahyana et al. (1992) menunjukkan bahwa pyropheophytin a yang terkandung
didalam alga laut Arame (Eisenia bicyclis) mempunyai aktivitas antioksidan yang
lebih tinggi daripada tokoferol.
Nakatani et al. (1986) menemukan komponen antioksidan tanaman
sirih-sirihan (Piper spp.) sebagai piperine, N-tral/.\·:feruloyl-tyramine,
diacetyl-N-trans-Jeruloyl-tyramine, trimethyl-N-trans-cafferoyl-tyramine, Jeruperine, coumaperin,
acetyl-coumaperin, N-5-2F:-pentenoyl-piperidine, piperic acid,
N-isobutyl-2E,4E,8Z-eicosatrienamide, sitosterol dan cubebin.
Eugenol merupakan komponen terbanyak dalam daun Jambosa
caryophillus yang menunjukkan aktivitas antioksidan saat ditambahkan pada
minyak kedele (Hsu, 1981). Pratt (1964) menyatakan bahwa quercetin yang
D. ISOLASI DAN IDENTIFIKASI ANTIOKSIDAN
Dewasa ini kromatografi merupakan metode pemisahan yang paling
banyak digunakan untuk tujuan kualitatif, kuantitatif dan preparatif Pemisahan
dengan kromatografi dilakukan dengan memodifikasi langsung beberapa sifat
umum molekul seperti kelarutan, adsorptibilitas dan volatilitas (Gritter et aI.,
1991)
Keuntungan penggunaan kromatografi antara lain waktunya singkat,
cukup efektif dan dapat melakukan pemisahan yang tidak mungkin dilakukan
dengan metode lain (Nur et aI., 1987). Disamping itu pengoperasiannya mudah
dan scdcrhana, scrta hanya mcmbutuhkan cuplikan yang sedikit.
Menurut Gritter et al. (1991) beberapa metode kromatografi yang banyak
digunakan adalah Kromatografi Lapis Tipis (KL T), Kromatografi Kolom (KK),
Kromatografi Cairan Kinerja Tinggi (KCKT) dan Kromatografi Gas (KG).
Kromatografi Lapis Tipis (KL T) pertama kali diperkenalkan oleh Stahl
pada tahun 1956 dengan cara menambahkan 2-5% perekat Paris (CaS04) kedalam
silika gel dan kemudian merekatkan silika gel tersebut pada suatu plat gelas
(Pomeranz dan Meloan, 1980).
Pomeranz dan Meloan (1994) menyatakan beberapa keuntungan KLT
antara lain cepat digunakan, peralatan sederhana dan mudah disiapkan, tidak
memerlukan keahlian khusus dan banyak parameter percobaan yang mudah
divariasikan untuk mendapatkan efek-efek pemisahan.
Prinsip-prinsip KL T yang utama adalah adsorben, pengembangan dan
deteksi (Heftman, 1976). Sedangkan menurut Ault (1976) teknik-teknik KLT
(1982) menyatakan bahwa silika gel adalah adsorben yang paling umum
digunakan untuk berbagai tujuan dan biasanya mengandung kalsium sulfat yang
berfungsi sebagai pengikat untuk meningkatkan daya adhesi lapisan pada plat.
Pengembangan dilakukan dalam suatu bejana yang telah dijenuhkan
dengan pelarut dan kejenuhan dipertahankan selama pengembangan. Larutan
pengembang dapat berupa satu atau lebih campuran pelarut yang ditentukan lewat
percobaan (Ault, 1976).
Tahap selanjutnya setelah pengembangan adalah deteksi atau visualisasi.
Menurut Ault (1976) jika senyawa yang terdapat didalam sampel sudah berwarna
maka dapat diamati secara langsung, tetapi jika tidak berwarna maka pengamatan
dapat dilakukan menggunakan sinar ultraviolet, uap iodium atau penyemprotan
dengan pereaksi khusus yang bereaksi akan dengan komponen dalam sampel.
E. SIRIH (Piper betle, Linn.)
Sirih termasuk divisi Spermatophyta, subdivisi Angiospermae, kelas
Dicotyledonae, ordo Diperales, famili Diperaceae, genus Piper dan spesies Piper
hetle Linn. (Syamsuhidayat dan Hutapea, 1991). Penyebaran tanaman sirih sangat
luas, dapat tumbuh baik di daerah tropis dan banyak dijumpai di pantai timur
Afrika, sekitar pulau Zanzibar, tepi Sungai Indus ke timur menelusuri Sungai Yan
Tze Kiang, Kepulauan Bonim, Malaysia, Indonesia dan Asia Tenggara lainnya
(Anonim, 1980).
Lebih lanjut Syamsuhidayat dan Hutapea (1991) menyatakan bahwa sirih
termasuk tumbuhan perdu yang merambat. Batangnya berkayu, bulat,
tunggal, pangkal berbentuk jantung, uJllng merunclOg, tepi rata, bertangkai,
permukaan halus, pertulangan menyirip, hijau dan hijau tua. Bunga sirih
berbentuk bulir majemuk yang terdiri atas bulir jantan dan bulir betina. Buah sirih
berbentuk bulat dengan warna hijau keabu-abllan.
Masyarakat Indonesia pada umumnya menggunakan daun sirih sebagai
obat tradisional selain sebagai makanan kegemaran. Sebagai obat, seduhan daun
sirih digunakan untuk menghentikan pendarahan gusi, menghilangkan bau mulut,
mengobati sariawan, mencegah bau badan, menciutkan pembuluh darah serta
sebagai obat batuk (Hernani dan Yuliani, 1991). Dharma (1985) menyebutkan
bahwa air rendaman daun sirih dapat digunakan untuk mencuci mata sedangkan
daun sirih yang masih segar berguna untuk menghentikan pendarahan hidung atau
mlmlsan.
Sebagai makanan kegemaran, sejak jaman dahulu sirih digunakan dalam
jamuan kehormatan bagi tamu-tamu raja. Biasanya daun sirih dimakan bersama
kapur sirih (CaC03), gambir dan pinang (Koesmiati, 1966).
Sirih juga banyak dimanfaatkan di dunia industri untuk berbagai keperluan.
Minyak atsiri daun sirih yang diperoleh dengan destilasi uap digunakan sebagai
flavoring agent dalam formula pasta gigi selain sebagai antiseptika (Sundari et aI.,
1991). Penelitian Huang et al. (1981) yang dikutip oleh Houlihan dan Ho (1985)
menyebutkan bahwa oleoresin daun sirih yang diekstrak dengan metanol dan
heksan menunjukkan aktivitas antioksidan yang lebih tinggi daripada BHT saat
ditambahkan kedalam lemak babi pad a konsentrasi 0.06 persen.
Di dalam 100 gram daun sirih segar terkandung komposisi sebagai berikut:
kadar air 84.5 mg, protein 3.1 mg, lemak 0.8 mg, karbohidrat 6.1 mg, serat 2.3
mg, karoten (dalam bentuk vitamin A) 9600 IU, vitamin C 5 mg, tiamin 70 llg dan
iodium 3.4 llg. Terkandung juga 0.26-0.42 mg kalium nitrat yang jumlahnya
berlainan tergantung posisi daun pada tanaman (Hidayat, 1968).
Daun sirih mengandung 0.7-2.6 persen minyak atsiri yang 60-80 persennya
terdiri dari fenilpropana (alilbrenkatekin): o-hidroksikavikol, kavikol, kavibetol,
eugenol, metil eugenol, karvacrol, sineol, p-simol, estragol, terpinen dan
seskuiterpen. Disamping itujuga terkandung 0.8 - 1.8 persen komponen lain yang
terdiri dari enzim diastase, tanin, gula dan amilum (Quenther (1949) seperti
dikutip oleh Prayogo, 1991).
Dalam bunga sirih, Hwang et a!. (1992) mengidentifikasi senyawa fenol
yang terkandung didalamnya yang berfungsi sebagai .flavouring agent sebagai
hydroxychavicol, eugenol, isoeugenol, quercetin, eugenol metyl ester dan safrole.
Andarwulan (1995) telah menyelidiki karakteristik antioksidan daun sirih,
terutama pemisahan komponen dalam oleoresin daun sirih dengan kromatografi
lapis tipis. Peneliti tersebut menemukan bahwa ekstrak oleoresin daun sirih
kuning mempunyai aktivitas antioksidan, dimana daun sirih yang diekstrak dengan
heksan kemudian dengan etanol menunjukkan aktivitas antioksidan relatif lebih
tinggi dibandingkan dengan BHA dan daun sirih yang diekstrak metanol serta
daun sirih yang diekstrak dengan heksan kemudian dengan metano!'
Pada tahun 1995 juga Andarwulan et al. melaporkan bahwa antioksidan
daun sirih yang diekstrak dengan pelarut etanol memberikan efek antioksidan
dalam sistem emulsi asam linoleat-etanol yang disimpan pada suhu 37°C. Dari
beberapa perlakuan yang berbeda yaitu jenis daun (hijau dan kuning), bentuk daun
(segar dan kering beku) serta cara penghilangan bau (distilasi uap dan soxhlet)
beku-distilasi uap mempunyai rendemen ekstrak antioksidan tertinggi (7.75 persen) dan
aktivitas antioksidan tertinggi (faktor protektif9.83 dibanding BHA dengan faktor
protektif 3.75). Kesimpulan ini diperkuat oleh penelitian yang dilakukan oleh
Susanto (1995) yang menunjukkan bahwa ekstrak antioksidan daun sirih hijau
kering beku-distilasi uap menghasilkan rendemen antioksidan tertinggi (9.75
persen), total fenol lebih tinggi dibandingkan apabila penghilangan bau dilakukan
dengan ekstraksi soxhlet, dan mempunyai aktivitas antioksidan tertinggi dengan
faktor protektif 13.09 (faktor protektifBHA sckitar 5.32).
Selanjutnya, Andarwulan et al. (1995) melakukan uji kestabilan ekstrak
antioksidan daun sirih hijau kering beku-distilasi uap dengan konsentrasi 50, 100
dan 200 ppm pada emulsi minyak kedele kasar dan minyak kedele mumi. Dari
pengujian aktivitas antioksidan dengan metode tiosianat diketahui bahwa aktivitas
antioksidan tertinggi ditemukan pada minyak kedele mumi yang diberi 200 ppm
ekstrak antioksidan, sedangkan yang terendah adalah pada minyak kedele mumi
.yang ditambahkan ekstrak antioksidan sebanyak 50 ppm. Efek interaksi dengan
asam sitrat telah diuji oleh para peneliti tersebut, dimana ekstrak antioksidan
dengan konsentrasi 50, 100 dan 200 ppm memberikan efek interaksi negatif
dengan 0.01,0.02 dan 0.04 persen asam sitrat.
Dwiyanti (1996) melakukan uji ketahanan panas ekstrak antioksidan daun
sirih hijau dan menyimpulkan bahwa ekstrak antioksidan daun sirih hijau dalam
medium oksidasi minyak kedele murni mengalami penurunan aktivitas antioksidan
yang tajam setelah dipanaskan pada suhu tinggi (160, 180 dan 200°C) dengan
lama pemanasan 30, 60, 90 dan 120 menit. Aktivitas antioksidan daun sirih
setelah dipanaskan 160°C selama 30, 60, 90 dan 120 menit mempunyai faktor
antioksidan terjadi pada pemanasan 180 dan 200°C selama 30, 60, 90 dan 120
menit ditandai dengan faktor protektifyang kurang dari satu.
Uji keamanan antioksidan daun sirih dosis tinggi secara in vivo dan in vitro
dilakukan oleh Harahap (1996) dengan menggunakan tikus putih jenis Wistar. Ia
menyimpulkan bahwa pertumbuhan berat badan rata-rata kelompok tikus yang
diberi ekstrak antioksidan sebanyak 200 ppm (0.185 g/kg lemak) tidak berbeda
nyata dengan kelompok tikus kontrol, tetapi berbeda nyata dengan kelompok
tikus lain yang diberi perlakuan ekstrak antioksidan 500 ppm (0.478 g/kg lemak),
1000 ppm (0.970 g/kg lemak), 1500 ppm (1.435 g/kg lemak) dan 2000 ppm
(1.872 g/kg lemak). Pemberian ekstrak antioksidan daun sirih tidak berpengaruh
nyata terhadap berat organ tikus yaitu hati, ginjal dan pankreas walaupun terjadi
kerontokan rambut mulai minggu ke-7 perlakuan. Total sel limfosit dan sel
limfosit hidup pada tikus yang diberi ekstrak antioksidan berbeda sangat nyata
dengan tikus kontrol. Selanjutnya peneliti tersebut menyatakan bahwa secara in
vivo ekstrak antioksidan daun sirih pada konsentrasi yang diteliti bersifat
prooksidan, sedangkan secara in vitro penambahan ekstrak antioksidan daun sirih
kedalam kultur sel cenderung melindungi sel dari kematian dan memacu
A. BAHAN DAN ALAT
Bahan baku pada penelitian ini adalah daun sirih hijau segar yang diperoleh
dari daerah Brebes, Jawa Tengah. Bahan kimia yang digunakan adalah etanol
absolut pro analysis dari Merck, asam asetat kemurnian 99.5% dari Kanto Chern
Co., kloroform ACS Reagent dari J. T. Baker, heksan ACS Reagent dari 1. T.
Baker, dietil eter pro analysis dari Merck, gas N2, feroklorida tetrahidrat dari
Merck (kemurnian minimal 99.0%), feriklorida anhydrous GPR dari Merck,
amonium tiosianat pro analysis dari Merck, asam linoleat kemurnian 88.0% dari
Wako Pure Chern., asam klorida 37% dari Merck, kaliumferisianida AnalaR dari
Merck, perak nitrat AnalaR dari Merck, ammonia 25% pro analysis dari Merck,
sodium karbonat anhydrous dari Merck, iodin kristal AnalaR dari Merck, anilin
GR dari Merck (kemurnian minimal 99.5%), p-anisidin grade 111 dari Sigma
Chern. Co., metanol pro analysis dari Merck, I-butanol dari Kanto Chern. Co.
(kemurnian minimal 96% v/v) dan sodium hidrosulfit anhydrous dari Kanto
Chem. Co.
A1at-alat yang digunakan yaitu alat distilasi uap, shaker, blender, penangas
aIr, pengering beku (freeze drier), alat penyaring vakum, rotavapor, peralatan
kromatografi lapis tip is, inkubator 37°C, oven, lampu ultraviolet, mikropipet,
B. METODE PENELITIAN
Penelitian ini dilakukan dalam tiga tahap. Tahap pertama meliputi
persiapan sampel, penghilangan bau dan ekstraksi antioksidan dari daun sirih.
Tahap kedua dilakukan pemisahan fraksi antioksidan dengan kromatografi lapis
tipis, analisis spektrum dan uji aktivitas antioksidan. Pada tahap ketiga
fraksi-fraksi hasil pemisahan yang mempunyai aktivitas lebih tinggi dengan BHA
(a=0.05) diidentifikasi dengan reaksi pewamaan.
1. Penelitian Tahap Pertama
a. Persiapan sampel
Daun sirih hij au segar setelah panen disortasi, dibersihkan, dicuci
dan ditiriskan. Kemudian dikeringbekukan, digiling, dan diayak dengan
saringan 40 mesh. Selanjutnya sampel disimpan diJreezer (suhu -30°C).
b. Penghilangan bau daun sirih
Terhadap 40 gram tepung daun sirih dilakukan distilasi uap selama
3-4 jam sehingga diperoleh tepung daun sirih yang bebas bau, kemudian
dikeringbekukan.
c. Ekstraksi dengan pelarut
Ekstraksi pelarut dilakukan dengan metode Hammerschmidt dan
Pratt (1978) dengan sedikit modifikasi pada waktu ekstraksi dan pelarut.
menggunakan shaker selama 3 jam. Kemudian ditambahkan 70 ml etanol
dan dipanaskan dalam penangas air bersuhu 70'C selama satu jam.
Hasilnya disaring dengan penyaring vakum menggunakan kertas saring
whatman 42. Selanjutnya residu yang diperoleh dicuci dengan 100 ml
etanol panas, kedua filtrat dicampur, kemudian pelarutnya diuapkan
menggunakan rotavapor dengan suhu 40°C dan reduced pressure (13.5
kgf/cm') sampai diperoleh pekatan ekstrak antioksidan daun sirih hijau.
Ekstrak yang diperoleh kemudian ditimbang.
2. Penelitian Tahap Kedua
a. Fraksinasi ekstrak antioksidan daun sirih
Pemisahan antioksidan dalam ekstrak daun sirih dilakukan dengan
plat kromatografi lapis tipis silika F254 menggunakan pelarut campuran
kloroform:heksana:asam asetat (98:2:2). Fraksi yang diperoleh dilihat
dibawah sinar lampu ultraviolet (panjang gelombang 254-366 11111). Dari
pembandingan nilai Rf fraksi tersebut dengan hasil pemisahan yang telah
dilakukan oleh Susanto (1995) dipilih beberapa fraksi yang akan
dipisabkan lebih lanjut. Fraksi-fraksi tersebut dikerok lalu dilarutkan
dalam 2 ml etanol, dikocok dengan vorteks dan disentrifusi untuk
pemurnian dari komponen penyusun plat KLT.
Fraksi -fraksi dari pengembangan pertama diatas dipisahkan lebih
lanjut dengan plat KLT yang sama dengan pelarut heksan:dietileter (3:7).
Nilai Rf fraksi-fraksi yang diperoleh dibandingkan lagi dengan hasil
penelitian yang telah dilakukan oleh Susanto (1995) untuk memperoleh
dugaan tersebut kemudian dikerok dan dilarutkan dengan 2 ml etanol,
dikocok dengan vorteks dan disentrifusi untuk pemurnian dari komponen
penyusun plat KLT. Masing-masing fraksi tersebut dianalisis sifat
spektralnya pada kisaran panjang gelombang 200 - 800 nm. Pelarut etanol
yang tersisa dihilangkan dengan hembusan gas nitrogen hingga terbentuk
residu. Residu yang diperoleh kemudian ditimbang.
b. Aktivitas antioksidan fraksi ekstrak antioksidan daun sirih
Residu fraksi antioksidan yang diperoleh dari tahap fraksinasi
tersebut diatas kemudian dilarutkan dengan etanol sehingga konsentrasinya
sarna. Pengukuran aktivitas antioksidan dilakukan dengan metode
tioksianat menurut Chen et al. (1996) dengan sedikit modifikasi pada suhu
inkubasi. Sebanyak 200 ppm fraksi antioksidan ditambah 1.0 ml buffer
fosfat 0.1 MpH 7, 1.0 ml asanl linoleat 50 mM dalam etanol 99.5%, dan
0.5 ml akuades. Campuran tersebut diinkubasi pada suhu 37"C. Pada hari
ke-I, 2, 4, 5, 6, 9, 11 dan 13 diambil contoh sebanyak 50 III untuk diuji
dengan penambahan 2.35 ml etanol 75%, 50 III amonium tiosianat 30%,
dan 50 III feroklorida 20 mM dalam HCl 3.5%. Setelah tiga menit
dilakukan pengukuran absorbansi dengan spektrofotometer pada panjang
gelombang 500 11m. Nilai absorbansi dinyatakan sebagai bilangan
peroksida.
Fraksi-fraksi yang mempunyai aktivitas antioksidan lebih tinggi
3. Penelitian Tahap Ketiga
Pada tahap ketiga dilakukan identifikasi fraksi yang mempunyaJ
aktivitas antioksidan lebih tinggi dari BHA dengan metode pewarnaan. Fraksi
diaplikasikan pada KLT dengan pelarut heksana:dietileter (3:7). Kromatogram
fraksi tersebut kemudian direaksikan dengan pereaksi pewarna menurut met ode
Duve dan White (1991).
1) Pereaksi 1
Kromatogram disemprot dengan larutan I % kalium ferisianida dalam air
dan 1% larutan feriklorida dalam air. Warna biru menunjukan adanya
komponen fenolik.
2) Pereaksi 2
Kromatogram disemprot dengan larutan 2% feriklorida dalam etano!.
Perubahan warna menjadi biru menunjukan adanya trihidroksifenolik, hijau
adalah dihidroksifenolik dan merah sampai coklat fenolik lain.
3) Pereaksi 3
Pereaksi 3 adalah larutan amoniakal perak nitrat yang dibuat dengan
menambahkan 3.4 g perak nitrat dalam 100 air kedalam larutan 30 ml
amonia dalam 70 ml air. Kromatogram disemprot dengan pereakasi diatas
kemudian dipanaskan pada suhu 105°C selama 10 menit. Komponen
pereduksi akan berubah warnanya menjadi coklat, hitam dan abu-abu.
4) Pereaksi 4
Kromatogram disemprot dengan larutan 20% sodium karbonat. Adanya
5) P ereaksi 5
Kromatogram diletakkan dalam bcjana KLT yang sudah dijenuhkan
dengan uap iodin. Warna eoklat menunjukkan adanya gula merkaptal,
alkohol, asam, gliserida, gula N-asilamino atau polisakarida.
6) Pereaksi 6
Pereaksi 6 merupakan eampuran 1.8% anilin dalam etanol dan 1.8% asam
oksalat dalam air. Setelah disemprotkan kromatogram lalu dipanaskan
pada suhu loooe selama 10 menit. Gula heksosa akan berwarna hijau
keeoklatan, gula pentosa berwarna merah dan kuning adalah asam uronat.
7) Pereaksi 7
Pereaksi dibuat dengan melarutkan 1 g p-anisidin dalam 10 ml metanol
kemudian ditambah 90 ml I-butanol dan 0.1 g sodium hidrosulfit.
Perubahan warna menjadi kuning menunjukkan komponen ketoheksosa,
hijau adalah metil pentosa, eoklat adalah aldopentosa, eoklat muda adalah
gula deoksi dan aldoheksosa, dan merah adalah asam uronat.
C. PENGAMATAN
1. Nilai Rf
Nilai Rf (Retardation factor) dihitung sebagai nilai perbandingan antara
jarak yang digerakkan oleh fraksi dengan jarak yang digerakkan oleh pelarut.
Penghitungan nilai Rf dilakukan terhadap semua fraksi ekstrak antioksidan
daun sirih yang terpisah dengan kromatografi lapis tipis.
Jarak yang digerakkan oleh fraksi (em) Rf=
2. Sifat Spektral
Masing-masing fraksi yang potensial sebagai antioksidan dilarutkan
dalam etanol dan diamati sifat spektralnya dengan spektrofotometer meliputi
panjang gelombang penyerapan maksimum dan profil penyerapan (spektrum)
pada kisaran panjang gelombang sinar ultraviolet hingga sinar tampak (200-800
nm).
3. Aktivitas Antioksidlln
Dari nilai pengukuran aktivitas antioksidan kemudian dihitung nilai
periode induksi. Periode induksi diartikan sebagai waktu yang dibutuhkan
untuk mencapai bilangan absorbansi sebesar 0.300 (Chen et ai, 1995). Nilai
periode induksi ditentukan dengan meregresilinierkan nilai absorbansi yang
diperoleh terhadap lama penyimpanan.
Nilai periode induksi sampel kemudian dibandingkan dengan kontrol
untuk mendapatkan nilai faktor protektif, dengan rumus seperti berikut :
Periode induksi sampel Faktor protektif=
Periode induksi kontrol
D.
RANCANGANPERCOBAANRancangan percobaan dalam penelitian ini adalah Rancangan Acak
Y;j >t + 't; + j3j + e;j
dim ana :
Y;j = Nilai pengamatan pada perlakuan ke-i, kelompok ke-j
セャ@ = Nilai Tengah Umum
't; = Pengaruh perlakuan ke-i
j3j Pengaruh kelompok ke-j
e;j = Galat percobaan pada perlakuan ke-i, kelompok ke-j
A. EKSTRAK ANTIOKSIDAN
Ekstrak antioksidan daun sirih dalam penelitian ini merupakan oleoresin
karena diperoleh dengan mengekstrak komponen antioksidan dalam daun sirih
dengan menggunakan pelarut organik tertentu (etanol). Pengertian oleoresin
berbeda dengan minyak atsiri dimana minyak atsiri diperoleh dengan
penyulingan dan hanya mengandung komponen volatil, sedangkan oleoresin
didapatkan dengan cara ekstraksi menggunakan pelarut organik sehingga selain
mengandung minyak atsiri juga mengandung resin yang bersifat nonvolatil
dengan rasa dan aroma tertentu (Stahl, 1973).
Pada persiapan sampel dilakukan pengeringan daun sirih dengan tujuan
untuk memperoleh kadar air minimum agar ekstraksi lebih mudah. Dengan
pengeringan beku diharapkan kcrusakan maupun hilangnya komponen kimiawi
yang terkandung dalam bahan akibat panas dapat dihindari. Kadar air rata-rata
daun sirih setelah pengeringan sebesar 5.65 persen dan data hasil pengukuran
lengkapnya dapat dilihat pada Lampiran I.
Penggilingan daun sirih kering beku hingga berukuran 40 mesh dimaksudkan untuk memperkecil dan menyeragamkan ukuran
partikel-partikelnya karena ukuran yang kecil dan seragam dapat mempermudah kontak
antara bahan dengan pelarut sehingga ekstraksi berlangsung dengan baik
(Purseglove et a!., 1981). Salah satu syarat antioksidan yang ditambahkan pada
bahan pangan yaitu senyawa tersebut tidak berbau dan tidak menimbulkan
peru bah an aroma yang tidak dikchendaki pada produk. Unluk ilu daun sirih
tajam dan tidak semua orang menyukainya. Dengan distilasi uap minyak atsiri
yang ada dalam daun sirih akan terikut dalam uap air saat tepung daun sirih
kering beku didistilasi.
Ekstraksi antioksidan dari tepung daun sirih hijau kering beku yang sudah
bebas bau dilakukan secara maserasi dengan menggunakan pelarut. Umumnya
maserasi untuk mengekstrak komponen antioksidan dilakukan dengan pelarut
metanol, etanol, heksan, aseton dan kloroform. Dalam penelitian ini ekstraksi
antioksidan dilakukan dengan etanol karena etanol merupakan pelarut organik
yang bersifat polar sehingga diharapkan komponen antioksidan fenolik terekstrak
sebanyak mungkin. Dari penelitian Susanto (\995) diketahui bahwa fraksi polar
dari ckstrak antioksidan daun sirih mempunyai aktivitas antioksidan serta total
fenolik yang lebih tinggi dibandingkan dengan fraksi nonpolarnya.
Alasan lain penggunaan etanol sebagai pelarut adalah karena etanol
merupakan pelarut yang relatif aman (tidak bersifat racun bagi tubuh). Meskipun
metanol dikenal sangat efektif untuk mengekstraksi komponen antioksidan,
namun pelarut ini bersifat toksik bila terminum, terhirup maupun bila terserap
pada permukaan kulit. Kendati setelah ekstraksi dilakukan penguapan pelarut,
tetapi tidak menjamin residu yang ditinggalkan bebas metanol dan tidak bersifat
toksik. Upaya mengganti dengan pelarut yang aman (etanol) setelah ekstraksi
dilakukan dengan metanol tidak praktis dan memerlukan tambahan biaya
schingga tidak ekonomis.
Daya ekstraksi etanol terhadap komponen antioksidan cukup baik dan
pernah dibuktikan oleh Duh et al. (1992) yang mengekstrak antioksidan dari kulit
kacang tanah. Ia menemukan bahwa ekstrak antioksidan yang diekstrak dengan
Selain itu ditinjau dari segi harga, etanol lebih murah daripada heksan,
metanol dan kloroform. Hal ini menjadi pertimbangan tersendiri dalarn
penerapannya nanti karena lebih ekonomis. Untuk pemakaian secara komersil
perlu diperhatikan penggunaan pelarut yang aman, murah, daya ekstraksi tinggi
serta mudah diperoleh.
Ekstrak antioksidan dari daun sirih hijau yang dilakukan penghilangan
bau dengan distilasi uap yang diperoleh masih agak berbau khas daun sirih.
Setelah pelarutnya dihilangkan dengan rotavapor dan hembusan gas nitrogen,
diperoleh ekstrak antioksidan daun sirih hijau berwama hijau pekat kehitarnan
dan agak berbau sirih dengan rendemen sebesar 11.38 persen. Data lengkap
penimbangan rendemen ekstrak antioksidan dapat dilihat pada Lampiran 1.
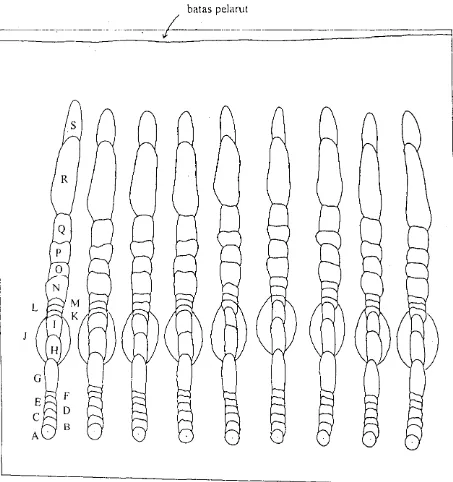
B. FRAKSINASI ANTIOKSIDAN
Pada tahap selanjutnya ekstrak antioksidan daun sirih hijau yang sudah
bebas bau difraksinasi dengan kromatografi lapis tipis silika berfluoresens F254 •
Pengembangan dilakukan dengan campuran pelarut kloroform:etanol:asarn
asetat (98:2:2) yang analog dengan pengembangan dimensi pertarna dari
pengembangan dua dimensi yang telah dilakukan oleh Susanto (1995) dengan
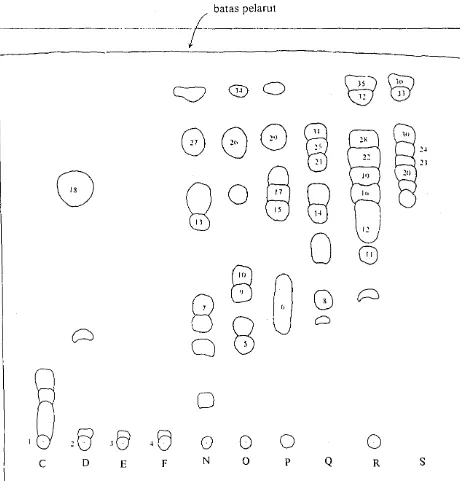
pelarut yang sarna. Dari hasiJ pengembangan ini diperoleh 19 fraksi yang
batas pelarut
イMMMセMMMセMMMMMセN@
MMセMMOMMNセMMMMN@
MMNMMセMMJ
L
G
E
C
A
R
Q
p
o
N
F
D
B M K
[image:40.600.57.510.94.576.2]1. Nilai Rf Fraksi Antioksidan dari Ekstrak Antioksidan Daun Sirih Hijau
Nilai Rf fraksi hasil pemisahan ekstrak antioksidan daun sirih hijau
disajikan pada Tabel I dan selengkapnya pada Lampiran 2.
Susanto (1995) tclah melakukan isolasi tcrhadap ekstrak antioksidan
dengan kromatografi lapis tipis silika. Pengembangan dilakukan secara dua
dimensi dengan pelarut pertama kloroform:etanol:asam asetat (98:2:2) dan
pelarut kedua heksan:dietil eter (3:7) dan menghasilkan 57 fraksi (Lampiran
3). Hasil uji aktivitas antioksidan menunjukkan bahwa fraksi nomor 5, 37,
25, 50, 26 dan 32 mempunyai aktivitas yang tidak berbeda nyata dengan
Tabel I. Nilai Rf dari ekstrak antioksidan daun sirih hijau yang difraksinasi dengan kromatografi lapis tipis silika dengan pelarut kloroform: etanol:asam asetat (98:2:2)
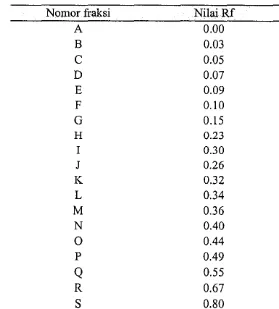
Nomor fraksi Nilai Rf
A 0.00
B 0.03
C 0.05
D 0.Q7
E 0.09
F 0.10
G 0.15
H 0.23
I 0.30
J 0.26
K 0.32
L 0.34
M 0.36
N 0.40
0
0.44P 0.49
Q
0.55R 0.67
[image:41.602.187.466.386.695.2]BHA (a=O.05). Nilai Rf keenam fraksi yang mempunyai aktivitas tinggi
tcrscbut dinyatakan dcngan Rf-l untuk Rf pada pengembangan dimensi
pertama dan Rf-2 untuk Rf pada pengembangan dimensi kedua seperti terlihat
pada Lampiran 4.
Nilai Rf fraksi-fraksi yang diperoleh kemudian dibandingkan dengan
nilai Rf-l hasil penelitian Susanto (1995). Fraksi-fraksi yang mempunyai
nilai Rf mendekati nilai referensi (Lampiran 4) dipilih untuk diaplikasikan
kembali, yaitu fraksi C, D, E, F, N, 0, P, Q, R dan S.
Fraksi-fraksi yang dipiJih tersebut kemudian dipisahkan dengan KL T
silika menggunakan pelamt campuran heksan:dietil eter (3:7), analog dengan
pengembangan dimensi kedua yang dilakukan Susanto (1995). Dari
pcmisahan ini dipcrolch 60 li'aksi yang tcrpisah scperti tcrlihat pada Gambar
4. Nilai Rf masing-masing fraksi tersebut dibandingkan dengan nilai Rf-2
hasil penelitian Susanto (1995) (Lampiran 4) sehingga didapatkan 36 fraksi
tcrpilih dengan nilai Rf seperti pada Tabel 2. Tiga puluh enam fraksi tersebut
diuji aktivitas antioksidannya dengan metode tosianat.
2. Aktivitas Antioksidan Fraksi-fraksi Antioksidan Daun Sirih Hijau
Fraksi antioksidan hasil pemisahan yang telah dipiJih (36 fraksi) diuji
aktivitasnya dengan metode tiosianat. Aktivitas antioksidan dinyatakan
dengan nilai periode induksi dan faktor protektif. Periode induksi yaitu waktu
yang dibutuhkan sejak awal tidak terdeteksinya hidroperoksida (yang
mempakan hasil reaksi berantai otooksidasi lemak) hingga terjadi kenaikan
tiba-tiba jumlah hidroperoksida di dalam sampel (Wong, 1989), sedangkan
dari faktor protektif dapat diketahui seberapa jauh suatu antioksidan mampu
c::::::7
®
0
wW
1 セ@ J 1G
88
21> -@
2);'0
セL@
,.
セ@ 1 Rセ@ セ@ I
8
1') 20Q
0
8B
@
1"15
"
0
G
ffi
0
8
8
')G)
00
o
o
o
o
o
c
D E F No
p Q Rs
MMNMMMMMMMMセMMNN@ . --- --- - - "
[image:43.610.69.529.92.573.2]Tabel 2. Nilai Rf fraksi dari ekstrak antioksidan daun sirih hijau yang dipisahkan dengan kromatografi lapis tipis siJika dengan pelarut heksan : dietil eter (3 :7)
Nomor fraksi 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 Nilai Rf 0.00 0.00 0.00 0.00 0.26 0.36 0.36 0.37 0.39 0.43 0.48 0.56 0.56 0.58 0.59 0.64 0.64 0.65 0.68 0.69 0.72 0.73 0.75 0.75 0.76 0.77 0.78 0.78 0.79 0.79 0.79 0.89 0.90 0.91 0.92 0.93
menghambat oksidasi bila dibandingkan dengan tanpa penambahan
antioksidan. Nilai periode induksi dan faktor protektif dari 36 fraksi tersebut
dapat dilihat pada Tabel 3 dan seJengkapnya pada Lampiran 6. Pada Gambar
[image:44.602.146.532.133.623.2]3. 35 3. 33 32 31 30 29 28 27 2. 25 2. 23 22 21
-
20 <1lセ@
19'"
18en
<1l 17
"d
0
I.
セ@ 15 I. 13 12 11 10 9 8 7
•
5•
3 2 BHAKontrol
KMMMMMMMKMMMMMセj@
--- --- + ---
MセN@
- - - --.. --1
0 5 10 15 20 25
Faktor protektif
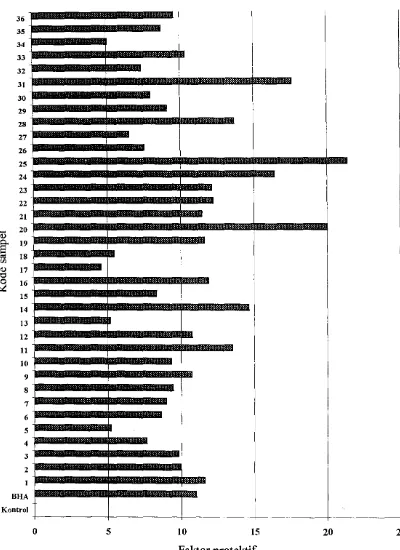
[image:45.607.90.490.90.640.2]Tabcl 3. Nilai peri ode induksi dan faktor protektif fraksi-fraksi dari ekstrak antioksidan daun sirih hij au yang difraksinasi dengan KL T
Kode sampel*J Kontrol BRA 1 2 3 4 5 6 7 8 9 10 II 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36
Periode induksi (hari) Faktor protektif
4.0
44.6 11.0
46.9 11.6
40.3 10.0
39.6 9.8
31.0 7.7
21.1 5.2
34.9 8.6
36.3 9.0
38.2 9.5
43.4 10.8
37.7 9.4
54.6 13.5
43.4 10.8
21.0 5.2
59.2 14.7
33.7 8.4
48.1 11.9
18.4 4.6
22.1 5.5
46.9 11.6
80.8 20.0
46.3 11.5
49.4 12.2
49.0 12.2
66.3 16.4
86.4 21.4
30.6 7.6
26.4 6.5
55.3 13.7
36.7 9.1
32.2 8.0
71.2 17.7
29.9 7.4
41.9 10.4
20.6 5.1
35.3 8.8
38.8 9.6
Dari data tersebut diketahui bahwa fraksi nomor 25 mempunyal
aktivitas antioksidan tertinggi dengan periode induksi sekitar 86.3 hari atau
21.0 kali bila tanpa penambahan antioksidan. Aktivitas antioksidan terendah
ditunjukkan oleh fraksi nomor 17 dengan periode induksi 18.4 hari atau 4.6
kali bila tanpa penambahan antioksidan.
Dengan konsentrasi antioksidan yang sarna dengan BHA (200 ppm)
pada saat dilakukan uji aktivitas antioksidan dengan metode tiosianat, temyata
diperoleh 13 fraksi yang mempunyai aktivitas lebih tinggi dari BHA yaitu
fraksi nomor 1, 11, 14, 16, 19,20,21,22,23,24,25,28 dan 31. Analisis
ragam terhadap fraksi-fraksi yang diuji aktivitas antioksidannya dapat dilihat
pada Lampiran 7. Dari uji berjarak Duncan (Lampiran 8) temyata fraksi
nomor 25, 20, 24 dan 31 berbeda nyata dengan BHA (a=0.05), sedangkan
fraksi nomor 14, 28, 11,22,23, 16, 19,21 dan I tidak berbeda nyata dengan
BHA (a=0.05).
3. SiCat Spektral Fraksi yang Potensial Sebagai Antioksidan
Panjang gelombang penyerapan maksimum fraksi-fraksi dari ekstrak
antioksidan daun sirih hij au yang difraksinasi dengan KL T silika yang
potensial sebagai antioksidan (aktivitas antioksidan lebih tinggi dari BHA)
dapat dilihat pada Tabel 4. Dari spektrum absorbsi masing-masing fraksi
seperti terlihat pada Gambar 6 sampai dengan Gambar 18 dapat diketahui
bahwa semua fraksi menyerap pada panj ang gelombang sinar ultraviolet
hingga sinar tampak atau dapat dikatakan semua fraksi tersebut mengandung
Tabel 4. Panjang gelombang penyerapan maksimum fraksi-fraksi yang potensial sebagai antioksidan
Nomor fraksi Panjang gelombang dalam nm Keterangan*)
(Absorb ansi)
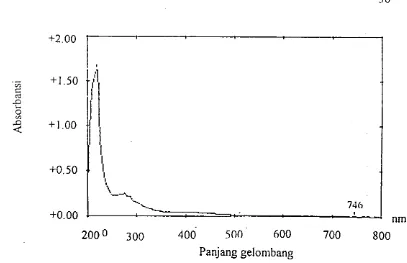
1 219 (1.631); ultraviolet
746 (0.008) sinar tampak
II 408 (0.043) sinar tampak
14 220 (0.786); ultraviolet
435 (0.059); 657 (0.021) sinar tampak
16 372 (0.125); ultraviolet
438 (0. 365); 526 (0.034); 602 (0.035); sinar tampak 656 (0.115); 727 (0.003)
19 220 (1.086); 276 (0.169); ultraviolet
426 (0.318); 569 (0.033); 611 (0.052); sinar tampak 659 (0.211)
20 438 (0.031) sinar tampak
21 220 (0.529); ultraviolet
412 (0.060); 660 (0.038) sinar tampak
22 210 (0.755); ultraviolet
410 (1.046); 508 (0.100); 537 (0.095); sinar tampak 562 (0.071); 610 (0.142); 662 (0.606)
23 221 (0.562); ultraviolet
411 (0.023); 691 (0.007) sinar tampak
24 220 (0.317); 277 (0.047); ultraviolet
417 (0.032); 660 (0.019) sinar tampak
25 220 (1.171); 277 (0.177); ultraviolet
417 (0.038); 660 (0.026) sinar tampak
28 210 (1.157); 277 (0.433); ultraviolet
411 (0.892); 509 (0.086); 539 (0.086); sinar tampak 562 (0.066); 612 (0.128); 662 (0.529)
31 212 (1.374); 281 (0.503); ultraviolet
431 (0.033); 658 (0.017); 764 (0.002) sinar tampak
[image:48.597.124.506.127.670.2]Pada penelitian ini digllnakan etanol absoilit sebagai pelarut llntllk
analisis spektral yang mempllnyai nilai cut of wavelength (COWL) sekitar
204-210 nm. Cut of wavelength yaitll panjang gelombang sllatll larutan yang
menllnjllkkan absorbansi sebesar 1.00 jika dillkllr dengan kllvet selebar 1 em
dengan menggllnakan air sebagai blanko (Williams dan Flemming, 1989).
Menllrut Kemp (1994) dibawah nilai COWL pelarut akan menyerap terlalll
banyak sehingga absorb ansi sampel sendiri tidak tereatat dengan tepa!.
Fraksi nomor 1,19,20,21,23,24,25, dan 31 menyerap pada panjang
gelombang 220 nm. Penyerapan maksimum pada 220 nm dapat menunjllkkan
adanya struktllr keton terkonjllgasi C=G C=O (Kemp, 1994) atan asam tidak
jenllh =C- COOH yang terikat pada einein benzen (Silverstein et aI., 1991),
sedangkan dari penyerapan pada 277 nm seperti pada fraksi nomor 19, 24, 25,
dan 28 dapat diketahlli adanya gllgllS benzen terdisllbtitllsi (R-C6H4-R') dengan
R=R'= -OH dan orientasi posisi meta, atall R=-CHO dan R'= -OMe dan
orientasi posisi para (Williams dan Flemming, 1989). Pada fraksi nomor 31
diduga terdapat gllgllS karbonil yang menyerap pada 279 nm (Kemp, 1994).
Bila dibandingkan dengan panjang gelombang penyerapan maksimllm
klorofil dan turunannya yang llmllm terdapat pada dalln berwama hijau, dapat
diduga bahwa didalam fraksi nomor 16 terkandung pyropheophytin b atau
pheophorbide b, dan fraksi nomor 22 diduga mengandllng pyropheophytin a
+2.00
,
+1.50
ttl
+1.00
+0.50
746
+0.00 nm
200 0 300 400 500 1i00 700 800
Panjang gelombang
Gambar 6. Spektrum absorbsi fraksi nomor I dari ekstrak antioksidan daun sirih hijau yang diisolasi dengan KL T
+2.50
l
+2.00
!
'Vl
c: +1.50
'"
.D ....
0
セ@
\
.D
セ@ +1.00
\
+0.50
408
+0.00 nm
200 300 400 500 600 700 800
Panjang gelombang
[image:50.595.109.516.60.323.2] [image:50.595.119.518.379.660.2]+0.80
j
+0.60+0.40
\
435+0.20
657
+0.00 nm
200 300 400 500 600 700 800
Panjang gelombang
Gambar 8. Spektrum absorbsi fraksi nomor 14 dari ekstrak antioksidan daun sirih hijau yang diisolasi dengan KL T
I!
I
+2.00
セ@
.<;;
I
I
c +1.50
\
oj
on ....
0
'"
.D
<C +1.00
I
+0.50
\
438 ,SZセ@
/'''\
656\.. 526 602 ,
+0.00
'-
nm200 300 400 500 600 700 800
Panjang gelombang
[image:51.605.88.538.70.335.2] [image:51.605.111.519.388.652.2]+1.20
r
.i.
+1.00
II
+0.80 .;;; c oj .0 ....+0.60 0 '" .0
-<
\
+0.40 426
+0.20
|セ@
659
,
+0.00 nm
200 300 400 500 600 700 800
Panjang gelombang
Gambar 10. Spektrum absorbsi fraksi nomor 19 dari ekstrak antioksidan daun sirih hijau yang diisolasi dengan KL T
+2.50
+2.00
セ@
.;;;
c
oj
.0 .... +1.50 0 '" .0
-<
+1.00 +0.50 438+0.00 nm
200 300 400 500 600 700 800
Panjang gelombang
Gambar 11. Spektrum absorbsi fraksi nomor 20 dari ekstrak antioksidan daun sirih hijau yang diisolasi dengan KL T
[image:52.595.120.511.51.332.2] [image:52.595.124.509.395.655.2]+0.50
fiji
+0.40
I
.<;;
I
c::
\
'"
+0.30.D '-0
セ@
.D
<t: +0.20
I
+0.10 412 660
+0.00 nm
200 300 400 500 600 700 800
Panjang gelombang
Gambar 12. Spektrum absorbsi fraksi nomor 21 dari ekstrak antioksidan daun sirih hijau yang diisolasi dengan KL T
.<;; c::
'"
.D '-0 セ@ .D <t: +1.20 +1.00 +0.80 +0.60 +0.40 +0.20 +0.00 200 410 nm300 400 500 600 700 800
[image:53.595.131.509.70.336.2] [image:53.595.122.506.396.650.2]Panjang gelombang
+0.60
l/I
1
.;;; +0.40
セ|@
c\
'"
. .D
セ@ 0 '" .D <t: +0.20 I \
\ 411
セ@
+0.00
691
nm
200 300 400 500 600 700 800
Panjang gelombang
Gambar 14. Spektrum absorbsi fraksi nomor 23 dari ekstrak antioksidan daun sirih hijau yang diisolasi dengan KL T
+0.30
t
j,
.f
+0.20
I
+0.10
277
C>60
417
.. セMMMMMMMGMNN@
+0. 00 L _ _
M\M⦅MMBセMMNN⦅MM]ZZ]]]]]]MZZZMBZZNNNMMNNNMG@
ZZZMMZZZ[Bセ]]T@
200 300 400 500 600 I 700 800
Panjang gelombang
nm
[image:54.597.110.511.52.337.2] [image:54.597.121.505.388.651.2]+ 1 20 .
t '
,j,I
+0.80
+0.40
1
\ 2:7
417
\ / . \ 660
+0.00
ャMMG⦅セBBZZ]]ZcZZZBB@
_ _ _ _ _--=='
'--''--_---1 nm200 300 400 500 600 700 800
Panjang gelombang
Gambar 16. Spektrum absorbsi fraksi nomor 25 dari ekstrak antioksidan daun sirih hijau yang diisolasi dengan KL T
+1.20 , [,,
+ 1.00 . 1 \
TセL@
1\277
+0.40
|O|セ@
+0.20 , 612
509539 562 '
662
,
セ@
,
"\..
+0.00 1 - - - 1 - - - - ' - - - < . _ _ '
--.-'-4-_ _
-..:.=-_--1 nm200 300 400 500 600 700 800
Panjang gelombang
[image:55.599.122.534.53.339.2] [image:55.599.109.534.386.661.2]+1.20
tt\
I ) I 'int::
'"
..0
セ@
+0.80 0
'"
..0
-<
281•
+0.40
Jl
• 431 658764
+0.00
200 300 400 500 600 700 800
Panjang gelombang
Gambar 18. S pektrum absorbsi fraksi nomor 31 dari ekstrak antioksidan daun sirih hijau yang diisolasi dengan KL T
C. IDENTIFlKASI FRAKSI ANTIOKSIDAN DENGAN PEWARNAAN KLT
Fraksi-fraksi yang mempunyai aktivitas antioksidan lebih tinggi dari BHA
diaplikasikan pada KLT silika dengan pelarut heksan:dietileter (3:7).
Kromatogram yang diperoleh kemudian disemprotkan dengan 7 jenis pereaksi
seperti tercantum p