EKSPRESI PEROKSISOME PROLIFERATOR ACTIVATOR RESEPTOR GAMMA
(PPARγ) PADA PENDERITA KARSINOMA NASOFARING
DI RSUP H. ADAM MALIK.
TESIS
Oleh:
FLORA ARMANTI
PROGRAM MAGISTER KEDOKTERAN KLINIK
ILMU KESEHATAN TELINGA HIDUNG TENGGOROK BEDAH KEPALA DAN LEHER FAKULTAS KEDOKTERAN UNIVERSITAS SUMATERA UTARA/
RSUP H. ADAM MALIK MEDAN
2013
EKSPRESI PEROKSISOME PROLIFERATOR ACTIVATOR RESEPTOR GAMMA
(PPARγ) PADA PENDERITA KARSINOMA NASOFARING
DI RSUP H. ADAM MALIK.
TESIS
Diajukan untuk Melengkapi Tugas dan Memenuhi Salah Satu Syarat untuk Mencapai Gelar Magister dalam Bidang Ilmu Kesehatan
Telinga Hidung Tenggorok Bedah Kepala Leher
Oleh : FLORA ARMANTI
PROGRAM MAGISTER KEDOKTERAN KLINIK
ILMU KESEHATAN TELINGA HIDUNG TENGGOROK BEDAH KEPALA DAN LEHER FAKULTAS KEDOKTERAN UNIVERSITAS SUMATERA UTARA/
RSUP H. ADAM MALIK MEDAN
2013
KATA PENGANTAR
Salam sejahtera, saya sampaikan puji syukur kepada Tuhan Yang
Maha Kuasa atas kasih setia, penyertaan dan karuniaNya saya dapat
menyelesaikan tesis ini sebagai salah satu syarat dalam menyelesaikan
pendidikan untuk memperoleh gelar Magister dalam bidang Ilmu
Kesehatan Telinga Hidung Tenggorok dan Bedah Kepala Leher di
Fakultas Kedokteran Universitas Sumatera Utara Medan. Saya
menyadari penulisan tesis ini masih jauh dari sempurna, baik isi maupun
bahasanya. Walaupun demikian, mudah-mudahan tulisan ini dapat
menambah perbendaharaan penelitian tentang Ekspresi Peroksisome Proliferator Activator Reseptor Gamma (PPARγ) pada Penderita Karsinoma Nasofaring di RSUP H. Adam Malik.
Dengan telah selesainya tulisan ini, pada kesempatan ini dengan
tulus hati saya mengucapkan terima kasih yang tak terhingga dan
penghargaan setinggi-tingginya kepada yang terhormat :
dr. Farhat, M. Ked (ORL-HNS), Sp. THT-KL (K) atas kesediaannya
sebagai ketua pembimbing penelitian ini, dr. Ida Sjailandrawati,
SpTHT-KL sebagai anggota pembimbing serta dr. Putri Ch. Eyanoer, MSEpid,
Ph.D sebagai pembimbing ahli. Di tengah kesibukan beliau, dengan
penuh perhatian dan kesabaran, telah banyak memberi bantuan,
bimbingan, saran dan pengarahan yang sangat bermanfaat kepada saya
dalam menyelesaikan tulisan ini.
Dengan telah berakhirnya masa pendidikan saya, pada
kesempatan yang berbahagia ini perkenankanlah saya menyampaikan
penghargaan dan terima kasih yang sebesar-besarnya kepada :
Yang terhormat Rektor Universitas Sumatera Utara, Bapak Prof.
dr. Syahril Pasaribu, Sp.A(K), DTM&H yang telah memberikan
kesempatan kepada penulis untuk mengikuti Program Magister
Kedokteran Klinik di Departemen THT-KL Fakultas Kedokteran
Universitas Sumatera Utara.
Yang terhormat Dekan Fakultas Kedokteran Universitas Sumatera
Utara Prof. dr. Gontar Alamsyah Siregar, Sp.PD(KGEH), atas
kesempatan yang diberikan kepada saya untuk mengikuti Program
Magister Kedokteran Klinik di Fakultas Kedokteran Universitas Sumatera
Utara.
Yang terhormat Bapak Direktur RSUP H. Adam Malik Medan, yang
telah mengizinkan peneliti untuk melakukan penelitian di rumah sakit
yang beliau pimpin dan telah memberikan kesempatan pada saya untuk
menjalani masa pendidikan di rumah sakit yang beliau pimpin.
Yang terhormat Ketua Departemen Ilmu Kesehatan Telinga Hidung
Tenggorok dan Bedah Kepala Leher Fakultas Kedokteran USU Prof. Dr.
dr. Abdul Rachman Saragih, Sp.THT-KL(K) dan Ketua Program Studi
Ilmu Kesehatan THT-KL Fakultas Kedokteran USU, dr T. Siti Hajar
Haryuna Sp.THT-KL, yang telah memberikan izin, kesempatan dan ilmu
kepada saya dalam mengikuti Program Magister Kedokteran Klinik
sampai selesai.
Yang terhormat supervisor di jajaran Departemen THT-KL Fakultas
Kedokteran USU/RSUP H. Adam Malik Medan, Prof. dr. Ramsi Lutan,
Sp.THT-KL(K), dr. Yuritna Haryono, Sp.THT-KL(K), Prof. dr. Askaroellah
Aboet, KL(K), Prof. Dr. dr. Abdul Rachman Saragih,
Sp.THT-KL(K), dr. Muzakkir Zamzam, SpTHT-Sp.THT-KL(K), dr. Mangain Hasibuan,
SpTHT-KL, dr. T.Sofia Hanum, Sp.THT-KL(K), Prof. Dr. dr. Delfitri Munir,
SpTHT-KL(K), dr. Linda I. Adenin, Sp.THT-KL, almh dr.
Hafni,Sp.THT-KL(K), dr. Ida Sjailandrawati Harahap, SpTHT-KL, dr. Adlin Adnan,
KL, dr. Rizalina A. Asnir, KL(K), dr. Siti Nursiah,
Sp.THT-KL, dr. Andrina Y.M. Rambe, Sp.THT-Sp.THT-KL, dr. Harry Agustaf Asroel, M.
Ked (ORL-HNS), KL, dr. Farhat, M. Ked (ORL-HNS),
Sp.THT-KL(K), dr. T. Siti Hajar Haryuna, Sp.THT-KL, dr. Aliandri, Sp.THT-KL, dr.
Asri Yudhistira, M. Ked (ORL-HNS), Sp.THT-KL, dr. Devira Zahara, M.
Ked HNS), Sp.THT-KL, dr. H.R. Yusa Herwanto, M. Ked
(ORL-HNS), Sp.THT-KL, dr. M. Pahala Hanafi Harahap, Sp.THT-KL dan dr.
Ferryan Sofyan, M.Kes, Sp.THT-KL. Terima kasih atas segala ilmu,
keterampilan dan bimbingannya selama ini.
Yang tercinta teman-teman sejawat PPDS Ilmu Kesehatan THT-KL
Fakultas Kedokteran USU, atas bantuan, nasehat, saran maupun
kerjasamanya selama masa pendidikan.
Yang mulia dan tercinta Ayahanda Drs. Asman R Karo-Karo, MM
dan Ibunda R. br Sembiring, ananda sampaikan rasa hormat dan terima
kasih yang tak terhingga serta penghargaan yang setinggi-tingginya atas
kasih sayang yang telah diberikan dan dilimpahkan kepada ananda sejak
dalam kandungan, dilahirkan, dibesarkan dan diberi pendidikan yang baik
serta diberikan suri tauladan yang baik hingga menjadi landasan yang
kokoh dalam menghadapi kehidupan ini, dengan memanjatkan doa
kepada Tuhan agar dengan umur panjang, kesehatan dan kesejahteraan
Engkau memberkati kedua orang tua kami.
Yang tercinta Ayah mertua Ir.Terang M Sebayang dan Ibu mertua
I br Bangun. Ayah dan Ibu mertua yang selama ini telah memberikan
dorongan dan restu untuk selalu menuntut ilmu setinggi-tingginya.
Kepada suamiku tercinta Roy Alexander Sebayang, ST serta buah
hati kami yang amat kusayang Primakasa Arlexta Sebayang, tiada kata
yang lebih indah yang dapat ibunda ucapkan selain ucapan terima kasih
yang setulus-tulusnya atas pengorbanan tiada tara, cinta dan kasih
sayang, kesabaran, ketabahan, pengertian dan dorongan semangat yang
tiada henti-hentinya dan doa kepada ibunda sehingga dengan penyertaan
Tuhan akhirnya kita sampai pada saat yang berbahagia ini.
Kepada adinda, dr. Fadli Armanto karo, dr. Fitri Armanti
karo-karo dan Ferni armanti karo-karo-karo-karo serta kakak dan adik ipar, penulis
mengucapkan terima kasih atas limpahan kasih sayang dan tak
henti-hentinya memberikan dorongan serta doa kepada penulis.
Kepada seluruh kerabat dan handai taulan yang tidak dapat kami
sebutkan satu persatu, yang telah memberikan bantuan kami ucapkan
terima kasih yang sebesar-besarnya.
Akhirnya izinkanlah saya mohon maaf yang setulus-tulusnya atas
segala kesalahan dan kekurangan saya selama mengikuti pendidikan ini,
semoga segala bantuan, dorongan, petunjuk yang diberikan kepada saya
selama mengikuti pendidikan kiranya mendapat balasan yang berlipat
ganda dari Tuhan, Yang Maha Pemurah, Maha Pengasih dan Maha
Penyayang. Amin.
Medan, Oktober 2013
Penulis
Flora Armanti
EKSPRESI PEROKSISOME PROLIFERATOR ACTIVATOR RESEPTORGAMMA (PPARγ) PADA PENDERITA KARSINOMA
NASOFARING DI RSUP H. ADAM MALIK ABSTRAK
Pendahuluan : Karsinoma nasofaring (KNF) merupakan tumor ganas yang umumnya diketahui pada keadaan stadium lanjut. Hal ini disebabkan karena gejala dini yang tidak khas dan juga letaknya yang tersembunyi sehingga penderita sering tidak memperhatikannya. Berdasarkan profil kesehatan 2007 oleh Departemen Kesehatan, KNF termasuk 10 jenis kanker terbanyak di Indonesia pada tahun 2004-2006 dan terus mengalami peningkatan jumlah penderita selama periode tersebut. (PPARγ) merupakan anggota dari family nuklear reseptor dengan beragam fungsi biologis yang mencakup mediasi diferensiasi adiposit, pengaturan aktivitas monosit, makrofag, anti-inflamasi dan penghambatan proliferasi sel tumor. Data lain menunjukkan bahwa PPARγ bisa berperan sebagai gen supressor tumor
Tujuan : Untuk mengetahui ekspresi PPARγ pada penderita karsinoma nasofaring di RSUP H. Adam Malik.
Metode : Penelitian ini bersifat deskriptif dengan pendekatan secara
cross sectional. Penelitian dilakukan di RSUP. H. Adam Malik Medan dan Departemen Patologi Anatomi Fakultas Kedokteran USU. Penelitian dilakukan mulai bulan Juni 2012 sampai Desember 2012.
Hasil Penelitian : Sebanyak 30 sampel KNF diperiksa ekspresi PPARγ dengan immunohistokimia. Penderita KNF paling banyak ditemukan pada laki-laki (70,0%), kelompok umur 41-60 tahun (63,3%) dan tipe non keratinizing squamous cell carcinoma (53,3%). Dengan menggunakan
Fisher’s exact test ditemukan hubungan yang signifikan antara kelenjar getah bening dan ekspresi PPARγ (p=0,031) juga ditemukan hubungan yang signifikan antara stadium dan ekspresi PPARγ (p= 0,028). Namun tidak ditemukan adanya hubungan antara ukuran tumor primer dan ekspresi PPARγ (p=0,160).
Kesimpulan: PPAR adalah nuklear reseptor yang paling sering berhubungan dengan kanker karsinoma sel skuamous kepala dan leher. Overekspresi PPARγ terlihat pada kanker skuamous sel karsinoma kepala dan leher. Tidak menemukan hubungan signifikan antara ekspresi PPARγ pada frekuensi tumor primer (T) dan tipe histopatologi karsinoma nasofaring. Ditemukan hubungan signifikan antara ekspresi PPARγ dengan kelompok stadium klinis karsinoma nasofaring p=0,028. Ditemukan hubungan ekspresi PPARγ dengan ukuran kelenjar getah bening dari karsinoma nasofaring p=0,031.
Kata Kunci : Karsinoma Nasofaring, PPARγ, Ekspresi, RSUP H. Adam Malik.
PEROXISOME PROLIFERATOR-ACTIVATED RECEPTOR GAMMA
ADAM MALIK GENERAL HOSPITAL
(PPARγ) EXPRESSIONS IN NASOPHARYNGEAL CARCINOMA PATIENTS AT
ABSTRACT
Introduction : Nasopharyngeal carcinoma (NPC) is a malignant tumor commonly detected in advanced stages due to the untypical early symptoms and its hidden site often remains unnoticed. According to the Health Profile 2007, Department of Health, NPC is one of the 10 most common cancers in indonesia from 2004 to 2006 and the number of patients continuously increase during that period. PPARγ is a member of the nuclear receptor family with diverse biological functions that include adipocytes differentiation, monocytes and macrophages regulation, anti-inflammatory and inhibition of tumor cell proliferation. Other data suggest that PPARγ may act as a tumor suppressor gene.
Objective : To find out the PPARγ expressions in nasopharyngeal carcinoma patients at Adam Malik General Hospital
Method : Descriptive study with cross sectional approach. The study was conducted at Adam Malik General Hospital and Department of Anatomic Pathology, Faculty of Medicine, Universitas Sumatera Utara, from June 2012 until December 2012.
Results : PPARγ expressions of 30 NPC samples examined by Immunohistochemistry method. NPC patients most commonly found in men (70.0%), 41-60 years age group (63.3%) and non-keratinizing squamous cell carcinoma type (53.3%). Fisher's exact test found a significant association between lymph nodes and PPARγ expression (p = 0.031) and also a significant relationship between the stage and the expression of PPARγ (p = 0.028), yet no relationship found between the size of the primary tumor and the expression of PPARγ (p = 0.160).
Conclusions: PPAR nuclear receptors are most frequently associated with cancer squamous cell carcinoma of the head and neck. PPARγ overexpression seen in cancer is squamous cell carcinoma of the head and neck. Found no significant relationship between the expression of PPARγ in the frequency of the primary tumor (T) and histopathological types of nasopharyngeal carcinoma. Found a significant relationship between the expression of PPARγ with clinical stage nasopharyngeal
carcinoma group p = 0.028. PPARγ expression was found relationship with the size of lymph nodes from nasopharyngeal carcinoma p = 0.031.
Keywords : nasopharyngeal carcinoma, PPARγ, expression, Adam Malik General Hospital
DAFTAR ISI
Bab 2. Tinjauan Pustaka 2.1. Karsinoma Nasofaring 4
2.2. Peroxisome Proliferator Activated Receptor (PPAR) 11
2.3. Peroksisome Proliferator Activator Reseptor Gamma (PPARγ) 13
2.4. Peran PPARγ Pada Kanker 16
2.5. Kerangka Konsep 18
Bab 4. Hasil Penelitian
4.1. Distribusi Frekuensi Umur Berdasarkan Karsinoma
Nasofaring 27
4.2. Distribusi Frekuensi Jenis Kelamin Berdasarkan Karsinoma
Nasofaring 28
4.3. Distribusi Frekuensi Tipe Histopatologi Berdasarkan
Karsinoma Nasofaring 28
4.4. Distribusi Frekuensi Tipe Histopatologi Karsinoma Nasofaring
Berdasarkan Ekspresi PPARγ 29
4.5. Distribusi Frekuensi Tumor Primer (T) Karsinoma Nasofaring
Berdasarkan Ekspresi PPARγ 30
4.6. Distribusi Frekuensi Metastasis Kelenjar Getah Bening (N)
Karsinoma Nasofaring Berdasarkan PPARγ 31
4.7. Distribusi Frekuensi Stadium Klinis Karsinoma Nasofaring
Berdasarkan Ekspresi PPARγ 32
Bab 5. Pembahasan
5.1. Distribusi frekuensi karsinoma nasofaring berdasarkan
Umur 33
5.2. Distribusi Frekuensi Karsinoma Nasofaring Berdasarkan
Jenis Kelamin 34
5.3. Distribusi Frekuensi Karsinoma Nasofaring Berdasarkan
Tipe Histopatologi 35
5.4. Distribusi Frekuensi Tipe Histopatologi Karsinoma Nasofaring
Berdasarkan Ekspresi PPARγ 36
5.5. Distribusi Frekuensi Ukuran Tumor Primer (T) Karsinoma
Nasofaring Berdasarkan Ekspresi PPARγ 36
5.6. Distribusi Frekuensi Ukuran Kelenjar Getah Bening (N)
Karsinoma Nasofaring Berdasarkan PPARγ 37
5.7. Distribusi Frekuensi Stadium Klinis Karsinoma Nasofaring
Berdasarkan Ekspresi PPARγ 38
Bab 6. Kesimpulan dan saran
6.1. Kesimpulan 40
6.2. Saran 41
Daftar Pustaka 42
PERSONALIA PENELITIAN 46
LAMPIRAN 48
DAFTAR TABEL
Tabel 4.1. Distribusi Frekuensi Umur Berdasarkan Karsinoma
Nasofaring
Tabel 4.2. Distribusi Frekuensi Jenis Kelamin Berdasarkan Karsinoma
Nasofaring
Tabel 4.3. Distribusi Frekuensi Tipe Histopatologi Berdasarkan
Karsinoma Nasofaring
Tabel 4.4. Distribusi Frekuensi Tipe Histopatologi Karsinoma Nasofaring
Berdasarkan Ekspresi PPARγ
Tabel 4.5. Distribusi Frekuensi Tumor Primer (T) Karsinoma
Nasofaring Berdasarkan Ekspresi PPARγ
Tabel 4.6. Distribusi Frekuensi Metastasis Kelenjar Getah Bening (N)
Karsinoma Nasofaring Berdasarkan PPARγ
Tabel 4.7. Distribusi Frekuensi Stadium Klinis Karsinoma Nasofaring
Berdasarkan Ekspresi PPARγ
DAFTAR GAMBAR
Gambar 2.1. Anatomi nasofaring
Gambar 2.2. Histopatologi karsinoma nasofaring
Gambar 2.3. Skema pengobatan KNF berdasarkan NCCN 2010
Gambar 2.4. Skema Represantasi dari Domain Struktural PPAR
Gambar 2.5. Mekanisme Transkipsi Gen dari PPARγ
Gambar 2.6. Mekanisme kerja ligan pada Nuklear Reseptor
EKSPRESI PEROKSISOME PROLIFERATOR ACTIVATOR RESEPTORGAMMA (PPARγ) PADA PENDERITA KARSINOMA
NASOFARING DI RSUP H. ADAM MALIK ABSTRAK
Pendahuluan : Karsinoma nasofaring (KNF) merupakan tumor ganas yang umumnya diketahui pada keadaan stadium lanjut. Hal ini disebabkan karena gejala dini yang tidak khas dan juga letaknya yang tersembunyi sehingga penderita sering tidak memperhatikannya. Berdasarkan profil kesehatan 2007 oleh Departemen Kesehatan, KNF termasuk 10 jenis kanker terbanyak di Indonesia pada tahun 2004-2006 dan terus mengalami peningkatan jumlah penderita selama periode tersebut. (PPARγ) merupakan anggota dari family nuklear reseptor dengan beragam fungsi biologis yang mencakup mediasi diferensiasi adiposit, pengaturan aktivitas monosit, makrofag, anti-inflamasi dan penghambatan proliferasi sel tumor. Data lain menunjukkan bahwa PPARγ bisa berperan sebagai gen supressor tumor
Tujuan : Untuk mengetahui ekspresi PPARγ pada penderita karsinoma nasofaring di RSUP H. Adam Malik.
Metode : Penelitian ini bersifat deskriptif dengan pendekatan secara
cross sectional. Penelitian dilakukan di RSUP. H. Adam Malik Medan dan Departemen Patologi Anatomi Fakultas Kedokteran USU. Penelitian dilakukan mulai bulan Juni 2012 sampai Desember 2012.
Hasil Penelitian : Sebanyak 30 sampel KNF diperiksa ekspresi PPARγ dengan immunohistokimia. Penderita KNF paling banyak ditemukan pada laki-laki (70,0%), kelompok umur 41-60 tahun (63,3%) dan tipe non keratinizing squamous cell carcinoma (53,3%). Dengan menggunakan
Fisher’s exact test ditemukan hubungan yang signifikan antara kelenjar getah bening dan ekspresi PPARγ (p=0,031) juga ditemukan hubungan yang signifikan antara stadium dan ekspresi PPARγ (p= 0,028). Namun tidak ditemukan adanya hubungan antara ukuran tumor primer dan ekspresi PPARγ (p=0,160).
Kesimpulan: PPAR adalah nuklear reseptor yang paling sering berhubungan dengan kanker karsinoma sel skuamous kepala dan leher. Overekspresi PPARγ terlihat pada kanker skuamous sel karsinoma kepala dan leher. Tidak menemukan hubungan signifikan antara ekspresi PPARγ pada frekuensi tumor primer (T) dan tipe histopatologi karsinoma nasofaring. Ditemukan hubungan signifikan antara ekspresi PPARγ dengan kelompok stadium klinis karsinoma nasofaring p=0,028. Ditemukan hubungan ekspresi PPARγ dengan ukuran kelenjar getah bening dari karsinoma nasofaring p=0,031.
Kata Kunci : Karsinoma Nasofaring, PPARγ, Ekspresi, RSUP H. Adam Malik.
PEROXISOME PROLIFERATOR-ACTIVATED RECEPTOR GAMMA
ADAM MALIK GENERAL HOSPITAL
(PPARγ) EXPRESSIONS IN NASOPHARYNGEAL CARCINOMA PATIENTS AT
ABSTRACT
Introduction : Nasopharyngeal carcinoma (NPC) is a malignant tumor commonly detected in advanced stages due to the untypical early symptoms and its hidden site often remains unnoticed. According to the Health Profile 2007, Department of Health, NPC is one of the 10 most common cancers in indonesia from 2004 to 2006 and the number of patients continuously increase during that period. PPARγ is a member of the nuclear receptor family with diverse biological functions that include adipocytes differentiation, monocytes and macrophages regulation, anti-inflammatory and inhibition of tumor cell proliferation. Other data suggest that PPARγ may act as a tumor suppressor gene.
Objective : To find out the PPARγ expressions in nasopharyngeal carcinoma patients at Adam Malik General Hospital
Method : Descriptive study with cross sectional approach. The study was conducted at Adam Malik General Hospital and Department of Anatomic Pathology, Faculty of Medicine, Universitas Sumatera Utara, from June 2012 until December 2012.
Results : PPARγ expressions of 30 NPC samples examined by Immunohistochemistry method. NPC patients most commonly found in men (70.0%), 41-60 years age group (63.3%) and non-keratinizing squamous cell carcinoma type (53.3%). Fisher's exact test found a significant association between lymph nodes and PPARγ expression (p = 0.031) and also a significant relationship between the stage and the expression of PPARγ (p = 0.028), yet no relationship found between the size of the primary tumor and the expression of PPARγ (p = 0.160).
Conclusions: PPAR nuclear receptors are most frequently associated with cancer squamous cell carcinoma of the head and neck. PPARγ overexpression seen in cancer is squamous cell carcinoma of the head and neck. Found no significant relationship between the expression of PPARγ in the frequency of the primary tumor (T) and histopathological types of nasopharyngeal carcinoma. Found a significant relationship between the expression of PPARγ with clinical stage nasopharyngeal
BAB 1
PENDAHULUAN
1.1. Latar Belakang
Karsinoma nasofaring (KNF) merupakan tumor ganas yang
umumnya diketahui pada keadaan stadium lanjut. Hal ini
disebabkan karena gejala dini yang tidak khas dan juga letaknya
yang tersembunyi sehingga penderita sering tidak
memperhatikannya. Diagnosis dini dari penyakit ini sangat
menentukan prognosis penderita (Farhat, 2009).
Populasi karsinoma nasofaring pada umumnya dijumpai di
Cina Selatan, Asia Tenggara, Kutub Utara, Timur Tengah dan di
bagian Afrika namun jarang dilaporkan di negara-negara bagian
Barat dan Jepang (Hsien et al, 2009). Prevalensi tertinggi dari
karsinoma nasofaring terdapat di Cina Selatan dengan angka
kejadian rata-rata 15-50 per 100.000 (X Xu et al, 2009). KNF
merupakan tumor ganas kepala dan leher yang terbanyak di
Indonesia, yaitu sekitar 60% dan menduduki urutan ke-4 dari
seluruh keganasan setelah tumor ganas mulut rahim, payudara,
getah bening dan kulit (Fachiroh et al, 2004).
Diagnosis KNF dapat ditegakkan melalui anamnese,
pemeriksaan klinis dan pemeriksaan penunjang. Pemeriksaan
penunjang terdiri dari endoskopi, biopsi, CT Scan dan
pemeriksaan imunohistokimia (Brennan, 2005). Salah satu
pemeriksaan imunohistokimia adalah pemeriksaan Nuklear
Reseptor (NR). Peroxisome Proliferator Activated Receptor
(PPAR) adalah nuklear reseptor yang paling sering berhubungan
dengan kanker karsinoma sel skuamous kepala dan leher. Saat ini
diketahui ada tiga isoform PPAR yang telah diidentifikasikan yaitu
Peroxisome Proliferator Activated Receptor alfa (PPARα),
Peroxisome Proliferator Activated Receptor gamma (PPARγ) (Li Yi
Ming et al, 2003).
Beberapa Nuklear Reseptor (NR) termasuk di dalamnya
PPAR berkaitan dengan kanker kepala dan leher. Dalam uji klinis
tampak gambaran nuklear resptor berfungsi dalam menerangkan
suatu prognostik dan terapi pada kanker. Target utama pada
Nuklear Reseptor (NR) berpotensi dalam pengembangan
antikanker. (Andrea Schweitzer et al, 2009).
Pada kanker skuamous sel karsinoma kepala dan leher juga terlihat adanya overekspresi pada PPARγ (Shirley, 2009).
Di bidang gastroenterology banyak dijumpai overekspresi PPARγ terutama pada kanker colon. Hal ini menyebabkan banyak peneliti yang memfokuskan diri pada permasalahan tersebut
sehingga menyebabkan sampai sekarang masih sesuatu hal yang
kontroversial (Li yi Ming et al, 2003).
Sampai saat ini di RSUP H. Adam Malik Medan belum ada
data mengenai ekspresi PPARγ pada karsinoma nasofaring,
sehingga peneliti tertarik untuk melakukan penelitian ini.
1.2. Permasalahan
Berdasarkan latar belakang yang telah dikemukakan di atas,
dapat dirumuskan suatu masalah penelitian yaitu bagaimana ekspresi PPARγ pada penderita karsinoma nasofaring di RSUP H. Adam Malik Medan.
1.3. Tujuan Penelitian
1.3.1. Tujuan Umum
1.3.2. Tujuan Khusus
a. Mengetahui distribusi frekuensi karsinoma nasofaring
berdasarkan umur.
b. Mengetahui distribusi frekuensi karsinoma nasofaring
berdasarkan jenis kelamin.
c. Mengetahui distribusi frekuensi karsinoma nasofaring
berdasarkan tipe histopatologi.
d. Mengetahui distribusi frekuensi ekspresi PPARγ berdasarkan
tipe histopatologi karsinoma nasofaring.
e. Mengetahui distribusi frekuensi ekspresi PPARγ berdasarkan
tumor primer (T) karsinoma nasofaring.
f. Mengetahui distribusi frekuensi ekspresi PPARγ berdasarkan
metastasis kelenjar getah bening (N) karsinoma nasofaring.
g. Mengetahui distribusi frekuensi ekspresi PPARγ berdasarkan
stadium klinis karsinoma nasofaring.
1.4. Manfaat Penelitian
Penelitian ini bermanfaat antara lain :
a. Memberikan informasi mengenai ekspresi PPARγ pada
karsinoma nasofaring di RSUP. H. Adam Malik Medan.
b. Sebagai rujukan penelitian berikutnya yang berkaitan dengan PPARγ pada karsinoma nasofaring.
c. Sebagai dasar penelitian selanjutnya dalam usaha
pengembangan terapi terhadap karsinoma nasofaring dalam
BAB 2
TINJAUAN PUSTAKA
2.1. Karsinoma Nasofaring
Nasofaring merupakan bagian faring yang terletak paling atas oleh
karena itu disebut juga dengan epifaring. Nasofaring secara anatomis
terletak di bagian belakang dari rongga hidung dan mempunyai batas
mulai dari dasar tengkorak sampai ke palatum mole. Atap nasofaring
dibentuk oleh basis sphenoid dan basis oksipital, dinding posterior di
bentuk oleh vertebra, dasar nasofaring di bentuk oleh palatum mole,
dinding depan di bentuk oleh koana, serta dinding lateral dimana
ditemukan muara tuba eustachius (Dhingra, 2007).
Gambar 2.1. Anatomi Nasofaring (Shirley, 2009)
Karsinoma nasofaring (KNF) adalah karsinoma sel skuamous
yang tumbuh dari epitel nasofaring. Karsinoma nasofaring ini dapat
tumbuh pada berbagai sisi nasofaring namun lebih sering terlihat pada
fossa Rosenmuller (Hsien et al, 2009). Faktor resiko untuk terjadinya KNF
adalah infeksi Epstein Barr Virus (EBV), selain daripada itu ikan asin,
asupan alkohol, merokok dan makanan cepat saji, terutama pada masa
anak-anak, juga menunjukkan hubungan dengan tingginya rata-rata
kejadian KNF (Randall, 2009).
Nasofaring merupakan daerah yang sulit untuk diperiksa oleh
dokter umum sehingga karsinoma nasofaring sering terlambat untuk di
diagnosis jika dibandingkan dengan keganasan lainnya pada kepala dan
leher. Oleh karena itu karsinoma nasofaring cenderung ditemukan pada
stadium lanjut (Randall, 2009).
Insiden KNF tetap tinggi di antara orang-orang Cina yang
berimigrasi ke negara-negara Asia dibandingkan dengan orang Cina yang
bermigrasi ke negara-negara Barat. Dilaporkan orang-orang Cina di Los
Angeles 6,5 kasus per 100.000 laki-laki dan 3,7 kasus per 100.000
perempuan, dibandingkan pada orang Cina yang bermigrasi ke Singapura
18,1 kasus per 100.000 laki-laki dan 7,4 kasus per 100.000 perempuan.
Insident KNF ada juga dilaporkan orang kaukasia di Hawai terdapat 0,7
per 100.000 laki-laki dan 0,9 per 100.000 perempuan, disisi lain orang
Cina yang tinggal di Hawai terdapat 8,9 kasus dari 100.000 laki-laki dan
3,7 kasus per 100.000 perempuan. Hal ini menunjukkan bahwa faktor
genetik, etnis dan lingkungan mungkin memainkan peranan dalam
etiologi penyakit (Hsien et al, 2009).
Dilaporkan insiden KNF di United Kingdom 0,25 per 100.000 usia
0-14 tahun, 0,1 per 100.000 usia 0-9 tahun dan 0,8 per 100.000 usia
10-14 tahun. Insiden KNF di Inggris 1-2 per 100.000 usia 15-19 tahun
(Brennan, 2005)
Di RSUP H. Adam Malik Medan pada tahun 1998-2002 ditemukan
130 penderita KNF dari 1370 pasien baru onkologi kepala dan leher
(Lutan, 2003) .
Klasifikasi histologi KNF yang diajukan oleh World Health
Organization (WHO) mengklasifikasikan tumor menjadi 3 kelompok, yaitu
(Fachiroh et al, 2004; Randall, 2009; William, 2006):
Tipe 1 : Karsinoma sel skuamosa berkeratinisasi (keratinizing
squamous cell carcinoma)
Tipe 2 : Karsinoma sel skuamosa tidak berkeratinisasi (non keratinizing
squamous cell carcinoma)
Tipe 3 : Karsinoma tidak berdiferensiasi (undifferentiated carcinoma)
Squamous cell carcinoma KNF
Undifferentiated carcinoma KNF
Gambar 2.2. Histopatologi karsinoma nasofaring
Untuk jenis KNF yang non keratinizing yaitu WHO tipe 2 dan 3
bersifat radiosensitif sehingga radioterapi menjadi pengobatan utama.
Pada tumor stadium lanjut terdapat angka yang tinggi pada metastase
regional dan jauh yang akan membutuhkan kombinasi radioterapi dengan
kemoterapi. Kemoterapi dapat meningkatkan efek radioterapi melalui
pemberian bahan radiosensitif pada jaringan tumor dan dapat
menurunkan mikrometastase sistemik (Randall, 2009).
Klasifikasi TNM menurut AJCC 2010:
Tumor Primer (T)
Tx Tumor primer tidak dapat dinilai
T0 Tidak terbukti adanya tumor primer
Tis Karsinoma in situ
T1 Tumor terbatas di nasofaring atau tumor meluas ke
orofaring dan/kavum nasi tanpa perluasan ke parafaring.
T2 Tumor dengan perluasan ke daerah parafaring.
T3 Tumor melibatkan struktur tulang dasar tengkorak dan/atau
T4 Tumor dengan perluasan intrakranial dan/atau terlibatnya
syaraf kranial, hipofaring, orbita atau dengan perluasan ke
fossa infratemporal/ruang mastikator.
KGB Regional (N)
Nx KGB regional tidak dapat dinilai
N0 Tidak ada metastase ke KGB regional
N1 Metastase kelenjar getah bening leher unilateral dengan
diameter terbesar 6 cm atau kurang, di atas fossa
supraklavikular, dan/atau unilateral atau bilateral kelenjar
getah bening retrofaring dengan diameter terbesar 6 cm
atau kurang.
N2 Metastase kelenjar getah bening bilateral dengan diameter
terbesar 6 cm atau kurang, di atas fossa supraklavikular.
N3 Metastase pada kelenjar getah bening diatas 6 cm dan/atau
pada fossa supraklavicular:
N3a Diameter terbesar lebih dari 6 cm
N3b Meluas ke fossa supraklavikular
Metastase Jauh (M)
M0 Tanpa metastase jauh
M1 Metastase jauh
Kelompok stadium :
IVA T4 N0 M0
T4 N1 M0
T4 N2 M0
IVB setiap T N3 M0
IVC setiap T setiap N M1
Penatalaksanaan
1. Radioterapi
Radioterapi telah menjadi modalitas terapi primer untuk KNF
selama bertahun-tahun. Ini disebabkan karena nasofaring berdekatan
dengan struktur penting dan sifat infiltrasi KNF, sehingga pembedahan
terhadap tumor primer sulit dilakukan. KNF umumnya tidak dapat
dioperasi, lebih responsif terhadap radioterapi dan kemoterapi
dibandingkan tumor ganas kepala leher lainnya (Guigay et al. 2006; Wei,
2006).
Pemberian radioterapi telah berhasil mengontrol tumor T1 dan T2
pada 75-90% kasus dan tumor T3 dan T4 pada 50-75% kasus. Kontrol
kelenjar leher mencapai 90% pada pasien dengan N0 dan N1, tapi tingkat
kontrol regional berkurang menjadi 70% pada kasus N2 dan N3 (Wei,
2006).
2. Kemoterapi
Kemoterapi sebagai komponen terapi kuratif utama pada KNF
pertama kali dipergunakan pada tahun 1970-an. Indikasi pemberian
kemoterapi adalah untuk KNF dengan penyebaran ke kelenjar getah
bening leher, metastase jauh, dan kasus-kasus residif (Mould & Tai,
2002; Zakifman & Harryanto, 2002). Penelitian inter grup 1997 pertama
kali menunjukkan bahwa pengunaan kemoterapi bersamaan dengan
radioterapi meningkatkan overall survival apabila dibandingkan dengan
radiosensitisizer dan membantu dalam mengurangi metastase jauh
(Mould & Tai, 2002; Wei, 2006).
3. Pembedahan
Pembedahan hanya sedikit berperan dalam penatalaksanaan KNF.
Terbatas pada diseksi leher radikal untuk mengontrol kelenjar yang
radioresisten dan metastase leher setelah radiasi dan pada pasien
tertentu, pembedahan penyelamatan (salvage treatment) dilakukan pada
kasus rekurensi di nasofaring atau kelenjar leher tanpa metastase jauh
(Chew, 1997; Wei, 2003; Wei, 2006; Lutzky et al. 2008).
National Comprehensive Cancer Network (2010) mempublikasikan
suatu petunjuk praktis klinis penanganan KNF sebagai berikut :
2.2. Peroxisome Proliferator Activated Receptor (PPAR)
Peroxisome Proliferator Activated Receptor (PPAR) pertama kali
dikloning dari hati tikus pada tahun 1990 sebagai nuclear reseptor dan
berpengaruh pada banyak senyawa sintesis yang disebut peroxisome
proliferator (PP). Pengaruh dari peroxisome proliferator ini baik dalam
ukuran dan jumlahnya dapat melakukan berbagai fungsi metabolisme
seperti derived respirasi peroksida, beta oksidasi asam lemak dan
metabolisme kolesterol dalam sel. Beberapa penelitian juga menyatakan
bahwa PPAR dapat menekan pertumbuhan kanker pada manusia baik
secara apoptosis dan induksi diferensiasi. PPAR adalah faktor transkripsi
yang diaktifkan oleh ikatan spesifik dan juga mempunyai peranan penting
dalam sinyal sel (Jiri et al, 2002).
Terdapat 3 (tiga) subtipe dari family hormon nuklear reseptor ini
yang dikenal, yakni PPAR-α, PPAR-β dan PPAR-γ yang ketiganya
menunjukkan pola ekspresi jaringan yang spesifik berdasarkan pola
fungsi biologis serta memiliki fitur struktural dan fungsional yang mirip. PPAR α banyak terdapat dalam sel hepatosit primer sebagai pengatur ekspresi protein yang terlibat dalam metabolisme asam lemak. PPAR β
adalah salah satu subtype yang paling luas penyebarannya dan sering
diekspresikan pada kadar yang tinggi (Li Yi Ming et al, 2003). PPAR γ paling dominan terdapat di jaringan lemak dimana PPARγ ini memainkan peranan penting dalam mengatur differensiasi sel lemak (Li Yi Ming et al,
2003; Tracey, 2003). Kemampuan PPARγ untuk mengatur differensiasi,
proliferasi, apoptosis sel yang menginspirasi beberapa peneliti untuk mengetahui penggunaan agonis PPARγ sebagai bahan atau obat kemoterapi. PPARγ ekspresinya tinggi pada liposarkoma dan beberapa
variasi tumor lainnya termasuk payudara, paru, kolon serta kanker kepala
Tabel 1: Klasifikasi superfamily Nuklear Reseptor (NR) dalam subfamily
Peroxisome proliferator-activated Peroxisome Proliferator-reseptor
Activated
Reseptor α,β,√,γ Receptor (PPAR)
Retinoic Acid Receptors Retinoic Acid Receptor ( RAR ) α,β,γ Retinoid acid receptor-related Retinoid acid receptor-related orphan receptor orphan receptors (ROR) α,β,γ Subfamily 2 Retinoid X receptor-like receptors
Hepatocyte nuclear factor - 4 Hepatocyte nuclear factor-4 (HNF-4) α,γ Retinoid X receptors Retinoid X receptor (RXR) α,β,γ
Subgroups Testicular receptors Testicular receptor 2,4 (TR2/4) Tailless-like receptors Human homologue of the
Drosophila tailless Gene (TLX); Photoreceptor cell-spesific nuclear Receptor (PNR)
Chicken ovalbumin upstream Chicken ovalbumin upstream Promoter-transcription factor-like Promoter-transcription factor
Reseptor (COUP-TF) I, II; V-erbA-related (EAR2) Subfamily 3 Estrogen receptor-like receptors
Estrogen receptors Estrogen receptor (ER) α,β
Subgroups Estrogen related receptors Estrogen-related receptor (ERR) α,β,γ 3-Ketosteroid receptors Androgen receptor (AR);
Progesterone Receptor (PR); Glucocorticoid receptor (GR); Mineralocorticoid receptor(MR) Subfamiliy 4 Nerve growth factor IB-like receptors
Nerve Growth factor IB/Nuclear Nerve Growth factor IB (NGF-IB); Nuclear Receptor related/Neuron-derived receptor related 1 (NURR1); Neuron-derived Orphan receptor orphan receptor 1 (NOR1)
Subfamily 5 Steroidogenic factor-like receptors Steroidogenic factor/Liver receptor Steroidogenic factor 1 (SF1); Homolog Liver receptor homologue-1 (LHR1)
Subfamily 6 Germ Cell Nuclear factor-like receptors Germ cell nuclear factor Germ Cell nuclear factor (GCNF)
Subfamily 0 Miscellaneous receptors
Dosage-sensitive sex reversal, Dosage-sensitive sex reversal, adrenal Adrenal hypoplasia critical region/ hypoplasia critical region, on
Small heterodimer partner chromosome X, gene 1 (DAX); Smal heterodimer partner (SHP)
Pada prinsipnya stuktur PPAR mempunyai empat domain
fungsional yang telah diidentifikasikan yaitu ujung N, DNA Binding
Domain (DBD), domain D, Ligand Binding Domain (LBD) atau ujung C
(Horvai et al , 2008).
NH2-terminal DBD LBD C-terminal
AF-1 Hinge AF-2
Gambar 2.4. Skema Represantasi dari Domain Struktural PPAR
Domain N-terminal A/B berisikan ligan independent yang memiliki
fungsi aktivasi 1 (AF-1) yang bertanggung jawab untuk fosforilasi PPAR.
DNA pengikat Domain (DBD = DNA Binding Domain) atau domain C
berfungsi untuk mempromosikan pengikatan PPAR terhadap respon
Proliferator Peroksisome Elemen (PPRE) di daerah promotor dari gen
target. Domain D adalah domain docking untuk kofaktor sedangkan
Domain E/F atau disebut Ligan Binding Domain (LBD) adalah domain
yang bertanggung jawab atas kekhususan ligan dan aktivasi pengikatan
PPAR terhadap PPRE, yang akan meningkatkan ekspresi dari gen yang
ditargetkan (Horvai et al , 2008; Schweitzer, 2009).
2.3. Peroksisome Proliferator Activator Reseptor Gamma (PPARγ)
Peroksisome proliferator activator reseptor gamma (PPARγ) adalah anggota dari family nuklear reseptor dengan beragam fungsi
biologis yang mencakup mediasi diferensiasi adiposit, pengaturan
aktivitas monosit, makrofag, anti-inflamasi dan penghambatan proliferasi
sel tumor (Li Yi Ming et al, 2003; Tracey, 2003). PPARγ juga ditemukan
terekspresi dalam beberapa karsinoma, sehingga menimbulkan dugaan
regulasi siklus sel (H Philip, 2003; Qing HE et al, 2009). Pada karsinoma
sel skuamous kepala dan leher terlihat adanya overekspresi pada PPARγ. Dimana PPARγ akan merangsang apoptosis dan menghambat invasi sel tumor pada karsinoma sel skuamous. Jika PPARγ meningkat maka apoptosis juga meningkat terutama pada tumor stadium dini (Qing
HE et al, 2009; Horvai et al, 2008)
PPARγ pertama kali diidentifikasi sebagai komponen dari suatu adipocyte differentiation-dependent regulatory factor (ARF6) yang
mengikat ke sel lemak spesifik dari asam lemak adipocyte mengikat
protein (AP2) gen (Lim Chui Hun,. 2007).
PPARγ, seperti PPAR lainnya, membentuk heterodimer dengan anggota subfamily reseptor nuklear yang lain, yakni reseptor retinoic X
(RXR), yang merupakan reseptor untuk asam 9-cis-retinoic. Setelah heterodimerisasi dengan RXR, PPARγ mengikat unsur proliferator peroksisom reseptor elemen (PPRE) yang terdapat pada DNA target
kemudian pada gilirannya akan mengatur transkripsi gen dan
menimbulkan efek biologik. Namun target gen yang memperantarai aktivitas anti kanker dengan aktivitas PPARγ mekanismenya masih belum jelas (Shirley, 2009; Lim Chui Hun, 2007).
PPARγ berperan sebagai faktor transkripsi setelah membentuk heterodimer dengan retinoid x reseptor (RXR) kemudian diaktifkan oleh
ikatan dengan ligan spesifik (Shirley, 2009). Ligan yang berbeda
mempunyai kemampuan untuk mengambil protein coaktivator yang
berbeda dan akan menimbulkan efek biologi yang berbeda juga. Yang
termasuk ligan alami salah satunya yaitu prostaglandin J2(PG-J2) dan
sintesis yaitu thiazolinediones (TZD). Keduanya adalah ligan PPARγ
dengan aktivitas agonis anti-proliferasi yang telah diidentifikasi. Yang
termasuk dalam ligan sintetik TZD adalah rosiglitazone (Avandia),
pioglitazone (Actos), dan troglitazone (Rezulin) (Tracey et al, 2003; H
Philip, 2003). Ligan sintetik yang baru yaitu Triterpinoid (2-cyano-3,
12-divoaleana-1,9-diene-28oic acid) dapat merangsang diferensiasi dan
dapat menghambat proliferasi dari berbagai sel kanker dan mempunyai
aktivitas anti peradangan. Asam retinoid trans juga telah digunakan
sebagai ligan PPARγ untuk mencegah recurren kanker karsinoma sel
skuamous kepala dan leher (Tracey et al, 2003; H Philip, 2003; NG
Nikitakis et al, 2002).
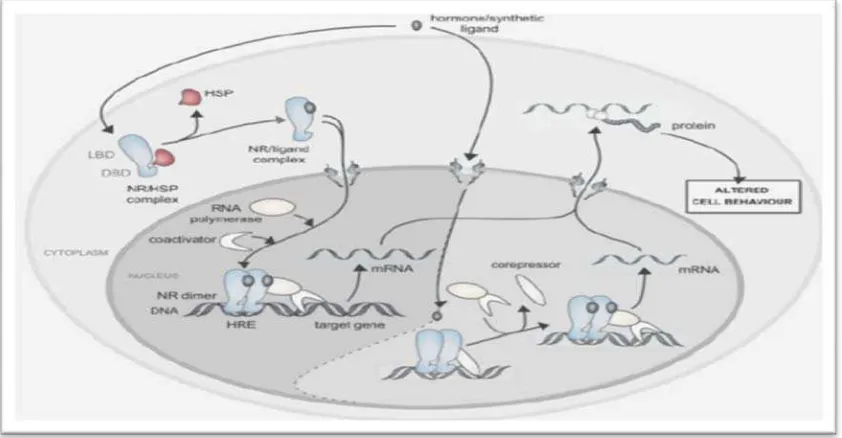
Cara kerja ligan pada nuklear reseptor yang terdapat di sitoplasma.
Ligan alami atau ligan sintetik berdifusi melewati membran sel dan
berikatan pada nuklear reseptor. Pengikatan ligan pada nuklear reseptor
disitoplasma mencetuskan perubahan. Ligan mengaktifkan heterodimer
nuklear reseptor kemudian masuk kedalam nukleus yang mengambil
protein coaktivator dan RNA polimerase kemudian berikatan di DNA
hormon reseptor elemen (HRE) dan mengaktifkan transkripsi gen dan
menyebabkan timbul efek biologis (Schweitzer et al, 2009).
2.4. Peran PPARγ pada Kanker
Nuklear reseptor memodulasi atau merangsang proliferasi,
apoptosis, invasi dan migrasi. PPAR dapat menekan pertumbuhan sel kanker pada manusia. Dengan adanya mutasi pada PPARγ akan mengakibatkan hilangnya ikatan ligan. Ini menunjukkan bahwa pentingnya PPARγ fungsional yang normal untuk pertumbuhan sel-sel manusia. Salah satu mekanismenya adalah upregulasi tumor oleh agonis PPARγ. Secara keseluruhan ligan PPARγ (agonis) telah dinyatakan sebagai antikanker yang potensial dan dapat berfungsi sebagai dasar
yang rasional dalam terapi beberapa tumor atau dalam kemopreventif. Data lain menunjukkan bahwa PPARγ bisa berperan sebagai gen supressor tumor. PPARγ juga berperanan sebagai faktor transkripsi setelah membentuk heterodimer dengan RXR dan berikatan dengan
elemen spesifik. Penelitian ini telah didukung pada in vitro seperti
liposarcoma, kanker ovarium, kanker payudara, kanker prostat, kanker
kandung kemih, beberapa jenis limfoma B, erytroleukemia, kanker
paru-paru, kanker lambung. Oleh karenanya pada saat ini nuklear reseptor
2.5. Kerangka Konsep
= Variabel penelitian
Epitel Nasofaring
Genetik
Lingkungan
Infeksi EBV
Karsinoma nasofaring - Jenis kelamin
- Umur
- Histopatologi - Ukuran tumor (T)
- Ukuran kelanjar getah bening Leher (N) - Stadium
BAB 3
METODOLOGI PENELITIAN
3.1 Jenis Penelitian
Penelitian ini bersifat deskriptif dengan pendekatan secara
cross sectional. Dalam penelitian ini tidak memberikan perlakuan
terhadap variabel, namun hanya melihat ekspresi imunohistokimia PPARγ. Pengukuran variabelnya dilakukan hanya satu kali dan pada satu saat.
3.2 Tempat dan Waktu Penelitian
Penelitian dilakukan di RSUP. H. Adam Malik Medan dan
Departemen Patologi Anatomi Fakultas Kedokteran USU.
Penelitian dilakukan mulai bulan Juni 2012 sampai Desember
2012.
3.3. Populasi, Sampel dan Tekhnik Pengambilan Sampel
3.3.1 Populasi
Populasi adalah penderita yang didiagnosis KNF
berdasarkan anamnesis, pemeriksaan fisik, pemeriksaan radiologi
dan hasil biopsi histopatologi yang berobat ke Divisi
Onkologi-Bedah Kepala Leher Departemen THT-KL FK USU/RSUP H. Adam
Malik Medan.
Kriteria Populasi
1. Penderita yang didiagnosis KNF, baik laki-laki maupun
perempuan dengan keadaan umum baik
2. Penderita yang belum pernah mendapat pengobatan dengan
radioterapi, kemoterapi dan kombinasi keduanya.
3. Hasil pemeriksaan biopsi histopatologi dari Departemen
Patologi Anatomi FK USU pada periode Januari 2011 sampai
dengan Mei 2012.
4. Bersedia diikutsertakan dengan menandatangani informed
consent.
3.3.2 Sampel
Sampel pada penelitian ini adalah total populasi penelitian.
3.3.3 Tekhnik Pengambilan Sampel
Pengambilan sampel penelitian adalah dengan cara non
probability consecutive sampling
3.4 Variabel Penelitian
Variabel pada penelitian ini adalah :
1. Karsinoma nasofaring
2. Umur
3. Jenis Kelamin
4. Tipe histopatologi
5. Tumor primer (T)
6. Ukuran kelenjar getah bening (N)
7. Stadium klinis
8. Ekspresi PPARγ.
3.5 Definisi Operasional
1. Karsinoma nasofaring adalah tumor ganas berasal dari sel
epitel yang melapisi permukaan nasofaring yang ditegakkan
berdasarkan hasil pemeriksaan histopatologi dan dinilai
berdasarkan kriteria WHO.
2. Jenis kelamin adalah perbedaan antara laki-laki dengan
perempuan secara biologis sejak lahir, yang akan menjadi
identitas responden:
a. Laki-laki
b. Perempuan
3. Umur adalah usia yang dihitung dalam tahun dan
perhitungannya berdasarkan kalender masehi. Umur penderita
karsinoma nasofaring dikelompokkan atas:
a. 20 tahun
b. 21-40 tahun
c. 41-60 tahun
d. > 60 tahun
4. Tipe histopatologi karsinoma nasofaring adalah jenis dari suatu
tumor ganas yang sediaanya diambil dari jaringan nasofaring
dan dilihat di bawah mikroskop oleh ahli patologi antomi yang
hasil pemeriksaannya berdasarkan kriteria WHO:
Tipe 1 : Keratinizing Squamous cell carcinoma
Tipe 2 : Non keratinizing squamous cell carcinoma
Tipe 3 : Undifferentiated carcinoma
5. Tumor primer (T) karsinoma nasofaring adalah besar dan
perluasan tumor primer sesuai kriteria AJCC tahun 2010 yang
diukur oleh ahli Radiologi dengan memakai CT-Scan.
Hasil ukur : 1, 2, 3, 4
T1 : Tumor terbatas di nasofaring atau tumor meluas ke
orofaring dan/kavum nasi tanpa perluasan ke parafaring.
T2 : Tumor dengan perluasan ke daerah parafaring.
T3 : Tumor melibatkan struktur tulang dasar tengkorak
dan/atau sinus paranasal
T4 : Tumor dengan perluasan intrakranial dan/atau
terlibatnya syaraf kranial, hipofaring, orbita atau dengan
perluasan ke fossa infratemporal/ruang mastikator.
6. Ukuran kelenjar getah bening leher (N) adalah ukuran kelenjar
getah bening leher sesuai kriteria AJCC tahun 2010 yang
diukur oleh ahli Radiologi dengan memakai CT-Scan.
Hasil ukur: 0,1,2,3
N0 : Tidak ada metastase ke KGB regional
N1 : Metastase kelenjar getah bening leher unilateral dengan
diameter terbesar 6 cm atau kurang, di atas fossa
supraklavikular, dan/atau unilateral atau bilateral
kelenjar getah bening retrofaring dengan diameter
terbesar 6 cm atau kurang.
N2 : Metastase kelenjar getah bening bilateral dengan
diameter terbesar 6 cm atau kurang, di atas fossa
supraklavikular.
N3 : Metastase pada kelenjar getah bening diatas 6 cm
dan/atau pada fossa supraklavicular.
7. Stadium karsinoma nasofaring adalah penentuan stadium
penyakit berdasarkan klasifikasi AJCC tahun 2010 yang
dikelompokkan menjadi: I, II, III, IV.
8. Ekspresi PPARγ.adalah pemeriksaan imunohistokimia yang
pada pewarnaan coklat pada sitoplasma dan membran sel.
Skor imunoreaktif diperoleh dengan mengalikan skor luas
dengan skor intensitas (Tan & Putti, 2005).
Hasil ukur skor immunoreaktif:
Ekspresi PPARγ negatif: 0-3
Ekspresi PPARγ positif / overekspresi: 4-9
3.6 Bahan Penelitian
Bahan yang digunakan dalam penelitian ini adalah jaringan
nasofaring dalam bentuk blok parafin dengan pulasan hematoksilin
eosin yang telah didiagnosis sebagai karsinoma nasofaring. Bahan
ini diperiksa secara immunohistokimia dengan menilai
immunoreaktivitas antibodi PPARγ.
0 : berarti negatif Skor luas dinilai :
1 : pewarnaan positif < 10% jumlah sel
2 : pewarnaan positif 10-50% jumlah sel
3 : pewarnaan positif > 50% jumlah sel
0 : berarti negatif
Skor intensitas dihitung :
1 : lemah
2 : sedang
3 : kuat
Untuk skor akhir digunakan skor imunoreaktif. Skor
imunoreaktif diperoleh dengan mengalikan skor luas dengan skor
intensitas. Skor imunoreaktif 4 atau lebih dinilai positif atau
overekspresi PPARγ.
Hasil ukur : 0 - 9
3.7 Instrumen Penelitian
Penelitian ini membutuhkan beberapa peralatan dan
reagen sebagai berikut:
a. Catatan medis penderita dan status penelitian penderita
b. Formulir persetujuan ikut penelitian
c. Reagen untuk pemeriksaan histopatologi
Formalin 10%, blok parafin, aqua destillata, hematoxyllin-eosin.
d. Reagen untuk pemeriksaan immunohistokimia
Xylol, alkohol absolut, alkohol 95%, alkohol 80%, alkohol 70%,
H202
e. Alat untuk biopsi
0,5% dalam methanol, Phosphat Buffer Saline (PBS), antibodi PPARγ, antibodi sekunder, Envision, Choromogen Diamino Benzidine (DAB). Lathium Carbonat jenuh, Tris EBTA,
Hematoxylin, aqua destillata.
Blakesley nasal foscep lurus/bengkok, endoskopi kaku, 4 mm,
00
f. Alat untuk pemeriksaan immunohistokimia .
Sistem visualisasi immunohistokimia (Envision kit), mesin
pemotong jaringan (microtome), silanized slide.
3.8 Prosedur Kerja Pewarnaan Immunohistokimia PPARγ.
1. Deparafinisasi slide (Xylol 1, Xylol 2, Xylol 3) @ 5 menit
2. Rehidrasi (Alkohol absolute, Alk 96%, Alk 80%,
Alk 70%)
@ 4 menit
3. Cuci dengan air mengalir 5 menit
4. Masukkan slide ke dalam PT Link Dako Epitope
Retrieval: set up Preheat 65°C, Running time
98°C selama 15 menit.
± 1 jam
5. Pap Pen. Segera masukkan dalam Tris Buffered
Saline (TBS) pH 7,4
5 menit
6. Blocking dengan peroxidase block 5-10 menit
7. Cuci dalam Tris Buffered Saline (TBS) pH 7,4 5 menit
8. Blocking dengan Normal horse Serum (NHS) 3% 15 menit
9. Cuci dalam Tris Buffered Saline (TBS) pH 7,4 5 menit
10. Inkubasi dengan Antibodi PPARγ dengan 1 jam
pengenceran 1:40
11. Cuci dalam Tris Buffered Saline (TBS) pH
7,4/Tween 20
5 menit
12. Dako Real Envision Rabbit/Mouse 30 menit
13. Cuci dalam Tris Buffered Saline (TBS) pH
7,4/Tween 20
5-10 menit
14. DAB+Substrat Chromogen solution dengan
pengenceran 20 µL DAB : 1000 µL substrat
(tahan 5 hari di suhu 2-8°C setelah di-mix)
5 menit
15. Cuci dengan air mengalir 10 menit
16. Counterstain dengan Hematoxylin 3 menit
17. Cuci dengan air mengalir 5 menit
18. Lithium carbonat (5% dlm aqua) 2 menit
19. Cuci dengan air mengalir 5 menit
20. Dehidrasi (Alk 80%, Alk 96%, Alk Abs) @5 menit
21. Clearing (Xylol 1, Xylol 2, Xylol 3) @5 menit
22. Mounting + cover glass
3.9 Kerangka Kerja
KARSINOMA NASOFARING
IMMUNOHISTOKIMIA PPAR-γ
Gambar 2.5 Kerangka kerja
3.10 Cara Pengumpulan Data
Data diambil dari hasil pemeriksaan di Departemen THT-KL
FK USU/RSUP H. Adam Malik Medan dan pemeriksaan
histopatologi dan imunohistokimia di Departemen Patologi Anatomi
FK USU.
3.11 Cara Analisis Data
Data yang telah terkumpul dideskripsikan untuk menjelaskan
distribusi frekuensi umur, jenis kelamin dan tipe histopatologi pada
KNF. Untuk menilai kebermaknaan antara variabel yang diteliti,
maka dilakukan uji chi square. Keseluruhan data dipresentasikan
dalam bentuk tabel dan grafik.
NEGATIF 0 -3
POSITIF/OVEREKSPRESI 4 - 9
BAB 4
HASIL PENELITIAN
Penelitian ini merupakan penelitian deskriptif dengan sampel
penelitian berasal dari jaringan nasofaring serta dilakukan pemeriksaan
histopatologi dan immunohistokimia PPARγ pada Departemen Patologi
Anatomi FK USU. Data penelitian ini merupakan seluruh kasus karsinoma
nasofaring yang memenuhi kriteria populasi.
4.1. Distribusi Frekuensi Karsinoma Nasofaring Berdasarkan Umur
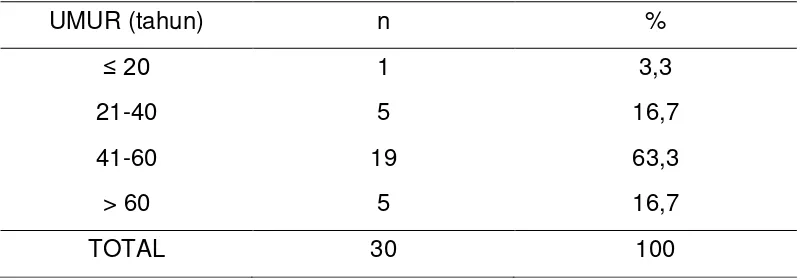
Tabel 4.1. Distribusi frekuensi karsinoma nasofaring berdasarkan umur
UMUR (tahun) n %
≤ 20 1 3,3
21-40 5 16,7
41-60 19 63,3
> 60 5 16,7
TOTAL 30 100
Pada tabel di atas dapat dilihat proporsi tertinggi pada kelompok umur
41-60 tahun yaitu 19 orang (63,3%), sedangkan yang terendah pada
kelompok umur ≤ 20 tahun yaitu 1 orang (3.3%). Umur termuda adalah 16
tahun dan tertua berumur 71 tahun dengan rerata umur 48.3 tahun.
27
4.2. Distribusi Frekuensi Karsinoma Nasofaring Berdasarkan Jenis Kelamin
Tabel 4.2. Distribusi frekuensi karsinoma nasofaring berdasarkan jenis
kelamin
Berdasarkan tabel di atas diketahui proporsi penderita karsinoma
nasofaring terbanyak pada jenis kelamin laki-laki yaitu 21 orang (70,0%)
sedang jenis kelamin perempuan 9 orang (30,0%).
4.3. Distribusi Frekuensi Karsinoma Nasofaring Berdasarkan Tipe Histopatologi
Tabel 4.3. Distribusi frekuensi karsinoma nasofaring berdasarkan tipe
histopatologi
KARAKTERISTIK HISTOPATOLOGI n %
Keratinizing squamous cell carcinoma
Non keratinizing squamous cell carcinoma
Undifferentiated carcinoma
Berdasarkan tabel di atas diketahui proporsi tipe histopatologi
penderita karsinoma nasofaring terbanyak adalah tipe non keratinizing
squamous cell carcinoma yaitu sebanyak 16 jaringan karsinoma
nasofaring (53,3%) dan kelompok terendah adalah tipe keratinizing
JENIS KELAMIN n %
Laki – laki 21 70,0
Perempuan 9 30,0
TOTAL 30 100
squamous cell carcinoma yaitu sebanyak 1 jaringan karsinoma nasofaring
(3,3%).
4.4. Distribusi Frekuensi Ekspresi PPARγ Berdasarkan Tipe Histopatologi Karsinoma Nasofaring
Tabel 4.4. Distribusi frekuensi ekspresi PPARγ berdasarkan tipe
histopatologi karsinoma nasofaring.
TIPE HISTOPATOLOGI
EKSPRESI PPARγ
Negatif Overekspresi
n % n %
Keratinizing squamous cell carcinoma 0 0,0 1 5,9
Non keratinizing squamous cell carcinoma 6 46,2 10 58,8
Undifferentiated carcinoma 7 53,8 6 35,3
TOTAL 13 100,0 17 100,0
Proporsi overekspresi PPARγ paling banyak dijumpai pada tipe
histopatologi non keratinizing squamous cell carcinoma sebanyak 10
jaringan karsinoma nasofaring (58,8%), diikuti tipe histopatologi
differentiated carcinoma sebanyak 6 jaringan karsinoma nasofaring
(35,3%), dengan uji Chi-Square untuk menguji hubungan antara tipe
histopatologi dengan ekspresi PPARγ didapatkan nilai p=0,456.
p=0,456
4.5. Distribusi Frekuensi Ekspresi PPARγ Berdasarkan Tumor Primer (T) Karsinoma Nasofaring.
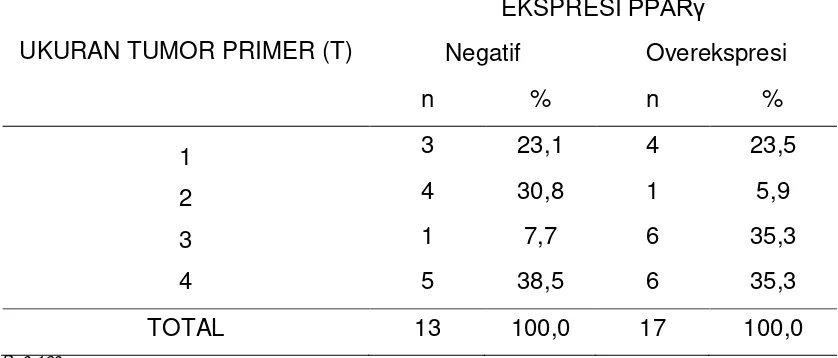
Tabel 4.5. Distribusi ekspresi PPARγ berdasarkan frekuensi tumor
primer (T) karsinoma nasofaring.
UKURAN TUMOR PRIMER (T)
EKSPRESI PPARγ
Negatif Overekspresi
n % n %
1
2
3
4
3 23,1 4 23,5
4 30,8 1 5,9
1 7,7 6 35,3
5 38,5 6 35,3
TOTAL 13 100,0 17 100,0
P=0,160
Proporsi overekspresi PPARγ paling banyak ditemukan pada
karsinoma nasofaring dengan ukuran tumor primer T3 dan T4 yaitu
masing-masing sebanyak 6 jaringan karsinoma nasofaring (35,3%), dan
terendah ditemukan pada ukuran tumor primer T2 yaitu sebanyak 1
jaringan karsinoma nasofaring (5,9%), dengan uji Chi-Square untuk
menguji hubungan antara tumor primer dengan ekspresi PPARγ
didapatkan nilai p=0,160.
4.6. Distribusi Frekuensi Ekspresi PPARγ Berdasarkan Metastasis Kelenjar Getah Bening (N) Karsinoma Nasofaring.
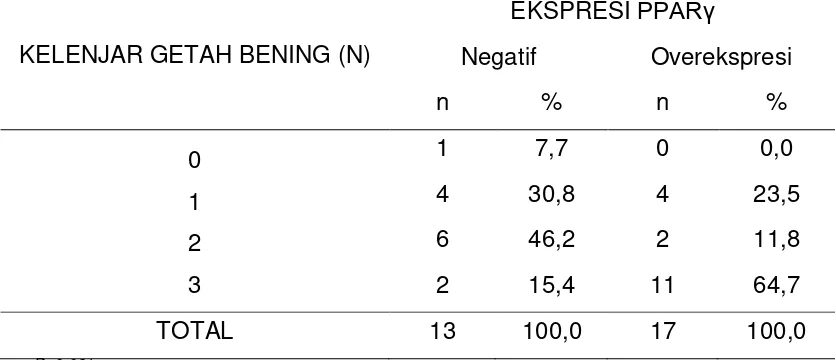
Tabel 4.6. Distribusi frekuensi ekspresi PPARγ berdasarkan metastasis
kelenjar getah bening (N) karsinoma nasofaring.
KELENJAR GETAH BENING (N)
EKSPRESI PPARγ
Negatif Overekspresi
n % n %
0
1
2
3
1 7,7 0 0,0
4 30,8 4 23,5
6 46,2 2 11,8
2 15,4 11 64,7
TOTAL 13 100,0 17 100,0
P=0,031
Penelitian ini menunjukkan proporsi overekspresi PPARγ paling banyak ditemukan pada ukuran kelenjar getah bening N3 yaitu sebanyak
11 jaringan karsinoma nasofaring (64,7%) dan terendah ditemukan pada
ukuran kelenjar getah bening N0 yaitu sebanyak 0 jaringan karsinoma
nasofaring (0,0%), dengan uji Chi-Square untuk menguji hubungan antara
kelenjar getah bening karsinoma nasofaring dengan ekspresi PPARγ
didapatkan nilai p=0,031.
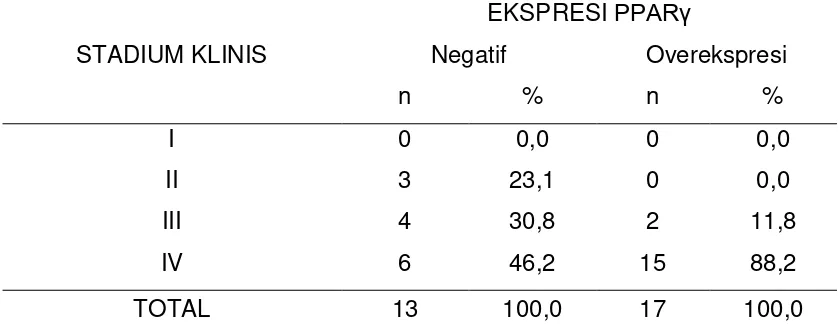
4.7. Distribusi Frekuensi Ekspresi PPARγ Berdasarkan Stadium Klinis Karsinoma Nasofaring.
Tabel 4.7. Distribusi frekuensi ekspresi PPARγ berdasarkan stadium
klinis karsinoma nasofaring.
STADIUM KLINIS
EKSPRESI PPARγ
Negatif Overekspresi
n % n %
I
II
III
IV
0 0,0 0 0,0
3 23,1 0 0,0
4 30,8 2 11,8
6 46,2 15 88,2
TOTAL 13 100,0 17 100,0
Berdasarkan tabel diatas dapat diketahui bahwa proporsi overekspresi PPARγ paling banyak ditemukan pada stadium 4 yaitu sebanyak 15 jaringan karsinoma nasofaring (88,2%), dan terendah ditemukan pada
stadium 1 yaitu sebanyak 0 jaringan karsinoma nasofaring (0,0%). Dari uji
dengan uji Chi-Square untuk menguji hubungan antara stadium klinis
karsinoma nasofaring dengan ekspresi PPARγ didapatkan nilai p=0,028.
P=0,028
BAB 5
PEMBAHASAN
Telah dilakukan penelitian histopatologi dan imunohistokimia PPARγ terhadap penderita karsinoma nasofaring di RSUP H. Adam Malik Medan mulai Juni 2012 sampai dengan Desember 2012 dengan sampel
merupakan penderita yang berobat periode Januari 2011 sampai dengan
April 2012 yaitu sebanyak 30 sampel dan akan dijabarkan seperti
dibawah ini.
5.1. Distribusi Frekuensi Karsinoma Nasofaring Berdasarkan Umur
Pada penelitian ini ditemukan distribusi frekuensi tertinggi
pada kelompok umur 41-60 tahun (63,3%), sedangkan yang
terendah pada kelompok umur ≤ 20 tahun (3.3%). Umur termuda
adalah 16 tahun dan tertua berumur 71 tahun dengan rerata umur
48.3 tahun.
Kelompok umur 41-60 tahun merupakan kelompok umur
yang memiliki angka kejadian penderita karsinoma nasofaring
yang cukup tinggi, hal ini terlihat pada beberapa penelitian lain di
Indonesia seperti yang didapat oleh Puspitasari (2011) di RSUP H.
Adam Malik Medan periode 2006-2010 dengan kelompok umur
terbanyak pada usia 51-60 tahun sebanyak 89 kasus (26,5%) dari
335 kasus. Penelitian lain yang dilakukan di luar negeri menjumpai
hal yang sama, menurut National Cancer Registry (2003) mencatat
kasus penderita kanker nasofaring tertinggi ditemukan pada
kelompok dari usia 40-49 sebesar 347 (36,3%) kasus dari 1.125
Demikian juga dengan Pua et al. (2008) di Malaysia
mendapatkan presentase tertinggi pada kelompok umur 51-60
tahun sebesar 12 penderita (28%) dari 225 kasus. kasus.
Hal ini disebabkan karena sistem mekanisme perbaikan
DNA yang mengalami mutasi (DNA repair) sudah kurang berfungsi
dengan baik dan penurunan daya tahan tubuh pada usia lebih dari
40 tahun. Mekanisme perbaikan DNA dibutuhkan guna
memperbaiki rangkaian asam amino pada kode genetik DNA yang
mengalami mutasi. Jika mekanisme perbaikan DNA ini mengalami
kegagalan dalam menjalankan fungsinya maka mutasi gen DNA
yang sudah terjadi akan menyebabkan pertumbuhan sel tidak
terkendali (Soehartono et al. 2007)
5.2. Distribusi Frekuensi Karsinoma Nasofaring Berdasarkan Jenis Kelamin
Penelitian ini menemukan bahwa jenis kelamin penderita
karsinoma nasofaring terbanyak adalah laki-laki sebanyak 21
orang (70,0%) dengan perbandingan laki-laki dengan perempuan
adalah 2.7:1.
Hasil ini sesuai dengan penelitian sebelumnya yaitu
Puspitasari (2011) di RSUP H. Adam Malik Medan mendapatkan
perbandingan laki-laki dengan perempuan 2.7:1. Penelitian lain
juga mendapatkan hasil yang sama seperti Anusha et al. (2012)
yaitu ditemukannya penderita karsinoma nasofaring terbanyak
adalah pada laki-laki dengan rata-rata 70%. Menurut National
Cancer Registry (2003), karsinoma nasofaring yang paling umum
adalah pada
Hampir semua penelitian penderita KNF lebih banyak
dijumpai pada laki-laki dibandingkan pada perempuan diduga ada
hubungan dengan kebiasaan hidup dan pekerjaan dimana laki-laki
lebih sering terpapar dengan karsinogen penyebab KNF seperti
paparan uap, asap debu dan gas kimia, paparan formaldehid di
tempat kerja dapat meningkatkan risiko KNF (Chang & Adami,
2006). Selain itu, mengkonsumsi minuman beralkohol dan laki-laki sebesar 70,8% di Cina.
merokok juga dapat meningkatkan risiko terkena KNF (Yunardi,
2010 Ellen T. Chang et al 2006).
5.3. Distribusi Frekuensi Karsinoma Nasofaring Berdasarkan Tipe Histopatologi
Penelitian ini menemukan tipe histopatologi penderita
karsinoma nasofaring terbanyak adalah tipe non keratinizing
squamous cell carcinoma sebanyak 16 jaringan karsinoma
nasofaring (53,3%) dan tipe histopatologi terendah adalah tipe
keratinizing squamous cell carcinoma yaitu sebanyak 1 jaringan
karsinoma nasofaring. (3,3%).
Hal ini senada dengan yang di laporkan oleh Cao et al
(2006) yaitu 97,6% dari 1.142 kasus KNF di Guangdong
merupakan tipe non keratinizing squamous cell carcinoma, 1,7%
tipe undifferentiated carcinoma dan 0,5% merupakan tipe
keratinizing squamous cell carcinoma. (Wei et al. 2011).
Hasil ini berbeda dengan penelitian yang mendapatkan jenis
histopatologi terbanyak di Singapore oleh Charles Gullo et al (2008) yang menemukan tipe terbanyak adalah undifferentiated carcinoma dengan nilai rata-rata WHO tipe 3 (55%) diikuti dengan
tipe keratinizing squamous cell carcinoma WHO tipe 1 (25%) dan
tipe non keratinizing squamous cell carcinoma sebesar WHO tipe
2. (20%).
Karsinoma nasofaring tipe non keratinizing squamous cell
carcinoma dan undifferentiated carcinoma paling banyak dijumpai
di daerah endemik KNF, seperti di Cina Selatan, Asia Tenggara
dan Mediterania. (Abdullah et al 2011)
5.4. Distribusi Frekuensi Ekspresi PPARγ Tipe Berdasarkan Histopatologi Karsinoma Nasofaring
Pada penelitian ini kami temukan nilai overekspresi PPARγ paling banyak dijumpai pada tipe histopatologi non keratinizing
squamous cell carcinoma sebanyak 10 jaringan karsinoma
nasofaring (58,8%) diikuti tipe histopatologi undifferentiated
carcinoma sebanyak 6 jaringan karsinoma nasofaring (35,3%). Jika dilihat dari distribusi overekspresi PPARγ berdasarkan tipe histopatologi dapat kita temukan overekspresi PPARγ banyak dijumpai pada tipe histopatologi yang berkaitan dengan inflamasi,
namun dengan uji Chi-Square menunjukkan tidak ada perbedaan yang signifikan antara ekspresi PPARγ dengan tipe histopatologi karsinoma nasofaring (p=0,456).
5.5. Distribusi Frekuensi Ekspresi PPARγ Berdasarkan Ukuran Tumor Primer (T) Karsinoma Nasofaring
PPARγ ini ditemukan dapat terekspresi dalam beberapa jenis tumor, sehingga menimbulkan dugaan bahwa PPARγ memiliki peranan didalam diferensiasi garis sel kanker dan dalam
regulasi siklus sel. Pada karsinoma sel skuamous kepala dan leher terlihat adanya overekspresi pada PPARγ.
Overekspresi PPARγ paling banyak ditemukan pada karsinoma nasofaring dengan ukuran tumor primer T4 yaitu
sebanyak 6 jaringan karsinoma nasofaring (35,3%) dan terendah
ditemukan pada ukuran tumor primer T2 yaitu sebanyak 1 jaringan
karsinoma nasofaring (5,9%) dengan nilai p=0,160.
Apabila kita melihat pembahasan diatas maka dapat
disimpulkan bahwa tidak ada hubungan yang signifikan antara tingkat tumor dengan PPARγ.
Hasil ini sama dengan penelitian yang dilakukan oleh
Mukunyadzi et al (2003) pada penderita karsinoma duktus saliva
yang menemukan bahwa tingkat ekspresi PPARγ dijumpai pada
semua tingkatan ukuran tumor primer namun tidak menemukan
hubungan yang signifikan antara ekspresi PPARγ dengan
kelompok ukuran tumor primer. Ekspresi PPARγ pada karsinoma
duktus saliva timbul dari reseptor androgen yang merupakan salah
satu dari hormone nuclear reseptor.
Galusca et al (2004) pada karsinoma tiroid papilari dimana
mereka menemukan peningkatan level PPARγ sejalan dengan
peningkatan ukuran tumor primer tetapi tidak menunjukkan adanya
hubungan yang signifikan antara level PPARγ dengan kelompok
ukuran tumor primer.
Hasil yang sama juga ditemukan oleh Lacroix et al (2004)
pada penelitian terhadap karsinoma tiroid folikular dimana tidak
ada hubungan yang signifikan antara peningkatan ekspresi PPARγ
dengan kelompok ukuran tumor primer.
5.6. Distribusi Frekuensi Ekspresi PPARγ Berdasarkan Ukuran Kelenjar Getah Bening (N) Karsinoma Nasofaring
Pada penelitian ini kami lakukan uji Chi-Square untuk
menguji hubungan antara kelenjar getah bening karsinoma
nasofaring dengan ekspresi PPARγ didapatkan nilai p=0,031. Kami
menemukan overekspresi PPARγ paling banyak dijumpai pada
kelompok ukuran kelenjar getah bening N3 yaitu sebanyak 11
jaringan karsinoma nasofaring (64,7%) dan N2 sebanyak 2
(11,8%), sedangkan pada kelompok ukuran kelenjar getah bening
N1 sebanyak 4 (23,5%). dan N0 sebanyak 0 jaringan karsinoma
nasofaring (0,0%).
Jika kita melihat tabel distribusi frekuensi ukuran kelenjar getah bening karsinoma nasofaring berdasarkan ekspresi PPARγ, dapat kita simpulkan bahwa ditemukan hubungan yang signifikan