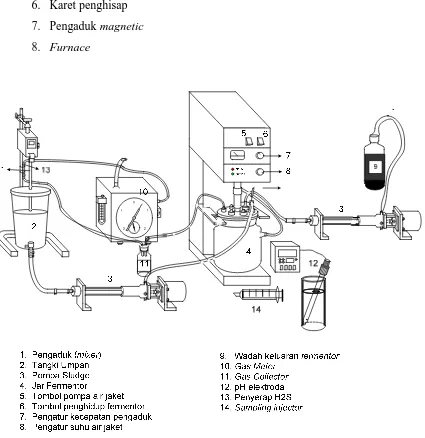
LAMPIRAN A
METODOLOGI PENELITIAN
A.1 LOKASI PENELITIAN
Penelitian ini dilakukan di Laboratorium Ekologi, Departemen Teknik
Kimia, Fakultas Teknik, Universitas Sumatera Utara (USU), Medan.
A.2 BAHAN DAN PERALATAN A.2.1 Bahan-Bahan
1. Starter dari penelitian sebelumnya
Fungsi: sebagai sumber mikroba untuk proses digestasi anaerobik
2. POME dari fat pit PTPN IV PKS Adolina
Fungsi: Bahan baku atau umpan dalam penelitian
3. Asam klorida (HCl) 0,1 N
Fungsi: Zat pentiter untuk analisis alkalinitas
4. Aquadest (H2O)
Fungsi: Pelarut dalam analisis alkalinitas dan sebagai pencuci dalam analisis
TSS dan VSS
5. Natrium Bikarbonat (NaHCO3)
Fungsi: Pengontrolan pH untuk variasi pH yang telah ditentukan
A.2.2 Peralatan
A. Peralatan Utama
1. Fermentor tangki berpengaduk/jar fermentor (EYELA model No.: MBF
300ME)
Fungsi: Tempat berlangsungnya proses digestasi aanerobik asidogenesis
2. Pompa sludge/slurry pump (HEISHIN, model No.:3NY06F)
Fungsi: memompa umpan (influent) masuk ke dalam fermentor dan
effluent keluar dari fermentor
3. Gas meter (SHINAGAWA, model No.:W-NK-0.5B)
4. Tangki umpan (service tank)
Fungsi: wadah penampungan umpan POME sebelum diumpankan ke
dalam fermentor
5. Pengaduk
Fungsi: menghomogenkan umpan POME di dalam tangki umpan
6. pH elektroda
Fungsi: mengukur pH
7. Timer (OMRON, model No.:H5F)
Fungsi: mengatur waktu dan lama pemompaan umpan masuk dan keluaran
(effluent) dari fermentor
8. Botol penampungan keluaran fermentor
Fungsi: Menampung keluaran (effluent) dari fermentor
9. Gas collector
Fungsi: menampung gas-gas yang mungkin terbentuk selama proses
asidogenesis
B. Peralatan Analisis
1. Buret 25 ml
Fungsi: mengukur volume zat pentiter HCl melalui titrasi dalam analisis
alkalinitas
2. Timbangan analitik
Fungsi: mengukur massa zat/sampel
3. Oven
Fungsi: memanaskan sampel dalam analisis TS dan TSS sampel
4. Desikator
Fungsi: mendinginkan sampel keluaran oven dan furnace sebelum
penimbangan
5. Karet penghisap
Fungsi: digunakan pada pipet ukur untuk menghisap zat pentiter HCl
6. Pengaduk magnetic
Fungsi: mengaduk dan menghomogenkan campuran dalam analisis
7. Furnace
Fungsi: memanaskan sampel dalam analisis VS dan VSS sampel
A.3 FLOWCHART PROSEDUR PENELITIAN A.3.1 Flowchart Prosedur Analisis pH
A.3.2 Flowchart Prosedur Analisis M-Alkalinity
A.3.3 Flowchart Prosedur Analisis Total Solids (TS)
A.3.4 Flowchart Prosedur Analisis Volatile Solids (VS)
Mulai
Dimasukkan cawan hasil analisis TS ke dalam furnace
Selesai
Dipanaskan pada suhu 550 oC selama 1 jam
Didinginkan cawan penguap di dalam desikator hingga suhunya mencapai suhu kamar
Ditimbang berat cawan
Gambar A.5 Flowchart Prosedur Analisis Volatile Solids (VS)
A.3.5 Flowchart Prosedur Analisis Total Suspended Solids (TSS)
Mulai
Ditimbang kertas saring kering yang digunakan
Dibasahi kertas saring dengan sedikit air suling
Diaduk sampel dengan mannetic stirrer
hingga homogen
Dipipetkan sampel ke penyaringan
Dicuci kertas saring atau saringan dengan 3 x 10 mL aquadest
Gambar A.6 Flowchart Prosedur Analisis Total Suspended Solids (TSS)
A.3.7 Flowchart Prosedur Analisis Chemical Oxygen Demand (COD)
A.3.8 Flowchart Prosedur Loading Up dan Operasi Target
LAMPIRAN B
DATA HASIL ANALISIS
B.1 KARAKTERISTIK LIMBAH CAIR PABRIK KELAPA SAWIT
Tabel B.1 Hasil Analisis Karakteristik LCPKS dari PTPN IV PKS Adolina
No. Parameter Satuan Hasil Uji Metode Uji
1. pH - 3,5–4,8 APHA 4500-H
2. Chemical Oxygen Demand (COD)
mg/L 41.818 SNI 06–6989.15–2004
3. Total Solid (TS) mg/L 16.040–61.000 APHA 2540B 4. Volatile Solid (VS) mg/L 16.060–52.360 APHA 2540E 5. Total Suspended
Solid (TSS)
mg/L 2.920–24.700 APHA 2540D
6. Volatile Suspended Solid (VSS)
mg/L 9.100–22.680 APHA 2540E
7. Oil and Grease* mg/L 0 SNI 06–6989.10–2004
8. Protein* % 0 Kjeldahl
9. Karbohidrat* % 0 Lane Eynon
10. Volatile fatty acids* -Asam asetat -Asam propionat -Asam butirat
mg/L
1.508,987 560,030 1.088,613 * Laporan hasil uji laboratorium terlampir
B.2 DATA HASIL PENELITIAN
B.2.1 Data Hasil Penelitian pada Variasi Hydraulic Retention Time (HRT)
Tabel B.2 Data Hasil Analisis pH, Alkalinitas, TS, VS, TSS dan VSS padaVariasi
Hydraulic Retention Time (HRT)
HRT Hari ke pH Alkalinitas TS VS TSS VSS
20 1 2 3 4 5 6 7 8 9 10 11 12 6,2 6,2 6,2 6,2 6,1 6,2 6,2 6,0 6,2 5,8 5,8 5,8 2.400 2.600 2.400 2.000 2.100 2.300 2.000 1.900 1.500 1.100 1.500 1.900 16.440 16.300 18.680 11.360 18.000 13.480 17.140 30.740 27.920 32.600 26.080 23.900 9.620 10.600 12.860 7.960 12.860 8.860 13.980 21.240 21.200 23.280 19.100 17.080
HRT Hari ke pH Alkalinitas TS VS TSS VSS
4 15 5,9 1.000 23.980 19.860 5.680 5.700
(Alkalinitas, TS, VS, TSS dan VSS dalam satuan mg/L)
Tabel B.3 Data Hasil Analisis Chemical Oxygen Demand (COD) pada Variasi
Hydraulic Retention Time (HRT)
HRT Hari ke
COD
Influent (mg/L) Effluent (mg/L) Reduksi (%) Rata-Rata (%)
20 10 13 15 28.780 23.415 21.463 20.976 18,64 25,42 27,12 23,73 15 10 13 15 37.561 23.902 26.341 21.463 36,36 29,87 42,86 36,36 10 10 13 15 30.732 16.097 18.049 24.878 47,62 41,27 19,05 35,98 4 10 13 15 36.585 18.049 12.683 20.976 50,67 65,33 42,67 52,89
Tabel B.4 Data Hasil Analisis Pembentukan Volatile Fatty Acid (VFA) pada Variasi Hydraulic Retention Time (HRT)
HRT Hari ke VFA (mg/L)
Asetat Propionat Butirat Total
20 10 13 15 2.054 400 5.228 1.254 1.600 1.690 2.867 2.818 3.067 6.176 4.817 9.986 15 10 13 15 3.220 320 921 1.277 1.336 1.135 1.761 1.652 2.186 6.258 3.308 4.242 10 10 13 15 1.246 884 754 1.881 645 1.455 3.687 961 3486 6.815 2.490 5.695 4 10 13 15 1.276 772 1.538 598 1.301 1.723 715 3.252 3.942 2.590 5.325 7.204
Tabel B.5 Data Perhitungan Rasio VFA/Alkalinitas pada Variasi Hydraulic
Retention Time (HRT)
HRT
Rata-Rata Total VFA
(mg/L)
Rata-Rata
Alkalinitas (mg/L) VFA/Alkalinitas
20 6.993 2.040 3,42
HRT
Rata-Rata Total VFA
(mg/L)
Rata-Rata
Alkalinitas (mg/L) VFA/Alkalinitas
10 5.000 1.935 2,58
4 5.039 1.823 2,76
B.2.2 Data Hasil Penelitian pada Variasi pH
Tabel B.6 Data Hasil Analisis pH, Alkalinitas, TS, VS, TSS dan VSS pada Variasi pH
pH Hari
ke pH Alkalinitas TS VS TSS VSS
6,0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 5,9 6,0 5,9 5,9 6,0 6,0 6,1 6,1 6,1 6,1 6,1 6,0 6,2 6,0 5,9 2.100 1.950 950 2.450 1.450 1.700 1.600 2.000 3.050 1.900 2.650 1.950 1.450 1.150 1000 22.760 27.860 30.020 29.000 28.020 28.340 36.520 33.280 29.100 31.020 27.860 22.740 22.740 23.040 23.980 21.740 22.020 24.280 21.680 20.680 20.600 28.440 26.700 21.780 26.360 20.680 16.260 17.300 16.620 19.860 4.780 5.100 5.680 3.840 5.060 5.700 5,5
1 5,7 2.000 22.940 18.340
pH Hari
ke pH Alkalinitas TS VS TSS VSS
5,0 7 8 9 10 11 12 13 14 15 4,9 4,8 4,9 4,8 4,8 4,9 5,0 5,0 5,0 950 750 350 400 450 800 900 900 450 35.840 34.460 20.340 27.100 23.400 25.740 26.600 27.040 25.120 28.580 24.860 15.060 21.100 17.740 19.700 21.360 21.320 24.040 7.560 6.260 7.600 5.640 5.620 5.480 4,5 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 4,7 4,7 4,6 4,6 4,5 4,6 4,6 4,6 4,5 4,5 4,4 4,5 4,4 4,5 4,4 – – – – – – – – – – – – – – – 29.500 29.160 26.940 27.380 31.500 31.440 32.440 29.420 30.040 27.120 31.200 29.700 33.460 33.220 35.220 21.260 20.860 19.220 20.500 25.440 23.920 25.120 22.060 23.800 21.000 23.960 24.140 28.620 27.120 28.560 12.880 14.840 13.120 10.880 13.320 11.760 (Alkalinitas, TS, VS, TSS dan VSS dalam satuan mg/L)
Tabel B.7 Data Hasil Analisis Chemical Oxygen Demand (COD) pada Variasi pH
pH Hari ke
COD
Influent (mg/L) Effluent (mg/L) Reduksi (%) Rata-Rata (%)
Tabel B.8 Data Hasil Analisis Pembentukan Volatile Fatty Acid (VFA) pada Variasi pH
pH Hari ke VFA (mg/L)
Asetat Propionat Butirat Total
6,0 10 13 15 1.276 772 1.538 598 1.301 1.723 715 3.252 3.942 2.590 5.325 7.204 5,5 10 13 15 1.217 2.194 2.920 1.299 1.720 1.641 3.075 4.401 3.906 5.592 8.316 8.467 5,0 10 13 15 3.240 5.389 4.737 1.212 1.836 1.584 2.891 4.256 4.024 7.344 11.482 10.345 4,5 10 13 15 4.753 4.522 3.966 1.467 1.393 1.218 5.326 5.346 4.817 11.548 11.261 10.002
Tabel B.9 Data Perhitungan Rasio VFA/Alkalinitas pada Variasi pH
pH
Rata-Rata Total VFA
(mg/L)
Rata-Rata
Alkalinitas (mg/L) VFA/Alkalinitas
6,0 10.937 1.823 2,76
5,5 9.724 1.323 5,63
5,0 7.458 770 12,63
LAMPIRAN C
CONTOH PERHITUNGAN
C.1 PERHITUNGAN REDUKSI COD
Dari Tabel B.3 diperoleh:
Pada HRT 20
COD influent = 28.780 mg/L
COD effluent = 23.415 mg/L
Degradasi COD (%) = 100%
COD
COD
COD − ×
influent
effluent influent
= 100%
780 . 28 415 . 23 780 .
28 − ×
= 23,73 %
C.2 PERHITUNGAN STANDAR DEVIASI
Contoh perhitungan standar deviasi pada VSS untuk variasi pH 6 adalah
sebagai berikut dan Tabel C.1 menunjukkan data VSS pada variasi pH 6.
Tabel C.1 Data VSS untuk variasi pH 6
No. Hari ke VSS (mg/L) VSS (mg/L)
1. 2. 3. 10 13 15 3.840 5.060 5.700 14.746 25.604 32.490
n=3 ∑X = 14.600 ∑X2 = 72.839
Standar deviasi =
(
)
(
1)
2 2 − −
∑
∑
n n X Xn i i
=
(
)
( )
3 1 314.600
-(72.839)
3 2
LAMPIRAN D
DOKUMENTASI
Gambar D.1 Tangki Umpan
Gambra D.3 Botol Keluaran Fermentor (Discharge)
Gambar D.4 Botol Penampung Biogas (Gas Collector)
Gambar D.6 Rangkaian Peralatan
Gambar D.7 Peralatan Analisis M-Alkalinity
Gambar D.9 Peralatan Analisis Padatan Tersuspensi
Gambar D.10 Peralatan Analisis Chemical Oxygen Demand (COD)
Gambar D.12 Desikator
Gambar D.13 Oven
LAMPIRAN E
HASIL UJI LABORATORIUM
E.2 HASIL UJI LABORATORIUM UNTUK ANALISIS PROTEIN DALAM LIMBAH CAIR PABRIK KELAPA SAWIT (LCPKS)
DAFTAR PUSTAKA
[1] Ismail, Mohd Nasir. 2015. “Crude Palm Oil Update Indonesia: Outlook
CPO Export Not too Great”. MPOB Palm News, 2 Februari 2015.
[2] Ahmed, Yunus, Zahira Yaakob, Parul Akhtar, Kamaruzzaman Sopian. 2014.
Production of Biogas and Performance Evaluation of Existing Treatment Processes
in Palm Oil Mill Effluent (POME). Renewable and Sustainable Energy Reviews 42
1260–1278.
[3] Baharuddin, Azhari Samsu, Lim Siong Hock, Mohd Zulkhairi Md Yusof,
Nor’ Aini Abdul Rahman, Umi kalsom Md Shah, Mohd Ali Hassan, Minato
Wakisaka, Kenji Sakai dan Yoshihito Shirai. 2010. Effects of Palm Oil Mill Effluent
(POME) Anaerobic Sludge From 500 m3 of Closed Anaerobic Methane Digested
Tank on Pressed-Shredded Empty Fruit Bunch (EFB) Composting Process. African
Journal of Biotechnology Vol. 9(1 6), hal. 2427-2436.
[4] Lam, M. & Lee, K. 2011. Renewable and Sustainable Bio-Energies
Production From Palm Oil Mill Effluent (POME): Win-Win Strategies Toward
Better Environmental Protection. Biotechnol. Adv., 29(1), 124-141.
[5] Soleimaninanadegani M, Manshad S. 2014. Enhancement of Biodegradation
of Palm Oil Mill Effluents by Local Isolated Microorganisms. International Scholarly
Research Notices 1–8.
[6] Basri, M.F., Yacob, S., Hassan, M.A., Shirai, Y., Wakisaka, M., Zakaria,
M.R., Phang, L.Y. 2010. Improved Biogas Production Palm Oil Mill Effluent by a
Scaled-down Anaerobic Treatment Process. Journal Microbiol Biotechnol.
26:505-506.
[7] Hassan, Osman Hassan, Tang Pei Ling, Mohammad Yusof Maskat, Rosli
Md. Illias, Khairiah Badri, Jamaliah Jahim, Nor Muhammad Mahadi. 2013.
Optimization of Pretreatments for The Hydrolysis of Oil Palm Empty Fruit Bunch
Fiber (EFBF) Using Enzyme Mixtures. Biomass and Bioenergy. Volume 56,
September 2013, Hal 137–146.
[8] Wijekoon, Kaushalya C, Chettiyappan Visvanathan, Amila Abeynayaka.
and Microbial Activity of A Two-Stage Thermophilic Anaerobic Membrane
Bioreactor. Bioresource Technology 102 hal 5353–5360.
[9] Yang Li, Yaobin Zhang, , Zibin Xu, Xie Quan, Shuo Chen. 2015.
Enhancement of Sludge Granulation in Anaerobic Acetogenesis by Addition of
Nitrate and Microbial Community Analysis. Biochemical Engineering Journal
Volume 95, 104–111.
[10] Dahiya, Shikha, Omprakash Sarkar, Y.V. Swamy dan S. Venkata Moha.
2015. Acidogenic Fermentation of Food Waste for Volatile Fatty Acid Production
with Co-Generation of Biohydrogen. Bioresource Technology, Vol 182, 103–113.
[11] Mujdalipah, Siti, Salundik Dohong, Ani Suryani, Amalia Fitria. 2014.
Pengaruh Waktu Fermentasi terhadap Produksi Biogas Menggunakan Digester Dua
Tahap pada Berbagai Konsentrasi Palm Oil-Mill Effluent dan Lumpur Aktif.
Agritech, Vol. 34, No.1.
[12] Pervin, Hasina M, Paul G. Dennis, Hui J. Lim, Gene W. Tyson, Damien J.
Batstone, Philip L. Bond. 2013. Drivers of Microbial Community Composition in
Mesophilic and Thermophilic Temperature-Phased Anaerobic Digestion
Pre-treatment Reactors. Water Research XXX 1-11.
[13] Nabarlatz, Debora-Alcida, Ligia-Patricia Arenas-Beltrán, Diana-Milena
Herrera-Soracá, Diana-Andrea Niño-Bonilla. 2013
. Biogas Production by Anaerobic
Digestion of Wastewater from Palm Oil Mill Industry. C.T.F Cience Tecnol.
Futuro Vol. 5 No. 2 Bucaramanga. ISSN 0122-5383.
[14] Vanegas, Carlos, John Bartlett. 2013. Anaerobic Digestion of Laminaria
digitata: The Effect of Temperature on Biogas Production and Composition. Waste
and Biomass Valorization, Vol 4, Issue 3, hal 509-515.
[15] Li, Qian, Wei Qiao, Xiaochang Wang, Kazuyuki Takayanagi, Mohammad
Shofie, Yu-You Li. 2014. Kinetic Characterization of Thermophilic and Mesophilic
Anaerobic Digestion for Coffee Grounds and Waste Activated Sludge. Waste
Management 36 (2015).
[16] Lee, Wee Shen, Adeline Seak May Chua, Hak Koon Yeoh, Gek Cheng Ngoh.
2013. Influence of Temperature of The Bioconversion of Palm Oil Mill Effluent Into
Volatile Fatty Acids As Precursor to The Production of Polyhydroxyalkanoates. J
[17] Trisakti, Bambang, Veronica Manalu, Irvan, Taslim, Muhammad Turmuzi.
2015. Acidogenesis of Palm Oil Mill Effluent to Produce Biogas: Effect of Hydraulic
Retention Time and pH. Procedia Social and Behavioral Sciences 195 (2015)
2466-2474.
[18] Woong Kim, Seung Gu Shin, Juntaek Lim, Seokhwan Hwang. Effect of
Temperature and Hydraulic Retention Time on Volatile Fatty Acid Production Based
on Bacterial Community Structure in Anaerobic Acidogenesis Using Swine
Wastewater. Bioprocess and Biosystems Engineering . June 2013, Volume 36, Issue
6, hal 791-798.
[19] Woong Kim, Seung Gu Shin, Juntaek Lim, Seokhwan Hwang. Effect of
Temperature and Hydraulic Retention Time on Volatile Fatty Acid Production Based
on Bacterial Community Structure in Anaerobic Acidogenesis Using Swine
Wastewater. Bioprocess and Biosystems Engineering . June 2013, Volume 36, Issue
6, hal 791-798.
[20] Ditjenbun Pertanian. 2014. http://ditjenbun.pertanian.go.id. Pertumbuhan
Areal Kelapa Sawit Meningkat. Diakses 28 Februari 2015.
[21] Zahrim A.Y., A. Nasimah, N. Hilal. 2014. Pollutants Analysis During
Conventional Palm Oil Mill Effluent (POME) Ponding System and Decolourisation
of Anaerobically Treated POME Via Calcium Lactate-Polyacrylamide. Journal of
Water Process Engineering 4 (2014) 159–165.
[22] Puah, Chiew Wei, Yuen May Choo, Soon Hock Ong. 2013. Production Of
Palm Oil With Methane Avoidance At Palm Oil Mill: A Case Study Of
Cradle-To-Gate Life Cycle Assessment. American Journal of Applied Sciences 10 (11):
1351-1355, 2013
[23] Ohimain, Elijah Ige, Sylvester Chibueze Izah. 2014. Estimation Of Potential
Electrical Energy and Currency Equivalent From Un-Tapped Palm Oil Mill
Effluents in Nigeria. International Journal of Farming and Allied Science. Vol., 3 (8):
855-862, 2014.
[24] Junga, P., P. Trávníček. 2014. Analyses of The Thermal Characteristics of Construction Details at The Biogas Station Plant. Res. Agr. Eng., 60: 121–126.
[25] Eriksson, Ola. 2010. Environmental Technology Assessment of Natural Gas
[26] Omer, Abdeen Mustafa. 2014. Applications of Biogas: State of the Art and
Future Prospective. Journal of Chemistry and Materials Research Vol. 1 (3), 2014,
79−107.
[27] Hosseini, Seyed Ehsan, Mazlan Abdul Wahid. 2013. Feasibility Study of
Biogas Production and Utilization as A Source of Renewable Energy in Malaysia.
Renewable and Sustainable Energy Reviews 19 (2013) 454–462.
[28] Victor, Reena, S.Shajin, R.M.Roshni, S.R.Asha. 2014. Augmentative
Invention of Biogas from the Agronomic Wastes Using Facultative Anaerobic
Bacterial Strain. International Journal of Current Microbiology Applied and Science
(2014) 3(4): 556-564.
[29] Molino, A, F. Nanna, Y. Ding , B. Bikson, G. Braccio. 2013. Biomethane
Production by Anaerobic Digestion of Organic Waste. Fuel. Volume 103, January
2013, Hal 1003–1009.
[30] Lim, JW, JY Wang. 2013. Enhanced Hydrolysis and Methane Yield by
Applying Microaeration Pretreatment to The Anaerobic Co-Digestion of Brown
Water and Food Waste. Waste Management Volume 33, Issue 4, April 2013, hal
813–819
[31] Demirel, B., dan Scherer, P. 2008. The Roles of Acetotrophic and
Hydrogenotrophic Methanogens During Anaerobic Conversion of Biomass to
Methane. Rev Environmental Science Biotechnology 7:175. Ken Anderson, Paul
Sallis, Sinan Uyanik. 2003. Anaerobic Treatment Processes The Handbook of Water
and Wastewater Microbiology, hal. 391-426, ISBN 0-12-470100-0.
[32] Denise Cysneiros, Charles J.Banks, Sonia Heaven, Kimon-Andreas G.Karatzas.
2012. The Role of Phase Separation and feed Sysle Length in Leach Beds Coupled to
Methanogenic Reactors for Digestion of a Solid Substrate (part 1): Optimisation of
Reactor Performance. Jurnal Bioresource Technology, 103: hal. 56-63.
[33] A. Schievano, A. Tenca, S. Lonati, E. Manzini dan F. Adani. 2014. Can
Two-Stage Instead of One-Two-Stage Anaerobic Digestion Really Increase Energy Recovery
From Biomass? Applied Energy 124 hal. 335–342.
[34] Ventura, Jey-R Sabado , Jehoon Lee dan Deokjin Jahng. 2014. A Comparative
Study on The Alternating Mesophilic and Thermophilic Two-Stage Anaerobic
[35] Kongjan, Prawit, Sompong O-Thong, Irini Angelidaki. 2013. Hydrogen and
Methane Production from Desugared Molasses Using A Two-Stage Thermophilic
Anaerobic Process. Eng. Life Sci. 2013, 1 3, No. 2, 118–125.
[36] Kavitha, S., Jayashree, C., Adish Kumar, S., Yeom, Ick Tae, Rajesh Banu, J.
2014. The Enhancement of Anaerobic Biodegradability of Waste Activated Sludge by
Surfactant Mediated Biological Pretreatment. Bioresource Technology xxx (2014)
xxx–xxx.
[37] Shana, A., Ouki, S., Asaadi, M., Pearce, P., Mancini, G. 2013. The Impact of
Intermediate Thermal Hydrolysis on The Degradation Kinetics of Carbohydrates in
Sewage Sludge. Bioresource Technology 137 (2013) 239–244.
[38] Teodorita Al Seadi, et al. Biogas Handbook. (Biogas for Eastern Europe,
2008). ISBN 978-87-992962-0-0
[39] Anna Schurer, Asa Jarvis. Microbiological Handbook for Biogas Plants.
(Svenskt Gastekniskt Center AB: Victoria, British Columbia, Canada, 2009).
[40] Gerhard Agrinz GmbH. 2010. Biogas Purificion and Assessment of The Nural
Gas Grid. Austria : Leitbnitz hal 10.
[41] DS, El Monayeri , Atta N. N., El Mokadem S.M, dan Aboulfotoh A. M. 2013.
Improvement of Anaerobic Digesters Using Pre-Selected Micro-Organisms.
International Water Technology Journal, IWTJ. Vol. 3 –No. 1.
[42] Intanoo, Patcharee, Erdogen Gulari dan Sumaeth Chavadej. Simultaneous
Production of Hydrogen and Methane from Cassava Wastewater Using a Two Stage
Upflow Anaerobic Sludge Blanket System under Thermophilic Operation. 2013. The
Italian Association of Chemical Engineering. ISBN 978-88-95608-30-3; ISSN
2283-9216.
[43] Pap, Bernadett, Ádám Györkei, Iulian Zoltan Boboescu, Ildikó K. Nagy,
Tibor Bíró, Éva Kondoros, Gergely Maróti. 2014. Temperature-Dependent
Transformation of Biogas-Producing Microbial Communities Points to The
Increased Importance of Hydrogenotrophic Methanogenesis Under Thermophilic
Operation. Bioresource Technology.
[44] Liu, Xin Yan, Li Wei, Fang Ma, Xiao Chen Huang, Zhen Zhao. 2013. Research
Progress of Methanogens Methanogenic Metabolic Pathway and its Ecological
[45] Barik, Debabrata, S. Murugan. 2015. Assessment Of Sustainable Biogas
Production from De-Oiled Seed Cake of Karanja - An Organic Industrial Waste
From Biodiesel Industries. Fuel 148 (2015) 25–31.
[46] Veeken, A., Kalyuzhnyi, S., Scharff, H., Hamelars, B. 2000. Effect of pH and
VFA on Hydrolysis of Organic Solid Waste. Journal of Environmental Engineering,
Vol. 126, No.12, hal 1076 – 1081Ruter, John M. 2012. Importance of Water Quality
in Container Plant Production. National Proceedings: Forest and Conservation
Nursery Associations.
[47] Baldrian, Petr, Jaroslav Šnajdr, Věra Merhautová, Petra Dobiášová, Tomáš
Cajthaml, Vendula Valášková. 2013. Responses of The Extracellular Enzyme
Activities in Hardwood Forest to Soil Temperature and Seasonality and The
Potential Effects of Climate Change. Soil Biology and Biochemistry Volume 56,
January 2013, hal. 60–68.
[48] Subramanyam, Revanuru dan Indra Mani Mishra. 2013. Characteristics Of
Methanogenic Granules Grown on Glucose in An Upflow Anaerobic Sludge Blanket
Reactor. Biosystem Engineering 114 hal 113-123.
[49] Moset Veronica, Morten Poulsen, Radziah Wahid, Ole Højberg dan Henrik Bjarne Mølle. 2015. Mesophilic Versus Thermophilic Anaerobic Digestion of Cattle
Manure: Methane Productivity and Microbial Ecology. Microbial Biotechnology
Journal.
[50] XJ Zhang. 2014. Anaerobic Process; Comprehensive Water Quality and
Purification, Volume 3 Subbab 3.7 : hal. 108-122.
[51] Rene Moletta. 2011. Anaerobic Digestion Monitoring and Control. Laboratoire
de Biotechnologie de l’Environment.
[52] R. Borja. 2011. Biogas Production; Downstream Processing and Product
Recovery. Subbab 2.55 hal. 785-798.
[53] Ken Anderson, Paul Sallis, Sinan Uyanik. 2003. Anaerobic Treatment
Processes” The Handbook of Water and Wastewater Microbiology. hal. 391-426,
ISBN 0-12-470100-0.
[54] Abdurahman, N.H., N.H. Azhari dan Y.M. Rosli. 2013. Ultrasonic Membrane
International Perspectives on Water Quality Management and Pollutant Control.
ISBN 978-953-51-0999-0.
[55] Henry Loekito. 2002. Teknologi Pengelolaan Limbah Industri Kelapa Sawit.
Jurnal Teknologi Lingkungan, 3(3) 2002: hal. 242-250.
[56] Yee-Shian Wong, Tjoon Tow Teng, Soon-An Ong, M. Norhashimah, M.
Rafatullah, Hong-Chen Lee, “Anaerobic Acidogenesis Biodegradation of Palm Oil
Mill Effluent Using Suspended Closed Anaerobic Bioreactor SCABR) at Mesophilic
Temperature”, Procedia Environmental Sciences, 18 (2013), hal: 433–441.
[57] Yee-Shian Wong, Tjoon Tow Teng, Soon-An Ong, M. Norhashimah, M.
Rafatullah, Hong-Chen Lee, “Methane gas Production from Palm Oil Wastewater An
Anaerobic Methanogenic Degradation Process in Continuous Stirrer Suspended
Closed Anaerobic Reactor”, Journal of the Taiwan Institute of Chemical Engineers,
2013.
[58] Piyarat Boonsawang, Athirat rerngnarong, Chakrit Tongurai, Sumate
Chaiprapat, ”Effect of pH, OLR and HRT on Performance of Acidogenic and
Methanogenic Reactors for Treatment of Biodiesel Wastewater”, Desalination and
Water Treatment, 2014, hal: 1–11.
[59] A.K. Kivaisi dan M. Mtila, ”Production of Biogas from Water Hyacinth
(Eichhornia crassipes) (Mart) (Solms) in a Two-Stage Bioreactor”, World Journal of
Microbiology and Biotechnology, 14 (1998), hal: 125–131.
[60] APHA. 1999. Standard Methods for the Examination of Water and Waste
Water. Edisi 20. Washington DC : APHA, AWWA, WEF.
[61] Yoshimassa, Tomiuchi. 2009. Current Strategy of Metawater on Methane
Fermentation of Palm Oil Plant Wastewater. Metawater Co.,Ltd.
[62] Standar Nasional Indonesia. Air dan Air Limbah – Bagian 15: Cara uji
Kebutuhan Oksigen Kimiawi (KOK) Refluks Terbuka dengan Refluks Terbuka secara
Titrimetri. SNI 06-6989.15-2004.
[63] Keputusan Menteri Negara Lingkungan Hidup, 1995, Nomor:
KEP-51/MENLH/10/1995.
[64] Dareioti, Margarita Andreas, Aikaterini Ioannis Vavouraki, Michaael Kornaros.
Maximization of Bio-Hydrogen Production: A Lab-Scalae Evaluation Using Batch
Tests. Bioresource Technology 162 (2014) hal. 218-227.
[65] Dr. C. Yans Guardia Puebla, Dr.C. Suyén Rodríguez Pérez Ing. Yennys Cuscó
Varona, M.C. Janet Jiménez Hernández Dr.C. Víctor Sánchez Girón. 2014.
Two-Phase Anaerobic Digestion Of Coffee Wet Wastewater: Effect Of Recycle On
Anaerobic Process Performance. Revista Ciencias Técnicas Agropecuarias,
ISSN-1010-2760, Vol. 23, No. 1 hal. 25-31.
[66] Zhang, Jingxin, Yaobin Zhang, Xie Quan, Shuo Chen. 2015. Enhancement Of
Anaerobic Acidogenesis By Integrating An Electrochemical System Into An
Acidogenic Reactor: Effect Of Hydraulic Retention Times (HRT) And Role Of
Bacteria And Acidophilic Methanogenic Archaea. Bioresource Technology 179, hal.
43-49
[67] Medina-Herrera, M. Rodríguez-García, A, Montoya-Herrera, L.,
Cárdenas-Mijangos, J., Godínez-Mora-Tovar, L.A., Bustos-Bustos E., Rodríguez-Valadez, F.J.
Dan Manríquez-Rocha J. 2014. Anaerobic Digestion Of Slaughterhouse Solid Waste
For The Optimization Of Biogas Production. International Journal Of Environment.
Res., 8(2):483-492.
[68] Wong, Yee-Shian, Tjoon Tow Teng, Soon-An Ong, M. Norhashimah M.
Rafatullahb And Hong-Chen Lee. 2013. Anaerobic Acidogenesis Biodegradation Of
Palm Oil Mill Effluent Using Suspended Closed Anaerobic Bioreactor (SCABR) at
Mesophilic Temperature. International Symposium On Environmental Science And
Technology.
[69] Ewelina Jankowska, Joanna Chwiałkowska, Mikołaj Stodolny, Piotr
Oleskowicz-Popiel. 2015. Effect of pH and Retention Time on Volatile Fatty Acids Production During
Mixed Culture Fermentation. Bioresource Technology Volume 190 hal.274-280.
[70] Kaushalya C. Wijekoon, Chettiyappan Visvanathan, Amila Abeynayaka,. 2011.
Effect of Organic Loading Rate on VFA Production, Organic Matter Removal and
Microbial Activity of a Two-Stage Thermophilic Anaerobic Membrane Bioreactor.
Bioresouce Technology, 102 : 5353–5360.
[71] R. Borja. 2011. Biogas Production. Downstream Processing and Product
[72] Xiaoying Dong, Lijie Shao, Yan Wang, Wei Kou, Yanxin Cao, Dalei Zhang.
2015. Biogas by Two-Stage Microbial Anaerobic and Semi- Continuous Digestion of
Chinese Cabbage Waste. Energy, Resource and Environmental Technology Vol 23
hal. 847-852.
[73] Maa, Huijun, Xingchun Chen, He Liu, Hongbo Liu, Bo Fu. 2016. Improved
Volatile Fatty Acids Anaerobic Production From Waste Activated Sludge By pH
Regulation: Alkaline or Neutral pH? Waste Management Vol 48 hal. 397-403.
[74] Zhao, Xu, Lijuan Wang, Xuebin Lu, Shuting Zhang. 2014. Pretreatment of
Corn Stover With Diluted Acetic Acid for Enhancement of Acidogenic Fermentation.
Bioresource Technology Vol 158 hal. 12-18.
[75] Afrilia, Intan. 2015. Pengaruh Hydraulic Retention Time (HRT) dan pH pada
Proses Asidogenesis Limbah Cair Pabrik Kelapa Sawit (LCPKS) pada Keadaan
Ambient. Medan: Universitas Sumatera Utara.
[76] Lintang, Ramlan. 2015. Pengaruh Hydraulic Retention Time (HRT) dan pH
pada Proses Asidogenesis Limbah Cair Pabrik Kelapa Sawit (LCPKS) Menggunakan
BAB III
METODOLOGI PENELITIAN
3.1 LOKASI PENELITIAN
Penelitian ini dilakukan di Laboratorium Ekologi, Departemen Teknik
Kimia, Fakultas Teknik, Universitas Sumatera Utara (USU), Medan.
3.2 BAHAN DAN PERALATAN 3.2.1 Bahan-Bahan
1. Starter dari hasil olahan penelitian asidogenesis sebelumnya
2. Sampel LCPKS dari fat pit PKS Adolina
3. Asam klorida (HCl) 0,1 N
4. Aquadest (H2O)
5. Natrium Bikarbonat (NaHCO3)
3.2.2 Peralatan 3.2.2.1 Peralatan Utama
1. Fermentor tangki berpengaduk/jar fermentor (EYELA model No:
MBF 300ME)
2. Pompa sludge/slurry pump (HEISHIN, model No.:3NY06F)
3. Gas meter (SHINAGAWA, model No.:W-NK-0.5B)
4. Tangki umpan (service tank)
5. Pengaduk
6. Sensor temperatur
7. pH elektroda
8. Timer (OMRON, model No.:H5F)
9. Botol penampungan keluaran fermentor
3.2.2.2 Peralatan Analisa
1. Buret 25 ml
2. Timbangan analitik
3. Oven
4. Desikator
5. Pipet volumetrik
6. Karet penghisap
7. Pengaduk magnetic
[image:37.595.118.543.211.649.2]8. Furnace
3.3 TAHAPAN PENELITIAN
3.3.1 Analisis Bahan Baku Limbah Cair Pabrik Kelapa Sawit (LCPKS) 3.3.1.1Analisis pH
Adapun prosedur analisis pH adalah [60]:
1) Kalibrasi pH meter dilakukan ke dalam pH 4, pH 7, dan pH 10.
2) Bagian elektroda dari pH meter dicuci dengan aquadest.
3) Elektoda dimasukkan ke dalam sampel yang akan diukur pH-nya.
4) Nilai bacaan pH meter ditunggu sampai konstan lalu dicatat nilai
bacaannya.
3.3.1.2Analisis M-Alkalinity
Adapun prosedur analisis M-alkalinity adalah [61]:
1) Sampel dimasukkan sebanyak 5 ml ke dalam beaker glass lalu
ditambahkan dengan aquadest hingga volume larutan 80 ml.
2) Beaker glass diletakkan di atas magnetic stirrer, dan diletakkan pH
elektroda di dalam beaker gelas, kemudian stirrer dihidupkan dan
kecepatan diatur sedemikian rupa hingga sampel tercampur sempurna
dengan aquadest.
3) Campuran dititrasi dengan larutan HCl 0,1 N hingga pH mencapai 4,8 ±
0,02.
4) Analisis M-Alkalinity dilakukan untuk Limbah Cair Pabrik Kelapa Sawit
(LCPKS) dan limbah fermentasi pada Jar fermentor.
5) M-Alkalinity dapat dihitung berdasarkan rumus sebagai berikut:
M-Alkalinity =
Sampel Vol
5 x 1000 x M x terpakai yang
Vol.HCl HCl
3.3.1.3Analisis Total Solids (TS)
Adapun prosedur analisis Total Solids (TS) adalah [60]:
1) Cawan penguap kosong yang telah dibersihkan, dipanaskan pada 105oC di dalam oven selama 1 jam. Apabila akan dilanjutkan untuk analisis zat
tersuspensi organik, cawan dipanaskan pada 550oC, selama 1 jam. 2) Cawan didinginkan selama 15 menit di dalam desikator, lalu ditimbang.
3) Sampel dikocok merata, lalu dituangkan ke dalam cawan. Volume sampel
diatur sehingga berat residu antara 25-250 mg.
4) Cawan berisi sampel dimasukkan ke dalam oven, suhu 98oC untuk mencegah percikan akibat didihan air di dalam cawan. Namun bila volum
sampel kecil dan dinding cawan cukup tinggi maka langkah ini tidak perlu.
5) Pengeringan diteruskan di dalam oven dengan suhu 103-105oC selama 1 jam.
6) Cawan yang berisi residu zat padat tersebut didinginkan di dalam desikator
sebelum ditimbang.
7) Langkah 5 dan 6 diulang sampai didapat berat yang konstan atau
berkurang berat lebih kecil 4% berat semula atau 0,5 mg, biasanya
pemanasan 1-2 jam sudah cukup. Penimbangan harus dikerjakan dengan
cepat untuk mengurangi galat.
8) Kandungan TS dapat dihitung berdasarkan rumus sebagai berikut:
mL sampel, volume
1000 B) -(A tal/L
padatan to
mg = ×
Keterangan: A = berat residu kering + cawan porselen, mg
B = berat cawan porselen, mg
3.3.1.4Analisis Volatile Solids (VS)
Adapun prosedur analisis Volatile solids (VS) adalah [60, 61]:
1) Cawan penguap setelah dari TS dipanaskan dengan menggunakan muffle
furnace pada suhu 550oC selama 1 jam.
2) Setelah itu cawan penguap didinginkan di dalam desikator hingga
mencapai suhu kamar.
3) Berat cawan penguap ditimbang.
4) Kandungan VS dapat dihitung berdasarkan rumus sebagai berikut:
mL sampel, volume
1000 B) -(A latil/L
padatan vo
mg = ×
Keterangan: A = berat residu+cawan porselen sebelum pembakaran, mg
B = berat residu + cawan porselen setelah pembakaran, mg (3.2)
3.3.1.5Analisis Total Suspended Solids (TSS)
Adapun prosedur analisis Total Suspended Solids (TSS) adalah [60]:
1) Berat kertas saring kering yang digunakan ditimbang.
2) Kertas saring dibasahi dengan sedikit air suling.
3) Sampel diaduk dengan magnetic stirrer untuk memperoleh sampel yang
lebih homogen.
4) Sampel dipipetkan ke penyaringan dengan volume tertentu pada waktu
contoh diaduk dengan magnetic stirer.
5) Kertas saring dicuci atau disaring dengan 3 x 10 ml aquadest.
6) Kertas saring dipindahkan secara hati-hati dari peralatan penyaring ke
wadah timbang dengan aluminium sebagai penyangga.
7) Dikeringkan di dalam oven setidaknya selama 1 jam pada suhu 103ºC
sampai dengan 105ºC, didinginkan dalam desikator untuk
menyeimbangkan suhu dan massanya.
8) Tahapan pengeringan, pendinginan dalam desikator, dan penimbangan
diulangi sampai diperoleh berat konstan atau sampai perubahan berat lebih
kecil dari 4% terhadap penimbangan sebelumnya atau 0,5 mg.
9) Kandungan TSS dapat dihitung berdasarkan rumus sebagai berikut:
mL sampel, volume
1000 B) -(A total/L
rsuspensi padatan te
mg = ×
Keterangan: A = berat kertas saring + berat residu, mg
B = berat kertas saring, mg
3.3.1.6Analisis Volatile Suspended Solids (VSS)
Adapun prosedur analisis Volatile Solids (VSS) adalah [60]:
1) Sampel residu hasil analisa TSS dibakar mengunakan api bunsen di dalam
cawan porselen yang telah dikering dan diketahui beratnya.
2) Setelah terbakar sempurna atau bebas asap, selanjutnya sampel diabukan
di dalam furnace pada suhu 550oC selama 1 jam.
3) Setelah 1 jam, furnace dimatikan dan sampel diambil setelah suhu furnace
sekitar 100oC dan disimpan di dalam desikator selama 15 menit lalu ditimbang.
mL sampel, volume
1000 B) -(A volatil/L
rsuspensi padatan te
mg = ×
Keterangan: A = berat residu + cawan porselen sebelum pembakaran, mg
B = berat residu + cawan porselen setelah pembakaran, mg
3.3.1.7Analisis Chemical Oxygen Demand (COD)
Adapun prosedur analisis Chemical Oxygen Demand (COD) adalah [62]:
1) Dimasukkan 10 ml contoh uji ke dalam erlenmeyer 250 ml.
2) Ditambahkan 0,2 g serbuk raksa (II) sulfat (HgSO4) dan beberapa batu didih.
3) Ditambahkan 5 ml larutan kalium dikromat, (K2Cr2O7) 0,25 N.
4) Ditambahkan 15 ml pereaksi asam sulfat (H2SO4) – perak sulfat (Ag2SO4)
perlahan-lahan sambil didinginkan dalam air pendingin.
5) Dihubungkan dengan pendingin Liebig dan dididihkan di atas hot plate
selama 2 jam.
6) Didinginkan dan dicuci bagian dalam dari pendingin dengan air suling hingga
volume contoh uji menjadi lebih kurang 70 ml.
7) Didinginkan sampai temperatur kamar, ditambahkan indikator ferroin 2
sampai dengan 3 tetes, dititrasi dengan larutan ferro ammonium sulfat atau
FAS 0,1 N sampai warna merah kecoklatan, dicatat kebutuhan larutan FAS.
8) Langkah 1 sampai dengan 7 dilakukan terhadap air suling sebagai blanko.
Kebutuhan larutan FAS dicatat. Analisis blanko ini sekaligus melakukan
pembakuan larutan FAS dan dilakukan setiap penentuan COD.
9) Kandungan COD dapat dihitung berdasarkan rumus sebagai berikut:
sampel ml
N)8000 )(
B A ( O
mg/l 2 = −
Keterangan: A = ml FAS untuk titrasi blanko
B = ml FAS untuk titrasi sampel
N = Normalitas FAS
8000 = berat miliekivalen oksigen ×1000 ml/l
(3.5)
3.3.2 Loading Up dan Operasi Target
Adapun prosedur loading up dan operasi target adalah:
1) Starter asidogenesis sebanyak 2 L dimasukkan ke dalam fermentor.
2) Bahan baku LCPKS dimasukkan ke dalam tangki umpan.
3) Kecepatan di dalam tangki umpan LCPKS segar diatur hingga kecepatan
300 rpm agar larutan LCPKS akan tercampur dengan baik.
4) Bahan baku LCPKS dialirkan dari tangki umpan ke dalam fermentor.
5) Suhu di dalam fermentor selama proses loading up dan operasi target
dijaga pada suhu kamar dengan kecepatan pengadukan pada 200 rpm.
6) HRT awal dimulai dengan HRT 20 hari untuk adaptasi hidrolitik bakteri
dengan umpan, dimasukkan secara bertahap yaitu 2 kali sehari.
7) Setelah 15 hari, percobaan dilanjutkan untuk HRT 15, 10, dan 4 hari.
Dilakukan analisis untuk tiap HRT.
8) pH di dalam fermentor di atur 6 untuk loading up dan 5,5; 5 dan 4,5 pada
operasi target dengan penambahan NaHCO3 hingga pH yang dinginkan
tercapai. Dilakukan analisis untuk setiap run.
3.3.3 Pengujian Sampel (Sampling)
Adapun prosedur yang dilakukan untuk pengujian sampel adalah sama
seperti prosedur yang dilakukan untuk analisis bahan baku, ditambah dengan
analisis VFA, sedangkan analisis gas dilakukan jika pada penelitian ada terbentuk
[image:42.595.109.542.557.735.2]gas yaitu gas CO2 dan H2S.
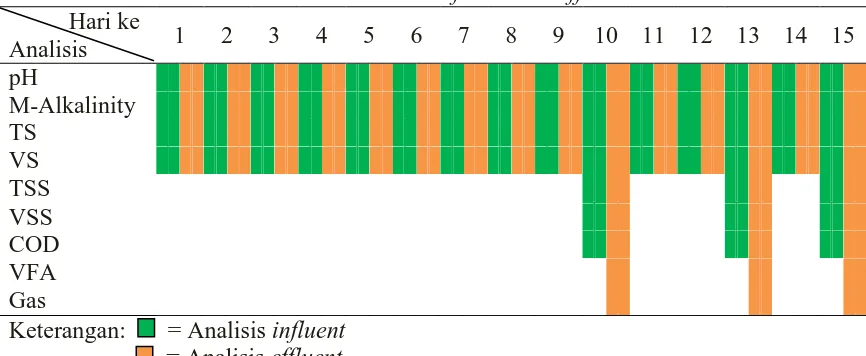
Tabel 3.1 Jadwal Analisis Influent dan Effluent Hari ke
Analisis 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 pH M-Alkalinity TS VS TSS VSS COD VFA Gas Keterangan: = Analisis influent
3.4 JADWAL PENELITIAN
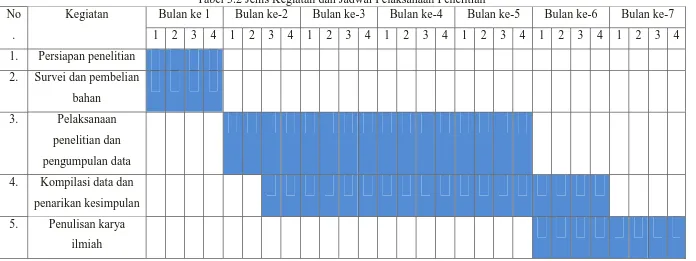
[image:43.842.80.776.176.437.2]Pelaksanaan penelitian direncanakan selama 7 (tujuh) bulan. Jenis kegiatan dan jadwal pelaksanaannya dapat dilihat pada Tabel 3.2.
Tabel 3.2 Jenis Kegiatan dan Jadwal Pelaksanaan Penelitian No
.
Kegiatan Bulan ke 1 Bulan ke-2 Bulan ke-3 Bulan ke-4 Bulan ke-5 Bulan ke-6 Bulan ke-7
1 2 3 4 1 2 3 4 1 2 3 4 1 2 3 4 1 2 3 4 1 2 3 4 1 2 3 4
1. Persiapan penelitian
2. Survei dan pembelian
bahan
3. Pelaksanaan
penelitian dan
pengumpulan data
4. Kompilasi data dan
penarikan kesimpulan
5. Penulisan karya
BAB IV
HASIL DAN PEMBAHASAN
4.1 KARAKTERISTIK LIMBAH CAIR PABRIK KELAPA SAWIT (LCPKS)
Bahan baku berupa LCPKS yang digunakan dalam penelitian ini berasal dari
PTPN IV PKS Adolina. Berikut hasil analisis karakteristik LCPKS yang digunakan
[image:44.595.117.521.261.516.2] [image:44.595.115.522.263.515.2]pada Tabel 4.1 dibawah ini
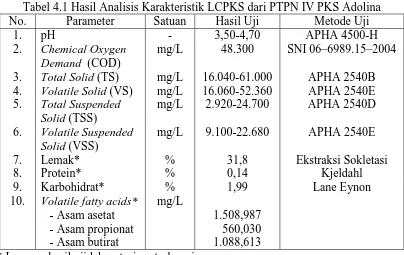
Tabel 4.1 Hasil Analisis Karakteristik LCPKS dari PTPN IV PKS Adolina
No. Parameter Satuan Hasil Uji Metode Uji
1. pH - 3,50-4,70 APHA 4500-H
2. Chemical Oxygen Demand (COD)
mg/L 48.300 SNI 06–6989.15–2004
3. Total Solid (TS) mg/L 16.040-61.000 APHA 2540B 4. Volatile Solid (VS) mg/L 16.060-52.360 APHA 2540E 5. Total Suspended
Solid (TSS)
mg/L 2.920-24.700 APHA 2540D
6. Volatile Suspended Solid (VSS)
mg/L 9.100-22.680 APHA 2540E
7. Lemak* % 31,8 Ekstraksi Sokletasi
8. Protein* % 0,14 Kjeldahl
9. Karbohidrat* % 1,99 Lane Eynon
10. Volatile fatty acids*
-Asam asetat -Asam propionat -Asam butirat
mg/L
1.508,987 560,030 1.088,613 * Laporan hasil uji laboratorium terlampir
Tabel 4.1 menunjukkan hasil analisis LCPKS dari PKS Adolina. Berdasarkan
tabel, nilai COD dan TSS yang diperoleh sebesar 41.818 mg/L dan 2.920–24.700
mg/L. Nilai ini berada di atas ambang baku mutu limbah buangan industri, dimana
parameter COD dan TSS maksimum yang diperbolehkan masing-masing sebesar 500
mg/L dan 300 mg/L [63], Selain itu, nilai pH yang berkisar antara 3,70-4,70
menunjukkan LCPKS bersifat korosif dan berpotensi mencemari lingkungan jika
langsung dibuang tanpa penanganan terlebih dahulu.
Walaupun berpotensi menjadi polutan, LCPKS dapat dimanfaatkan sebagai
bahan baku pembuatan biogas melalui proses digestasi anaerob karena mengandung
organik tertinggi berupa lemak, kemudian protein dan yang terendah adalah
karbohidrat. Pemanfaatan LCPKS menjadi biogas dapat mengurangi dampak
pencemaran lingkungan dan meningkatkan sumber energi terbarukan.
4.2 HASIL PENELITIAN PROSES LOADING UP
Proses loading up pada penelitian ini dilakukan agar mikroorganisme yang
berperan dalam proses asidogenesis dapat tumbuh dan beradaptasi dengan baik pada
starter yang berasal dari kolam pengasaman PTPN III PKS Torgamba, sehingga
proses asidogenesis dapat berlangsung pada HRT operasi target. Selama proses
loading up, fermentor dioperasikan dengan penurunan HRT dari 20, 15, 10 dan 4
hari pada temperatur termofilik (55oC) dengan laju pengadukan 200 rpm. Selama
proses loading up, pH dikontrol konstan 6 (± 0,2) dengan penambahan natrium
bikarbonat (NaHCO3). Pertumbuhan mikroba pada saat proses loading up dapat
dilihat dari analisis pH, alkalinitas, TS, VS, TSS, VSS, COD, dan VFA.
4.2.1 Pengaruh HRT terhadap pH dan Alkalinitas
Digestasi anaerob sangat dipengaruhi oleh perubahan pH. Untuk menghindari
terbentuknya asam propionat berlebih dan menghambat aktivitas mikroba
metanogenesis, pH pada proses asidogenesis sebaiknya berkisar antara 6,0 sampai
6,5 [64]. Berdasarkan hal ini, pH fermentor pada proses loading up dipertahankan 6
(± 0,2) dengan penambahan NaHCO3 pada LCPKS yang diumpankan. Tujuannya
agar tidak terjadi perbedaan pH yang signifikan antara LCPKS yang diumpankan
dengan LCPKS di dalam fermentor dan proses asidogenesis yang diharapkan dapat
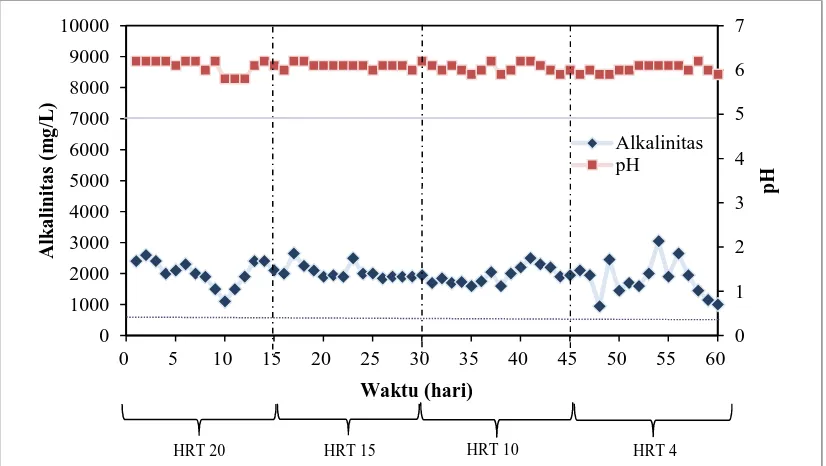
tercapai. Pengaruh HRT terhadap pH dan alkalinitas ditunjukkan pada Gambar 4.1
Gambar 4.1 Pengaruh HRT terhadap pH dan Alkalinitas
Nilai alkalinitas berfluktuasi seiring dengan perubahan pH dalam fermentor.
Nilai alkalinitas yang diperoleh pada HRT 20 berfluktuasi antara 1.100 – 2.600
mg/L, pada HRT 15 alkalinitas berfluktuasi antara 1.850 – 2.650 mg/L, pada HRT 10
alkalinitas berfluktuasi antara 1.600 – 2.200 mg/L, dan pada HRT 4 alkalinitas
berfluktuasi antara 950 – 2.650 mg/L. Meski demikian, nilai alkalinitas yang
diperoleh pada penelitian ini termasuk kedalam rentang yang masih wajar yaitu 830
-7.000 mg/L [65].
Oleh sebab itu, pada proses loading up tahapan asidogenesis LCPKS pada
keadaan termofilik, penurunan HRT tidak memberikan dampak yang signifikan
terhadap nilai pH dan alkalinitas. Grafik alkalinitas berfluktuasi pada kisaran pH dan
alkalinitas proses asidogenesis.
4.2.2 Pengaruh HRT terhadap Profil Pertumbuhan Mikroba
Hydraulic Retention Time (HRT) menyatakan lamanya umpan berada dalam
bioreaktor. HRT yang pendek menguntungkan dari segi ukuran reaktor, terutama di
tempat-tempat dengan ruang lahan yang terbatas atau kapasitas operasional reaktor
anaerobik yang kecil [18]. HRT pendek biasa digunakan dalam tahap asidogenesis
untuk mempertahankan pH rendah agar pertumbuhan bakteri hidrolisis-asidogenesis
dapat meningkat. Namun HRT yang terlalu rendah dapat menyebabkan proses
hidrolisis zat organik tidak sempurna, dan hal ini akan menurunkan efisiensi proses
0 1 2 3 4 5 6 7 0 1000 2000 3000 4000 5000 6000 7000 8000 9000 10000
0 5 10 15 20 25 30 35 40 45 50 55 60
p H A lk a li n it a s (m g /L ) Waktu (hari) Alkalinitas pH HRT 4 HRT 15 HRT 10
asidogenesis [66]. Pertumbuhan mikroba dapat diukur secara tidak langsung dengan
analisa VSS [67]. Konsentrasi VSS dapat menjadi indikator pertumbuhan mikroba
aktif dalam reaktor. Adapun pengaruh HRT terhadap pertumbuhan mikroba
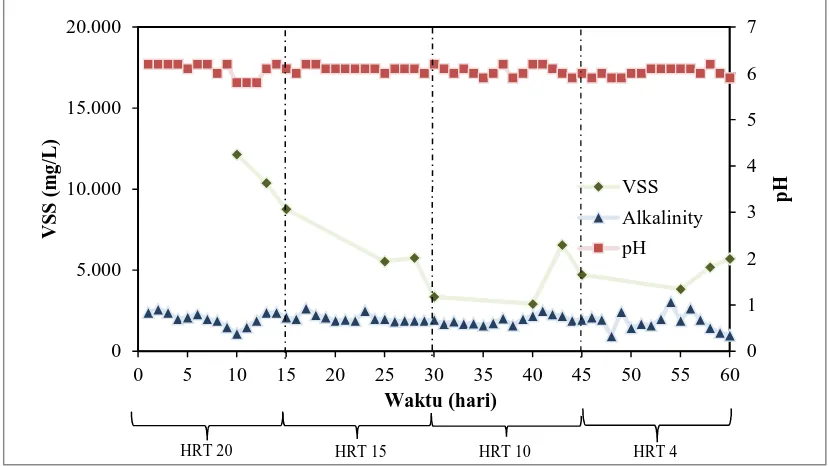
[image:47.595.113.528.185.418.2]ditunjukkan pada gambar 4.2.
Gambar 4.2 Pengaruh HRT terhadap Profil Pertumbuhan Mikroba
Gambar 4.2 menunjukkan konsentrasi VSS yang berfluktuasi seiring dengan
perubahan pH dan alkalinitas. Pada HRT 20 terjadi penurunan konsentrasi VSS
dengan rentang nilai antara 8.760–12.140 mg/L. Hal ini disebabkan oleh
pertumbuhan mikroba dalam proses digestasi anaerobik yang membutuhkan waktu
untuk beradaptasi dalam mengkonsumsi substrat yang diumpankan ke dalam
fermentor [31]. Pada HRT 15 dan 10 konsentrasi VSS mengalami fluktuasi dengan
rentang nilai masing-masing antara 3.360–5.540 mg/L dan 2.940–6.560 mg/L,
namun perbedaan nilai VSS tidak terlalu jauh, sehingga pada HRT ini pertumbuhan
mikroba mulai stabil. Konsentrasi VSS mengalami peningkatan pada HRT 4 dengan
rentang nilai antara 3.840–5.700 mg/L, hal menandakan bahwa pertumbuhan
mikroba pada fermentor cukup stabil, mikroba mampu beradaptasi dan efektif dalam
mengkonsumsi substrat yang diumpankan ke dalam fermentor. Pertumbuhan
mikroorganisme pada HRT 4 menunjukkan hasil yang lebih baik walaupun
pertumbuhan mikroba yang lebih tinggi diperoleh pada HRT 10. Hal tersebut
0 1 2 3 4 5 6 7
0 5.000 10.000 15.000 20.000
0 5 10 15 20 25 30 35 40 45 50 55 60
p
H
V
S
S
(
m
g
/L
)
Waktu (hari)
VSS Alkalinity pH
HRT 10
dikarenakan karena lebih banyaknya bahan baku LCPKS yang dapat diolah menjadi
VFA.
Oleh sebab itu, pada proses loading up tahapan asidogenesis LCPKS pada
keadaan termofilik, penurunan HRT memberikan dampak yang signifikan terhadap
konsentrasi VSS, dimana seiring dengan menurunnya HRT diperoleh konsentrasi
VSS yang stabil.
4.2.3 Pengaruh HRT terhadap Reduksi Chemical Oxygen Demand (COD)
Chemical Oxygen Demand (COD) merupakan parameter yang menunjukkan
banyaknya senyawa organik yang terdapat dalam bahan baku LCPKS sebagai
influent dan keluaran dari fermentor sebagai effluent. Pada proses asidogenesis
LCPKS ini diharapkan penurunan nilai COD yang tidak terlalu besar dikarenakan
hasil yang didapat merupakan produk intermediet berupa VFA yang nantinya akan
dilanjutkan pada proses metanogenesis. Pengaruh HRT terhadap Reduksi COD di
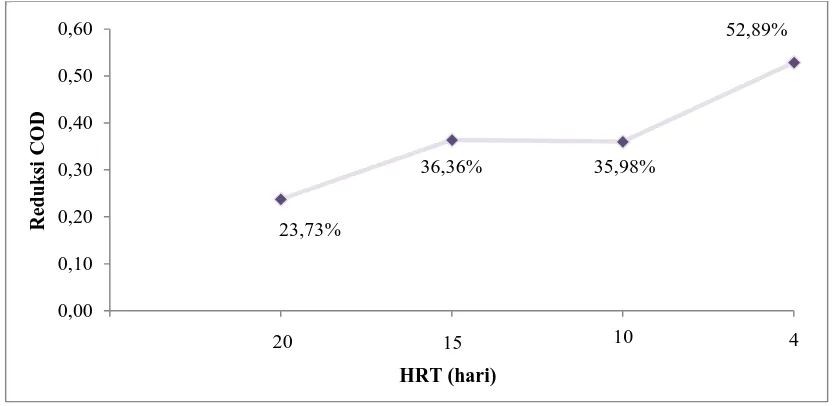
[image:48.595.112.529.395.598.2]tunjukkan pada Gambar 4.3 dibawah ini.
Gambar 4.3 Pengaruh HRT terhadap Reduksi Chemical Oxygen Demand (COD)
Gambar 4.3 menunjukkan bahwa pada perubahan HRT mulai dari HRT 20,
15, 10 dan 4 profil reduksi COD terhadap perubahan HRT cenderung meningkat
meskipun terjadi penurunan COD pada HRT 10. Reduksi COD yang diperoleh pada
HRT 20 sebesar 23,73%, pada HRT 15 sebesar 36,36%, pada HRT 10 sebesar
35,98%, dan pada HRT 5 sebesar 52,89%.
23,73%
36,36% 35,98%
52,89%
0,00 0,10 0,20 0,30 0,40 0,50 0,60
0 15 30 45 60
R
ed
u
k
si
C
O
D
HRT (hari)
Peningkatan HRT dapat menyebabkan penurunan efisiensi reduksi COD [68].
Reduksi COD tertinggi diperoleh pada HRT 4. Hal ini kemungkinan disebabkan oleh
meningkatnya OLR (Organic Loading Rate) [38]. Dengan kata lain, substrat yang
masuk kedalam fermentor semakin banyak, sehingga pertumbuhan mikroba lebih
tinggi dibanding HRT sebelumnya.
4.2.4 Pengaruh HRT terhadap Pembentukan Volatile Fatty Acid (VFA)
Pada proses digestasi anaerobik, asidogenesis merupakan tahapan pertama
yang mengkonversikan senyawa organik menjadi VFA berantai pendek yaitu berupa
asam asetat, asam propionat dan asam butirat [16]. Pengaruh HRT terhadap
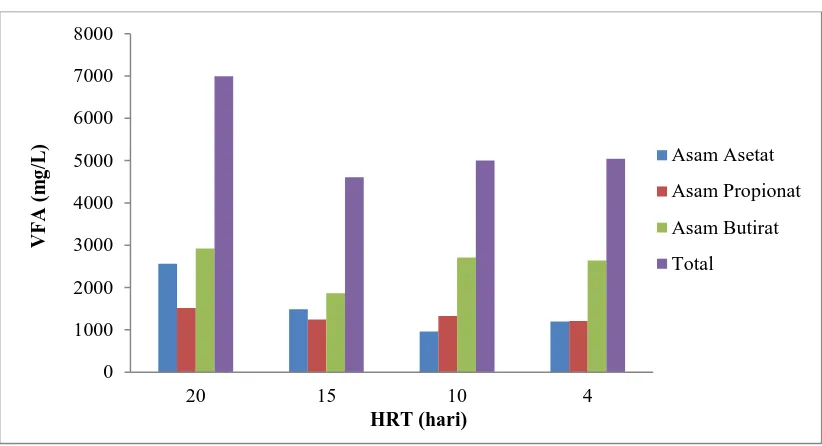
[image:49.595.115.526.307.530.2]pembentukan VFA ditunjukkan pada Gambar 4.4 dibawah ini.
Gambar 4.4 Pengaruh HRT Terhadap Pembentukan Volatile Fatty Acid (VFA)
Gambar 4.4 menunjukkan profil pembentukan total VFA yang berfluktuasi
pada HRT 20, 15, 10 dan 4. Pada HRT 20 diperoleh konsentrasi asam asetat, asam
propionat, asam butirat dan total VFA masing-masing sebesar 2560,657 mg/L;
1514,895 mg/L; 2917,388 mg/L dan 6992,24 mg/L, pada HRT 15 diperoleh
konsentrasi masing-masing sebesar 1487,088 mg/L; 1249,301 mg/; 1866,454 mg/L
dan 4602,842 mg/L, pada HRT 10 diperoleh konsentrasi masing-masing sebesar
961,4325 mg/L; 1327,206 mg/L; 2711,254 mg/L dan 4999,892 mg/L, serta pada
HRT 4 diperoleh konsentrasi masing-masing sebesar 1195,355 mg/L; 1207,817
mg/L; 2636,277 mg/L dan 5039,449 mg/L. Total VFA tertinggi diperoleh pada HRT
0 1000 2000 3000 4000 5000 6000 7000 8000
20 15 10 4
V
F
A
(
m
g
/L
)
HRT (hari)
20, hal ini kemungkinan disebabkan oleh protein dan karbohidrat terurai yang lebih
banyak tersedia pada HRT yang panjang [69].
Asam propionat, asam butirat dan asam organik lain yang terbentuk pada
proses asidogenesis akan dikonversi oleh mikroba menjadi asam asetat [38], tetapi
menurut Kaushalya C, et al, 2011 [70], asam propionat merupakan senyawa yang
paling sulit untuk dikonversi menjadi asetat akibatnya dapat menjadi inhibitor dalam
proses asidogenesis apabila konsentrasi asam propionat yang terbentuk lebih besar
dari 1.000–2.000 mg/L sedangkan konsentrasi asam butirat dapat ditolerir hingga
10.000 mg/L.
Hasil penelitian menunjukkan adanya konsentrasi asam propionat dan butirat
dengan rentang masing-masing sebesar 598-1.881 mg/L dan 715–3.941 mg/L.
Karena masih dalam batas yang ditolerir, pada proses loading up tahapan
asidogenesis LCPKS pada keadaan termofilik, penurunan HRT tidak menyebabkan
dampak inhibitor pada reaktor asidogenesis.
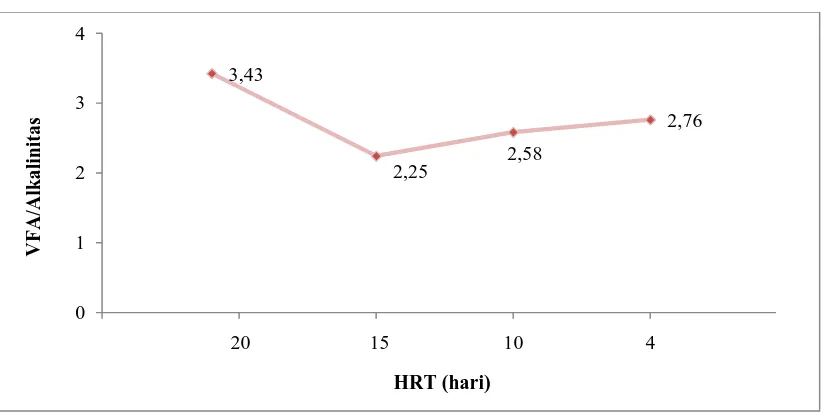
4.2.5 Pengaruh HRT terhadap Rasio VFA/Alkalinitas
Konsentrasi VFA ditunjukkan oleh konsentrasi asam asetat, asam propionat
dan asam butirat. Kestabilan sistem pada digestasi anaerob dapat ditunjukan oleh
rasio VFA/Alkalinitas. Pengaruh HRT terhadap Rasio VFA/Alkalinitas ditunjukkan
[image:50.595.116.527.493.700.2]pada Gambar 4.5 dibawah ini.
Gambar 4.5 Pengaruh HRT Terhadap Rasio VFA/Alkalinitas
3,43
2,25
2,58
2,76
0 1 2 3 4
0 5 10 15 20 25
V
F
A
/A
lk
a
li
n
it
a
s
HRT (hari)
Gambar 4.5 menunjukkan bahwa rasio VFA/alkalinitas yang diperoleh pada
perubahan HRT dari 20, 15, 10, dan 4 mengalami fluktuasi. Pada HRT 20 diperoleh
rasio VFA/alkalinitas sebesar 3,43, pada HRT 15 sebesar 2,24, pada HRT 10 sebesar
2,58, dan pada HRT 4 sebesar 2,76. Menurut Bambang Trisakti et al [17] proses
asidogenesis diasumsikan stabil pada nilai rasio VFA/alkalinitas > 1. Hasil yang
diperoleh pada proses loading up pada penelitian ini adalah rasio VFA/alkalinitas >
1. Hal tersebut membuktikan bahwa proses asidogenesis berjalan dengan baik
sehingga diperoleh nilai VFA yang lebih besar dibandingkan nilai alkalinitas. Dan
dapat disimpulkan bahwa proses asidogenesis layak dilakukan pada setiap HRT yang
yang telah dilaksanakan.
4.3 HASIL PENELITIAN VARIASI pH
Pada penelitian ini, proses digestasi anaerobik yang dilakukan dibatasi hingga
tahapan asidogenesis dengan VFA sebagai produk intermediet, dimana terdapat
rentang pH yang optimal untuk pertumbuhan mikroorganisme asidogenik sehingga
perlu dilakukan variasi pH pada penelitian ini untuk mendapatkan rentang pH terbaik
yang dapat menghasilkan konsentrasi VFA tertinggi selama proses asidogenesis
dengan bahan baku LCPKS.
Pada operasi target (variasi pH) digunakan HRT 4 yang dilangsungkan pada
keadaan termofilik dengan pengadukan 200 rpm. Pada operasi target, pengaruh pH
fermentor pada proses asidogenesis ditinjau dari perubahan pH fermentor dengan
variasi 4,5; 5; 5,5 dan 6 (±0,2). Pengaturan pH dilakukan dengan penambahan
natrium bikarbonat (NaHCO3). Metabolisme dan pertumbuhan mikroba di dalam
fermentor pada saat variasi pH dilangsungkan dapat dilihat dari hasil analisis pH,
alkalinitas, TS, VS, TSS, VSS, COD dan VFA.
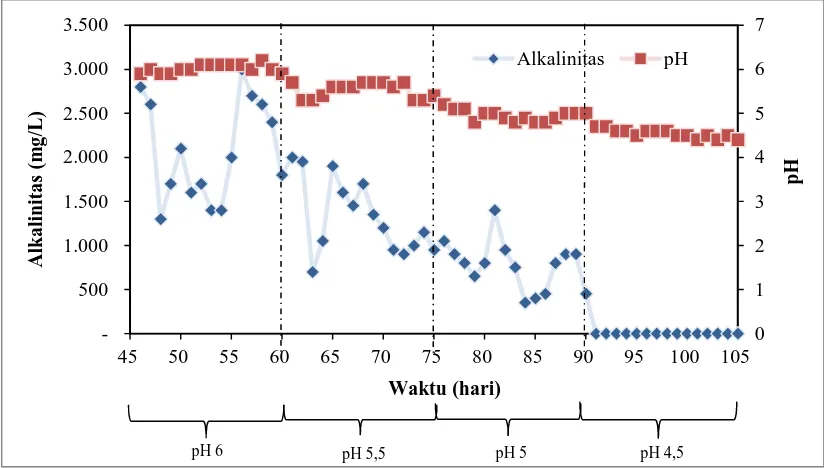
4.3.1 Pengaruh Variasi pH Terhadap Alkalinitas
Mikroorganisme yang berperan dalam proses asidogenesis umumnya dapat
tumbuh dan optimal menghasilkan asam pada pH rendah (5-6), akan tetapi
memungkinkan hingga pH 4 [45]. Pada proses asidogenesis, pH yang terlalu tinggi
dapat menyebabkan mikroorganisme penghasil metana berkembangbiak melebihi
dapat menghambat aktivitas mikroorganisme asam [71]. Alkalinitas menggambarkan
kemampuan dari proses di dalam reaktor untuk menetralisir asam organik yang
berlebihan dan menjaga pH agar tetap konstan [47]. Gambar 4.6 menunjukkan
[image:52.595.114.526.168.402.2]pengaruh variasi pH terhadap alkalinitas.
Gambar 4.6 Pengaruh Variasi pH terhadap Alkalinitas
Gambar 4.6 menunjukkan bahwa pada variasi pH 6; 5,5 dan 5 diperoleh profil
alkalinitas yang mengalami fluktuasi terhadap penurunan pH. Adapun nilai
alkalinitas pada pH 6 memiliki rentang nilai antara 1.300–3.000 mg/L, pada pH 5,5
memiliki rentang nilai antara 700–2.000 mg/L dan pada pH 5 memiliki rentang nilai
antara 450–1.400 mg/L. Sedangkan pada pH 4,5 nilai alkalinitas tidak dapat diukur
dengan metode analisis yang digunakan. Meskipun diperoleh nilai alkalinitas yang
berfluktuasi, namun alkalinitas cenderung menurun terhadap penurunan pH .
Oleh sebab itu, pada variasi pH tahapan asidogenesis LCPKS pada keadaan
termofilik, penurunan pH memberikan dampak yang signifikan terhadap alkalinitas,
dimana dengan menurunnya pH diperoleh nilai rata-rata alkalinitas yang menurun.
4.3.2 Pengaruh Variasi pH terhadap Profil Pertumbuhan Mikroba
Pertumbuhan mikroba asidogenesis selama di dalam fermentor dengan
menggunakan variasi pH, dapat digambarkan dari adanya perubahan konsentrasi
VSS seperti yang telah dijelaskan pada pembahasan di subbab 4.2.2 dimana mikroba
0 1 2 3 4 5 6 7 500 1.000 1.500 2.000 2.500 3.000 3.500
45 50 55 60 65 70 75 80 85 90 95 100 105
p H A lk a li n it a s (m g /L ) Waktu (hari) Alkalinitas pH
pH 5,5 pH 5
yang berperan dalam proses asidogenesis LCPKS ini tumbuh dengan cara
tersuspensi. Gambar 4.7 menunjukkan pengaruh variasi pH terhadap profil
[image:53.595.115.528.147.382.2]pertumbuhan mikroba melalui perubahan konsentrasi VSS.
Gambar 4.7 Pengaruh Variasi pH terhadap Profil Pertumbuhan Mikroba
Gambar 4.7 menunjukkan bahwa profil konsentrasi VSS cenderung
meningkat yang menandakan bahwa terdapat pertumbuhan mikroba. Konsentrasi
VSS meningkat pada pH 6 dengan rentang nilai antara 3.840–5700 mg/L dan terus
meningkat pada pH 5,5 dengan rentang nilai antara 4.960-6.940 mg/L; pada pH 5
konsentrasi VSS tidak terlalu jauh berbeda dengan rentang nilai antara 6.260-76.00
mg/L, dan meningkat kembali pada pH 4,5 dengan rentang nilai antara 6.580-7.540
mg/L. Kecenderungan profil pengaruh variasi pH terhadap rata-rata VSS dapat
dilihat dari Gambar 4.8 berikut.
0 1 2 3 4 5 6 7
0 5.000 10.000 15.000 20.000 25.000
45 50 55 60 65 70 75 80 85 90 95 100 105
p
H
V
S
S
(
m
g
/L
)
Waktu (hari)
VSS pH
pH 5,5 pH 5
Gambar 4.8 Pengaruh Variasi pH terhadap Rata-Rata VSS
(Error Bar Menyatakan Standar Deviasi)
Gambar 4.8 menunjukkan rata-rata VSS terhadap penurunan pH. Rata-rata
VSS pada pH 6 bernilai 4.907±960, kemudian meningkat pada pH 5,5 dengan nilai
5.947±990 mg/L, menurun pada pH 5 dengan nilai 5.580±87 mg/L, kemudian
meningkat pada pH 5 dengan nilai 7.160±510 mg/L yang merupakan nilai rata-rata
VSS tertinggi. Penurunan konsentrasi mikroba pada pH 5 menunjukkan proses
adaptasi mikroba terhadap lingkungannya.
Fluktuasi pada nilai VSS kemungkinan disebabkan oleh perubahan pH.
Perubahan pH dapat menyebabkan perubahan drastis pada jumlah mikroba yang
terdapat dalam reaktor asidogenik, karena perubahan pH mempengaruhi metabolisme
dari mikroba seperti efisiensi degradasi substrat dan pelepasan produk metabolisme
dari sel mikroba [72].
Oleh sebab itu, pada variasi pH tahapan asidogenesis LCPKS pada keadaan
termofilik, penurunan pH memberikan dampak yang signifikan terhadap konsentrasi
VSS, dimana seiring dengan menurunnya pH diperoleh konsentrasi VSS yang
meningkat.
4.3.3 Pengaruh Variasi pH terhadap Volatile Solids (VS)
Pada proses asidogenesis, senyawa organik padat akan dikonversi oleh
mikroba menjadi VFA yang merupakan senyawa terlarut [38]. Nilai reduksi Volatile
Solid (VS) menunjukkan banyaknya bahan organik padat dalam umpan yang mampu
0 2.000 4.000 6.000 8.000 10.000
45 60 75 90 105
V
S
S
m
g
/L
5 4,5 pH
direduksi oleh mikroba. Gambar 4.9 menunjukkan pengaruh variasi pH terhadap
[image:55.595.118.518.123.343.2]perubahan VS effluent.
Gambar 4.9 Pengaruh Variasi pH terhadap Volatile Solid (VS)
Gambar 4.9 menunjukkan bahwa pada pH 6, 5,5, 5 dan 4,5 profil VS
menunjukkan nilai yang fluktuatif. Pada pH 6 diperoleh VS dengan nilai 16.180 –
31.820 mg/L, pada pH 5,5 diperoleh VS dengan nilai 14.940 – 26.100 mg/L, pada
pH 5 diperoleh VS dengan nilai 14.140 – 31.900 mg/L dan pH 4,5 diperoleh VS
dengan nilai 17.560 – 31.740 mg/L Kecenderungan profil pH terhadap nilai rata-rata
[image:55.595.114.527.499.699.2]VS ditunjukkan pada Gambar 4.10 berikut ini.
Gambar 4.10 Pengaruh Variasi pH terhadap Rata-Rata Volatile Solid (VS)
(Error Bar Menyatakan Standar Deviasi)
0 1 2 3 4 5 6 7 5.000 10.000 15.000 20.000 25.000 30.000 35.000 40.000 45.000
45 50 55 60 65 70 75 80 85 90 95 100 105
p H V S ( m g /L ) Waktu (hari)
VS effluent pH
pH 5,5 pH 5
pH 6 pH 4,5
0 10000 20000 30000 40000 50000
0 15 30 45 60
VS Influent VS Effluent
Gambar 4.10 menunjukkan profil rata-rata VS effluent yang berfluktuasi
terhadap penurunan pH. Rata-rata VS effluent untuk variasi 6; 5,5; 5 dan 4,5
masing-masing bernilai 24.117±3.725 mg/L, 18.441±2.866 mg/L, 23.940±6.014 mg/L dan
21.424±3.467 mg/L, dengan persen reduksi VS masing-masing sebesar 11,9 %, 10,2
%, 15,1 % dan 14 %. Semakin tinggi nilai reduksi VS maka semakin banyak
senyawa organik padat yang berhasil direduksi oleh mikroba asidogenesis. pH netral
atau tanpa penambahan alkali, merupakan kondisi terbaik bagi berlangsungnya
proses penguraian senyawa organik menjadi VFA karena menyediakan lingkungan
yang cocok bagi mikroba asidogenesis [73]. Oleh sebab itu, pada penelitian ini, pH 5
merupakan pH terbaik bagi mikroba untuk dapat mereduksi LCPKS.
4.3.4 Pengaruh Variasi pH terhadap Reduksi Chemical Oxygen Demand (COD)
Reduksi Chemical Oxygen Demand (COD) sebagaimana telah dijelaskan
pada subbab 4.2.3 menunjukkan rasio COD influent dan COD effluent yang dapat
didegradasi oleh mikroba. Reduksi COD dapat menjadi parameter keberhasilan
sistem pengolahan yang dilakukan. Gambar 4.11 menunjukkan pengaruh variasi pH
[image:56.595.116.528.477.670.2]terhadap reduksi COD.
Gambar 4.11 Pengaruh Variasi pH terhadap Reduksi Chemical Oxygen Demand (COD)
53%
53%
44%
23%
0,00 0,10 0,20 0,30 0,40 0,50 0,60
45 60 75 90 105
R
ed
u
k
si
C
O
D
pH
Gambar 4.11 menunjukkan bahwa dengan penurunan pH diperoleh reduksi
COD yang cenderung menurun. Reduksi COD pada pH 6 bernilai 52,87%, sedikit
meningkat pada pH 5,5 menjadi 53%, kemudian menurun pada pH 5 menjadi 44%
dan reduksi COD terendah terjadi pada pH 4,5 dengan nilai 23%. Reduksi COD
tertinggi diperoleh pada pH 6. Pada proses digestasi anaerobik tahap asidognesis
reduksi COD yang tinggi harus dihindari. Reduksi COD yang tinggi memungkinkan
terbentuknya biogas atau terjadinya proses metanogenesis [68].
4.3.5 Pengaruh Variasi pH terhadap Pembentukan Volatile Fatty Acid (VFA)
VFA merupakan senyawa intermediet yang dihasilkan selama tahapan
asidogenesis dengan rantai karbon hingga enam atom. Dalam proses asidogenesis,
produksi VFA secara terus-menerus akibat kinerja mikroba dapat menurunkan pH
fermentor. Namun, akumulasi VFA tidak selalu dinyatakan dengan penurunan nilai
pH, karena terdapat kapasitas buffer pada fermentor [38]. Pada penelitian ini, VFA
ditunjukkan oleh konsentrasi asam asetat, asam propionat dan asam butirat. Gambar
[image:57.595.115.527.412.613.2]4.12 menunjukkan pengaruh variasi pH terhadap pembentukan VFA.
Gambar 4.12 Pengaruh variasi pH terhadap Pembentukan Volatile Fatty Acid (VFA)
Gambar 4.12 menunjukkan profil pembentukan total VFA yang meningkat
dengan penurunan pH. Total VFA dari masing-masing variasi pH bernilai lebih besar
dari total VFA LCPKS segar sebesar 3.157,63 mg/L yang menandakan bahwa pada
setiap variasi pH terjadi pembentukan VFA.
0 5000 10000 15000
6 5,5 5 4,5
V
F
A
(
m
g
/L
)
pH
Total VFA lebih banyak terbentuk pada pH 4,5 yaitu 10.937 mg/L. Tetapi
pada HRT ini terbentuk asam butirat yang lebih tinggi dibanding asam asetat yaitu
5.163 mg/L. Total produksi VFA yang diperoleh pada pH 5 yaitu 9.724 mg/L
merupakan yang tertinggi setelah pH 4,5. Asam asetat yang dihasilkan sebesar 4.456
mg/L, merupakan yang tertinggi dibandingkan semua variasi pH, dan asam butirat
yang dihasilkan sebesar 3.724 mg/L, lebih rendah dibandingkan pada pH 4,5.
Sehingga pada proses loading up ini pH 5 memberikan hasil VFA yang lebih baik.
Nilai pH optimum ini lebih rendah dibanding yang diperoleh pada penelitian
Bambang Trisakti, et al, 2015 [17] yang dicapai pada pH 6. Hal ini tentu lebih
menguntungkan karena dengan pH yang lebih rendah maka jumlah NaHCO3 yang
diperlukan untuk menstabilkan pH dalam proses asidogenesis menjadi berkurang.
Standar maksimum konsentrasi asam-asam organik yang terbentuk pada
proses asidogenesis te