ABSTRAK
FATMA DEWI PRAVITA PUTRI. Studi Kasus Patologi Protozoa Tetrahymena spp pada Ikan Hias Guppy (Poecilia reticulata ). Dibimbing oleh DEWI RATIH AGUNGPRIYONO dan SRI ESTUNINGSIH.
Penelitian ini bertujuan mempelajari kasus infeksi protozoa Tetrahymena spp. yang ditemukan pada ikan Guppy (Poecilia reticulata), dengan mempelajari morfologi parasit dalam irisan jaringan serta lesi yang ditimbulkannya. Sampel yang digunakan adalah ikan hias Guppy yang terlihat sakit. Pengamatan gejala klinis pada sampel ikan Guppy terlihat lesu, keseimbangannya terganggu sehingga berenang secara vertikal. Pengamatan organ ikan dilakukan secara makroskopis dan mikroskopis. Hasil pengamatan makroskopis menunjukkan bahwa pada kulit ikan terdapat lesi hemoragi pada dorsal dan lateral abdomen. Parasit protozoa berada di jaringan kulit, otot dan insang. Protozoa teridentifikasi melalui pewarnaan Hematoksilin-Eosin (HE) dan berespon positif terhadap pewarnaan Periodic Acid Schiff (PAS). Pemeriksaan morfologi protozoa menunjukkan bentuk tubuh bulat pyriform, dengan ujung anterior menyempit. Protozoa tersebut berukuran rata-rata sekitar 50,5 x 32,4 µm. Protozoa menyebabkan terjadinya erosi, hemoragi di kulit, degenerasi dan nekrosa otot serta edema di insang. Sedangkan pada hati ditemukan degenerasi lemak yang parah. Gambaran histopatologi pada usus memperlihatkan adanya edema dan kongesti di mukosa. Ikan ini dipelihara di akuarium sehingga menurunnya kualitas air atau kontaminasi lewat pakan dan penanganan yang buruk diduga sebagai predisposisi penyakit.
Kata kunci: ikan Guppy, protozoa ikan, Tetrahymena spp.
ABSTRACT
FATMA DEWI PRAVITA PUTRI. Case Study Pathology of Protozoan Tetrahymena spp. Infection in the Freshwater Ornamental Fish Guppy (Poecilia reticulata). Supervised by DEWI RATIH AGUNGPRIYONO dan SRI ESTUNINGSIH.
with gills edema. Severe fatty degeneration was presented in liver while there was edema and congestion in the intestinal mucosa. As these fishes were been cultured in the aquarium such disease is thought to be caused by the deterioration of water quality, feed contamination or a poor handling.
STUDI KASUS PATOLOGI INFEKSI PROTOZOA
Tetrahymena
spp PADA IKAN HIAS
GUPPY (
Poecilia reticulata
)
FATMA DEWI PRAVITA PUTRI
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Studi Kasus Patologi Infeksi Protozoa Tetrahymena spp pada Ikan Hias Guppy (Poecilia reticulata ) adalah benar karya saya dengan arahan dari Komisi Pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari Penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
FATMA DEWI PRAVITA PUTRI. Studi Kasus Patologi Protozoa Tetrahymena spp pada Ikan Hias Guppy (Poecilia reticulata ). Dibimbing oleh DEWI RATIH AGUNGPRIYONO dan SRI ESTUNINGSIH.
Penelitian ini bertujuan mempelajari kasus infeksi protozoa Tetrahymena spp. yang ditemukan pada ikan Guppy (Poecilia reticulata), dengan mempelajari morfologi parasit dalam irisan jaringan serta lesi yang ditimbulkannya. Sampel yang digunakan adalah ikan hias Guppy yang terlihat sakit. Pengamatan gejala klinis pada sampel ikan Guppy terlihat lesu, keseimbangannya terganggu sehingga berenang secara vertikal. Pengamatan organ ikan dilakukan secara makroskopis dan mikroskopis. Hasil pengamatan makroskopis menunjukkan bahwa pada kulit ikan terdapat lesi hemoragi pada dorsal dan lateral abdomen. Parasit protozoa berada di jaringan kulit, otot dan insang. Protozoa teridentifikasi melalui pewarnaan Hematoksilin-Eosin (HE) dan berespon positif terhadap pewarnaan Periodic Acid Schiff (PAS). Pemeriksaan morfologi protozoa menunjukkan bentuk tubuh bulat pyriform, dengan ujung anterior menyempit. Protozoa tersebut berukuran rata-rata sekitar 50,5 x 32,4 µm. Protozoa menyebabkan terjadinya erosi, hemoragi di kulit, degenerasi dan nekrosa otot serta edema di insang. Sedangkan pada hati ditemukan degenerasi lemak yang parah. Gambaran histopatologi pada usus memperlihatkan adanya edema dan kongesti di mukosa. Ikan ini dipelihara di akuarium sehingga menurunnya kualitas air atau kontaminasi lewat pakan dan penanganan yang buruk diduga sebagai predisposisi penyakit.
Kata kunci: ikan Guppy, protozoa ikan, Tetrahymena spp.
ABSTRACT
FATMA DEWI PRAVITA PUTRI. Case Study Pathology of Protozoan Tetrahymena spp. Infection in the Freshwater Ornamental Fish Guppy (Poecilia reticulata). Supervised by DEWI RATIH AGUNGPRIYONO dan SRI ESTUNINGSIH.
with gills edema. Severe fatty degeneration was presented in liver while there was edema and congestion in the intestinal mucosa. As these fishes were been cultured in the aquarium such disease is thought to be caused by the deterioration of water quality, feed contamination or a poor handling.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan Institut Pertanian Bogor
STUDI KASUS PATOLOGI INFEKSI PROTOZOA
Tetrahymena
spp PADA IKAN HIAS
GUPPY (
Poecilia reticulata
)
FATMA DEWI PRAVITA PUTRI
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
Judul Skripsi : Studi Kasus Patologi Infeksi Protozoa Tetrahymena spp pada Ikan Hias Guppy (Poecilia reticulata )
Nama : Fatma Dewi Pravita Putri NIM : B04080100
Disetujui oleh
drh Dewi Ratih A PhD, APVet Pembimbing I
Dr drh Sri Estuningsih, MSi APVet Pembimbing II
Diketahui oleh
drh Agus Setiyono, MS PhD, APVet Wakil Dekan Fakultas Kedokteran Hewan
PRAKATA
Puji dan syukur Penulis panjatkan kepada Allah atas segala karunia berupa nikmat dan rahmat-Nya sehingga Penulis dapat menyelesaikan skripsi yang
berjudul “Studi Kasus Patologi Protozoa Tetrahymena spp pada Ikan Hias Guppy
(Poecilia reticulata ).”
Terima kasih Penulis ucapkan kepada Drh. Dewi Ratih Agungpriyono Ph.D, APVet dan Dr. drh. Sri Estuningsih MSi, APVet selaku Dosen Pembimbing Skripsi, serta Dr. drh. H. Trioso Purnawarman, M.Si selaku Dosen Pembimbing Akademik yang telah memberikan motivasi, saran dan bimbingan dalam kegiatan akademik. Di samping itu, penghargaan Penulis sampaikan kepada Toko Ikanku di Dramaga Bogor yang telah mengizinkan Penulis mengambil sampel ikan dan memberikan informasi pada penelitian ini. Penghargaan Penulis sampaikan kepada dr. Farmaditya Eka Putra M.Sc, Ph.D yang telah membantu dalam pengumpulan data jurnal dan konsultasi penulisan karya ilmiah.
Ungkapan terima kasih juga disampaikan kepada ayah, ibu atas segala doa dan kasih sayangnya, serta orang-orang yang selalu mendukung dan membantu Penulis dalam melakukan penelitian: drh. Mawar Subangkit, Bapak Kasnadi, Bapak Sholeh, Mbak Kiki, dan seluruh staf Bagian Patologi FKH IPB. Ucapan terima kasih juga disampaikan kepada orang-orang terkasih Penulis: Rahma, Desray, Bolas, Susi, Jenny, Alvi, Mudita, dan teman-teman Avenzoar lainnya yang tidak bisa Penulis cantumkan semua.
Semoga karya ilmiah ini bermanfaat dan dapat dijadikan penelitian lebih lanjut untuk memperkaya ilmu pengetahuan di Indonesia. Akhir kata Penulis memohon maaf atas segala kekurangan dan kesalahan Penulis dalam karya ilmiah ini.
DAFTAR ISI
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
TINJAUAN PUSTAKA 2
METODE PENELITIAN 4
Waktu dan Tempat 4
Alat dan Bahan 4
Metode Penelitian 5
Studi manajemen budidaya ikan hias 5
Pengambilan sampel 5
Transportasi sampel ke laboratorium 5
Pencatatan data sampel 5
Euthanasi 5
Nekropsi 5
Pemeriksaan patologi anatomi 6
Fiksasi 6
Pembuatan sediaan histopatologi 6
Pemeriksaan histopatologi 6
Identifikasi parasit protozoa 6
Analisis data 6
HASIL DAN PEMBAHASAN 7
Hasil 7
Manajemen budidaya Guppy 7
Pengamatan gejala klinis 7
Pemeriksaan patologi anatomi 8
Pemeriksaan histopatologi 10
Pembahasan 17
SIMPULAN DAN SARAN 22
Saran 22
DAFTAR PUSTAKA 22
LAMPIRAN 25
RIWAYAT HIDUP 27
DAFTAR GAMBAR
1 Poecilia reticulata 3
2 Sampel ikan Guppy berenang secara vertikal 8
3 Ikan Guppy mengalami lesi hemoragi pada kulit 9
4 Insang ikan Guppy terlihat pucat 10
5 Organ internal rongga abdomen ikan Guppy 10
6 Infiltrasi protozoa di kulit 11
7 Infiltrasi protozoa di otot 12
8 Protozoa berespon basofilik terhadap pewarnaan HE 13 9 Protozoa berespon positif terhadap pewarnaan PAS 13
10 Reaksi pigmentasi pada kulit 14
11 Infiltrasi protozoa dan udema di insang 14
12 Udema di insang 15
13 Gambar kongesti dan degenerasi lemak pada hati 15
14 Gambar akumulasi melanophore di serosa 16
15 Lesi udema dan kongesti pada usus ikan Guppy 16
16 Histopatologi Tetrahymena corlissi 18
DAFTAR LAMPIRAN
PENDAHULUAN
Latar Belakang
Indonesia dikenal memiliki kekayaan sumberdaya perikanan yang cukup besar, terutama dalam perbendaharaan jenis-jenis ikan. Diperkirakan sekitar 16 % spesies ikan yang ada di dunia hidup di perairan Indonesia. Menurut data, total jumlah jenis ikan yang terdapat di perairan Indonesia mencapai 7000 spesies. Hampir 2000 spesies di antaranya merupakan jenis ikan air tawar (Khairuman dan Amri 2011). Budidaya ikan hias di Indonesia sampai saat ini masih mengalami kendala baik dalam hal pemeliharaan maupun pemasarannya. Masalah umum yang ada pada dunia ikan hias adalah ketidakmampuan memenuhi permintaan pasar yang cukup besar baik dari kuantitas maupun kualitas (Satyani 2003). Dibandingkan dengan ikan konsumsi, peranan pemerintah dalam pengembangan usaha budidaya ikan hias masih terbatas. Berdasarkan survei yang dilakukan, kegiatan budidaya ikan hias masih terkonsentrasi di kota-kota besar dan didominasi tangkapan dari alam (Gustiano et al. 2008).
Keberadaan ikan hias saat ini tidak lagi sebagai hiburan atau hobi semata tetapi telah berkembang menjadi objek yang dimanfaatkan bagi kepentingan dunia pendidikan, penelitian, medis maupun keperluan konservasi alam. Sampai saat ini ikan hias air tawar merupakan salah satu jenis komoditas ekspor nonmigas bidang perikanan yang mampu menyumbang devisa negara yang cukup besar (Gustiano et al. 2008). Usaha budidaya ikan hias merupakan salah satu usaha yang memberikan alternatif sumber penghasilan untuk meningkatkan pendapatan petani/pengusaha ikan hias. Peluang usaha dan potensi ekonomis budidaya ikan hias lebih menggiurkan dibandingkan dengan ikan konsumsi. Dengan pola pemeliharaan dan pemberian makanan yang hampir sama dengan ikan konsumsi , budidaya ikan hias mampu menghasilkan pemasukan yang lebih besar. Harga ikan hias yang memiliki bentuk, warna, corak yang indah akan berharga cukup mahal. Hasil budidaya ikan hias lebih menekankan kualitas sehingga bisa dilakukan di lahan sempit dan bisa dilakukan sebagai usaha sampingan (Tinangon 2010).
Begitu banyak agen penyakit yang menyerang spesies ikan hias di Indonesia. Beragam jenis penyakit pada ikan tersebut disebabkan oleh jamur, bakteri, protozoa maupun virus. Beberapa penyakit yang disebabkan oleh protozoa antara lain: Ichtyophthirius multifilis, Trichodina heterodentata, Tetrahymena sp, dan Cryptocaryon, sedangkan beberapa penyakit yang disebabkan oleh cacing antara lain: Lernaea sp., Argulus sp., Gyrodactylus sp., dan Dactylogyrus sp. (Alifuddin et al. 2002). Penyakit yang disebabkan cendawan adalah Saprolegnia sp., Achlya sp.. Penyakit yang disebabkan oleh bakteri yaitu Aeromonas sp., Pseudomonas sp., Mycobacteria sp., Columnaris sp., Flexibacter sp., Myxobacteria sp., dan Edwardsiella sp.. Penyakit yang disebabkan oleh virus adalah Infectious pancreatic necrosis, Channel catfish virus, Viral hemorrhagic septicemia, Swim bladder inflammation, dan Koi Herpes Virus (Kordi & Ghufran 2004).
2
termasuk dokter hewan yang memiliki peranan yang besar untuk mengatasi penyakit-penyakit tersebut. Dalam mendukung semuanya itu perlu diterapkannya ilmu patologi untuk dapat mengetahui lebih lanjut penyakitnya serta tata cara penanganan penyakit tersebut. Pemeriksaan patologi pada ikan hias bertujuan untuk mempelajari perubahan patologi anatomi dan histopatologi organ yang dapat disebabkan oleh gangguan infeksius dan non infeksius. Manfaat dari pemeriksaan patologi ini adalah dapat diperoleh informasi mengenai perubahan patologi pada organ-organ ikan hias serta penyebabnya sehingga dapat digunakan untuk strategi penanggulangan penyakit-penyakit pada ikan hias baik yang bersifat infeksius maupun non infeksius.
Tujuan Penelitian
Tujuan dari penelitian ini adalah untuk mempelajari kasus infeksi protozoa Tetrahymena spp. yang ditemukan, dengan mempelajari morfologi parasit dalam irisan jaringan ikan Guppy (Poecilia reticulata) serta melakukan analisa patogenesa penyakit berdasarkan lesi histopatologi yang ditemukan.
Manfaat Penelitian
Manfaat yang diharapkan dari penelitian ini adalah diperoleh data mengenai kasus kejadian penyakit yang terjadi pada ikan Guppy (Poecilia reticulata). Selain itu, tulisan ini diharapkan dapat memberikan masukkan untuk berbagai pihak yang berkaitan dengan kesehatan ikan hias untuk mendukung manajemen pengelolaan budidaya ikan hias
TINJAUAN PUSTAKA
Guppy (Poecilia reticulata)
3
Gambar 1 Poecilia reticulata (Sumber : Monks 2012)
Penyakit pada Ikan Guppy
Penyakit yang menyerang spesies ikan hias Guppy beragam. Beragam jenis penyakit pada ikan tersebut disebabkan oleh jamur, bakteri, parasit maupun virus. Pada tahun 2001, fungi Achyla bisexualis dilaporkan menginfeksi Guppy di Thailand. Hasil penelitian tersebut menyatakan Achyla bisexualis merupakan infeksi sekunder setelah infeksi dari Tetrahymena sp. dan tidak menyebabkan kematian pada Guppy (Lawhavinit et al. 2002). Saprolegnia juga dilaporkan dapat menyerang ikan Guppy (Khalil 2010). Penelitian inventaris parasit pada ikan hias Guppy kobra yang dilalulintaskan melalui Bandara Soekarno-Hatta, Cengkareng, Jakarta ditemukan parasit Trichodina hetero-dentata dan Lernea di permukaan tubuhnya (Alifuddin et al. 2002). Infeksi Tetrahymena sp. telah didiagnosa pada Guppy yang diimpor dari Singapura. Ciliata mengelilingi organ internal, regio peri-orbital mata dan ditemukan dalam embrio Guppy yang sedang berkembang (Leibowitz & Zilberg 2009).
4
Gejala Klinis Ikan Sakit
Ikan yang sakit menimbulkan gejala-gejala klinis yang spesifik. Menurut Kordi dan Ghufran (2004), ciri ikan yang sakit dapat ditinjau dari segi perilaku, equilibrium, lesi eksternal, dan faktor kondisi. Perilaku ikan sakit biasanya tidak normal. Ikan sering terlihat menggosok-gosokan tubuhmya pada suatu permukaan benda dan tidak mau makan. Ikan yang sakit akan memisahkan diri dan berenang secara pasif. Ikan yang terserang penyakit, keseimbangannya terganggu, meloncat-loncat tidak teratur, dan terkadang dapat menabrak dinding bak. Lesi eksternal adalah abnomalitas dari organ tubuh tertentu karena adanya serangan penyakit. Lesi eksternal pada ikan antara lain terjadi perubahan warna, produksi lendir yang berlebihan, kerusakan organ seperti kulit, sirip, insang, dan ulkus (Kordi & Ghufran 2004).
METODE PENELITIAN
Waktu dan Tempat
Penelitian ini dilaksanakan selama 6 bulan, dimulai dari bulan April sampai September 2012. Penelitian diawali dengan pengambilan sampel ikan hias air tawar yang terlihat mengalami penyakit. Tempat pengambilan sampel dilakukan di tempat jual beli ikan hias Toko Ikanku, Babakan Tengah, kelurahan Babakan Kampus IPB, Dramaga Bogor. Setelah dilakukan pemeriksaan patologi anatomi, kemudian sampel ikan dijadikan sediaan histopatologi sehingga dapat diperiksa lebih lanjut. Pembuatan histopatologi, pemeriksaan, dan interpretasi dilakukan di Laboratorium Diagnostik Patologi, Bagian Patologi Departemen Klinik Reproduksi dan Patologi (KRP), Fakultas Kedokteran Hewan, Institut Pertanian Bogor (FKH IPB), dilanjutkan dengan penyusunan laporan hasil pemeriksaan.
Alat dan Bahan
5 Metode Penelitian
Studi manajemen budidaya ikan hias
Sebelum dilakukan pengamatan dan pengambilan sampel, perlu dipelajari studi manajemen ikan untuk mengetahui pembenihan, perawatan serta pengolahan ikan dengan baik agar dapat dibandingkan dengan gejala-gejala klinis yang terjadi pada ikan serta memahami adanya penyakit infeksius ataupun non infeksius. Pengambilan sampel
Pengamatan ikan dilakukan terlebih dahulu untuk dapat mengetahui ikan mana yang mengalami kelainan. Pengambilan sampel dilakukan pada ikan yang terlihat mengalami kelainan. Kelainan pada ikan diantaranya tampak ada sesuatu yang menempel pada tubuh ikan terutama di bawah sisik atau pada pangkal sirip, terjadi perubahan warna atau bentuk, hilang keseimbangan, ikan berenang mendekati permukaaan terus menerus, lemah dan nafsu makan turun, kerusakan pada jaringan insang atau kulit ikan, terdapat luka, dan terdapat pendarahan pada organ atau jaringan.
Transportasi sampel ke laboratorium
Sampel dibawa dengan kantong plastik berukuran cukup luas yang ditambahkan oksigen ke dalamnya. Saat mengganti tempat dari plastik menuju bak ikan di laboratorium, harus dilakukan secara teliti, jangan sampai suhu pada air berubah.
Pencatatan data sampel
Ikan sampel yang terlihat gejala klinisnya berjumlah 5 ekor. Pencatatan data sampel meliputi deskripsi tempat pengambilan sampel, jumlah ikan yang terinfeksi, warna, tingkah laku, dan umur ikan yang terinfeksi (Stoskopf 1993). Pada studi kasus ini ikan Guppy dengan infeksi Tetrahymena spp hanya ditemukan pada 1 dari 5 ekor yang diperiksa, sehingga jumlah sampel pada studi kasus ini adalah 1 ekor.
Euthanasi
Ikan di-euthanasi dengan cara dimasukkan ke dalam wadah berisi air, kemudian diletakkan ke dalam freezer dengan suhu -18°C selama 20 menit. Pendinginan ini akan menurunkan metabolisme dan tidak meningkatkan ambang nyeri (Noga 2010).
Nekropsi
6
Pemeriksaan patologi anatomi
Ikan yang sudah dinekropsi diamati lesi dan abnormalitas lainnya dari jaringan eksterna serta organ interna. Semua lesi dan abnormalitas didokumentasi menggunakan kamera. Penggaris diposisikan di samping ikan terlebih dahulu agar ukuran ikan dapat diketahui.
Fiksasi
Ikan yang sudah dinekropsi dan didokumentasi kemudian difiksasi menggunakan NBF 10% selama 24 jam. Ikan dapat langsung dimasukkan ke dalam wadah NBF 10% tanpa memisahkan organ-organ karena ukurannya yang relatif kecil atau kurang dari 10 cm.
Pembuatan sediaan histopatologi
Tubuh ikan yang sudah difiksasi kemudian dipotong (grossing) melintang dan dibagi atas lima sampai enam bagian, lalu dimasukkan ke dalam kaset jaringan. Hal ini dimaksudkan agar seluruh bagian ikan mulai dari insang hingga ginjal posterior dapat terlihat dalam pemeriksaan histopatologi. Potongan kemudian diproses menjadi sediaan histopatologi dengan pewarnaan Hematoksilin Eosin (HE) dan Periodic Acid-Schiff (PAS) (Bancroft dan Stevens 1990) (Lampiran 1).
Pemeriksaan histopatologi
Preparat yang telah dibuat kemudian diamati di bawah mikroskop cahaya untuk melihat perubahan pada sel ataupun organ.
Identifikasi parasit protozoa
Mengidentifikasi protozoa diperlukan penentuan karakteristik morfologi dan dilakukan pengukuran bentuk tubuh. Kemudian dilakukan pencarian mengenai literatur parasit protozoa mana yang memiliki morfologi dan ukuran serupa dengan protozoa yang ditemukan. Pengamatan keberadaan protozoa di jaringan dan lesi akibat invasi yang ditimbulkan dapat membantu proses identifikasi. Hasil yang ditemukan dicocokkan dengan literatur yang ada (Noga 2010).
Analisis data
7
HASIL DAN PEMBAHASAN
Hasil
Manajemen Budidaya Guppy
Tempat pengambilan sampel ikan hias Guppy (Poecilia reticulata) yang sakit pada studi kasus ini terletak di daerah Babakan Tengah, kelurahan Babakan Kampus IPB, Dramaga Bogor. Toko Ikanku merupakan tempat jual beli ikan hias. Toko Ikanku mengambil ikan dari para petani di daerah Bogor. Asal Guppy berasal dari daerah Parung dan Cibinong, Bogor. Petani ikan Guppy di Parung membudidayakan ikannya di kolam-kolam terbuka sedangkan petani ikan di Cibinong membudidayakan ikannya di dalam akuarium. Petani melakukan pemijahan ikan tersebut dilakukan di kolam dan ketika akan bertelur maka penetasan dilakukan di dalam akuarium hingga telur tersebut menjadi larva. Larva yang dihasilkan kemudian dimasukkan ke dalam kolam maupun akuarium. Ikan diberi pakan hidup berupa cacing sutera yang diperoleh dari lingkungan kotor, sungai, lumpur, dan hasil limbah. Petani ikan Guppy memakai air kolam terbuka yang memiliki resiko penyakit lebih tinggi.
Transportasi dari petani menuju Toko Ikanku menggunakan wadah plastik dan dibawa dengan menggunakan motor. Ikan pertama kali datang langsung dimasukkan akuarium karantina. Ikan dikarantina selama 3-5 hari disesuaikan suhu airnya 25-28 oC. Sebelum dimasukkan akuarium display dilakukan berbagai persiapan. Akuarium display dicuci bersih dengan methylene blue kemudian dikeringkan selama sehari. Sumber air berasal dari air sumur. Air yang digunakan untuk pemeliharaan di Toko Ikanku berasal dari air sumur yang mengandung tingkat oksigen yang rendah. Air sumur di tampung selama 1-2 hari di dalam reservoir dan diberi aerasi. Penampungan air bertujuan untuk menghilangkan gas karbondioksida dan gas beracun serta menurunkan pH.
Ikan Guppy ditempatkan dalam akuarium berukuran panjang x lebar x tinggi 40 x 25 x 25 sentimeter dengan kepadatan dalam akuarium 100 ekor ikan. Air yang digunakan adalah air yang cukup mengandung oksigen dan jernih. Ikan Guppy dipelihara dengan suhu optimal untuk pemeliharaan sekitar 25-28 ° C. Ikan diberi pakan hidup berupa cacing sutra. Ikan juga diberi pakan kering buatan. Pemilihan pakan ikan kering berdampak pada meningkatnya tingkat kekeruhan air. Pengamatan gejala klinis
8
Gambar 2 Ikan Guppy sampel ini menunjukkan gejala klinis dengan berenang secara vertikal.
Pemeriksaan patologi anatomi
9
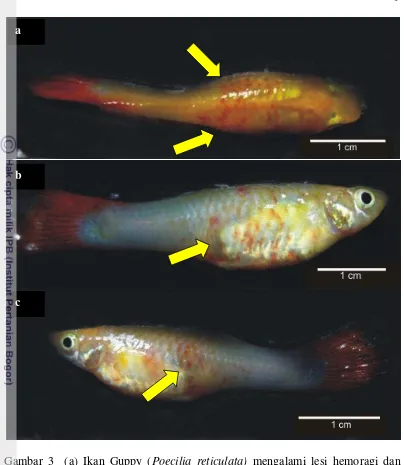
Gambar 3 (a) Ikan Guppy (Poecilia reticulata) mengalami lesi hemoragi dan ptekhie pada bagian dorsal dan lateral (panah). (b) Ikan Guppy (Poecilia reticulata) mengalami lesi hemoragi dan ptekhie pada bagian lateral dextra (panah). (c) Ikan Guppy (Poecilia reticulata) mengalami lesi hemoragi dan ptekhie pada bagian lateral sinistra (panah).
a
b
10
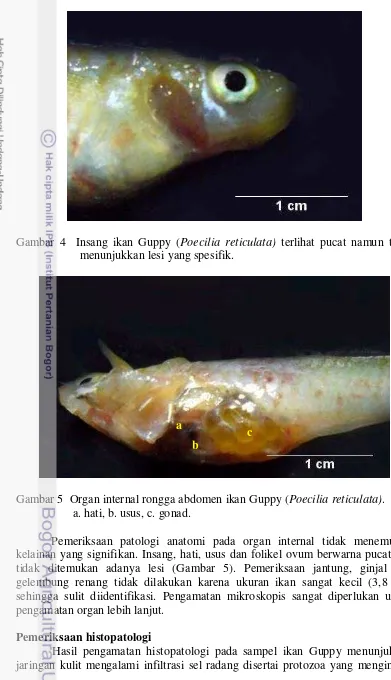
Gambar 4 Insang ikan Guppy (Poecilia reticulata) terlihat pucat namun tidak menunjukkan lesi yang spesifik.
Gambar 5 Organ internal rongga abdomen ikan Guppy (Poecilia reticulata). a. hati, b. usus, c. gonad.
Pemeriksaan patologi anatomi pada organ internal tidak menemukan kelainan yang signifikan. Insang, hati, usus dan folikel ovum berwarna pucat dan tidak ditemukan adanya lesi (Gambar 5). Pemeriksaan jantung, ginjal dan gelembung renang tidak dilakukan karena ukuran ikan sangat kecil (3,8 cm) sehingga sulit diidentifikasi. Pengamatan mikroskopis sangat diperlukan untuk pengamatan organ lebih lanjut.
Pemeriksaan histopatologi
Hasil pengamatan histopatologi pada sampel ikan Guppy menunjukkan jaringan kulit mengalami infiltrasi sel radang disertai protozoa yang menginvasi
a
b
11 permukaan kulit hingga menembus ke lapisan otot. Pada kulit di sekitar lesi erosi juga ditemukan fokus-fokus hemoragi yang ditandai adanya sel-sel darah merah. Protozoa dalam jumlah besar menginfeksi kulit pada bagian epidermis dan dermis. Epidermis terlepas, mengalami degenerasi, serta terjadi epidermal dermatitis yang ditandai dengan infiltrasi sel radang mononuklear pada lapisan epidermis dan dermis.
Gambar 6 Protozoa ditemukan dari lapisan epidermis hingga ke bagian profundal dari epidermis. Epidermis mengalami peradangan akibat infestasi protozoa (panah kuning), mengundang infiltrasi sel radang mononuklear limfositik (panah hitam) dan fokus-fokus hemoragi (panah merah). Infeksi protozoa dari permukaan menembus ke dalam dermis. Peradangan menyebabkan kerusakan jaringan otot yang parah terlihat sebagai nekrosa otot (panah hijau) dan degenerasi otot (panah oranye), Pewarnaan HE.
12
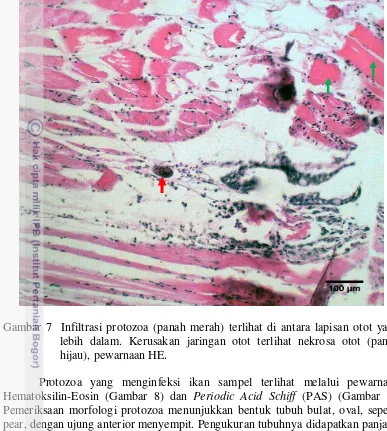
Gambar 7 Infiltrasi protozoa (panah merah) terlihat di antara lapisan otot yang lebih dalam. Kerusakan jaringan otot terlihat nekrosa otot (panah hijau), pewarnaan HE.
13
Gambar 8 Protozoa berespon basofilik terhadap pewarnaan HE (panah kuning) Protozoa mendigesti eritrosit ikan, di dalam dan di sekitar protozoa terdapat butiran eritrosit (panah merah). Makronukleus protozoa terlihat oval (panah biru), pewarnaan HE, Bar = 50 µm.
14
Gambar 10 Reaksi pigmentasi (panah hitam) di dalam sel mukus, pewarnaan PAS.
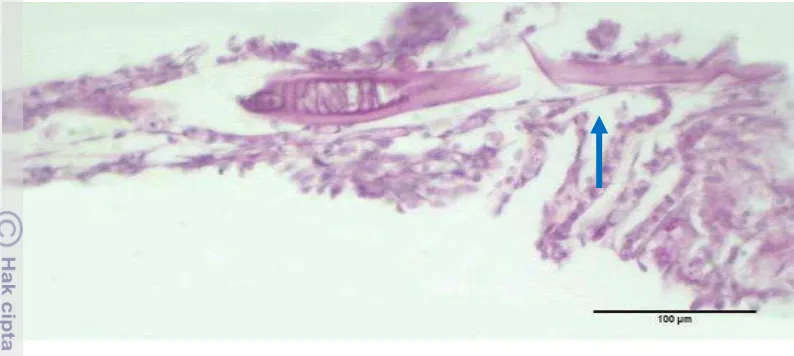
Hasil pengamatan histopatologi pada sampel ikan Guppy menunjukkan jaringan insang yang rusak parah. Parasit protozoa ditemukan menginfeksi insang (Gambar 11). Terlihat pada pembesaran fokus objektif 20x parasit menginfiltrasi kapiler lamela primer insang. Perubahan histopatologi lain yang ditemukan pada insang adalah udema lamela (Gambar 12). Udema lamela menyebabkan epitel lamela sekunder hampir terlepas dari kapiler bahkan sempurna terlepas dari lamela primer.
15
Gambar 12 Udema lamela (panah biru), pewarnaan PAS.
Gambar 13 Gambaran mikroskopis hati ikan Guppy, terdapat kongesti dan degenerasi lemak hepatosit. Pewarnaan HE.
16
Gambar 14 Gambaran serosa dari gelembung renang ikan Guppy dan akumulasi melanophore (panah hitam), pewarnaan HE.
Perubahan pada usus ikan Guppy tidak ditemukan parasit baik protozoa, helminth dan ektoparasit. Lapisan lamina propria dan tunika muskularis tidak mengalami kelainan spesifik. Lumen usus dan vili rapat. Pada lapisan mukosa terlihat udema dan kongesti (Gambar 15).
[image:30.595.93.458.408.691.2]17 Pembahasan
Berdasarkan pengamatan histopatologi pada sampel ikan Guppy terlihat adanya parasit protozoa di jaringan kulit, otot dan insang. Protozoa yang biasanya menginfeksi jaringan tersebut, diantaranya adalah Ichthyobodo sp., Chilodonella sp., Ichthyophthirius multifiliis, Uronema sp., Trichodina sp., dan Tetrahymena spp. (Bruno et al. 2006). Untuk menspesifikasikan jenis protozoa yang menginfeksi diperlukan pengamatan karakteristik morfologi, pengukuran bentuk tubuh, keberadaan protozoa, dan lesi akibat invasi yang ditimbulkan yang dicocokkan dengan literatur yang ada (Noga 2010).
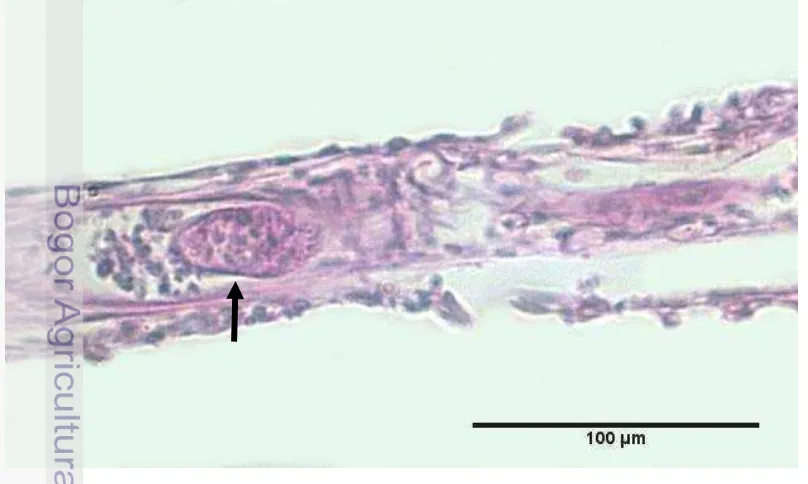
Pemeriksaan morfologi protozoa yang ditemukan menunjukkan bentuk tubuh bulat, oval, seperti pear, dengan ujung anterior menyempit. Karakteristik morfologi Ichthyobodo sp. memiliki bentuk tubuh oval atau berbentuk ginjal dengan dua pasang flagela untuk bergerak (Bruno et al. 2006). Menurut Anshary (2008) Chilodonella sp. memiliki tubuh yang kecil, berbentuk oval, dorsal dan ventral tubuhnya datar, dan terdapat silia di permukaannya. Ichthyophthirius multifiliis merupakan protozoa berbentuk bulat/oval dan permukaan tubuhnya diselaputi silia. Makronukleus Ichthyophthirius multifiliis berbentuk seperti tapal kuda dan mikronukleusnya berbentuk bulat (Bruno et al. 2006). Protozoa Uronema sp. mempunyai bentuk tubuh ovoid, memiliki silia yang jarang dan silia caudal yang panjang, dan satu makronukleus dan mikronukleus. Protozoa ini sering menginfeksi spesies ikan perairan air laut (Azad et al. 2007; Noga 2010). Karakteristik morfologi Trichodina sp. menurut Basson & van As (2006) ialah berbentuk bulat dan simetris. Pada bagian mulutnya dilengkapi alat penghisap berbentuk seperti jangkar. Karakteristik morfologi protozoa yang ditemukan serupa dengan protozoa Tetrahymena spp. yang memiliki bentuk tubuh pyriform, oval, bentuk buah pear, tubuh simetris radial, memiliki silia seluruh tubuh, dan ujung anterior menyempit (Hoffman et al. 1975; Bruno et al. 2006; Leibowitz & Zilberg 2009). Protozoa yang menginfeksi ikan terlihat berwarna basofilik melalui pewarnaan HE dan memberikan reaksi positif terhadap pewarnaan PAS. Astrofsky et al. (2002) juga melaporkan dalam kajiannya bahwa Tetrahymena spp. berespon basofilik terhadap pewarnaan HE dan bereaksi positif terhadap pewarnaan PAS.
18
[image:32.595.70.460.64.546.2]Tetrahymena spp menunjukkan pembentukan mikronukleus yang penting untuk keperluan konjugasi dan rekombinasi seksual.
Gambar 16 Histopatologi Tetrahymena corlissi. Di dalam vakuola Tetrahymena corlissi terlihat nukleus eritrosit ikan yang dicerna. (Sumber: Hoffman et al. 1975)
Ikan Guppy mengalami kerusakan jaringan kulit yang parah akibat protozoa yang menginvasi permukaan kulit hingga menembus ke lapisan lebih dalam. Lesi berupa erosi epidermis serta degenerasi hingga nekrosa terjadi pada otot. Temuan patologi anatomi kulit ikan mengalami hemoragi di beberapa tempat diantaranya kulit daerah abdomen, lateral dan sekitar dorsal. Hasil pengamatan histopatologi pada sampel ikan Guppy menunjukkan fokus-fokus hemoragi yang ditandai adanya sel-sel eritrosit. Pada kasus ini, protozoa terlihat memakan sel eritosit yang dapat diidentifikasi dari sitoplasma protozoa yang berisi sel darah merah. Hoffman et al. (1975) dan Bruno et al. (2006) melaporkan hal yang sama yaitu bahwa protozoa Tetrahymena spp. terlihat mendigesti eritosit pada potongan jaringan.
19 banyak ditemukan dihubungkan dengan lesi tersebut. Pada jaringan otot yang terletak jauh dari lesi kulit, Tetrahymena spp. ditemukan di antara serabut otot.
Penampakan insang secara makroskopis tampak pucat dengan lesi yang tidak spesifik. Pengamatan histopatologi insang pada sampel ikan Guppy kasus ini menunjukkan jaringan insang yang rusak. Parasit protozoa ditemukan menginfiltrasi kapiler lamela primer insang. Lesi insang dari infestasi Tetrahymena spp. yang ditemukan di dalam pembuluh darah lamela primer insang dilaporkan juga oleh Bruno et al. (2006), Leibowitz & Zilberg (2009) dan Monks (2012). Udema lamela menyebabkan epitel lamela sekunder hampir terlepas dari lamela primer. Protozoa yang terakumulasi di kapiler insang dapat menyebabkan efek obstruksi (trombus). Protozoa menghalangi pengambilan dan penyaluran oksigen sehingga menyebabkan ikan hipoksia (kekurangan oksigen). Udema lamela disebabkan meningkatnya tekanan hidrostatik intravaskular yang menimbulkan perembesan cairan plasma darah keluar ke ruang interstitium. Kondisi peningkatan tekanan hidrostatik terjadi pada pembuluh darah yang kongesti karena terdapat trombus yang menyumbat aliran darah.
Kemiripan morfologi serta lesi yang ditimbulkan dengan literatur, mengarahkan bahwa protozoa kasus ini adalah Tetrahymena spp. Tetrahymena spp. diklasifikasikan dalam subkelas Hymenostomatia. Protozoa bersilia, Tetrahymena spp., adalah agen penyebab utama penyakit yang menyerang Guppy dan umumnya dikenal sebagai 'Guppy-killer parasite ' (Hoffman et al. 1975; Imai et al. 2000; Leibowitz et al. 2005).
Pengamatan gejala klinis sampel ikan terlihat lesu, gerak renangnya lambat dan keseimbangannya terganggu sehingga berenang secara vertikal. Terganggunya keseimbangan berenang ikan ini diduga karena terjadi kerusakan pada gelembung renang (gas bladder) (Wildgoose 2007). Pengamatan histopatologi gelembung renang pada sampel ikan Guppy tidak menunjukkan lesi yang signifikan. Akumulasi melanophore ditemukan pada serosa gelembung renang. Melanophore yang ditemukan menunjukkan ikan dalam kondisi stres. Kondisi stres akut menyebabkan kenaikan sekresi kortisol oleh hormon adrenokortikotropin (ACTH). Melanophore-stimulating hormone (MSH) dan beta-endorphin (beta-endorphin) juga menstimulasi lepasnya kortisol. Kenaikan kortisol menyebabkan Alpha-MSH menstimulasi persebaran granula melanin pada ikan. Pigmentasi terjadi karena adaptasi ikan terhadap lingkungan (Bonga 2011).
Temuan lesi lain yang didapatkan selain pada kulit, otot dan insang adalah pada hati dan usus. Perubahan histopatologi yang ditemukan pada organ hati adalah degenerasi lemak dan kongesti. Imai et al. (2000) melaporkan invasi parasit Tetrahymena spp. pada ikan Guppy ditemukan di rongga abdomen, organ internal, seperti usus, hati, mata, rongga kepala, dan medulla spinalis. Pada kasus ini tidak ditemukan lesi signifikan pada usus ikan Guppy, tidak juga ditemukan parasit baik protozoa ataupun helminth. Udema dan kongesti pada usus menunjukkan adanya peradangan akut dan ringan.
20
hati dan otot dipecah untuk mempertahankan kadar glukosa darah melalui proses glikogenolisis. Pemecahan cadangan lemak dan protein juga terjadi untuk mendapat sumber energi baru (glukoneogenesis). Penggunaan cadangan glikogen dan lipolisis dari jaringan adiposa akan meningkatkan kadar asam lemak bebas di dalam darah. Banyaknya asupan lemak bebas akan terakumulasi di dalam sel hati sehingga merusak jalur metabolisme lemak. Degenerasi lemak secara mikroskopis akan memperlihatkan sel hati membesar berisi vakuola lemak pada sitoplasma (Cheville 1999).
Udema dan kongesti yang ditemukan di usus merupakan tahapan reaksi peradangan akut. Kongesti dapat disebabkan oleh gangguan sistemik yang dapat mengganggu pengosongan darah vena. Terkadang kerja jantung untuk memompa darah gagal, keadaan ini dapat mengakibatkan gangguan aliran darah. Kelainan pada jantung tidak dapat teramati karena organ jantung tidak terpotong. Udema adalah bagian dari reaksi peradangan akut. Kenaikan lokal permeabilitas dinding pembuluh darah terhadap protein memungkinkan molekul-molekul besar ini lolos dari pembuluh (Abrams 1994).
Perubahan pada saluran pencernaan dapat terjadi karena modifikasi diet pangan dan kondisi sistem pertahanan tubuh inang. Kondisi stress menyebabkan menurunnya sistem pertahanan. Penurunan sistem pertahanan menyebabkan keseimbangan bakteri flora di dalam saluran pencernaan terganggu. Jika jumlah bakteri patogen lebih banyak dibandingkan jumlah bakteri apatogen, maka bakteri patogen akan menginvasi usus dan menyebabkan penyakit. Mikrobiota usus yang apatogen penting untuk pemeliharaan kesehatan inang, menyediakan energi dan nutrisi seperti vitamin K dan B12 serta perlindungan terhadap invasi organisme patogen (Woodmansey 2007).
Infeksi parasit protozoa Tetrahymena spp. ini diduga berasal dari air yang digunakan untuk pemeliharaan ikan. Air berasal dari lingkungan yang kotor dengan kandungan bahan organik yang tinggi. Pembersihan kotoran di dasar akuarium yang kurang bersih dan masih menyisakan bahan organik seperti feses ikan dan sisa pakan, juga dapat menyebabkan pencemaran lingkungan akuarium. Kondisi akuarium dengan kotoran yang larut dalam air, amonia tinggi dapat menghambat pertumbuhan ikan. Lingkungan yang kotor juga dapat menjadi sumber penularan penyakit. Menurut Leibowitz et al. (2005) kualitas air yang buruk, termasuk amonia dan bahan organik, dan suhu air rendah meningkatkan kerentanan ikan terhadap infeksi. Kandungan bahan organik dan nutrisi tinggi dapat digunakan oleh parasit, sehingga meningkatkan populasinya di dalam air. Kondisi stres pada ikan juga mengakibatkan meningkatnya kerentanan terhadap agen infeksius.
21 penyakit, dan tiba-tiba akan menyebabkan masalah jika kondisi dalam akuarium memburuk atau ikan yang dipelihara menjadi stres atau memiliki luka.
Petani ikan hias Guppy yang menggunakan air kolam terbuka untuk usaha budidayanya cenderung tidak memperhatikan kandungan gas dan bahan organik dalam kolam tersebut. Ikan Guppy dewasa yang siap dijual akan didistribusikan ke suplier atau ke pengumpul. Transportasi yang tidak sesuai dengan aturan dapat menyebabkan ikan bergesekan dengan ikan lain sehingga menyebabkan lapisan lendir rusak. Menurut Leibowitz et al. (2005) ikan lebih rentan terinfeksi protozoa saat pengiriman ikan. Faktor predisposisi tetrahymenosis ikan adalah akibat kepadatan populasi ikan yang tinggi, tingginya akumulasi bahan organik, dan penurunan pH yang disebabkan oleh akumulasi CO2. Kondisi pada saat pengemasan dan transportasi ikan dapat menyebabkan stress berat, yang kemungkinan akan meningkatkan kerentanan ikan terhadap patogen (Barton & Iwama 1991).
Tetrahymena spp. merupakan protozoa bersilia yang hidup bebas di air tawar. Infeksi Tetrahymena spp. di alam dapat ditransmisikan secara horizontal dengan perantara air. Protozoa Tetrahymena spp. dapat melekat pada permukaan kulit dan insang ikan yang mengalami erosi. Protozoa ini memakan bahan organik seperti bakteri dan potongan sel yang hancur serta bersifat saprozoik bersilia (Kozloff 1990). Ikan yang stress akan mengalami penurunan nafsu makan sehingga menyebabkan penurunan imunitas tubuh. Imunitas ikan yang rendah menyebabkan kegagalan pertahanan tubuh ikan Rute infeksi Tetrahymena spp. dimulai dari penetrasi parasit ke kulit kemudian masuk ke dalam otot, dari sana mencapai organ internal dan sirkulasi darah. Selain masuk melalui luka yang terbuka protozoa ini dapat juga menginfeksi dengan berpenetrasi pada kulit yang tidak terluka tetapi saat kondisi ikan stress (Imai et al. 2000).
Pengendalian dan pencegahan infeksi parasit protozoa menurut Basson dan van As (2006) antara lain, menjaga kualitas air dengan membersihkan sisa pakan yang berlebih, menjaga kestabilan kandungan bahan organik dan kimia, dan temperatur, serta menjaga air agar terbebas dari patogen dan polutan. Kolam dan tangki/akuarium harus dikosongkan secara teratur dan dasarnya harus dibersihkan dengan kapur. Akuarium juga dapat dibuat bebas dari parasit dengan cara menyiramnya dengan formalin 5%. Jaring untuk menangkap ikan, ember dan peralatan lain yang dipergunakan dalam budidaya harus bersih. Ikan yang baru harus selalu rutin diobati dan dikarantina selama beberapa hari sebelum dimasukkan ke dalam kolam/akuarium yang sudah didesinfeksi. Ikan harus diberi pakan yang seimbang dan tidak berlebihan. Suplai oksigen harus mencukupi dan temperatur harus tepat. Kepadatan ikan dalam kolam harus dijaga agar tidak terlalu padat. Mengurangi penanganan (handling) ikan dan melakukan pemeriksaan ikan dari parasit secara rutin.
22
Pemberian albendazole dan chloraquine juga efektif melawan invasi Tetrahymena spp.. Menjaga kondisi lingkungan tetap stabil dapat membantu pengobatan Guppy (Monks 2012). Pemberian pakan yang tinggi kadar asam lemak asam arachidonat membantu penyembuhan Guppy dari infeksi (Noga 2010).
SIMPULAN DAN SARAN
Simpulan
Berdasarkan pengamatan patologi anatomi dan histopatologi morfologi protozoa menggunakan pewarnaan HE dan PAS serta studi literatur maka protozoa yang menginfeksi kulit, otot, dan insang kasus ikan Guppy ini adalah Tetrahymena spp.
Saran
Mempelajari kemungkinan adanya parasit protozoa Tetrahymena spp. pada pakan organik. Konfirmasi jenis spesies pada protozoa Tetrahymena spp. dengan bantuan Polymerase chain reaction (PCR).
DAFTAR PUSTAKA
Abrams GD. 1994. Gangguan sirkulasi. Di dalam Price SA, Wilson LM, editor. Patofisiologi Konsep Klinis Proses-Proses Penyakit. Jakarta: Penerbit Buku Kedokteran EGC. Hlm: 93-95.
Alifuddin M, Priyono A, Nurfatimah A. 2002. Inventarisasi parasit pada ikan hias yang dilalulintaskan di Bandara Soekarno-Hatta, Cengkareng, Jakarta. Jurnal Akuakultur Indonesia 1(3): 123-127.
Anonim. 2012. Gupi. [terhubung berkala]. http://id.wikipedia.org/wiki/Gupi.[26 Agustus 2012].
Anshary H. 2008. Modul Pembelajaran Berbasis Student Center Learning (SCL) Mata Kuliah Parasitologi Ikan. Makassar: Fakultas Ilmu Kelautan dan Perikanan, Universitas Hasanuddin. Hlm: 27-50.
Areechon N, Chansue N, Ponpornpisit A. 2001. Systemic granulomatosis in guppies Poecilia reticulata. Kasetsart Journal (Natural Science) 35: 456-459.
Aryanto H. 1997. Dinamika Populasi Ikan Guppy (Poecilia reticulata Peters). [skripsi]. Semarang: Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Diponegoro. Hlm: 6-9.
Astrofsky KM, Schech JM, Sheppard BJ, Obenschain CA, Chin AM, Kacergis MC, Laver ER, Bartholomew JL, Fox JG. 2002. High mortality due to Tetrahymena sp. infection in laboratory-maintained zebrafish (Brachydanio rerio). Comparative Medicine 52(4): 363-367.
23 silver pomfret (Pampus argentus Euphrasen) in Kuwait. Aquaculture 262: 202-210.
Bacha WJ, Bacha LM. 2000. Color Atlas of Veterinary Histology Second Edition. United States: Lippincott Williams & Wilkins. Hal.: 1-3.
Bancroft J, Stevens A. 1990. Theory and Practice of Histological Techniques. New York: Churchill livingstone. Hlm: 1.
Barton BA, Iwama GK. 1991. Physiological changes in fish from stress in aquaculture with emphasis on the response and effects of corticosteroids. Annual Review of Fish Diseases 1: 3–26.
Basson L, van As J. 2006. Trichodinidae and other Ciliophorans (Phylum ciliopora). Di dalam Woo PTK, editor. Fish Diseases and Disorders Volume 1 : Protozoan and Metazoan Infections Second Edition. UK: CABI. Hlm: 175-179.
Bonga SEW. 2011. Hormone response to stress. Di dalam Farrell AP, editor. Encyclopedia of Fish Physiology: From Genome To Environtment. UK: Elsevier Inc. Hlm: 1515-1519.
Bruno DW, Nowak B, Elliott G. 2006. Guide to the identification of fish protozoan and metazoan parasites in stained tissue sections. Diseases of Aquatic Organism 70: 1-36.
Bharati VR, Khan RN, Kalavati C, Ramam AV. 2001. Protozoan colonization on artificial substrates in relation to water quality in a tropical Indian Harbour. Journal of Environtmental Sciences 13: 143–147.
Cheville NF. 1999. Introduction to Veterinary Pathology Second Edition. United States of America: Iowa State University Pr. Hlm: 29-31, 91-93.
Gustiano R, Prihadi TR, Kusrini E. 2008. Survai potensi, distribusi sumber daya, dan usaha ikan hias air tawar di beberapa sentra produksi. Media Akuakultur 3(1): 77-80.
Hoffman GL, Lando M, Camper JE, Coats DW, Stookey L, Burek JD. 1975. A disease of freshwater fishes caused by Tetrahymena corlissi Thompson, 1955 and key for identification of holotrich ciliates of freshwater fishes. Journal of Parasitology 61 (2): 217-223.
Imai S, Tsurimaki S, Goto E, Wakita K, Hatai K. 2000. Tetrahymena infection in guppy, Poecilia reticulata. Fish Pathology 35(2): 67-72.
Jeffri. 2010. Budidaya Ikan Guppy. [terhubung berkala]. http://jeffri022.student.umm.ac.id/2010/02/10/budidaya-ikan-guppy/. [26 Agustus 2012].
Kordi H dan Ghufran KM. 2004. Penanggulangan Hama dan Penyakit Ikan. Jakarta: Bina Adiaksara. Hlm: 3-25.
Khairuman dan Amri K. 2011. Buku Pintar Budi Daya 15 Ikan konsumsi. Jakarta: Agromedia. Hlm: 4.
Khalil B. 2010. Histopathology of skin of some fishes of family Sciaenidae from Karachi Coast [disertasi]. Karachi: Department of Zoologi Jinnah University for Women Nazimabad Karachi Pakistan.
Kim JH, Hayward CJ, Heo GJ. 2002. Nematode worm infections (Camallanus cotti, Camallanidae) in guppies (Poecilia reticulata) imported to Korea. Aquaculture 205: 231-235.
24
Lawhavinit O, Chukanhom K, Hatai K. 2002. Effect of Tetrahymena on the occurrence of Achlyosis in the guppy. Mycoscience 43: 27-31.
Leibowitz MP, Ariav R, Zilberg D. 2005. Environtmental and physiological conditions affecting Tetrahymena sp. infection in guppy, Poecilia reticulata Peters. Journal of Fish Diseases 28:539-547.
Leibowitz MP, Zilberg D. 2009. Tetrahymena sp. nfection in guppy, Poecilia reticulata Peters: parasite characterization and pathology of infected fish. Journal of Fish Diseases 32:845-855.
Leibowitz MP, Chettri JK, Ofir R, Zilberg D. 2010. Treatment development for systemic Tetrahymena sp. infection in guppy, Poecilia reticulata Peters. Journal of Fish Diseases 33:473-480.
Monks N. 2012. Guppy Disease (Tetrahymena). [terhubung berkala]. http://www.fishchannel.com. [26 Agustus 2012].
Noga EJ. 2010. Fish Disease : Diagnosis and Treatment Second Edition. Wiley-Blackwell : Iowa. Hlm: 107-267, 140-141.
Peters. 1859. Poecilia reticulata, Peters “Guppy”. [terhubung berkala]. http://www.fisbase.org/FieldGuide/FieldGuideSummary.cfm?GenusName =Poecilia&SpeciesName=reticulata&pda=&sps=. [29 Agustus 2012]. Satyani D. 2003. Ikan hias air tawar: prospek dan masalah. Warta Penelitian
Perikanan Indonesia 9: 8-13.
Schelkle B, Doetjes R, Cable J. 2011. The salt myth revealed: treatment of Gyrodactylid infections on ornamental guppies, Poecilia reticulata. Aquaculture 311: 74-79.
Stoskopf MK. 1993. Fish Medicine. WB Saunders Company: Philadelphia. Hlm:2-47.
Supriyadi H, A Hardjamulia. 1986. Current of Programs for Health Certification and Quarantine in Indonesia, in Arthur JR 1986. Fish Quarantine and Fish Disease in South and Southeast Asia. 1986. IDRC: Ottawa Kanada. Hlm: 27-29.
Tinangon A. 2010. Hasilkan Rupiah dengan Budidaya Ikan Hias Air Tawar [skripsi]. Yogyakarta: Sekolah Tinggi Manajemen Informatika dan Komputer Yogyakarta. Hlm: 2-6.
Wildgoose WH. 2007. Buoyancy disorders of ornamental fish: A review of cases seen in veterinary pratice. Fish Veterinary Journal 9:22-37.
25
LAMPIRAN
Lampiran 1
Pembuatan Sediaan Histopatologi
Pembuatan sediaan histopatologi berdasarkan Bacha dan Bacha (2000) pada organ ikan dapat dilakukan dengan prosedur sebagai berikut :
1. Grossing
Sediaan organ ikan yang sudah direndam dalam larutan Neutral Buffer Formalin (NBF) 10%, kemudian dipotong dengan ketebalan + 3 mm dan potongannya dimasukkan ke dalam kaset jaringan.
2. Dehidrasi
Organ yang ada dalam kaset jaringan dimasukkan ke dalam gelas-gelas mesin autotechnicon untuk dilakukan dehidrasi. Dehidrasi ini dilakukan bertahap dengan menggunakan alkohol yang konsentrasinya bertingkat, dimulai dari konsentrasi 70%, 80%, 90%, 95%, alkohol absolut 1, alkohol absolut 2. Setelah itu dilakukan proses penjernihan (clearing) dengan memasukkan sediaan ke dalam xylol, dua kali ulangan.
3. Infiltrasi Parafin
Jaringan diinfiltrasi dalam parafin dengan merendamnya dalam parafin cair sebanyak tiga kali ulangan.
4. Penanaman (embedding) dan pencetakan (blok)
Sediaan yang telah diinfiltrasi parafin ditanam dalam cetakan yang telah berisi parafin cair setengah dari dinding cetakan, kemudian setelah mulai membeku ditambahkan lagi dengan parafin cair sampai penuh. Proses ini dilakukan di mesin tissue embedding console (Sakura®). Sediaan tersebut diatur letaknya kemudian diberi label lalu dibekukan dalam lemari es untuk memudahkan pemotongan.
5. Pemotongan
Jaringan dipotong 3-5 µm dengan mikrotom (Spencer®). Hasil potongan diletakkan di atas air hangat untuk mencegah terjadinya lipatan saat dibentangkan. Sediaan dilekatkan di atas gelas objek kemudian dikeringkan di dalam inkubator.
Pewarnaan Hematoksilin Eosin (HE)
Pewarnaan HE termasuk dalam jenis pewarnaan ganda (double staining) karena menggunakan 2 jenis zat warna. Pada pewarnaan ganda, umumnya pewarnaan yang digunakan satu bersifat asam dan yang lain bersifat basa. Paduan sifat tersebut menyebabkan bagian-bagian yang bersifat asidofilik dan basofilik dapat ditonjolkan. Penggunaan pewarna ganda bertujuan agar terjadi kekontrasan antara bagian yang bersifat asidofilik dan basofilik, sehingga pengenalan bagian tertentu dapat lebih cepat dan jelas terlihat.
26
secara berurutan masing-masing selama 2-3 menit. Sediaan kemudian dicuci dengan air mengalir. Selanjutnya sediaan dimasukkan ke dalam 5% sodium tiosulfat 2-3 menit. Sediaan dicuci kembali dalam air mengalir selama 3-5 menit. Sediaan diwarnai dengan pewarna hematoksilin Mayer selama 8 menit, kemudian dicuci dengan air mengalir, direndam dalam lithium carbonat selama 15-30 detik, kemudian dicuci kembali dalam air mengalir. Sediaan diwarnai dengan pewarna eosin selama 2-3 menit, setelah itu sediaan dicuci dalam air mengalir untuk membersihkan warna eosin yang berlebihan. Selanjutnya sediaan didehidrasi dengan memasukkannya ke dalam alkohol 70%, alkohol 95%, alkohol absolut dua kali ulangan masing selama 2-3 menit, xylol dua kali ulangan masing-masing selama 2 menit. Setelah semuanya selesai, sediaan dikeringkan kemudian ditetesi dengan mounting medium dan ditutup dengan gelas penutup dan siap untuk diperiksa di bawah mikroskop (Bancroft dan Stevens 1990).
Pewarnaan Periodic Acid-Schiff Reaction (PAS)
27
RIWAYAT HIDUP
PENDAHULUAN
Latar Belakang
Indonesia dikenal memiliki kekayaan sumberdaya perikanan yang cukup besar, terutama dalam perbendaharaan jenis-jenis ikan. Diperkirakan sekitar 16 % spesies ikan yang ada di dunia hidup di perairan Indonesia. Menurut data, total jumlah jenis ikan yang terdapat di perairan Indonesia mencapai 7000 spesies. Hampir 2000 spesies di antaranya merupakan jenis ikan air tawar (Khairuman dan Amri 2011). Budidaya ikan hias di Indonesia sampai saat ini masih mengalami kendala baik dalam hal pemeliharaan maupun pemasarannya. Masalah umum yang ada pada dunia ikan hias adalah ketidakmampuan memenuhi permintaan pasar yang cukup besar baik dari kuantitas maupun kualitas (Satyani 2003). Dibandingkan dengan ikan konsumsi, peranan pemerintah dalam pengembangan usaha budidaya ikan hias masih terbatas. Berdasarkan survei yang dilakukan, kegiatan budidaya ikan hias masih terkonsentrasi di kota-kota besar dan didominasi tangkapan dari alam (Gustiano et al. 2008).
Keberadaan ikan hias saat ini tidak lagi sebagai hiburan atau hobi semata tetapi telah berkembang menjadi objek yang dimanfaatkan bagi kepentingan dunia pendidikan, penelitian, medis maupun keperluan konservasi alam. Sampai saat ini ikan hias air tawar merupakan salah satu jenis komoditas ekspor nonmigas bidang perikanan yang mampu menyumbang devisa negara yang cukup besar (Gustiano et al. 2008). Usaha budidaya ikan hias merupakan salah satu usaha yang memberikan alternatif sumber penghasilan untuk meningkatkan pendapatan petani/pengusaha ikan hias. Peluang usaha dan potensi ekonomis budidaya ikan hias lebih menggiurkan dibandingkan dengan ikan konsumsi. Dengan pola pemeliharaan dan pemberian makanan yang hampir sama dengan ikan konsumsi , budidaya ikan hias mampu menghasilkan pemasukan yang lebih besar. Harga ikan hias yang memiliki bentuk, warna, corak yang indah akan berharga cukup mahal. Hasil budidaya ikan hias lebih menekankan kualitas sehingga bisa dilakukan di lahan sempit dan bisa dilakukan sebagai usaha sampingan (Tinangon 2010).
Begitu banyak agen penyakit yang menyerang spesies ikan hias di Indonesia. Beragam jenis penyakit pada ikan tersebut disebabkan oleh jamur, bakteri, protozoa maupun virus. Beberapa penyakit yang disebabkan oleh protozoa antara lain: Ichtyophthirius multifilis, Trichodina heterodentata, Tetrahymena sp, dan Cryptocaryon, sedangkan beberapa penyakit yang disebabkan oleh cacing antara lain: Lernaea sp., Argulus sp., Gyrodactylus sp., dan Dactylogyrus sp. (Alifuddin et al. 2002). Penyakit yang disebabkan cendawan adalah Saprolegnia sp., Achlya sp.. Penyakit yang disebabkan oleh bakteri yaitu Aeromonas sp., Pseudomonas sp., Mycobacteria sp., Columnaris sp., Flexibacter sp., Myxobacteria sp., dan Edwardsiella sp.. Penyakit yang disebabkan oleh virus adalah Infectious pancreatic necrosis, Channel catfish virus, Viral hemorrhagic septicemia, Swim bladder inflammation, dan Koi Herpes Virus (Kordi & Ghufran 2004).
2
termasuk dokter hewan yang memiliki peranan yang besar untuk mengatasi penyakit-penyakit tersebut. Dalam mendukung semuanya itu perlu diterapkannya ilmu patologi untuk dapat mengetahui lebih lanjut penyakitnya serta tata cara penanganan penyakit tersebut. Pemeriksaan patologi pada ikan hias bertujuan untuk mempelajari perubahan patologi anatomi dan histopatologi organ yang dapat disebabkan oleh gangguan infeksius dan non infeksius. Manfaat dari pemeriksaan patologi ini adalah dapat diperoleh informasi mengenai perubahan patologi pada organ-organ ikan hias serta penyebabnya sehingga dapat digunakan untuk strategi penanggulangan penyakit-penyakit pada ikan hias baik yang bersifat infeksius maupun non infeksius.
Tujuan Penelitian
Tujuan dari penelitian ini adalah untuk mempelajari kasus infeksi protozoa Tetrahymena spp. yang ditemukan, dengan mempelajari morfologi parasit dalam irisan jaringan ikan Guppy (Poecilia reticulata) serta melakukan analisa patogenesa penyakit berdasarkan lesi histopatologi yang ditemukan.
Manfaat Penelitian
Manfaat yang diharapkan dari penelitian ini adalah diperoleh data mengenai kasus kejadian penyakit yang terjadi pada ikan Guppy (Poecilia reticulata). Selain itu, tulisan ini diharapkan dapat memberikan masukkan untuk berbagai pihak yang berkaitan dengan kesehatan ikan hias untuk mendukung manajemen pengelolaan budidaya ikan hias
TINJAUAN PUSTAKA
Guppy (Poecilia reticulata)
2
termasuk dokter hewan yang memiliki peranan yang besar untuk mengatasi penyakit-penyakit tersebut. Dalam mendukung semuanya itu perlu diterapkannya ilmu patologi untuk dapat mengetahui lebih lanjut penyakitnya serta tata cara penanganan penyakit tersebut. Pemeriksaan patologi pada ikan hias bertujuan untuk mempelajari perubahan patologi anatomi dan histopatologi organ yang dapat disebabkan oleh gangguan infeksius dan non infeksius. Manfaat dari pemeriksaan patologi ini adalah dapat diperoleh informasi mengenai perubahan patologi pada organ-organ ikan hias serta penyebabnya sehingga dapat digunakan untuk strategi penanggulangan penyakit-penyakit pada ikan hias baik yang bersifat infeksius maupun non infeksius.
Tujuan Penelitian
Tujuan dari penelitian ini adalah untuk mempelajari kasus infeksi protozoa Tetrahymena spp. yang ditemukan, dengan mempelajari morfologi parasit dalam irisan jaringan ikan Guppy (Poecilia reticulata) serta melakukan analisa patogenesa penyakit berdasarkan lesi histopatologi yang ditemukan.
Manfaat Penelitian
Manfaat yang diharapkan dari penelitian ini adalah diperoleh data mengenai kasus kejadian penyakit yang terjadi pada ikan Guppy (Poecilia reticulata). Selain itu, tulisan ini diharapkan dapat memberikan masukkan untuk berbagai pihak yang berkaitan dengan kesehatan ikan hias untuk mendukung manajemen pengelolaan budidaya ikan hias
TINJAUAN PUSTAKA
Guppy (Poecilia reticulata)
3
Gambar 1 Poecilia reticulata (Sumber : Monks 2012)
Penyakit pada Ikan Guppy
Penyakit yang menyerang spesies ikan hias Guppy beragam. Beragam jenis penyakit pada ikan tersebut disebabkan oleh jamur, bakteri, parasit maupun virus. Pada tahun 2001, fungi Achyla bisexualis dilaporkan menginfeksi Guppy di Thailand. Hasil penelitian tersebut menyatakan Achyla bisexualis merupakan infeksi sekunder setelah infeksi dari Tetrahymena sp. dan tidak menyebabkan kematian pada Guppy (Lawhavinit et al. 2002). Saprolegnia juga dilaporkan dapat menyerang ikan Guppy (Khalil 2010). Penelitian inventaris parasit pada ikan hias Guppy kobra yang dilalulintaskan melalui Bandara Soekarno-Hatta, Cengkareng, Jakarta ditemukan parasit Trichodina hetero-dentata dan Lernea di permukaan tubuhnya (Alifuddin et al. 2002). Infeksi Tetrahymena sp. telah didiagnosa pada Guppy yang diimpor dari Singapura. Ciliata mengelilingi organ internal, regio peri-orbital mata dan ditemukan dalam embrio Guppy yang sedang berkembang (Leibowitz & Zilberg 2009).
4
Gejala Klinis Ikan Sakit
Ikan yang sakit menimbulkan gejala-gejala klinis yang spesifik. Menurut Kordi dan Ghufran (2004), ciri ikan yang sakit dapat ditinjau dari segi perilaku, equilibrium, lesi eksternal, dan faktor kondisi. Perilaku ikan sakit biasanya tidak normal. Ikan sering terlihat menggosok-gosokan tubuhmya pada suatu permukaan benda dan tidak mau makan. Ikan yang sakit akan memisahkan diri dan berenang secara pasif. Ikan yang terserang penyakit, keseimbangannya terganggu, meloncat-loncat tidak teratur, dan terkadang dapat menabrak dinding bak. Lesi eksternal adalah abnomalitas dari organ tubuh tertentu karena adanya serangan penyakit. Lesi eksternal pada ikan antara lain terjadi perubahan warna, produksi lendir yang berlebihan, kerusakan organ seperti kulit, sirip, insang, dan ulkus (Kordi & Ghufran 2004).
METODE PENELITIAN
Waktu dan Tempat
Penelitian ini dilaksanakan selama 6 bulan, dimulai dari bulan April sampai September 2012. Penelitian diawali dengan pengambilan sampel ikan hias air tawar yang terlihat mengalami penyakit. Tempat pengambilan sampel dilakukan di tempat jual beli ikan hias Toko Ikanku, Babakan Tengah, kelurahan Babakan Kampus IPB, Dramaga Bogor. Setelah dilakukan pemeriksaan patologi anatomi, kemudian sampel ikan dijadikan sediaan histopatologi sehingga dapat diperiksa lebih lanjut. Pembuatan histopatologi, pemeriksaan, dan interpretasi dilakukan di Laboratorium Diagnostik Patologi, Bagian Patologi Departemen Klinik Reproduksi dan Patologi (KRP), Fakultas Kedokteran Hewan, Institut Pertanian Bogor (FKH IPB), dilanjutkan dengan penyusunan laporan hasil pemeriksaan.
Alat dan Bahan
4
Gejala Klinis Ikan Sakit
Ikan yang sakit menimbulkan gejala-gejala klinis yang spesifik. Menurut Kordi dan Ghufran (2004), ciri ikan yang sakit dapat ditinjau dari segi perilaku, equilibrium, lesi eksternal, dan faktor kondisi. Perilaku ikan sakit biasanya tidak normal. Ikan sering terlihat menggosok-gosokan tubuhmya pada suatu permukaan benda dan tidak mau makan. Ikan yang sakit akan memisahkan diri dan berenang secara pasif. Ikan yang terserang penyakit, keseimbangannya terganggu, meloncat-loncat tidak teratur, dan terkadang dapat menabrak dinding bak. Lesi eksternal adalah abnomalitas dari organ tubuh tertentu karena adanya serangan penyakit. Lesi eksternal pada ikan antara lain terjadi perubahan warna, produksi lendir yang berlebihan, kerusakan organ seperti kulit, sirip, insang, dan ulkus (Kordi & Ghufran 2004).
METODE PENELITIAN
Waktu dan Tempat
Penelitian ini dilaksanakan selama 6 bulan, dimulai dari bulan April sampai September 2012. Penelitian diawali dengan pengambilan sampel ikan hias air tawar yang terlihat mengalami penyakit. Tempat pengambilan sampel dilakukan di tempat jual beli ikan hias Toko Ikanku, Babakan Tengah, kelurahan Babakan Kampus IPB, Dramaga Bogor. Setelah dilakukan pemeriksaan patologi anatomi, kemudian sampel ikan dijadikan sediaan histopatologi sehingga dapat diperiksa lebih lanjut. Pembuatan histopatologi, pemeriksaan, dan interpretasi dilakukan di Laboratorium Diagnostik Patologi, Bagian Patologi Departemen Klinik Reproduksi dan Patologi (KRP), Fakultas Kedokteran Hewan, Institut Pertanian Bogor (FKH IPB), dilanjutkan dengan penyusunan laporan hasil pemeriksaan.
Alat dan Bahan
5 Metode Penelitian
Studi manajemen budidaya ikan hias
Sebelum dilakukan pengamatan dan pengambilan sampel, perlu dipelajari studi manajemen ikan untuk mengetahui pembenihan, perawatan serta pengolahan ikan dengan baik agar dapat dibandingkan dengan gejala-gejala klinis yang terjadi pada ikan serta memahami adanya penyakit infeksius ataupun non infeksius. Pengambilan sampel
Pengamatan ikan dilakukan terlebih dahulu untuk dapat mengetahui ikan mana yang mengalami kelainan. Pengambilan sampel dilakukan pada ikan yang terlihat mengalami kelainan. Kelainan pada ikan diantaranya tampak ada sesuatu yang menempel pada tubuh ikan terutama di bawah sisik atau pada pangkal sirip, terjadi perubahan warna atau bentuk, hilang keseimbangan, ikan berenang mendekati permukaaan terus menerus, lemah dan nafsu makan turun, kerusakan pada jaringan insang atau kulit ikan, terdapat luka, dan terdapat pendarahan pada organ atau jaringan.
Transportasi sampel ke laboratorium
Sampel dibawa dengan kantong plastik berukuran cukup luas yang ditambahkan oksigen ke dalamnya. Saat mengganti tempat dari plastik menuju bak ikan di laboratorium, harus dilakukan secara teliti, jangan sampai suhu pada air berubah.
Pencatatan data sampel
Ikan sampel yang terlihat gejala klinisnya berjumlah 5 ekor. Pencatatan data sampel meliputi deskripsi tempat pengambilan sampel, jumlah ikan yang terinfeksi, warna, tingkah laku, dan umur ikan yang terinfeksi (Stoskopf 1993). Pada studi kasus ini ikan Guppy dengan infeksi Tetrahymena spp hanya ditemukan pada 1 dari 5 ekor yang diperiksa, sehingga jumlah sampel pada studi kasus ini adalah 1 ekor.
Euthanasi
Ikan di-euthanasi dengan cara dimasukkan ke dalam wadah berisi air, kemudian diletakkan ke dalam freezer dengan suhu -18°C selama 20 menit. Pendinginan ini akan menurunkan metabolisme dan tidak meningkatkan ambang nyeri (Noga 2010).
Nekropsi
6
Pemeriksaan patologi anatomi
Ikan yang sudah dinekropsi diamati lesi dan abnormalitas lainnya dari jaringan eksterna serta organ interna. Semua lesi dan abnormalitas didokumentasi menggunakan kamera. Penggaris diposisikan di samping ikan terlebih dahulu agar ukuran ikan dapat diketahui.
Fiksasi
Ikan yang sudah dinekropsi dan didokumentasi kemudian difiksasi menggunakan NBF 10% selama 24 jam. Ikan dapat langsung dimasukkan ke dalam wadah NBF 10% tanpa memisahkan organ-organ karena ukurannya yang relatif kecil atau kurang dari 10 cm.
Pembuatan sediaan histopatologi
Tubuh ikan yang sudah difiksasi kemudian dipotong (grossing) melintang dan dibagi atas lima sampai enam bagian, lalu dimasukkan ke dalam kaset jaringan. Hal ini dimaksudkan agar seluruh bagian ikan mulai dari insang hingga ginjal posterior dapat terlihat dalam pemeriksaan histopatologi. Potongan kemudian diproses menjadi sediaan histopatologi dengan pewarnaan Hematoksilin Eosin (HE) dan Periodic Acid-Schiff (PAS) (Bancroft dan Stevens 1990) (Lampiran 1).
Pemeriksaan histopatologi
Preparat yang telah dibuat kemudian diamati di bawah mikroskop cahaya untuk melihat perubahan pada sel ataupun organ.
Identifikasi parasit protozoa
Mengidentifikasi protozoa diperlukan penentuan karakteristik morfologi dan dilakukan pengukuran bentuk tubuh. Kemudian dilakukan pencarian mengenai literatur parasit protozoa mana yang memiliki morfologi dan ukuran serupa dengan protozoa yang ditemukan. Pengamatan keberadaan protozoa di jaringan dan lesi akibat invasi yang ditimbulkan dapat membantu proses identifikasi. Hasil yang ditemukan dicocokkan dengan literatur yang ada (Noga 2010).
Analisis data
7
HASIL DAN PEMBAHASAN
Hasil
Manajemen Budidaya Guppy
Tempat pengambilan sampel ikan hias Guppy (Poecilia reticulata) yang sakit pada studi kasus ini terletak di daerah Babakan Tengah, kelurahan Babakan Kampus IPB, Dramaga Bogor. Toko Ikanku merupakan tempat jual beli ikan hias. Toko Ikanku mengambil ikan dari para petani di daerah Bogor. Asal Guppy berasal dari daerah Parung dan Cibinong, Bogor. Petani ikan Guppy di Parung membudidayakan ikannya di kolam-kolam terbuka sedangkan petani ikan di Cibinong membudidayakan ikannya di dalam akuarium. Petani melakukan pemijahan ikan tersebut dilakukan di kolam dan ketika akan bertelur maka penetasan dilakukan di dalam akuarium hingga telur tersebut menjadi larva. Larva yang dihasilkan kemudian dimasukkan ke dalam kolam maupun akuarium. Ikan diberi pakan hidup berupa cacing sutera yang diperoleh dari lingkungan kotor, sungai, lumpur, dan hasil limbah. Petani ikan Guppy memakai air kolam terbuka yang memiliki resiko penyakit lebih tinggi.
Transportasi dari petani menuju Toko Ikanku menggunakan wadah plastik dan dibawa dengan menggunakan motor. Ikan pertama kali datang langsung dimasukkan akuarium karantina. Ikan dikarantina selama 3-5 hari disesuaikan suhu airnya 25-28 oC. Sebelum dimasukkan akuarium display dilakukan berbagai persiapan. Akuarium display dicuci bersih dengan methylene blue kemudian dikeringkan selama sehari. Sumber air berasal dari air sumur. Air yang digunakan untuk pemeliharaan di Toko Ikanku berasal dari air sumur yang mengandung tingkat oksigen yang rendah. Air sumur di tampung selama 1-2 hari di dalam reservoir dan diberi aerasi. Penampungan air bertujuan untuk menghilangkan gas karbondioksida dan gas beracun serta menurunkan pH.
Ikan Guppy ditempatkan dalam akuarium berukuran panjang x lebar x tinggi 40 x 25 x 25 sentimeter dengan kepadatan dalam akuarium 100 ekor ikan. Air yang digunakan adalah air yang cukup mengandung oksigen dan jernih. Ikan Guppy dipelihara dengan suhu optimal untuk pemeliharaan sekitar 25-28 ° C. Ikan diberi pakan hidup berupa cacing sutra. Ikan juga diberi pakan kering buatan. Pemilihan pakan ikan kering berdampak pada meningkatnya tingkat kekeruhan air. Pengamatan gejala klinis
8
Gambar 2 Ikan Guppy sampel ini menunjukkan gejala klinis dengan berenang secara vertikal.
Pemeriksaan patologi anatomi
[image:51.595.87.406.84.538.2]9
Gambar 3 (a) Ikan Guppy (Poecilia reticulata) mengalami lesi hemoragi dan ptekhie pada bagian dorsal dan lateral (panah). (b) Ikan Guppy (Poecilia reticulata) mengalami lesi hemoragi dan ptekhie pada bagian lateral dextra (panah). (c) Ikan Guppy (Poecilia reticulata) mengalami lesi hemoragi dan ptekhie pada bagian lateral sinistra (panah).
a
b
[image:52.595.109.513.68.533.2]10
[image:53.595.69.460.74.754.2]Gambar 4 Insang ikan Guppy (Poecilia reticulata) terlihat pucat namun tidak menunjukkan lesi yang spesifik.
Gambar 5 Organ internal rongga abdomen ikan Guppy (Poecilia reticulata). a. hati, b. usus, c. gonad.
Pemeriksaan patologi anatomi pada organ internal tidak menemukan kelainan yang signifikan. Insang, hati, usus dan folikel ovum berwarna pucat dan tidak ditemukan adanya lesi (Gambar 5). Pemeriksaan jantung, ginjal dan gelembung renang tidak dilakukan karena ukuran ikan sangat kecil (3,8 cm) sehingga sulit diidentifikasi. Pengamatan mikroskopis sangat diperlukan untuk pengamatan organ lebih lanjut.
Pemeriksaan histopatologi
Hasil pengamatan histopatologi pada sampel ikan Guppy menunjukkan jaringan kulit mengalami infiltrasi sel radang disertai protozoa yang menginvasi
a
b
[image:53.595.126.433.83.306.2]11 permukaan kulit hingga menembus ke lapisan otot. Pada kulit di sekitar lesi erosi juga ditemukan fokus-fokus hemoragi yang ditandai adanya sel