LAPORAN PRAKTIK KERJA PROFESI FARMASI INDUSTRI
Di
LEMBAGA FARMASI DIREKTORAT KESEHATAN ANGKATAN DARAT (LAFI DITKESAD)
BANDUNG
Disusun Oleh:
Norma Imelda Ambarita, S.Farm. NIM 113202040
PROGRAM STUDI PENDIDIKAN PROFESI APOTEKER FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
Lembar Pengesahan
LAPORAN PRAKTIK KERJA PROFESI APOTEKER
FARMASI INDUSTRI
Di
Lembaga Farmasi Direktorat Kesehatan Angkatan Darat (Lafi Ditkesad) Bandung
1-30 Mei 2012
Laporan ini disusun untuk melengkapi salah satu syarat untuk mencapai gelar Apoteker pada Fakultas Farmasi Universitas Sumatera Utara Medan
Disusun Oleh:
Norma Imelda Ambarita, S.Farm. NIM 113202040
Lafi Ditkesad Disetujui Oleh: Pembimbing PKPA,
Dra. Emmy Winarni, Apt. Mayor Ckm (K) NRP 32984
Medan, Juli 2012 Fakultas Farmasi
Universitas Sumatera Utara Dekan,
KATA PENGANTAR
Puji dan syukur kami panjatkan kepada Tuhan Yang Maha Esa atas berkat dan karunia-Nya sehingga penulis dapat menyelesaikan Praktek Kerja Profesi
Apoteker di Lembaga Farmasi Direktorat Kesehatan Angkatan Darat (Lafi Ditkesad) Bandung.
Pelaksanaan Praktek Kerja Profesi Apoteker di Lafi Ditkesad ini
berlangsung mulai tanggal 1 - 30 Mei 2012. Laporan ini merupakan hasil Praktek Kerja Profesi Apoteker (PKPA) yang dilaksanakan di Lafi Ditkesad sebagai salah
satu syarat untuk menyelesaikan Program Pendidikan Profesi Apoteker di Fakultas Farmasi Universitas Sumatera Utara.
Pada kesempatan ini penulis ingin mengucapkan terima kasih kepada
Bapak Prof. Dr. Sumadio Hadisahputra, Apt., selaku Dekan Fakultas Farmasi Universitas Sumatera Utara dan Bapak Drs. Wiryanto, M.S., Apt., selaku Ketua
Program Pendidikan Profesi Apoteker Fakultas Farmasi Universitas Sumatera Utara.
Pada kesempatan ini juga, penulis ingin mengucapkan terima kasih
kepada:
1. Letkol Ckm Drs. Hidayatulrachman, Apt., M.Si., selaku Perwira Pelaksana
Harian dan sebagai Kepala Lembaga Farmasi Direktorat Kesehatan Angkatan Darat.
2. Letkol Ckm (K) Dra. Nur Laila, Apt., M.Si., selaku Kepala Bagian
3. Letkol Ckm Drs. Joeda, Apt., selaku Pa Ahli Madya Analisis Mengenai Dampak Lingkungan Lembaga Farmasi Direktorat Kesehatan Angkatan Darat.
4. Letkol Ckm Drs. Edy Tri K, Apt., M.M., selaku Kepala Instalasi Pengawasan Mutu Lembaga Farmasi Direktorat Kesehatan Angkatan Darat..
5. Letkol Ckm Drs. Junaedi, Apt., selaku Kepala Instalasi Produksi Lembaga Farmasi Direktorat Kesehatan Angkatan Darat.
6. Mayor Ckm. (K). Dra. Emmy Winarni, Apt., selaku Kepala Seksi Penelitian
dan Pengembangan Produksi Instalasi Penelitian dan Pengembangan Lembaga Farmasi Direktorat Kesehatan Angkatan Darat dan sebagai
pembimbing PKPA.
7. Mayor Ckm Tantri Murdoyo, S.Si., Apt., selaku Kepala Seksi Perencanaan Program dan Anggaran Bagian Administrasi dan Logistik Lembaga Farmasi
Direktorat Kesehatan Angkatan Darat.
8. Mayor Ckm Drs. T.P.H. Simorangkir, Apt., M.Si., selaku Kepala Seksi Sediaan Khusus Instalasi Produksi dan selaku Koordinator Praktek Kerja
Mahasiswa di Lembaga Farmasi Direktorat Kesehatan Angkatan Darat. 9. Mayor Ckm Gogok Hariyanto, S.Si., Apt., M.Si., selaku Kepala Seksi
Sediaan Sefalosporin Instalasi Produksi Lembaga Farmasi Direktorat Kesehatan Angkatan Darat.
10. Mayor Ckm Martin, S.Si., Apt., selaku Kepala Instalasi Penyimpanan di
Lembaga Farmasi Direktorat Kesehatan Angkatan Darat.
11. Lettu Ckm (K) Anggita Candrasari, S. Farm., Apt., selaku Kepala Urusan
Instalasi Penelitian dan Pengembangan Lembaga Farmasi Direktorat Kesehatan Angkatan Darat.
12. Dra. Lisa Olii, Apt., M.Si., selaku Kepala Seksi Pengujian Kimia, Fisika,
dan Mikrobiologi Instalasi Pengawasan Mutu Lembaga Farmasi Direktorat Kesehatan Angkatan Darat.
13. Dra. Neneng Cahyati, Apt., selaku Kepala Seksi Kemas Instalasi Produksi Lembaga Farmasi Direktorat Kesehatan Angkatan Darat..
14. Bapak/Ibu serta seluruh staf Lembaga Farmasi Direktorat Kesehatan
Angkatan Darat yang telah memberikan bantuan, pengalaman, bimbingan, dan kerjasama selama pelaksanaan PKPA.
Penulis menyadari bahwa dalam penulisan laporan ini masih banyak terdapat kekurangan dan kesalahan. Penulis berharap semoga pengetahuan dan pengalaman yang diperoleh selama menjalani Praktek Kerja Profesi Apoteker ini
dapat memberikan manfaat bagi rekan-rekan sejawat dan semua pihak yang memerlukan.
Medan, Juli 2012
DAFTAR ISI
2.1.4 Penyelenggaraan Industri Farmasi ... 6
2.1.5 Pembinaan dan Pengawasan Industri Farmasi ... 7
2.2 Cara Pembuatan Obat yang Baik (CPOB) ... 7
2.2.12.2 Dokumentasi ... 17
2.2.12.3 Kualifikasi ... 18
III. TINJAUAN KHUSUS LAFI DITKESAD ... 20
3.1 Sejarah Lembaga Farmasi Ditkesad ... 20
3.2 Visi dan Misi Lafi Ditkesad ... 22
3.4.2 Eselon Pembantu Pimpinan ... 24
3.4.3 Eselon Pelayanan Yakni Tata Usaha dan Urusan Dalam .. 25
3.4.4 Eselon Pelaksana ... 26
3.5 Kualifikasi Tenaga Kerja Lafi Ditkesad ... 28
3.6 Kegiatan di Lafi Ditkesad ... 30
3.6.1 Kegiatan Bagminlog ... 30
3.6.2 Kegiatan Instalasi Pengawasan Mutu ... 31
3.6.3 Kegiatan Instalasi Penelitian dan Pengembangan ... 34
3.6.4 Kegiatan Instalasi Produksi ... 35
3.6.5 Kegiatan Instalasi Simpan ... 45
3.6.6 Kegiatan Pemeliharan dan Sistem Penunjang ... 48
4.7 Pengawasan Mutu ... 67
4.8 Inspeksi Diri dan Audit Mutu ... 67
4.9 Penanganan keluhan, penarikan kembali obat dan kembalian obat ... 67
4.10 Dokumentasi ... 68
4.11 Pembuatan dan analisis berdasarkan kontrak ... 68
4.12 Kualifikasi dan validasi ... 69
V. KESIMPULAN DAN SARAN ... 70
5.1 Kesimpulan ... 70
5.2 Saran ... 71
DAFTAR PUSTAKA ... 72
DAFTAR LAMPIRAN
Halaman
Lampiran 1 Struktur Organisasi Ditkesad ... 74
Lampiran 2 Struktur Organisasi Lembaga Farmasi Ditkesad ... 75
Lampiran 3 Struktur organisasi Instalasi Penyimpanan ... 76
Lampiran 4 Denah Bangunan ... 77
Lampiran 5 Sistem Pengawasan Mutu Lafi Ditkesad ... 78
Lampiran 6 Blanko Laporan Hasil Pengujian Laboratorium ... 79
Lampiran 7 Blanko Catatan Pengujian Tablet dan Kapsul ... 80
Lampiran 8 Blanko Laporan Hasil Pengujian Larutan/Sirup/Injeksi ... 81
Lampiran 9 Alur Proses Produksi Tablet Biasa/Salut Secara Granulasi Basah ... 82
Lampiran 10 Alur Produksi Tablet Biasa/Salut dengan Metode Cetak Langsung ... 83
Lampiran 11 Alur Produksi Kapsul ... 84
Lampiran 12 Alur Produksi Sirup ... 85
Lampiran 13 Alur Proses Cairan Obat Luar ... . 86
Lampiran 14 Alur Penerimaan Materil Produksi dari Gupus II Ditkesad ke Instalsimpan Lafi Ditkesad ... 87
Lampiran 15 Alur Materil Produksi Dari Instalsimpan Lafi Ditkesad Sampai Produk Jadi ... 88
Lampiran 16 Alur pengiriman Produk Jadi dari Instalsimpan Lafi ke Gupus II Ditkesad dan Distribusi ke Daerah ... 89
Lampiran 17 Blanko Bukti Penyerahan Bahan ... 90
Lampiran 18 Blanko Kartu Gudang ... 91
BAB I PENDAHULUAN
1.1 Latar Belakang
Pembangunan di bidang kesehatan sebagai salah satu upaya pembangunan nasional diarahkan pada tercapainya kesadaran, kemauan dan kemampuan untuk
hidup sehat bagi setiap penduduk agar dapat terwujud derajat kesehatan yang optimal. Oleh karena itu, kesehatan menjadi salah satu indikator tingkat
kesejahteraan manusia dan salah satu tolak ukur indeks pembangunan manusia (human development index) suatu bangsa. Adanya sumber daya manusia yang
berkualitas akan meningkatkan daya saing bangsa tersebut dalam persaingan
global saat ini. Salah satu komponen kesehatan yang sangat penting adalah tersedianya obat sebagai bagian dari pelayanan kesehatan masyarakat dan peran
industri farmasi sangat penting dalam memproduksi obat yang aman (safety), berkhasiat (efficacy) dan berkualitas (quality).
Industri farmasi sebagai industri penghasil obat, memiliki peran strategis
dalam usaha pelayanan kesehatan kepada masyarakat. Seiring dengan meningkatnya pendidikan dan tingkat kesadaran masyarakat akan arti pentingnya
kesehatan, maka industri farmasi dituntut untuk dapat menyediakan obat dalam jenis, jumlah dan kualitas yang memadai (Priyambodo, 2007).
Berdasarkan Peraturan Pemerintah No. 51 tahun 2009 tentang pekerjaan
kefarmasian dalam produksi sediaan farmasi harus memenuhi ketentuan Cara Pembuatan Obat yang Baik yang ditetapkan oleh Menteri Kesehatan RI.
Proses pembuatan obat dan alat kesehatan harus dilakukan dengan cara
produksi yang baik yaitu memenuhi syarat-syarat yang berlaku yang didukung oleh tenaga farmasi yang profesional dan kompeten. Maka industri farmasi dalam
pembuatan obat harus menerapkan acuan standar sebagai pedoman dalam pembuatan obat yang baik sesuai dengan Keputusan Menkes No. 43/Menkes/SK/11/1988 tentang Cara Pembuatan Obat yang Baik (CPOB) yang
mengharuskan pembuatan obat yang baik untuk menjamin mutu obat yang dihasilkan industri farmasi dalam seluruh aspek dan serangkaian kegiatan
produksi sehingga obat jadi yang dihasilkan memenuhi syarat mutu yang telah ditentukan dan sesuai dengan tujuan penggunaannya. Oleh karena itu seorang apoteker selaku penanggung jawab maupun pelaksana kegiatan industri perlu
memahami konsep Cara Pembuatan Obat yang Baik (CPOB), baik secara teoritis maupun praktis.
Peran apoteker dalam industri farmasi adalah melakukan pekerjaan
kefarmasian berupa pembuatan termasuk pengendalian mutu, pengamanan, pengadaan, penyimpanan dan distribusi sediaan farmasi serta alat kesehatan.
Seorang apoteker harus dapat menjamin penerapan Cara Pembuatan Obat yang Baik (CPOB) di berbagai bagian dalam industri farmasi untuk menjamin produksi obat dan alat kesehatan yang memenuhi persyaratan keamanan, kemanjuran dan
berkualitas. Guna mendukung kompetensi apoteker dalam melaksanakan pekerjaan kefarmasian secara praktis, maka Fakultas Farmasi Universitas
menyelenggarakan program PKPA yang dilaksanakan pada tanggal 1 Mei sampai 30 Mei 2012.
1.2 Tujuan
1. Mengetahui peran dan fungsi apoteker di industri farmasi.
2. Mengetahui penerapan seluruh aspek Cara Pembuatan Obat yang Baik
BAB II
TINJAUAN PUSTAKA
2.1 Industri Farmasi
2.1.1 Pengertian Industri Farmasi
Industri farmasi menurut Peraturan Menteri Kesehatan RI No. 1799/Menkes/Per/XII/2010 tentang Industri Farmasi adalah badan usaha yang memiliki izin dari Menteri Kesehatan untuk melakukan kegiatan pembuatan obat
atau bahan obat. Industri farmasi, sebagai industri penghasil obat, dituntut untuk dapat menghasilkan obat yang harus memenuhi persyaratan khasiat (efficacy),
keamanan (safety) dan mutu (quality) dalam dosis yang digunakan untuk tujuan kesehatan (Priyambodo, 2007).
Menurut Priyambodo (2007), dibandingkan dengan berbagai industri lain,
industri farmasi memiliki ciri yang spesifik. Ciri industri farmasi yang perlu diperhatikan antara lain:
1. Industri farmasi merupakan industri yang diatur secara ketat (seperti registrasi,
Cara Pembuatan Obat yang Baik, distribusi dan perdagangan produk yang dihasilkan, dan lain lain) karena menyangkut jiwa (nyawa) manusia.
2. Industri farmasi di samping menghasilkan obat untuk penderita, juga merupakan suatu industri yang berorientasi untuk memperoleh keuntungan (profit). Jadi tidak hanya aspek sosial namun juga ada aspek ekonomi (bisnis).
diinginkan karena penggunaan obat, industri farmasi dituntut dan membayar ganti rugi yang sangat besar.
4. Industri farmasi adalah industri berbasis riset yang selalu memerlukan inovasi,
karena usia hidup produk atau obat (product life cycle) relatif singkat (lebih kurang 10-25 tahun) dan sesudah itu akan ditemukan obat generasi baru yang
lebih baik, lebih aman dan lebih efektif. 2.1.2 Persyaratan Izin Industri Farmasi
Menurut Peraturan Menteri Kesehatan RI No. 1799/Menkes/Per/XII/2010 tentang Industri Farmasi, proses pembuatan obat dan/atau bahan obat hanya dapat dilakukan oleh industri farmasi.Setiap pendirian industri farmasi wajib
memperoleh izin industri farmasi dari Direktur Jenderal. Direktur Jenderal yang dimaksud adalah Direktur Jenderal pada Kementerian Kesehatan yang tugas dan tanggung jawabnya di bidang pembinaan kefarmasian dan alat kesehatan.
Persyaratan untuk memperoleh izin industri farmasi sebagaimana yang tercantum dalam Permenkes RI No. 1799/Menkes/Per/IX/2010 adalah sebagai berikut:
1. Berbadan usaha berupa perseroan terbatas
2. Memiliki rencana investasi dan kegiatan pembuatan obat 3. Memiliki Nomor Pokok Wajib Pajak
4. Memiliki paling sedikit 3 (tiga) orang apoteker Warga Negara Indonesia masing-masing sebagai penanggung jawab pemastian mutu, produksi, dan pengawasan mutu
5. Komisaris dan direksi tidak pernah terlibat, baik langsung ataupun tidak langsung dalam pelanggaran peraturan perundang-undangan di bidang
Dikecualikan dari persyaratan di atas poin 1 dan 2, bagi pemohon izin industri farmasi milik Tentara Nasional Indonesia dan Kepolisian Negara Republik Indonesia.
2.1.3 Tata Cara Pemberian Izin Usaha Industri Farmasi
Berdasarkan Permenkes RI No. 1799/Menkes/Per/IX/2010, untuk
memperoleh izin usaha industri farmasi diperlukan persetujuan prinsip. Permohonan persetujuan prinsip diajukan secara tertulis kepada Direktur Jenderal. Persetujuan prinsip diberikan oleh Direktur Jenderal setelah pemohon
memperoleh persetujuan Rencana Induk Pembangunan (RIP) dari Kepala Badan. Dalam hal permohonan persetujuan prinsip telah diberikan, pemohon dapat
langsung melakukan persiapan, pembangunan, pengadaan, pemasangan, dan instalasi peralatan, termasuk produksi percobaan dengan memperhatikan ketentuan peraturan perundang-undangan. Persetujuan prinsip ini berlaku selama
3 (tiga) tahun dan dapat diubah berdasarkan permohonan dari pemohon izin industri farmasi yang bersangkutan.
2.1.4 Penyelenggaraan Industri Farmasi Suatu industri farmasi mempunyai fungsi: a. Pembuatan obat dan/atau bahan obat
b. Pendidikan dan pelatihan c. Penelitian dan pengembangan
Izin industri farmasi berlaku untuk seterusnya selama industri farmasi
yang bersangkutan masih berproduksi dan memenuhi ketentuan peraturan perundang-undangan (Peraturan Menteri Kesehatan RI No.
2.1.5 Pembinaan dan Pengawasan Industri Farmasi
Pembinaan terhadap pengembangan Industri Farmasi dilakukan oleh Direktur Jenderal, sedangkan pengawasan dilakukan oleh Kepala Badan.
Pelanggaran terhadap ketentuan dalam Permenkes RI No. 1799/Menkes/Per/IX/2010 dapat dikenakan sanksi administratif berupa :
a. Peringatan secara tertulis
b. Larangan mengedarkan untuk sementara waktu dan/atau perintah untuk penarikan kembali obat atau bahan obat dari peredaran bagi obat atau bahan
obat yang tidak memenuhi standar dan persyaratan keamanan, khasiat/manfaat, atau mutu
c. Perintah pemusnahan obat atau bahan obat, jika terbukti tidak memenuhi persyaratan keamanan, khasiat/manfaat, atau mutu
d. Penghentian sementara kegiatan
e. Pembekuan izin industri farmasi f. Pencabutan izin industri farmasi
2.2 Cara Pembuatan Obat yang Baik
Cara Pembuatan Obat yang Baik (CPOB) bertujuan untuk menjamin obat dibuat secara konsisten, memenuhi persyaratan yang ditetapkan dan sesuai dengan
tujuan penggunaannya. CPOB mencakup seluruh aspek produksi dan pengendalian mutu (Anonim, 2006).
Ruang lingkup CPOB meliputi manajemen mutu, personalia, bangunan
produk dan produk kembalian, dokumentasi, pembuatan dan analisis berdasarkan kontrak, serta kualifikasi dan validasi (Anonim, 2006).
2.2.1 Manajemen Mutu
Industri farmasi harus membuat obat sedemikian rupa agar sesuai dengan tujuan penggunaannya, memenuhi persyaratan yang tercantum dalam izin edar
(registrasi) dan tidak menimbulkan resiko yang membahayakan penggunanya karena tidak aman, mutu rendah atau tidak efektif. Manajemen mutu bertanggung jawab untuk pencapaian tujuan ini melalui suatu “Kebijakan Mutu” yang
memerlukan partisipasi dan komitmen dari semua jajaran di semua departemen di dalam perusahaan, para pemasok, dan para distributor (Anonim, 2006).
Menurut Anonim (2009), untuk melaksanakan Kebijakan Mutu dibutuhkan 2 unsur dasar:
1. Sistem mutu yang mengatur struktur organisasi, tanggung jawab dan
kewajiban, semua sumber daya yang diperlukan, semua prosedur yang mengatur proses yang ada.
2. Tindakan sistematis untuk melaksanakan sistem mutu, yang disebut pemastian
mutu atau quality assurance.
2.2.2 Personalia
Berdasarkan Peraturan Pemerintah RI No. 51 tahun 2009, industri farmasi harus memiliki 3 (tiga) orang apoteker sebagai penanggung jawab masing-masing pada bidang pemastian mutu, produksi, dan pengawasan mutu setiap produksi
Sediaan Farmasi.
Sumber daya manusia sangat penting dalam pembentukan dan penerapan
sebab itu industri farmasi farmasi bertanggung jawab untuk menyediakan personil yang terkualifikasi dalam jumlah yang memadai untuk melaksanakan semua tugas (Anonim, 2006).
2.2.3 Bangunan dan Fasilitas
Bangunan dan fasilitas untuk pembuatan obat hendaklah memiliki desain,
konstruksi, letak yang memadai dan kondisi yang sesuai serta perawatan yang dilakukan dengan baik untuk memudahkan pelaksanaan operasi yang benar. Tata letak dan desain ruangan harus dibuat sedemikian rupa untuk memperkecil
terjadinya resiko kekeliruan, pencemaran silang dan kesalahan lain serta memudahkan pembersihan, sanitasi dan perawatan yang efektif untuk
menghindari pencemaran silang, penumpukan debu atau kotoran dan dampak lain yang dapat menurunkan mutu obat (Anonim, 2006).
Untuk pengolahan produk yang mengandung bahan yang beracun dan
bahan sitotoksik, harus disediakan fasilitas tersendiri untuk masing-masing produk, dengan sistem penyaringan udara khusus (efisiensi minimum 98%). Sedangkan untuk sediaan beta laktam (turunana penisillin) harus terpisah secara
fisik dengan bangunan non-beta laktam (Priyambodo, 2007).
2.2.4 Peralatan
Peralatan yang digunakan dalam pembuatan obat hendaklah memiliki rancang bangun dan konstruksi yang tepat, ukuran yang memadai, dan ditempatkan dengan tepat sehingga mutu dari setiap produk obat terjamin secara
teratur melalui program perawatan untuk mencegah cacat fungsi atau kontaminasi yang dapat mengubah identitas, kualitas atau kemurnian suatu produk (Anonim, 2006).
2.2.5 Sanitasi dan Higiene
Tingkat sanitasi dan higiene yang tinggi diterapkan pada setiap aspek
pembuatan obat. Ruang lingkup meliputi personalia, bangunan, peralatan, dan perlengkapan, bahan produksi serta wadahnya, dan setiap hal yang dapat merupakan sumber pencemaran produk. Sumber pencemaran dihilangkan melalui
suatu program sanitasi dan higiene yang menyeluruh serta terpadu (Anonim, 2006).
Sanitasi dan higiene yang diatur dalam pedoman CPOB terbaru adalah terhadap personalia, bangunan, dan peralatan. Prosedur sanitasi dan higiene divalidasi serta dievaluasi secara berkala untuk memastikan efektivitas prosedur
agar selalu memenuhi persyaratan (Anonim, 2006). 2.2.6 Produksi
Produksi hendaklah dilaksanakan dengan mengikuti prosedur yang telah
ditetapkan dan memenuhi ketentuan CPOB yang senantiasa dapat menjamin produk obat jadi dan memenuhi ketentuan izin pembuatan serta izin edar
(registrasi) (Anonim, 2006).
Produksi hendaklah dilakukan dan diawasi oleh personil yang kompeten. Menurut Anonim (2006), aspek yang perlu diperhatikan dalam proses produksi
a. Penanganan terhadap bahan awal.
Setiap bahan awal, sebelum dinyatakan lulus untuk digunakan hendaklah memenuhi spesifikasi bahan awal yang sudah ditetapkan dan diberi label dengan
nama yang dinyatakan dalam spesifikasi. Pada saat penerimaan, hendaklah dilakukan pemeriksaan secara visual tentang kondisi umum, keutuhan wadah,
segelnya, kebocoran, kemungkinan adanya kerusakan bahan, dan kesesuaian catatan pengiriman dengan label dari pemasok. Bahan awal yang diterima hendaklah dikarantina sampai disetujui dan diluluskan untuk pemakaian oleh
kepala bagian pengawasan mutu. Persediaan bahan awal hendaklah diperiksa dalam selang waktu tertentu. Bahan awal yang cenderung rusak atau turun
potensinya atau aktifitasnya selama dalam penyimpanan hendaknya ditandai secara jelas, disimpan terpisah dan secepatya dimusnahkan atau dikembalikan kepada pemasok.
b. Validasi proses
Semua kegiatan produksi hendaklah divalidasi dengan tepat, hal tersebut bertujuan untuk menguatkan pelaksanaan CPOB. Validasi hendaklah
dilaksanakan menurut prosedur yang telah ditentukan dan catatan hasilnya disimpan dengan baik. Perubahan penting dalam proses, peralatan atau bahan
harus divalidasi ulang untuk menjamin bahwa perubahan tersebut tetap menghasilkan produk yang memenuhi spesifikasi yang telah ditentukan.
c. Pencegahan pencemaran silang
Setiap tahap proses, produk, dan bahan hendaklah dilindungi terhadap pencemaran mikroba dan pencemaran lain yang dapat timbul akibat tidak
yang sedang diproses, dari sisa yang tertinggal pada alat dan pakaian kerja operator. Sistem penghisap udara yang efektif hendaknya dipasang untuk menghindari pencemaran dari produk atau proses lain.
d. Sistem penomoran batch dan lot
Sistem ini diperlukan untuk memastikan bahwa produk antara, produk
ruahan atau produk jadi suatu bets atau lot dapat dikenali dengan nomor bets atau lot tertentu dan tidak digunakan secara berulang.
e. Penimbangan dan penyerahan
Penimbangan atau perhitungan dan penyerahan bahan awal, bahan pengemas, produk antara, dan produk ruahan dianggap sebagai bagian dari siklus
produksi dan memerlukan dokumentasi yang lengkap. Hanya bahan awal, bahan pengemas, produk antara dan produk ruahan yang telah diluluskan oleh pengawasan mutu dan masih belum kadaluarsa yang dapat diserahkan.
f. Pengolahan
Semua bahan dan peralatan yang digunakan dalam proses pengolahan hendaklah diperiksa terlebih dahulu. Semua kegiatan pengolahan hendaklah
dilaksanakan mengikuti prosedur tertulis yang telah ditentukan. Bahan yang dapat diolah ulang melalui prosedur tertentu yang disahkan serta hasilnya memenuhi
persyaratan spesifikasi yang ditentukan dan tidak mempengaruhi mutu dimana semua proses pengolahan ulang hendaklah disahkan dan didokumentasikan. Pencegahan pencemaran silang dilakukam untuk setiap pengolahan.
g. Pengemasan
Pengemasan berfungsi membagi-bagi dan mengemas produk ruahan
pengawasan yang ketat untuk menjaga identitas, keutuhan, dan mutu produk akhir yang dikemas. Produk jadi yang sudah dikemas hendaklah dikarantina sambil menungu pelulusan dari bagian pengawasan mutu.
h. Pengawasan selama proses
Pengawasan tersebut dimaksudkan untuk memantau hasil dan memvalidasi
kinerja dari proses produksi yang mungkin menjadi penyebab variasi karakteristik produk selama proses berjalan.
i. Penanganan bahan dan produk yang ditolak, dipulihkan dan dikembalikan
Bahan dan produk yang ditolak hendaklah diberi penandaan yang jelas dan disimpan terpisah di area terlarang (restricted area). Bahan atau produk tersebut
hendaklah dikembalikan kepada pemasoknya atau, bila dianggap perlu diolah ulang atau dimusnahkan. Langkah apapun yang diambil hendaklah lebih dulu disetujui oleh kepala bagian Manajemen Mutu (Pemastian Mutu) dan dicatat.
j. Karantina produk jadi dan penyerahan ke gudang obat jadi
Karantina produk jadi merupakan tahap akhir pengendalian sebelum penyerahan ke gudang dan siap untuk didistribusikan. Selama menunggu
pelulusan dari bagian manajemen mutu, seluruh bets/lot yang sudah dikemas hendaknya disimpan dalam status karantina. Setelah pelulusan, produk tersebut
dipindahkan dari daerah karantina ke gudang produk jadi.
k. Penyimpanan bahan awal, bahan pengemas, produk antara, produk ruahan dan produk jadi. Bahan atau produk hendaknya disimpan rapi dan teratur
untuk mencegah risiko tercampur baur atau pencemaran serta memudahkan pemeriksaan dan pemeliharaan. Hendaknya semuanya disimpan dalam kondisi
l. Pengiriman dan pengangkutan produk jadi
Pengawasan distribusi produk jadi pada sistem distribusi hendaknya dirancang dengan tepat sehingga menjamin produk jadi yang pertama masuk akan
didistribusikan terlebih dahulu. Pengiriman dan pengangkutan produk dilakukan setelah ada permintaan pengiriman.
2.2.7 Pengawasan Mutu
Pengawasan mutu adalah bagian yang esensial dari cara pembuatan obat yang baik untuk memastikan tiap obat yang dibuat senantiasa memenuhi
persyaratan mutu yang sesuai dengan tujuan penggunaannya. Keterlibatan dan rasa tanggung jawab semua unsur yang berkepentingan dalam seluruh rangkaian
pembuatan adalah mutlak untuk mencapai sasaran mutu yang ditetapkan mulai dari saat obat dibuat sampai distribusi obat jadi (Anonim, 2001)
Pengawasan mutu mencakup semua kegiatan yang dilakukan di
laboratorium, termasuk pengambilan sampel, pemeriksaan dan pengujian bahan awal, produk antara, produk ruahan dan produk jadi. Kegiatan ini juga mencakup uji stabilitas, program pemantauan lingkungan, pengujian yang dilakukan dalam
rangka validasi, penanganan sampel pertinggal, menyusun dan memperbaharui spesifikasi bahan dan produk, serta metode pengujiannya (Anonim, 2006).
2.2.8 Inspeksi Diri dan Audit Mutu
Tujuan inspeksi diri adalah untuk mengevaluasi apakah semua aspek produksi dan pengawasan mutu industri farmasi memenuhi ketentuan CPOB.
Program inspeksi diri hendaklah dirancang untuk mendeteksi kelemahan dalam pelaksanaan CPOB dan untuk menetapkan tindakan perbaikan yang diperlukan
Inspeksi diri hendaklah dilakukan secara independen dan rinci oleh petugas yang kompeten dari perusahaan. Ada manfaatnya juga bila menggunakan auditor luar yang independen. Inspeksi diri hendaklah dilakukan secara rutin dan
pada situasi khusus, misalnya bila terjadinya penarikan kembali obat jadi atau terjadi penolakan yang berulang. Semua saran untuk tindakan perbaikan supaya
dilaksanakan. Prosedur dan catatan inspeksi diri hendaklah didokumentasikan dan dibuat program tindak lanjut yang efektif (Anonim, 2006).
Inspeksi diri dapat dilakukan oleh tiap bagian sesuai dengan kebutuhan
pabrik, namun inspeksi diri yang dilakukan secara menyeluruh dilaksanakan minimal satu kali dalam setahun. Frekuensi inspeksi diri tertulis dalam prosedur
tetap inspeksi diri (Anonim, 2006).
Penyelenggaraan audit mutu berguna sebagai pelengkap inspeksi diri. Audit mutu meliputi pemeriksaan dan penilaian semua atau sebagian dari sistem
manajemen mutu dengan tujuan spesifik untuk meningkatkan mutu. Audit mutu umumnya dilaksanakan oleh spesialis dari luar atau independen atau tim yang dibentuk khusus untuk hal ini oleh manajemen perusahaan (Anonim, 2006).
2.2.9 Penanganan Keluhan Terhadap Produk, Penarikan Kembali Produk dan Produk Kembalian
Penarikan kembali produk adalah suatu penarikan kembali dari satu atau beberapa bets atau seluruh bets produk tertentu dari peredaran. Hal ini dilakukan
bila ada produk yang merugikan yang serius serta berisiko terhadap kesehatan (Anonim, 2006).
Obat kembalian adalah obat jadi yang telah beredar yang kemudian
sehingga menimbulkan keraguan akan keamanan, identitas, mutu dan jumlah obat yang bersangkutan (Anonim, 2006).
Penanganan keluhan dan laporan hendaknya dicatat dan secepatnya
ditangani kemudian dilakukan penelitian dan evaluasi. Tindak lanjut dilakukan berupa tindakan perbaikan, penarikan produk dan dilaporkan kepada pemerintah
yang berwenang (Anonim, 2006).
Pencatatan dilakukan untuk penanganan obat kembalian dan dilaporkan, dan setiap pemusnahan dibuatkan berita acara yang ditandatangani oleh pelaksana
dan yang menyaksikan pemusnahan (Anonim, 2006). 2.2.10 Dokumentasi
Dokumentasi adalah bagian dari sistem informasi manajemen dan dokumentasi yang baik merupakan bagian yang esensial dari pemastian mutu. Dokumentasi yang jelas adalah fundamental untuk memastikan bahwa tiap
personil menerima uraian tugas yang relevan secara jelas dan rinci sehingga memperkecil resiko terjadi salah tafsir dan kekeliruan yang biasanya btimbul karena hanya mengandalkan komunikasi lisan (Anonim, 2006).
2.2.11 Pembuatan dan Analisis berdasarkan Kontrak
Pembuatan dan analisis berdasarkan kontrak harus dibuat secara benar,
disetujui dan dikendalikan untuk menghindari kesalahpahaman yang dapat menyebabkan produk atau pekerjaan dengan mutu yang tidak memuaskan. Kontrak tertulis antara pemberi kontrak dan penerima kontrak harus dibuat secara
diedarkan yang menjadi tanggung jawab penuh kepala bagian manajemen mutu (Pemastian Mutu) (Anonim, 2006).
2.2.12 Kualifikasi dan Validasi.
CPOB mensyaratkan industri farmasi untuk mengidentifikasi validasi yang perlu dilakukan sebagai bukti pengendalian terhadap aspek kritis dari kegiatan
yang dilakukan. Perubahan signifikan terhadap fasilitas, peralatan dan proses dapat mempengaruhi mutu produk hendaklah divalidasi (Anonim, 2006).
2.2.12.1 Perencanaan Validasi
Seluruh kegiatan validasi hendaklah direncanakan. Unsur utama program validasi hendaklah dirinci dengan jelas dan didokumentasikan di dalam Rencana
Induk Validasi (RIV) atau dokumen setara. RIV sekurang-kurangnya mencakup: kebijaksanaan validasi; struktur organisasi kegiatan validasi; ringkasan fasilitas, sistem, peralatan dan proses yang akan divalidasi; format dokumen, protokol, dan
laporan validasi, perencanaan dan jadwal pelaksanaan; pengendalian perubahan; acuan dokumen yang digunakan (Anonim, 2006).
2.2.12.2 Dokumentasi
Protokol validasi tertulis hendaklah dibuat untuk merinci kualifikasi dan validasi yang akan dilakukan. Protokol hendaklah dikaji dan disetujui oleh kepala
bagian Manajemen Mutu (Pemastian Mutu). Hendaklah dibuat laporan yang mengacu pada protokol kualifikasi dan/atau protokol validasi dan memuat ringkasan hasil yang diperoleh, tanggapan terhadap penyimpangan yang terjadi,
kesimpulan dan rekomendasi perbaikan tiap perubahan terhadap rencana yang ditetapkan dalam protokol hendaklah didokumentasikan dengan pertimbangan
2.2.12.3 Kualifikasi
Kualifikasi dibedakan atas : 1. Kualifikasi Desain (KD)
Kualifikasi desain (KD) adalah unsur pertama dalam melakukan validasi terhadap fasilitas, sistem atau peralatan baru.
2. Kualifikasi instalasi (KI)
Kualifikasi Instalasi adalah (KI) hendaklah dilakukan terhadap fasilitas, sistem dan peralatan baru atau yang dimodifikasi.
KI hendaklah mencakup, tidak terbatas pada hal berikut:
a. Instalasi peralatan, pipa dan sarana penunjang dan instrumentasi hendaklah
sesuai dengan spesifikasi dan gambar teknik yang didesain;
b. Pengumpulan dan penyusunan dokumen pengoperasian peralatan dari pemasok
c. Ketentuan dan persyaratan kalibrasi d. Verifikasi bahan konstruksi.
3. Kualifikasi Operasional (KO)
KO hendaklah dilakukan setelah KI selesai dilaksanakan, dikaji dan disetujui.
KO hendaklah mencakup, tidak terbatas pada hal berikut:
a. Pengujian yang perlu dilakukan berdasarkan pengetahuan tentang proses, sistem dan peralatan.
4. Kualifikasi Kinerja (KK)
KK hendaklah dilakukan setelah KI dan KO selesai dilaksanakan, dikaji dan disetujui.
5. Kualifikasi Fasilitas, Peralatan dan Sistem Terpasang yang telah Operasional.
Hendaklah tersedia bukti untuk mendukung dan memverifikasi parameter operasional dan batas variabel kritis pengoperasian alat. Selain itu, kalibrasi, prosedur pengoperasian, pembersihan, perawatan preventif serta prosedur dan
BAB III
TINJAUAN KHUSUS LEMBAGA FARMASI DIREKTORAT KESEHATAN ANGKATAN DARAT
3.1 Sejarah Lembaga Farmasi Direktorat Kesehatan Angkatan Darat Lembaga Farmasi Direktorat Kesehatan Angkatan Darat (Lafi Ditkesad), atau yang dahulu bernama Militaire Scheikundig Laboratorium (MSL),
merupakan lembaga yang didirikan oleh Pemerintah Belanda yang berfungsi sebagai tempat pemeriksaan obat-obatan yang dibutuhkan oleh tentara Belanda,
didirikan pada tahun 1818 di Jakarta dan tanggal 28 Oktober 1928 pindah ke Bandung.
Pada tanggal 23 Januari 1950 dibentuk panitia pengalihan dari MSL
kepada TNI AD, pada tanggal 1 Juni 1950 dilaksanakan serah terima MSL berdasarkan telegrafisch order No. 13579 tanggal 8 Mei 1950 dari chief generale
staf van de nederlandse strijdkratchten in Indonesia, yang menjadi dasar dalam penetapan hari jadi Lafi Ditkesad. Selanjutnya dengan Surat Keputusan Dirkesad Nomor : Skep/23/I/1997 tanggal 31 Januari 1997 ditetapkan tanggal 1 Juni
sebagai hari jadi Lafi Ditkesad.
Berdasarkan SK Ditkesad No. Kep/61/10/IX/1960 tanggal 13 September
1960 terhitung mulai tanggal 8 Juni 1960 LKAD dan DOAD disatukan menjadi Lembaga Farmasi Angkatan Darat (Lafiad). Kemudian pada tanggal 15 Oktober 1970 Lafiad dipisah kembali menjadi:
1. Lembaga Farmasi Angkatan Darat (LFAD), selanjutnya menjadi Lafiad dan kemudian menjadi Lembaga Farmasi Jawatan Kesehatan Angkatan
2. Depot Obat Angkatan Darat (DOAD), selanjutnya menjadi Depot Alat Peralatan Kesehatan (Dopalkes) dan kemudian menjadi Depot Pusat Perbekalan Kesehatan Jawatan Kesehatan Angkatan Darat (Dopusbekkes
Jankesad).
Pada tahun 1985 antara Lafi Jankesad dan Dopusbekkes Jankesad
disatukan kembali menjadi Lafi Ditkesad. Terhitung mulai tanggal 30 Januari 2004 Lafi Ditkesad dipisah kembali menjadi Lembaga Farmasi Ditkesad (Lafi Ditkesad) dan Gudang Pusat II Ditkesad (Gupus II Ditkesad).
Pada awalnya, kegiatan produksi Lafi Ditkesad dilakukan di Jl. Gudang Utara No. 25 Bandung dengan luas tanah 6.562 m2 dan luas bangunan 3.382
m2.Namun berdasarkan hasil evaluasi Direktur Jenderal Balai Pengawasan Obat dan Makanan Departemen Kesehatan Republik Indonesia, sarana fasilitas produksi di tempat tersebut belum memenuhi persyaratan sesuai dengan
Keputusan Menteri Kesehatan RI No. 43/MENKES/SK/II/1988 tentang pedoman CPOB dan Surat Keputusan Dirjen POM No. 544/A/SK/XII/1989 tentang penerapan CPOB. Oleh sebab itu, pada tahun 1995 diajukanlah Rencana Induk
Perbaikan (RIP) Lafi Ditkesad dengan lokasi di Jl. Gudang Utara No. 26 Bandung dengan luas tanah 12.152 m2 dan luas bangunan 6.087,25 m2. Gedung baru Lafi
Ditkesad dirancang sesuai dengan persyaratan CPOB. Pada tanggal 28 Februari 1996, RIP tersebut mendapat persetujuan dari Dirjen POM Depkes RI.
Pada tahun 1997, pembangunan sarana fasilitas Lafi Ditkesad dimulai
3.2 Visi dan Misi Lafi Ditkesad 3.2.1 Visi
Visi Lafi Ditkesad adalah menjadi satu-satunya lembaga produksi yang
mampu memenuhi kebutuhan obat bermutu bagi TNI.
3.2.2 Misi
Lafi Ditkesad mempunyai misi sebagai berikut :
a. Mampu memenuhi kebutuhan obat dukkes dan yankes TNI AD. b. Pusat litbang dan informasi obat TNI AD.
c. Mampu menjadi mitra industri farmasi lain dalam memenuhi kebutuhan obat nasional.
3.3 Kedudukan, Tugas Pokok, dan Fungsi Lafi Ditkesad
Lembaga Farmasi Direktorat Kesehatan Angkatan Darat (Lafi Ditkesad) merupakan badan pelaksana di tingkat Ditkesad yang berkedudukan langsung di
bawah Direktur Kesehatan Angkatan Darat (Dirkesad). Tugas pokok Lafi Ditkesad adalah membantu Dirkesad dalam menyelenggarakan pembinaan dan melaksanakan produksi, penelitian dan pengembangan obat dalam rangka
mendukung tugas pokok Ditkesad.
Dalam melaksanakan tugas pokok tersebut, Lafi Ditkesad menyelenggarakan
tugas-tugas sebagai berikut:
A. Tugas dalam Melaksanakan Fungsi Utama
1. Penelitian dan Pengembangan, meliputi segala usaha, pekerjaan,
2. Produksi, meliputi segala usaha pekerjaan dan kegiatan di bidang produksi obat.
3. Pengawasan Mutu, meliputi segala usaha, pekerjaan dan kegiatan
Pemeriksaan fisika, kimia, mikrobiologi, terhadap bahan baku, bahan pendukung produksi, pengawasan selama proses produk antara, produk
ruahan dan produk jadi.
4. Pemeliharaan, meliputi segala usaha, pekerjaan, kegiatan di bidang pemeliharaan dan perbaikan peralatan produksi, pengawasan mutu dan
sistem penunjang.
5. Penyimpanan, meliputi segala usaha, pekerjaan dan kegiatan di bidang
penerimaan, penyimpanan dan pengeluaran bahan baku, bahan pendukung produksi, peralatan dan obat jadi.
B. Tugas Melaksanakan Fungsi Organik Militer
Meliputi segala usaha, pekerjaan dan kegiatan di bidang intelijen, operasi, personil, logistik, teritorial, perencanaan dan pengawasan serta pemeriksaan dalam rangka mendukung tugas pokok Lafi Ditkesad.
C. Tugas Melaksanakan Fungsi Organik Pembinaan
Meliputi segala usaha, pekerjaan dan kegiatan di bidang latihan
kesatuan dalam rangka mendukung tugas pokok Lafi Ditkesad.
3.4 Struktur Organisasi Lafi Ditkesad
Susunan organisasi Lafi Ditkesad berdasarkan Peraturan Kasad Nomor
Perkasad/219/XII/2007, tanggal 10 Desember 2007 adalah sebagai berikut:
3.4.1 Eselon Pimpinan
Kalafi dijabat oleh seorang Perwira Menengah (Pamen) Angkatan Darat berpangkat Kolonel Ckm. Dalam melaksanakan tugas dan kewajibannya bertanggung jawab kepada Dirkesad.
2. Wakil Kepala Lembaga Farmasi, disingkat Wakalafi
Wakalafi dijabat oleh seorang Pamen Angkatan Darat, berpangkat
Letnan Kolonel Ckm, dalam melaksanakan tugas dan kewajibannya bertanggung jawab langsung kepada Kalafi.
3.4.2 Eselon Pembantu Pimpinan
1. Perwira Ahli Lembaga Farmasi, disingkat Pa Ahli Lafi.
Pa Ahli Lafi dijabat oleh 3 (tiga) orang Pamen Angkatan Darat berpangkat Letnan Kolonel Ckm.
Pa Ahli terdiri dari:
a. Perwira Ahli Madya Manajemen Mutu, disingkat Pa Ahli Madya
Jemen Mutu
b. Perwira Ahli Madya Teknologi Farmasi, disingkat Pa Ahli Madya Tekfi
c. Perwira Ahli Madya Analisis Mengenai Dampak Lingkungan, disingkat Pa Ahli Madya Amdal.
2. Bagian Administrasi Logistik, disingkat Kabagminlog.
Kabagminlog dijabat oleh Pamen Angkatan Darat berpangkat Letnan Kolonel Ckm, dalam pelaksanaaan tugas kewajibannya
dijabat oleh seorang Pamen Angkatan Darat berpangkat Mayor Ckm, terdiri dari:
a. Kepala Seksi Perencanaan Program dan Anggaran, disingkat
Kasirenprogar
b. Kepala Seksi Pengendalian Materil, disingkat Kasidalmat.
3.4.3 Eselon Pelayanan yakni Seksi Tata Usaha dan Urusan Dalam
Kepala Seksi Tata Usaha dan Urusan Dalam (Kasituud) dijabat oleh seorang Pamen Angkatan Darat berpangkat Mayor Ckm yang dalam
melaksanakan tugasnya bertanggung jawab kepada Kalafi. Kasituud merupakan unsur pelayanan Lafi Ditkesad yang bertanggung jawab menyelenggarakan
kegiatan di bidang pengamanan, administrasi personil, logistik, tata usaha, dan urusan dalam.
Kasituud dibantu oleh tiga kepala urusan yang masing-masing dijabat
oleh dua orang Pama Angkatan Darat berpangkat Kapten Ckm, satu orang PNS golongan III dan satu Perwira Urusan yang dijabat oleh Pama Angkatan Darat berpangkat Letnan Ckm. Kepala dan Perwira Urusan tersebut, yakni:
1. Kepala Urusan Administrasi Personil dan Logistik disingkat Kaurminperslog
3.4.4 Eselon Pelaksana
Eselon pelaksana dijabat oleh lima Kepala Instalasi (Kainstal), yaitu:
1. Kepala Instalasi Penelitian dan Pengembangan disingkat
Kainstallitbang, dijabat oleh seorang Pamen Angkatan Darat berpangkat Letnan Kolonel Ckm yang dalam melaksanakan
tugasnya dibantu oleh dua Kepala Seksi (Kasi) yang masing-masing dijabat oleh Pamen Angkatan Darat berpangkat Mayor Ckm, yaitu: a. Kepala Seksi Penelitian dan Pengembangan Produksi, disingkat
Kasilitbangprod.
b. Kepala Seksi Penelitian dan Pengembangan Sistem Metoda dan
Personel, disingkat Kasilitbangsistodapers.
2. Kepala Instalasi Produksi, disingkat Kainstalprod dijabat oleh seorang Pamen Angkatan Darat berpangkat Letnan Kolonel Ckm
berkualifikasi apoteker. Dalam pelaksanaan tugas dan kewajibannya bertanggung jawab kepada Kalafi dan dibantu oleh empat Kepala Seksi yang masing-masing dijabat oleh Pamen Angkatan Darat
berpangkat Mayor Ckm, terdiri dari:
a. Kepala Seksi Sediaan Non Betalaktam, disingkat Kasidia Non
Betalaktam
b. Kepala Seksi Sediaan Betalaktam, disingkat Kasidia Betalaktam c. Kepala Seksi Sediaan Sefalosporin, disingkat Kasidia
Sefalosporin
3. Kepala Instalasi Pengawasan Mutu, disingkat Kainstalwastu dijabat oleh seorang Pamen Angkatan Darat berpangkat Letnan Kolonel Ckm berkualifikasi apoteker. Kainstalwastu dalam melaksanakan
tugasnya dibantu oleh dua Kepala Seksi yang masing-masing dijabat oleh Pamen Angkatan Darat berpangkat Mayor Ckm, terdiri dari:
a. Kepala Seksi Pengujian Kimia, Fisika, dan Mikrobiologi disingkat Kasiuji Kifis dan Mikro.
b. Kepala Seksi inspeksi, disingkat Kasiinspek.
Kainstalwastu dalam pelaksanaan tugas dan kewajibannya bertanggung jawab kepada Kalafi.
4. Kepala Instalasi Pemeliharaan dan Sistem Penunjang, disingkat Kainstalhar & Sisjang dijabat oleh Pamen Angkatan Darat berpangkat Mayor Ckm. Kainstalhar & Sisjang dalam melaksanakan
tugasnya dibantu oleh dua Kepala Urusan yang masing-masing dijabat oleh Pamen Angkatan Darat berpangkat Kapten Ckm, terdiri dari:
a. Kepala Urusan Pemeliharaan, disingkat Kaurhar
b. Kepala Urusan Sistem penunjang, disingkat Kaursisjang
Kainstalhar & Sisjang dalam pelaksanaan tugas dan kewajibannya bertanggung jawab kepada Kalafi.
5. Kepala Instalasi Simpan, disingkat Kainstalsimpan dijabat oleh
Pamen Angkatan Darat berpangkat Mayor Ckm. Kainstalsimpan dalam melaksanakan tugasnya dibantu oleh satu Kepala Urusan yang
Perwira Urusan yang dijabat oleh Pama Angkatan Darat berpangkat Letnan Ckm, terdiri dari:
a. Kepala Urusan Penyimpanan Material Produksi, disingkat
Kaursimpanmatprod.
b. Perwira Urusan Penyimpanan Obat Jadi, disingkat Paursimpan
Obat Jadi.
Kainstalsimpan dalam pelaksanaan tugas dan kewajibannya bertanggung jawab kepada Kalafi, dalam melaksanakan tugas
sehari-hari dikoordinasikan oleh Wakalafi.
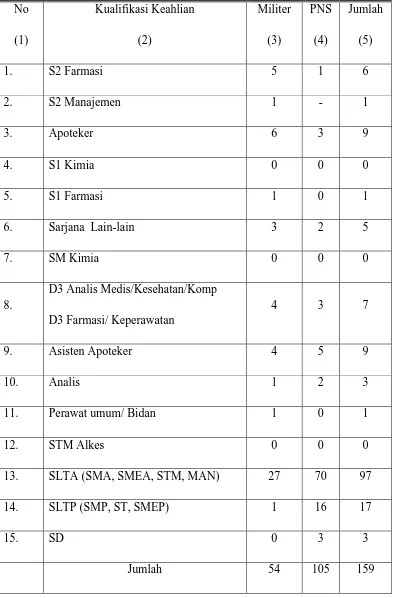
3.5 Kualifikasi Tenaga Kerja Lafi Ditkesad
Berdasarkan statusnya, personil Lafi Ditkesad terdiri dari militer dan
Pegawai Negeri Sipil (PNS). Personel Lafi Ditkesad berdasarkan keahliannya terdiri dari Magister Farmasi, Magister Manajemen, Apoteker, Sarjana Kimia,
3.6 Kegiatan di Lafi Ditkesad
3.6.1 Kegiatan Bagian Administrasi dan Logistik (Bagminlog)
Kabagminlog menerima wewenang dari Kalafi Ditkesad untuk
merencanakan pengadaan barang produksi obat Lafi Ditkesad berdasarkan data dari Sub Direktorat Pembinaan Pelayanan Kesehatan (Subditbinyankes).
Subditbinyankes adalah bagian dari Direktorat Kesehatan Angkatan Darat (DITKESAD) yang salah satu tugasnya mengumpulkan data kebutuhan obat berdasarkan pola penyakit dan laporan dari masing-masing Kesehatan Daerah
Militer (Kesdam), Satuan Kesehatan (Satkes) dan Rumah Sakit Pusat Angkatan Darat (RSPAD) di seluruh Indonesia untuk prajurit, PNS TNI AD dan
keluarganya. Dari data – data tersebut dibuat Daftar Rencana Kebutuhan Obat Angkatan Darat (Renbut Obat AD) yang disesuaikan dengan anggaran yang tersedia. Kebutuhan obat tersebut tidak semua dapat diproduksi oleh Lafi Ditkesad
tetapi sebagian dari kebutuhan tersebut diperoleh dengan cara membeli obat jadi sesuai dengan SKEP Kasad No: 336/X/2005 tanggal 17 Oktober 2005 yang isinya mengatur pengadaan barang atau material dan jasa di lingkungan Angkatan Darat.
Pengadaan barang dilakukan oleh Ditkesad melalui pembentukan Panitia Pengadaan atau lelang, kemudian Dirkesad membentuk tim komisi penerimaan
barang yang bertugas memeriksa keadaan barang secara administrasi dan fisik, sedangkan uji kimia dan uji mutu dilakukan oleh Instalwastu. Setelah barang lulus uji mutu, maka dibuat Laporan Hasil Pengujian (LHP) dan Berita Acara (BA)
diganti, kemudian barang yang lolos administrasi dan uji mutu dikirim ke Gudang Pusat II yang disertai dengan surat Perintah Penerimaan Material (PPnM).
3.6.2 Kegiatan Instalasi Pengawasan Mutu (Instalwastu)
Pengawasan mutu merupakan bagian integral dari suatu produksi obat. Instalwastu bertanggung jawab terhadap setiap hal yang menyangkut kualitas
bahan baku obat, bahan pembantu, bahan pengemas, produk antara, produk ruahan, dan obat jadi yang dihasilkan sampai dengan pemantauan kualitas setelah didistribusikan dengan standar waktu kadaluarsa. Instalwastu juga bertanggung
jawab terhadap kualitas lingkungan kerja yang meliputi pengawasan bangunan, ruangan dan peralatan serta fasilitas penunjang lainnya seperti pemeriksaan
sirkulasi udara, pemeriksaan mutu air dan pemeriksaan limbah. Tanggung jawab tersebut diwujudkan dalam suatu sistem pengawasan mutu.
Pelaksanaan kegiatan di Instalwastu ditunjang oleh fasilitas instrumen
HPLC, spektrofotometer dengan sistem terkomputerisasi, Laminar Air Flow (LAF), Read Biotic (pembaca hambatan bakteri), Climatic Chamber, Dissolution Tester, serta berbagai fasilitas penunjang lainnya.
Dalam menjalankan tugasnya, Instalwastu didukung oleh personil yang terdiri dari apoteker dan analis yang sudah terlatih dan berpengalaman dalam
menjalankan tugasnya.
Kegiatan Instalwastu tersebut dilaksanakan pada tahap persiapan, selama proses produksi dan setelah proses produksi. Beberapa kegiatan Instalwastu
1. Menyiapkan metoda pemeriksaan, pengujian dan validasi metoda analisa yang sesuai dengan acuan standar resmi seperti Farmakope Indonesia
2. Menyiapkan prosedur pengambilan sampel untuk pemeriksaan dan pengujian, dimana setiap sampel yang diambil dicatat dan
didokumentasikan
3. Menyiapkan dan menyimpan baku pembanding kerja untuk pengujian 4. Menyimpan contoh pertinggal setiap bets produk jadi dan catatan
pengujian atau pemeriksaan
5. Meluluskan atau menolak bahan yang akan digunakan dalam produksi
meliputi bahan baku obat, bahan baku pembantu dan bahan pengemas. Hasilnya dicatat pada laporan hasil pengujian
6. Melaksanakan In Process Control (IPC) selama proses produksi dan
memberikan keputusan atas diluluskan atau tidaknya hasil suatu tahap produksi sampai hasil produk akhir
7. Melaksanakan pengujian terhadap hasil jadi suatu sediaan, hasil yang
diperoleh, dicatat pada catatan pengujian sediaan jadi
8. Meneliti dokumen produksi (catatan pengolahan bets dan catatan
pengemasan bets) sebelum obat diluluskan
9. Melaksanakan uji stabilitas dipercepat untuk menetapkan kondisi penyimpanan dan masa edar suatu produk
11.Memantau stabilitas produk-produk yang telah dikeluarkan atau didistribusikan sampai beberapa waktu setelah batas kadaluarsa terutama untuk sediaan antibiotika
12.Hasil pengujian laboratorium yang dilaksanakan diringkas, dicatat dan didokumentasikan dalam lembaran yang disebut Laporan Hasil
Pengujian (LHP)
Bangunan Instalwastu terdiri dari: 1. Laboratorium kimia
Ruang laboratorium kimia memiliki peralatan dan fasilitas yang menunjang pemeriksaan mutu secara kimia, seperti lemari asam dan
climatic chamber.
2. Laboratorium mikrobiologi
Laboratorium mikrobiologi dilengkapi dengan ruangan steril dan Laminar
Air Flow dan alat pembaca daya hambat bakteri (Read Biotic) serta
alat-alat penunjang lainnya seperti inkubator untuk jamur dan bakteri, lemari pendingin dan autoklaf.
3. Ruang fisika
Peralatan yang terdapat di ruang fisika antara lain adalah alat uji kekerasan
tablet yang disertai dengan uji ketebalan dan diameter tablet, alat uji keregasan tablet, alat uji kebocoran strip dan alat uji waktu hancur tablet. 4. Ruang instrumen
Peralatan yang terdapat di ruang instrumen adalah Spektrofotometer UV– Vis, alat uji disolusi dan HPLC.
6. Ruang contoh pertinggal
Ruang ini sebagai tempat penyimpanan contoh pertinggal obat jadi dengan
masa simpan satu tahun setelah masa kadaluarsa.
7. Gudang reagen 8. Perpustakaan 9. Ruang staf
3.6.3 Kegiatan Instalasi Penelitian dan Pengembangan (Installitbang)
Peran Installitbang secara umum adalah melakukan penelitian terhadap
produk baru dan pengembangan produk lama untuk memperoleh dan meningkatkan kualitas produk yang lebih baik. Pelaksanaan kegiatan dimulai dengan pengajuan rencana penelitian dan pengembangan produk Lafi Ditkesad
yang meliputi:
1. Membuat spesifikasi teknis bahan baku obat, bahan pembantu dan bahan
pengemas.
2. Mencari dan meneliti formula yang dapat dikembangkan sebagai produk Lafi Ditkesad.
3. Merevisi ulang suatu formula yang sudah ditetapkan bila suatu saat terjadi perubahan alat, bahan baku dan komponen produksi lainnya.
4. Mengadakan evaluasi terhadap keluhan yang terjadi dan obat kembalian.
Penelitian dan pengembangan dimulai dari penelusuran pustaka, pengadaan bahan, penelitian skala laboratorium dan skala produksi. Terakhir
3.6.4 Kegiatan Instalasi Produksi (Instalprod)
Kegiatan produksi obat-obatan dilaksanakan oleh Instalasi Produksi yang kegiatannya meliputi perencanaan, pengaturan, pelaksanaan dan pengendalian
produksi. Produk yang dihasilkan oleh Lafi Ditkesad berupa produk Betalaktam dan produk Non Betalaktam.
Pada Instalasi Produksi terdapat empat seksi yaitu: seksi sediaan Non Betalaktam, seksi sediaan Betalaktam, seksi sediaan Sefalosporin dan seksi kemas. Masing-masing seksi dikepalai oleh seorang Apoteker.
Obat-obat yang diproduksi oleh Lafi Ditkesad tidak diperdagangkan bagi masyarakat umum, namun demikian proses produksinya tetap dilaksanakan sesuai
dengan Pedoman CPOB yang dikeluarkan oleh Badan POM. Rencana produksi obat dibuat berdasarkan pada banyaknya jenis obat yang diminta, jenis peralatan yang dimiliki (kapasitas dan spesifikasi mesin), jumlah sumber daya manusia dan
jam kerja serta waktu produksi yang tersedia.
Seluruh proses produksi yang dilaksanakan, dicatat dan didokumentasikan dalam Catatan Pengolahan Bets dan Catatan Pengemasan Bets (Batch Record)
yang disusun oleh kasi-kasi produksi dan dikeluarkan oleh Kepala Instalprod, diperiksa oleh Kepala Instalwastu, diketahui oleh Kepala Instalitbang dan diterima
oleh Kepala Instalsimpan. Hal yang diuraikan dalam Catatan Pengolahan Bets dan Catatan Pengemasan Bets adalah kode produk, nama produk, nomor bets, besar bets, bentuk sediaan, kemasan dan tanggal pengolahan atau pengemasan.
Selain itu, catatan pengolahan bets juga menguraikan mengenai komposisi, spesifikasi, peralatan, penimbangan, prosedur pengolahan dan rekonsiliasi. Pada
bahan pengemas, prosedur pengemasan primer, kesiapan jalur pengemasan sekunder, prosedur pengemasan sekunder, hasil obat jadi, kelulusan oleh pengawasan mutu, rekonsiliasi proses pengemasan dan pengiriman obat jadi ke
instal simpan.
Proses produksi dimulai dari penimbangan bahan baku dan penyiapan
bahan kemas yang akan digunakan dan dikeluarkan dari Instal simpan berdasarkan catatan pengolahan bets dan catatan pengemasan bets untuk setiap produk. Barang yang telah dikeluarkan dari Instalsimpan selanjutnya memasuki
tahap pengolahan pada masing-masing seksi produksi, yaitu seksi sediaan Non Betalaktam, seksi sediaan Betalaktam, dan seksi sediaan Sefalosporin.
1. Seksi Sediaan Non Betalaktam
Seksi sediaan Non Betalaktam dikepalai oleh seorang kepala seksi (Apoteker) yang bertanggung jawab kepada Kainstalprod. Pada seksi ini
dilakukan kegiatan produksi sediaan tablet, kapsul, sirop, cairan obat luar. Kegiatan pada seksi ini meliputi penimbangan, pencampuran, pengeringan, granulasi, pencetakan, penyalutan dan stripping. Hasil dari seksi ini kemudian
dikirim ke seksi kemas untuk dikemas. a. Sediaan Tablet
Ruang produksi tablet terdiri dari ruang staging, ruang mucilago, ruang campur, ruang granulator, ruang FBD (Fluid Bed Dryer), ruang oven, ruang pengayakan, ruang cetak, ruang IPC, ruang penyalutan, ruang stripping, ruang
memadai, HVAC dengan penghisap debu, dan lapisan epoksi pada dinding dan lantai.
Metoda pembuatan tablet yang umum digunakan adalah metoda granulasi
basah. Tablet yang diproduksi adalah tablet biasa, tablet kunyah, tablet dan tablet salut film.
Proses pembuatan tablet di Lafi Ditkesad sebagian besar menggunakan metoda granulasi basah dan metoda cetak langsung. Proses produksi tablet dengan metoda granulasi basah terdiri dari tahapan sebagai berikut :
1) Penimbangan bahan baku
Penimbangan bahan baku antara lain penimbangan bahan aktif, bahan
pengisi, bahan pelincir, dilakukan di ruang kelas E dan dilaksanakan oleh personil dari Instalsimpan.
2) Pencampuran bahan berkhasiat dengan fase dalam
Setelah semua bahan ditimbang, dilakukan proses pencampuran hingga homogen.
3) Granulasi basah
Setelah pencampuran dilakukan proses granulasi, dimana bahan adonan dicampur dengan bahan pengikat. Adonan basah dikeringkan sampai
setengah kering dengan oven pengering kemudian dapat dilewatkan pada mesh dengan ukuran tertentu sesuai ukuran tablet yang akan dibuat.
4) Pengeringan
5) Pengayakan
Granul kering dilewatkan pada mesh sesuai ukuran tablet yang akan dibuat. 6) Pengawasan mutu (In process control)
Sebelum dilakukan pencampuran, terlebih dahulu ditentukan kadar airnya. 7) Pencampuran/massa cetak
Granul kering kemudian dicampur dengan fase luar, yakni dengan penambahan bahan pelincir dan bahan penghancur luar.
8) Pengawasan mutu (In process control)
Sebelum proses pencetakan, dilakukan pemeriksaan homogenitas dan kadar zat aktif.
9) Pencetakan
Campuran ini kemudian dicetak menjadi tablet. 10) Pengawasan mutu (In process control)
Sebelum dikemas primer, dilakukan pemeriksaan keseragaman bobot, tebal, diameter, kekerasan, kerapuhan, waktu hancur, kadar zat aktif dan disolusi untuk tablet tertentu.
11) Penyalutan
Jika tablet memerlukan penyalutan, maka dapat dilakukan penyalutan.
12) Penyetripan
13) Pengawasan mutu (In process control)
Pada hasil penyetripan dilakukan uji mutu (IPC) meliputi tes kebocoran strip. Tablet yang telah lulus uji mutu siap dikemas sekunder (pengepakan)
dan obat jadi dikirim ke Instalasi Simpan.
Produksi tablet dengan metoda cetak langsung adalah sebagai berikut:
1) Penimbangan bahan baku
Penimbangan bahan baku antara lain penimbangan bahan aktif, bahan pengisi, bahan pelincir, dilakukan di ruang kelas E dan dilaksanakan oleh
personil dari Instalasi Simpan. 2) Pengayakan
Beberapa bahan baku dilewatkan pada ayakan dengan ukuran mesh tertentu. Dalam proses pencetakan langsung sifat alir dan kompresibilitas bahan awal sangat menentukan tablet yang dihasilkan.
3) Pencampuran
Bahan aktif dan bahan tambahan dicampur homogen menggunakan mixer. 4) Pengawasan mutu (In Process Control)
Sebelum proses pencetakan, dilakukan pemeriksaan homogenitas kadar zat aktif.
5) Pencetakan
Bahan campuran kemudian dicetak menjadi tablet. 6) Pengawasan mutu (In Process Control)
Sebelum dikemas primer, dilakukan pemeriksaan keseragaman bobot, tebal, diameter, kekerasan, kerapuhan, waktu hancur, kadar zat aktif dan uji
7) Penyetripan
Setelah tablet selesai dicetak atau disalut (untuk tablet salut) maka dilakukan proses pengemasan primer yakni penyetripan (stripping).
8) Pengawasan mutu (In Process Control)
Pada hasil penyetripan dilakukan uji mutu (IPC) meliputi tes kebocoran
strip. Tablet yang telah lulus uji mutu siap dikemas sekunder (pengepakan) dan dikirim ke Instalasi Simpan.
b. Sediaan Kapsul
Ruang produksi kapsul terdiri dari ruang pencampuran, ruang pengisian dan polishing, serta ruang stripping. Peralatan yang digunakan
untuk pembuatan kapsul diantaranya adalah mesin pencampur, mesin pengisi kapsul, mesin polishing dan mesin strip.
Proses produksi kapsul terdiri dari tahapan sebagai berikut:
1) Penimbangan bahan baku
Penimbangan bahan baku antara lain penimbangan bahan aktif, bahan pengisi, bahan pelincir. Penimbangan Penimbangan bahan baku dilakukan
di ruang kelas E umum dan ditimbang oleh personil Instalsimpan. 2) Pencampuran
Semua bahan yang telah ditimbang kemudian dicampur hingga homogen. Bahan yang diisikan ke dalam cangkang kapsul ada yang harus digranulasi terlebih dahulu untuk memperbaiki sifat alirnya sedangkan untuk bahan
3) Pengawasan mutu dan In Process Control
Sebelum diisikan ke dalam cangkang kapsul, dilakukan pemeriksaan homogenitas kadar zat aktif.
4) Pengisian kapsul
Setelah massa kapsul diluluskan oleh Instalwastu maka massa kapsul
diisikan ke dalam cangkang kapsul. Selama pengisian, dilakukan uji mutu (IPC) terhadap keseragaman bobot.
5) Polishing
Sebelum kapsul distrip, kapsul dipolishing terlebih dahulu untuk menghilangkan debu-debu yang menempel pada bagian luar cangkang
kapsul.
6) Pengawasan mutu dan In Process Control
Sebelum kapsul distrip dilakukan uji mutu (IPC) yang meliputi kadar zat
aktif, keseragaman bobot dan waktu hancur. 7) Penyetripan
Setelah dipolishing maka kapsul siap distrip dengan cara yang sama
seperti pada proses stripping tablet. 8) Pengawasan mutu dan In Process Control
Pada hasil penyetripan dilakukan uji mutu (IPC) meliputi tes kebocoran strip.Kapsul yang telah lulus uji mutu siap dikemas dan dikirim ke Instalasi Simpan.
c. Sediaan Sirup
Ruang produksi sirup terdiri dari ruang pencampuran dan ruang
pemanas (double jacket), filter, drum stainless, mesin pengisi sirup, penutup botol dan pemasangan etiket yang merupakan satu rangkaian (In Line Process).
Proses pembuatan sirup diawali dengan :
1) Penimbangan bahan baku dilakukan di ruang kelas E dan yang
melaksanakannya adalah personil dari Instalsimpan. 2) Pembuatan larutan gula pekat (Syrupus Simplex).
Pembuatan larutan gula pekat dilakukan pada tangki pemanas
(double jacket). Pemanasan menggunakan uap air yang dihasilkan oleh ketel uap (Steam Boiller).
3) Pencampuran
Zat aktif dan zat tambahan lain (zat pewarna dan pengawet) yang telah ditimbang masing-masing dilarutkan dalam pelarut yang
sesuai sampai larut sempurna, kemudian dicampur dengan larutan gula pekat. Essence dapat ditambahkan jika diperlukan dan volume ditambahkan sampai tanda batas yang telah ditentukan.
4) Pengawasan mutu dan In Process Control
Pada saat pencampuran dilakukan uji mutu (IPC) terhadap
homogenitas, kadar zat aktif, pH larutan dan bobot jenis. 5) Pengisian, penutupan dan labelling
Setelah lulus uji mutu dilakukan pengisian, penutupan dan
kontrol setiap 15 menit terhadap keseragaman volume, hasil penutupan dan pemasangan label.
6) Pengawasan mutu dan In Process Control
Pada produk yang telah dikemas dilakukan pengambilan sampel untuk dilakukan pemeriksaan mutu meliputi keseragaman
isi/volume, kadar zat aktif, pH larutan dan bobot jenis. Setelah lulus uji mutu dilakukan pengemasan sekunder (pengepakan) dan kemudian diserahkan ke Instalasi Simpan.
2. Seksi Sediaan Betalaktam
Seksi sediaan Betalaktam dikepalai oleh seorang Apoteker. Proses
produksi Betalaktam dilakukan di gedung yang terpisah dengan produksi Non Betalaktam untuk menghindari terjadinya kontaminasi silang. Gedung produksi Betalaktam telah dilengkapi dengan sistem pengaturan udara (Air Handling
System), air washer, air shower, dan ruang penyangga. Lantai, dinding dan
langit-langit dilapisi oleh bahan epoksi untuk memudahkan pembersihan. Pembagian ruangan berdasarkan tingkat kebersihan juga telah dilakukan, yaitu ruang kelas E,
F dan G.
Sistem pengaturan udara (AHS atau AHU) di ruang produksi produk steril
injeksi terpisah dari AHS atau AHU untuk sediaan produksi peroral. Tekanan udara di ruangan dengan tingkat kebersihan lebih tinggi (ruang produksi steril) memiliki tekanan udara lebih positif dari ruang dengan tingkat kebersihan yang
3. Seksi Sefalosporin
Produksi Sefalosporin belum dimulai karena bangunan produksi untuk sefalosporin belum siap untuk melaksanakan kegiatan produksi.
4. Seksi Kemas
Kasi kemas Lafi Ditkesad dijabat seorang apoteker yang bertanggung
jawab kepada Kepala Instalasi Produksi. Pengemasan dilakukan pada produk ruahan tablet, kapsul, sirup dan salep. Pengemasan tablet dan kapsul dilakukan setelah proses stripping, menggunakan bahan pengemas polycellonium. Tablet
yang sudah distrip, dipilih yang baik kemudian dimasukkan ke dalam sak plastik dilengkapi dengan brosur lalu diseal, setiap sak plastik berisi 25 strip, tiap-tiap
strip berisi 10 tablet. Hasil seal kemudian dimasukkan ke dalam dus yang dilengkapi dengan slip pak dimana setiap dus isinya berbeda sesuai dengan ukuran diameter tablet. Untuk tablet dengan diameter 6,5-7,5 mm, setiap dus berisi 50 sak
plastik. Untuk tablet dengan diameter 10-13 mm, setiap dus berisi 30 sak plastik. Untuk kaplet setiap dus berisi 20 sak plastik.
Untuk sediaan kapsul, setelah kapsul distrip, dipilih yang baik kemudian
dimasukkan ke dalam sak plastik dilengkapi dengan brosur lalu diseal. Hasil seal kemudian dimasukkan ke dalam dus yang dilengkapi dengan slip pak dimana tiap
dus berisi 20 sak plastik, setiap sak plastik berisi 25 strip dan setiap strip berisi 10 kapsul. Untuk sirup dipak ke dalam dus. Tiap dus berisi 25 botol dilengkapi dengan brosur, sendok takar dan slip pak.
Pengemasan cairan obat luar, pengemasan menggunakan dus, dimana tiap dus berisi 36 botol untuk botol bervolume 60 ml, dan 10 botol untuk bervolume 1
Bila pengemasan selesai, dilakukan pemeriksaan QC oleh Instalwastu. Setelah diperiksa oleh Instalwastu, hasil pengemasan diberi label “Diluluskan” kemudian seksi kemas membuat laporan administrasi yang terdiri dari laporan
bulanan untuk dilaporkan ke KaLafi dan bukti penyerahan obat ke Instalsimpan, selanjutnya obat dikirim ke Instalasi Simpan.
3.6.5 Kegiatan Instalasi Simpan
Kegiatan Instalasi Simpan meliputi penerimaan, penyimpanan dan pengeluaran atas perintah Kalafi serta menyelenggarakan dan melaksanakan
kegiatan pengamanan dan pemeliharaan material yang berupa : bahan baku, bahan pendukung, peralatan untuk proses produksi dan obat jadi.
Barang yang diperoleh dari rekanan akan disimpan di Gudang Pusat II Ditkesad yang sebelumnya dilakukan proses pemeriksaan secara administrasi, fisik (label dan segelnya diperiksa), serta kimia (spesifikasi barang) yang
dilakukan oleh Instalwastu. Pemeriksaan ini dilakukan oleh Tim Komisi Pusat (wakil dari Ditkesad, Gupus II, dan Lafi Ditkesad). Setelah Laporan Hasil Pengujian (LHP) menyatakan memenuhi syarat atau lulus, maka barang dari
Gupus II siap dikirim ke Lafi Ditkesad (Instalsimpan) dengan adanya PPM dari Dirkesad. Barang yang masuk ke Instalsimpan diperiksa kembali oleh Tim Komisi
Intern Lafi Ditkesad (personil dari Instalwastu, Minlog, dan Instalprod) mengenai kesesuaian barang dengan PPM kemudian dibuat BP (Bukti Penyerahan). Setelah dinyatakan lulus oleh Tim Komisi Intern maka barang disimpan di gudang
Instalsimpan sesuai dengan jenis, sifat fisika kimia dan stabilitas dari barang tersebut, kemudian dibuat Berita Acara (BA). Instalsimpan memiliki beberapa
pengemas, gudang sejuk, gudang cairan. Bahan-bahan yang thermolabil disimpan di gudang sejuk. Gudang Instalsimpan merupakan ruangan kelas G (Black area) yang jumlah pertikelnya tidak diperhitungkan.
Setiap bahan baku yang masuk dan keluar di Instalsimpan dicatat dalam kartu barang/kartu gantung dan card deck. Untuk kartu barang/kartu gantung
pencatatan dilakukan setiap kali melakukan penimbangan sedangkan card deck pencatatannya per-item obat yang telah selesai diproduksi. Sistem pencatatan card deck ini bertujuan untuk memudahkan administrasi dalam pemantauan bahan
yang dikeluarkan per-item. Pencatatan barang yang masuk dan keluar Instalsimpan diperlukan sebagai dokumentasi.
Barang-barang yang tersimpan di gudang Instalsimpan disusun berdasarkan jenis dan sifat barang, barang yang kecil disimpan di atas rak, barang dengan ukuran besar disimpan di atas pallet, barang yang higroskopis dan
termolabil disimpan di gudang sejuk. Untuk pengeluaran barang disesuaikan dengan jadwal produksi dan jumlahnya disesuaikan dengan catatan pengolahan bets, sedangkan Sistem First in First Out (FIFO), First Expired First Out (FEFO),
First Unstable First Out (FUFO) tetap menjadi prioritas, namun demikian barang
yang diterima oleh Instalsimpan adalah barang yang langsung di pakai oleh
Instalasi Produksi. Material produksi tersebut oleh Instalasi Produksi diolah dan dikemas menjadi produk jadi, kemudian seksi kemas menyerahkan produk jadi tersebut kepada Instalasi Simpan, yang selanjutnya diserahkan ke Gudang Pusat
II.
Penyelenggaraan administrasi yang menyertai penerimaan dan
1. Perintah Penerimaan Material (PPnM) 2. Perintah Pengeluaran Material (PPM) 3. Berita Acara Penerimaan Barang (BAPB)
4. Bukti Penyerahan (BP) 5. Surat Keluar Barang (SKB)
6. Kartu Gudang 7. Kartu Kendali
8. Buku Harian Penerimaan dan Pengeluaran Barang
9. Buku Besar Penerimaan dan Pengeluaran Barang
Instalsimpan mempunyai 2 gudang yang terpisah untuk material Non
Betalaktam dan Betalaktam. Material Non Betalaktam disimpan di Instalsimpan yang memiliki ruang-ruang dengan 2 kelas yang berbeda tingkat kebersihannya yaitu kelas E dan tak terhingga (berhubungan langsung dengan udara luar). Kelas
E terdiri dari ruang timbang, ruang staging (digunakan untuk penyimpanan bahan baku obat yang sudah ditimbang) dan ruang sampling. Kelas tak terhingga (Kelas G) terdiri dari ruang administrasi, gudang bahan baku, gudang bahan pendukung,
gudang bahan kemas, gudang cairan, gudang sejuk untuk menyimpan bahan baku obat dan bahan pendukung yang memerlukan kondisi penyimpanan khusus dan
gudang obat jadi. Material untuk produksi Betalaktam disimpan tersendiri di gedung produksi Betalaktam.
Peralatan yang digunakan di Instalasi Simpan, yaitu:
1. Timbangan dengan kapasitas 1 kg, 10 kg, dan 30 kg
2. Timbangan digital berprinter dengan kapasitas maksimal 60 kg
4. Alat pengusir tikus 5. Alat pemadam kebakaran 6. Alat pengambilan sample
3.6.6 Kegiatan Instalasi Pemeliharaan dan Sistem Penunjang (Instalhar & Sisjang)
Instalhar dan Sisjang merupakan pelaksana fungsi pemeliharaan dan perbaikan terhadap peralatan produksi dan laboratorium agar siap digunakan setiap saat. Kegiatan lainnya yaitu penanganan limbah industri, penyiapan utilitas
guna mendukung kegiatan produksi dan perencanaan kebutuhan suku cadang untuk mendukung kegiatan pemeliharaan dan perbaikan. Seluruh kegiatan
pemeliharaan dan perbaikan akan dilaporkan kepada Kalafi Ditkesad.
Fasilitas pendukung (utility) yang ada di Lafi Ditkesad adalah: Pengolahan air baku farmasi, instalasi listrik, instalasi boiler (steam), instalasi udara
bertekanan, Instalasi Pengolahan Air Limbah (IPAL) dan sistem pengaturan udara (AHS).
Penanggung jawab pengolahan fasilitas utility ini adalah Kepala Instalasi
Pemeliharaan dan Sistem Penunjang (Kainstalhar & Sisjang). Fasilitas utility terdiri dari:
1. Listrik
Sumber listrik Lafi Ditkesad berasal dari PLN dengan daya sebesar 1000 kW. Pada saat ini belum digunakan generator. Tetapi pada
2. Pengolahan Air
Air merupakan salah satu aspek kritis (vital) dalam pelaksanaan CPOB. Hal tersebut disebabkan karena air merupakan bahan baku dalam
jumlah besar, terutama untk produk sirup, obat suntik cair, cairan infus dan lain-lain. Tujuan dari sistem pengolahan air untuk produksi adalah
menghilangkan cemaran sesuai dengan standar kualitas air yang telah ditetapkan (priyambodo, 2007).
Kualifikasi air terdiri atas:
a. Grade I : Raw Water
Fungsi : Untuk Pemadam Kebakaran, menyiram tanaman dan lain-
lain, contoh: air sumur, PDAM b. Grade II : Potable Water (PW)
Fungsi : Cuci pakaian, cuci alat non steril, pembersihan ruangan,
cuci tangan, kamar mandi.
c. Grade III : Purified Water/ Aquademineralisata
Fungsi : Cuci akhir container, produksi sirup/tablet/coating
d. Grade IV : Water for injection
Fungsi : Cuci akhir container steril, cuci vial/ampul, produksi
steril dan laboratorium
Air yang digunakan di Lafi Ditkesad yaitu sumber air bersih yang didapat dari suplai Perusahaan Daerah Air Minum (PDAM) yang
kemudian diolah menjadi air baku farmasi melalui instalasi pengolahan air. Air baku farmasi adalah air yang telah memenuhi syarat untuk