Informasi Dokumen
- Penulis:
- Nur Azizah
- Pengajar:
- Prof. Bambang Sutjiatmo
- Prof. Dr. Afifah B. Sutjiatmo, MS., Apt
- Drs. I Made Pasek Narendra, MM., Apt
- Hestiary Ratih, S.Si., M.Si., Apt
- Agung Yuwono, S.Si., Apt
- Hanni Nur.T, S.Si., Apt
- Sekolah: Universitas Jenderal Achmad Yani
- Mata Pelajaran: Pendidikan Profesi Apoteker
- Topik: Laporan Praktek Kerja Profesi Apoteker di PT. Solas Langgeng Sejahtera
- Tipe: laporan
- Tahun: 2013
- Kota: Bandung
Ringkasan Dokumen
I. PENDAHULUAN
Bagian ini menjelaskan latar belakang pentingnya industri farmasi dalam memenuhi kebutuhan kesehatan masyarakat. Industri farmasi diharapkan dapat memproduksi obat berkualitas yang sesuai dengan standar yang ditetapkan. Dalam upaya mencapai hal ini, penerapan Cara Pembuatan Obat yang Baik (CPOB) menjadi suatu keharusan. Praktek Kerja Profesi Apoteker (PKPA) di PT. Solas Langgeng Sejahtera bertujuan untuk memberikan pemahaman mendalam mengenai tugas dan tanggung jawab apoteker dalam industri farmasi.
1.1. Latar Belakang
Industri farmasi di Indonesia mengalami pertumbuhan yang pesat, didorong oleh kebutuhan obat yang semakin meningkat. Pemerintah mewajibkan penerapan GMP untuk memastikan kualitas dan keamanan obat. Dalam konteks ini, apoteker memegang peran penting dalam memastikan bahwa produk yang dihasilkan memenuhi standar yang ditetapkan.
1.2. Tujuan
Tujuan dari PKPA ini adalah untuk memberikan wawasan kepada mahasiswa mengenai tugas apoteker di industri farmasi, membekali mereka dengan pengetahuan dan keterampilan praktis, serta memahami penerapan CPOB dalam proses produksi obat. Hal ini diharapkan dapat mempersiapkan mahasiswa untuk memasuki dunia kerja sebagai tenaga farmasi yang profesional.
1.3. Waktu Pelaksanaan
PKPA dilaksanakan di PT. Solas Langgeng Sejahtera pada tanggal 6 hingga 29 November 2013. Kegiatan ini memberikan kesempatan bagi mahasiswa untuk terlibat langsung dalam proses produksi dan memahami aspek-aspek penting dalam industri farmasi.
II. TINJAUAN UMUM
Tinjauan umum ini mencakup definisi industri farmasi, persyaratan yang harus dipenuhi oleh industri, serta penerapan CPOB dalam proses produksi obat. Hal ini penting untuk memberikan gambaran menyeluruh tentang bagaimana industri farmasi beroperasi dan tantangan yang dihadapi.
2.1. Industri Farmasi
Industri farmasi adalah badan usaha yang memiliki izin untuk memproduksi obat. Dalam menjalankan operasinya, industri ini harus memenuhi berbagai persyaratan yang ditetapkan oleh pemerintah, termasuk memiliki apoteker yang kompeten dan menerapkan praktik pembuatan obat yang baik.
2.2. Cara Pembuatan Obat yang Baik
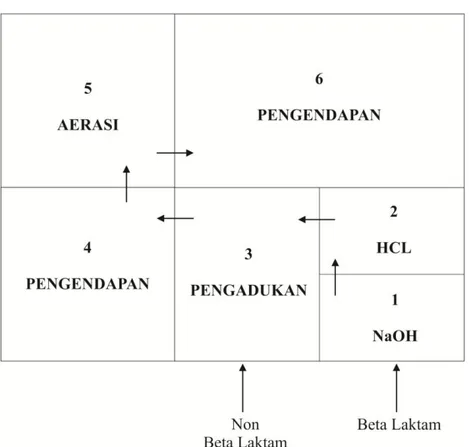
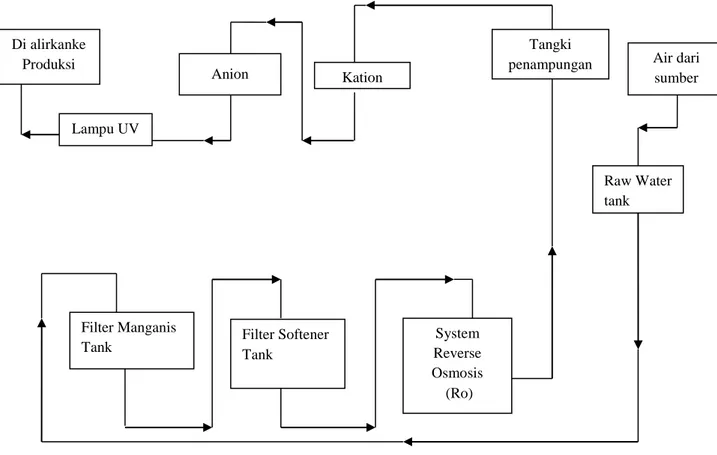
CPOB merupakan pedoman yang harus diikuti oleh industri farmasi untuk memastikan bahwa produk yang dihasilkan memenuhi standar kualitas. Hal ini mencakup manajemen mutu, personalia, bangunan dan fasilitas, serta pengawasan mutu. Setiap aspek ini harus diperhatikan untuk mencegah risiko terhadap kualitas obat.
2.3. Peran, Fungsi dan Tugas Apoteker di Industri Farmasi
Apoteker memiliki peran penting dalam industri farmasi, termasuk sebagai penanggung jawab produksi dan pengawasan mutu. Mereka bertanggung jawab untuk memastikan bahwa obat yang diproduksi memenuhi standar yang ditetapkan dan berfungsi dalam pengembangan produk serta registrasi obat.
III. TINJAUAN KHUSUS
Bagian ini memberikan informasi spesifik tentang PT. Solas Langgeng Sejahtera, termasuk sejarah, lokasi, tata letak bangunan, dan struktur organisasi perusahaan. Ini penting untuk memahami konteks di mana PKPA dilaksanakan.
3.1. Sejarah dan Perkembangan
PT. Solas Langgeng Sejahtera didirikan pada tahun 1997 dan mulai beroperasi pada tahun 1999. Perusahaan ini telah memperoleh berbagai sertifikat CPOB untuk produk-produk yang dihasilkannya. Seiring dengan pertumbuhannya, perusahaan juga telah meningkatkan fasilitas dan peralatan untuk mendukung proses produksi.
3.2. Lokasi dan Tata Letak Bangunan
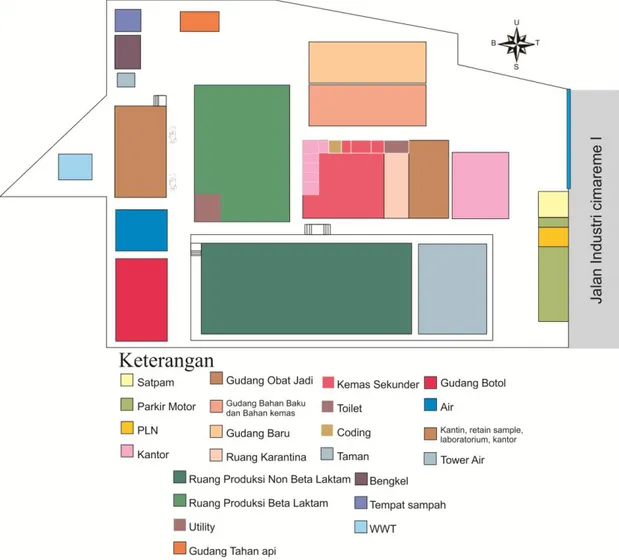
Perusahaan berlokasi di Jalan Industri I no.18, Padalarang, Bandung, dengan luas area bangunan yang cukup untuk mendukung kegiatan produksi. Tata letak bangunan dirancang untuk mendukung efisiensi produksi dan menjaga kebersihan lingkungan kerja.
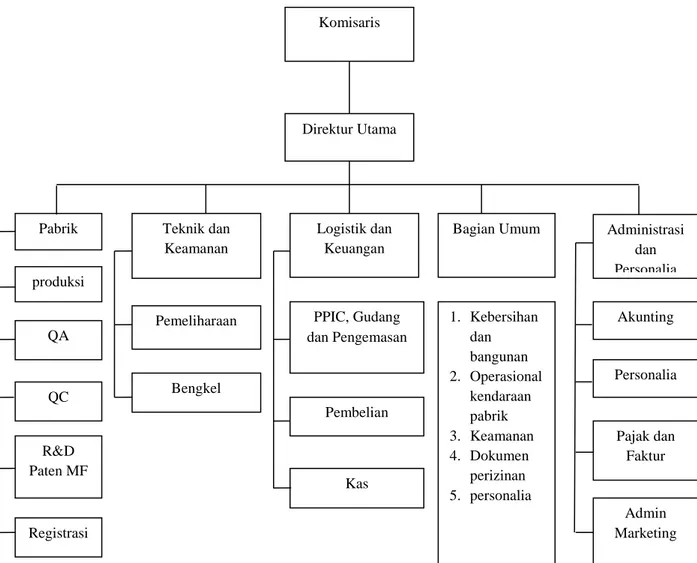
3.3. Struktur Organisasi
Struktur organisasi PT. Solas Langgeng Sejahtera terdiri dari direktur dan beberapa bagian, termasuk produksi, QA, QC, dan R&D. Apoteker berperan penting dalam setiap bagian ini, memastikan bahwa semua kegiatan produksi dan pengawasan mutu dilakukan sesuai dengan standar yang ditetapkan.