SKRIPSI
KARAKTERISASI DAN PURIFIKASI ANTOSIANIN PADA BUAH DUWET (Syzygium cumini)
Oleh
BEATRICE BENNITA LEIMENA F24103029
KARAKTERISASI DAN PURIFIKASI ANTOSIANIN PADA BUAH DUWET (Syzygium cumini)
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN pada Departemen Ilmu dan Teknologi Pangan
Fakultas Teknologi Pertanian Institut Pertanian Bogor
Oleh :
BEATRICE BENNITA LEIMENA F24103029
2008
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
INSTITUT PERTANIAN BOGOR FAKULTAS TEKNOLOGI PERTANIAN KARAKTERISASI DAN PURIFIKASI ANTOSIANIN
PADA BUAH DUWET (Syzygium cumini)
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN pada Departemen Ilmu dan Teknologi Pangan
Fakultas Teknologi Pertanian Institut Pertanian Bogor
Oleh :
BEATRICE BENNITA LEIMENA F24103029
Dilahirkan pada tanggal 14 Januari 1985 Di Kudus
Tanggal lulus : Januari 2008 Menyetujui:
Bogor, 2008
Prof. Dr. Ir. C. Hanny Wijaya, MAgr. Dosen Pembimbing
Beatrice Bennita Leimena. F24103029. Karakterisasi dan Purifikasi Antosianin pada Buah Duwet (Syzygium cumini). Di bawah Bimbingan : C. Hanny Wijaya. 2008
RINGKASAN
Warna merupakan salah satu penentu mutu pada produk pangan. Suatu pangan yang memiliki nilai gizi yang tinggi, apabila tidak didukung dengan warna yang sesuai maka akan menurunkan mutu produk tersebut. Pewarna makanan dapat dibedakan menjadi tiga kelompok berdasarkan asalnya yaitu pewarna alami, identik alami, dan buatan. Salah satu buah yang berpotensi sebagai sumber pewarna alami adalah buah duwet (Syzygium cumini). Buah ini banyak dijumpai di Indonesia namun belum dimanfaatkan secara optimal. Buah yang sudah matang akan berwarna ungu kehitaman dan berpotensi sebagai sumber pigmen antosianin untuk digunakan dalam industri pangan sehingga dapat meningkatkan nilai manfaat dari buah tersebut. Penelitian ini bertujuan untuk mengetahui karakteristik kimia dari buah duwet seperti komposisi kimia dan kandungan antosianin serta mempelajari proses purifikasi untuk menduga karakteristik antosianin yang terdapat dalam buah duwet sehingga dapat dimanfaatkan sebagai pigmen alami.
Pada penelitian ini dilakukan pengujian untuk mengetahui komposisi kimia dari buah duwet, yang meliputi kadar air, kadar abu, kadar protein, kadar lemak, dan karbohidrat. Selain itu juga dilakukan pengukuran konsentrasi antosianin dan perhitungan rendemen antosianin pada beberapa sampel, yaitu : kulit buah duwet (pada beberapa tingkat kematangan), kulit dan daging buah duwet dengan tingkat kematangan tertinggi serta sampel pembanding (anggur dan kubis ungu). Pengukuran konsentrasi antosianin dilakukan dengan menggunakan metode pH-differential dan hasil yang diperoleh dinyatakan sebagai kandungan antosianin.
Tahap selanjutnya dilakukan proses ekstraksi pada kulit buah dengan kandungan antosianin tertinggi. Ekstrak tersebut kemudian dimurnikan dengan menggunakan C-18 Sep-Pak Cartridge. Ekstrak yang telah dimurnikan kemudian dihidrolisis basa dan asam. Selanjutnya dilakukan analisis dengan menggunakan spektrofotometer UV-Vis dan TLC untuk mengetahui karakteristik dari pigmen antosianin yang terdapat dalam buah duwet. Analisis dengan spektrofotometer digunakan untuk mengetahui spektra dari antosianin yang terdapat dalam buah duwet, sedangkan analisis dengan TLC untuk menduga jenis antosianin yang terdapat dalam buah duwet.
CyE/g, kulit buah dengan warna ungu sedikit merah sebesar 2.67 mg CyE/g, dan kulit buah dengan warna ungu kehitaman sebesar 3.79 mg CyE/g. Sedangkan kandungan antosianin dalam kulit dan daging buah duwet dengan kematangan tertinggi sebesar 1.24 mg CyE/g. Kandungan antosianin pada sampel pembanding sebesar 0.51 mg CyE/g pada kulit buah anggur dan 0.82 mgCyE/g pada kubis ungu. Rendemen antosianin yang terdapat dalam kulit buah duwet pada berbagai tingkat kematangan sebagai berikut: untuk kulit buah berwarna hijau sebesar 0 %, kulit buah dengan warna merah sebesar 0.02 %, kulit buah dengan warna merah agak keunguan sebesar 0.10 %, kulit buah dengan warna ungu sedikit merah sebesar 0.27 %, kulit buah dengan warna ungu kehitaman sebesar 0.38 %, dan pada bagian kulit dan daging buah sebesar 0.12 %. Sedangkan rendemen antosianin pada kulit buah anggur sebesar 0.05 % dan kubis ungu sebesar 0.08 %.
RIWAYAT HIDUP PENULIS
Penulis dilahirkan di Kudus, 14 Januari 1985 dan merupakan anak kedua dari pasangan Lazarus Leimena dan Inajati Gani. Penulis menempuh pendidikannya di TK Cahaya Nur Kudus, SD Cahaya Nur Kudus, SLTP Negeri I Kudus, SMU Sedes Sapientiae Semarang, dan berhasil masuk Institut Pertanian Bogor (IPB) melalui jalur USMI (Ujian Seleksi Masuk IPB) di Departemen Ilmu dan Teknologi Pangan, Fakultas Teknologi Petanian.
Selama melakukan studi di Departemen Ilmu dan Teknologi Pangan, penulis juga aktif dalam berbagai kegiatan dan organisasi. Penulis adalah anggota Unit Kegiatan Mahasiswa (UKM) Persekutuan Mahasiswa Kristen IPB (PMK) (2003-2007). Penulis juga berperan serta sebagai panitia dalam kegiatan Konferensi HMPPI (Himpunan Mahasiswa Peduli Pangan Indonesia), BAUR 2005, dan LCTIP (Lomba Cepat Tepat Ilmu Pangan) 2005. Pada tahun 2005, penulis ikut ambil bagian dalam seminar dan pelatihan HACCP yang diselenggarakan oleh Departemen Ilmu dan Teknologi Pangan, IPB dan BPOM-RI. Penulis pernah menjadi asisten praktikum Penyimpanan Pangan pada periode Januari-Juni 2007.
i
KATA PENGANTAR
Puji dan syukur kepada Tuhan Yesus Kristus karena penyelesaian skripsi terjadi bukan atas kekuatan penulis sendiri, melainkan juga atas anugerah kekuatan-Nya. Terima kasih untuk setiap kegagalan dan keberhasilan yang terus menempa keuletan penulis. Selain itu, banyak pihak yang juga telah membantu penulis selama perjalanan hidup dan pelaksanaan tugas akhir. Oleh karena itu, pada kesempatan ini penulis menyampaikan terima kasih yang mendalam kepada:
1. Prof. Dr. Ir. C. Hanny Wijaya, MAgr. selaku Dosen Pembimbing Akademik sekaligus Dosen Pembimbing Skripsi. Terima kasih atas bimbingan, masukan, dorongan, dan saran Ibu selama ini.
2. Dr. Ir. Dede. R. Adawiyah, MSi. selaku dosen penguji. Terima kasih atas masukan dan kesediaan Ibu sebagai penguji.
3. Ibu Didah Nurfaridah, STP. MSi. selaku dosen penguji. Terima kasih atas masukan dan kesediaan Ibu sebagai penguji.
4. Ibu Puspita Sari STP, MAgr. selaku pemberi proyek dalam penelitian tentang buah duwet ini dan pemberi masukan kepada penulis.
5. Keluargaku: Papa, Mama, Ci Milkha, dan Robby atas perhatian, dukungan, doa, dan semangat kepada penulis.
6. Teman teristimewaku, Daniel yang telah memberikan dukungan, semangat, saran, dan doa kepada penulis.
7. Teman-teman satu bimbingan bu Hanny : Eko, Andrea, Tuti, Ratna, teman-teman ITP 39, 41, dan 42, terima kasih atas semangat dan dukungannya serta perkumpulannya selama bimbingan.
ii
10.Teman-teman ITP 40 : Hayuning, Herher, Dhani, Martin, Danang, Reza, Tilo, Mita, Lilin, Ajik, Andal, Steph, Rina, Lasty, dan semua teman-teman lainnya yang tidak bisa disebutkan satu-persatu. Terima kasih atas dukungannya selama 4 tahun ini.
11.Teman-teman ITP 39, 41, dan 42. Terima kasih atas dukungan dan semangatnya.
12.Teman-teman Perwira 45 : Mpin dan Nene (atas semangatnya kepada penulis untuk menyelesaikan skripsi), Ajik (atas bimbingannya kepada penulis dalam menyelesaikan skripsi), Ella, Lisa, Tere, Cat2, dan yang lainnya. Terima kasih atas kebersamaannya selam penulis tinggal di Bogor.
13.Staf dan Teknisi Laboratorium ITP , Seafast Center, dan LJA : Pak Sobirin, Pak Wahid, Pak Koko, Bu Rubiah, Pak Rojak, Pak Taufik, Mba Ririn, dan teknisi lainnya yang telah membantu penulis dalam menyelesaikan penelitian.
14.Semua pihak yang telah membantu yang tidak dapat disebutkan satu per satu.
Penulis berharap agar skripsi ini dapat bermanfaat bagi berbagai pihak dengan berbagai cara. Penulis menyadari bahwa masih banyak kekurangan dalam pelaksanaan penelitian dan penyusunan skripsi ini. Oleh karena itu, kritik dan saran yang membangun sangat diharapkan.
Bogor, Januari 2008
iii
DAFTAR ISI
Halaman
KATA PENGANTAR ... i
DAFTAR ISI ... iii
DAFTAR TABEL ... v
DAFTAR GAMBAR ... vi
DAFTAR LAMPIRAN ... vii
I. PENDAHULUAN ... 1
A. LATAR BELAKANG ... 1
B. TUJUAN ... 2
C. MANFAAT ... 2
II. TINJAUAN PUSTAKA ... 3
A. DUWET ... 3
B. ANTOSIANIN ... 6
C. EKSTRAKSI ANTOSIANIN ... 9
D. PURIFIKASI ANTOSIANIN ... 11
E. KARAKTERISASI ANTOSIANIN ... 12
III. METODOLOGI PENELITIAN ... 15
A. BAHAN DAN ALAT ... 15
1. BAHAN ... 15
2. ALAT ... 15
B. TAHAPAN PENELITIAN ... 15
1. Persiapan Kulit Buah Duwet ... 16
2. Ekstraksi Antosianin ... 16
3. Purifikasi Antosianin ... 17
4. Hidrolisis Basa dan Asam ... 17
C. METODE ANALISIS ... 17
iv
5. Penentuan Kadar Karbohidrat ... 19
6. Penentuan Konsentrasi Antosianin ... 20
7. Penentuan Rendemen Antosianin ... 20
8. Penentuan Karakteristik Antosianin ... 21
IV. HASIL DAN PEMBAHASAN ... 22
A. KARAKTERISTIK KIMIA BUAH DUWET ... 22
1. Komposisi Kimia Buah Duwet ... 22
2. Kandungan Antosianin Buah Duwet ... 24
B. EKSTRAKSI ANTOSIANIN ... 29
C. PURIFIKASI ANTOSIANIN ... 32
D. KARAKTERISASI ANTOSIANIN ... 34
V. KESIMPULAN DAN SARAN ... 44
A. KESIMPULAN ... 44
B. SARAN ... 45
DAFTAR PUSTAKA ... 46
SKRIPSI
KARAKTERISASI DAN PURIFIKASI ANTOSIANIN PADA BUAH DUWET (Syzygium cumini)
Oleh
BEATRICE BENNITA LEIMENA F24103029
KARAKTERISASI DAN PURIFIKASI ANTOSIANIN PADA BUAH DUWET (Syzygium cumini)
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN pada Departemen Ilmu dan Teknologi Pangan
Fakultas Teknologi Pertanian Institut Pertanian Bogor
Oleh :
BEATRICE BENNITA LEIMENA F24103029
2008
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
INSTITUT PERTANIAN BOGOR FAKULTAS TEKNOLOGI PERTANIAN KARAKTERISASI DAN PURIFIKASI ANTOSIANIN
PADA BUAH DUWET (Syzygium cumini)
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN pada Departemen Ilmu dan Teknologi Pangan
Fakultas Teknologi Pertanian Institut Pertanian Bogor
Oleh :
BEATRICE BENNITA LEIMENA F24103029
Dilahirkan pada tanggal 14 Januari 1985 Di Kudus
Tanggal lulus : Januari 2008 Menyetujui:
Bogor, 2008
Prof. Dr. Ir. C. Hanny Wijaya, MAgr. Dosen Pembimbing
Beatrice Bennita Leimena. F24103029. Karakterisasi dan Purifikasi Antosianin pada Buah Duwet (Syzygium cumini). Di bawah Bimbingan : C. Hanny Wijaya. 2008
RINGKASAN
Warna merupakan salah satu penentu mutu pada produk pangan. Suatu pangan yang memiliki nilai gizi yang tinggi, apabila tidak didukung dengan warna yang sesuai maka akan menurunkan mutu produk tersebut. Pewarna makanan dapat dibedakan menjadi tiga kelompok berdasarkan asalnya yaitu pewarna alami, identik alami, dan buatan. Salah satu buah yang berpotensi sebagai sumber pewarna alami adalah buah duwet (Syzygium cumini). Buah ini banyak dijumpai di Indonesia namun belum dimanfaatkan secara optimal. Buah yang sudah matang akan berwarna ungu kehitaman dan berpotensi sebagai sumber pigmen antosianin untuk digunakan dalam industri pangan sehingga dapat meningkatkan nilai manfaat dari buah tersebut. Penelitian ini bertujuan untuk mengetahui karakteristik kimia dari buah duwet seperti komposisi kimia dan kandungan antosianin serta mempelajari proses purifikasi untuk menduga karakteristik antosianin yang terdapat dalam buah duwet sehingga dapat dimanfaatkan sebagai pigmen alami.
Pada penelitian ini dilakukan pengujian untuk mengetahui komposisi kimia dari buah duwet, yang meliputi kadar air, kadar abu, kadar protein, kadar lemak, dan karbohidrat. Selain itu juga dilakukan pengukuran konsentrasi antosianin dan perhitungan rendemen antosianin pada beberapa sampel, yaitu : kulit buah duwet (pada beberapa tingkat kematangan), kulit dan daging buah duwet dengan tingkat kematangan tertinggi serta sampel pembanding (anggur dan kubis ungu). Pengukuran konsentrasi antosianin dilakukan dengan menggunakan metode pH-differential dan hasil yang diperoleh dinyatakan sebagai kandungan antosianin.
Tahap selanjutnya dilakukan proses ekstraksi pada kulit buah dengan kandungan antosianin tertinggi. Ekstrak tersebut kemudian dimurnikan dengan menggunakan C-18 Sep-Pak Cartridge. Ekstrak yang telah dimurnikan kemudian dihidrolisis basa dan asam. Selanjutnya dilakukan analisis dengan menggunakan spektrofotometer UV-Vis dan TLC untuk mengetahui karakteristik dari pigmen antosianin yang terdapat dalam buah duwet. Analisis dengan spektrofotometer digunakan untuk mengetahui spektra dari antosianin yang terdapat dalam buah duwet, sedangkan analisis dengan TLC untuk menduga jenis antosianin yang terdapat dalam buah duwet.
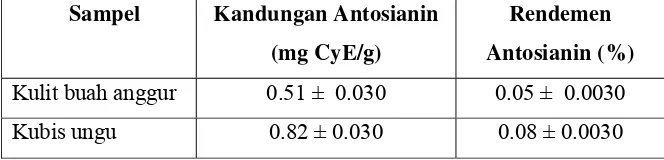
CyE/g, kulit buah dengan warna ungu sedikit merah sebesar 2.67 mg CyE/g, dan kulit buah dengan warna ungu kehitaman sebesar 3.79 mg CyE/g. Sedangkan kandungan antosianin dalam kulit dan daging buah duwet dengan kematangan tertinggi sebesar 1.24 mg CyE/g. Kandungan antosianin pada sampel pembanding sebesar 0.51 mg CyE/g pada kulit buah anggur dan 0.82 mgCyE/g pada kubis ungu. Rendemen antosianin yang terdapat dalam kulit buah duwet pada berbagai tingkat kematangan sebagai berikut: untuk kulit buah berwarna hijau sebesar 0 %, kulit buah dengan warna merah sebesar 0.02 %, kulit buah dengan warna merah agak keunguan sebesar 0.10 %, kulit buah dengan warna ungu sedikit merah sebesar 0.27 %, kulit buah dengan warna ungu kehitaman sebesar 0.38 %, dan pada bagian kulit dan daging buah sebesar 0.12 %. Sedangkan rendemen antosianin pada kulit buah anggur sebesar 0.05 % dan kubis ungu sebesar 0.08 %.
RIWAYAT HIDUP PENULIS
Penulis dilahirkan di Kudus, 14 Januari 1985 dan merupakan anak kedua dari pasangan Lazarus Leimena dan Inajati Gani. Penulis menempuh pendidikannya di TK Cahaya Nur Kudus, SD Cahaya Nur Kudus, SLTP Negeri I Kudus, SMU Sedes Sapientiae Semarang, dan berhasil masuk Institut Pertanian Bogor (IPB) melalui jalur USMI (Ujian Seleksi Masuk IPB) di Departemen Ilmu dan Teknologi Pangan, Fakultas Teknologi Petanian.
Selama melakukan studi di Departemen Ilmu dan Teknologi Pangan, penulis juga aktif dalam berbagai kegiatan dan organisasi. Penulis adalah anggota Unit Kegiatan Mahasiswa (UKM) Persekutuan Mahasiswa Kristen IPB (PMK) (2003-2007). Penulis juga berperan serta sebagai panitia dalam kegiatan Konferensi HMPPI (Himpunan Mahasiswa Peduli Pangan Indonesia), BAUR 2005, dan LCTIP (Lomba Cepat Tepat Ilmu Pangan) 2005. Pada tahun 2005, penulis ikut ambil bagian dalam seminar dan pelatihan HACCP yang diselenggarakan oleh Departemen Ilmu dan Teknologi Pangan, IPB dan BPOM-RI. Penulis pernah menjadi asisten praktikum Penyimpanan Pangan pada periode Januari-Juni 2007.
i
KATA PENGANTAR
Puji dan syukur kepada Tuhan Yesus Kristus karena penyelesaian skripsi terjadi bukan atas kekuatan penulis sendiri, melainkan juga atas anugerah kekuatan-Nya. Terima kasih untuk setiap kegagalan dan keberhasilan yang terus menempa keuletan penulis. Selain itu, banyak pihak yang juga telah membantu penulis selama perjalanan hidup dan pelaksanaan tugas akhir. Oleh karena itu, pada kesempatan ini penulis menyampaikan terima kasih yang mendalam kepada:
1. Prof. Dr. Ir. C. Hanny Wijaya, MAgr. selaku Dosen Pembimbing Akademik sekaligus Dosen Pembimbing Skripsi. Terima kasih atas bimbingan, masukan, dorongan, dan saran Ibu selama ini.
2. Dr. Ir. Dede. R. Adawiyah, MSi. selaku dosen penguji. Terima kasih atas masukan dan kesediaan Ibu sebagai penguji.
3. Ibu Didah Nurfaridah, STP. MSi. selaku dosen penguji. Terima kasih atas masukan dan kesediaan Ibu sebagai penguji.
4. Ibu Puspita Sari STP, MAgr. selaku pemberi proyek dalam penelitian tentang buah duwet ini dan pemberi masukan kepada penulis.
5. Keluargaku: Papa, Mama, Ci Milkha, dan Robby atas perhatian, dukungan, doa, dan semangat kepada penulis.
6. Teman teristimewaku, Daniel yang telah memberikan dukungan, semangat, saran, dan doa kepada penulis.
7. Teman-teman satu bimbingan bu Hanny : Eko, Andrea, Tuti, Ratna, teman-teman ITP 39, 41, dan 42, terima kasih atas semangat dan dukungannya serta perkumpulannya selama bimbingan.
ii
10.Teman-teman ITP 40 : Hayuning, Herher, Dhani, Martin, Danang, Reza, Tilo, Mita, Lilin, Ajik, Andal, Steph, Rina, Lasty, dan semua teman-teman lainnya yang tidak bisa disebutkan satu-persatu. Terima kasih atas dukungannya selama 4 tahun ini.
11.Teman-teman ITP 39, 41, dan 42. Terima kasih atas dukungan dan semangatnya.
12.Teman-teman Perwira 45 : Mpin dan Nene (atas semangatnya kepada penulis untuk menyelesaikan skripsi), Ajik (atas bimbingannya kepada penulis dalam menyelesaikan skripsi), Ella, Lisa, Tere, Cat2, dan yang lainnya. Terima kasih atas kebersamaannya selam penulis tinggal di Bogor.
13.Staf dan Teknisi Laboratorium ITP , Seafast Center, dan LJA : Pak Sobirin, Pak Wahid, Pak Koko, Bu Rubiah, Pak Rojak, Pak Taufik, Mba Ririn, dan teknisi lainnya yang telah membantu penulis dalam menyelesaikan penelitian.
14.Semua pihak yang telah membantu yang tidak dapat disebutkan satu per satu.
Penulis berharap agar skripsi ini dapat bermanfaat bagi berbagai pihak dengan berbagai cara. Penulis menyadari bahwa masih banyak kekurangan dalam pelaksanaan penelitian dan penyusunan skripsi ini. Oleh karena itu, kritik dan saran yang membangun sangat diharapkan.
Bogor, Januari 2008
iii
DAFTAR ISI
Halaman
KATA PENGANTAR ... i
DAFTAR ISI ... iii
DAFTAR TABEL ... v
DAFTAR GAMBAR ... vi
DAFTAR LAMPIRAN ... vii
I. PENDAHULUAN ... 1
A. LATAR BELAKANG ... 1
B. TUJUAN ... 2
C. MANFAAT ... 2
II. TINJAUAN PUSTAKA ... 3
A. DUWET ... 3
B. ANTOSIANIN ... 6
C. EKSTRAKSI ANTOSIANIN ... 9
D. PURIFIKASI ANTOSIANIN ... 11
E. KARAKTERISASI ANTOSIANIN ... 12
III. METODOLOGI PENELITIAN ... 15
A. BAHAN DAN ALAT ... 15
1. BAHAN ... 15
2. ALAT ... 15
B. TAHAPAN PENELITIAN ... 15
1. Persiapan Kulit Buah Duwet ... 16
2. Ekstraksi Antosianin ... 16
3. Purifikasi Antosianin ... 17
4. Hidrolisis Basa dan Asam ... 17
C. METODE ANALISIS ... 17
iv
5. Penentuan Kadar Karbohidrat ... 19
6. Penentuan Konsentrasi Antosianin ... 20
7. Penentuan Rendemen Antosianin ... 20
8. Penentuan Karakteristik Antosianin ... 21
IV. HASIL DAN PEMBAHASAN ... 22
A. KARAKTERISTIK KIMIA BUAH DUWET ... 22
1. Komposisi Kimia Buah Duwet ... 22
2. Kandungan Antosianin Buah Duwet ... 24
B. EKSTRAKSI ANTOSIANIN ... 29
C. PURIFIKASI ANTOSIANIN ... 32
D. KARAKTERISASI ANTOSIANIN ... 34
V. KESIMPULAN DAN SARAN ... 44
A. KESIMPULAN ... 44
B. SARAN ... 45
DAFTAR PUSTAKA ... 46
v
DAFTAR TABEL
Halaman Tabel 1. Kandungan nilai gizi buah duwet per 100 g ... 5 Tabel 2. Struktur alami yang terjadi pada antosianidin ... 7 Tabel 3. Komposisi kimia buah duwet ... 22 Tabel 4. Kandungan antosianin kulit buah duwet pada berbagai tingkat
kematangan. ... 25 Tabel 5. Kandungan antosianin pada bagian buah duwet pada tingkat
vi
DAFTAR GAMBAR
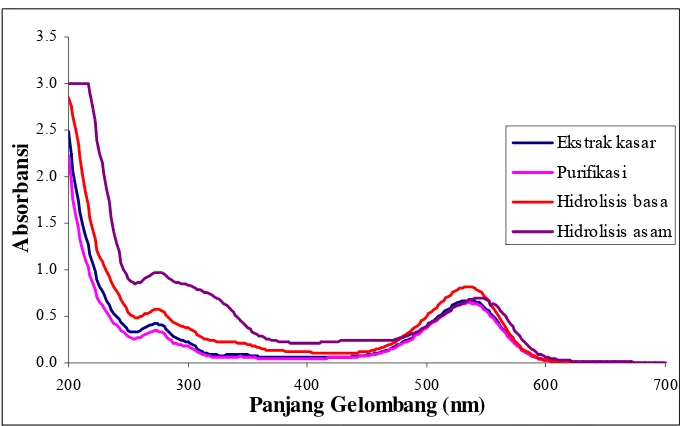
Halaman Gambar 1. Buah Duwet (Syzygium cumini) ... 4 Gambar 2. Struktur dasar kation flavilium (Jackman dan Smith, 1996) ... 6 Gambar 3. Pola spektra kulit buah duwet pada berbagai tingkat kematangan
dalam pH 1 ... 26 Gambar 4. Pola spektra dalam pelarut metanol-HCl 0.01% pada berbagai
perlakuan. ... 36 Gambar 5. Pola spektra buah duwet dan sampel pembanding dalam metanol-
vii
DAFTAR LAMPIRAN
Halaman Lampiran 1. Penentuan kadar air ... 52 Lampiran 2. Penentuan kadar abu ... 52 Lampiran 3. Penentuan kadar lemak ... 52 Lampiran 4. Penentuan kadar protein ... 53 Lampiran 5. Penentuan kadar karbohidrat ... 53 Lampiran 6. Penentuan konsentrasi antosianin buah duwet pada berbagai
tingkat kematangan ... 54 Lampiran 7. Penentuan konsentrasi antosianin pada sampel pembanding ... 55 Lampiran 8. Panjang gelombang dan absorbansi kulit buah duwet pada
berbagai tingkat kematangan dalam pH 1. ... 57 Lampiran 9. Panjang gelombang dan absorbansi kulit buah duwet pada
berbagai perlakuan. ... 59 Lampiran 10. Data panjang gelombang dan absorbansi buah duwet dengan
sampel pembanding. ... 66 Lampiran 11. Data panjang gelombang maksimum untuk beberapa jenis
antosinidin* ... 73 Lampiran 12. Data panjang gelombang maksimum untuk beberapa jenis
I. PENDAHULUAN
A. LATAR BELAKANG
Penentuan mutu bahan pangan pada umumnya dipengaruhi oleh
beberapa faktor diantaranya citarasa, warna, tekstur dan nilai gizinya. Warna
pada makanan dapat memberikan pengaruh tertentu pada produk pangan.
Warna tersebut dapat membuat produk menjadi lebih menarik serta
meningkatkan kualitas produk pangan tersebut (Winarno,1997). Suatu
pangan yang memiliki nilai gizi yang tinggi, apabila tidak didukung dengan
warna yang sesuai maka akan mempengaruhi penerimaan konsumen.
Penggunaan pewarna antara lain terdapat pada berbagai jenis makanan dan
minuman.
Pewarna makanan ini dapat berasal dari sumber nabati maupun
hewani. Pewarna makanan dapat dibedakan menjadi tiga kelompok
berdasarkan asalnya, yaitu pewarna alami, pewarna identik alami, dan
pewarna sintetik. Sejak jaman dulu telah digunakan pewarna alami sebagai
pewarna makanan. Misalnya penggunaan daun suji dan kunyit sebagai
pewarna alami. Sejak ditemukannya pewarna sintetik, penggunaan pewarna
alami mulai berkurang walaupun tidak hilang sama sekali. Pewarna alami ini
mempunyai beberapa kelemahan salah satu diantaranya adalah stabilitasnya
yang rendah yang sangat dipengaruhi oleh suhu dan pH.
Penggunaan pewarna sintetik pada makanan sudah sangat luas. Akan
tetapi, penggunaan pewarna sintetik ini dapat menimbulkan masalah
kesehatan seperti kanker, stroke, dan penyakit jantung, dan hiperaktif pada
anak-anak (Anonim, 2007c; Anonim, 2008a, dan 2008b). Oleh karena itu,
penggunaan pewarna alami kini kembali disukai oleh masyarakat. Hal ini
disebabkan pewarna alami lebih bersifat aman untuk dikonsumsi. Selain
digunakan sebagai pewarna, pewarna alami ini juga dapat berfungsi sebagai
flavor, antioksidan, antimikroba, dan fungsi-fungsi lainnya (Winarno, 1997).
Indonesia mempunyai banyak tanaman yang dapat digunakan sebagai
sumber pewarna alami, tetapi penggunaan dan pengolahannya dalam
adalah buah duwet (Syzygium cumini). Buah duwet dengan ukuran dan kualitas yang bagus memiliki rasa manis, agak asam dan sedikit sepat
(Anonim, 2006b). Di Indonesia, pemanfaatan buah duwet ini masih belum
optimal. Buah duwet biasanya hanya dikonsumsi secara langsung tanpa
melalui proses pengolahan apapun. Dilihat dari kulit buah yang berwarna
ungu kehitaman apabila sudah matang, maka buah yang dihasilkan akan
sangat berpotensi sebagai sumber pigmen antosianin yang dapat digunakan
dalam industri pangan. Untuk itu perlu dilakukan usaha untuk mengetahui
karakteristik kimia buah duwet sehingga dapat meningkatkan nilai manfaat
buah tersebut. Selain itu, perlu dilakukan usaha untuk mempelajari
karakteristik pigmen yang terdapat dalam buah duwet sehingga dapat
dimanfaatkan sebagai pewarna alami.
B. TUJUAN
Penelitian ini bertujuan untuk mengetahui karakteristik kimia dari buah
duwet, seperti komposisi kimia dan kandungan antosianin serta mempelajari
proses purifikasi untuk menduga karakteristik pigmen antosianin yang ada
dalam buah duwet.
C. MANFAAT
Manfaat dari penelitian ini adalah dapat diketahuinya karakteristik
kimia, dan karakteristik pigmen yang terdapat dalam buah duwet sehingga
II. TINJAUAN PUSTAKA
A. DUWET
Duwet (Syzygium cumini) merupakan tumbuhan beriklim tropis yang berasal dari India, Burma, Ceylon (Morton, 1978). Tanaman ini juga tumbuh
di bagian selatan Asia termasuk Myanmar dan Afganistan. Di Indonesia,
tanaman ini juga dikenal dengan berbagai nama diantaranya adalah jambolan,
jambolana, jamblang, jambul, dan jamun. Klasifikasi dari tanaman duwet
adalah kingdom: Plantae, divisi: Magnoliophyta, kelas: Magnoliopsida, ordo:
Myrtales, famili: Myrtaceae, genus: Syzygium, dan spesies: S. cumini
(Anonim, 2006b).
Tanaman ini kokoh, bercabang banyak, percabangannya tidak beraturan
dan rendah (Morton, 1978). Tinggi maksimum dari tanaman ini dapat
mencapai 30 meter dan diameter batangnya 40-90 cm. Kulit kayu yang berada
di bagian bawah tanaman kasar dan berwarna kelabu tua, sedangkan semakin
ke atas akan semakin licin dan berwarna kelabu muda. Daunnya saling
berhadapan, bentuknya bundar telur sampai lonjong, berukuran 5-25 cm
panjangnya dan 2-10 cm lebarnya. Pangkal daunnya berbentuk membundar,
sedangkan ujungnya tumpul atau berujung lancip. Tepi daunnya rata dan
berpinggir tipis serta tembus pandang. Selagi muda daunnya berwarna merah
muda, setelah tua daunnya menjadi kasar, berwarna hijau tua mengkilap pada
bagian atasnya. Jika diremas, daunnya agak berbau terpentin (Verheij dan
Coronel, 1997). Bunganya kecil-kecil, berwarna putih keabu-abuan sampai
merah jambu, dan wangi. Pada umumnya muncul dari cabang-cabang yang
tidak berdaun. Daun mahkotanya berbentuk bundar dan berjumlah 4 helai
(Anonim, 2006a).
Buahnya berbentuk lonjong sampai bulat telur, seringkali membengkok,
bermahkotakan cuping kelopak. Panjang buahnya 1-5 cm warnanya berubah
dari hijau sampai ungu tua dan berwarna hampir hitam saat sudah matang
dengan sempurna. Buahnya bergerombol dari hanya 10 sampai 40 buah
(Anonim, 2006b). Di Indonesia, daging buahnya berwarna putih sampai agak
buahnya berasa sepat, kadang-kadang tidak terlalu enak, dan rasanya
bervariasi dari asam sampai agak manis. Memiliki kulit buah yang tipis, halus,
dan mengkilat. Biji buahnya berjumlah 0–5 butir, berbentuk lonjong,
panjangnya sampai 3.5 cm, dan berwarna hijau sampai coklat (Morton, 1978).
Gambar 1. Buah Duwet (Syzygium cumini)
Menurut Verheij dan Coronel (1997), perbanyakan dan penanaman duwet
pada umumnya diperbanyak dengan benih. Pertumbuhan dan perkembangan
benih duwet berkecambah pada minggu kedua setelah persemaian. Semai
yang dihasilkan dapat tumbuh dengan cepat. Pohonnya dapat berbunga 7 – 8
tahun kemudian, yang pada saat itu batangnya bercabang rendah dan
percabangannya memencar dengan baik. Pohon yang berasal dari tempelan
atau sambungan akan lebih cepat dewasa dan dapat mulai berbunga dalam
waktu 3 – 4 tahun. Pembungaan yang banyak itu terutama muncul dari ketiak
daun pada puncuk yang berumur 5 – 12 bulan. Pembungaan tersebut dapat
juga keluar dari ujung ranting atau pada ranting yang tidak berdaun.
Penyerbukannya dibantu oleh kumbang atau kutu, tetapi juga oleh angin. Di
Jawa, pembungaan terjadi pada bulan Juli – Agustus dan buah matang pada
bulan September dan Oktober.
Pohon yang berasal dari benih pada umumnya menghasilkan buah
berukuran kecil, rasanya sangat asam dan sepat, sedangkan hasil seleksi
perbaikan dapat menghasilkan buah berukuran besar, rasanya enak dan berbiji
5 kehitaman, tetapi ada juga kultivar yang putih warna buahnya (Verheij dan
Coronel, 1997).
Buah duwet yang mempunyai ukuran dan kualitas yang bagus biasanya
mempunyai rasa yang manis atau sedikit asam. Buah yang sudah matang biasa
dimakan dalam keadaan segar. Di Filipina dan India, buah duwet yang sudah
matang ini ditaburi dengan garam dan diaduk dalam sebuah mangkuk tertutup
untuk melunakkannya. Buah ini juga biasa diolah menjadi sari buah, jeli, atau
anggur. Di Filipina, anggur duwet diproduksi secara komersial. Daunnya
digunakan sebagai pakan. Bunganya mengandung banyak nektar yang dari
situ kumbang membuat madu dengan kualitas yang baik. Kulit kayunya terasa
sepat dan dapat digunakan sebagai obat kumur. Kulit buahnya dapat
digunakan sebagai pewarna. Tepung bijinya bermanfaat untuk mengobati
kencing manis, disentri, diare, dan penyakit lainnya (Verheij dan Coronel,
1997). Nilai gizi yang terkandung dalam buah duwet per 100 gramnya dapat
dilihat pada Tabel 1.
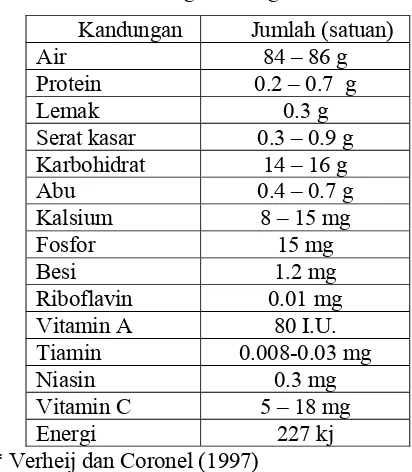
Tabel 1.Kandungan nilai gizi buah duwet per 100 g *
Kandungan Jumlah (satuan)
Air 84 – 86 g
Tiamin 0.008-0.03 mg
Niasin 0.3 mg
Vitamin C 5 – 18 mg
Energi 227 kj
* Verheij dan Coronel (1997)
Menurut penelitian, biji buah duwet mengandung glukosida phytomelin.
Zat ini dapat mengurangi kerapuhan pembuluh darah kapiler penyebab luka
diabetes yang lama sembuhnya. Kelebihan koresterol di dalam darah juga
Dalam buah duwet banyak mengandung astringen, yaitu suatu zat yang
dipercaya dapat membantu penyembuhan luka diabetes karena sifat astringen
yang dapat menciutkan kulit (Anonim, 2008c)
B. ANTOSIANIN
Antosianin merupakan salah satu dari kelompok pigmen utama pada
tanaman (Harborne dan Grayer, 1988). Pigmen ini berada pada sebagian besar
tanaman tingkat tinggi dan terdapat pada seluruh bagian tanaman (Brouillard,
1982). Pigmen antosianin sebagian besar terdapat pada tamanan yang
berbunga dan menghasilkan warna dari merah tua sampai biru pada bunga,
buah, dan daun (Harborne dan Grayer, 1988). Antosianin dapat larut dalam air
sel vakuola dan jarang ditemui dalam bentuk hablur. Vakuola adalah organel
sitoplasmik yang berisi cairan yaitu air, dibatasi oleh membran yang mungkin
identik dengan membran sel tanaman (Kimball, 1993).
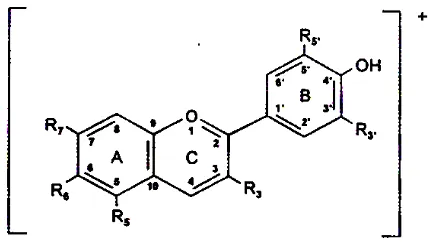
Secara kimia, semua antosianin merupakan turunan dari kation flavilium
(3,5,7,4’ tetrahidroksiflavilium) yang merupakan struktur dasar dari
antosianidin (Timberlake dan Bridle, 1997). Menurut Harborne dan Grayer
(1988), semua antosianin merupakan turunan suatu struktur aromatik tunggal
yaitu sianidin yang dengan penambahan atau pengurangan gugus hidroksil,
metilasi, atau glikosilasi maka jenis antosianin lain terbentuk.
Gambar 2. Struktur dasar kation flavilium (Jackman dan Smith, 1996)
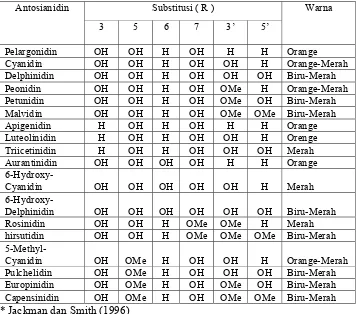
Menurut Jackman dan Smith (1996), ada 18 jenis antosianidin yang telah
ditemukan, namun hanya enam yang memegang peranan penting dalam bahan
pangan dan sering ditemukan yaitu pelargonidin, sianidin, delpinidin,
7 Struktur alami yang terjadi pada antosianidin dapat dilihat pada Tabel 2.
Umumnya antosianidin tidak ditemukan di dalam tanaman, jenis pigmen yang
terdapat dalam bunga dan buah sebagian besar berada dalam bentuk
glikolisasi. Glikolisasi juga diasumsikan dapat meningkatkan kestabilan dan
kelarutan pigmen antosianin dalam air, sebab antosianidin kurang stabil dan
kurang larut di dalam air dibandingkan dengan antosianin.
Tabel 2.Struktur alami yang terjadi pada antosianidin *
Antosianidin Substitusi ( R ) Warna
3 5 6 7 3’ 5’
Aurantinidin OH OH OH OH H H Orange
6-Hydroxy-Cyanidin OH OH OH OH OH H Merah
6-Hydroxy-Delphinidin OH OH OH OH OH OH Biru-Merah
Rosinidin OH OH H OMe OMe H Merah
* Jackman dan Smith (1996)
Menurut Markakis (1982), molekul antosianin disusun dari sebuah
aglikon (antosianidin) yang teresterifikasi dengan satu atau lebih gula (glikon).
Menurut Timberlake dan Bridle (1983), gula yang menyusun antosianin terdiri
dari:
Monosakarida, biasanya glukosa, galaktosa, ramnosa, dan arabinosa
Disakarida yang merupakan dua buah monosakarida dengan
kombinasi dari empat monosakarida diatas dan xilosa, seperti
Trisakarida, merupakan tiga buah monosakarida yang mengandung
kombinasi dari gula-gula di atas dalam posisi linier maupun rantai
cabang.
Gula yang paling banyak dijumpai adalah monosakarida seperti glukosa,
galaktosa, ramnosa, dan arabinosa. Di dan tri sakarida juga dibentuk dari
kombinasi monosakarida diatas. Dalam tanaman, antosianin dalam bentuk
glikosida yaitu ester dengan satu molekul monosakarida disebut
monoglukosida dan biosida atau diglukosida jika memiliki dua molekul gula
(Winarno, 1997).
Keragaman antosianin dapat terjadi karena perbedaan sifat gula, jumlah
satuan gula, dan letak ikatan gulanya. Molekul gula ini dapat memberikan
dampak kestabilan pada molekul antosianin. Pada molekul gulanya sering
terjadi asilasi sehingga terdapat molekul ketiga yang biasanya berupa asam
ferulat, koumarat, kafeat, malonik, atau asetat (Bennion, 1980; Tranggono,
1990; Francis, 2000). Antosianin yang terasilasi ditemukan pada kubis ungu,
wortel ungu, lobak, dan ubi jalar ungu, dimana gugus asil ini dapat
memperbaiki stabilitas pigmen antosianin (Bassa dan Francis, 1987; Giusti et al., 1998).
Warna dari pigmen antosianin ini dipengaruhi oleh beberapa faktor,
diantaranya adalah kandungan pigmen, pH, suhu, enzim, logam, dan
kopigmentasi (Francis, 1982). Glikolisasi dan metilasi juga turut
mempengaruhi warna dari pigmen tersebut. Penambahan gugus glikosida atau
peningkatan jumlah gugus hidroksil bebas pada rantai karbon nomor 5 (cincin
A) dapat meningkatkan warna kebiruan, sedangkan metilasi dapat
meningkatkan warna kemerahan (Robinson, 1991).
Pada medium air, termasuk pada makan, antosianin terdapat dalam empat
bentuk struktur kesetimbangan yaitu quinonoidal base, kation flavilium
berwarna merah, karbinol pseudobase, dan kalkon yang tidak berwarna.
Bentuk kesetimbangan ini sangat dipengaruhi oleh pH. Pada pH rendah,
struktur kation flavilium dominan, sedangkan pada pH 4 – 6 bentuk karbinol
yang dominan (Elbe dan Schwartz, 1996). Semakin tinggi nilai pH, maka
9 Antosianin yang mengandung komponen yang berperan sebagai kopigmen
warnanya akan lebih stabil terhadap cahaya pada tingkatan tertentu (Bobbio et al., 1992). Selain itu, warna pigmen juga dipengaruhi oleh pelarut. Warna antosianin akan menjadi lebih biru pada pelarut alkohol dibandingkan dengan
pelarut air (Swain, 1976).
Kondisi yang sedikit asam akan meningkatkan intensitas warna dari
pigmen antosianin. Selain itu, dengan terikatnya beberapa jenis gula juga
dapat meningkatkan intensitas warna dari pigmen antosianin (Lewis et al., 1997). Antosianin berada dalam bentuk kation flavilium pada pH yang lebih
rendah daripada 2 (Robinson, 1991). Antosianin lebih stabil pada larutan yang
bersifat asam dari pada larutan yang bersifat netral atau basa. Menurut
Brouillard (1972), pada pH 2 sampai 4 antosianin stabil, terutama dalam
keadaan tanpa oksigen.
Pigmen antosianin ini telah lama dikonsumsi oleh manusia dan hewan
bersamaan dengan buah atau sayur yang mereka makan. Selama ini tidak
pernah terjadi suatu penyakit ataupun keracunan yang disebabkan oleh pigmen
ini (Brouillard, 1982). Menurut penelitian yang banyak dilakukan, pigmen
antosianin dan senyawa-senyawa flavonoid lainnya terbukti memiliki efek
positif terhadap kesehatan (Bridle dan Timberlake, 1997). Banyak bukti telah
menunjukkan bahwa antosianin bukan saja tidak beracun (non-toxic) dan tidak menimbulkan efek mutagenik, tetapi juga memiliki sifat yang positif (Saija,
1994). Antosianin memiliki warna yang kuat, larut dalam air, relatif stabil
dalam air pada pH asam dan adanya pembatasan penggunaan bahan pewarna
merah sintetik, maka antosianin cocok dijadikan sebagai substitusi pawarna
makanan sintetis (Markakis, 1982).
C. EKSTRAKSI ANTOSIANIN
Langkah pertama yang dilakukan dalam mengukuran dan
mengidentifikasi suatu senyawa yang terdapat dalam suatu bahan adalah
dengan melakukan ekstraksi. Menurut Harborne (1987), ekstraksi adalah
proses penarikan komponen/zat aktif suatu sampel dengan menggunakan
pelarut tertentu. Pemilihan metode ekstraksi senyawa ditentukan oleh
kelarutan dalam pelarut yang digunakan. Prinsip ekstraksi adalah melarutkan
senyawa polar dalam pelarut polar dan senyawa non-polar dalam senyawa
non-polar.
Menurut Jackman dan Smith (1996), antosianin ini tidak stabil dalam
suasana netral atau basa. Oleh karena itu, prosedur ekstraksi biasanya
dilakukan dengan menggunakan pelarut asam yang dapat merusak jaringan
tanaman. Cara tradisional yang paling sering digunakan untuk mengekstraksi
antosianin adalah dengan maserasi yaitu “merendam” bahan yang akan
diekstrak dalam alkohol, pada suhu rendah dengan panambahan sedikit asam
seperti HCl.
Menurut Markakis (1982), metode ekstraksi yang paling bagus untuk
bahan yang berasal dari tanaman adalah dengan melarutkan bahan kedalam 1
% HCl dalam metanol. Di dalam pangan, metode ekstraksi yang paling baik
adalah dengan melarutkan bahan dengan 1 % HCl dalam etanol. Hal ini
disebabkan karena sifat toksik dari metanol meskipun ekstraksi dengan
menggunakan etanol ini kurang efektif dan lebih sulit untuk mendapatkan
konsentratnya. Berbagai contoh ekstraksi antosianin antara lain ekstraksi
dengan menggunakan metanol dengan 1% HCl pada buah cranberry dan anggur, ekstraksi dengan menggunakan campuran metahol, asam asetat, dan
air (25:1:24) pada blueberry (Teeling et al., 1971; Espada et al., 2004; Lohachoompol et al., 2004).
Menurut Strack dan Wray (1993), penambahan asam sebagai pelarut
tidak selalu diperlukan. Metode ekstraksi yang digunakan untuk analisis
kuantitatif harus diperiksa secara menyeluruh pada tanaman dan jenis pigmen
tertentu. Jika terdapat gugus asil pada antosianin misalnya didalam kubis
ungu, maka penggunaan asam sebagai campuran pelarut harus dihindarkan.
Hal ini disebabkan ikatan asil ini mudah terhidrolisis (Markakis, 1982).
Beberapa contoh ekstraksi yang tidak menggunakan asam adalah pada
11 (70:30), dan pada kacang polong ungu pelarut yang digunakan adalah 15 %
aseton (Teeling et al., 1971; Galindo et al.,1999; Terahara et al., 2000; Awika
et al., 2004).
Antosianin, seperti flavonoid lainnya, merupakan struktur dengan cincin
aromatik yang berisi substituen komponen polar dan residu glikosil sehingga
menghasilkan molekul polar. Dengan keadaannya yang polar, antosianin lebih
mudah larut dalam air dibanding dalam pelarut non polar. Tergantung dari
kondisi medianya, antosianin juga dapat larut dalam eter dengan pH dimana
molekul dapat terionisasi. Degradasi pigmen antosianin ini dapat
diminimalisasi dengan membekukannya, freeze dried, atau spray dried
(Jackman dan Smith, 1996).
D. PURIFIKASI ANTOSIANIN
Purifikasi dari ekstrak antosianin ini diperlukan karena tidak ada sistem
pelarut yang dapat digunakan untuk memisahkan antosianin secara spesifik.
Sejumlah bahan-bahan lainnya yang harus dipertimbangkan antara lain adalah
polifenol yang lain dan pektin yang dapat mengganggu stabilitas dan atau
analisis dari pigmen tersebut (Jackman dan Smith, 1996).
Menurut Timberlake dan Bridle (1997), pemurnian dari ekstrak
antosianin ini dapat menggunakan kromatografi kolom penukar ion dengan
resin penukar kation Amberlite CG-50 atau Dowex 50 WX-4. Konsentrat
pekat dimasukkan ke dalam kolom sehingga antosianin akan diabsorpsi oleh
resin sedangkan kotoran akan dielusi oleh air. Antosianin yang telah
diabsorpsi kemudian dielusi dengan metanol-HCl.
Cara-cara lain yang dapat digunakan untuk memisahkan atau
memurnikan antosianin dari ekstrak kotor atau konsentratnya antara lain
dengan menggunakan Sephadex G-25 atau LH-20, Droplet counter-current chromatography (DCCC) dengan menggunkan n-butanol-asam asetat glasial-air sebagai sistem pelarut, preparative thin layer chromatography (PTLC) (Jackman dan Smith, 1996).
Secara tradisional, pemurnian antosianin untuk tujuan analisis ini
dilakukan dengan kromatografi kertas atau kromatografi lapis tipis (TLC).
campuran yang komplek adalah dengan menggunakan reversed-fase High Performance Liquid Chromatography (HPLC). Teknik ini tidak merusak komponen dan menghasilkan pemisahan komponen yang dapat dibaca untuk
analisis berikutnya (Jackman dan Smith, 1996).
Salah satu metode pemurnian antosianin yang dilakukan pada sampel
kulit buah leci (Litchi chinensis Sonn.) adalah dengan menggunakan Sephadex G-25 cartridge dan dielusi dengan 50 % aseton/1 % asam format/ air (Lee dan Wicker, 1991). Pemurnian antosianin pada pinta boca (Solanum stenotomom) dilakukan dengan menggunakan solid phase extraction (SPE) didalam C-18
cartridges (Eon et al., 2004).
E. KARAKTERISASI ANTOSIANIN
Metode kromatografi dan spektroskopik telah digunakan untuk
mengidentifikasi antosianin secara cepat dan akurat. Akan tetapi, karakteristik
mutlak dari antosianin tidak dapat ditentukan hanya dengan menggunakan
kromatografi atau spektroskopi saja. Karakteristik struktural dari antosianin ini
biasanya melibatkan identifikasi dari aglikon, gula dan gugus asil (Jackman
dan Smith, 1996). Menurut Markakis (1982), aglikon dan bagian dari gula ini
dapat diidentifikasi dengan hidrolisis asam yang diikuti dengan kromatografi
kertas.
Menurut Jackman dan Smith (1996), karakterisasi dari antosianin ini
melibatkan hidrolisis asam, basa, enzim, dan peroksida. Hidrolisis asam
digunakan untuk memecah aglikon dan gula dari pigmen tersebut, sedangkan
hidrolisis basa ini digunakan untuk menentukan aglikon alami dan untuk
menentukan gugus asil. Selain itu, penentuan karakterisasi dari pigmen
antosianin ini juga dapat dilakukan dengan analisis spektroskopi. Menurut
Markham (1988), analisis spektroskopi UV dan sinar tampak merupakan cara
tunggal yang paling berguna untuk menganalisa struktur flavonoid. Hal ini
dikarenakan ciri spektrum yang sama memberikan data mengenai jenis
senyawa yang sama (Harborne, 1987). Keuntungan dari cara spektroskopi ini
adalah sangat sedikitnya jumlah sampel yang diperlukan untuk analisis
13 Prisip dasar dari analisis spektroskopi adalah bila suatu sinar melalui
larutan kimia tertentu, maka senyawa tersebut akan menyerap sinar dengan
panjang gelombang tertentu. Warna larutan kimia tergantung pada jenis sinar
yang dipancarkan dan tertangkap oleh mata kita, sehingga senyawa kimia ada
yang berwarna ataupun tidak berwarna. Spektrofotometer merupakan alat
pengukur kualitatif dan kuantitatif karena jumlah sinar yang diserap oleh
partikel di dalam larutan juga tergantung pada jenis dan jumlah partikel. Ada
beberapa jenis spektroskopi, salah satunya adalah spektroskopi absorpsi (Nur,
1989).
Spektroskopi absorpsi memiliki prinsip dasar yaitu bila suatu cahaya
putih atau radiasi dilewatkan melalui larutan berwarna, maka radiasi dengan
panjang gelombang tertentu akan diserap (absorpsi) secara selektif dan radiasi
lainnya akan diteruskan (transmisi). Absorpsi maksimum dari larutan
berwarna terjadi pada daerah berlawanan. Misalnya larutan merah akan
menyerap radiasi maksimum pada daerah warna hijau. Dengan kata lain,
warna yang diserap adalah warna komplementer dari warna yang diamati.
Sehingga larutan yang berwarna merah akan menyerap radiasi panjang
gelombang sekitar 500 nm (Nur, 1989).
Kromatografi adalah salah satu teknik yang dapat digunakan untuk
memisahkan dan mengidentifikasikan komponen-komponen yang tersebar
pada tanaman tingkat tinggi. Teknik-teknik kromatografi sederhana seperti
kromatografi kertas, kromatografi lapis tipis, dan kromatografi kolom terbuka
dapat digunakan untuk mengisolasi dan menganalisis antosianin (Strack dan
Wray, 1993). Analisis dengan kromatografi lapis tipis (TLC) ini sudah
diaplikasikan untuk menganalisis bermacam-macam komponen meliputi
lemak, karbohidrat, vitamin, asam amino, dan pigmen alami. Salah satu
analisis pigmen antosainin yang menggunakan TLC dilakukan pada kulit buah
anggur (Fong et al., 1971; Heidari et al., 2004).
Karakterisasi pigmen hasil kromatografi kemudian dibandingkan
dengan standar antosianin, aglikon, dan gula. Meskipun antosianin dan
aglikon dapat diperoleh dari berbagai sumber, antosianin ini memerlukan
akhir, pembandingan langsung dengan senyawa autentik harus dilakukan. Bila
senyawa autentik tidak terdapat, maka perbandingan yang seksama dengan
III. METODOLOGI PENELITIAN
A. BAHAN DAN ALAT 1. BAHAN
Bahan utama yang digunakan dalam penelitian ini adalah buah
duwet pada berbagai tingkat kematangan. Bahan – bahan lain yang
digunakan adalah buah anggur, kubis ungu, etanol, metanol, hexane,
n-butanol, asam asetat, HCl, KOH, K2SO4, HgO, H2SO4 pekat, NaOH,
Na2S2O3, asam borat, indikator (merah metil dan metil biru), asam fosfat,
asam asetat, buffer potasium klorida, buffer sodium asetat, gas nitrogen, dan air deionisasi.
2. ALAT
Alat yang digunakan adalah pisau stainless steel, hand blender, penyaring filter, sentrifus, rotary vacuum evaporator, neraca analitik, soxhlet, oven, penangas air, tanur, cawan porselin, labu destruksi, alat
destilasi, lemari beku, C-18 Sep-Pak cartridge, SPE (solid phase extraction), pH-meter, plat TLC, chamber TLC, spektrofotometer, dan alat-alat gelas keperluan analisis.
B. TAHAPAN PENELITIAN
Pada penelitian ini dilakukan pengujian karakteristik kimia dari buah
duwet, yang meliputi kadar air, kadar abu, kadar protein, kadar lemak, dan
karbohidrat. Selain itu juga dilakukan pengukuran konsentrasi antosianin dan
perhitungan rendemen antosianin pada beberapa tingkat kematangan kulit
buah duwet, kulit dan daging buah duwet dengan tingkat kematangan paling
tinggi, dan sampel pembanding (anggur dan kubis ungu). Pengukuran
konsentrasi antosianin ini dilakukan dengan cara mengekstrak sampel-sampel
tersebut. Ekstrak yang diperoleh kemudian dianalisis konsentrasi antosianin
Tahap selanjutnya dilakukan ekstraksi pada kulit buah dengan
kandungan antosianin tertinggi. Ekstrak tersebut kemudian dimurnikan dengan
menggunakan C-18 Sep-Pak Cartridge. Ekstrak yang telah dimurnikan kemudian dihidrolisis basa dan asam. Selanjutnya dilakukan analisis dengan
menggunakan spektrofotometer UV-Vis dan TLC untuk mengetahui
karakteristik dari pigmen antosianin yang terdapat dalam buah duwet. Analisis
dengan menggunakan spektrofotometer digunakan untuk mengetahui spektra
dari antosianin yang terdapat dalam buah duwet, sedangkan analisis dengan
TLC untuk menduga jenis antosianin yang terdapat dalam buah duwet.
1. Persiapan Kulit Buah Duwet
Buah duwet dipisahkan dari bijinya sehingga diperoleh sampel
kulit-daging buah, sedangkan kulit buah duwet dipisahkan dari daging
buahnya dengan menggunakan pisau stainless steel sehingga diperoleh
kulit buahnya saja. Kulit buah dan kulit-daging buah secara terpisah
diblansir selama 2 menit dengan menggunakan uap panas untuk
menginaktifkan enzim polifenol oksidase. Sampel yang diperoleh
dimasukkan ke dalam kantong plastik dan disimpan dalam lemari
pembeku untuk tahapan selanjutnya.
2. Ekstraksi Antosianin (Sari et al., 2005)
Ekstraksi antosianin dilakukan dengan metode maserasi
menggunakan pelarut etanol. Sampel sebanyak 25 gram dihancurkan dan
dilarutkan dalam etanol (50 ml) kemudian diekstrak dengan cara distirer
selama 60 menit pada suhu 27oC. Larutan disentrifus selama 15 menit
dengan kecepatan 4000 rpm untuk memisahkan filtrat dan residu. Filtrat
yang dihasilkan kemudian ditampung dalam erlenmeyer, sedangkan
residunya diekstrak kembali dengan cara yang sama sampai didapat filtrat
yang bening yang menandakan bahwa semua antosianin telah terekstrak.
Ekstrak yang didapat kemudian disaring dengan menggunakan penyaring
17
3. Purifikasi Antosianin (Galindo et al., 1999)
Purifikasi antosianin dilakukan dengan melewatkan ekstrak pada
C-18 Sep-Pak Cartridge. Cartridge yang digunakan diaktifkan terlebih dahulu dengan melewatkan metanol, kemudian air yang telah diasamkan
dengan 0.01 % HCl. Ekstrak pekat kemudian dilewatkan kedalam C-18
Sep-Pak Cartridge yang telah diaktifkan. Antosianin dan senyawa fenolik lainnya diserap pada mini kolom, sedangkan gula, asam, dan komponen
larut air lainnya dielusi dengan larutan air yang telah diasamkan dengan
0.01 % HCl sebanyak 2 kali volume kolom. Antosianin dielusi dengan
metanol yang mengandung 0.01 % HCl. Fraksi metanolik ini kemudian
dipekatkan dengan rotavapor pada suhu 35oC dan pigmen yang tersisa dilarutkan dalam air deionisasi yang mengandung 0.01 % HCl.
4. Hidrolisis Basa dan Asam (Galindo et al., 1999) a. Hidrolisis Basa
Pigmen yang sudah dimurnikan (2 ml) kemudian disaponifikasi
di dalam tabung reaksi bertutup dengan menggunakan 10 % KOH (10
ml). Proses ini dilakukan selama 8 menit pada suhu ruang dan dalam
ruangan gelap. Larutan ini kemudian dinetralkan dengan HCl 2 N.
Hidrolisat ini kemudian dimurnikan dengan melewatkannya ke dalam
C-18 Sep-Pak Cartridge.
b. Hidrolisis Asam
Pigmen murni yang sudah disaponifikasi (1 ml) dicampur
dengan 15 ml HCl 2 N di dalam tabung reaksi tertutup, kemudian
dihembus dengan gas nitrogen dan ditutup. Pigmen dihidrolisis selama
45 menit pada suhu 100oC dan didinginkan. Hidrolisat ini kemudian
dimurnikan dengan melewatkannya ke dalam C-18 Sep-Pak Cartridge.
C. METODE ANALISIS
1. Penentuan Kadar Air (AOAC Official Method. 979.12, 1995)
Cawan aluminium dikeringkan pada suhu 100-105oC selama 1 jam
dan dimasukkan dalam cawan aluminium yang telah dikeringkan. Setelah
itu, sampel besarta cawan dikeringkan dalam oven vakum bersuhu 70 ± 1
o
C dengan tekanan maksimum 5000 N/m2 (Pa) atau 37.5 mmHg selama 16
± 0.5 jam kemudian didinginkan dalam desikator dan ditimbang. Kadar air
dihitung dengan menggunakan rumus;
%
M1 = berat cawan + sampel sebelum dikeringkan
M2 = berat cawan + sampel setelah dikeringkan
2. Penentuan Kadar Abu (AOAC Official Method 940.26, 1995)
Cawan poselin dikeringkan pada suhu 100oC, didinginkan dalam
desikator kemudian ditimbang. Sampel sebanyak 5-10 gram dimasukkan
dalam cawan porselin dan dimasukkan ke dalam tanur bersuhu ≤ 525 oC.
Proses pengabuan dilakukan selama 12-18 jam, kemudian dimasukkan
kedalam desikator untuk didinginkan lalu ditimbang. Kadar abu dihitung
dengan rumus;
M1 = berat cawan + sampel sebelum dikeringkan
M2 = berat cawan + sampel setelah dikeringkan
3. Penentuan Kadar Protein (AOAC Official Method 920.152, 1995; AOAC Official Method 960.52, 1995)
Penentuan kadar protein buah duwet menggunakan metode mikro
Kjeldhal. Sampel ditimbang 0.2 g (kira-kira membutuhkan 0.5 – 1 ml HCl
0.02 N). Sampel dimasukkan ke dalam labu Kjeldahl dan ditambahkan
1.9±0.1 g K2SO4, 40±10 mg HgO, dan 2.0±0.1 ml H2SO4 kemudian
19 air (1-2 ml). Setelah itu, sampel dimasukkan ke dalam alat destilasi dan
ditambahkan 10 ml larutan NaOH-Na2S2O3. Digunakan asam borat yang
telah ditambahkan indikator campuran merah metil dan metil biru
sebanyak 2-4 tetes. Destilasi sampai mendapatkan 15 ml destilat dan
dilarutkan menjadi 50 ml. Hasil ini kemudian dititrasi dengan HCl 0.02 N
sampai titik akhir dari titrasi. Titik akhir titrasi ketika warna titrat berubah
dari hijau menjadi biru keunguan/abu-abu. Kadar protein dihitung dengan
rumus;
4. Penentuan Kadar Lemak (SNI 01-2891-1992)
Penentuan kadar lemak buah duwet menggunakan metode ekstraksi
langsung dengan alat Soxhlet. Sampel ditimbang ± 5 gram kemudian dimasukkan kedalam selongsong kertas yang dialasi dengan kapas dan
disumbat dengan kapas. Setelah itu, dimasukkan ke dalam alat soxhlet
yang telah dihubungkan dengan labu lemak yang telah diketahui bobotnya.
Ekstraksi dilakukan selama 6 jam dengan menggunakan pelarut heksan.
Setelah diperoleh labu lemak berisi lemak hasil ekstraksi dan pelarut, labu
dikeringkankan dengan oven 105°C. Labu lemak dimasukkan dalam
desikator dan setelah itu ditimbang berat labu berisi lemak. Kadar lemak
dihitung dengan rumus;
5. Penentuan Kadar Karbohidrat (by difference)
Penentuan kadar karbohidrat buah duwet dilakukan dengan
menggunakan perhitungan Carbohydrate by Difference. Perhitungan ini bukan berdasarkan analisis tetapi berdasarkan perhitungan sebagai berikut:
6. Penentuan Konsentrasi Antosianin (Prior et al., 1998)
Konsentrasi antosianin dapat diukur berdasarkan metode pH-differential. Sebanyak masing-masing 0.05 ml sampel dimasukkan ke dalam 2 buah tabung reaksi. Tabung reaksi pertama ditambah larutan
buffer potasium klorida (0.025 M) pH 1 sebanyak 4.95 ml dan tabung reaksi kedua ditambahkan larutan buffer sodium asetat (0.4 M) pH 4.5 sebanyak 4.95 ml. Pengaturan pH dalam pembuatan buffer potasium klorida dan sodium asetat menggunakan HCl pekat. Absorbansi dari kedua
perlakuan pH diukur dengan spektrofotometer pada panjang gelombang
516 nm dan 700 nm setelah didiamkan selama 15 menit.
Nilai absorbansi sampel ekstrak dihitung dengan menggunakan
persamaan: A = [( A516 - A700 )pH1 – ( A516 - A700 )pH4.5 ].
Konsentrasi antosianin dihitung sebagai sianidin-3-glikosida
menggunakan koefisien ekstingsi molar sebesar 29 600 L cm-1 dan berat
molekul sebesar 448.8.
Konsentrasi antosianin ( mg L-1 ) = ( A x BM x FP x 1000 )
( ε x 1),
dimana: A = absorbansi
BM = berat molekul ( 448.8 )
FP = faktor pengenceran ( 5 ml / 0.05 ml )
ε = koefisien ekstingsi molar ( 29 600 L cm -1 ).
Konsentrasi antosianin selanjutnya dinyatakan dalam mg CyE/g
sampel (CyE = sianidin equivalen).
7. Penentuan Rendemen Antosianin
Rendemen antosianin dihitung dalam persen yang menyatakan
banyaknya antosianin yang terdapat dalam sampel berdasarkan berat
basah.
21
8. Penentuan Karakteristik Antosianin (Harborne, 1967; Hrazdina, 1970; Francis, 1982)
Karakteristik antosianin pada buah duwet ditentukan dengan
menggunakan analisis spektrofotometrik dan TLC (Thin Layer
Chromatography). Analisis spektrofotometrik didasarkan pada prosedur yang dilakukan oleh Harborne (1967) dan Francis (1982). Analisis ini
dilakukan untuk mengetahui spektra/spektrum dan dapat diketahui panjang
gelombang maksimum dari komponen antosianin pada buah duwet
sehingga dapat diketahui karakteristiknya seperti ada tidaknya gugus asil.
Pengukuran ini dilakukan pada ekstrak kasar, ekstrak yang telah
dipurifikasi, ekstrak yang telah dihidrolisis basa, dan asam dengan
menggunakan spektrofotometer UV-Vis pada panjang gelombang antara
200 – 700 nm. Data karakteristik dari panjang gelombang maksimum
(spektra) yang diperoleh kemudian dicocokkan dengan tabel data panjang
gelombang maksimum untuk beberapa antosianidin (Lampiran 11) dan
antosianin (Lampiran 12).
Analisis TLC didasarkan pada prosedur yang dilakukan oleh
Hrazdina (1970) dengan modifikasi yaitu penggantian plat selulose dengan
plat silika gel. Analisis ini dilakukan pada ekstrak pekat, ekstrak yang
sudah dipurifikasi, ekstrak yang sudah dihidrolisis basa. Lempeng TLC
yang digunakan pada penelitian ini terbuat dari silika gel, sedangkan
eluennya adalah BAW (n-butanol-asam asetat-air dengan perbandingan
4:1:5). Sebelum digunakan, eluen ini dijenuhkan selama 1 jam. Sampel
dispotkan pada lempeng TLC dengan jarak 1 cm dari bagian bawah
lampeng TLC dan jarak antara masing-masing spot adalah 1 cm. Spot
tersebut dibiarkan kering, kemudian dielusi dengan eluen BAW dalam
TLC chamber hingga jarak eluen 0.5 cm dari bagian atas lempeng TLC. Lempeng tersebut kemudian dibiarkan kering dan dihitung nilai Rf-nya.
Perhitungan nilai Rf adalah sebagai berikut:
IV. HASIL DAN PEMBAHASAN
A. KARAKTERISTIK KIMIA BUAH DUWET
1. Komposisi Kimia Buah Duwet
Komposisi kimia dari buah duwet yang meliputi analisis kadar air,
kadar abu, kadar lemak, kadar protein, dan karbohidrat. Penentuan
komposisi kimia dilakukan pada kulit dengan daging buah dan kulit buah.
Hal ini dilakukan karena pada penelitian ini bahan yang digunakan adalah
keduanya yaitu, kulit dengan daging buah dan kulit buah sehingga dapat
diketahui karakteristik kimia dari masing-masing sampel tersebut. Hasil
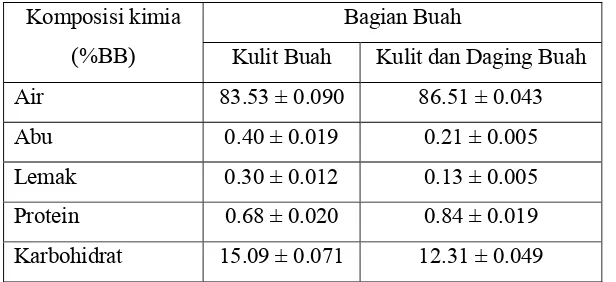
analisis komposisi kimia dapat dilihat pada Tabel 3.
Tabel 3. Komposisi kimia buah duwet Komposisi kimia
(%BB)
Bagian Buah
Kulit Buah Kulit dan Daging Buah
Air 83.53 ± 0.090 86.51 ± 0.043
Abu 0.40 ± 0.019 0.21 ± 0.005
Lemak 0.30 ± 0.012 0.13 ± 0.005
Protein 0.68 ± 0.020 0.84 ± 0.019
Karbohidrat 15.09 ± 0.071 12.31 ± 0.049
Karakteristik penting dari produk hortikultura khususnya
buah-buahan adalah kandungan air. Kadar air inilah yang memberikan tingkat
juiciness dan kesegaran (freshness) sebagai ciri khas dari buah. Air merupakan komponen penting dalam bahan pangan yang terdapat sebagai
komponen di dalam atau di luar sel dalam produk sayuran, buah-buahan
maupun hewan (Sakidja, 1989). Kadar air bagian kulit buah duwet adalah
83.53%, sedangkan kadar air bagian kulit dan daging buah duwet adalah
86.51%. Perbedaan ini disebabkan karena air yang terdapat pada daging
buah lebih banyak dibandingkan dengan air yang terdapat pada kulit buah.
Kadar air yang tinggi dapat memicu reaksi enzimatis maupun non
23 Abu adalah zat anorganik sisa hasil pembakaran suatu bahan
organik. Kandungan abu dan komposisinya tergantung pada macam bahan
dan cara pengabuannya (Sudarmadji et al., 1996). Kadar abu dipengaruhi oleh komponen mineral yang terdapat dalam bahan pangan. Menurut
Winarno (1997), unsur mineral dikenal sebagai bahan anorganik yang
tidak terbakar selama proses pembakaran sehingga terbentuk abu. Kadar
abu kulit buah duwet adalah 0.40% sedangkan kulit dan daging buah
sebesar 0.21%. Perbedaan ini menunjukkan bahwa senyawa anorganik
lebih banyak terdapat dalam kulit buah.
Lemak yang terdapat dalam buah-buahan adalah lemak nabati.
Kadar lemak pada kulit buah sebesar 0.30% sedangkan kadar lemak pada
kulit dan daging buah adalah 0.13%. Hal ini menunjukkan bahwa kadar
lemak di kulit buah lebih banyak. Kadar lemak ini disebabkan oleh adanya
lapisan lilin yang terdapat pada permukaan kulit sehingga kadar lemak
pada sampel kulit buah saja lebih banyak dibandingkan dengan kadar
lemak yang ada pada kulit dan daging buah. Kadar lemak yang tinggi
menyebabkan komponen nonpolar tinggi pula. Tingginya komponen
nonpolar akan mempengaruhi karakteristik dari pigmen antosianin
sehingga penentuan karakteristik dari antosianin ini menjadi lebih sulit.
Kadar protein yang diperoleh adalah kadar protein kasar karena
dihitung berdasarkan pada jumlah nitrogen yang terkandung dalam bahan
pangan (AOAC Official Method 920.152, 1995). Hasil penelitian
menunjukkan bahwa kadar protein pada kulit buah sebesar 0.68%,
sedangkan pada kulit dan daging buah sebesar 0.84%.
Komponen karbohidrat yang banyak pada bahan pangan adalah
pati, gula, pektin, dan selulosa. Penentuan kadar karbohidrat dalam
penelitian ini menggunakan cara perhitungan kasar atau juga disebut
carbohydrate by difference. Menurut Winarno (1997), perhitungan
carbohydrate by difference adalah penentuan karbohidrat dalam bahan pangan secara kasar dan hasilnya biasanya dicantumkan dalam daftar
komposisi bahan pangan. Hasil penelitian menunjukkan bahwa kandungan
buah. Kandungan karbohidrat pada kulit buah sebesar 15.09% sedangkan
pada kulit dan daging buah sebesar 12.31%.
Secara keseluruhan komposisi kimia kulit dengan daging buah dan
kulit buah tidak jauh berbeda bila dibandingkan dengan literatur. Menurut
Verheij dan Coronel (1997), kandungan tiap 100 gram bagian buah duwet
yang dapat dimakan adalah kadar air sebesar 84-86 %, kadar abu sebesar
0.4-0.7 %, kadar protein sebesar 0.2-0.7 %, kadar lemak sebesar 0.3 %,
dan karbohidrat sebesar 14-16 %. Komposisi kimia buah duwet bila
dibandingkan dengan buah yang sejenis seperti buah anggur yang
memiliki komposisi kimia sebagai berikut : kadar air 74.80 %, kadar abu
0.52 %, kadar protein 0.58 %, kadar lemak 0.32 %, dan karbohidrat 15.78
% memiliki karakterisitik yang hampir sama dengan buah duwet (Anonim,
2008d).
2. Kandungan Antosianin Buah Duwet
Pengukuran konsentrasi antosianin digunakan untuk mengetahui
kandungan total antosianin. Konsentrasi antosianin ini diukur dengan
menggunakan metode pH differential. Total antosianin ini dihitung dari selisih pengukuran absorbansi sampel pada panjang gelombang
maksimum yang dilarutkan masing-masing dalam dua macam larutan
buffer yang memiliki nilai pH yang berbeda. Pada pH 1, antosianin berada dalam bentuk kation flavilium yang menunjukkan jumlah antosianin dan
senyawa-senyawa pengganggu. Sedangkan pada pH 4.5, antosianin berada
dalam bentuk karbinol yang menunjukkan jumlah senyawa pengganggu.
Selisih dari kedua pengukuran akan menunjukkan jumlah antosianin
(Francis, 1982).
Analisis ini dilakukan dengan menggunakan spektrofotometer
UV-Vis pada dua panjang gelombang yaitu 516 dan 700 nm. Panjang
gelombang 516 nm merupakan panjang gelombang maksimum dari
antosianin buah duwet. Hasil ini diperoleh dengan melarutkan ekstrak
25 pada pH antara 4 – 5, antosianin kehilangan proton sehingga menghasilkan
struktur karbinol pseudobase.
Pengukuran konsentrasi antosianin dilakukan pada bagian kulit
buah duwet dengan berbagai tingkat kematangan karena pada umumnya
antosianin terdapat pada permukaan buah. Tingkat kematangan ini dapat
dilihat dari warna kulit buah duwet yang berubah dari hijau menjadi ungu.
Kulit buah berwarna hijau menunjukkan buah masih muda sedangkan kulit
buah berwarna ungu menunjukkan buah telah matang. Dalam penelitian
ini digunakan lima tingkat kematangan dari buah duwet, yaitu buah duwet
dengan kulit yang masih hijau penuh, buah duwet dengan kulit merah,
buah duwet dengan kulit merah agak ungu, buah duwet dengan kulit ungu
sedikit merah, dan buah duwet dengan kulit ungu kehitaman. Kandungan
antosianin kulit buah duwet pada berbagai tingkat kematangan dapat
dilihat pada Tabel 4.
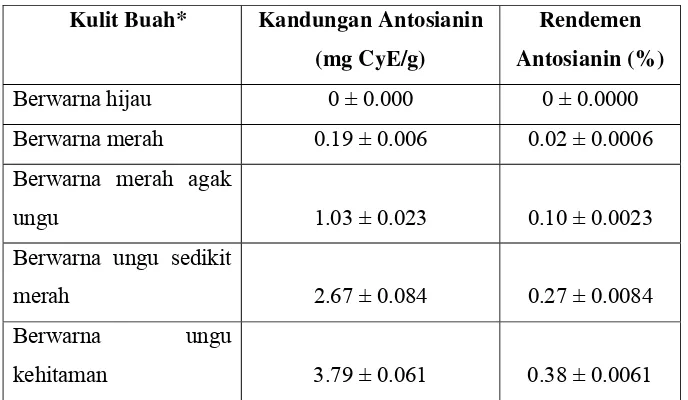
Tabel 4. Kandungan antosianin kulit buah duwet pada berbagai tingkat kematangan.
Kulit Buah* Kandungan Antosianin (mg CyE/g)
* Sampel dari atas kebawah menunjukkan perubahan tingkat kematangan dari muda ke matang.
Buah duwet dengan kulit hijau penuh tidak memiliki kandungan
pigmen antosianin. Menurut MacDougall (2002), karakteristik warna hijau
pada buah yang belum matang disebabkan oleh adanya pigmen klorofil
antosianin sehingga nilai konsentrasi antosianinnya 0. Ekstrak yang
didapat berwarna hijau, hal ini membuktikan bahwa tidak adanya
kandungan antosianin di dalam kulit yang berwarna hijau. Hasil ini juga
dapat dilihat dari Gambar 3.
0.0
350 400 450 500 550 600 650
Panjang gelombang (nm)
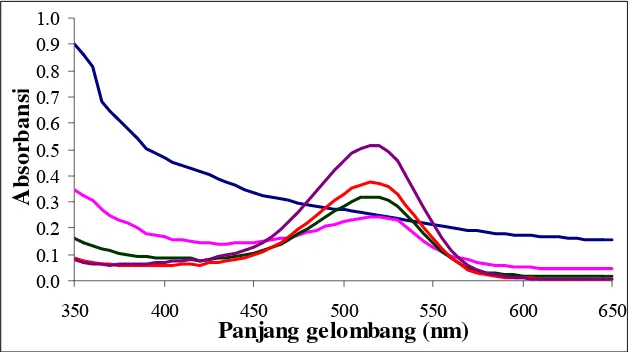
= kulit buah duwet berwarna hijau semua = kulit buah duwet berwarna merah
= kulit buah duwet berwarna merah agak keunguan = kulit buah duwet berwarna ungu sedikit merah = kulit buah duwet berwarna ungu kehitaman
Gambar 3. Pola spektra kulit buah duwet pada berbagai tingkat kematangan dalam pH 1
Hasil tersebut menunjukkan bahwa gambar spektrum pada kulit
buah duwet berwarna hijau berbeda dari gambar spektrum yang lain.
Gambar spektrum pada ekstrak kulit buah duwet yang berwarna hijau ini
tidak memiliki panjang gelombang maksimum didaerah antara 500 – 550
nm, sehingga dapat dikatakan bahwa pada sampel ini tidak memiliki
kandungan antosianin. Menurut Jackman dan Smith (1996), antosianin
mempunyai panjang gelombang maksimum pada daerah visibel yaitu 465
– 550 nm.
Kandungan antosianin pada kulit buah duwet sebanding dengan
tingkat kematangannya. Kandungan antosianin semakin meningkat dengan
27 kematangan ini dapat dilihat dari perubahan warna kulit buah duwet, yaitu
dari kulit yang berwarna hijau sampai kulit yang berwarna ungu
kehitaman. Kandungan antosianin pada berbagai tingkat kematangan buah
duwet berturut-turut adalah sebagai berikut, untuk kulit buah berwarna
merah adalah sebesar 0.19 mg CyE/g, kulit buah dengan warna merah
agak keunguan sebesar 1.04 mg CyE/g, kulit buah dengan warna ungu
sedikit merah sebesar 2.67 mg CyE/g, dan kulit buah dengan warna ungu
kehitaman sebesar 3.79 mg CyE/g. Hasil penelitian menunjukkan bahwa
kulit dengan tingkat kematangan paling tinggi yaitu dengan warna kulit
ungu kehitaman memiliki kandungan antosianin yang paling besar.
Perubahan tingkat kematangan ini juga sebanding dengan
rendemen antosianin. Buah yang semakin matang memiliki rendemen
antosianin semakin besar. Nilai rendemen antosianin pada berbagai tingkat
kematangan buah berturut-turut adalah untuk kulit buah berwarna hijau
adalah sebesar 0 %, kulit buah dengan warna merah adalah sebesar 0.02
%, kulit buah dengan warna merah agak keunguan sebesar 0.10 %, kulit
buah dengan warna ungu sedikit merah sebesar 0.27 %, dan kulit buah
dengan warna ungu kehitaman sebesar 0.38 %.
Selama proses pematangan buah banyak terjadi perubahan kimia,
termasuk perubahan komposisi pigmen dan perubahan warna yang
melibatkan proses biosintesis dan katabolisme. Selama proses pematangan
ini, kloroplas secara berangsur-angsur akan digantikan oleh kromoplas
yang hanya mengandung karotenoid. Proses pematangan pada berbagai
buah ini juga melibatkan biosintesis antosianin yang larut dalam air yang
terakumulasi dalam vakuola sentral dari sel mesofil. Proses sintesis dari
antosianin ini diawali oleh malonil-CoA yang berasal dari 3 asetil-CoA
dan p-koumaroil-CoA fenilalanin (MacDougall, 2002). Faktor-faktor yang
sangat penting yang mempengaruhi biosintesis dan akumulasi dari
antosianin selama proses pematangan antara lain adalah cahaya dan suhu
(Francis, 1982).
Pada penelitian ini juga dilakukan pengukuran konsentrasi
ungu kehitaman (tingkat kematangan paling tinggi). Hasilnya dapat dilihat
pada Tabel 5.
Tabel 5. Kandungan antosianin pada bagian buah duwet pada tingkat kematangan tertinggi.
Bagian Buah Kandungan Antosianin (mg CyE/g)
Rendemen Antosianin (%)
Kulit buah 3.79 ± 0.061 0.38± 0.0061
Kulit dan daging buah 1.24 ± 0.054 0.12 ± 0.0054
Hasil yang diperoleh menunjukkan adanya perbedaan kandungan
antosianin yang cukup besar antara kulit buah dan kulit dengan daging
buah. Kandungan antosianin pada bagian kulit buah sebesar 3.79 mg
CyE/g sedangkan pada bagian kulit dengan daging buah sebesar 1.24 mg
CyE/g. Menurut MacDougall (2002), antosianin ini terdapat pada sel
epidermal dan subepidermal, yang terlarut dalam vakuola atau
terakumulasi pada gelembung yang disebut antosianoplas. Umumnya
antosianin terdapat pada permukaan buah yaitu kulit buah. Rendemen
antosianin pada bagian kulit buah lebih besar bila dibandingkan dengan
bagian kulit dan daging buah.
Perbedaan ini juga dapat dilihat pada sampel setelah mengalami
proses penghancuran. Sampel kulit buah memiliki warna ungu yang lebih
tua bila dibandingkan dengan sampel kulit dengan daging buah yang
memiliki warna ungu muda. Hal ini dapat menunjukkan kandungan
antosianin yang terdapat dalam kulit buah lebih tinggi. Oleh karena itu,
pada analisis selanjutnya hanya digunakan kulit buah saja karena akan
menghasilkan pigmen yang lebih banyak sehingga lebih efektif.
Untuk membandingkan kandungan antosianin yang terdapat pada
buah duwet digunakan bahan lain yaitu kulit buah anggur dan kubis ungu.