Oleh:
Ir. Mahreni, MT, PhD
KIMIA ORGANIK
(KO)
Semt II
IKATAN KIMIA DAN STRUKTUR MOLEKUL
•KONFIGURASI ELEKTRON DAN STRUKTUR LEWIS
•RESONANSI
•RUMUS KIMIA DALAM KIMIA ORGANIK
•PEMUTUSAN IKATAN
•KEELEKTRONEGATIFAN
•MOLEKUL POLAR DAN NON POLAR
•IKATAN HIDROGEN
•IKATAN SIGMA DAN PHI
•ORBITAL HIBRIDA KARBON, NITROGEN DAN OKSIGEN
TATA NAMA
•TATA NAMA ALKANA, ALKENA, ALKOHOL, ETER, ALDEHID, KETON, ASAM KARBOKSILAT, ESTER, AMINA
•PRIORITAS TATA NAMA
Alkana
•Sumber-sumber alkana •Sifat fisika alkana
•Sifat kimia alkana •Pembakaran alkana •Halogenasi alkana •Pirolisia alkana
ALKIL HALIDA
•REAKSI SUBSTITUSI DAN ELIMINASI
•REAKSI SN-2 •REAKSI SN-1 •REAKSI E1 •REAKSI E2
ALKOHOL DAN ETER •SIFAT FISIS DAN KIMIA ALKOHOL
•REAKSI PEMBUATAN ALKOHOL
•REAKSI-REAKSI ALKOHOL
Alkena dan Alkuna
•Pembuatan Alkena dan Alkuna •Reaksi Adisi Hidrogen halida, halogen dan hidrogen terhadap alkena
Reaksi Oksidasi Alkena
ALDEHID , KETON, ASAM KARBOKSILAT DAN
TURUNANNYA
Pembuatan Aldehid, Keton, Asam Karboksilat dan
turunannya
Reaksi-reaksi Aldehid dan Keton, asam karboksilat dan ester
AROMATIK
STRUKTUR SENYAWA AROMATIK
Reaksi substitusi pertama REAKSI SUBSTITUSI KE
Polimer
•Penggolongan Polimer •Polimerisasi radikal bebas Polimerisasi ionik
KARBOHIDRAT, LEMAK DAN PROTEIN
STRUKTUR DAN SIFAT LEMAK STRUKTUR ASAM AMINO
KLASISIFIKASI PROTEIN IKATAN PEPTIDA
PROTEIN DAN DENATURASI PROTEIN
PENGGOLONGAN KARBOHIDRAT
SUMBER REFERENSI
– FESSENDEN, R.J. DAN J. S. FESSENDEN, 1986, ORGANIC
CHEMISTRY 3RD EDITION. WADSWORTH, INC., BELMONT,
CALIFORNIA. ALIH BAHASA : PUDJATMAKA, A.H. 1999,
KIMIA ORGANIK. PENERBIT ERLANGGA, JAKARTA, JILID 1 – FESSENDEN, R.J. DAN J. S. FESSENDEN, 1986, ORGANIC
CHEMISTRY 3RD EDITION. WADSWORTH, INC., BELMONT,
CALIFORNIA. ALIH BAHASA : PUDJATMAKA, A.H. 1999,
KIMIA ORGANIK. PENERBIT ERLANGGA, JAKARTA, JILID 2 – SOLOMONS, T.W.G., 1988, ORGANIC CHEMISTRY 3 RD
EDITION, JOHN WILEY & SONS, INC., NEW YORK
– HART, H., L.E. CRAINE DAN D.J. HART, 2003, ORGANIC
CHEMISTRY 11TH EDITION. WADSWORTH, INC., BELMONT,
CALIFORNIA. ALIH BAHASA : SUMINAR S.A., 2003, KIMIA ORGANIK, EDISI 11, PENERBIT ERLANGGA, JAKARTA
– BEYER, H. AND WALTER, W., 1996, “HANDBOOK OF
NILAI RENTANG
A >80
B+ 70-79,9
B 60 -69,9
C+ 50-59,9
C 40 – 49,9
D 30-39,9
E <30
TUGAS 20%
UJIAN TENGAH SEMESTER 30% UJIAN AKHIR SEMESTER 45%
KEHADIRAN 5%
Bobot untuk komponen-komponen penilaian Penilaian dilakukan dengan menggunakan
REVIEW
Kimia Organik ?
Unsur yang Lazim dalam Kimia
Organik?
Bagaimana ikatan antar unsur
yang membentuk senyawa ?
Teori kuantum
•Tiap kulit elektron suatu atom dibagi menjadi
orbital atom
• orbital atom adalah bagian dari ruang
dimana kebolehjadian ditemukannya elektron
dengan tingkat energi tertentu
y x z 2s y y y x x x z z z
2px 2py 2pz
n= 1
n= 2
Nomor kulit Jumlah orbital di setiap jenis Jmlh elektron jika kulit penuh
s p d
1 1 0 0 2
2 1 3 0 8
3 1 3 5 18
8
JUMLAH ORBITAL DAN ELEKTRON DALAM 3 KULIT PERTAMA
No. Atom Unsur Jumlah elektron disetiap orbital
1 s 2 s 2 p 3 s 3 p
1 H 1
2 He 2
3 Li 2 1
4 Be 2 2
5 B 2 2 1
6 C 2 2 2
7 N 2 2 3
8 O 2 2 4
9 F 2 2 5
10 Ne 2 2 6
11 Na 2 2 6 1
12 Mg 2 2 6 2
17 Cl 2 2 6 2 5
SUSUNAN ELEKTRON DALAM 17 UNSUR PERTAMA
PENGIKAT AN dari
SUDUT PANDANG
IKATAN KIMIA
•
Ikatan ion
dihasilkan dari perpindahan
elektron dari satu atom ke atom lain
•
Ikatan kovalen
dihasilkan oleh
penggunaan bersama sepasang
elektron oleh dua atom.
•
Ikatan Hidrogen
terjadi karena
adanya intaraksi dipol yang kuat antara
molekul yang mengandung atom
Contoh: pembentukan molekul NaCl dari atom Na dan Cl
Satu elektron dipindahkan dari Na ke Cl
Na
.
+
Cl
:
Na
+:
Cl
..
..
:
-
atau Na Cl
+-..
..
.
Sekarang tiap atom mempunyai oktet lengkap
dalam kulit terluar (kulit terluar Na+ tidak ditunjukkan)
Ikatan ion terbentuk oleh pemindahan elektron.
Satu atom memberikan elektron terluarnya ke atom lain.
Atom yang MEMBERI elektron menjadi ion POSITIF atau KATION.
Atom yang MENERIMA elektron menjadi ion NEGATIF atau ANION.
Ikatan Kovalen terbentuk oleh penggunaan
bersama sepasang elektron antara dua
atom.
Contoh pembentukan molekul H
2, Cl
2dan CH
4.
H. + H. H H:
.Cl.. :.. .
.. ..
:Cl + : :Cl Cl.. :.. .. .. H H H H.. .. C : :
C. .
. . + 4H.
sepasang elektron antara dua atom disebut ikatan tunggal. kqalau 2 pasang atau 3 pasang elektron; disebut ikatan rangkap
IKATAN KOVALEN MAJEMUK
Banyaknya ikatan kovalen yang dibentuk oleh
ebuah atom tergantung
banyaknya elektron
Golongan
I II III IV V VI VII
H 2,1 Li 1,0 Be 1,5 B 2,0 C 2,5 N 3,0 O 3,5 F 4,0 Na 0,9 Mg 1,2 Al 1,5 Si 1,8 P 2,1 S 2,5 Cl 3,0 Br 2,8 I 2,5
Elektronegatifitas beberapa atom
Jika kita lihat dr kiri ke kanan unsur lebih
elektronegatif sebab meningkatnya No atom atau muatan inti.
Jika melihat kebawah, unsur kurang
elektronegatif, sebab elektron valensi
terlindungi dr inti akibat meningkatnya jumlah elektron di kulit dalam.
Kemampuan atom untuk
menarik elektron luarnya (elektron valensi) disebut
Keelektronegatifan
Muatan formal
Dalam molekul netral jumlah muatan formal
saling meniadakan atau berjumlah nol.
Apabila muatan suatu struktur tidak nol,
maka truktur tersebut adalah ion. Jumlah
muatan formal menyatakan muatan ion.
Misalnya atom oksigen, muatan formalnya =
0, bila membentuk 2 ikatan kovalen. Bila
hanya membentuk 1 Ikatan kovalen maka
muatan formalnya -1 dan bila membentuk 3
buah ikatan kovalen maka muatan
RUMUS DALAM KIMIA
ORGANIK
Rumus struktur
menunjukkan
struktur dari molekul
Rumus Lewis
adalah rumus struktur,
Bila molekul mempunyai dua atau lebih
gugus atom yang identik, dapat
Contoh ikatan rangkap atau ganda
dalam rumus struktur termampatkan
Struktur tersingkat menggunakan garis
Soal Latihan 1.4.
Untuk setiap rumus ini, tuliskan rumus yang lebih dimampatkan
Soal latihan 1. 5
Tuliskan rumus struktur lengkap untuk senyawa berikut ini (tunjukkan semua ikatan dengan garis dan pasangan
elektron bebas jika ada).
Pemutusan (disosiasi) Ikatan
DISOSIASI
HETEROLITIK
HOMOLITIK
Sepasang ION
Radikal bebas
kedua elektron dipertahankan pada satu atom
tiap atom dalam ikatan kovalen menerima satu
Molekul Polar dan Non Polar
Ikatan kovalen nonpolar = Ikatan antar atom yang mempunyai keelektronegatifan sama/hampir sama, membentuk molekul, dan kedua atom mempunyai tarikan
yang sama/hampir sama terhadap elektron ikatan
Distribusi elektron ikatan polar dilambangkan dengan muatan parsial positif (δ+) dan negatif (δ-)
atau
dengan panah bersilang yang mengarah dari ujung parial positif ke ujung parsial negatif.
Soal Latihan 1.6
Gunakan panah bersilang dan muatan parsial untuk menunjukkan arah momen ikatan senyawa berikut:
MOMEN IKATAN dinyatakan dengan satuan
Debye (D) merupakan ukuran kepolaran
ikatan.
D = e (satuan elektrostatik) x d (jarak muatan, Ao).
Momen ikatan beberapa ikatan kovalen
MOMENT DIPOL
Momen dipol (µ) adalah jumlah vektor momen ikatan dalam molekul
Karena penjumlahan vektor bergantung pada besar
Gaya Tarik Antar Molekul
INTERAKSI DIPOL menyebabkan molekul saling tarik menarik antar muatan yang berlainan dan
tolak menolak antar muatan yang sama.
Molekul non polar saling ditarik oleh
interaksi dipol-dipol lemah (gaya London)
Gaya London timbul dari dipol yang
Interaksi berbagai dipol secara
kolektif disebut gaya Van der Waals
Besarnya gaya
Van der Ewaals
berbanding
lurus dengan jarak antar molekul
Gaya Vander Waals
mempengaruhi titik
TARIKAN ANTAR MOLEKUL
A. Antar aksi dipole-dipole
Molekul saling tarik menarik atau saling tolak menolak timbul oleh antar aksi dipole-dipole molekular. Misalnya dalam keadaan cair, molekul CH3I dapat saling tarik menarik atau
Ikatan Hidrogen
Jenis antar aksi dipole-dipole yang khusus kuat terjadi antara molekul yang mengandung atom hidrogen yang terikat pada atom nitrogen, oksigen atau fluor. Unsur O, N dan F mempunyai pasangan elektron bebas dan bersifat elektronegatif beberapa senyawa yang yang mengandung ikatan NH, OH dan HF adalah air (OH) amin (NH ) dan asam fluorida (HF). Dalam keadaan cair, molekul dari salah satu senyawa ini mempunyai tarikan yang kuat satu terhadap lainnya. Atom hidrogen yang partial positif dari satu molekul ditarik oleh pasangan elektron bebas molekul lainnya yang elektronegatif. Gaya tarik antar molekul ini disebut ikatan hidrogen.
Energi disosiasi ikatan hidrogen antara 5-10 kkal/mol lebih rendah dari energi disosiasi ikatan kovalen tetapi lebih besar dari tarikan dipole-dipole pada molekul non polar. Hal ini disebabkan oleh ukuran molekul hidrogen sangat kecil sehingga dapat menempati rangan yang sangat dekat dengan atom yang mempunyai elektronegatifitas dan elektron bebas molekul lain, hasilnya adalah tarikan yang kuat. Berbeda dengan molekul metili odine .
Kekuatan ikatan hidrogen tidak sama
Ikatan hidrogen dua
senyawa yang berbeda,
Pengaruh Ikatan Hidrogen
Titik DidihContoh: Etanol (CH3CH2OH) dan dimetil eter (CH3OCH3) mempunyai berat molekul yang sama namun titik didihnya berbeda
Kelarutan
Asam dan basa
Bronsted-Lowry
Asam adalah zat yang dapat memberikan ion hidrogen
contohnya HCl dan H2SO4, HNO3
Basa adalah zat yang dapat menerima ion hidrogen
misalnya OH dan NH3.
Asam kuat adalah asam yang dapat terionisasi sempurna di
dalam air (HCl, H2SO4)
Asam lemah adalah asam yang terdisosiasi sebagian dalam
Asam dan basa konyugasi
•
Basa konyugasi adalah ion atau molekul
yang dihasilkan setelah kehilangan ion H+
dari asamya. Ion Cl
-adalah basa konyugasi
dari HCl. Asam konyugasi dari NH
3adalah
NH
4+•
Bila asamnya asam kuat, basa konyugasi
adalah basa lemah.
•
Bila asamnya adalah asam lemah, maka
Asam dan basa Lewis
•
Konsep Lewis mendifinisikan bahwa
asam Lewis adalah suatu zat yang
dapat menerima pasangan elektron.
Setiap spesies yang dengan atom yang
kekurangan elektron dapat berfungsi
sebagai asam Lewis. Contohnya garam
anhidrid ZnCl2, FeCl3 dan AlBr3.
•
Basa Lewis adalah zat yang dapat
Soal Latihan 1.8.
Tunjukkan semua jenis ikatan hidrogen (bila ada) yang ditemukan dalam senyawa berikut:
a.CH3CH2CH2NH2 cair
b.larutan CH3OH dalam H2O
c. CH3CH2OCH2CH3 cair
ORBITAL DAN PERANANYA DALAM IKATAN KOVALEN
Sejak th 1923 Louis de Broglie, mengemukakan pendapat bahwa elektron mempunyai sifat partikel dan juga gelombang.
Masing-masing orbital atom dari atom bersifat seperti fungsi gelombang dan mempunyai amplitudo positif dan negatif. Dengan adanya amplitudo positif dan negatif, maka orbital mempunyai simpul terkecuali orbitas 1s tidak mempunyai simpul. Orbitan 1s berbentuk lingkaran mengelilingi inti atom seperti pada atom hidrogen. Orbital 2s dan 2p dapat dilihat pada gambar di bawah ini:
Bidang simpul
2p 2s
IKATAN DALAM HIDROGEN
1s 1s
Tumpangsuh Orbital molekul dengan 2 e dari spin berlawanan
ORBITAL IKATAN DAN ANTI IKATAN
Energi potensial, E
+
-+
+ +
Orbital anti ikatan (σ*)
Orbital ikatan (σ) interferensi
memperkuat Keluar fasa
Sefasa
Keboleh jadian menemukan elektron di antara dua inti atom sangat rendah sehingga inti atom tidak dilindungi oleh elektron dan saling tolak menolak, tolakan inti menyebabkan energi anti ikatan lebih tinggi dibandingkan energi atom hidrogen
ENERGI ATOM HIDROGEN, HIDROGEN DALAM ORBITAL IKATAN DAN ANTI IKATAN
Energi potensial, E
σ*
σ
1s 1s
Orbital anti ikatan
Orbital atom dari H dan H
Orbital ikatan
ORBITAL MOLEKUL
HIDROGEN
IKATAN DARI SUDUT PANDANG
ORBITAL
Orbital s berbentuk bola, sedangkan orbitas p bentuk
cuping dan saling tegak lurus mengarah ke sumbu X,Y
dan Z. Pengikatan dr sudut pandang orbital, atom
saling mendekat sehingga orbital atomnya dapat
bertumpang-tindih sampai membentuk suatu ikatan
Analog dengan orbital atom, orbital molekul juga hanya mengandung tidak lebih dari 2 elektron/orbital
Ada 2 cara orbital atom saling bertumpang tindih, yaitu :
a. Tumpang tindih ujung-ujung, menghasilkan orbital molekul sigma, ikatannya isebut ikatan sigma (σ).
+
+
p p Ikatan π p-p
b. Tumpang tindih sisi-sisi, menghasilkan orbital molekul pi (π), ikatannya disebut ikatan pi (π).
ikatan
Pembentukan ikatan sigma sp2-sp2 dan ikatan pi p-p
Ikatan pi (π)
mempunyai energi yang
lebih tinggi dari pada ikatan sigma, juga
agak kurang stabil dibanding ikatan
σsp
2-sp
2.
Ikatan
pi
merupakan
kedudukan kereaktifan
kimia.
ORBITAL HIBRIDA KARBON
Atom hidrogen menjadi bagian suatu molekul, menggunakan orbital atom 1s untuk ikatan. C dengan elektron valensi 4 sebagai elektron ikatan. Keempat orbital atom C tidak semuanya digunakan murni untuk membentuk ikatan, tetapi digunakan hibridasi seperti berikut:
2. Hibridisasi sp2: untuk membentuk ikatan rangkap
Hibridisasi sp
3
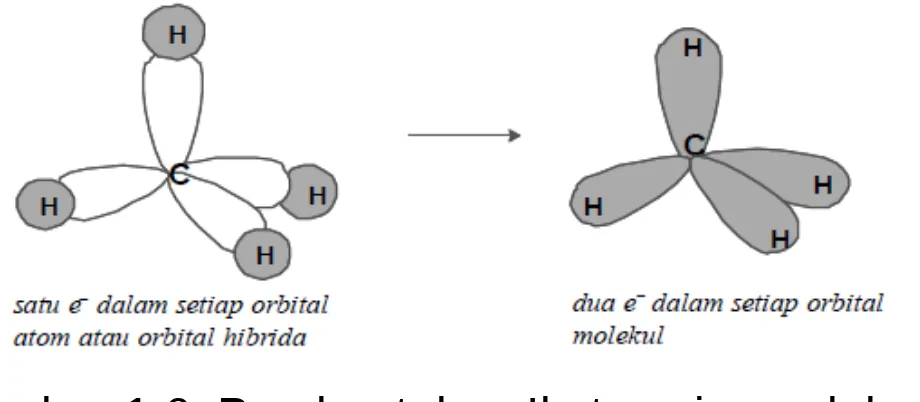
Hibridisasi lengkap keempat orbital atom molekul CH4 (1 orbital 2s dan 3 orbital 2p) menghasilkan 4 orbital sp3 yang ekivalen, dan panjang ikatan C- H maupun sudut ikatan H-C-H besarnya sama, sehingga keempat ikatan yang terbentuk ekivalen, maka bentuk molekul metana (CH4) adalah tetrahedral.
Gambar 1.5. orbital hibrida sp
3atom karbon
Gambar 1.5 menunjukan :Pencampuran orbital 2s
dan 2p membentuk orbital sp3, menghasilkan bentuk
bola bowling dengan simpul pada inti. Cuping besar digunakan untuk tumpang tindih(untuk ikatan), cuping
kecil tidak untuk ikatan. Empat orbital hibrida sp3
Gambar 1.6. Pembentukan Ikatan sigma dalam
molekul metana (CH4)
Orbital pembentuk ikatan yang terjadi di dalam molekul
metana (CH4) masing-masing orbital sp3 dari karbon
bertumpang tindih dengan orbital 1s dari hidrogen
Beberapa cara untuk
menggambarkan molekul metana
CH
4Rumus
struktur
Hibridisasi sp
2
Pembentukan orbital hibrida sp2 karbon yaitu
hibridisasi orbital 2s-nya hanya dengan dua orbital 2p-nya. Satu orbital 2p tidak terhibridasi
Tiga orbital sp2 terletak dalam satu bidang dengan
sudut 120o, satu orbital p yang tidak terhibridisasi
Karbon dalam keadaan hibridisasi sp2
Ikatan rangkap dinyatakan oleh dua garis identik, namun di dalam ikatan rangkap
C=C maupun C=O bukan identik yang sederhana, tetapi bahwa garis rangkap menggambarkan satu ikatan sigma dan
satu ikatan pi yang lemah
Adanya ikatan pi yang menunjukan kereaktifan kimia, membuat molekul ini
Contoh soal: Jenis tumpang tindih apa yang
terdapat dalam setiap ikatan CH3CH=CH2?
Soal latihan 1.9
Tulis rumus struktur lengkap untuk
masing-masing senyawa berikut.
Jenis orbital apa yang tumpang
tindih membentuk masing-masing
ikatan?
a.(CH
3)
3CH
b.CH
2=C(CH
3)
2Hibridisasi sp
Bila atom C dihubungkan hanya terhadap dua atom lainnya, seperti dalam asetilena ( H-C≡C-H), keadaan hibridisasinya adalah sp. Yaitu
Kedua orbital sp terletak jauh dalam garis lurus dengan sudut 180o
diantaranya. Orbital p saling tegak lurus dan tegak lurus terhadap garis orbital
sp.(lihat gambar)
C C
kedua orbital sp adalah linier kedua orbital p
sp sp
satu orbital sp
orbital sp yang kedua
90o
90o
orbital p saling tegak lurus
dan tegak lurus terhadap orbital p
ikatan sigma orbital p dua ikatan phi
Ikatan dalam molekul asetilena ( H-C≡C-H)
Beberapa contoh senyawa yang mengandung ikatan ganda tiga :
σ
π
Notes: Ikatan rangkap tiga mengandung dua ikatan π,
RINGKASAN HIBRIDISASI ATOM
KARBON
• Bila atom karbon terikat pada 4 atom lain, ikatan dari atom karbon terbentuk dari empat orbital sp3 yang equvalen. Karbon sp3 adalah tetrahedral. Empat ikatan C-H adalah sama iaitu ikatan sigma (simetris).
• Contoh CH4, CHCl3
• Bila atom karbon terikat pada tiga atom lain, ikatan dari atom karbon terbentuk dari tiga orbital sp2 yang equivalen dengan satu orbital p yang tinggal. Tiga orbital sp2 membentuk ikatan sigma dan satu orbital p membentuk ikatan pi. Karbon sp2 membentuk dimensi trigonal, contohnya C2H4.
GUGUS FUNGSI
Gugus fungsi: Ikatan karbon-karbon sp3-sp3 dan sp3-s adalah umum terdapat di dalam senyawa organik yang mengandung hidrogen tetapi ikatan antara orbital sp3-sp3 dan sp3-sp3-s tidak berperan di dalam reaktifitas molekul organik. Yang memegang peranan utama di dalam menentukan reaktivitas suatu molekul organik adalah ikatan pi atau atom lain yang disebut gugus fungsi. Misalkan kelektronegatifan dan keelektropositifan dalam molekul organik dapat membuat molekul tersebut reaktif dan disebut gugus fungsi.
CH3 CH CH2
CH
3CH
2 NH2CH
3CH
2OH
GUGUS FUNGSI
Senyawa yang mempunyai gugus fungsi yang sama cenderung mengalami reaksi kimia yang sama.
Jenis gugus fungsi dan nama
1. R-OH (alkohol), CH3OH (metanol)
2. R-Cl (kloro alkana)
3. R-NH2 (Amino alkana)
4. R-NO2 (Nitro alkana)
5. R-CHO (aldehid atau alkanal)
6. R-COOH (Karboksilat), RCOOH (asam alkanoat), HCOOH (asam metanoat)
7. R-CO-R (Keton), CH3-CO-C2H5 (Metil etil keton)
8. -CO- (gugus karbonil)
9. C6H5- (gugus fenil), C6H5OH (fenol)
10.C6H5CH2- (gugus benzil), C6H5CH2-Cl (Benzil
Orbital Hibrida Nitrogen
Nitrogen mempunyai 5 elektron pada kulitterluar. Orbital atom dari nitrogen
berhibridisasi dengan cara yang sangat bersamaan dengan karbon
Perbedaan antara nitrogen dan karbon adalah satu orbital sp3 dari nitrogen sudah terisi dengan sepasang elektron, sehingga
Contoh: Pada molekul Amonia (NH3) mengandung
atom nitrogen sp3 yang terikat pada 3 tom hidrogen
N
H H
H H CH
H
N
CH3 CH3
N
CH
3 3 3
orbital sp yang terisi
amonia amina
sp3-s sp3-sp3
Analog dengan atom karbon,
nitrogen juga dapat
berhibridisasi sp
2dan sp
.
Perbedaan penting antara nitrogen
dan karbon adalah
satu orbital
dari nitrogen terisi penuh
IKATAN NITROGEN DALAM AMONIA
Molekul amonia (NH3) mempunyai atom Nitrogen sp3 yang terikat pada atom hidrogen. Molekul amin
(misalkan metil amin = CH3NH2) sama atom
nitrogen sp3 terikat pada atom karbon . Di dalam kedua molekul nitrogen mempunyai ikatan orbital sp3 dengan sepasang elektron yang tak terbagi.
Berikan rumus struktur lengkap untuk setiap senyawa berikut ini dan ceritakan jenis orbital yang saling tumpangsuh dalam pembentukan setiap ikatan
Orbital Hibrida Oksigen
Atom Oksigen mempunyai 6 elektron valensi.
Oksigen berhibridisasi menngikuti cara yang sama
dengan karbon dan nitrogen. Hanya saja dua dari
empat orbital hibrida sp3 dari oksigen sudah terisi
Alkohol dan eter yang analog dengan air,
mengandung atom oksigen terhibridisasi sp3 dan
mempunyai 2 pasang elektron valensi menyendiri
IKATAN RANGKAP TERKONYUGASI
CH2
Atom karbon berdampingan(ikatan rangkap terkonjugasi)
CH CH CH2
Antara gugus fungsi saling mempengaruhi
CH2 CH CH2 CH CH2
atom karbon yang tak berdampingan (ikatan rangkap terisolasi)
CH
CH3 CH3 H3C
CH C CH3 CH CH CH C CH3 CH
CH2OH
Berapa banyak ikatan rangkap terkonyugasi ?
Soal 2.10
2.10
2.11 Gambarkan struktur suatu senyawa delapan
STRUKTUR RESONANSI
Struktur resonansi suatu mulekul atau
ion ialah dua atau lebih struktur
dengan susunan atom yang identik
tetapi berbeda susunan elektronnya.
Struktur Resonansi
Benzena adalah senyawa silkik dengan 6 atom karbon yang terhibridasi sp2 membentuk cincin planar.
Setiap C
mempunyai satu H, orbital
p tak terhibridasi yang tegak lurus bidang
A B C
ikatan σ
ikatan π
lingkaran menyatakan delokalisasi
sempurna 3 ikatan π dapat seperti A
atau B, ikatannya seolah bergantian antara ikatan
tunggal dan ikatan rangkap. Padahal ikatan antar C panjangnya sama
Ke 6 elektron π terdelokalisasi sempurna dalam awan muatan elektron berbentuk
Struktur Kekule (1972) disebut juga sebagai lambang resonansi atau
struktur resonansi benzena.
struktur resonansi benzena (rumus Kekule)
Struktur nyata benzena tidak bergeser antara 2 struktur yang berbeda tetapi
Benzena digambarkan dengan
segienam dan lingkaran di dalamnya yang menyatakan awan π aromatik.
Gugus nitro (-NO2) adalah salah satu contoh gugus yang mengandung struktur resonansi.
Penulisan struktur resonansi: inti-inti atom molekul tidak bertukar posisi hanya elektron saja yang bergeser
terdelokalisasi.
Pergeseran elektron dapat terjadi dengan cara sebagai berikut :
Dari suatu ikatan π ke sebuah atom
disebelahnya
Dari suatu ikatan π ke posisi ikatan
disebelahnya
Rangkuman
Sifat-sifat
fisika
senyawa ditentukan
oleh
struktur
molekul dan jenis
ikatan kimianya.
Untuk
dapat
menuliskan struktur
molekul
dapat
dimulai
dari
konfigurasi elektron
masing-masing atom
SOAL
1. Gambarkan struktur titik elektron (struktur Lewis) untuk CCl2F2.
2. Gunakakan panah bersilang untuk menunjukkan arah momen ikatan senyawa berikut untuk struktur H3C-OH.
3. Tuliskan rumus struktur lengkap untuk senyawa berikut ini
(tunjukkan semua ikatan dengan garis dan pasangan elektron bebas jika ada) untuk senyawa: H2C=O
4. Hitung muatan formal semua atom kecuali H dalam struktur berikut ini. a. amonia (NH3) b. CH3
COO-5. Untuk setiap rumus ini, tuliskan rumus yang lebih dimampatkan
6. Tunjukkan semua jenis ikatan hidrogen (bila ada) yang ditemukan dalam senyawa berikut.