ANALISIS KADAR BESI (Fe), TEMBAGA (Cu) DAN KALSIUM
(Ca) DALAM AIR GAMBUT SETELAH DIJERNIHKAN
DENGAN METODE ELEKTROKOAGULASI
TESIS
Oleh
JATI SETIASIH
087006014/KM
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
ANALISIS KADAR BESI (Fe), TEMBAGA (Cu) DAN KALSIUM
(Ca) DALAM AIR GAMBUT SETELAH DIJERNIHKAN
DENGAN METODE ELEKTROKOAGULASI
TESIS
Diajukan Sebagai Salah Satu Syarat untuk
Memperoleh Gelar Magister Sains dalam Program Studi Magister Kimia pada Fakultas Matematika dan Ilmu Pengetahuan Alam
Universitas Sumatera Utara
Oleh
JATI SETIASIH
087006014/KM
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
Judul Tesis : ANALISIS KADAR BESI (Fe), TEMBAGA (Cu), DAN KALSIUM (Ca) DALAM AIR GAMBUT SETELAH DIJERNIHKAN DENGAN
METODE ELEKTROKOAGULASI. Nama Mahasiswa : Jati Setiasih
NIM : 087006014 Program Studi : Ilmu Kimia
Menyetujui Komisi Pembimbing
(Prof. Dr. Zul Alfian, Msc) (Prof. Dr. Harry Agusnar, MSc, M.Phil) Ketua Anggota
Ketua Program Studi, Dekan,
(Prof. Basuki Wirjosentono, MS,Ph.D) (Prof. Dr. Eddy Marlianto, MSc)
Telah diuji pada
Tanggal : 24 Maret 2010
PANITIA PENGUJI TESIS
Ketua : Prof.Dr.Zul Alfian, MSc
Anggota : 1. Prof. Dr. Harry Agusnar, MSc, M.Phil 2. Prof. Basuki Wirjosentono, MS, Ph.D 3. Prof. Dr. Yunazar Manjang
PERNYATAAN
ANALISIS KADAR BESI (Fe), TEMBAGA (Cu) DAN KALSIUM (Ca) DALAM AIR GAMBUT SETELAH DIJERNIHKAN
DENGAN METODE ELEKTROKOAGULASI
TESIS
Dengan ini saya menyatakan bahwa dalam tesis ini tidak terdapat karya yang pernah diajukan Perguruan Tinggi dan sepanjang pengetahuan saya tidak terdapat karya atau pendapat yang pernah ditulis atau diterbitkan oleh orang lain kecuali disebutkan sumbernya dalam daftar pustaka.
Medan, Maret 2010 Penulis,
ABSTRAK
Air gambut yaitu air yang terdapat dan selalu menggenangi lahan gambut. Ciri-ciri air gambut intensitas warna yang tinggi (kuning atau merah kecoklatan), pH rendah antara 2-5, rasanya asam, kandungan zat organiknya tinggi serta rendahnya konsentrasi partikel dan kation.
Pada sebagian gambut kandungan Fe, Al, Na, S dan P mencapai kadar tinggi. Sedangkan kandungan unsur mikro dalam gambut adalah B, Sr, Zn, Cr, Ag, Au, Ca, Ba, Ti, V, Cu, Mn, I dan Co.
Metode elektrokoagulasi adalah salah satu cara untuk mengolah air gambut menajdi air bersih. Proses elektrokoagulasi ini dilakukan dengan cara memasukkan elektroda dari Lempeng Logam Aluminium dengan ukuran 5 x 8 cm dengan ketebalan 1 mm, Larutan Tawas 10 ml (1000 ppm), arus listrik 12 volt dan waktu elektrokoagulasi 45 menit ke dalam 1000 ml sampel air gambut.
Dalam penelitian ini yang dianalisis adalah kadar Besi (Fe), Tembaga (Cu), dan Kalsium (Ca) sebelum dan setelah dijernihkan. Analisis logam-logam tersebut menggunakan alat spektrofotometer Serapan Atom (SSA).
Hasil yang diperoleh bahwa kadar Besi (Fe), Tembaga (Cu) dan Kalsium (Ca) berturut-turut adalah 1,4030 mg/L, 0,2954 mg/L dan 3,7361 mg/L sedangkan kadar Besi (Fe), Tembaga (Cu) dan Kalsium (Ca) setelah dijernihkan berturut-turut adalah 0,3411 mg/L, 0,0156 mg/L dan 2,0560 mg/L. Hal ini menunjukkan bahwa metode elektrokoagulasi dengna penambahan tawas 10 ml (1000 ppm) telah menurunkan kadar Fe sebesar 75,69 %, kadar Tembaga (Cu) sebesar 94,75 % dan kadar Kalsium sebesar 44,97 %.
Kata Kunci : Air Gambut, Metode Elektrokoagulasi, Logam Fe, Cu, dan C
ABSTRACT
Peat moss water is water found and covers the peat moss area. The characteristics of peat moss water is a higher color intensity (yellow or brownish red). The lower of pH in the range of 2-5, sour, the higher organic ontent and the lower concentration of particle and cation. The content of Fe, Al, Na, S and P is higher. While the content of micro element in peat moss are B, S, Zn, C, Ag, Au, Ca, Ba, Ti, V, Cu, Mn, I and Co. Electrocoagulation method is process method of peat moss water to be the pure water. The electro coagulation process is conducted by put the electrode from the alluminium plate in the size of 5 x 8 cm and thickness 1 mm, alum 100 ml (1000 ppm), electric current 12 volt and electrocoagulation time is 45 minutes into 1000 ml sampel of peat moss.
This research will analyse the content of iron (Fe), cuprum (Cu), and calsium (Ca) in which before and after purification. The analysis of the elements using the atom absorption spectrophotometric.
The results is the content of the content iron (Fe), curprum (Cu), and calsium (Ca) are 1,4030 mg/L, 0,2954 mg/L and 3,7361 mg/L, respectively. The weight of iron (Fe), cuprum (Cu) nd calsium (Ca) after was cleaned the arragered were 0,3411 mg/L, 0,0156 mg/L and 2,0560 mg/L. This indicates that electrocoagulation method by alum 10 ml (1000 ppm) minimize the content of Fe for 75,69%, Cuprum (Cu) content for 94,72% and Calcium content is 44,97 %.
Keywords : Peat moss water, Electrocoagulation method, Metal Fe, Cu and Ca.
KATA PENGANTAR
Puji dan syukur penulis panjatkan kehadirat Allah SWT atas berkat dan rahmat-Nya sehingga penulis dapat menyelesaikan penulisan tesis yang berjudul “ ANALISIS KADAR BESI (Fe), TEMBAGA (Cu) DAN KALSIUM (Ca) DALAM AIR GAMBUT SETELAH DIJERNIHKAN DENGAN METODE ELEKTROKOAGULASI ”.
Pada kesempatan ini penulis mengucapkan terima kasih kepada Gubernur Sumatera Utara c.q Ketua Bappeda Propinsi Sumatera Utara yang telah memberikan beasiswa kepada penulis sebagai mahasiswa Sekolah Pascasarjana Universitas Sumatera Utara. Dengan selesainya penulisan tesis ini penulis mengucapkan teirma kasih yang sebesar-besarnya kepada :
Rektor Universitas Sumatera Utara Prof. Dr. Chairuddin P. Lubis, DTM & H, SpA (K) atas kesempatan dan fasilitas yang diberikan kepada penulis untuk mengikuti pendidikan. Direktur Sekolah PascaSarjana ibu Prof. Dr. Ir. Chairunnisa B., MSc, Dekan F-MIPA USU Prof. Dr. Eddy Marlianto,MSc dan Ketua Program Studi Kimia Prof. Basuki Wirjosentono, MS, Ph.D atas kesempatan yang diberikan untuk menjadi mahasiswa Program Magister pada sekolah pascasarjana Universitas Sumatera Utara.
Terima kasih dan penghargaan yang setinggi-tingginya kepada : Prof. Dr. Zul Alfian, MSc., selaku Pembimbing Utama dan Prof. Dr. Harry Agusnar, MSc., M.Phil selaku anggota Komisi Pembimbing yang setiap saat penuh perhatian, selalu memberikan bimbingan, saran dan perbaikan dalam penyusunan tesis ini.
Serta tidak lupa penulis ucapkan terima kasih yang sebesar-besarnya keapda : 1. Bapak Prof. Basuki Wirjosentono, Ms, Ph.D., Bapak Prof. Pina Barus, Ibu Dr.
Rumondang Bulan selaku penguji yang telah banyak memberikan masukan dan saran untuk menyelesaikan tesis ini, untuk itu penulis ucapkan terima kasih. 2. Kepala Laboratorium Kimia Analitik FMIPA Universitas Sumatera Utara beserta
staf dan asisten atas fasilitas dan sarana yang telah diberikan.
3. Bapak/Ibu Dosen PascaSarjana Ilmu Kimia terkhusus Bapak Dr. Hamonangan Nainggolan, yang telah membimbing dan memotivasi saya sampai selesainya tesis ini. Kepada Bapak saya ucapkan terima kasih.
4. Kepala MAN 2 MODEL MEDAN Bapak H. Ali Masran Daulay SPd, MA yang telah memberikan kesempatan kepada penulis untuk mengikuti Program Pendidikan Pascasarjana di Universitas Sumatera Utara.
5. Orang tua saya yang saya sayangi Bapak H. Katimin Dwi Jomartoyo dan Ibunda Hj. Sutiyah serta buat semua adik-adik tercinta Menik Sularsih,SPd, Ir. Trigus Taman dan Ratna Susanti, SKM, serta yang saya sayangi keluarga Bapak mertua, Almarhum Bapak Sirun beserta Ibu Masinah Br. Ginting serta adik Dessy Ratnasari (Juliati) yang telah memberikan perhatian, kasih sayang, dan motivasi baik dalam do’a, tenaga dan materil dalam menyelesaikan penelitian dan tesis ini. 6. Sahabat saya terkasih Suyati, SPd, MPKim beserta suami Bapak Syamsul Komar, SPd, Msi, yang telah banyak memberikan dorongan moril da bantuan yang tak ternilai harganya, saya ucapkan terima kasih.
7. Rekan-rekan mahasiswa Program Studi Kimia Sekolah PascaSarjana Universitas Sumatera Utara angkatan 2008 yang telah banyak membantu penulis.
Akhirnya terima kasih kepada suami terkasih Subowo dan anak-anakku tersayang Baskoro Pakusadewo, Wira Ardi Kesuma Adji, dan Embun Faradiba yang dengan kesabaran dan perhatiannya serta dukungan do’a dan dorongan semangatnya sehingga penulis dapat menyelesaikan pendidikan. Semoga segala bantuan dan perhatian yang telah diberikan kepada penulis menjadi amal kebaikan. Penulis berharap penelitian ini bermanfaat bagi yang memerlukan dimasa yang akan datang.
Medan, Maret 2010 Penulis
RIWAYAT HIDUP
JATI SETIASIH
Lahir di Purbalingga, 30 Januari 1967 dari pasangan H. Katimin Dwijomartoyo dan Hj. Sutiyah anak pertama dari empat bersaudara.
Pendidikan Sekolah Dasar (SD) Negeri TIDU I, Kec. Bukateja, Kab. Purbalingga Provinsi Jawa Tengah. Lulus tahun 1980, Sekolah Menengah Pertama (SMP) Negeri I Bukateja, Kab. Purbalingga, Provinsi Jawa Tengah Lulus tahun 1983, Sekolah Menengah Atas (SMA) Negeri I Purbalingga, Provinsi Jawa Tengah lulus tahun 1986, melanjutkan pendidikan ke Institut Keguruan Ilmu Pendidikan (IKIP) Negeri Semarang, Provinsi Jawa Tengah, lulus dengan mendapat gelar Sarjana S-1 (Dra). Tahun 1991 mengajar di SMA Swasta UISU Medan tahun 1994-1996, di SMA Swasta Al-Azhar Medan tahun 1994-1996, di MAN Panyabungan Mandailing Natal tahun 1997-2000 dan di MAN 2 MODEL MEDAN dari tahun 2000 hingga sekarang. Mengikuti Program Magister Ilmu Kimia Universitas Sumatera Utara tahun 2008 dengan Beasiswa dari Bappeda Provinsi Sumatera Utara lulus tahun 2010.
DAFTAR ISI
Halaman
ABSTRAK ... i
ABSTRACT ... ii
KATA PENGANTAR ...iii
RIWAYAT HIDUP ... iv
DAFTAR ISI... vi
DAFTAR TABEL... ix
DAFTAR GAMBAR ... xi
DAFTAR LAMPIRAN...xiii
BAB 1 PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan ... 6
1.2.1 Identifikasi Masalah... 6
1.2.2 Rumusan Masalah ... 7
1.2.3 Pembatasan Masalah ... 7
1.3 Tujuan Penelitian... ... 7
1.4 Manfaat Penelitian ... 8
1.5 Metodologi Penelitian... ... 8
BAB 2 TINJAUAN PUSTAKA ... 10
2.2. Air Gambut ... 11
2.3. Pengelolaan Air Gambut ... 19
2.4. Elektro Koagulasi ... 20
2.4.1 Koagulasi ... 26
2.4.2 Flokulasi ... 26
2.4.3 Keuntungan dari Elektrokoagulasi ... 27
2.5. Zat Besi (Fe) ...28
2.5.1 Sifat-sifat Logam Besi ... 28
2.5.2 Logam Besi dalam Kehidupan Manusia... 28
2.5.3 Logam Besi dalam Air... 29
2.6. Logam Berat Tembaga (Cu) ... 30
2.7. Logam Kalsium ... 31
2.8. Spektro Fotometer Serapan Atom (SSA) ... 32
2.8.1 Prinsip Dasar Spektofotometer Serapan Atom ... 32
2.8.2 Cara Kerja Spektrofoto Serapan Atom ... 33
BAB 3 METODOLOGI PENELITIAN ...35
3.1 Lokasi Penelitian ... 35
3.2 Populasi dan Sampel... 35
3.3 Bahan – bahan dan ALat ... 36
3.4 Prosedur Penelitia... 37
3.4.1 Preparasi Pelitian ... 37
3.4.3 Preparasi Larutan Tawas 1000 ppm... 38
3.4.4 Pembuatan Kurvakalibrasi Besi (Fe) SNI.06.6989.6-200439 3.4.4.1 Pengukuran Logam Besi (Fe)SNI.06.6989.6-2004... 39
3.4.5 Pembuatan Kurva Kalibrasi Tembaga (Cu) SNI.06.6989.6 -2004... 40
3.4.5.1 Pengukuran Logam Tembaga (Cu) dengan SSa ... 41
3.4.6 Pembuatan Kurva Kalibrasi Kalsium (Ca) SNI.06.6989.56. 2005 ... 42
3.5 Bagan Pembuatan Kurva Kalibrasi Besi (Fe) ... 45
3.6 Bagan Pembuatan Kurva Kalibrasi Tembaga (Cu)... 46
3.7 Bagan Pembuatan Kurva Kalibrasi Kalsium (Ca) ... 47
3.8 Bagan Penelitian ... 48
BAB 4 HASIL DAN PEMBAHASAN ... 50
4.1 Hasil Penelitian ... 50
4.1.1 Pengukuran Logam Besi (Fe)... 50
4.1.1.1 Penentuan Kurva Kalibrasi dengan Analisis Regresi Besi (Fe) ... 50
4.1.1.2 Penurunan Persamaan Garis Regresi Kadar Analit Besi (Fe) dengan Metode Kurva Kalibrasi ... 52
4.1.1.3 Penurunan Persamaan Regresi Besi (Fe) ... 53
4.1.1.4 Penentuan Kadar Analit Besi (Fe)... 54
4.1.2 Pengukuran Logam Tembaga (Cu) ... 56
4.1.2.2 Penurunan Persamaan Garis Regresi dan Kadar Analit
Tembaga (Cu) dengan Metode Kurva Kalibrasi.. 58
4.1.2.3 Penurunan Persamaan Regresi TEmbaga (Cu).... 59
4.1.2.4 Penentuan Kadar Analit Tembaga (Cu)... 60
4.1.3 Pengukuran Logam Kalsium (Ca)……… ……62
4.1.3.1 Penentuan Kurva Kalibrasi dengan Analisis Regresi Kalsium (Ca) ...62
4.1.3.2 Penurunan Persamaan Garis Regresi dan Kadar Analit Kalsium (Ca) dengan Metode Kurva Kalibrasi... 64
4.1.3.3 Penurunan Persamaan Regresi Kalsium (Cu) ... 65
4.1.3.4 Penentuan Kadar Analit Kalsium (Ca) ... 66
4.2 Pembahasan... 68
4.2.1 Perlakuan Sampel Air Gambut ... 68
4.2.2 Penurunan Kadar Logam Besi (Fe) ... 72
4.2.3 Penurunan Kadar Logam Tembaga (Cu)... 75
4.2.4 Penurunan Kadar Logam Kalsium (Ca) ... 77
BAB 5 KESIMPULAN DAN SARAN ...79
5.1. Kesimpulan ... 79
5.2. Saran ... ... 81
DAFTAR TABEL
Nomor Judul Halaman
1.1 Kandungan Unsur Mikro Tanah Gambut Sumatera Utara... 2
1.2 Kualitas air di perairan lahan gamut bekas terbakar di sekitar Taman Nasioanl Berbak, jambi (Suryadipura , 1998. Tidak dipublikasikan ... 2
1.3 Kualitas air tanah pada sistem drainase dangkal dibanding dengan sistem sawah di daerah Kalimantan Selatan ... 3
3.1 Kondisi Parameter Spektroskopi Serapan Atom(SSA) Untuk Unsur (Fe) dengan Shimadzu AA 6-300 ... 40
3.2 Kondisi Parameter Spektroskopi Serapan Atom(SSA) Untuk Unsur (Cu) Tembaga dengan Shimadzu AA 6-3000C... 41
3.3 Kondisi Parameter Spektroskopi Serapan Atom(SSA) Untuk Unsur (Ca) dengan Shimadzu AA 6-300 ... 43
4.1 Data Hasil Pengukuran Absorbansi Larutan Standar Besi (Fe) dengan Spektroskopi Serapan Atom (SSA) ... 50
4.2 Data Hasil Penurunan Persamaan Garis Regresi Untuk Besi (Fe)... 52
4.3 Data Hasil Pengukuran Absorbansi Larutan Standar Besi (Cu) ... 56
4.4 Data Hasil Penurunan Persamaan Garis Regresi Untuk Tembaga (Cu) ... 58
4.5 Data Hasil Pengukuran Absorbansi Larutan Standar Kalsium (Ca) ... 62
4.6 Data Hasil Penurunan Persamaan Garis Regresi Untuk Kalsium (Ca)... 64
4.7 Pengaruh Elektrokoagulasi Terhadap Pengelolaan Air Gambut... 68 4.8 Elektrokoagulasi Sampel Air Gambut dengan Penambahan Larutan Tawas69
viii
x
DAFTAR GAMBAR
Nomor Judul Halaman
2.1Model Sturuktur Aam Humat Berdasrakan Stevenson (1982) R Dapat
Berupa Alkil, Aril, Atau Arakil... 15
2.2Model Aturuktur Asam Fulvat Berdasarkan Buffle et al. (1997) ... 16
2.3Pronsip dari Proses Elektrokoagulasi (Ni’am, 2001)... 21
2.4Mekanisme dalam Elektrokoagulasi ... 22
2.5Skematis Ringkasan Spektrofotometer Serapan Atom ... 33
3.1Susunana Alat Elektrokoagulasi ... 38
3.2Flow Shett Pembuatan Kurva Kalibrasi Besi (Fe) ... 45
3.3Flow Shett Pembuatan Kurva Kalibrasi Tembaga (Cu)... 46
3.4Flow Shett Pembuatan Kurva Kalibrasi Kalsium (Ca) ... 47
3.5Flao Shett Elektrokoagulasi Sampel Air Gambut ... 48
3.6Flow Shatt Elektrokoagulasi Sampel Air Gambut dengan Penambahan Tawas 10 ml (1000 ppm) ... 49
3.7Kurva Kalibrasi Larutan Standar Besi (Fe)... 51
3.8Kurva Kalibrasi Larutan Standar Tembaga (Cu) ... 57
3.9Kurva Kalibrasi Larutan Standar Kalsium (Ca)... 63
4.1Grafik Kenaikan pH Sampel Air Gambut ... 70
4.2Grafik Penurunan Warna Sampel Air Gambut ... 71
4.4Grafik Pengaruh Perlakuan Sampel Terhadap Kadar Logam Tembaga (Cu) dalam Air Gambut ... 75
DAFTAR LAMPIRAN
Nomor Judul Halaman
1. KEPUTUSAN MENTERI KESEHATAN RI 416/MENKES/PER/IX/ 1990... 85 2. Data Hasil Pengukuran Absorobasi Logam Fe Dalam Air Sampel Gambut
Sebelum Dielektrokoagulasi ... 87 3. Data Hasil Pengukuran Absorobasi Logam Fe Dalam Sampel Air Gambut
Sesudah Dielektrokoagulasi ... 88 4. Data Hasil Pengkuta Absorobasi Logam Fe Dalam Sampel Air Gambut
Sesudah Dielektrokoagulasi Denga Penambahan Tawas... 89 5. Data Absorbansi Rata- RataDan Hasil Perhitungan Konsentrasi Logam Fe
Dalam Sampel Air Gambut... 90 6. Data Hasil Pengukuran Absorobasi Logam Cu dalam Sampel Air Gambut
Sebelum Dielektrokoagulasi ... 91 7. Data Hasil Pengukuran Absorobasi Logam Cu dalam Sampel Air Gambut
Sesudah Dielektrokoagulasi... 92 8. Data Hasil Pengukuran Absorobasi Logam Cu dalam Sampel Air Gambut
Sesudah Dielektrokoagulasi dengan penambahan Tawas... 92 9. Data Absorbansi Rata- Rata Dan Hasil Perhitungan Kadar Logam Cu dalam
Sampel Air Gambut ... 93 10. Data Hasil Pengukuran Logam Ca Dalam Sampel Air Gambut Sebelum Dielektrokoagulasi ... 94 11. Data Hasil Pengukuran Absorobasi Logam Ca dalam Sampel Air Gambut
12. Data Hasil Pengukuran Absorobasi Logam Ca dalm Sampel Air Gambut Sesudah Dielektrokoagulasi Denga Penambahan Tawas ... 96
ABSTRAK
Air gambut yaitu air yang terdapat dan selalu menggenangi lahan gambut. Ciri-ciri air gambut intensitas warna yang tinggi (kuning atau merah kecoklatan), pH rendah antara 2-5, rasanya asam, kandungan zat organiknya tinggi serta rendahnya konsentrasi partikel dan kation.
Pada sebagian gambut kandungan Fe, Al, Na, S dan P mencapai kadar tinggi. Sedangkan kandungan unsur mikro dalam gambut adalah B, Sr, Zn, Cr, Ag, Au, Ca, Ba, Ti, V, Cu, Mn, I dan Co.
Metode elektrokoagulasi adalah salah satu cara untuk mengolah air gambut menajdi air bersih. Proses elektrokoagulasi ini dilakukan dengan cara memasukkan elektroda dari Lempeng Logam Aluminium dengan ukuran 5 x 8 cm dengan ketebalan 1 mm, Larutan Tawas 10 ml (1000 ppm), arus listrik 12 volt dan waktu elektrokoagulasi 45 menit ke dalam 1000 ml sampel air gambut.
Dalam penelitian ini yang dianalisis adalah kadar Besi (Fe), Tembaga (Cu), dan Kalsium (Ca) sebelum dan setelah dijernihkan. Analisis logam-logam tersebut menggunakan alat spektrofotometer Serapan Atom (SSA).
Hasil yang diperoleh bahwa kadar Besi (Fe), Tembaga (Cu) dan Kalsium (Ca) berturut-turut adalah 1,4030 mg/L, 0,2954 mg/L dan 3,7361 mg/L sedangkan kadar Besi (Fe), Tembaga (Cu) dan Kalsium (Ca) setelah dijernihkan berturut-turut adalah 0,3411 mg/L, 0,0156 mg/L dan 2,0560 mg/L. Hal ini menunjukkan bahwa metode elektrokoagulasi dengna penambahan tawas 10 ml (1000 ppm) telah menurunkan kadar Fe sebesar 75,69 %, kadar Tembaga (Cu) sebesar 94,75 % dan kadar Kalsium sebesar 44,97 %.
Kata Kunci : Air Gambut, Metode Elektrokoagulasi, Logam Fe, Cu, dan C
ABSTRACT
Peat moss water is water found and covers the peat moss area. The characteristics of peat moss water is a higher color intensity (yellow or brownish red). The lower of pH in the range of 2-5, sour, the higher organic ontent and the lower concentration of particle and cation. The content of Fe, Al, Na, S and P is higher. While the content of micro element in peat moss are B, S, Zn, C, Ag, Au, Ca, Ba, Ti, V, Cu, Mn, I and Co. Electrocoagulation method is process method of peat moss water to be the pure water. The electro coagulation process is conducted by put the electrode from the alluminium plate in the size of 5 x 8 cm and thickness 1 mm, alum 100 ml (1000 ppm), electric current 12 volt and electrocoagulation time is 45 minutes into 1000 ml sampel of peat moss.
This research will analyse the content of iron (Fe), cuprum (Cu), and calsium (Ca) in which before and after purification. The analysis of the elements using the atom absorption spectrophotometric.
The results is the content of the content iron (Fe), curprum (Cu), and calsium (Ca) are 1,4030 mg/L, 0,2954 mg/L and 3,7361 mg/L, respectively. The weight of iron (Fe), cuprum (Cu) nd calsium (Ca) after was cleaned the arragered were 0,3411 mg/L, 0,0156 mg/L and 2,0560 mg/L. This indicates that electrocoagulation method by alum 10 ml (1000 ppm) minimize the content of Fe for 75,69%, Cuprum (Cu) content for 94,72% and Calcium content is 44,97 %.
Keywords : Peat moss water, Electrocoagulation method, Metal Fe, Cu and Ca.
BAB 1 PENDAHULUAN
1.1. Latar Belakang
Luas lahan gambut di Indunesia merupakan 87% dari seluruh luas gambut di Asia Tenggara atau 52,4% dari seluruh lahan gambut di daerah tropik. Lahan gambut di Indonesia tersebar di Sumatera (41,1%), Kalimantan (33,8 %), Irian Jaya (23,0 %), Sulawesi (1,6 %) serta Halmahera dan Seram (0,5 %). Di Kalimantan, lahan gambut terdapat di wilayah pantai Propinsi Kalimantan Barat, Kalimantan Tengah dan Kalimantan Selatan serta sebagian kecil Pantai Kalimantan Timur (Komarudin, 19998).
Gambut terbentuk di alam dalam berbagai kondisi biologi, kimia, fisika dan geologi yang mempengaruhi sifat-sifat fisika-kimianya. Kimiawi gambut terjadi akibat dari kombinasi komposisi kimia tumbuhan mire dan mikroorganisme, kualitas air tanah dan substansi-substansi sekunder yang dihasilkan selama proses dekomposisi.
Tabel 1.1 Kandungan Unsur MikroTanah Gambut Sumatera Utara Unsur-unsur Kandungan unsur (kg/ha)
pada kedalaman 0-25 cm
Kandungan unsur (kg/ha) pada kedalaman 80-100 cm
Co 0,1-0,2 0,05-0,1
Cu 0,8-8 0,2-0,8
Fe 143-175 67-122
Mn 4,1-25 1,1-1,7
Mo 0,6-1 0,3-0,6
Zn 2,8-4,4 1,8-4,8
Sumber: Wahyunto, dkk, 2004
Tabel 1.2. Kualitas air di perairan lahan gamut bekas terbakar di sekitar Taman Nasioanl Berbak, jambi (Suryadipura , 1998. Tidak dipublikasikan)
Kualitas air di perairan lahan gamut bekas terbakar
Parameter Satuan
Simpang Datuk Rawa gamut tergenang (5 titik pengamatan Air Hitam Dalam Rawa gamut tergenang (6 titik pengamatan) Sungai Palas Rawa gamut tergenang (6 titik pengamatan) Sungai Rambut Perairan gamut mengalir (2 titik pengamatan) Fisika 1.padatan tersuspensi
Mg/1 6-6 2-10 2-8 34-38
2. konduktivitas umhos/ cm 1300-1800 140-323 700-1050 500-900
Kimia
1. pH* * 3,28-3,40 4,20-5,20 3,30-3,51 3,35-3,49
2. Alkalinitas Mg/1CaCO3 ttd ttd ttd ttd
3. Asiditas Mg/1 280-760 44-64 120-220 160
4. Total Fe Mg/1 3,22-5,32 1,31-5,49 1,71-4,65 4,56-6,43
5. Kalsium (Ca) Mg/1 0,05-0,24 0,05-0,55 0,26-3,77 0,05-0,31
6. COD Mg/1 7,5-20,0 8-86 7,5-20,0 45-74
7. Sulfat (SO4) Mg/1 682-695 38-385 137-477 136-333
8. Kesadahan Total Mg/1CaCO3 280-320 20-70 140-240 100-140
9. Oxygen terlarut Mg/1 O2 3,7-5,6 2,8-5,7 1,5-5,3 3,2-4,2
*) tingginya nilai konduktivitas dan rendahnya pH diduga berasal dari
Tabel 1.3. Kualitas air tanah pada sistem drainase dangkal dibanding dengan sistem sawah di daerah Kalimantan Selatan
Sifat air tanah Musim kemarau
drainase dangkal Sawah
Musim hujan
Drainase dangkal Sawah
- pH 5,0 3,9 4,3 3,6
- SO42- (me/kg) 2.0 2,7 3,1 5,1
- Fe2+ (me/kg) 0,66 0,55 0,82 1,1
- Al3+ (me/Kg) 0,71 1,1 0,90 1,2
- Mg2+ (me/Kg) 0,39 0,58 0,90 1,2
Sumber : Balittra,1998
Air gambut, yaitu air yang terdapat dan selalu menggenangi lahan gambut. Air gambut yang terdapat di Indonesia secara kuantitatif sangat potensial untuk dikelola sebagai sumber daya air yang dapat diolah menjadi air bersih atau air minum, namun kenyataannya secara kualitas, air gambut dalam penggunaannya masih banyak mengalami kendala.
Salah satu kendala penggunaannya sebagai air bersih adalah : 1. Intensitas warna yang tinggi (berwarna coklat kemerahan) 2. pH yang rendah
3. Kandungan zat organik yang tinggi
4. Kekeruhan dan kandungan partikel tersuspensi yang rendah 5. Kandungan kation yang rendah
turunannya. Asam humus tersebut berasal dari dekomposisi bahan organik seperti daun, pohon atau kayu (Kusnaedi, 2006). Adanya ion Fe+2 dalam air gambut berasal dari pirit. Pirit adalah mineral tanah berukuran mikro yang tidak terlihat dengan mata, yang terdapat pada tanah-tanah yang berkembang dari bahan endapan marin. Pirit terbentuk dalam lingkungan air laut atau payau, yang mempunyai bahan organik yang berasal dari tumbuhan pantai seperti api-api bakau atau nipah dan bakteri anaerobik pereduksi senyawa sulfat. Sebagai hasil kerja bakteri anaerob pereduksi senyawa sulfat, terbentuk mineral-mineral tanah berukuran mikro, yang disebut pirit (FeS2) (Pyrite cubic-FeS2). Lapisan tanah yang banyak mengandung mineral pirit ini, apabila masih belum diganggu, jenuh air atau tergenang dan piritnya belum teroksidasi disebut lapisan bahan sulfidik.
Adanya ion Al3+ dan Fe3+ yang melimpah, serta ion-ion basa lain (K, Ca, Mg dan Na) yang terkandung dalam mineral tanah gambut akan tercuci keluar dan hanyut terbawa air mengalir.
Penelitian tentang pengolahan air gambut ini telah banyak dilakukan diantaranya melalui proses elektrokoagulasi (suib, 1994) dengan menggunakan protein biji kelor sebagai koagulasi (Chaidir dkk, 1999), membrane ultra fitrasi dengan coagulation (Fitria, 2008), pengolahan air gambut dengan menggunakan cangkang telur sebagai adsorben (Novita, 2008), penurunan warna air gambut dengan serbuk tulang ayam (Darmayanto, 2008), pengelolaan air gambut dengan menggunakan poly Aluminium Clorida (PAC) (Nurmida Rumapea,2009).
Disamping itu yang melatar belakangi penelitian ini adalah penelitian tentang pengolahan air gambut yang telah dilakukan oleh saudara Susilawati,
tentang pembuatan Model Pengolahan Air Gambut Untuk Menghasilkan Air Bersih Dengan Metode Elektrokoagulasi (2009).
Proses elektrokoagulasi ini dilakukan dengan cara memasukkan elektroda dari lempeng logam Aluminium (Al) ke dalam elektrolit (air baku) pada suatu becker glass. Lempeng Aluminium tersebut dialiri dengan listrik arus searah, sehingga elektroda logam aluminium tersebut sedikit demi sedikit akan larut ke dalam air membentuk ion Al3+, bereaksi dengan air membentuk Al (OH)3.n.H2O koagulan yang sangat efektif.
tersebut dihasilkan air bersih yang dapat dimanfaatkan oleh masyarakat sekitar lahan gambut dan untuk selanjutnya dapat dilakukan analisis kadar logam dalam air gambut tersebut. Diharapkan penelitian ini dapat menyempurnakan penelitian pengolahan air gambut menjadi air bersih.
1.2. Permasalahan
1.2.1. Identifikasi Masalah
Air gambut sangat potensial untuk dikelola sebagai sumber daya air yang dapat diolah menjadi air bersih atau air minum, namun kenyataannya secara kualitas, air gambut dalam pengguanaannya masih banyak mengalami kendala.
1.2.2. Rumusan Masalah
Permasalahan dalam penelitian ini adalah :
a. Apakah Metode Elektrokoagulasi dapat digunakan untuk menjernihkan air gambut
b. Apakah kadar logam dalam air gambut akan mengalami penurunan setelah dijernihkan dengan Metode Elektrokoagulasi
1.2.3. Pembatasan Masalah
Penelitian ini dibatasi pada :
a. Sampel air gambut diambil dari Desa Hutabalang Kec. Bidari Kab. Tapanuli Tengah Propinsi Sumatera Utara.
b. Analisis kadar logam meliputi : Logam Besi (Fe), Logam Tembaga (Cu), Logam Kalsium (Ca) dalam sampel Air Gambut sebelum dan sesudah dilakukan penjernihan dengan Metode Elektrokoagulasi.
1.3. Tujuan Penelitian
1. Menjerhihkan Air Gambut dari Desa Hutabalang Kec. Bidari Kab. Tapanuli Tengah Propinsi Sumatera Utara dengan Metode Elektrokoagulasi
3. Mendapatkan data persentase penurunan kadar logam Besi (Fe), Tembaga (Cu) dan Kalsium (Ca) dalam Air Gambut.
1.4. Manfaat Penelitian
Penelitian ini diharapkan dapat :
1. Memberikan Alternatif Pengolahan Air Gambut menjadi air bersih, kepada masyarakat khususnya masyarakat di Desa Hutabalang Kec. Bidari Kab. Tapanuli Tengah Propinsi Sumatera Utara.
2. Memberikan informasi kepada masyarakat bahwa kadar Logam Besi (Fe), Logam Tembaga (Cu), Logam Kalsium (Ca) dalam Air Gambut seteleh dijernihkan dengan Metode elektrokoagulasi masih sesuai dengan Peraturan Menteri Kesehatan No. 416/PER/IX/1990.
1.5. Metodologi Penelitian
sel. Di dalam reaktor elektroda Alumunium menghasilkan koagulan Al(OH)3 xH2O yang membawa flok dan padatan yang lebih berat ke dasar reaktor, sedangkan gas hidrogen yang dihasilkan membawa padatan tersuspensi yang lebih ringan ke permukaan cairan.
Pengambilan sampel dilakukan dengan cara menentukan 5 titik lokasi yang ditarik secara diagonal, kemudian dari masing – masing titik diambil sampel dengan tiga kedalaman, dengan volume masing masing 1000 ml yaitu pada permukaan, pertengahan dan dasar.
BAB 2
TINJAUAN PUSTAKA
2.1 Tanah Gambut
Tanah gambut adalah tanah-tanah jenuh air yang tersusun dari bahan tanah organik yaitu sisa-sisa tanaman dan jaringan tanaman yang melapuk dengan ketebalan lebih dari 50 cm.
Tanah gambut biasanya adalah merupakan lokasi yang tergenang air yang biasanya ditemukan pada landskap yang relatip rata. Kondisi dingin dan anaerobik hingga sepuluh sentimeter di bawah permukaan menyebabkan residu organik menumpuk, hingga kedalaman setidaknya 30 cm dan kerap kali hingga beberapa meter. Serangkaian proses dekomposisi dan akumulasi yang kompleks yang menjadi ciri dari lingkungan semacam ini menghasilkan formasi gambut. Bog-bog gambut terbentuk di mana keberadaan air yang berlebihan selama sebagian besar waktu setahun atau sepanjang tahun mencegah degradasi total substansi-substansi organik, yang menyebabkan akumulasi sedimen-sedimen yang membentuk gambut.
Salah satu sifat yang menjadikan gambut berperan penting dalam sistem hidrologi adalah kemampuannya bertindak seperti spons. Tanah gambut merupakan tanah organik yang mampu menyerap air dalam jumlah yang sangat besar sehingga air hujan yang jatuh dapat diserap dan dapat mengurangi bahaya banjir. Sebaliknya pada musim kemarau, lahan rawa gambut dapat melepaskan kembali air tawarnya sebagai aliran sungai/ permukaan yang dapat dipergunakan oleh pemukiman sekitarnya (Andri esse, 1988).
2.2 Air Gambut
Air gambut adalah air permukaan yang banyak terdapat di daerah berawa atau dataran rendah di Sumatera dan Kalimantan, yang mempunyai ciri-ciri sebagai berikut:
1) Intensitas warna yang tinggi (berwarna coklat kemerahan) 2) pH yang rendah
3) Kandungan zat organik yang tinggi
4) Kekeruhan dan kandungan partikel tersuspensi yang rendah 5) Kandungan kation yang rendah
Warna coklat kemerahan pada air gambut merupakan akibat dari tingginya kandungan zat organik (bahan humus) terlarut terutama dalam bentuk asam dan turunannya. Asam humus tersebut berasal dari dekomposisi bahan organik seperti daun, pohon atau kayu (Kusnaedi, 2006).
tanah-tanah yang berkembang dari bahan endapan marin. Pirit terbentuk dalam lingkungan air laut atau payau, yang mempunyai bahan organik yang berasal dari tumbuhan pantai seperti api-api bakau atau nipah dan bakteri anaerobik pereduksi senyawa sulfat. Sebagai hasil kerja bakteri anaerob pereduksi senyawa sulfat, terbentuk mineral-mineral tanah berukuran mikro, yang disebut pirit (FeS2) (Pyrite cubic-FeS2). Lapisan tanah yang banyak mengandung mineral pirit ini, apabila masih belum diganggu, jenuh air atau tergenang dan piritnya belum teroksidasi disebut lapisan bahan sulfidik.
Proses pembentukan pirit pada tanah / endapan marin ternyata melalui beberapa tahapan (Laragenhoff, 1986) sebagai berikut :
a. Reduksi sulfat (SO4)-2 menjadi sulfide (S-) oleh bakteri pereduksi sulfat dalam lingkungan anaerob.
b. Oksidasi parsial sulfide menjadi polisulfida, atau unsur S, diikuti pembentukan FeS, dari senyawa S-terlarut dan besi (Fe)-oksida atau mineral silikat mengandung Fe.
c. Pembentukan FeS2, dari kombinasi FeS dengan unsur S, atau presipitasi langsung dari Fe-terlarut (Ion Ferro, Fe2+) dengan ion-ion polisulfida.
6) Fe2O3 + 4(SO4)-2 + 8 (H2O Intensitas warna yang tinggi (berwarna coklat kemerahan)
7) pH yang rendah
8) Kandungan zat organik yang tinggi
9) Kekeruhan dan kandungan partikel tersuspensi yang rendah 10)Kandungan kation yang rendah
+ ½ O2 2FeS2 + 8(HCO3)- + H2O
sulfat bahan organik pirit karbohidrat
Tanah marin mempunyai kenampakan sebagai tanah liat yang selalu jenuh air (water logged) dengan muka air tanah dekat dengan permukaan tanah. Dalam kondisi alami sebelum dibuka untuk pemukiman, tanah marin sering tergenang air, namun apabila tanah marin kemudian direklamasi dengan dibukanya saluran-saluran drainase, air tanah menjadi turun, lingkungan pirit menjadi terbuka dalam suasana aerobik. Sehingga terjadi oksidasi pirit, yang menghasilkan asam sulfat. Reaksinya dapat digambarkan sebagai berikut :
FeS2 + 14/4 O2 + 7/2 H2O Fe(OH)3 + 2(SO4)-2 + 4H+ pirit oksigen besi-III asam sulfat
Dalam kondisi teroksidasi sangat kuat, antara lain akibat drainase yang drastis, misalnya air tanah turun terlalu dalam, atau oleh penggalian parit atau saluran drainase, bahan sulfidik mengandung pirit akan menghasilkan mineral jarosit yang nampak sebagai karatan-karatan berwarna kuning jerami, dengan reaksi tanah yang sangat masam.
FeS2 + 15/4 O2 + 1/3 K+ 1/3 KFe(SO4)2(OH)6 + 4/3(SO4)-2 + 3 H+ pirit oksigen jarosit asam sulfar
Pada proses oksidasi pirit dibebaskan ion sulfat. Ion H+ dan senyawa besi Ferri bervalensi tiga (Fe(OH)3) yang segera tereduksi menjadi ion besi Ferro-bervalensi dua (Fe(OH)2) yang mudah bergerak, karena merupakan ion-ion bebas. Terlalu banyaknya ion-ion H+ dalam larutan tanah, disamping menyebabkan terjadinya pertukaran ion yang mendesak keluar semua basa-basa tanah (Ca, Mg, K dan Na) dalam kompleks adsorpsi liat dan humus, ion-ion H+ juga membentuk senyawa hidrat dengan molekul air (yang bersifat bipolar) dan masuk kedalam struktur kisi (Lattice) mineral liat untuk menggantikan / subtitusi tempat. Ion Al3+ dalam kisi mineral. Mineral liat menjadi tidak stabil, kisinya runtuh (Collapsed)
Humus terdiri dari 2 senyawa utama yaitu substansi non humus (missal: lipid, asam amonia, karbohidrat) dan substansi humus (merupakan senyawa amorf dengan berat molekul tinggi, warna coklat sampai hitam).
Substansi humus dibedakan menjadi:
1. Humic Acid (asam humus): warna gelap, amorf, dapat diekstaksi (larut) dengan basa kuat, garam netral, tidak larut dalam asam; mengandung gugus fungsional asam seperti fenoliuk dan karboksilik; aktif dalam reaksi kimia; Berat molekul (BM) 20.000-1.360.000.
2. Fulvic Acid (asam Fulfat); dapat diekstraksi dengan basa kuat, gugus fungsional asam, larut juga dalam asam, mengandung gugus fungsional basa; aktif dalam reaksi kimia; BM 275-2110.
[image:37.612.113.511.468.658.2]3. Humin: tidak terlarut dalam asam dan basa; BM terbesar; tidak aktif; warna paling gelap.
Gambar 2.2. Model struktur asam fulvat berdasarkan Buffle et al. (1977).
Dalam larutan (pH 3,5 - 9), asam humat membentuk sistem koloid polielektrolit linear yang bersifat fleksibel; sedangkan pada pH rendah asam humat berbentuk kaku (rigid) dan cenderung teragregasi membentuk suatu padatan makromolekul melalui ikatan hidrogen. Dengan meningkatnya pH akan menyebabkan ikatan hidrogen semakin lemah sehingga agregat akan terpisah satu sama lain. Keadaan tersebut dipengaruhi oleh disosiasi gugus fungsional yang bersifat asam pada asam humat seperti -COOH. Umumnya gugus -COOH terdisosiasi pada pH sekitar 4-5, sedangkan gugus -OH fenolat atau –OH alkoholat terdisosiasi pada pH sekitar 8-10. Spark dkk (1997) telah mengamati kelarutan asam humat batubara yang menunjukkan bahwa kelarutan maksimum asam humat terjadi pada pH 3-6 yaitu sekitar 80% dan sisa padatan mulai larut pada pH 8,5. Dengan demikian dapat dinyatakan bahwa pada pH yang relatif tinggi (konsentrasi H+ rendah) akan meningkatkan kensentrasi -COO- yang dapat berfungsi sebagai ligan pada asam humat.
Walaupun pada pH yang relatif rendah, asam humat cenderung tidak berinteraksi dengan ion logam, akan tetapi sebagai padatan polielektrolit, asam humat memiliki kemampuan untuk mengadsorpsi logam. Asam humat dengan ion logam dapat mengalami presipitasi. Tingkat flokulasi yang terjadi bergantung pada pH, sifat-sifat gugus fungsional pada asam humat yang dapat bertindak sebagai ligan dan sifat ion logam.
Substansi humus bergabung dengan bagian mineral tanah adalah sebagai berikut: 1. Sebagai garam dari asam organik dengan berat molekul rendah (acetat, oxalat,
2. Sebagai garam dari substansi humus dengan kation alkalin – humat, fulvat. 3. Sebagai chelat dengan ion logam.
4. Sebagai subsansi yang tertahan pada permukaan mineral tanahliat. Substansi humus dengan kation alkalin terdiri dari senyawa:
1. humat (garam dari asam humus) 2. fulvat (garam dari asam fulvat)
Ini adalah sebagian besar senyawa karakteristik substansi tanah humus. Kation alkalin (Na+, K+, Ca2+, Mg2+) terbentuk terutama melalui pertukaran ion sederhana dengan gugus COOH (RCOONa, RCOOK, dll.). Humat dan fulvat terjadi di dalam tanah sebagian besar sebagai campuran dengan hidroksida Fe dan Al. Kemampuan membentuk kompleks dari asam humus dan asam fulvat sebagian besar merupakan hasil dari isi gugus fungsionalnya yang mengandung oksigen, seperti COOH, phenol OH dan gugus C=O. Bahan-bahan organik utama tanah membentuk komplek yang bisa larut dan yang tidak bisa larut dengan ion logam dan dengan demikian memegang peranan rangkap di dalam tanah.
dalam penyerapan substansi humus oleh mineral tanahliat, antara lain: 1. gaya van der Waals
2. pengikatan dengan pembentukan-jembatan kation 3. pengikatan H
Kation polivalen utama bertanggungjawab atas pengikatan asam humus dan asam fulvat pada tanahliat adalah Ca2+, Fe3+ dan Al3+. Sebaliknya Fe3+ dan Al3+ membentuk komplek koordinasi yang kuat dengan senyawa organik. Kation polivalen bertindak sebagai jembatan antara kedua tempat bermuatan.
Penyerapan asam fulvat pada permukaan oksida disertai dengan penggantian gugus OH oleh ion COO-. Anion organik tidak mudah diganti dengan garam sederhana, walaupun penyerapan sensitif pH. Seperti halnya dengan kation organik pada permukaan mineral tanahliat, ikatan yang sangat kuat akan terjadi jika lebih dari satu gugus pada molekul humus berpartisipasi.
2.3 Pengolahan Air Gambut
Karekteristik air gambut seperti yang telah disebutkan di atas menunjukkan bahwa air gambut kurang menguntungkan untuk dijadikan air bagi masyarakat di daerah berawa. Namun karena jumlah air gambut tersebut sangat banyak dan dominan berada di daerah tersebut maka harus bisa menjadi alternatif sumber air minum masyarakat. Kondisi yang kurang menguntungkan dari segi kesehatan adalah sebagai berikut (Mu-min 2002).
a. Kadar keasaman pH yang rendah dapat menyebabkan kerusakan gigi dan sakit perut.
c. Apabila dalam pengolahan air gambut tersebut digunakan klor sebagai desinfektan, akan terbentuk TriHaloMetan (THM) seperti senyawa organoklor yang dapat bersifat karsinogenik.
d. Ikatan yang kuat dengan logam (besi dan mangan) menyebabkan kandungan logam dalam air tinggi dan dapat menimbulkan kematian jika dikonsumsi secara terus-menerus.
Berdasarkan pada pengetahuan tentang penyebab dan kandungan warna pada air gambut dan sifat-sifatnya, maka proses dan metode pengolahan yang dapat diterapkan untuk mengolah jenis air berwarna alami adalah Metode Elektrokoagulasi (Mahmud, 2002).
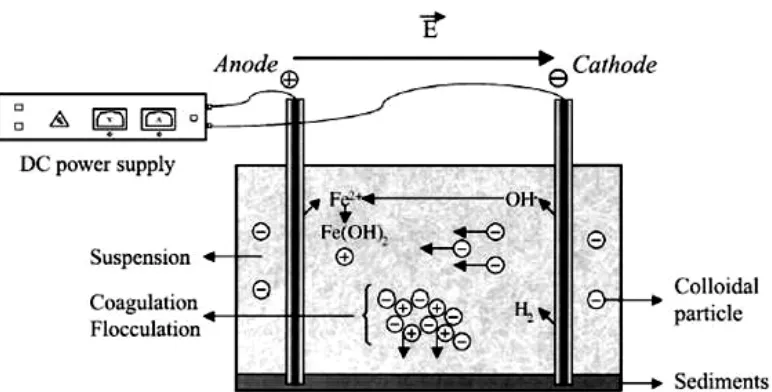
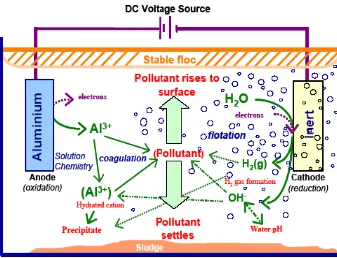
2.4 Elektrokoagulasi
Gambar 2.3. Prinsip dari proses elektrokoagulasi (Ni’am, 2007)
Gambar 2.4. Mekanisme Dalam Elektrokoagulasi (Holt,2001)
Tampak jelas bahwa elektrokoagulasi memiliki kemampuan untuk membersihkan berbagai polutan dengan berbagai kondisi mulai dari: zat-zat padat tersuspensi; logam berat; produk petroleum; warna dari larutan yang mengandung pewarna; humus cair; dan defluoridasi air.
Mekanisme yang mungkin:
memasukkan kation logam in situ, secara elektrokimia, dengan menggunakan anoda yang dikorbankan (biasanya aluminium atau besi).
M → Mn+ + ne- (1)
2H2O + 2e-→ 2OH- + H2 (2) Kation terhidrolisis di dalam air yang membentuk hidroksida dengan
spesies-spesies utama yang ditentukan oleh pH larutan. Persamaan 3-6 menggambarkan hal ini dalam kasus aluminium.
Al3+ + H2O → AlOH2+ + H+ (3)
AlOH2+ + H2O → Al(OH)2+ + H+ (4)
Al(OH)2+ + H2O → Al(OH)30 + H+ (5)
Al(OH)30 + H2O → Al(OH)4- + H+ (6)
Kation bermuatan tinggi mendestabilisasi setiap partikel kolloid dengan pembentukan komplek polihidrosida polivalen. Komplek-komplek ini memiliki sifat-sifat penyerapan yang tinggi, yang membentuk agregat dengan polutan. Evolusi gas hidrogen membantu dalam percampuran dan karenanya membantu flokulasi. Begitu flok dihasilkan, gas elektrolitik menimbulkan efek pengapungan yang memindahkan polutan ke lapisan flok-foam pada permukaan cairan.
Ada berbagai cara dengan mana spesies-spesies bisa berinteraksi dalam larutan:
1. Migrasi ke elektroda dengan muatan berlawanan (elektroforesis) dan agregasi disebabkan netralisasi muatan.
3. Kation logam berinteraksi dengan OH- untuk membentuk hidroksida, yang memiliki sifat-sifat penyerapan tinggi yang dengan demikian mengalami pengikatan pada polutan (koagulasi jembatan).
4. Hidroksida membentuk struktur mirip-kisi yang lebih besar dan menyapu air (koagulasi sapuan).
5. Oksidasi polutan menjadi spesies yang tidak begitu toksit.
6. Pembersihan dengan elektroflotasi dan pelekatan pada gelembung-gelembung.
Reaksi yang terjadi pada proses ini adalah : a. Reaksi pada katoda
Reaksi pada katoda adalah reaksi reduksi terhadap kation, jadi yang diperhatikan kationnya saja.
1. Jika larutan mengandung ion-ion logam alkali, ion-ion logam alkali tanah, ion Al+3, dan ion Mg2+, mengandung ion-ion logam ini tidak dapat direduksi dari larutannya. Yang akan mengalami reduksi adalah pelarut (air) dan terbentuk gas Hidrogen (H2) pada katoda.
2H2 O + 2e 2OH- + H2
Dari daftar E0 diketahui bahwa reduksi terhadap air lebih mudah berlangsung dari pada reduksi terhadap ion-ion di atas.
2H+ + 2e H2
3. Jika larutan mengandung ion-ion lain maka ion-ion logam ini diendapkan pada permukaan batang katoda.
Fe2+ + 2e Fe Mn 2+ + 2e Mn
b. Reaksi Pada Anoda
Elektroda pada Anoda, elektrodanya dioksidasi (bereaksi) diubah menjadi ionnya.
Contoh :
Al Al3+ + 3e Zn Zn2+ + 2e
Dalam system elektrokimia dengan anoda terbuat dari alumunium, berapa kemungkinan reaksi elektroda dapat terjadi sebagai berikut.
Anoda : Al Al3+ + 3e Katoda : 2H2O + 2e H2 + 2 OH
2.4.1. Koagulasi
Koagulasi adalah peristiwa destabilisasi partikel-partikel koloid dan larutan. Partiekl-partikel tersebut membentuk lapisan secara kimia yang kemudian diikuti dengan flokulasi. Zat-zat kimia yang digunakan untuk mendestabilkan partikel koloid disebut dengan koagulan.
Koagulan yang paling umum dan sering digunakan adalah alum (aluminium sulfat) dan garam-garam dari senyawa besi. Karakteristik dari kation multivalensi adalah mempunyai kemampuan menarik koagulan ke muatan partikel koloid (Proste,1997).
Pada dasarnya koagulasi disebabkan oleh ion-ion yang muatannya berlawanan dengan partikel koloid, dalam hal ini ion-ion koagulan yang bermuatan positif akan mentralisir muatan negatif partikel koloid yang menyebabkan dapat mengurangi gaya tolak-menolak antar partikel-partikel koloid sehingga terjadi pengendapan (Robert,1986).
2.4.2. Flokulasi
2.4.3. Keuntungan dari elektrokoagulasi
a. Elektrokoagulasi membutuhkan peralatan yang sampel dan mudah untuk mengoperasikannya
b. Air yang ditreatmen dengan elektrokoagulasi menjadi bersih, jernih dan tidak berbau.
c. Effluen yang dihasilkan elektrokoagulasi mengandung TDS (Total Dissolved Solid) yang lebih sedikit dibandingkan dengan yang ditreatment secara kimia. d. Proses elektrokoagulasi mempunyai keuntungan memindahkan (Removing)
partikel-partikel koloid yang paling kecil, sebab di aplikasikan medan elektrik dengan gerak yang lebih cepat.
e. Proses elektrokoagulasi jauh dari penggunaan bahan-bahan kimia dan tidak ada problem untuk menetralisir kelebihan bahan-bahan kimia, dan tidak ada polusi yang kedua yang disebabkan subtansi kimia yang ditambahkan pada konsentrasi yang tinggi.
f. Produksi gelembung-gelembung gas selama elektrolisis dapat membawa polutan-polutan ke atas sehingga dapat dengan mudah di konsentrasikan, dikumpulkan dan dipindahkan (removed).
2.5 Zat Besi (Fe)
2.5.1. Sifat-sifat logam besi
Besi (Fe) adalah metal berwarna putih kepekatan, liat dapat dibentuk. Besi dalam sistem periodik unsur dengan nomor atom 26 terdapat dalam golongan VIII B dan period eke-4. Besi melebur pada suhu 15350C, titik didihnya 30000C, dan mempunyai densitas 7,87 g/cm3.
2.5.2. Logam besi dalam kehidupan manusia
Proses biokimia dalam tubuh mahluk hidup hamper selalu melibatkan unsur-unsur logam di dalamnya. Pada suatu proses fisiologi yang normal, ion logam esensial sangat berperan aktivitasnya baik dalam ikatannya dengna protein, enzim maupun bentuk lainnya. Manusia yang sehat dalam jaringan tubuhnya selalu ditemukan ion logam yang normal. Sedang ion logam yang ditemukan terlalu rendah pada jaringan tertentu misalnya darah (Fe), hati (Cu), dapat digunakan untuk mendiagnosa adanya kelainan pada orang yang bersangkutan yang kemungkinan menderita defisiensi atau penyakit lainnya.
2.5.3. Logam besi dalam air
Besi merupakan salah satu elemen kimia yang dapat ditemui pada hamper setiap tempat di bumi, pada semua lapisan geologis dan semua badan air, besi yang ada di dalam air dapat bersifat :
1. Terlarut sebagai Fe2+ (ferro) atau Fe3+ (ferri).
2. Tersuspensi sebagai butir kolodial (diameter <1um) atau lebih besar seperti Fe2O3, FeO, Fe(OH)3, dan sebagainya.
3. Tergabung dengan zat organik atau zat padat yang inorganik atau seperti tanah liat.
Pada air permukaan jarang dijumpai kadar Fe yang lebih besar dari 1 mg/l, tetapi di dalam air tanah kadar Fe dapat jauh lebih tinggi. Pada air yang mengandung oksigen (O2), seperti seringkali air tanah, besi berada sebagai Fe3+ yang cukup larut, sedangkan pada air sungai yang mengalir dan terjadi aerasi, Fe2+ teroksidasi menjadi Fe3+, Fe3+ ini sulit larut pada pH 6 sampai 8, bahkan dapat menjadi ferihidroksida (Fe(OH)3 atau salah satu jenis oksida yang merupakan zat padat dan dapat mengendap. Demikian halnya di dalam air sungai, besi berada sebagai Fe2+, Fe3+ terlarut dan Fe3+ dalam bentuk senyawa organik berupa koloidal.
konsentrasi yang lebih besar dari 1mg/l dapat menyebabkan warna air menjadi kemerah-merahan, memberi rasa yang tidak enak pada minuman, dapat membentuk endapan pada pipia-pipa logam dan bahan cucian.
Atas dasar pertimbangan diatas, maka ditetapkan standar konsentrasi maksimum Fe dalam air minum oleh Depkes RI, sebesar 0,1-1,0 mg/l (SNI 06-6989,4-2004). Dengan dipenuhinya standar tersebut oleh air minum, maka diharapkan berbagai hal yang tidak inginkan tersebut diatas tidak terjadi
2.6 Logam Berat Tembaga (Cu)
Tembaga dengan nama kimia cuprum dilambangkan dengan Cu. Unsur logam ini berbentuk kristal dengan warna kemerahan. Dalam tabel periodik unsur-unsur kimia, tembaga menempati posisi dengan nomor atom 29 dan mempunyai bobot berat atom 63,546. Unsur tembaga di alam dapat ditemukan dalam bentuk logam bebas. Akan tetapi, lebih banyak ditemukan dalam bentuk persenyawaan atau sebagai senyawa padat dalam bentuk mineral.
Logam Cu dapat terakumulasi dalam jaringan tubuh, maka apabila konsentrasinya cukup besar logam itu akan meracuni manusia tersebut. Pengaruh racun yang ditimbulkan dapat berupa muntah-muntah, rasa terbakar di daerah esofargus dan lambung, kolik serta mencret-mencret. Kemudian disusul dengan hipotensi, nekrosi hati dan koma (Supriharyono, 2000).
ginjal, sarap sentral dan diikuti pada dengan despresi. Keracunan tembaga menunjukkan sifat-sifat yang agak kurang beracun dibandingkan dengan logam berat lainnya, tetapi bila keracunan dalam jumlah kecil terjadi terus menerus( menelan) dapat menimbulkan pigmentary cirrhosis hati (hati mengeras) (Adiwisastra,1985).
.Logam Cu dibutuhkan untuk sistem enzimoksidatif seperti enzim askorbat-oksidasi, sistikrom Cu-oksidase, Polipenol-oksidase, amina-oksiadse dan lain-lain. Cu juga dibutuhkan manusia sebagai komplek Cu-protein yang mempunyai fungsi tertentu dalam pembentukan haemoglobin, kalogen, pembuluh darah dan myelin otak (Heryandro palar,1994).
2.7 Logam Kalsium (Ca)
Kalsium terdapat sebanyak 99% dalam tulang kerangkan dan sisanya dalam cairan antar sel dan plasma. Dalam bahan makanan terutama terdapat dalam susu dan telur, juga gandum dan sayur-mayur, antara lain bayam. Resorpsinya dari usus memerlukan adanya vitamin D dalam bentuk aktifnya, yaitu kalsitriol.
Fungsinya selain sebagai bahan bangun bagi kerangka, juga sebagai pemeran penting pada regulasi daya rangsang dan kontraksi otot serta penerusan implus saraf. Lagi pula Ca mengatur permeabilitas membran sel bagi Kdan Na dan mengaktivasi banyak reaksi enzim, seperi pembekuan darah.
Dalam kebanyakan kasus kekurangan di sebabkan oleh defisiensi Vitamin D dan terhambatnya resorpsi Ca, atau karena penyakit hipoparatiroris dan insufisiensi ginjal.
2.8 Spetrofotometer Serapan Atom (SSA)
Spektrofotometer Serapan Atom adalah suatu metode pengukuran kuantitatif suatu unsur yang terdapat dalam cuplikan berdasarkan penerapan cahaya pada panjang gelombang tertentu oleh atom-atom bentuk gas dalam keadaan dasar. Telah lama ahli kimia menggunakan pancaran radiasi oleh atom yang dieksistasikan dalam suatu nyala sebagai alat analitis. Suatu nyala yang lain, kebanyakan atom berada dalam keadaan eksitasi. Fraksi atom-atom yang tereksitasi berubah secara eksponensial dengan temperatur. Tehnik ini digunakan untuk penetapan sejumlah unsur, kebanyakan logam, dan sample yang sangat beraneka ragam.
2.8.1 Prinsip Dasar Spektrofotometer Serapan Atom
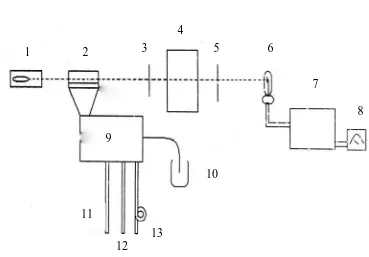
2.8.2. Cara Kerja Spektrofotometer Serapan Atom Setiap alat SSA terdiri atas tiga komponen berikut :
a. Unit atomisasi b. Sumber radiasi
[image:55.612.109.478.242.499.2]c. Sistem pengukur fotometrik
Gambar 2.5. Skematis Ringkas Spektrofotometer Serapan Atom Keterangan :
1 : Lampu katoda 2 : Tungku 3 : Entrace Slit 4 : Monokromator 5. : Exit Slit
1 2 3
4
5 6
7
8 9
10
11
12
6. : Foto Detektor 7. : Amplifier 8. : Skala Pembacaan 9 : Nebulizer
BAB 3
METODE PENELITIAN
3.1 Lokasi Penelitian
Penelitian ini dilakukan dilaboratorium kimia Analitik F MIPA USU dengan mengambil sampel air gambut dari Desa Hutabalang Kec. Bidari Kabupaten Tapanuli Tengah, Sumatera Utara.
3.2 Populasi dan Sampel
Luas lahan gambut di Tapanuli Tengah sekitar 17 ribu ha (5,2 % dari luas lahan gambut di Sumatera Utara). Populasi dalam penelitian ini adalah seluruh air yang menggenangi lahan gambut di Kec. Bidari Kabupaten Tapanuli Tengah. dengan langkah-langkah sebagai berikut:
1. Menentukan lokasi 5 (lima) titik yang ditarik secara diagonal dari tepi lahan gambut.
2. Dari titik itu masing-masing sampel di ambil tiga titik kedalaman yaitu pada permukaan, tengah dan dasar air gambut.
3. Membilas terlebih dahulu bagian dalam penampang (alat untuk mengambil sampel) secara merata sebanyak 3 (tiga) kali dengan sampel tersebut.
3.3 Bahan-Bahan dan Alat
Bahan-bahan kimia yang digunakan dalam penelitian ini adalah :
a. Akuades. -
b. Asam nitrat p.a HNO3 p.a.(merck)
c. Larutan standar logam besi (Fe) p.a.(merck) d. Larutan standar logam Tembaga (Cu) p.a.(merck) e. Larutan standar logam Kalsium (Ca) p.a.(merck)
f. Gas asetilen (C2H2) -
g. Asam klorida pekat (HCl) 37 % p.a.(merck)
h. Air gambut -
i. Tawas komersial 17 % -
Peralatan yang digunakan dalam penelitian ini adalah :
a. Spektrofotometer Serapan Atom - Shimadzu AA 6-300. b. Lampu hollow katoda Fe. -
c. Lampu hollow katoda Cu. - d. Lampu hollow katoda Ca. -
e. Gelas Beaker pyrex
f. Neraca Analitis Mettler PM 2000 g. Penangas listrik (hot plate). -
i. Statif dan Klem -
j. Stopwatch - Diamond
k. pH meter -
l. Adaptor 3-13,8V\ 10 A -
m. Labu takar - pyrex
n. Gelas ukur - Pyrex
o. Pengaduk -
p. Kabel tembaga -
q. Lempeng aluminium -
3.4 Prosedur Penelitian 3.4.1 Preparasi Sampel
Sampel air gambut dibagi menjadi dua bagian, satu bagian langsung digunakan untuk proses elektrokoagulasi, sedang satu bagian lagi di destruksi dengan menambahkan HNO3 pekat untuk proses analisis Fe, Cu, dan Ca.
3.4.2 Preparasi Alat Elektrokoagulasi
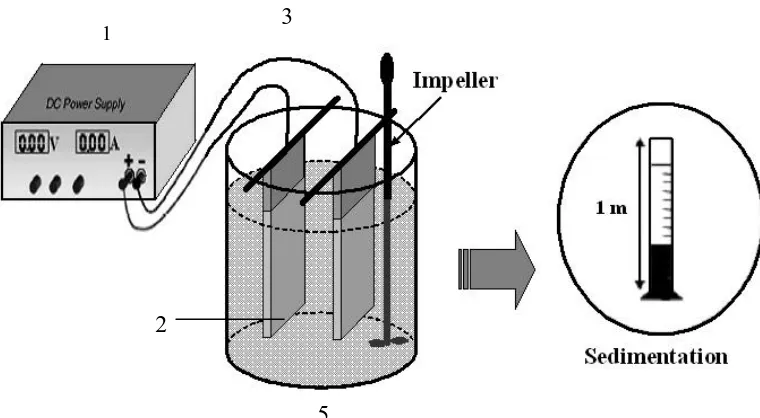
Perangkat Alat Elektrokoagulasi terdiri dari :
Plat Aluminium ukuran 5x8 cm tebal 1 mm 2 buah
Power Suplly 12 Volt
Kabel + dan kabel – -
Gambar 3.1. Susunan Alat Elektrokoagulasi Keterangan : 1. Power Supply
2. Plat Aluminium Ukuran (5x8) cm 2 buah 3. Kabel + dan Kabel –
4. Pengaduk
5. Gelas Kimia 1000 ml
3.4.3 Preparasi Larutan Tawas 1000 ppm
Ditimbang sebanyak 1,0000 gram Al2(SO4)3 dalam botol timbang lalu dipindahkan ke dalam labu takar 1000 ml secara kuantitatif lalu diencerkan dengan akuades sampai tanda garis.
5
1 3
3.4.4 Pembuatan Kurva Kalibrasi Besi (Fe) (SNI.06.6989.04-2004) Pembuatan larutan baku logam besi, Fe 100 mg/L
a. Pipet 10 ml larutan induk logam besi, Fe 1000 mg/L kedalam labu ukur 100 ml.
b. Tepatkan dengan larutan pengencer sampai tanda tera.
Pembuatan larutan baku logam besi, Fe 10 ng/L
a. Pipet 10 ml larutan standar logam besi, Fe 100 mg/L kedalam labu ukur 100 ml.
b. Tepatkan dengan larutan pengencer sampai tandatera.
Pembuatan larutan kerja logam besi, Fe
a. Pipet masing-masing 1, 5, 10, dan 15 ml larutan baku besi, Fe 10 mg/L. Masing-masing kedalam labu ukur 100 ml.
b. Tambahkan larutan pengencer sampai tepat tanda tera sehingga diperoleh konsentrasi logam besi 0,1; 0,5; 1,0 dan 1,5 mg/L.
c. Ukurlah nilai absorbansi masing-masing larutan kerja yang telah dibuat pada panjang gelombang 248,3 nm.
3.4.4.1 Pengukuran Logam Besi (Fe) Dengan SSA
a. Lampu katoda dari logam yang akan dianalisis dipasang pada alat SSA pada posisi 1.
b. Alat SSA dihidupkan beserta komputer dan printer.
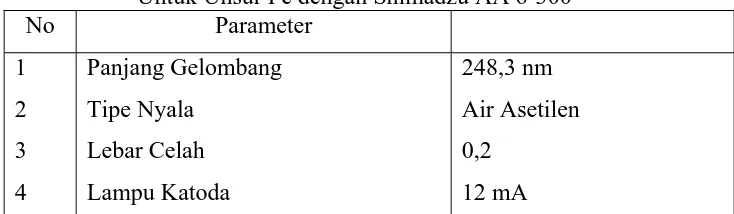
Tabel 3.1. Kondisi Parameter Spektroskopi Serapan Atom (SSA) Untuk Unsur Fe dengan Shimadzu AA 6-300
No Parameter
1 2 3 4
Panjang Gelombang Tipe Nyala
Lebar Celah Lampu Katoda
248,3 nm Air Asetilen 0,2
12 mA
Sumber : Petunjuk Penggunaan Alat Type Shimadzu AA 6-300
d. Setelah kondisi diatas diprogram dengan komputer. e. Selanjutnya kompresor dihidupkan.
f. Kran udara pada kompresor yang menuju SSA dibuka. g. Kemudian kran asetilensor yang menuju SSA dibuka.
h. Tombol Ignisi ditekan selama 2 sampai 3 detik sehingga nyala yang kebiru-biruan.
i. Pipas kapiler pada nebulizer di celup pada blanko. j. Uji blanko hingga absorbansi 0.
k. Larutan standar diaspirasi terhadap nyala dan nilai absorbansinya akan terlihat di komputer.
l. Buat kurva kalibrasi untuk mendapatkan persamaan garis regresi.
Dilanjutkan dengan pengujian contoh uji yang sudah dipersiapkan (SNI.06.6989.4-2004)
3.4.5 Pembuatan Kurva Kalibrasi Tembaga Cu (SNI.06.6989.6-2004)
Pembuatan larutan baku logam, Cu 100 mg/L
a. Pipet 10 ml larutan induk logam tembaga. Cu 1000 mg/L kedalam labu ukur 100 ml.
Pembuatan larutan baku logam tembaga, Cu 10 mg/L
a. Pipet 10 ml larutan standar tembaga, Cu 100 mg/L kedalam labu ukur 100 ml.
b. Tepatkan dengan larutan pengencer sampai tanda tera.
Pembuatan larutan kerja logam tembaga, Cu.
a. Pipet 2, 5, 10 ml dan 15 ml larutan baku tembaga, Cu 10 mg/L masing-masing kedalam labu ukur 100 ml.
b. Tambahkan larutan pengencer sampai tepat tanda tera sehingga diperoleh konsentrasi logam tembaga, Cu 0,2 ; 0,5 ; 1,0 mg/L, dan 1,5 mg/L.
c. Ukurlah nilai absorbansi masing-masing larutan kerja yang telah dibuat pada panjang gelombang 324,8 nm.
3.4.5.1 Pengukuran Logam Tembaga (Cu) Dengan SSA
a. Lampu katoda dari logam yang akan dianalisa dipasang pada alat SSA pada posisi 1.
b. Alat SSA dihidupkan beserta komputer dan printer.
c. Beberapa parameter pengukur untuk logam tembaga, Cu ditetapkan sebagai berikut :
Tabel 3.2. Kondisi Parameter Spektroskopi Serapan Atom (SSA) Untuk Unsur Tembaga, Cu dengan Shimadzu AA 6-300
No Parameter
1 2 3 4
Panjang Gelombang Tipe Nyala
Lebar Celah Lampu Katoda
324,8 nm ... ..Air Asetilen.
...0,7 ...6 mA
d. Setelah kondisi diatas diprogram dengan komputer, selanjutnya kopresor dihidupkan.
e. Kran udara pada kompresor yang menuju SSA dibuka.
f. Tombol Ignisi ditekan selama 2 sampai 3 detik sehingga nyalayang kebiru-biruan.
g. Pipas kapiler pada nebulizer dicelupkan pada larutan blanko. h. Uji blanko hingga absorbansi 0.
i. Larutan standar diaspirasikan terhadap nyala dan nilai absorbansinya akan terlihat di komputer.
j. Buat kurva kalibrasi untuk mendapatkan persamaan garis regresi.
k. Dilanjutkan dengan pengujian contoh uji yang sudah dipersiapkan (SNI.06-6989.6-2004).
3.4.6 Pembuatan Kurva Kalibrasi Kalsium Ca (SNI.06.6989.56.2005)
Pembuatan larutan baku kalsium 100 mg/L
a. Pipet 10 ml larutan induk kalsium 1000 mg/L dan masukkan kedalam labu ukur 100 ml.
b. Tambahkan larutan pengencer hingga sampai tanda tera dan dihomogenkan.
Pembuatan larutan baku kalsium 10 mg/L.
a. Pipet 10 ml larutan baku kalsium, ca 100 mg/L kedalam labu ukur 100 mg/L.
b. Tepatkan dengan larutan pengencer sampai tanda tera.
Pembuatan larutan kerja kalsium
b. Tambahkan larutan pengencer sampai tepat tanda tera kemudian dihomogenkan sehingga diperoleh kadar kalsium 0,0 mg/L, 1,0 mg/L, 2,0 mg/L, 3,0 mg/L dan 4,0 mg/L.
c. Ukurlah nilai absorbansi masing-masing larutan kerja yang telah dibuat pada panjang gelombang 422,7 nm.
3.4.6.1 Pengukuran Logam Kalsium Dengan SSA
a. Lampu katoda dari logam yang akan dianalisa dipasang pada alat SSA pada posisi 1.
b. Alat SSA dihidupkan beserta komputer dan printer.
[image:65.612.158.522.409.512.2]c. Beberapa parameter pengukur untuk kalsium (Ca) ditetapkan sebagai berikut .
Tabel 3.3. Kondisi Parameter Spektroskopi Serapan Atom (SSA) Untuk Unsur Ca dengan Shimadzu AA 6-300.
No Parameter
1 2 3 4
Panjang Gelombang Tipe Nyala
Lebar Celah Lampu Katoda
422,7 nm ... Air Asetilen
0,7 10 mA
Sumber : Petunjuk Penggunaan Alat SSA Type Shimadzu AA 6-300
d. Setelah kondisi diatas diprogram dengan komputer, selanjutnya kopresor dihidupkan.
e. Kran udara pada kompresor yang menuju SSA dibuka. f. Kemudian kran asetilensor yang menuju SSA dibuka.
g. Tombol Ignisi ditekan selama 2 sampai 3 detik sehingga nyala yang kebiru-biruan.
i. Uji blanko hingga absorbansi 0.
j. Larutan standar diaspirasi terhadap nyala dan nilai absorbansinya akan terlihat di komputer.
k. Buat kurva kalibrasi untuk mendapatkan persamaan garis regresi.
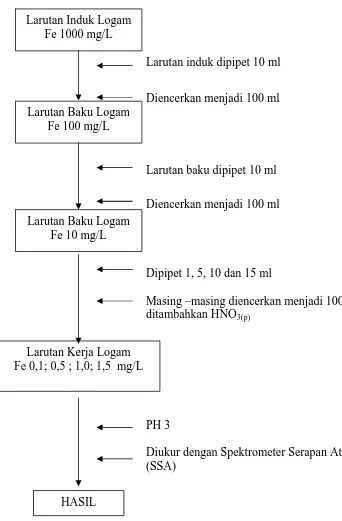
3.5. Bagan Pembuatan Kurva Kalibrasi Besi (Fe) (SNI 06.6989.4.2004)
Larutan induk dipipet 10 ml
Diencerkan menjadi 100 ml
Larutan baku dipipet 10 ml
Diencerkan menjadi 100 ml
Dipipet 1, 5, 10 dan 15 ml
Masing –masing diencerkan menjadi 100 ml ditambahkan HNO3(p)
PH 3
[image:67.612.148.490.140.661.2]Diukur dengan Spektrometer Serapan Atom (SSA)
Gambar 3.2. Flow Shett Pembuata Kurva Kalibrasi Besi (Fe) Larutan Induk Logam
Fe 1000 mg/L
Larutan Baku Logam Fe 100 mg/L
Larutan Baku Logam Fe 10 mg/L
Larutan Kerja Logam Fe 0,1; 0,5 ; 1,0; 1,5 mg/L
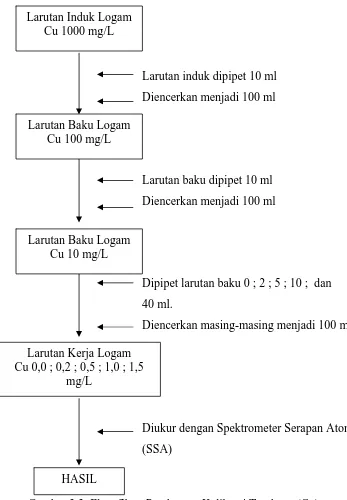
3.6 Bagan Pembuatan Kurva Kalibrasi Tembaga (Cu) (SNI 06.6989.6.2004)
Larutan induk dipipet 10 ml Diencerkan menjadi 100 ml
Larutan baku dipipet 10 ml Diencerkan menjadi 100 ml
Dipipet larutan baku 0 ; 2 ; 5 ; 10 ; dan 40 ml.
Diencerkan masing-masing menjadi 100 ml
[image:68.612.123.470.189.689.2]Diukur dengan Spektrometer Serapan Atom (SSA)
Gambar 3.3. Flow Shett Pembuatan Kalibrasi Tembaga (Cu) Larutan Kerja Logam
Cu 0,0 ; 0,2 ; 0,5 ; 1,0 ; 1,5 mg/L
HASIL
Larutan Induk Logam Cu 1000 mg/L
Larutan Baku Logam Cu 100 mg/L
3.7 Bagan Pembuatan Kurva Kalibrasi Kalsium, Ca (SNI.06.6989.56.2005)
Larutan induk dipipet 10 ml Diencerkan menjadi 100 ml
Larutan induk dipipet 10 ml Diencerkan menjadi 100 ml
Larutan baku dipipet 0,0 ; 1,0 ; 2,0 ; 3,0 ml Dan 4,0 m
Diencerkan masing-masing menjadi 100 ml
[image:69.612.144.491.135.656.2]Diukur dengan Spektrometer Serapan Atom (SSA)
Gambar 3.4. Flow Shett Pembuatan Kalibrasi Kalsium (Ca) Larutan Kerja Logam
Ca 0,0 ; 1,0 ; 2,0 ; 3,0 ; dan 4,0 mg/L
HASIL
Larutan Induk Logam Ca 1000 mg/L
Larutan Baku Logam Ca 100 mg/L
3.8. Bagan Penelitian
[image:70.612.138.490.254.431.2]Elektrokoagulasi air gambut
Gambar 3.5. Flow Shett Elektrokoagulasi Sampel Air Gambut Air Gambut 1000 ml
Diamati perubahannya Dielektrokoagulasi selama 0 – 60 menit
Elektrokoagulasi air gambut dengan penambahan tawas
[image:71.612.107.511.147.650.2]
Gambar 3.7. Flow Shett Elektrokoagulasi Sampel Air Gambut Dengan Penambahan Tawas 10 ml (1000 ppm)
Proses Elektrokoagulasi Air Gambut 1000 ml
Filtrate Jernih Endapan
HASIL
Dianalisis logam Fe, Cu, Ca dengan Spektrofotometer Serapan Atom (SSA)
Dipisahkan
Diamati perubahannya Dielektrokoagulasi selama 45 menit
Ditambahkan tawas 10 ml (1000 ppm)
BAB 4
HASIL DAN PEMBAHASAN
4.1 Hasil Penelitian
4.1.1. Pengukuran Logam Besi (Fe)
[image:72.612.83.486.412.567.2]Pada pengukuran logam Besi (Fe) pada air Gambut dimulai dengan pengukuran Absorbansi Standar Besi (Fe) dengan spektrofotometri serapan atom (SSA). Data hasil pengukuran absorbnsi dari larutan Standar Besi (Fe) diplotkan terhadap konsentrasi larutan Standar Besi (Fe) tertera pada tabel berikut :
Tabel 4.1. Data Hasil Pengukuran Absorbansi Larutan Standar Besi (Fe) Dengan Spektroskopi Serapan Atom (SSA)
No. Kadar Besi (Fe) (mg/L)
Absorbansi (A) 1.
2. 3. 4.
0,0000 1,0000 3,0000 4,0000
0,0000 0,0182 0,0568 0,0763
4.1.1.1.Penentuan Kurva Kalibrasi dengan Analisis Regresi Besi (Fe)
y = 0.0191x - 0.0004 R2 = 0.9999
-0.01 0 0.01 0.02 0.03 0.04 0.05 0.06 0.07 0.08 0.09
0 1 2 3 4 5
KADAR BESI (Fe) (mg/L)
[image:73.612.109.470.114.335.2]AB S O RB AN S I ( A ) Series1 Linear (Series1)
Gambar 4.1. Kurva Kalibrasi Larutan Standar Besi (Fe)
Diperolehnya gambar 4.1. dari persamaan garis regresi linear hubungan antara absorban terhadap konsentrasi larutan Standar sebagai berikut :
Dimana
Y = nilai absorban
X = konsentrasi kandungan Besi dalam air gambut.
Nilai Koefisien Korelasi (r) sebesar = 0,999. Hasil ini menunjukkan bahwa antara Kandungan Besi (Fe) dalam konsentrasi absorbansi korelasi positif dan korelasinya sangat erat (R2 = 0,999).
Nilai R2 sebesar 0,999 berarti Kurva pada gambar 4.1. tersebut mempunyai keakuratan dalam menentukan konsentrasi sebesar 99,99%.
Selanjutnya untuk menentukan kandungan logam Besi (Fe) dalam sampel air gambut , dilakukan pengukuran absorban. Data absorban larutan sampel air gambut dapat dilihat pada lampiran 2, untuk perlakuan sampel air gambut sebelum dilakukan penjernihan dengan metode elektrokoagulasi , lampiran 3, untuk perlakuan sampel air gambut dengan metode elektrokoagulasi dan lampiran 4, untuk perlakuan sampel air gambut setelah dilakukan penjernihan dengan metode elektrokoagulasi dengan penambahan larutan tawas 10 ml
(1000 ppm).
4.1.1.2 Penurunan Persamaan Garis Regresi Kadar Analit Besi (Fe) Dengan Metode Kurva Kalibrasi
Hasil Pengukuran larutan Standar Besi (Fe) dari suatu seri Larutan Standar Besi (Fe) diplotkan terhadap Konsentrasi Larutan Standar sehingga diperoleh suatu Kurva Kalibrasi berupa garis lurus linear.
[image:74.612.80.526.573.709.2]Persamaan garis regresi untuk Kurva Kalibrasi ini dapat diturunkan dengan metode least-square dan ditunjukkan pada Tabel berikut :
Tabel 4.2. Data Hasil Penurunan Persamaan Garis Regresi untuk Besi (Fe)
No. X1
(mg/L)
Xi (A) X1 -X Y1 - Y
(
)
2X
Xi −
( )
Yi −Y 2(
X1−X)( )
Yi −YX = 2,0000 4 0000 , 8 4 X = =
∑
Y = 0,037825
4 1513 , 0
4 = =
∑
Y4.1.1.3. Penurunan Persamaan Regresi Besi (Fe)
Persamaan garis regresi untuk kurva kalibrasi dapat diturunkan dari persamaan garis.
Y = a + bx A : Intercept B : Slope
Selanjutnya harga slope dapat ditentukan dengan menggunakan metode Least-Square dengan mensubstitusikan harga-harga yang tercantum pada tabel 4.1.
b =
(
)(
)
(
)
∑
∑
− − − 2 1 1 1 X X X Y Y Xb = 0,01912 10,0000
0,1912 =
Dari persamaan garis = Y = a + bx Maka a = y – bx
= 0,037825 – (0,01912 x 2,0000) = 0,037825 – 0,03824
Jadi persamaan diperoleh : Y = 0,01912x – 0,000415
Untuk : x =0,0000 ; maka y = -0,00415 x =1,0000 ; maka y = 0,018705 x =3,0000 ; maka y = 0,05321 x =4,0000 ; maka y = 0,076065
4.1.1.4.Penentuan Kadar Analit Besi (Fe)
Analit dapat ditentukan dengan menggunakan metode Kurva Kalibrasi dengan mensubstitusikan nilai y (absorbansi) diperoleh dari hasil pengukuran, terhadap garis regresi dan kurva kalibrasi .
Dari data hasil pengukuran absorbansi terhadap sampel diperoleh serapan (A) sebagai berikut :
Y1 = 0,0263 Y2 = 0,0266 Y3 = 0,0267
Dengan mensubtitusikan nilai Y (absorbansi) ke persamaan regresi maka : Y = 0,01912 x – 0,000415
X3 = 1,418148536 +
∑
Xi= 4,2282949779Dengan demikian kandungan kadar Besi ( Fe) dari sample tersebut adalah :
40943166 , 1 3 228294979 , 4
3 = =
=
∑
− Xi
X
2 1 X)
X
( − − = 0,000148928
2 2 X)
X
( − − = 0,000012157
2 3 X)
X
( − − = 0,000075983
__________________ +
) (
∑
Xi−X− = 0,000237068Maka : 010887332 , 0 2 000237068 , 0 1 ) ( 2 = = − − =
∑
− n X Xi SDiperoleh harga : Sx = 0,006285804 3 010887332 , 0 . . = = n S
Dari data hasil distribusi t student untuk n=3, derajat kebebasan (dk) = n-1 =2 Untuk derajat kebebasan 95% (P=0,05), nilai t = 4,303
Maka d = t (0,05 ; n-1)
Dari data pengukuran kandungan Besi ( Fe ) dari sample air gambut adalah 1,4094 mg/L + 0,0270
(Data kadar Besi ( Fe ) selengkapnya pada lampiran 5).
4.1.2. Pengukuran Logam Tembaga ( Cu )
Pada pengukuran logam Tembaga ( Cu ) pada air gambut dimulai dengan pengukuran absorbansi standar Tembaga ( Cu ) dengan Spektrofotometri Serapan Atom (SSA).
[image:78.612.87.456.414.546.2]Dari hasil pengukuran absorbansi dari larutan standar Tembaga ( Cu ) diplotkan terhadap konsentrasi larutan standar Tembaga ( Cu ) tertera pada tabel berikut.