Lampiran 1.
Bagan Penelitian
I II III
Ra
Rc
Rb
Rb
Ra
Rc
Rf
Rb
R0
Ra
Re
Rc
R0
Re
Rd
Rf
Rd
Re
Rf
R0
Rd
B
U S
Lampiran 2 : Tinggi tanaman 4 minggu setelah tanam (mst)
Perlakuan Ulangan I Ulangan II Ulangan III Total Rataan
R0 42,80 39,40 47,60 129,80 43,27
Tinggi tanaman 8 minggu setelah tanam (mst)
Perlakuan Ulangan I Ulangan II Ulangan III Total Rataan
Tinggi tanaman 12 minggu setelah tanam (mst)
Perlakuan Ulangan I Ulangan II Ulangan III Total Rataan
R0 65,00 55,10 55,80 175,90 58,63
Tinggi tanaman 16 minggu setelah tanam (mst)
Perlakuan Ulangan I Ulangan II Ulangan III Total Rataan
Tinggi tanaman 20 minggu setelah tanam (mst)
Perlakuan Ulangan I Ulangan II Ulangan III Total Rataan
R0 77,20 75,20 67,20 219,60 73,20
Tinggi tanaman 24 minggu setelah tanam (mst)
Perlakuan Ulangan I Ulangan II Ulangan III Total Rataan
Tinggi tanaman 28 minggu setelah tanam (mst)
Perlakuan Ulangan I Ulangan II Ulangan III Total Rataan
R0 88,1 90,3 73,8 252,2 84,07
Lampiran 3 : Jumlah daun 4 minggu setelah tanam (mst)
Perlakuan Ulangan I Ulangan II Ulangan III Total Rataan
Jumlah daun 8 minggu setelah tanam (mst)
Perlakuan Ulangan I Ulangan II Ulangan III Total Rataan
R0 7 8 8 23 7,67
Jumlah daun 12 minggu setelah tanam (mst)
Perlakuan Ulangan I Ulangan II Ulangan III Total Rataan
Jumlah daun 16 minggu setelah tanam (mst)
Perlakuan Ulangan I Ulangan II Ulangan III Total Rataan
R0 9 9 10 28 9,33
Jumlah daun 20 minggu setelah tanam (mst)
Perlakuan Ulangan I Ulangan II Ulangan III Total Rataan
Jumlah daun 24 minggu setelah tanam (mst)
Perlakuan Ulangan I Ulangan II Ulangan III Total Rataan
R0 9 9 10 28 9,33
Jumlah daun 28 minggu setelah tanam (mst)
Perlakuan Ulangan I Ulangan II Ulangan III Total Rataan
Lampiran 4 : Lilit batang 4 minggu setelah tanam (mst)
Perlakuan Ulangan I Ulangan II Ulangan III Total Rataan
R0 4,50 3,60 3,60 11,70 3,90
Lilit batang 8 minggu setelah tanam (mst)
Perlakuan Ulangan I Ulangan II Ulangan III Total Rataan
Lilit batang 12 minggu setelah tanam (mst)
Perlakuan Ulangan I Ulangan II Ulangan III Total Rataan
R0 7,80 6,10 6,10 20,00 6,67
Lilit batang 16 minggu setelah tanam (mst)
Perlakuan Ulangan I Ulangan II Ulangan III Total Rataan
Lilit batang 20 minggu setelah tanam (mst)
Perlakuan Ulangan I Ulangan II Ulangan III Total Rataan
R0 8,70 8,30 9,10 26,10 8,70
Lilit batang 24 minggu setelah tanam (mst)
Perlakuan Ulangan I Ulangan II Ulangan III Total Rataan
Lilit batang 28 minggu setelah tanam (mst)
Perlakuan Ulangan I Ulangan II Ulangan III Total Rataan
R0 10,90 9,60 10,30 30,80 10,27
Lampiran 5. Luas daun 28 minggu setelah tanam (mst)
Perlakuan Ulangan I Ulangan II Ulangan III Total Rataan
R0 532,04 409,85 467,44 1409,33 469,78 Transformasi data √x + 0,5
Perlakuan Ulangan I Ulangan II Ulangan III Total Rataan
Sidik ragam
Lampiran 6 : Kejadian penyakit dan Keparahan penyakit (%) Ulangan I -Trdpat miselia dabagian rambut akar bagian bawah/ujung akar.
Ra + - -Tanaman sehat
Rb + +
-Trdpat miselia jamur di bagian rambut akar(akar Tersier) -Akar terlihat jarang/sedikit
-Daun ke-3 tidk mmbuka sempurna dan klorosis
Rc +
+
- Trdpat miselia jamur di bagian rambut akar dengan populasi yang cukup rapat. dan daun ke-2 terdapat garis kekuningan/ klorosis.
Rd + - -Tanaman sehat
Re + +
-Daun ke-3 tidak membuka sempurna
-Daun ke-4 bewarna kuning pucat(klorosis)
-Terdapat Miselia jamur
Rf + +
-Trdpat miselia jamur cukup banyak di akar tersier bagian bawah
-Trdpat daun tombak 1
Ulangan II
Perlakuan
Kelas Penyakit
Keparahan
Kejadian
Penyakit
Keterangan
0 1 2 3 4
R0 + +
-Terdapat sedikit miselia jamur di bagian rambut akar
-Daun ke-3,4 berwarna kekuningan dan pucat ( Klorosis)
Ra + - -Tanaman Sehat
Rb +
-
-Daun ketiga mengalami klorosis dan terdapat bercak bergaris pada daun ke-4 dan 5.
Rc + - Tanaman Sehat
Rd + + -Daun ke-3 dan 4 mengalami klorosis
Re + +
-Terdpat miselia jamur cukup banyak di bagian rambut akar
-Daun ke-3 dan ke-4 mengalami klorosis
Rf + + -Daun ke-4 mengalami klorosis
Ulangan III
Perlakuan
Keparahan
Kelas Penyakit Kejadian
Penyakit
Keterangan
0 1 2 3 4
R0 + +
-Trdpat miselia jamur cukup banyak di bagian rambut akar
-Trdpat tubuh buah
-Daun ke-3 dan 4 mengalami klorosis
Ra + +
-Trdpat miselia jamur sedikit di rambut akar
-Daun ke-3 berwarna kuning pucat(Klorosis)
Rb + + -Daun ke-3,4,5 mengalami klorosis
dan bergaris kuning kecoklatan
Rd + +
-Trdpat miselia di bagian ujung-ujung rambut akar
-Daun ke-3 tidak membuka sempurna dan berwarna kekuningan(Klorosis)
Re + -Daun ke-3 dan 4 mengalami
klorosis
Rf + - Tanaman Sehat
Kejadian penyakit (%)
Perlakuan Ulangan I Ulangan II Ulangan III Total Rataan
R0 100,00 100,00 100,00 300,00 100,00
Perlakuan Ulangan I Ulangan II Ulangan III Total Rataan
Dokumentasi peneliti
1. Persiapan penaman bibit kelapa sawit dengan media topsoil + kompos dan pengaplikasian cendawan Ganoderma dan agens antagonis.
3. Pembongkaran bibit kelap sawit untuk melihat tingkat keparahan penyakit
DAFTAR PUSTAKA
Abdullah F., Ilias GNM., Nelson M., Nur AIMZ., dan Kalsom UY. 2003. Disease assessment and the efficacy of Trichoderma as a Biocontrol agent of
Basal Stem Rot of Oil Palms. Research Bulletin Science Putra. 11 : 31-33.
Agrios GN. 2005. Plant Pathology. Fifth Edition. Elsevier Academic Press. USA. 922 p.
Alexopoulus CJ danMims CW. 1996. Introductory Mycology. 4 th Ed. John Willey &Sons Inc, New York.
Alviodinasyari R., Martina A., dan Lestari W. 2015. Pengendalian G. boninense oleh Trichoderma sp. pada kecambah dan bibit kelapa sawit (Elaeis guineensis jacq.) di tanah gambut. FMIPA Vol. 2:1. Binawidya Pekanbaru.
Ariffin D., Idris AS., dan Singh G. 2000. Status of Ganoderma in oil palm. Di dalam: Flood J, Bridge PD, Holderners M. (Editor), Ganoderma Disease of Perenial Crops. CABI Publishing, Wallingford, UK. hlm 49-68. Barnett HL., dan Hunter BB. 1987. Illustrated Genera of Imperfect Fungi. Fourth
Edition. Macmillian Publishing Company. Canada.
Berg G. 2009. Plant–microbe interactions promoting plant growth and health: perspectives for controlled use of microorganisms in Agriculture.AppliedMicrobiology and Biotechnology 84: 11-18.
Basset K, dan Peters RN. 2003. Ganoderma: A Significant RootPathoge
Arborilogical.Com/Articles/GanodeRma.Htm. 8 Juli 2015.
Badan Pusat Statistik (BPS). 2015. Produksi perkebunan besar menurut jenis tanaman http://bps.go.id diakses tanggal 18 Mei 2016.
Breton F, Hasan Y, Hariadi S, Lubis Z, dan De Franqueville H, 2006.Characterization Of Parameters For The Development Of AnEarly Screening Test For Basal Stem Rot Tolerance In Oil PalmProgenies.
Journal Of Oil Palm Research (Special Issue, April2006) 24–36.
Djafaruddin. 2000. Dasar-dasar pengendalian penyakit tanaman. Bumi aksara. Jakarta. Hlm.271.
Flood JP.,Bridge D dan Holdernes M. 2000. Ganoderma diseases of perennial crops. Wallingford. UK, Cabi Publishing, 275 p.
Gandjar I., Samsuridjal W dan Detrasi A. 2006. Mikologi dasar dan terapan. Jakarta: Yayasan Obor Indonesia.
Gao FK., Dai CH dan Liu XZ. 2010. Mechanisms of fungal endophytes in plant protection against pathogens. African Journal of Microbiology Research4: 1346-1351.
Ghimire SR dan Hyde KD. 2004. Fungal Endophyte. In. A.Varma, L. Abbott, D.Werner, R.Hampp Eds. Plant Surface Microbiology. Springer-Verlag Berlin Heidelberg. Pp. 281-292.
Idris AS danAriffin D. 2003. Ganoderma : Penyakit Reput Pangkal Batang dan Kawalannya. Unit Pembangunan Pekebun Kecil dan Pemindahan Teknologi, Bahagian Biologi, Malaysian Palm Oil Board (MPOB), Bangi.
Jing CJ. 2007. Kepatogenan G.boninense pada Kelapa Sawit dan hubungan Biologinya dengan Ganoderma spp. daripada perumah Palma lain. Pusat Pengajian Sains Patologi Tumbuhan, 13-40p. Malaysia.
Julyanda M. 2011.Keragaman dan kelimpahan cendawan pada Rizosfer Kelapa Sawit sehat dan terserang G. boninense. Jurnal penelitian Departemen Proteksi Tanaman Fakultas PertanianInstitut Pertanian Bogor. Bogor. Kristiana R. 2012. Isolasi, identifikasi, skrining dan penghambatan kapang
Rizosfer terhadap F. oxysporum sp lycopersici. Tesis FMIPAUniversitas Indonesia. Depok.
Mohd Su’ud M., Loonis P. dan Idris As.2007. Towards Automatic Recognition And Grading Of Ganoderma Spp. Infection Pattern Using Fuzzy Systems. Int J Biomed Sci 2, 1306-1216.
Naher L., Yusuf UK, Siddiquee S, Ferdous J dan Rahman MA. 2012. Effect of media on growth and antagonistic activity of selected Trichoderma strains against Ganoderma.African Journal of Microbiology Research Vol. 6(48), pp. 7449-7453.
Naher L, Yusuf UK., Ismail A., Tan SG danMondal MMA. 2013. Ecological status of Ganoderma and Basal Stem Root Disease of Oil Palms (Elaeis Guineensis Jacq). AJCS. 7(11):1723–1727.
Paterson RRM. 2007. Ganoderma disease of Oil Palm – a white rot perspective necessary for integrated control. Crop protection26, 1369-1376.
Prasetyo AE, Susanto A dan Utomo C. 2008. Metode penghindaran penyakit busuk pangkal batang kelapa sawit (Ganoderma boninense) dengan sistem lubang tanam besar. Jurnal penelitian kelapa sawit. 16(2):77-86 Pusat Penelitian Kelapa Sawit. Medan.
Pratiwi E, Hasanah U dan Idramsyah. 2014. Identifikasi Senyawa Metabolit Sekunder Pada Jamur Endofit Dari Tumbuhan Raru (Cotylelobium Melanoxylon). Prosiding Seminar Nasional Biologi. FMIPA, Universitas Negeri Medan, Medan.
Priyatno TP. 2012. Balai besar penelitian dan pengembangan Bioteknologi dan sumberdaya Genetik Pertanian. Badan Litbang Pertanian. edisi 5-11 september 2012 no.3472 tahun X1III. Bogor
Puspitasari D., Rimbawanto A dan Hidayati N. 2009. Karakteristik morfologi dan verifikasi DNA Ganoderma philippii penyebab Busuk Akar Acacia mangium. Balai Besar Penelitian Bioteknologi dan Pemuliaan Tanaman Hutan. Jurnal Pemuliaan Tanaman Hutan. Vol. 3 No. 2, 83-94.
Purwanto R. 2008. Peranan Mikroorganisme Endofit sebagai PenghasilAntibiotik. www.kabarindonesia.com. Diakses 8 Agustus 2015.
PT. Socfindo. 2008. Petunjuk teknis penanganan kecambah dan pembibitan Kelapa Sawit. PT. Socfindo IndonesiaOil Palm Seed Variety. Sumatera Utara. Medan.
Risanda D. 2008. Pengembangan teknik inokulasi buatan Ganoderma Boninense Pat. Pada Bibit Kelapa Sawit (Elaeis Guineensis Jacq.). Skripsi. Fakultas Pertanian. Institut Pertanian Bogor. Bogor.
Rusdiana O., Fakuara Y., Kusmana C dan Hidayat Y. 2000. Respon pertumbuhan akar tanaman sengon (Paraserienthes falcataria) terhadap kepadatan dan kandungan air tanah podsolik merah kuning. Jurnal Manajemen Hutan Tropika 6(2):45-53.
Semangun H. 2000. Penyakit-Penyakit Tanaman Perkebunan Di Indonesia. Gadjah Mada University Press. Yogyakarta. 150-161p.
Simarmata R. 2007. Isolasi MikrobaEndofitik dari Tanaman Obat Sambung Nyawa Gynura Procumbens) dan Analisis Potensinya sebagai Antimikroba. Jurnal Penelitian Hayati 13 : 85-90.
Steel RGD danTorrie JH. 1993. Prinsip dan Prosedur Statistika (Pendekatan Biometrik) Penerjemah B Sumantri. Gramedia Pustaka Utama. Jakarta. Suciatmih. 2001.Test of lignin and cellulose decompositionand phosphate
solubilization by soil fungi of GunungHalimun. Berita Biologi 6(5), 685-690. Edisi Khusus Biodivertsitas Taman Nasional Gunung Halimun. Susanto A. 2002. Kajian pengendalian hayati Ganoderma boninense Pat.
penyebab Penyakit Busuk Pangkal Batang Kelapa Sawit. Disertasi. Fakultas Pasca Sarjana, Institut Pertanian Bogor. Bogor.
Susanto A, Sudharto P dan Daisy T. 2002. Hiperparasitisme beberapa Agens Biokontrol terhadap G. boninense penyebab Penyakit Busuk Pangkal Batang Kelapa Sawit. Jurnal Fitopatology Indonesia. 9(2):39-46.
Susanto A., Ginting PA., Surianto dan Prasetyo AE., 2008. Pola penyebaran Ganoderma boninense Pat. Pada perkebunan Kelapa Sawit (Elaeis Guineensis Jacq.) di lahan gambut. Studi kasus di PT. Anak Tasik Labuhan Batu Sumatera Utara. Jurnal Penelitian Kelapa Sawit. Medan. Susanto A. 2011. Ganoderma diperkebunan Kelapa Sawit dari waktu ke waktu.
Simposium Nasional dan Lokakarya : Sebagai Patogen Penyakit Tanaman & Bahan Baku Obat Tradisional. Bogor.
Susanto A., Prasetyo AE dan Wening S. 2013. Laju Infeksi Ganoderma pada Empat Kelas Tekstur Tanah. Jurnal Fitopatologi Indonesia. 9(2) April 2013 hlm: 39-46.
Syafi S. 2008. Respons Morfologis dan Fisiologis Bibit Berbagai Genotipe Jarak Pagar (Jatropha curcas L.) terhadap Cekaman Kekeringan. Tesis. IPB. Bogor.
Tambunan RR., Elfina Y dan Ali M. 2014. Efek bahan pembawa pada beberapa suhu pengeringan Biofungisida pelet T. pseudokoningiirifai terhadap jamur G. boninense pat secara in vitro. Fakultas Pertanian Universitas Riau. Riau.
Yulianti T. 2012. Menggali Potensi Endofit untuk Meningkatkan Kesehatan Tanaman Tebu Mendukung Peningkatan Produksi Gula. Balai Penelitian Tanaman Pemanis dan Serat Vol. 11:2. 111 – 122. Malang.
Worang RL. 2003. Fungi Endofit sebagai penghasilAntibiotika. Makalah Pengantar Falsafah Sains Program Pasca sarjana Institut Pertanian Bogor. http//rantje_worang.com. Diakses 23 maret 2015.
BAHAN DAN METODE PENELITIAN
Tempat dan waktu penelitian
Penelitiandilaksanakan diRumah KacaFakultasPertanian, UniversitasSumatera Utara, Medandengan ketinggian tempat ±25 meterdiatas permukaan lautmulai bulanJuni 2015sampai dengan Januari 2016.
Bahan dan alat
Bahan yang digunakan dalam penelitian adalah bibittanamankelapa sawit berumur 4 bulan varietas DxP unggul yang berasal dari PT. Socfindo, isolatcendawanendofit, biakanmurniGanoderma,media Malt Agar, Potato
Dextrose Agar(PDA), Rubber Wood Block (RWB), polibeg ukuran 10
kg,danmethyl blue.
Alat yang digunakan adalah meteran,timbangananalitik,hot plate, mikroskopcampound,autoclave, oven, inkubator,danlaminar airflow(LAF).
Metodepenelitian
Penelitian inimenggunakanRancanganAcakKelompok (RAK) non faktorialyaitu :
R0=kontrol (tanpa cendawan endofit)
Ra=Aspergillus sp1 + Ganoderma
Rb=Aspergillus sp2 + Ganoderma
Rc=Rhopalomyces sp + Ganoderma
Rd = Chrysosporium sp+ Ganoderma
Re = Gongronella sp1 + Ganoderma
Rf = Gongronella sp2 + Ganoderma
R0 Ra Rb Rc Rd Re Rf Jumlahulangan : 3 ulangan
Ukuran polibeg : 45 cm x 15 cm Jumlahtanaman/polibeg :1tanaman Jumlahtanamanseluruhnya : 21tanaman Jarakantarpolibeg : 40 cm Jarakantarblok : 50 cm
Analisis data
Datahasilpenelitiandianalisisdenganmenggunakansidikragamdenganmodel linear aditifsebagaiberikut :
Yij = µ + Ti + εij;i = 1,2,3,4 ; j = 1,2,3,4,5,6 Dimana:
Yij : Responataunilaipengamatandariperlakuanjenisjamurendofitke-i dan
ulanganke-j. µ : Nilai tengah umum Ti : Pengaruh perlakuan ke-i
εij : Pengaruh galat percobaan dari perlakuan ke-i dan ulangan ke-j
PELAKSANAAN PENELITIAN Eksplorasi cendawan endofit
Eksplorasi dilakukan dengan mengambil sampel akar tanaman kelapa sawit yang sehat darikebun PTPN II Tandem Hulu, Provinsi Sumatera Utara, dengan ketinggian tempat ± 30 meter di atas permukaan laut dan kedalaman 15-30 cm.Akar yang diambil dicuci dengan air mengalir selama 15 menit, kemudian direndam dengan HgCl 0,1% selama 1 menit kemudian dibilas dengan air steril. Selanjutnya akar direndam dengan alkohol 96% selama 1 menit dan dibilas dengan air steril setalah itu akar direndam dengan air steril selama 15 menit sebanyak dua kali tahap perendaman. Akar yang telah disterilisasi permukaan kemudian ditanam dalam media PDA selama 2 hari untuk mendeteksi kontaminan(Naheret al.,2012). Akar yang bebas kontaminan digunakan untuk eksplorasi jamur endofit.
Perbanyakan Ganoderma
Isolat Ganoderma didapatkan dari koleksi Laboratorium Fakultas Pertanian Universitas Sumatera Utara,kemudian diperbanyak menggunakan media Ekstra Malt Agar. Setelah tumbuh kemudian dibiakkan kembali ke RWB untuk pengaplikasian ke lapangan (Susantoet al., 2008).
Perbanyakan agens antagonis
Persiapan media tanam kelapa sawit
Media untuk penanaman bibit kelapa sawit terdiri dari campuran topsoil tanah Ultisol Desa Mancang Kabupaten Langkat sebanyak 8 kg/polibeg. Kemudian kompos TKKS sebanyak 500 g/polibeg. Pemupukan dasar NPKMg sebanyak 3g/polibeg yang diberikan dengan cara disebar pada media tanam(PT. Socfindo, 2008).
Identifikasi cendawan endofit dan Ganoderma
Biakan murni cendawan diamati menggunakan mikroskop dengan mengambil sampel biakan menggunakan selotip transparan. Sample miselium yang terambil kemudian diletakkan pada objek glass yang telah ditetesi dengan methyl blue (Susanto et al., 2008). Kemudian di identifikasi secara makroskopis dan mikroskopis dengan menggunakan buku panduan klasifikasi menurut Barnett and Hunter (1987).
Inokulasi Ganoderma
Cendawan Ganodermadiinokulasikan sebelum dilakukan penanaman bibit kelapa sawit. Inokulasi dengan cara memasukkan RWB kedalam tanah dengan jarak 10 cm dari dasar polibeg kemudian ditambah lapisan tanah di atasnya. Keadaan ini dibiarkan selama 3 hari (Alviodinasyari et al., 2015).
Penanaman bibit kelapa sawit
Inokulasi agens antagonis
Inokulasi agens antagonis dilakukan secara bersamaan pada penanaman bibit tanaman kelapa sawit dengan jamur endofit dicampur bahan pembawa berupazeolit dengan perbandingan 2 : 3 sebanyak 50 g. Pengaplikasian dengan cara menaburkan cendawan antagonis disekitar perakaran tanaman(Tambunan et al., 2014).
Pemeliharaan Tanaman
Penyiraman
Dilakukan setiap pagi dan sore hari selama mulai dari penanaman hingga panen.
Penyiangan gulma
Kegiatan ini dilakukan apabila didapati gulma yang tumbuh disekitar tanaman. Penyiangan dilakukan dengan cara dicabut secara manual.
Pemupukan
Pupuk yang digunakan adalah pupuk anorganik NPKMg (15:15:6:4). Aplikasi dilakukan dari bibit berumur 4 bulan dengan cara ditabur dipermukaan tanah. Adapun dosis yang diberikan adalah sesuai rekomendasi dari PT. Socfindo sebagai berikut.
Tabel 1. Dosis pemupukan
Bulan Minggu setelah tanam NPKMg (g/polibeg)
Peubah amatan Tinggi tanaman (cm)
Pengukuran tinggi tanaman dilakukan dengan menggunakan meteran, diamati pada4, 8, 12, 16, 20, 24 dan 28minggu setelah tanam (mst).
Lilit batang (cm)
Pengukuran lilit batang tanaman dilakukan dengan mengukur lingkaran batang yangdiamati pada 4, 8, 12, 16, 20, 24 dan 28mst.
Jumlah daun (helai)
Penghitungan jumlah daun tanaman dilakukan dengan cara menghitung jumlah daun yang tumbuh pada tiap 4, 8, 12, 16, 20,24 dan 28mst.
Luas daun tanaman (cm2)
Pengukuran luas daun tanaman dihitung pada akhir pengamatan yaitu pada 28 mst.
Periode inkubasi (mst)
Diamati setiap minggunya dengan melihat tanaman yang bergejala akibat serangan patogen Ganoderma pada setiap perlakuan.
Kejadian penyakit (%)
Pengamatan kejadian penyakit dilakukandengan menghitung jumlah tanaman terserang akibatGanoderma,yaitu mencatat ciri-ciri yang ditimbulkan seperti klorosis, daun mengering, atau munculnya tubuh buah.Persentase kejadian penyakit dapat dihitung dengan menggunakan rumus:
a
Kp= x 100% b
Keterangan :
Kp: kejadian penyakit
b : total seluruh tanaman Indeks keparahan penyakit (%)
Indeks keparahan penyakit ditentukan dengan menggunakan skala0-4 (Tabel 2; Gambar 1). Selanjutnya keparahan penyakit dihitung dengan menggunakan rumus seperti yang didiskripsikan olehAbdullah et al.,(2003):
∑ (A x B)
Indeks Keparahan Penyakit (IKP) =x 100 ∑B x 4
Dimana :
A = kelas penyakit (0, 1, 2, 3, or 4)
B = jumlah tanaman yang menunjukkan gejala kelas penyakit setiap perlakuan Tabel 2. Tanda dan gejela pada tanaman yang diskor berdasarkan skala penyakit 0-4.
Kelas penyakit Tanda dan gejala infeksi
0 Tanaman sehat dengan daun berwarna hijau, tidak terdapat miselium jamur pada semua bagian tanaman
1 Terdapat massa jamur berwarna putih pada bagian tanaman, dengan atau tanpa daun yang klorosis 2 Terdapat basidioma pada bagian tanaman dengan
1-3 daun klorosis
3 Terdapat formulasi basidioma (tubuh buah) dengan lebih dari 3 daun klorosis
4 Basidioma (tubuh buah) terbentuk dengan baik dan tanaman mati
Histopatologi
HASIL DAN PEMBAHASAN
Hasil eksplorasi diperoleh 6 isolat cendawan endofit yang didapat dari tanaman kelapa sawit sehatdan cendawan Ganoderma. Selanjutnya isolat tersebut diidentifikasi secara makroskopis dan mikroskopis (Tabel 3) dandigunakan dalam penelitian.
Tabel 3. Karakteristik dan identifikasi cendawanGanoderma dan endofit asal akar tanaman kelapa sawit.
Kode
isolat Genus Sumber sampel Karakteristik Makro-/Mikroskopis R0 Ganoderma sp Koleksi
Laboratorium Penyakit Tumbuhan
Fakultas Pertanian USU
Koloni jamur berwarna putih dan tipis, tepi kolonihalus. Pertumbuhan koloni cepat, Hifa tidak bersekat, reproduksi seksual dengan basidiospore, terdapat basidium dengan tiga tonjolan sterigma. Tangkai basidium ramping dan tidak bercabang.
Ra Aspergillus sp1. Kebun PTPN II Tandem Hulu
Permukaan koloni berwarna putih dan tebal, tepi koloni teratur dan melingkar. Hifa tidak bersekat, konidiofor panjang dan tidak bercabang,ujung konidiofor membengkak atau disebut vesikel dan tempatmelekatnya kumpulan fialid/konidia,Konidia berbentuk bulatdan berwarna hitam.
Rb Aspergillus sp2. Kebun PTPN II Tandem Hulu
Permukaan koloni berwarna putih dengan bintik warna hijau yang menyebar dan halus, pola pertumbuhan tidak teratur. Pada bagian belakang koloni berwarna kekuningan. Hifa tidak bersekat, konidiofor hialin panjang dan tidak bercabang, ujung konidiofor membengkak atau disebut vesikel dan tempat melekatnya kumpulan fialid/konidia, Konidia berbentuk bulat dan tidak berwarna
Rc Rhopalomyces sp.
Kebun PTPN II Tandem Hulu
Warna koloni putih, tebal, permukaannya sedikit kasar dan bergelombang, pertumbuhannya merata dan melingkar kemudian teratur. Hifa bersekat, konidiofor tegak, ramping, sederhana, di ujung konidia membesar tempat
Warna miselium putih mengembang dibagian tengah seperti kapas dan halus, permukaan koloni bergelombang, ujung hifanya teratur dan melekat dipermukaan media. Struktur hifa bersekat, konidiofor pendek dan konidiamelekat di ujung konidiofor, konidia berbentuk bulat agak lonjong seperti buah pir.
Re Gongronella sp1.
Kebun PTPN II Tandem Hulu
Warna koloni putih, halus dan berwarna gelap di tengah koloni, pertumbuhannya cepat, pola pertumbuhan merata dan ujung koloni bergerigi,dapat merubah warna media PDA menjadi merah
muda. Struktur hifanya
tidakbersekat, sporangiofornyatidak bercabang, kolumela, bulat dan hialin berada di ujungsporangiofor, danspora berbentuk bulat dan hialin. Rf Gongronella
sp2.
Kebun PTPN II Tandem Hulu
Warna koloni putih,halus dan awal pertumbuhan tipis kemudian menebal, pertumbuhannya cepat dalam 6 hari sudah dapat memenuhi cawan petri, semakin tua koloni berwarna kehitaman. Struktur hifanyatidakbersekat,
sporangiofornyatidakbercabang, kolumelabulat dan hialin beradadi ujung sporangiofor, sporangium bulat yangberisi sporadidalamnya, spora berbentuk bulat dan hialin.
Rb
Tinggi tanaman (cm), jumlah daun (helai) dan dan lilit batang (cm).
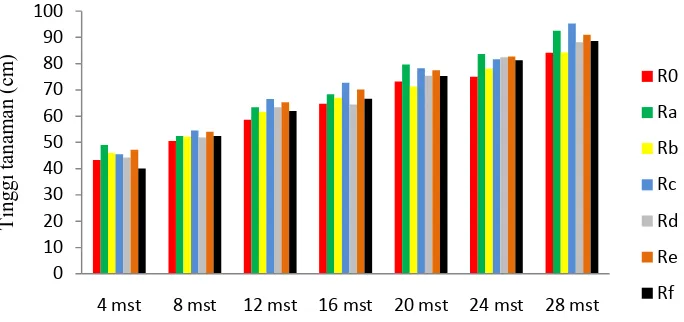
Berdasarkan hasilanalisissidik ragam tinggi tanaman menunjukkan bahwa pemberian cendawan endofit berbeda tidak nyata pada 4 sampai28 minggu setelah tanam (mst). Tinggi tanaman 4 sampai 28 mst dapat dilihat pada Gambar 3dan Lampiran 2.
Rd
Re
Gambar 3.Perbedaan pemberian cendawan endofit terhadap tinggi tanaman kelapa sawit.
Keterangan:Perlakuan R0 (Tanpa endofit), Ra (Aspergillus sp1), Rb(Aspergillus sp2), Rc (Rhopalomyces sp), Rd (Chrysosporium sp), Re (Gongronella sp1), Rf (Gongronella sp2).
Dari Gambar 3 terlihat bahwa rataan tinggi tanaman menunjukkan berbeda tidak nyata, dengan tanaman tertinggi terdapat pada 28 mst pada perlakuan Rc (Rhopalomyces sp + Ganoderma) yaitu 95,23 cm dan terendah ialah terdapat pada perlakuan kontrol (R0) (Tanpa endofit) yaitu 84,07 cm (Lampiran 2). Selama 28 mst belum menunjukkan adanya tanaman yang kerdil akibat infeksi patogen, di karenakan infeksi Ganodermayang bersifat lambat, sehingga gejala pada tahap awal pembibitan tidak begitu terlihat jelas secara visual terutama pada tinggi tanaman. Seperti pernyataan dari Basset dan Peters (2003); Mohd Su’ud et al. (2007), menjelaskan bahwaGanoderma mampu menyebabkan penyakit pada tanaman perkebunan yang serangannya baru diketahui ketika tingkat infeksi sudah kritis dan tanaman sudah sulit diselamatkan.
Tinggi tanaman dipengaruhi oleh pemberian cendawan endofit, disebabkan endofit merupakan biofertilizer bagi tanaman dan memiliki senyawa yang bisa bersifat toksik bagi patogen. Djafarudin (2000); Kristiana (2012)
0
Pengamatan per minggu setelah tanam (mst)
mengungkapkan bahwa cendawan endofit dapat mengeluarkan senyawa toksin seperti aflatoksin, aspergilin dan fumigatin serta menghasilkan agens antifungi volatil sehingga dapat menghambat perkembangan pathogen tanah. Tanaman dapat dilihat pada Gambar 4 berikut ini.
Keterangan : R0 (Tanpa endofit), Ra (Aspergillus sp1), Rb (Aspergillus sp2), Rc (Rhopalomyces sp), Rd (Chrysosporium sp), Re (Gongronella sp1), Rf (Gongronella sp2).
Gambar 4terlihat bahwa pengaplikasian cendawan endofit memiliki pertumbuhan tinggi yang hampir sama, sedangkan tanpa perlakuan cendawan endofit (R0) terlihat lebih pendek. Hal ini di karenakan pemberian cendawan endofit memberikan pengaruh terhadap pertumbuhan tinggi tanaman.Menurut Yulianti (2012), beberapa jenis cendawan endofit memilki kemampuan sebagai penetral kontaminan tanah sehingga meningkatkan fitoremidiasi, dan sebagai agens biokontrol. Hal yang sama juga dinyatakan oleh Pratiwi (2014), bahwa kemampuan menghambat cendawan endofit karena mampu menghasilkan senyawa aktif yang berpotensi sebagai antimikroba.
tanam (mst). Jumlah daun 4 sampai 28 mst dapat dilihat pada Gambar 5Lampiran 3.
Gambar 5. Perbedaan pemberian cendawan endofit terhadap jumlah daun tanaman kelapa sawit.
Keterangan : R0 (Tanpa endofit), Ra (Aspergillus sp1), Rb(Aspergillus sp2), Rc (Rhopalomyces sp), Rd (Chrysosporium sp), Re (Gongronella sp1), Rf (Gongronella sp2).
Dari Gambar 5 terlihat bahwa jumlah daun menunjukkan berbeda tidak nyata, dengan jumlah daun terbanyak pada 16 dan 24 mst yaitu pada perlakuan Rf ( Gongronella sp2 + Ganoderma) yaitu 11,33 helai dan Rd (Chrysosporium sp + Ganoderma) yaitu 11,33 helai (Lampiran 3). Sedangkan jumlah daun terendah pada 16 dan 24 mst ialah pada perlakuan kontrol (R0) (Tanpa endofit) yaitu 9,33 helai.
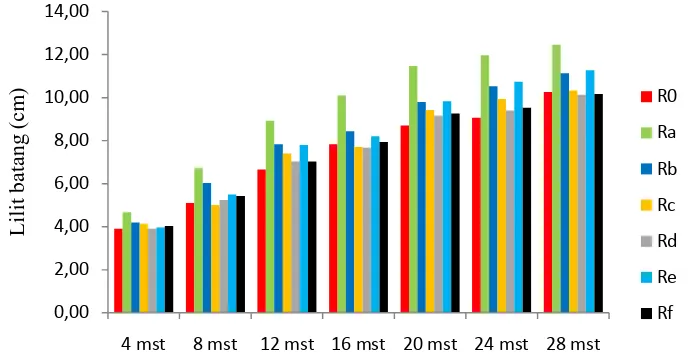
Berdasarkan hasilsidik ragam pemberian cendawan endofit terhadap lilit batang pada 4 sampai 28minggu setelah tanam (mst) menunjukkan berbeda tidak nyata. Lilit batang tanaman 4 sampai 28mstdapat dilihat pada Gambar 6Lampiran 4.
Pengamatan jumlah daun per minggu setelah tanam (mst)
Gambar 6.Perbedaan pemberian cendawan endofit terhadap lilit batang tanaman kelapa sawit.
Keterangan :R0 (Tanpa endofit), Ra (Aspergillus sp1), Rb(Aspergillus sp2), Rc (Rhopalomyces sp), Rd (Chrysosporium sp), Re (Gongronella sp1), Rf (Gongronella sp2).
Dari Gambar 6terlihat bahwa pertambahan lilit batang mulai 4 sampai 28 mst tetap meningkat secara kualitatif, terutama pada perlakuan Ra (Aspergillus sp1 + Ganoderma) yang merupakan lilit batang tertinggi yaitu 12,47 cm. Namun berbeda tidak nyata pada perlakuan lainnya. Sedangkan lilit batang terendah pada 28 mst ialah perlakuan Rd (Chrysosporium sp + Ganoderma) yaitu 10,13 cm (Lampiran 4).
Hasil pengamatan menunjukkan bahwa pemberian cendawan endofit terhadap infeksi Ganodermabelum terlalu signifikan dalam mempengaruhi faktor pertumbuhan tanaman seperti tinggi tanaman, jumlah daun hingga lilit batang. Hal ini dikarenakan periode yang pendek dalam penelitian menjadi salah satu faktor yang kemungkinan belum secara nyata memberikan pengaruh cendawan endofit terhadap pertumbuhan tanaman kelapa sawit yang terinfeksi pathogen(Risanda, 2008). Karena semakin lama periode perlakuan maka semakin besar penghambatan pertumbuhan yang terjadi pada tanaman. Susanto (2011),
0,00
Pengamatan per minggu setelah tanam (mst)
menyatakan bahwa gejala awal penyakit sulit dideteksi karena perkembangannya yang lambat dan dikarenakan gejala eksternal berbeda dengan gejala internal. Hal ini dikarenakan penyakit busuk akar merupakan jenis penyakit monosiklik yang lambat perkembangannya, sehingga gejala awal serangan sulit untuk diketahui apabila tidak melihat kondisi perakarannya (Puspitasariet al. 2009).
Luas daun tanaman kelapa sawit (cm2)
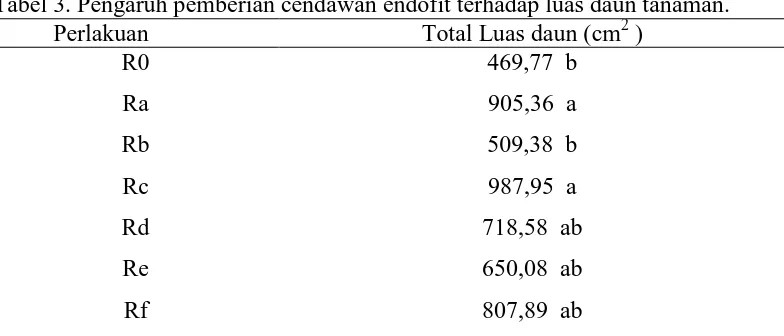
Berdasarkan hasilanalisis sidik ragam luas daun tanaman menunjukkan bahwa pemberian cendawan endofit berpengaruh nyata terhadap luas daun tanaman. Hal ini dapat dilihat pada Tabel 3 Lampiran 5.
Tabel 3. Pengaruh pemberian cendawan endofit terhadap luas daun tanaman.
Perlakuan Total Luas daun (cm2 )
yaitu 650,08 cm2dan luas daun tanaman terkecil ialah pada perlakuan R0(Tanpa endofit) yaitu 469,77 cm2.
Tanaman dengan tanpa pemberian cendawan endofit menunjukkan pertumbuhan daun yang lebih sempit. Hal ini karena proses penyerapan unsur hara melalui akar terganggu akibat adanya infeksi dari patogen, sehingga serapan hara untuk melakukan fotosintesis terhambat dan mempengaruhi luasan permukaan daun kelapa sawit.Susanto et al. (2002), menyatakan akibat kurangnya unsur hara yang diangkut dari akar menuju daun, sehingga proses fotosintesis dan sintesis klorofil terganggu, akibatnya daun tidak sempurna dan dapat menyebabkan kematian pada tanaman.Selengkapnya dapat dilihat pada Gambar 7 berikut ini.
Gambar 7. Pengaruh pemberian cendawan endofit terhadap luas daun tanaman kelapa sawit. R0 (Tanpa endofit), Ra (Aspergillus sp1), Rb (Aspergillus sp2), Rc (Rhopalomyces sp), Rd (Chrysosporium sp), Re (Gongronella sp1), Rf (Gongronella sp2).
Gambar 4 memperlihatkan perbedaan yang cukup jelas dari masing-masing daun tanaman yang diberi perlakuan cendawan endofit terhadap infeksi Ganoderma. Pada tanaman muda gejala eksternal ditandai dengan menguningnya sebagian besar daun atau pola belang dibeberapa bagian daun yang diikuti
klorosis. Daun ukurannya lebih kecil daripada daun normal dan mengalami nekrosis pada bagian ujungnya. Selain itu tanaman yang terserang juga kelihatan lebih pucat dari tanaman lain yang ada disekitarnya (Ariffin et al. 2000; Sinaga et al. 2003; Yanti & Susanto 2004). Hal ini dikarenakan cendawan endofit memilikiperanan penting sebagai biofertilizer terhadap tanaman, sehingga dapat memperbaiki penyerapan unsur hara maupun asimilasi metabolit dalam proses fotosintesis. Menurut Rusdiana et al.,(2000), akar merupakan pintu masuk bagi hara dan air dari tanah yang sangat penting untuk proses fisiologi tanaman. Jika fungsi bagian akar terganggu maka pertumbuhan bagian pucuk, warna daun bahkan luas permukaan daunnya akan terganggu pula. Efek ini akan segera menjalar ke sistem respirasi pada daun karena unsur hara yang dibutuhkan oleh tanaman menjadi sangat berkurang.
Periode inkubasi (mst), Kejadian penyakit (%), dan Keparahan penyakit (%)
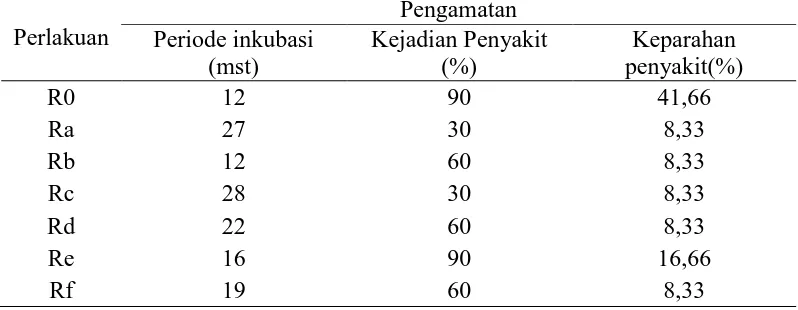
Respon pemberian cendawan endofit dalam menekan infeksi Ganoderma terhadap periode inkubasi, kejadian penyakit dan keparahan penyakit dapat dilihat pada Tabel 4 Lampiran 6.
Tabel 4. Respon pemberian cendawan endofit terhadap periode inkubasi, kejadian penyakit, dan keparahan penyakitbusuk pangkal batang.
Keterangan : R0 (Tanpa endofit), Ra(Aspergillus sp1), Rb (Aspergillus sp2),Rc (Rhopalomyces sp), Rd (Chrysosporium sp), Re (Gongronella sp1), Rf (Gongronella sp2).
Gambar8. A: daun klorosis, B: daun sehat, C: daun nekrosis dan D: munculnya tubuh buah pada pangkal batang.
Dari Gambar 8 menunjukkan gejala serangan penyakit pada bibit kelapa sawit terjadi sebagian besar menunjukkan perubahan warna daun menjadi kuning dan pucat, diikuti dengan adanya nekrosis (kematian jaringan) pada pertulangan daun.Hal yang sama di laporkan oleh Susanto et al. (2002) menyatakan bahwa sebagian besar bibit kelapa sawit menunjukkan perubahan warna dan nekrosis pada daun selanjutnya diikuti pertumbuhan tubuh buah Ganoderma yang muncul pada pangkal batang kemudian bibit kelapa sawit mengalami kematian.
Gejala visual penyakit busuk pangkal batang pada daun terlihat ialah klorosis dan nekrosis pada helaian daun, sedangkan pada pangkal batang muncul tubuh buah Ganoderma (Gambar 8). Hal ini membuktikan bahwa infeksi Ganodermatidak hanya terjadi pada tanaman tua saja, tetapi juga dapat terjadi pada bibit atau tanaman muda kelapa sawit. Risanda (2008) mengungkapkan bahwa gangguan fisiologis dari patogen terhadap daun kelapa sawit mengalami perubahan warna (klorosis) dan diikuti dengan kematian jaringan (nekrosis). Suciatmih (2001) melaporkan bahwa cendawan endofit merupakan salah satu mikroba tanah yang mempunyai peranan besar pada siklus makanan yang selanjutnya akan menentukan kesuburan tanah dan pertumbuhan tanaman.
Hasil sidik ragam kejadian dan keparahan penyakit menunjukkan bahwa pemberian cendawan endofit berpengaruh tidak nyata (Tabel 4 Lampiran 6). Kejadian penyakit tertinggi terdapat pada perlakuan kontrol (R0) (Tanpa endofit) yaitu 90% dengan tingkat keparahan penyakit yaitu 41,67% dan Re (Gongronella
sp1 + Ganoderma) yaitu 90% dengan keparahan penyakit 16,67% berbeda tidak nyata dengan perlakuan lainnya. Sedangkan yang terendah terdapat pada perlakuan Ra (Aspergillus sp1+ Ganoderma) yaitu 30% dengan keparahan penyakit yaitu 8,33% dan Rc (Rhopalomyces sp + Ganoderma) yaitu 30% dengan tingkat keparahan penyakit yaitu 8,33%.
Tingginya persentase kejadian penyakit disebabkan oleh besarnya tingkat keparahan yang terjadi pada bagian akar tanaman. Hal ini sesuai pernyataan dari Ariffin et al. (2000); Sinaga et al. (2003); Yanti & Susanto (2004); Risanda, (2008) menyebutkan bahwa gejala yang tampak pada daun menandakan bahwa penampang pangkal batang maupun akar telah mengalami kerusakan sebesar ± 50%. Pertumbuhannya terhambat, daun tidak membuka, adanya nekrosis, dan selanjutnya daun akan patah.
menjelaskan bahwa pengamatan gejala serangan penyakit dapat di lihat secara visual tanaman yang sakit dan sehat pada bagian akar tanaman.
Histopatologi
Pengamatan yang dilakukan secara mikroskopis pada akar yang terserang Ganoderma ditunjukkan oleh adanya bercak nekrotik berwarna coklat dan
menghitam, kemudian meluas seiring dengan perkembangan penyakit (Risanda, 2008). Tahap penyerangan Ganoderma terhadap akar tanaman sehat terjadi melalui penetrasi, infeksi serta kolonisasi. Setelah kontak dengan permukaan akar tanaman,Ganoderma harus menembus dinding sel yang terdiri dari selulosa. Taniwiryono dan Panji (1999) menambahkan bahwa penularan Ganoderma terjadi melalui kontak akar, setelah itu luka pada akar dapat meningkatkan kemungkinan infeksi patogen dari busuk akar. Susanto (2002), menjelaskan bahwa adanya pengaruh umur tanaman, yaitu apabila tanaman semakin dewasa, maka akan membuat sistem perakarannya semakin panjang sehingga tingkat probabilitas terjadinya inokulan dengan inokulum patogen semakin tinggi. Menurut Paterson (2007) ; Shobah (2015), tanaman yang terinfeksi oleh Ganoderma akan terdegradasi ligninnya karena cendawan bersifat lignolitik dan lama kelamaan akan mengalami kematian.
rapuh, jaringan kortikel menjadi berwarna coklat, mudah untuk didisintegrasikan, stele menjadi kehitaman, terkadang pada bagian permukaan sebelah dalam eksodermis ditemukan tanda penyakit berupa hifa berwarna keputihan dan umumnya disertai pembusukkan berwarna coklat muda dengan jalur-jalur tidak teratur yang berwarna lebih gelap. Hasil selengkapnya dapat dilihat pada Gambar 9 berikut ini.
jyfv
Gambar9. A. pangkal batang sehat dan B. Jaringan akar sehat, C. pangkal batang terserang dan D. Jaringan akar terserang .
Dari Gambar 9terlihat jaringan akar yang sehat tidak terdapat miselium patogen maupun bercak nekrotik dan pembusukan pada akar (Gambar 9A dan B). Sedangkan jaringan akar yang sakit akan berubah warna dari putih menjadi coklat bahkan menghitam (Gambar 9C dan D). Penyerapan nutrisi dari akar tanaman akan berpengaruh karna rusaknya jaringan akibat perkembangan patogen di dalam akar. Risanda (2008) mengungkapkan kemampuan patogen untuk hidup dan
D G C
berkembang di dalam jaringan sel tanaman saling berhubungan. Ketika cendawan mampu memanfaatkan bahan-bahan yang berada pada inang (akar tanaman) sebagai food base-nya yang baru, cendawan akan mampu melanjutkan siklus patogenesis hingga menimbulkan kerusakan pada sistem perakaran.
KESIMPULAN DAN SARAN Kesimpulan
1. Hasil eksplorasi diperoleh 6 isolat cendawan endofit yaitu Aspergillus sp1, Aspergillus sp2, Rhopalomyces sp, Chrysosporium sp, Gongronella sp1, Gongronella sp2, yang didapat dari tanaman kelapa sawit.
2. Tinggi tanaman, jumlah daun dan lilit batang pada 4 sampai 28 mst berbeda tidak nyata terhadap pemberian cendawan endofit.
3. Luas daun pada 28 mst berbeda nyata dengan nilai tertinggi pada perlakuan cendawan Rhopalomyces sp yaitu 987.956 cm2 dan Aspergillus sp1 yaitu 905.360 cm2.
4. Masa inkubasi terpendek terjadi yaitu 12 mst pada perlakuan tanpa endofit (R0) dan Aspergillus sp2 (Rb). Sedangkan masa inkubasi terlama pada perlakuan Rhopalomyces sp (Rc) yaitu 28 mstdan Aspergillus sp1 (Ra) yaitu 27 mst.
5. Tingkat kejadian dan keparahan penyakit berbeda tidak nyata, nilai tertinggi pada perlakuan tanpa endofit (R0) yaitu 90% dengan keparahan penyakit 41% dan Gongronella sp1 (Re) yaitu 90% dengan keparahan penyakit 16%.
Saran
TINJAUAN PUSTAKA
Biologi penyakit busuk pangkal batang (Ganodermaspp.) Kingdom : Myceteae
Divisio : Eumycophyta Class : Basidiomycetes Ordo : Aphyllophorales Famili : Ganodermataceae Genus : Ganoderma
Spesies : Ganoderma spp. (Alexopolus and Mims, 1996).
Basidiokarp yang dibentuk awalnya berukuran kecil, bulat, berwarna putih, dengan pertumbuhan yang cepat hingga membentuk basidiokarp dewasa yang memiliki bentuk, ukuran, dan warna yang variatif. Umumnya basidiokarp berkembang sedikit di atas dan mengelilingi bagian pangkal batang yang sakit. Ukuran basidiokarp yang bertambah besar menunjukkan perkembangan penyakit semakin lanjut dan akhirnya menyebabkan kematian pada tanaman (Ariffinet al., 2000).
Siklus hidup Ganoderma
Ganoderma merupakan cendawan Basidiomycota yang bersifat tular tanah dan sebagai penyebab utama penyakit akar putih pada tanaman berkayu dengan menguraikan lignin. Sebagian besar siklus Ganoderma ada didalam tanah atau jaringan tanaman. Penularan penyakit busuk pangkal batang melalui tiga cara, yaitu kontak akar tanaman dengan sumber inokulum Ganoderma, udara dengan basidiospora, dan inokulum sekunder berupa tunggul tanaman atau inang alternatif (Susanto, 2013).
Ganoderma menghasilkan sporamelalui struktur pembiakan yang disebut basidium. Basidiospora dihasilkan setelah plasmogami, kariogami dan meiosis. Kariogami dan meiosis berlaku dalam basidium dan empat basiodiospora dihasilkan pada setiap basidium(Jing, 2007).
Gejala serangan Ganoderma
Penyakit busuk pangkal batang (BPB) yang disebabkan oleh Ganoderma merupakan penyakit yang penting dalam industri kelapa sawit(Flood et al., 2000). Umumnya, gejala dari BPB akan terlihat setelah 6 sampai 12 bulan setelah infeksi. Pangkal batang kelapa sawit yang terinfeksi akan membusuk sehingga akan tumbang sebelum masa produktif berakhir. Pada daerah endemik, penyakit ini dapat menyerang tanaman dengan umur dua tahun. Penyebab penyakit BPB kelapa sawit di beberapa negara dilaporkan berbeda-beda, yaitu beberapa spesies Ganoderma saprofitik dari kelompok Basidiomycota (Bretonet al.,2006).
Gejala serangan penyakit pada daun bibit kelapa sawit terjadi setelah munculnya tubuh buah pada bulan pertama, sebagian besar bibit menunjukkan pertumbuhan tubuh buah pada pangkal batang yang diikuti dengan nekrosis (kematian jaringan) pada pertulangan daun akibat kurangnya unsur hara yang diangkut dari akar menuju daun, sehingga proses fotosintesis, sintesis klorofil, transfer asimilat terganggu, dan dapat menyebabkan kematian pada bibit kelapa sawit (Susanto et al., 2013).
Secara umum, pada tanaman muda daun pada pelepah tua berwarna kekuningan, kadangkala di pucuk daun menjadi kering atau nekrotik. Akhirnya seluruh daun dan pelepah menjadi layu dan kering. Tanaman yang terserang menunjukkan pertumbuhan yang lemah dan terhambat pertumbuhannya (Idris danAriffin, 2003).
Miselium jamur menyerang tanaman dengan cara mendegradasi lignin dan selulosa. Proses pendegradasi lignin dan selulosa pada serangan lanjut dapat menyebabkan pelapukan kayu dan akar. Adanya miselium jamur didalam bagian
kayu menyebabkan kondisinya mudah terurai dan lapuk (Puspitasariet al., 2009).
Faktor-faktor yang mempengaruhi seranganGanoderma
Penyebaran penyakit BPB telah dilaporkan berlaku pada tanaman kelapa sawit yang ditanam di semua jenis tanah, yaitu tanah pantai, pedalaman, dan gambut. Kejadian dilaporkan lebih serius pada tanaman kelapa sawit yang ditanam di tanah bekas tanaman kelapa sawit dimana tunggul-tunggul dibiarkan tetap berada di lahan tanpa dilakukannya pembongkaran. Sisa jaringan kelapa sawit tertinggal didalam tanah yang berasal dari tanaman(Idris dan Ariffin, 2003).
ini terjadi karena substrat bagi Ganoderma akan semakin tersedia atau inokulum semakin tinggi populasinya (Susanto, 2002).
Pengendalian Ganoderma
Pengendalian penyakit busuk pangkal batang harus dilakukan melalui pendekatan ekologis. Hal ini terbukti dari perbaikan kesehatan tanah melalui teknik budidaya kelapa sawit dengan menggunakan pupuk organik dan kimia secara berimbang memperpanjang produktivitas kelapa sawit dan mencegah melemahnya kekuatan fisik kelapa sawit. Bahkan perbaikan tanah disekitar tanaman yang sakit dapat memulihkan kembali tanaman tersebut dan dapat kembali memberikan hasil yang diharapkan. Nampaknya perawatan yang intensif dapat memperpanjang usia ekonomis kelapa sawit yang tadinya terinfeksi. Aplikasi agens biokontrol seperti Trichoderma, Gliocladium, dan cendawan endofit lainnya juga dapat membantu menghambat perkembangan penyakit tersebut (Priyatno, 2012).
Sanitasi merupakan salah satu usaha yang dapat dilakukan untuk mengurangi inokulum Ganoderma. Tanaman tua yang terserang diracun dan ditumbangkan dengan dibongkar hingga perakaran terangkut ke permukaan. Pangkal batang yang masih berada dalam tanah dikorek dan dikumpulkan untuk dimusnahkan. Lubang yang dikorek kemudian ditimbun dengan tanah baru (Idris dan Ariffin, 2003).
maupun patogen. Mikroorganisme dapat hidup pada kisaran kelembapan udara 70-90%. Derajat keasaman lingkungan, pH substrat sangat penting untuk pertumbuhan jamur, karena enzim-enzim tertentu hanya akan menguraikan suatu substrat sesuai dengan aktivitasnya pada pH tertentu. Umumnya jamur dapat tumbuh pada pH di bawah 7 (Gandjar et al.,2006).
Potensi cendawan endofit
Salah satu organisme penghasil antibiotik salah satunya adalah cendawan endofit. Cendawan endofit biasanya terdapat dalam suatu jaringan seperti daun, ranting atau akar tumbuhan. Cendawan ini dapat menginfeksi tumbuhan sehat pada jaringan tertentu dan mampu menghasilkan mikotoksin, enzim serta antibiotika. Kelompok endofit mampu memproduksi senyawa antibiotik yang aktif melawan bakteri maupun jamur. Asosiasi beberapa endofit dengan tumbuhan inang mampu melindungi tumbuhan inangnya dari beberapa patogen virulen, baik bakteri maupun jamur (Purwanto, 2008).
Cendawan endofit hidup berasosiasi secara simbiosis mutualisme dengan tumbuhan inangnya dan mampu menginfeksi tumbuhan sehat pada jaringan tertentu tanpamenimbulkan tanda adanya infeksi, kemudian menghasilkan enzim danmetabolit sekunder yang dapat bermanfaat bagi fisiologi dan ekologi tumbuhan inang, mikotoksin, dan juga antibiotik yang dimanfaatkan tumbuhan inang untukmelawan penyakit yang ditimbulkan oleh patogen tumbuhan. Sebaliknya, cendawan endofitdapat memperoleh nutrisi untuk melengkapi siklus hidupnya dari tumbuhan inangnya (Pratiwi,2014).
patogen secara langsung melalui senyawa antibiotik dan enzim litik. Perangsangan endofit terhadap tanaman dalampembentukan metabolit sekunder
seperti asamsalisilat, asam jasmonat, dan etilene yangberfungsi dalam pertahanan tanaman terhadapserangan patogen atau yang berfungsi sebagaiantimikroba seperti fitoaleksin.Perangsanganpertumbuhan tanaman sehingga lebih kebal dantahan terhadap serangan patogen.Kolonisasi jaringan tanaman sehingga patogen sulitpenetrasi (Gaoet al.,2010).
Pengendalian hayati dengan pemanfaatan mikroorganisme antagonis merupakan alternatif sebagai pengendalian penyakit tanaman. Pengendalian hayati merupakan perlindungan tanaman dari patogen termasuk penyebaran mikroorganisme antagonis pada saat setelah atau sebelum terjadinya infeksi patogen. Introduksi agens hayati antagonis berpotensi mengendalikan patogen tular tanah, yaitu menekan inokulum, mencegah kolonisasi, melindungi perkecambahan biji dan akar tanaman dari infeksi patogen. Selain itu secara langsung dapat menghambat patogen dengan sekresi antibiotik, berkompetisi terhadap ruang atau nutrisi, menginduksi proses ketahanan tanaman (Agrios, 2005).
hidup bersimbiosis mutualisme, dalam hal ini jamur endofitmendapatkan nutrisi dari hasil metabolisme tanaman dan memproteksi tanamanmelawan serangga, atau jaringan yang patogen, sedangkan tanamanmendapatkan derivat nutrisi dan senyawa aktif yang diperlukan selama hidupnya (Simarmata, 2007).
Mikroorganisme endofitakan mengeluarkan suatu metabolit sekunder yang merupakan senyawa antibiotikitu sendiri. Metabolit sekunder merupakan senyawa yang disintesis oleh suatumikroba, tidak untuk memenuhi kebutuhan primernya (tumbuh dan berkembang)melainkan untuk mempertahankan eksistensinya dalam berinteraksi denganlingkungannya. Metabolit sekunder yang dihasilkan oleh mikroorganisme endofitmerupakan senyawa antibiotik yang mampu melindungi tanaman dari seranganhama insekta, mikroba patogen, sehingga dapatdimanfaatkan sebagai agen biokontrol (Purwanto, 2008).
PENDAHULUAN
Latar belakang
Kelapa sawit (Elaeis guineensisJacq.) merupakan tumbuhan industri penting penghasil Crude Palm Oil (CPO), juga sebagai bahan bakar terbarukan (biodisel). Kebutuhan produksi kelapa sawit meningkat tajam seiring dengan meningkatnya kebutuhan CPO dunia, seperti yang terjadi beberapa tahun terakhir ini. Beberapa tahun kedepan diperkirakan investasi terbesar subsektor perkebunan masih didominasi oleh kelapa sawit dalam tigaaspek yaitu luas total lahan, total produksi CPO, maupun tingkatproduktivitas. Indonesiaadalah produsen kelapa sawit terbesar di dunia.Namun, tingkat produktivitasnya masih lebih rendah dibanding negara lain. Sumatera Utara dengan luas lahan 1,39 juta hektar mampu memproduksi 4,75 juta ton minyak sawit. Produktivitas tersebut bisa lebih meningkat dengan sistem pengelolaan yang lebih baik (BPS, 2015).
Ganoderma merupakan patogen tular tanah yang merupakan parasit fakultatif dengan kisaran inang yang luas dan mempunyai kemampuan saprofit yang tinggi. Patogen ini tergolong ke dalam cendawan akar putih (white rot fungi) yang mampu mendegradasi lignin, selulosa, dan polisakarida lainnya. Patogenisitasnyatidak hanya terjadi pada tanaman tua saja, tetapi juga dapat terjadi pada bibit atau tanaman muda kelapa sawit (Risanda, 2008).
Kondisi penyakit busuk pangkal batang saat ini berbeda dengan kondisi beberapa dekade yang lalu atau pada awal pengusahaan perkebunan kelapa sawit. Perubahan terjadi pada aspek kejadian penyakit dan distribusi, gejala dan patogenisitas, dan epidemi penyakit. Secara umum, penyakit menjadi lebih berat dan laju infeksinya semakin cepat. Distribusi penyakit ini sudah menyebar diseluruh Indonesia, meskipun dengan kejadian penyakit yang bervariasi (Susanto et al., 2013).
Upaya pengendalian dengan menggunakan fungisida sintetik harus dibatasi, karena telah menimbulkan banyak dampak negatif, seperti munculnya ras-ras baru dari patogen yang mempunyai daya virulensi yang lebih tinggi sehingga menjadi lebih tahan terhadap fungisida, terbunuhnya musuh alami yang bersifat menguntungkan serta tersebarnya banyak jenis bahan pencemar dilingkungan hidup sehingga kualitasnya menurun(Tambunan et al., 2014).
mengakibatkan penurunan produksi tanaman (Julyanda, 2011).Salah satu teknik pengendalian yang bisa dilakukan adalah dengan memanfaatkan cendawan endofit. Cendawan endofit adalah mikroorganisme yang hidup didalam jaringan tanaman tanpa menimbulkan efek negatif, dan penghasil enzim yang dapat berpotensi sebagai biokontrol(Berg, 2009).Secara alami merupakan bagian dari tanaman sehat.Cendawan endofit mampu menghasilkan berbagai macam antioksidan, asam fenol dan derivatnya. Senyawa-senyawa tersebut berperan dalam meningkatkan ketahanan tanaman terhadap tekanan luar(Ghimire dan Hyde, 2004).
Senyawa bioaktif yang berasal dari cedawan endofit ada yang berpotensi sebagai antimikroba (menghambat pertumbuhan atau membunuh mikroba-mikroba patogen), contohnya senyawa taksol, zat pengatur tumbuh, serta penghasil enzim hidrolitik seperti amilase, selulase, xilanase, ligninase, dan kitinase. Potensi biologis dari cendawan endofit lainnya ialah sebagai antiimunosupresif, antioksidan, dan antivirus (Pratiwi,2014).
Kemampuan menghambat cendawan endofit memungkinan disebabkan karena mampu menghasilkan metabolit sekunder yang aktif. Secara umum senyawa antimikroba yang dihasilkan oleh cendawan endofitbersifat netral, polar, dan memiliki gugus fenol. Fenol ini mampu mendenaturasikan protein pada dinding dan membran sel jamur (Elfina et al., 2013).
untuk melakukan penelitian menggunakan cendawan endofit pada pembibitan kelapasawit dalam mengendalikan penyakit busuk pangkal batang.
Tujuan penelitian
Adapun tujuan dari penelitian ini adalah untuk mendapatkan cendawanendofitasal tanaman kelapa sawit yang berpotensi sebagai agens biokontrol untuk mengendalikan Ganodermapada pembibitan kelapa sawit.
Hipotesis penelitian
Cendawan endofit asal tanaman yang mampu menghambat perkembangan penyakit busuk pangkal batang pada kelapa sawit.
Kegunaan penelitian
ABSTRAK
RENDI KURNIAWAN. 2016: Cendawan Endofit Asal Tanaman Kelapa Sawit dan Potensinya Sebagai Agens Biokontrol Untuk Mengendalikan Ganoderma spp. dibimbing oleh Mukhtar Iskandar Pinem dan Lisnawita.
Penggunaan mikroorganisme antagonis merupakan salah satu alternatif pencegahan penyakit busuk pangkal batang yang disebabkan oleh Ganoderma spp. pada perkebunan kelapa sawit. Penelitian ini bertujuan untuk mendapatkan cendawan endofit asal tanaman kelapa sawit yang berpotensi sebagai agens biokontrol untuk mengendalikan Ganoderma pada pembibitan kelapa sawit. Penelitian dilaksanakan di Rumah Kaca Fakultas Pertanian USU pada Juni 2015 sampai Januari 2016 menggunakanRancanganAcak Kelompoknon faktorial dengan enam perlakuan yaitu Aspergillus sp1 + Ganoderma, Aspergillus sp2 + Ganoderma, Rhopalomyces sp + Ganoderma, Cunninghamella sp + Ganoderma, Gongronella sp1 + Ganoderma, Gongronella sp2 + Ganoderma dan tiga ulangan. Parameter yang diamati pertambahan tinggi tanaman, lilit batang, jumlah daun, luas daun, periode inkubasi, kejadian penyakit, indeks keparahan penyakit dan histopatologi.
Hasil penelitian menunjukkan bahwa cendawan endofit Aspergillus sp1 dan Rhopalomyces sp berpotensi sebagai agens biokontrol dalam menekan perkembangan Ganoderma pada pembibitan kelapa sawit. Hasil terbaik didapat dengan waktu periode inkubasi terpanjang yaitu 28 mst dengan tingkat kejadian penyakit sebesar 30% dan juga mampu membantu pertumbuhan tinggi, jumlah daun dan luas daun tanaman.
ABSTRACT
RENDI KURNIAWAN. 2016: Original Endophytic Fungus Oil Palm Plant and Its Potentity as Biocontrol Agents to Control Ganoderma spp. supervised by Mukhtar Iskandar Pinem and Lisnawita.
The use of antagonistic microorganisms is one alternative base stem rot disease prevention caused by Ganoderma spp. in oil palm plantations. This purpose of this study was original endophtytic fungal on palm trees as a potential biocontrol agents for control of Ganoderma in oil palm nursery. Research conducted at the Faculty of Agriculture USU Greenhouse in june 2015 to January 2016 using randomized block design non faktorial with six treatments, Aspergillus sp1 + Ganoderma, Aspergillus sp2 + Ganoderma, Rhophalomyces sp + Ganoderma, Cunninghamella sp + Ganoderma, Gongronella sp1 + Ganoderma, Gongronella sp2 + Ganoderma and three replications. The date were analyzed by using analysis of variance followed by Duncan’s Multiple Range Test. The parameters observed accretion plant heigh, girth, number of leaves, leaf area, the incubation period, the incidence of disease, disease severity index and histopathology.
The results showed that endophytic fungi Aspergillus sp1 and Rhopalomyces sp. are potential as biocontrol agents in suppressing the development of Ganoderma in oil palm nursery. The best result were obtained by the farthest incubation period of time which 28 weeks after incubation with an incidence rate of the disease was 30% and it was also able to helped high growth, number of leaves and leaf area of plants.
CENDAWAN ENDOFIT ASAL TANAMAN KELAPA SAWIT DAN POTENSINYA SEBAGAI AGENS BIOKONTROL UNTUK
MENGENDALIKAN Ganodermaspp.
SKRIPSI
Oleh:
RENDI KURNIAWAN
110301032/ AGROEKOTEKNOLOGI
PROGRAM STUDI AGROEKOTEKNOLOGI FAKULTAS PERTANIAN
CENDAWAN ENDOFIT ASAL TANAMAN KELAPA SAWIT DAN POTENSINYA SEBAGAI AGENS BIOKONTROL UNTUK
MENGENDALIKAN Ganodermaspp.
SKRIPSI
Oleh:
RENDI KURNIAWAN
110301032/ AGROEKOTEKNOLOGI
Skripsi Sebagai Salah Syarat Untuk Dapat Memperoleh Gelar Sarjana di Program Studi Agroekoteknologi Fakultas Pertanian
Universitas Sumatera Utara, Medan.
PROGRAM STUDI AGROEKOTEKNOLOGI FAKULTAS PERTANIAN
Judul : Cendawan endofit asal tanaman kelapa sawit dan potensinya sebagai agens biokontrol untuk mengendalikan Ganoderma spp. Nama : Rendi Kurniawan
NIM : 110301032
Program Studi :Agroekoteknologi
Minat : Hama dan Penyakit Tumbuhan
Disetujui Oleh: Komisi Pembimbing
Ir. Mukhtar Iskandar Pinem M. Agr Dr. Lisnawita SP, M.Si Ketua Anggota
Mengetahui,
ABSTRAK
RENDI KURNIAWAN. 2016: Cendawan Endofit Asal Tanaman Kelapa Sawit dan Potensinya Sebagai Agens Biokontrol Untuk Mengendalikan Ganoderma spp. dibimbing oleh Mukhtar Iskandar Pinem dan Lisnawita.
Penggunaan mikroorganisme antagonis merupakan salah satu alternatif pencegahan penyakit busuk pangkal batang yang disebabkan oleh Ganoderma spp. pada perkebunan kelapa sawit. Penelitian ini bertujuan untuk mendapatkan cendawan endofit asal tanaman kelapa sawit yang berpotensi sebagai agens biokontrol untuk mengendalikan Ganoderma pada pembibitan kelapa sawit. Penelitian dilaksanakan di Rumah Kaca Fakultas Pertanian USU pada Juni 2015 sampai Januari 2016 menggunakanRancanganAcak Kelompoknon faktorial dengan enam perlakuan yaitu Aspergillus sp1 + Ganoderma, Aspergillus sp2 + Ganoderma, Rhopalomyces sp + Ganoderma, Cunninghamella sp + Ganoderma, Gongronella sp1 + Ganoderma, Gongronella sp2 + Ganoderma dan tiga ulangan. Parameter yang diamati pertambahan tinggi tanaman, lilit batang, jumlah daun, luas daun, periode inkubasi, kejadian penyakit, indeks keparahan penyakit dan histopatologi.
Hasil penelitian menunjukkan bahwa cendawan endofit Aspergillus sp1 dan Rhopalomyces sp berpotensi sebagai agens biokontrol dalam menekan perkembangan Ganoderma pada pembibitan kelapa sawit. Hasil terbaik didapat dengan waktu periode inkubasi terpanjang yaitu 28 mst dengan tingkat kejadian penyakit sebesar 30% dan juga mampu membantu pertumbuhan tinggi, jumlah daun dan luas daun tanaman.
ABSTRACT
RENDI KURNIAWAN. 2016: Original Endophytic Fungus Oil Palm Plant and Its Potentity as Biocontrol Agents to Control Ganoderma spp. supervised by Mukhtar Iskandar Pinem and Lisnawita.
The use of antagonistic microorganisms is one alternative base stem rot disease prevention caused by Ganoderma spp. in oil palm plantations. This purpose of this study was original endophtytic fungal on palm trees as a potential biocontrol agents for control of Ganoderma in oil palm nursery. Research conducted at the Faculty of Agriculture USU Greenhouse in june 2015 to January 2016 using randomized block design non faktorial with six treatments, Aspergillus sp1 + Ganoderma, Aspergillus sp2 + Ganoderma, Rhophalomyces sp + Ganoderma, Cunninghamella sp + Ganoderma, Gongronella sp1 + Ganoderma, Gongronella sp2 + Ganoderma and three replications. The date were analyzed by using analysis of variance followed by Duncan’s Multiple Range Test. The parameters observed accretion plant heigh, girth, number of leaves, leaf area, the incubation period, the incidence of disease, disease severity index and histopathology.
The results showed that endophytic fungi Aspergillus sp1 and Rhopalomyces sp. are potential as biocontrol agents in suppressing the development of Ganoderma in oil palm nursery. The best result were obtained by the farthest incubation period of time which 28 weeks after incubation with an incidence rate of the disease was 30% and it was also able to helped high growth, number of leaves and leaf area of plants.
RIWAYAT HIDUP
RENDI KURNIAWAN, lahir tanggal 15april 1993diPulo Jantan, Kec. Na IX-X, Kab.Labuhan Batu Utara, Sumatera Utara. Merupakan anak keenamdaritujuh bersaudara dari pasangan bapak Edi Sunarmandan ibu Atik.
Pendidikan Formal telah ditempuh adalah:
- SD Negeri 116262 di Desa Pulo Jantan Lulus Tahun 2005
- Madrasah tsanawiyah di Desa Padang Maninjau Lulus Tahun 2008 - SMA Negri 1diAek Kuo Lulus Tahun 2011
- Tahun 2011 Lulus Seleksi Masuk Universitas Sumatera Utara melalui jalur SNMPTN jalur Undangan di Jurusan Agroekoteknologi, Fakultas Pertanian, Universitas Sumatera Utara. Tahun 2014 pengambilan minat Hama dan Penyakit Tumbuhan.
Pendidikan Informal:
- Tahun 2013-2014menjabat sebagai ketua koordinator bidang LITBANG di UKM HN (Himadita Nursery)kemudian Tahun 2014-2015 menjabat sebagai Bendahara keuangan sekaligus BPH di UKM HN Fakultas Pertanian Universitas Sumatera Utara.Fakultas Pertanian Universitas Sumatera Utara.
- Tahun 2014 melaksanakan Praktek Kerja Lapangan (PKL) di perkebunan kelapa sawit di PT. Sarana Tetap Perkasa di Pangkalan Susu Kab. Langkat.
- Tahun 2014-2015 sebagai anggota dan pengurus KOMUS (Komunikasi Muslim) Hama dan Penyakit Tumbuhan, Fakultas Pertanian Universitas Sumatera Utara.
- Tahun 2014-2015 menjadi asisten Laboratorium Hama Penyakit Perkebunan Sub Penyakit Tumbuhan, Fakultas Pertanian Universitas Sumatera Utara.
KATA PENGANTAR
Puji dan syukur penulis panjatkan kehadirat Tuhan Yang Maha Esa atasberkat dan rahmat-Nya penulis dapat menyelesaikan skripsi ini.
Adapun judul dari penelitian ini adalah “Cendawan endofit asal tanaman kelapa sawit dan potensinya sebagai agens biokontrol untuk mengendalikan Ganoderma spp.”yang merupakan salah satu syarat untuk mendapat gelar sarjana
di Program Studi Agroekoteknologi Fakultas Pertanian Universitas Sumatera Utara, Medan.
Penulis mengucapkan terima kasih kepada Bapak Ir. Mukhtar Iskandar Pinem M. Agr, dan Ibu Dr. Lisnawita SP, M.Si., sebagai ketua dan anggota komisi pembimbing yang telah memberi banyak saran dan bimbingan kepada penulis untuk mempersiapkan penulisan skripsi ini.
Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan. Oleh karena itu penulis mengharapkan kritik dan saran yang bersifat membangun demi kesempurnaan skripsi ini.
Akhir kata penulis mengucapkan terima kasih dan semoga skripsi ini bermanfaat bagi kita semua.
Medan,Oktober 2016
DAFTAR ISI
Hipotesapenelitian ... 4
Kegunaan penelitian ... 4
TINJAUAN PUSTAKA Biologi Ganoderma ... 5
Siklus hidup Ganoderma ... 6
Gejala serangan Ganoderma ... 7
Faktor-faktor yang mempengaruhi serangan Ganoderma ... 8
Pengendalian Ganoderma ... 9
Potensi cendawan endofit . ... 10 Eksplorasi cendawan endofit ... 15
Perbanyakan Ganoderma ... 15
Perbanyakan agens antagonis ... 15
Persiapan bibit kelapa sawit. ... 16
Identifikasi endofit dan Ganoderma ... 16
Penanaman media tanam sawit ... 16
Inokulasi agen antagonis. ... 17
Pemeliharaan tanaman Penyiraman ... 17
Penyiangan gulma ... 17
Pemupukan ... 17
Peubah amatan ... 18
Tinggi tanaman (cm). ... 18
Lilit batang (cm) ... 18
Jumlah daun (helai) ... 18
Luas daun tanaman (cm2) ... 18
Perode inkubasi (mst) ... 18
Kejadian penyakit (%) ... 18
Indeks keparahan penyakit (%)... 19
Histopatologi ... 20
HASIL DAN PEMBAHASAN Hasil ... 21
Pembahasan ... 25
KESIMPULAN DAN SARAN Kesimpulan ... 38
Saran ... 38 DAFTAR PUSTAKA
DAFTAR TABEL
No Judul Hlm.
1. Dosis pemupukan... 17
2. Skala penyakit berdasarkan skor penyakit ... 19
3. Identifikasi cendawan endofit secara makroskopis dan mikroskopis ... 21
4. Pengaruh pemberian cendawan endofit terhadap luas daun tanaman ... 29
DAFTAR GAMBAR
No Judul Hlm.
1. Sampel tanaman dengan setiap kelas penyakit ...20
2. Hasil identifikasi makroskopis dan mikroskopis ...23
3. Perbedaan pemberian cendawan endofit terhadap tinggi tanaman kelapa sawit ...25
4. Tanaman kelapa sawit ...26
5. Perbedaan pemberian cendawan endofit terhadap jumlah daun tanaman kelapa sawit ... 27
6. Perbedaan pemberian cendawan endofit terhadap lilit batang tanaman kelapa sawit ...28
7. Luas daun tanaman kelapa sawit ...30
8. Daun klorosis, daun sehat, daun nekrosis dan tubuh buah ...33
DAFTAR LAMPIRAN
No Judul Hlm.
1. Bagan penelitian ...43
2. Tinggi tanaman...44
3. Jumlah daun tanaman ...47
4. Lilit batang tanaman ...51
5. Luas daun tanaman ...54
6. Skala keparahan penyakit dan kejadian penyakit...55
7. Kejadian penyakit...57
8. Keparahanpenyakit ...58