INDUKSI KALUS DAN TUNAS SECARA
in vitro
TANAMAN MAHKOTA DEWA DENGAN
MANIPULASI ZAT PENGATUR
TUMBUH DAN EKSPLAN
MENA MENTARY
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
INDUKSI KALUS DAN TUNAS SECARA
in vitro
TANAMAN MAHKOTA DEWA DENGAN
MANIPULASI ZAT PENGATUR
TUMBUH DAN EKSPLAN
MENA MENTARY
Tesis
sebagai salah satu syarat untuk memperoleh gelar
Magister Sains pada
Program Studi Agronomi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
SURAT PERNYATAAN
Saya menyatakan dengan sebenar-benarnya bahwa segala pernyataan dalam tesis ini yang berjudul:
INDUKSI KALUS DAN TUNAS SECARA in vitro TANAMAN MAHKOTA
DEWA DENGAN MANIPULASI ZAT PENGATUR TUMBUH DAN EKSPLAN
merupakan gagasan atau hasil penelitian tesis saya sendiri dengan bimbingan dari Komisi Pembimbing saya, kecuali yang dengan jelas ditunjukkan rujukannya. Tesis ini belum pernah diajukan untuk memperoleh gelar pada program sejenis di perguruan tinggi lainnya.
Semua data dan informasi yang digunakan telah dinyatakan secara jelas dan dapat diperiksa kebenarannya.
Bogor, Januari 2006
ABSTRAK
MENA MENTARY. 2006. Induksi Kalus dan Tunas secara in vitro Tanaman Mahkota Dewa dengan Manipulasi Zat Pengatur Tumbuh dan Eksplan. Dibimbing
oleh GUSTAF ADOLF WATTIMENA dan MUHAMMAD MACHMUD.
Penelitian ini bertujuan untuk mengevaluasi pengaruh taraf konsentrasi BA dan NAA dalam menginduksi tunas mahkota dewa (Phaleria macrocarpa [Scheff.] Boerl.) dengan eksplan biji, mengevaluasi pengaruh taraf konsentrasi 2,4-D dan BA dalam menginduksi kalus mahkota dewa dengan eksplan daun dan biji, dan mengevaluasi pengaruh taraf konsentrasi NAA dan BA dalam menginduksi kalus mahkota dewa dengan eksplan daun dan biji. Tiga percobaan dilakukan di laboratorium Biologi Molekuler Seluler Tanaman, Pusat Ilmu Hayat dan Bioteknologi IPB. Setiap percobaan menggunakan Rancangan Acak Lengkap (RAL) pola faktorial. Percobaan I (induksi tunas) terdiri dari 16 kombinasi perlakuan NAA dan BA pada media MS. Percobaan II (induksi kalus) terdiri dari 9 kombinasi perlakuan 2,4-D dan BA pada media MS. Enam kombinasi perlakuan NAA dan BA pada media MS untuk percobaan III (induksi kalus). Percobaan I menggunakan eksplan biji, sedangkan percobaan II dan III menggunakan eksplan daun dan biji.
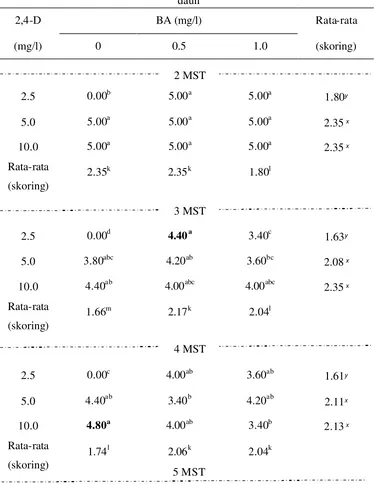
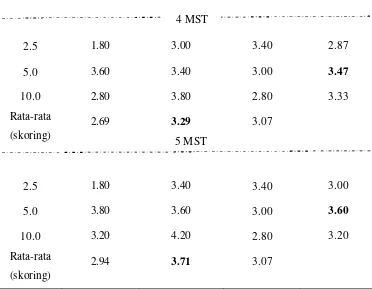
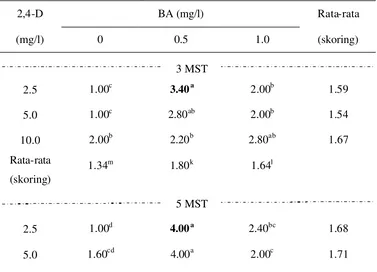
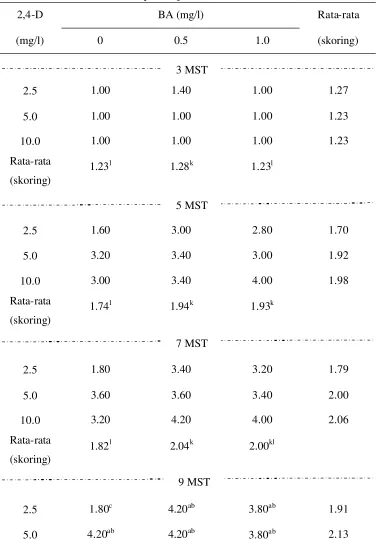
Pembentukan tunas mahkota dewa pada kultur in vitro dapat dihasilkan dengan menambahkan kombinasi konsentrasi BA dan NAA ke media dasar MS. Hasil terbaik yaitu pada perlakuan BA tunggal, tanpa NAA. Konsentrasi BA terbaik untuk pertunasan pada penelitian ini yaitu 2.5 mg/l. Kombinasi konsentrasi ZPT 2,4-D dan BA mampu menginduksi terbentuknya kalus eksplan biji dan daun. Pada eksplan daun, perlakuan terbaik yaitu 2.5 mg/l 2,4-D + 0.5 mg/l BA dan 5.0 mg/l 2,4-D + 0.5 mg/l BA. Pada eksplan biji, kombinasi konsentrasi terbaik dalam menginduksi kalus yaitu 10.0 mg/l 2,4-D + 5.0 mg/l BA. Kombinasi konsentrasi NAA dan BA mampu menginduksi terbentuknya kalus pada eksplan daun dan biji. Pada eksplan daun, perlakuan terbaik yaitu 20.0 mg/l NAA tanpa BA dan 20.0 mg/l NAA + 0.5 mg/l BA. Pada eksplan biji, kombinasi konsentrasi terbaik dalam menginduksi kalus yaitu 20.0 mg/l NAA + 0.5 mg/l BA dan 20.0 mg/l NAA + 1.0 mg/l BA.
ABSTRACT
MENA MENTARY. 2006. in vitro Callus and Shoot Induction of “Mahkota Dewa” by Manipulation of Plant Growth Regulators and Explant. Supervised
by GUSTAF ADOLF WATTIMENA and MUHAMMAD MACHMUD.
The objective of this research was to study the effects of auxin and cytokinin in in vitro callus and shoot induction of “mahkota dewa” (Phaleria macrocarpa). Three experiments used Complete Randomized Design for shoot induction (experiment I) and callus induction (experiment II and III). Shoot induction experiment consisted of 16 combinations of BA (0.0, 2.5, 5.0, and 7.5 mg/l) and NAA (0.0, 0.5, 1.0, and 1.5 mg/l) using MS basal medium and seed as explant. The callus induction experiment consisted of MS basal medium with nine combinations of 2,4-D (2.5, 5.0, and 10.0 mg/l) and BA (0.0, 0.5, and 1.0 mg/l) and six combinations of NAA (20.0 and 40.0 mg/l) and BA (0.0, 0.5, and 1.0 mg/l). Experiment II and III using leaf and seed as explants in separated experiment. within MS medium.
The result of experiment I showed that shoots can be produced in MS basal medium with combinations BA and NAA. The best combination of auxin and cytokinin for shoot induction was BA 2.5 mg/l. For callus induction using leaf explants was 2,4-D 2.5 mg/l + BA 0.5 mg/l and 20.0 mg/l NAA without BA, and for seed explants was 2,4 -D 10.0 mg/l + BA 5.0 mg/l and NAA 20.0 mg/l + BA 0.5 mg/l but it is not significantly with NAA 20.0 mg/l + BA 1.0 mg/l.
Judul Tesis : Induksi Kalus dan Tunas secara in vitro Tanaman Mahkota
Dewa dengan Manipulasi Zat Pengatur Tumbuh dan Eksplan
Nama Mahasiswa : Mena Mentary
NIM : A155014031
Program Studi : Agronomi
Disetujui,
Komisi Pembimbing
Prof. Dr. Ir. G. A. Wattimena, M.Sc Dr. Ir. H. M. Machmud, M.Sc, APU
Ketua anggota
Diketahui,
Ketua Program Studi Agronomi Dekan Sekolah Pascasarjana
Dr. Ir. Satriyas Ilyas, M.S i. Prof. Dr. Ir. Syafrida Manuwoto, M.Sc.
PRAKATA
Alhamdulillah, penulis panjatkan puji dan syukur kepada Allah SWT atas
segala rahmat dan karunia-Nya sehingga penelitian dan karya ilmiah ini berhasil
diselesaikan. Tema penelitian yang telah dilaksanakan sejak bulan April 2005 ini
ialah perbanyakan in vitro dan induksi kalus, dengan judul Induksi Kalus dan
Tunas secara in vitro Tanaman Mahkota Dewa dengan Manipulasi Zat Pengatur
Tumbuh dan Eksplan. Selama proses penelitian dan penulisan karya ilmiah ini,
penulis memperoleh dukungan, sokongan, bantuan, serta saran profesional dari
berbagai pihak. Oleh karena itu, pada kesempatan ini penulis mengucapkan terima
kasih kepada Bapak Prof. Dr. Ir. G. A. Wattimena, M.Sc selaku ketua komisi
pembimbing dari Institut Pertanian Bogor, Bapak Dr. Ir. H. M. Machmud, M.Sc.
APU selaku pembimbing anggota dari Balai Penelitian Bioteknologi (Balitbio)
Sumberdaya Genetik, Balitbang Departemen Pertanian C imanggu-Bogor, serta
Bapak Dr. Ir. Agus Purwito, M.Sc selaku penguji luar komisi dari Institut
Pertanian Bogor.
Penulis juga mengucapkan terima kasih kepada Kepala Balai Besar Diklat
Agribisnis Tanaman Pangan dan Tanaman Obat (BBDATPO) Ketindan, Jawa
Timur-BPSDMP Departemen Pertanian, Ibu Nia Dahniar, S.P serta kru laboran
(Pak Asep, Sarah, dan Iri) Laboratorium Biologi Molukuler Seluler Tanaman
Pusat Penelitian Sumber daya Hayati dan Bioteknologi IPB, Lusiana Tatipatta
S.P, M.Si., Catur Wasonowati, S.P, M.Si., Risa S.P, M.Si., Ir. Nurbaiti, Nila
Hayati, S.P, dan rekan-rekan Forsca (Forum Mahasiswa Pascasarjana Agronomi
IPB).
Ungkapan terima kasih yang sebesar-besarnya juga disampaikan kepada
Ayah, Ibu, Suami, serta seluruh keluarga yang telah memberikan do’a yang tak
pernah putus, dukungan dan bantuan setiap saat, serta kasih sayang yang tulus dan
mulia. Semoga Allah SWT senantiasa melimpahkan rahmat kepada mereka.
Besar harapan semoga karya ilmiah ini bermanfaat.
Bogor, Januari 2006
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 5 April 1978 dari Ayah Damman Huri, BBA dan Ibu Rasyidah. Penulis merupakan putri ketiga dari empat bersaudara.
Tahun 1996 penulis lulus dari SMA Negeri 85 Jakarta dan pada tahun yang sama lulus seleksi masuk Universitas Syiah Kuala (Unsyiah) Banda Aceh melalui Ujian Masuk Perguruan Tinggi Negeri (UMPTN). Penulis memilih Program Studi Agronomi, Fakultas Pertanian. Pada tahun 2001 penulis lulus kemudian melanjutkan studi di Program Pascasarjana IPB dan diterima di Program Studi Agronomi.
DAFTAR ISI
halaman
PRAKATA DAFTAR TABEL DAFTAR GAMBAR DAFTAR LAMPIRAN
PENDAHULUAN
Latar Belakang ... 1
Tujuan ... 3
Hipotesis ………... 4
TINJAUAN PUSTAKA
Tanaman Mahkota Dewa ... 5Manfaat dan Kandungan Kimia ... 6
Arti Ekonomi ... 7
Perbanyakan Tanaman secara in vitro ... 8
Zat Pengatur Tumbuh ... 16
Induksi Kalus ... 22
Induksi Tunas ... 25
METODOLOGI PENELITIAN
Tempat dan Waktu Penelitian ... 27Bahan Penelitian ………... 27
Metode Penelitian ……… 27
Pembuatan Media Perlakuan ………... 28
Percobaan I: Pengaruh Taraf Konsentrasi BA dan NAA dalam Menginduksi Tunas Mahkota Dewa dengan Eksplan Biji .………... 28
Percobaan II: Pengaruh Taraf Konsentrasi 2,4-D dan BA dalam Menginduksi Kalus Mahkota Dewa dengan Eksplan Daun dan Biji ... .…………. 30
Percobaan III: Pengaruh Taraf Konsentrasi NAA dan BA dalam Menginduksi Kalus Mahkota Dewa dengan Eksplan Daun dan Biji ……….. 31
HASIL DAN PEMBAHASAN Percobaan I Hasil ………... 36
Kondisi Umum ... 36
Pembahasan ... 40
Percobaan II Hasil ………... 44
Kondisi Umum ... 44
Percobaan III
Hasil ………... 59
Kondisi Umum ... 59
Pembahasan ………... 70
Pembahasan Umum ... 74
SIMPULAN DAN SARAN ... 81
DAFTAR PUSTAKA
………
82INDUKSI KALUS DAN TUNAS SECARA
in vitro
TANAMAN MAHKOTA DEWA DENGAN
MANIPULASI ZAT PENGATUR
TUMBUH DAN EKSPLAN
MENA MENTARY
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
INDUKSI KALUS DAN TUNAS SECARA
in vitro
TANAMAN MAHKOTA DEWA DENGAN
MANIPULASI ZAT PENGATUR
TUMBUH DAN EKSPLAN
MENA MENTARY
Tesis
sebagai salah satu syarat untuk memperoleh gelar
Magister Sains pada
Program Studi Agronomi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
SURAT PERNYATAAN
Saya menyatakan dengan sebenar-benarnya bahwa segala pernyataan dalam tesis ini yang berjudul:
INDUKSI KALUS DAN TUNAS SECARA in vitro TANAMAN MAHKOTA
DEWA DENGAN MANIPULASI ZAT PENGATUR TUMBUH DAN EKSPLAN
merupakan gagasan atau hasil penelitian tesis saya sendiri dengan bimbingan dari Komisi Pembimbing saya, kecuali yang dengan jelas ditunjukkan rujukannya. Tesis ini belum pernah diajukan untuk memperoleh gelar pada program sejenis di perguruan tinggi lainnya.
Semua data dan informasi yang digunakan telah dinyatakan secara jelas dan dapat diperiksa kebenarannya.
Bogor, Januari 2006
ABSTRAK
MENA MENTARY. 2006. Induksi Kalus dan Tunas secara in vitro Tanaman Mahkota Dewa dengan Manipulasi Zat Pengatur Tumbuh dan Eksplan. Dibimbing
oleh GUSTAF ADOLF WATTIMENA dan MUHAMMAD MACHMUD.
Penelitian ini bertujuan untuk mengevaluasi pengaruh taraf konsentrasi BA dan NAA dalam menginduksi tunas mahkota dewa (Phaleria macrocarpa [Scheff.] Boerl.) dengan eksplan biji, mengevaluasi pengaruh taraf konsentrasi 2,4-D dan BA dalam menginduksi kalus mahkota dewa dengan eksplan daun dan biji, dan mengevaluasi pengaruh taraf konsentrasi NAA dan BA dalam menginduksi kalus mahkota dewa dengan eksplan daun dan biji. Tiga percobaan dilakukan di laboratorium Biologi Molekuler Seluler Tanaman, Pusat Ilmu Hayat dan Bioteknologi IPB. Setiap percobaan menggunakan Rancangan Acak Lengkap (RAL) pola faktorial. Percobaan I (induksi tunas) terdiri dari 16 kombinasi perlakuan NAA dan BA pada media MS. Percobaan II (induksi kalus) terdiri dari 9 kombinasi perlakuan 2,4-D dan BA pada media MS. Enam kombinasi perlakuan NAA dan BA pada media MS untuk percobaan III (induksi kalus). Percobaan I menggunakan eksplan biji, sedangkan percobaan II dan III menggunakan eksplan daun dan biji.
Pembentukan tunas mahkota dewa pada kultur in vitro dapat dihasilkan dengan menambahkan kombinasi konsentrasi BA dan NAA ke media dasar MS. Hasil terbaik yaitu pada perlakuan BA tunggal, tanpa NAA. Konsentrasi BA terbaik untuk pertunasan pada penelitian ini yaitu 2.5 mg/l. Kombinasi konsentrasi ZPT 2,4-D dan BA mampu menginduksi terbentuknya kalus eksplan biji dan daun. Pada eksplan daun, perlakuan terbaik yaitu 2.5 mg/l 2,4-D + 0.5 mg/l BA dan 5.0 mg/l 2,4-D + 0.5 mg/l BA. Pada eksplan biji, kombinasi konsentrasi terbaik dalam menginduksi kalus yaitu 10.0 mg/l 2,4-D + 5.0 mg/l BA. Kombinasi konsentrasi NAA dan BA mampu menginduksi terbentuknya kalus pada eksplan daun dan biji. Pada eksplan daun, perlakuan terbaik yaitu 20.0 mg/l NAA tanpa BA dan 20.0 mg/l NAA + 0.5 mg/l BA. Pada eksplan biji, kombinasi konsentrasi terbaik dalam menginduksi kalus yaitu 20.0 mg/l NAA + 0.5 mg/l BA dan 20.0 mg/l NAA + 1.0 mg/l BA.
ABSTRACT
MENA MENTARY. 2006. in vitro Callus and Shoot Induction of “Mahkota Dewa” by Manipulation of Plant Growth Regulators and Explant. Supervised
by GUSTAF ADOLF WATTIMENA and MUHAMMAD MACHMUD.
The objective of this research was to study the effects of auxin and cytokinin in in vitro callus and shoot induction of “mahkota dewa” (Phaleria macrocarpa). Three experiments used Complete Randomized Design for shoot induction (experiment I) and callus induction (experiment II and III). Shoot induction experiment consisted of 16 combinations of BA (0.0, 2.5, 5.0, and 7.5 mg/l) and NAA (0.0, 0.5, 1.0, and 1.5 mg/l) using MS basal medium and seed as explant. The callus induction experiment consisted of MS basal medium with nine combinations of 2,4-D (2.5, 5.0, and 10.0 mg/l) and BA (0.0, 0.5, and 1.0 mg/l) and six combinations of NAA (20.0 and 40.0 mg/l) and BA (0.0, 0.5, and 1.0 mg/l). Experiment II and III using leaf and seed as explants in separated experiment. within MS medium.
The result of experiment I showed that shoots can be produced in MS basal medium with combinations BA and NAA. The best combination of auxin and cytokinin for shoot induction was BA 2.5 mg/l. For callus induction using leaf explants was 2,4-D 2.5 mg/l + BA 0.5 mg/l and 20.0 mg/l NAA without BA, and for seed explants was 2,4 -D 10.0 mg/l + BA 5.0 mg/l and NAA 20.0 mg/l + BA 0.5 mg/l but it is not significantly with NAA 20.0 mg/l + BA 1.0 mg/l.
Judul Tesis : Induksi Kalus dan Tunas secara in vitro Tanaman Mahkota
Dewa dengan Manipulasi Zat Pengatur Tumbuh dan Eksplan
Nama Mahasiswa : Mena Mentary
NIM : A155014031
Program Studi : Agronomi
Disetujui,
Komisi Pembimbing
Prof. Dr. Ir. G. A. Wattimena, M.Sc Dr. Ir. H. M. Machmud, M.Sc, APU
Ketua anggota
Diketahui,
Ketua Program Studi Agronomi Dekan Sekolah Pascasarjana
Dr. Ir. Satriyas Ilyas, M.S i. Prof. Dr. Ir. Syafrida Manuwoto, M.Sc.
PRAKATA
Alhamdulillah, penulis panjatkan puji dan syukur kepada Allah SWT atas
segala rahmat dan karunia-Nya sehingga penelitian dan karya ilmiah ini berhasil
diselesaikan. Tema penelitian yang telah dilaksanakan sejak bulan April 2005 ini
ialah perbanyakan in vitro dan induksi kalus, dengan judul Induksi Kalus dan
Tunas secara in vitro Tanaman Mahkota Dewa dengan Manipulasi Zat Pengatur
Tumbuh dan Eksplan. Selama proses penelitian dan penulisan karya ilmiah ini,
penulis memperoleh dukungan, sokongan, bantuan, serta saran profesional dari
berbagai pihak. Oleh karena itu, pada kesempatan ini penulis mengucapkan terima
kasih kepada Bapak Prof. Dr. Ir. G. A. Wattimena, M.Sc selaku ketua komisi
pembimbing dari Institut Pertanian Bogor, Bapak Dr. Ir. H. M. Machmud, M.Sc.
APU selaku pembimbing anggota dari Balai Penelitian Bioteknologi (Balitbio)
Sumberdaya Genetik, Balitbang Departemen Pertanian C imanggu-Bogor, serta
Bapak Dr. Ir. Agus Purwito, M.Sc selaku penguji luar komisi dari Institut
Pertanian Bogor.
Penulis juga mengucapkan terima kasih kepada Kepala Balai Besar Diklat
Agribisnis Tanaman Pangan dan Tanaman Obat (BBDATPO) Ketindan, Jawa
Timur-BPSDMP Departemen Pertanian, Ibu Nia Dahniar, S.P serta kru laboran
(Pak Asep, Sarah, dan Iri) Laboratorium Biologi Molukuler Seluler Tanaman
Pusat Penelitian Sumber daya Hayati dan Bioteknologi IPB, Lusiana Tatipatta
S.P, M.Si., Catur Wasonowati, S.P, M.Si., Risa S.P, M.Si., Ir. Nurbaiti, Nila
Hayati, S.P, dan rekan-rekan Forsca (Forum Mahasiswa Pascasarjana Agronomi
IPB).
Ungkapan terima kasih yang sebesar-besarnya juga disampaikan kepada
Ayah, Ibu, Suami, serta seluruh keluarga yang telah memberikan do’a yang tak
pernah putus, dukungan dan bantuan setiap saat, serta kasih sayang yang tulus dan
mulia. Semoga Allah SWT senantiasa melimpahkan rahmat kepada mereka.
Besar harapan semoga karya ilmiah ini bermanfaat.
Bogor, Januari 2006
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 5 April 1978 dari Ayah Damman Huri, BBA dan Ibu Rasyidah. Penulis merupakan putri ketiga dari empat bersaudara.
Tahun 1996 penulis lulus dari SMA Negeri 85 Jakarta dan pada tahun yang sama lulus seleksi masuk Universitas Syiah Kuala (Unsyiah) Banda Aceh melalui Ujian Masuk Perguruan Tinggi Negeri (UMPTN). Penulis memilih Program Studi Agronomi, Fakultas Pertanian. Pada tahun 2001 penulis lulus kemudian melanjutkan studi di Program Pascasarjana IPB dan diterima di Program Studi Agronomi.
DAFTAR ISI
halaman
PRAKATA DAFTAR TABEL DAFTAR GAMBAR DAFTAR LAMPIRAN
PENDAHULUAN
Latar Belakang ... 1
Tujuan ... 3
Hipotesis ………... 4
TINJAUAN PUSTAKA
Tanaman Mahkota Dewa ... 5Manfaat dan Kandungan Kimia ... 6
Arti Ekonomi ... 7
Perbanyakan Tanaman secara in vitro ... 8
Zat Pengatur Tumbuh ... 16
Induksi Kalus ... 22
Induksi Tunas ... 25
METODOLOGI PENELITIAN
Tempat dan Waktu Penelitian ... 27Bahan Penelitian ………... 27
Metode Penelitian ……… 27
Pembuatan Media Perlakuan ………... 28
Percobaan I: Pengaruh Taraf Konsentrasi BA dan NAA dalam Menginduksi Tunas Mahkota Dewa dengan Eksplan Biji .………... 28
Percobaan II: Pengaruh Taraf Konsentrasi 2,4-D dan BA dalam Menginduksi Kalus Mahkota Dewa dengan Eksplan Daun dan Biji ... .…………. 30
Percobaan III: Pengaruh Taraf Konsentrasi NAA dan BA dalam Menginduksi Kalus Mahkota Dewa dengan Eksplan Daun dan Biji ……….. 31
HASIL DAN PEMBAHASAN Percobaan I Hasil ………... 36
Kondisi Umum ... 36
Pembahasan ... 40
Percobaan II Hasil ………... 44
Kondisi Umum ... 44
Percobaan III
Hasil ………... 59
Kondisi Umum ... 59
Pembahasan ………... 70
Pembahasan Umum ... 74
SIMPULAN DAN SARAN ... 81
DAFTAR PUSTAKA
………
82DAFTAR TABEL
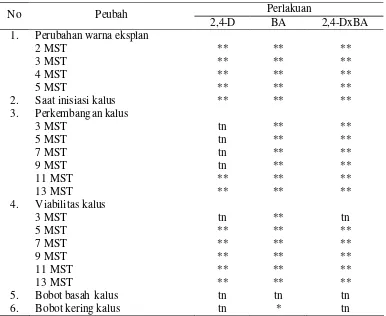
halaman 1 Rekapitulasi uji F pengaruh NAA dan BA terhadap pembentukan
tunas dari eksplan biji mahkota dewa ………... 36 2 Pengaruh kombinasi NAA dan BA terhadap saat inisiasi primordial
tunas dari eksplan biji mahkota dewa ………... 37 3 Pengaruh kombinasi NAA dan BA terhadap jumlah tunas dari
eksplan biji mahkota dewa ………... 38 4 Pengaruh kombinasi NAA dan BA terhadap jumlah daun dari
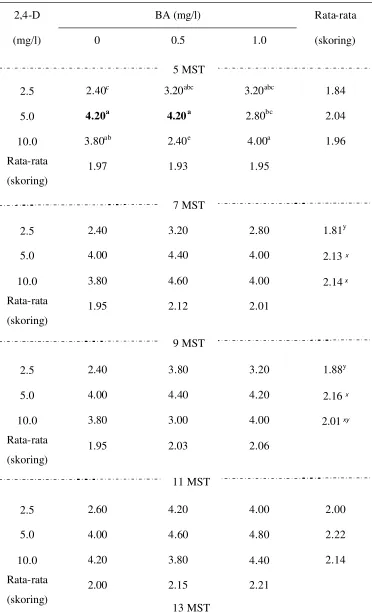
eksplan biji mahkota dewa ………... 41 5 Rekapitulasi uji F pengaruh 2,4-D dan BA terhadap pembentukan
kalus eksplan daun mahkota dewa ……… 45 6 Rekapitulasi uji F pengaruh 2,4-D dan BA terhadap pembentukan
kalus eksplan biji mahkota dewa ……… 46 7 Pengaruh kombinasi 2,4-D dan BA terhadap perubahan warna
eksplan daun mahkota dewa ……….. 47
8 Pengaruh kombinasi 2,4-D dan BA terhadap perubahan warna
eksplan biji mahkota dewa ……… 48
9 Pengaruh kombinasi 2,4-D dan BA terhadap saat inisiasi kalus
eksplan daun mahkota dewa ……….. 49
10 Pengaruh kombinasi 2,4-D dan BA terhadap saat inisiasi kalus
eksplan biji mahkota dewa ……… 49
11 Pengaruh kombinasi 2,4-D dan BA terhadap perkembangan kalus
eksplan daun mahkota dewa ……….. 51
12 Pengaruh kombinasi 2,4-D dan BA terhadap perkembangan kalus
eksplan biji mahkota dewa ……… 52
13 Pengaruh kombinasi 2,4-D dan BA terhadap viabilitas kalus eksplan
daun mahkota dewa ……….. 53
14 Pengaruh kombinasi 2,4-D dan BA terhadap viabilitas kalus eksplan
biji mahkota dewa ……… 54
15 Pengaruh kombinasi 2,4-D dan BA terhadap bobot basah kalus
eksplan daun mahkota dewa ……….. 55
16 Pengaruh kombinasi 2,4 -D dan BA terhadap bobot kering kalus
eksplan daun mahkota dewa ……….. 55
17 Pengaruh kombinasi 2,4-D dan BA terhadap bobot basah kalus
eksplan biji mahkota dewa ……… 56
18 Pengaruh kombinasi 2,4 -D dan BA terhadap bobot kering kalus
eksplan biji mahkota dewa ……… 56
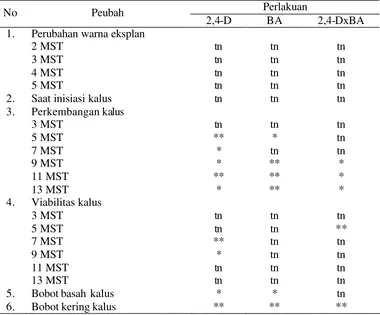
19 Rekapitulasi uji F pengaruh NAA dan BA terhadap pembentukan kalus eksplan daun mahkota dewa ……… 60 20 Rekapitulasi uji F pengaruh NAA dan BA terhadap pembentukan
kalus eksplan daun mahkota dewa ……… 61 21 Pengaruh kombinasi NAA dan BA terhadap perubahan warna
eksplan daun mahkota dewa ……….. 62
22 Pengaruh kombinasi NAA dan BA terhadap perubahan warna
23 Pengaruh kombinasi NAA dan BA terhadap saat inisiasi kalus
eksplan daun mahkota dewa ……….. 64
24 Pengaruh kombinasi NAA dan BA terhadap saat inisiasi kalus
eksplan biji mahkota dewa ……… 64
25 Pengaruh kombinasi NAA dan BA terhadap perkembangan kalus
eksplan daun mahkota dewa ……….. 65
26 Pengaruh kombinasi NAA dan BA terhadap perkembangan kalus
eksplan biji mahkota dewa ……… 66
27 Pengaruh kombinasi NAA dan BA terhadap viabilitas kalus eksplan
daun mahkota dewa ……….. 67
28 Pengaruh kombinasi NAA dan BA terhadap viabilitas kalus eksplan
biji mahkota dewa ……… 68
29 Pengaruh kombinasi NAA dan BA terhadap bobot basah kalus
eksplan daun mahkota dewa ……….. 69
30 Pengaruh kombinasi NAA dan BA terhadap bobot kering kalus
eksplan daun mahkota dewa ……….. 69
31 Pengaruh kombinasi NAA dan BA terhadap bobot basah kalus
eksplan biji mahkota dewa ……… 69
32 Pengaruh kombinasi NAA dan BA terhadap bobot kering kalus
DAFTAR GAMBAR
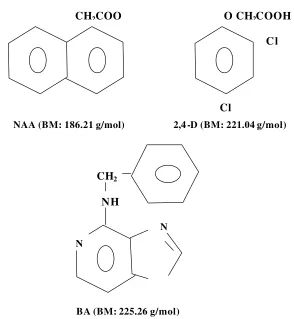
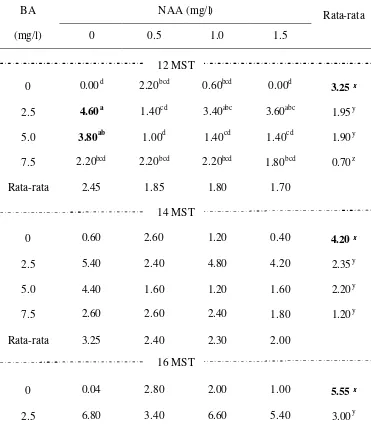
halaman 1 Perdu mahkota dewa dan buah mahkota dewa ……….. 6 2 Rumus bangun dan berat molekul NAA, 2,4-D, dan BA ... 21 3 Skoring perubahan warna eksplan daun ………... 33 4 Skoring perubahan warna eksplan biji ………. 33 5 Skoring perkembangan kalus pada eksplan daun ………..…. 34 6 Skoring perkembangan kalus pada eksplan biji ……… 34 7 Skoring viabilitas kalus pada eksplan daun ………... 35 8 Skoring viabilitas kalus pada eksplan biji ………. 35 9 Tunas yang terbentuk pada 16 perlakuan ……….. 39 10 Interaksi BA dan NAA terhadap jumlah tunas mahkota dewa pada
12 MST, 14 MST, dan 16 MST ……… 39
11 Interaksi NAA dan BA terhadap jumlah daun mahkota dewa pada
12 MST, 14 MST, dan 16 MST ……… 40
12 Histogram rata-rata tinggi tanaman ……….. 40
13 Skema pertumbuhan kalus ……… 72
14 Eksplan daun dengan satu ujung berkalus ………. 73 15 Eksplan daun dengan dua ujung berkalus ………. 73 16 Sistem kontrol ZPT pada aliran informasi dari DNA ke protein ….. 75 17 Peran ZPT pada pascatranslasi ……….. 76 18 Model dugaan keberadaan auksin dalam mempengaruhi aktivitas
enzim hingga menghasilkan suatu produk akhir ………… 77 19 Model dugaan keberadaan senyawa penghambat dalam
DAFTAR LAMPIRAN
halaman 1 Tahapan Pekerjaan Kultur Jaringan Tanaman ... 87
2 Diagram Alir Penelitian ……….. 88
3 Pembuatan Larutan Stok untuk Medium Murashige dan Skoog .... 89 4 Pembuatan Larutan Stok untuk Zat Pengatur Tumbuh …………... 89 5 Tabel sidik ragam pengaruh BA dan NAA terhadap saat inisiasi
primordia tunas mahkota dewa ………... 90 6 Tabel sidik ragam pengaruh BA dan NAA terhadap jumlah tunas
mahkota dewa ………. 90
7 Tabel sidik ragam pengaruh BA dan NAA terhadap jumlah daun
mahkota dewa ………. 91
8 Tabel sidik ragam pengaruh BA dan NAA terhadap tinggi tanaman mahkota dewa ………... 91 9 Tabel sidik ragam pengaruh 2,4 -D dan BA terhadap perubahan
warna eksplan daun mahkota dewa pada media kalus I …………. 92 10 Tabel sidik ragam pengaruh 2,4-D dan BA terhadap saat inisiasi
kalus eksplan daun mahkota dewa pada media kalus I …………... 93 11 Tabel sidik ragam pengaruh 2,4-D dan BA terhadap perkembangan
kalus eksplan daun mahkota dewa pada media kalus I
………... 94
12 Tabel sidik ragam pengaruh 2,4-D dan BA terhadap viabilitas kalus eksplan daun mahkota dewa pada media kalus I …………... 95 13 Tabel sidik ragam pengaruh 2,4-D dan BA terhadap bobot basah
kalus eksplan daun mahkota dewa pada media kalus I …………... 96 14 Tabel sidik ragam pengaruh 2,4-D dan BA terhadap bobot kering
kalus eksplan daun mahkota dewa pada media kalus I …………... 96 15 Tabel sidik ragam pengaruh 2,4 -D dan BA terhadap perubahan
warna eksplan biji mahkota dewa pada media kalus I ……… 97 16 Tabel sidik ragam pengaruh 2,4-D dan BA terhadap saat inisiasi
kalus eksplan biji mahkota dewa pada media kalus I ………. 98 17 Tabel sidik ragam pengaruh 2,4-D dan BA terhadap perkembangan
kalus eksplan biji mahkota dewa pada media kalus I
……… 99
18 Tabel sidik ragam pengaruh 2,4-D dan BA terhadap viabilitas kalus eksplan biji mahkota dewa pada media kalus I ………. 100 19 Tabel sidik ragam pengaruh 2,4-D dan BA terhadap bobot basah
kalus eksplan biji mahkota dewa pada media kalus I ………. 101 20 Tabel sidik ragam pengaruh 2,4-D dan BA terhadap bobot kering
kalus eksplan biji mahkota dewa pada media kalus I ………. 101 21 Tabel sidik ragam pengaruh NAA dan BA terhadap perubahan
warna eksplan daun mahkota dewa pada media kalus II ………… 102 22 Tabel sidik ragam pengaruh NAA dan BA terhadap saat inisiasi
23 Tabel sidik ragam pengaruh 2,4-D dan BA terhadap perkembangan kalus eksplan daun mahkota dewa pada media kalus II
………... 104
24 Tabel sidik ragam pengaruh NAA dan BA terhadap viabilitas kalus eksplan daun mahkota dewa pada media kalus II …………... 105 25 Tabel sidik ragam pengaruh NAA dan BA terhadap bobot basah
kalus eksplan daun mahkota dewa pada media kalus II …………. 106 26 Tabel sidik ragam pengaruh NAA dan BA terhadap bobot kering
kalus eksplan daun mahkota dewa pada media kalus II …………. 106 27 Tabel sidik ragam pengaruh NAA dan BA terhadap perubahan
warna biji mahkota dewa pada media kalus II ……… 107 28 Tabel sidik ragam pengaruh NAA dan BA terhadap saat inisiasi
kalus eksplan biji mahkota dewa pada media kalus II ……… 108 29 Tabel sidik ragam pengaruh NAA dan BA terhadap perkembangan
kalus eksplan biji mahkota dewa pada media kalus II
………... 109
30 Tabel sidik ragam pengaruh NAA dan BA terhadap viabilitas kalus eksplan biji mahkota dewa pada media kalus II ………... 110 31 Tabel sidik ragam pengaruh NAA dan BA terhadap bobot basah
kalus eksplan biji mahkota dewa pada media kalus II ……… 111 32 Tabel sidik ragam pengaruh NAA dan BA terhadap bobot kering
PENDAHULUAN
Latar Belakang
Mahkota dewa [Phaleria macrocarpa (Scheff.) Boerl.] merupakan
tanaman asli Indonesia yang diperkirakan berasal dari Papua (Irian Jaya), jika
dilihat dari sinonim nama botani dari mahkota dewa (Phaleria papuana).
Tanaman ini termasuk famili Thymelaeacae (Dalimartha 2003). Tanaman
mahkota dewa digolongkan ke dalam tanaman obat dan saat ini telah menyebar
hampir ke seluruh Indonesia, walaupun belum dibudidayakan secara khusus.
Tanaman ini umumnya tumbuh liar di hutan -hutan, di kebun sebagai tanaman
peneduh, atau di pekarangan sebagai tanaman hias.
Pengembangan obat tradisional menjadi fitofarmaka memerlukan
penanganan yang cukup serius, karena berbagai permasalahan muncul, seperti
masalah yang berkaitan dengan sumber daya alam, sumber daya manusia,
pengolahan, modal, serta pemasaran. Meningkatnya pemakaian obat tradisional
mengakibatkan peningkatan penggunaan tanaman obat, tetapi hal ini tidak
diimbangi dengan budidaya dan pelestarian plasma nutfah. Tanaman mahkota
dewa belum dibudidayakan dengan baik dan bermutu rendah.
Permasalahan yang muncul adalah salah satu mata rantai agribisnis yang
mencakup hubungan antara penyediaan komoditas pertanian sebagai bahan baku
(input) dengan kegiatan agroindustri. Komoditas dalam hal ini adalah mahkota
dewa, yang diupayakan penyediaan dalam jumlah banyak dan berkesinambungan.
Sekarang ini mahkota dewa cenderung diperbanyak dengan biji, walaupun ada
juga yang memperbanyak dengan cangkok.
Pembibitan mahkota dewa yang diperbanyak dengan biji, dilakukan selama
lebih kurang tiga bulan. Biji tidak dapat digunakan untuk bahan baku obat, karena
dipakai kembali untuk penanaman. Permasalahan lain yang timbul yaitu
keharusan penggunaan bahan baku obat yang seragam, terutama kandungan kimia
tanaman mahkota dewa.
Perbanyakan dengan biji merupakan perbanyakan generatif yang nantinya
dapat menyebabkan tingkat keragaman yang sangat tinggi (Griffiths et al. 1996).
berubah. Tanaman mahkota dewa dapat diperbanyak melalui biji dan cangkokan.
Kedua cara tersebut mempunyai kekurangan-kekurangan seperti tidak seragam,
tergantung musim, tidak bebas penyakit, serta membutuhkan waktu yang lama.
Perbanyakan klonal secara in vitro dapat membuka jalan untuk mengatasi
kekurangan-kekurangan perbanyakan secara biasa. Dalam budidaya apapun,
masalah bahan tanam sangat penting, karena bibit yang kurang baik akan sangat
berpengaruh terhadap pertumbuhan dan hasil. Penggunaan teknik in vitro dengan
metode kultur jaringan akan mengatasi kendala-kendala yang umumnya dijumpai
pada teknik-teknik budidaya dengan pembiakan generatif ataupun vegetatif yang
dapat dikatakan sebagai teknik konvensional. Penelitian tentang budidaya
mahkota dewa, terutama pada aspek pembibitan serta perbanyakan tanaman
tersebut dengan teknik in vitro belum banyak dilakukan.
Pembibitan akan lebih efisien dan ekonomis dengan teknik in vitro; dalam
waktu satu tahun dapat dihasilkan ribuan bibit dari sedikit bahan tanam yang
digunakan. Dengan metode kultur yang tepat, bahan eksplan yang baik, dan
kombinasi konsentrasi zat pengatur tumbuh yang tepat, akan didapat hasil
perbanyakan dengan kualitas plantlet yang baik serta dalam jumlah banyak dalam
waktu singkat tanpa tergantung musim.
Teknik kultur jaringan dapat memberikan solusi terhadap permasalahan
-permasalahan tersebut. Pembibitan dilakukan dalam waktu lebih cepat, seragam,
dan menggunakan bahan tanam yang sedikit, sehingga biji mahkota dewa juga
dapat digunakan sebagai bahan baku obat. Keberhasilan teknik kultur jaringan ini
sangat ditentukan oleh jenis bahan tanam, medium, dan zat pengatur tumbuh yang
digunakan.
Kemajuan ilmu kimia menyebabkan orang mengenal susunan molekul
hormon tumbuhan yang dikenal dengan zat pengatur tumbuh (ZPT), sehingga
dapat dimanfaatkan dalam kultur jaringan untuk memacu terbentuknya jaringan
tertentu dari organ dengan ukuran kecil sebagai bahan tanam (eksplan) maupun
sel-sel kalus yang belum terdiferensiasi.
Zat pengatur tumbuh memegang peranan penting dalam pertumbuhan dan
perkembangan kultur. Faktor yang perlu mendapat perhatian dalam penggunaan
penggunaan, dan periode masa induksi kultur seperti yang dikemukakan oleh
Gunawan (1995).
Berdasarkan konsep George dan Sherrington (1984) bahwa untuk induksi
kalus tanaman dikotil diperlukan auksin dengan konsentrasi tinggi dan tetap
memerlukan sitokinin pada konsentrasi sangat rendah. Induksi tunas diperlukan
sitokinin dengan konsentrasi tinggi dan auksin pada konsentrasi rendah, ada juga
induksi tunas dapat dihasilkan dengan penggunaan sitokinin tunggal tanpa auksin.
Kultur in vitro tanaman mahkota dewa sejauh ini belum ada penelitian ataupun
literatur mengenai hal tersebut. Namun demikian, untuk menentukan konsentrasi
auksin dan sitokinin yang diperlukan pada penelitian ini mengacu kepada tanaman
lain yang mendekati kesamaan walaupun tidak sefamili. Penelitian kultur in vitro
tanaman lain dengan famili yang sama dengan mahkota dewa yaitu Thymeleaceae
juga tidak ditemukan.
Aplikasi teknik in vitro pada tanaman mahkota dewa akan sangat
bermanfaat pada aspek pembibitan yang cepat, sehat, dan tersedia
berkesinambungan. Selain itu aspek penting dari teknik in vitro adalah senyawa
metabolit sekunder yang dihasilkan melalui kultur kalus. Aspek ini yang nantinya
akan berperan dalam bidang agroindustri bidang fitofarmaka dari komoditi
mahkota dewa sebagai tanaman obat unggulan Indonesia.
Tujuan
Tujuan penelitian ini yaitu:
1. Mengevaluasi pengaruh taraf konsentrasi BA dan NAA dalam
menginduksi tunas mahkota dewa dengan eksplan biji.
2. Mengevaluasi pengaruh taraf konsentrasi 2,4-D dan BA dalam
menginduksi kalus mahkota dewa dengan eksplan daun dan biji.
3. Mengevaluasi pengaruh taraf konsentrasi NAA dan BA dalam
Hipotesis
1. Terdapat interaksi antara taraf BA dan NAA dalam menginduksi tunas
mahkota dewa dengan eksplan biji.
2. Terdapat interaksi antara taraf 2,4-D dan BA dalam menginduksi kalus
mahkota dewa dengan eksplan daun dan biji.
3. Terdapat interaksi NAA dan BA dalam menginduksi kalus mahkota dewa
TINJAUAN PUSTAKA
Tanaman Mahkota Dewa
Taksonomi dan Morfologi
Klasifikasi botani mahkota dewa menurut Balitbang Depkes (1999) yaitu:
Divisi : Spermatophyta
Subdivisi : Angiospermae
Kelas : Dicotyledoneae
Ordo : Thymelaeales
Famili : Thymelaeacae
Genus : Phaleria
Spesies : Phaleria macrocarpa (Scheff.) Boerl.
Mahkota dewa [Phaleria macrocarpa (Scheff.) Boerl.] termasuk famili
Thymelaeaceae dan memiliki sinonim P. papuana Warb. var. wichnannii (val.)
Back. Nama daerah Mahkota Dewa adalah Simalakama (Melayu), Makutadewa,
Makuto Mewo, Makuto Ratu, Makuto Rojo (Jawa). Nama simplisia tanaman ini
adalah Phaleriae fructus yang berarti buah mahkota dewa (Dalimartha 2003).
Nama asing tanaman ini adalah pau (dari bahasa Cina) dan Crown of God
(Inggris).
Mahkota dewa merupakan perdu menahun (Gambar 1) yang tumbuh subur
di tanah yang gembur dan subur pada ketinggian 10 - 1200 m dpl. Perdu ini
tumbuh tegak setinggi 1 - 2,5 m bahkan ada yang lebih dari 2,5 m. Karakteristik
tanaman ini adalah batang bulat, permukaan kasar, warna coklat, berkayu dan
bergetah, serta percabangan simpodial. Tanaman ini memiliki daun tunggal, letak
berhadapan, bertangkai pendek, bentuk lanset atau jorong, ujung dan pangkal
runcing, tepi rata, pertulangan menyirip, permukaan licin , warna hijau tua,
panjang 7 - 10 cm, dan lebar 2 - 5 cm.
Berbunga sepanjang tahun letak tersebar di batang atau ketiak daun,
bentuk tabung, berukuran kecil, berwarna putih dan harum. Bentuk buah tanaman
ini adalah bulat dengan diameter 3-5 cm, permukaan licin, beralur, berwarna hijau
Daging buah berwarna putih, berserat, dan berair. Biji bulat, keras,
berwarna coklat. Akar tanaman mahkota dewa adalah tunggang berwarna kuning
kecoklatan. Bijinya bersifat racun sedangkan buahnya berkhasiat menghilangkan
gatal (antipruritas) dan anti kanker. Daun dan biji digunakan untuk pengobatan
penyakit kulit seperti eksim dan gatal-gatal (Dalimartha 2003).
(a) (b)
Gambar 1 Perd u Mahkota Dewa (a) dan Buah Mahkota Dewa (b).
Manfaat dan Kandungan Kimia
Fitokimia merupakan suatu studi mengenai senyawa yang bersifat aktif
farmakologis yang terkandung pada tumbuh-tumbuhan, merupakan penelitian
dasar yang sangat penting untuk mengetah ui khasiat dan kegunaannya. Penelitian
dapat meliputi ekstraksi, isolasi, dan skrining fitokimia. Harbone (1987)
menyatakan bahwa skrining dimaksudkan untuk mengetahui jenis/golongan
kandungan aktif yang terdapat di dalam suatu tanaman, seperti alkaloid, glikosida,
minyak atsiri, dan steroid.
Kandungan kimia tanaman mahkota dewa belum banyak terungkap.
Namun demikian ada beberapa penelitian tentang fitokimia, bahwa daun mahkota
dewa mengandung antihistamin, alkaloid, saponin, dan polifenol (lignan). Kulit
buah mengandung alkaloid, saponin, dan flavonoid. Zat antihistamin yang
terkandung dalam mahkota dewa ini yang berguna untuk mencegah berbagai
penyakit alergi seperti biduran, gatal, salesma, dan sesak napas. Hal ini telah
dibuktikan oleh beberapa penelitian medis dan masyarakat luas yang telah
membuktikan secara empiris.
Alkaloid ada yang bersifat antitumor, antara lain yaitu alkaloid pirosilisin,
1991). Senyawa aktif dari golongan terpen bersifat iritasi dan karsinogen, seperti
croton oil dari Croton tiglium. Forbol yang diisolasi dari Croton berkhasiat
sebagai antileukimia.
Kandungan kimia mahkota dewa terdiri atas alkaloid, fenol, tanin,
flavonoid, saponin, sterol/terpen. Senyawa toksik yang terdapat dalam buah
mahkota dewa adalah lignan dengan rumus molekul C6H20O6 dan telah diketahui
strukturnya (Widowati 2004). Batang mahkota dewa terbukti secara empiris bisa
mengobati penderita kanker tulang. Penyakit yang dapat disembuhkan dengan
daun mahkota dewa antara lain lemah syahwat, disentri, alergi, dan tumor. Bijinya
beracun, oleh karena itu dianjurkan sebagai obat oles untuk aneka penyakit kulit.
(Harmanto 2005).
Harmanto (2005) dalam bukunya juga menyatakan bahwa dalam
pengobatan alternatif, mahkota dewa terbukti bisa mengobati berbagai penyakit
berbahaya pada manusia, seperti kanker, tumor, diabetes, asam urat, gangguan
ginjal, lever, penyakit kulit, menurunkan kolesterol, menambah stamina, dan
menghilangkan ketergantungan narkoba. Ekstrak mahkota dewa juga dapat
digunakan untuk mengobati penyakit pada hewan piaraan.
Mahendra (2005) menyatakan bahwa kandungan buah Mahkota dewa terdiri
dari golongan alkaloid, tanin, flavonoid, fenol, saponin, lignan, minyak astiri, dan
sterol. Senyawa lignan baru yang terdapat pada ekstrak daging buah mahkota
dewa berfungsi sebagai antikanker dan antioksidan. Rumus molekul lignan baru
tersebut adalah C6H20O6 dan berstruktur 5{4(4methoxyphenyl tetrahydrofuro
-[3,4 – C] furan-1-yl)-benzene-1,2,3, triol}.
Arti Ekonomi Mahkota Dewa
Tanaman mahkota dewa merupakan salah satu tanaman yang memiliki
potensi tinggi untuk dikembangkan menjadi bahan obat, karena tanaman tersebut
diketahui mempunyai khasiat untuk menyembuhkan berbagai macam penyakit.
Buah mahkota dewa dapat langsung digunakan dalam bentuk simplisia, yaitu
buah dipotong kecil-kecil tanpa terkena bijinya, selanjutnya dioven ataupun
dijemur dengan panas matahari. Simplisia tersebut langsung dapat digunakan
Pengolahan hasil mahkota dewa dalam bentuk lain yaitu dalam bentuk
serbuk dari buah dan biji, kapsul, tablet, dan liquid yang biasanya dicampur
dengan madu. Sisi ekonomi lain yang penting dari mahkota dewa yaitu produksi
bahan obat untuk spektrum luas yang mengacu pada suatu proses Agroindustri
fitofarmaka, akan menyebabkan suatu keharusan persediaan bahan baku tanaman
dengan jumlah sangat besar dalam waktu relatif cepat yang nantinya dapat
mengimbangi kontinuitas agroindustri.
Pengembangan obat tradisional ke arah fitofarmaka memiliki peluang
pasar yang sangat besar. Selama ini obat-obat fitofarmaka yang berada di pasaran
masih kalah bersaing dengan obat paten. Oleh karena itu Sjamsuhidayat (1996)
menyatakan bahwa kegiatan yang berkaitan dengan upaya pengembangan
tanaman obat meliputi: 1) pemetaan ekonomis flora alami, 2) seleksi dan
pembuktian keaslian spesies tanaman, 3) pengumpulan data etnomedik dan
etnobotanik, 4) percobaan pemuliaan untuk pengembangan varietas dengan hasil
tinggi, 5) budidaya tanaman skala menengah, 6) penelitian kimia kandungan
tanaman, 7) penelitian analisis kimia kandungan bahan aktif, 8) penelitian
farmakologi dan toksikologi, 9) pembuatan ekstrak tanaman skala pilot plan, 10)
standardisasi ekstrak, 11) formulasi ekstrak ke bentuk sediaan obat, 12) penelitian
toksisitas terhadap formulasi, dan 13) penelitian analisis produk formulasi.
Perbanyakan Tanaman secara in vitro
Teknik Kultur Jaringan
Kultur jaringan dalam bahasa Inggris disebut tissue culture. Tissue berarti
jaringan yaitu sekumpulan sel dengan bentuk dan fungsi yang sama. Culture
berarti kultur yaitu budidaya. Teknik kultur jaringan merupakan suatu metode
untuk mengisolasi atau mengambil bagian tanaman seperti protoplasma, sel,
sekelompok sel, jaringan, dan organ, kemudian menumbuhkannya dalam kondisi
aseptic (bebas hama dan penyakit). Selanjutnya bagian-bagian tersebut dapat
memperbanyak diri dan menjadi tanaman lengkap (Nugroho & Sugito 1996).
Gunawan (1995) mendefinisikan kultur jaringan dengan suatu metode untuk
mengisolasi bagian tanaman seperti protoplasma, sel, sekelompok sel, jaringan,
serta ZPT dalam wadah tertutup yang tembus cahaya agar bagian -bagian tersebut
memperbanyak diri dan beregenerasi kembali menjadi tanaman lengkap.
Teknik kultur jaringan merupakan salah satu metode perbanyakan secara in
vitro. Pada mulanya teknik kultur jaringan ini dilakukan untuk membuktikan
kebenaran teori totipotensi sel. Akan tetapi berkembang untuk penelitian di bidang
fisiologi tanaman dan biokimia.
Menurut Gamborg (1982) kultur jaringan merupakan sejumlah teknik untuk
menumbuhkan organ, jaringan, dan sel tanaman. Jaringan dapat dikulturkan
secara aseptic dalam medium hara. Kemudahan dalam melakukan kultur
tergantung pada jenis tanaman dan asal jaringan.
Prinsip biologi kultur organ dan kultur jaringan, pertama kali diperkenalkan
oleh Haberlandt, seorang ahli fisiologi Jerman pada tahun 1902, dengan cara
menanam sel pada media buatan, akan tetapi sel tersebut gagal tumbuh. Kemudian
tahun 1934, White dari Amerika Serikat berhasil menumbuhkan akar tomat secara
in vitro dengan menambahkan ekstrak ragi dan thiamin. Tahun 1939 White,
Goutheret, dan Noubecort melaporkan hasil penelitian mereka yang berhasil
menumbuhkan jaringan kalus tanaman dalam suatu media sintetis (Hartman &
Kester 1983).
Kultur jaringan menggunakan dasar teori seperti yang telah dikemukakan
oleh Schwann dan Schleiden, yaitu bahwa sel memiliki kemampuan otono m atau
mampu tumbuh mandiri, bahkan memiliki kemampuan totipotensi. Totipotensi sel
merupakan kemampuan setiap sel, pada bagian manapun dari sel tersebut diambil,
apabila diletakkan dalam lingkungan yang sesuai akan tumbuh menjadi tanaman
yang sempurna (Nugroho & Sugito 1996).
Totipotensi didefinisikan secara sederhana yaitu kemampuan dari sebuah sel
untuk tumbuh dan berkembang bila tersedia lingkungan luar yang sesuai (Mantell
et al. 1985). Seperti juga teori yang telah dikembangkan oleh beberapa ahli botani
pada permulaan abad ke-20 bahwa sel atau jaringan pada tanaman pada dasarnya
dapat ditanam terpisah dalam suatu kultur in vitro.
Sekarang ini teknik kultur jaringan tidak hanya dimanfaatkan untuk
perbanyakan, tetapi juga untuk tujuan lain seperti mempro duksi senyawa
pemuliaan tanaman bebas penyakit terutama virus, pemuliaan tanaman seperti
melalui polinasi in vitro, manipulasi jumlah kromosom, penyelamatan embryo,
membuat tanaman haploid dengan kultur polen, kultur oval, pembuatan tanaman
hibrida somatik melalui fusi protoplasma (fusi intraspesifik dan interspesifik),
transfer DNA atau organel untuk suatu sifat yang dikehendaki.
Beberapa metode yang ditempuh dalam perbanyakan secara in vitro yaitu:
perbanyakan tunas dari mata tunas aksilar dan pembentukan adventif atau somatik
embrio adventif, yang meliputi morfogenesis langsung dan morfogenesis tidak
langsung (Wattimena 1992). Morfogenesis langsung terjadi karena
pembentukannya terjad i langsung dari bagian jaringan eksplan. Morfogenesis
tidak langsung karena pembentukannya terjadi setelah melalui tahap pembentukan
kalus.
Metode yang pertama yaitu multiplikasi (perbanyakan) tunas dari mata
tunas aksilar lebih banyak digunakan dalam usaha perbanyakan tanaman. Telah
banyak penelitian yang dilakukan, membuktikan bahwa metode tersebut lebih
cepat dalam hal perbanyakan tanaman dan sedikit penyimpangan genetik bahkan
tidak terjadi penyimpangan genetik. Morfogenesis tidak langsung yang melalui
pembentukan kalus, tingkat penyimpangan genetik yang lebih tinggi dan waktu
perbanyakan yang lebih lama.
Syarat awal untuk menerapkan metode kultur jaringan sebagai suatu cara
perbanyakan pada suatu tanaman yaitu : (1) kecepatan organogenesis atau
embriogenesis untuk pembentukkan plantlet tinggi, (2) plantlet yang dihasilkan
secara in vitro harus mampu bertahan di lapang dan penampakan di lapang seperti
yang diharapkan atau lebih baik, (3) penggunaan kultur jaringan dapat
memberikan keuntungan lebih dibanding sistem perbanyakan secara
konvensional, dan (4) sifat -sifat atau karakteristik yang diinginkan harus dapat
dipertahankan (Brown & Sommer 1982).
Pemanfaatan teknik kultur in vitro dalam bidang agronomi telah
dikemukakan oleh Gunawan (1995) antara lain yaitu membantu perbanyakan
vegetatif tanaman dalam rangka penyediaan bibit dari induk superior,
membersihkan bahan tanaman/bibit dari virus yang ada dalam tubuh induk,
persenyawaan kimia untuk keperluan farmasi dan pewarna untuk industri
makanan dan kosmetik di dalam kultur sel.
Menurut George dan Sherrington (1984) ada 2 (dua) macam kemungkinan
pertumbuhan tanaman in vitro yaitu pertumbuhan terorganisasi dan pertumbuhan
tak terorganisasi. Pertumbuhan terorganisasi terjadi pada bagian-bagian tanaman
(organ) seperti titik tumbuh (meristem) pucuk atau akar, daun yang baru/mulai
muncul, kuncup bunga, dan buah-buah kecil yang dikulturkan.
Pertumbuhan tak terorganisasi jarang terjadi di alam, seringkali terjadi
ketika potongan-potongan tanaman yang dikulturkan secara in vitro. Jaringan
-jaringan yang kemudian terbentuk, kekurangan beberapa struktur khas yang dapat
dikenali dan hanya berisi sejumlah sel berbeda jenis yang ditemukan pada
tanaman lengkap yang selanjutnya disebut kalus.
Organogenesis dari eksplan membentuk tunas melalui kalus atau tanpa kalus
tergantung dari ZPT, jenis eksplan, jenis tanaman, dan media yang digunakan.
Jenis dan konsentrasi ZPT yang ditambahkan, akan mempengaruhi ZPT yang
terkandung dalam jaringan dan selanjutnya akan membentuk arah perkembangan
organogenesis dari eksplan. Auksin dan sitokinin merupakan kelompok ZPT yang
penting untuk meregenerasikan tanaman dari eksplan. Regenerasi tanaman dapat
dilakukan secara langsung atau melalui dua tahap yaitu media induksi kalus dan
media induksi tunas adventif.
Eksplan dan Regenerasi Tanaman
Eksplan diartikan sebagai bagian tanaman yang digunakan sebagai bahan
untuk inisiasi suatu kultur (Gunawan 1988). Eksplan yang ditanam dalam media
yang sesuai dapat beregenerasi melalui proses organogenesis. Hal-hal yang perlu
dipertimbangkan dalam menentukan eksplan yang tepat adalah pemilihan bagian
tanaman sebagai sumber eksplan sebelum dikulturkan (Gunawan 1992).
Pemilihan eksplan yang tepat sangat mempengaruhi keberhasilan kultur
jaringan suatu tanaman. Jenis eksplan yang digunakan sangat bervariasi
tergantung dari spesies, kultivar, dan tujuan yang hendak dicapai. Apabila
informasi yang jelas mengenai spesies atau kultivar tanaman yang akan
dikulturkan tidak tersedia, dapat dipakai informasi dari spesies atau kultivar yang
Bentuk pertumbuhan yang berkembang dari eksplan atau inokulum yang
dipakai tergantung pada 2 (dua) hal yaitu potensi genetik tanaman yang dibiakkan
serta lingkungan fisik dan kimia tempat tanaman tersebut dibiakkan. Secara umum
semua spesies tanaman dapat diperbanyak secara kultur jaringan jika telah
diketahui kebutuhan hara, hormon tanaman, dan cara pembiakannya (Hartmann &
Kester 1983).
Sumber eksplan berpengaruh terhadap pertumbuhan dan arah perkembangan
morfogenetik. Pemilihan eksplan perlu dipertimbangkan tujuan dari kulturnya.
Untuk mendapatkan kalus dan/atau organogenesis, sebaiknya daun berikut tulang
daun juga dipergunakan, tetapi pada beberapa spesies terdapat perbedaan dalam
kemampuan membentuk tunas adventif (Gunawan 1992).
Murashige (1974) menyatakan bahwa musim ketika eksplan diambil,
kualitas tanaman secara keseluruhan, kondisi aseptik media dan eksplan, ukuran
dan umur fisiologis tanaman mempengaruhi keberhasilan regenerasi.
Keberhasilan kultur jaringan akan lebih besar apabila eksplan yang digunakan
masih mempunyai sifat meristematik.
Pemilihan ukuran eksplan juga memerlukan perhatian khusus, tergantung
pada tujuan pembiakkan. Apabila ukuran eksplan terlalu kecil (< 20 mm) akan
menyebabkan daya tahan tanaman berkurang. Sedangkan ukuran eksplan yang
terlampau besar (> 20 mm) menyebabkan eksplan mudah terkontaminasi.
Selanjutnya menurut Katuuk (1989) potongan jaring an atau organ yang
dikulturkan dinamakan eksplan. Oleh karena kecilnya potongan jaringan tersebut
maka teknik perbanyakan tanaman cara ini dinamakan mikropropagasi.
Mikropropagasi terbagi menjadi 2 (dua) macam yaitu mikropropagasi material
vegetatif (kultu r meristem, kultur pucuk, kultur tunas adventif, kultur kalus, kultur
sel/suspensi, dan kultur protoplas) dan mikropropagasi material reproduktif
(kultur polen/anther, kultur ovari dan ovul, kultur embrio, dan kultur biji).
Mikropropagasi mempunyai urutan kerja sesuai dengan perkembangan
eksplan (Katuuk 1989). Hartmann dan Kester (1983) telah memisahkan 5 (lima)
tahap kegiatan dihubungkan dengan perkembangan eksplan, antara lain yaitu
tahap persiapan (tahap 0), tahap inisiasi (tahap I), tahap multiplikasi (tahap II),
Regenerasi tanaman melalui kultur jaringan dapat diperoleh melalui 3
(tiga) cara yaitu pembentukan tunas samping (aksilar), pembentukan tunas
adventif (langsung dari organ maupun dari jaringan kalus) dan embriogenesis
somatik (Gunawan 1988). Jaringan muda secara umum mudah membentuk kalus
(Gamborg & Shyluk 1981). Regenerasi tunas secara in vitro dapat dilakukan
dengan menggunakan berbagai bagian tanaman seperti batang, tunas pucuk,
kotiledon, akar, embrio (Evans et al. 1981), umbi, bulb, buah, dan bagian -bagian
bunga (Gamborg & Shyluk 1981), serta daun (Lee et al. 1994). Regenerasi terjadi
melalui perimbangan auksin dan sitokinin yang tepat.
Eksplan harus disterilkan sebelum dikulturkan, begitu pula dengan alat dan
media yang digunakan harus disterilkan dan disimpan dalam kondisi aseptik
(George & Sherrington 1984). Gunawan (1988) menyatakan bahwa beberapa jenis
bahan yang digunakan untuk proses sterilisasi eksplan antara lain kalsium
hipoklorit, natrium hipoklorit, alkohol, benlate, dan HgCl.
Faktor yang sangat menentukan regenerasi tunas adalah jenis dan
konsentrasi ZPT, serta tipe dan umur eksplan. Menurut Hartmann & Kester
(1983) ada 5 (lima) tipe regenerasi vegetatif dalam kultur jaringan yaitu kultur
meristem, kultur pucuk, inisiasi tunas adventif, organogenesis, dan
embryogenesis. Penggunaan teknik in vitro untuk tujuan perbanyakan vegetatif
merupakan bidang yang paling maju.
Pelestarian plasma nutfah in vitro mempunyai beberapa keuntungan
dibandingkan dengan cara in situ. Keuntungan tersebut antara lain yaitu hemat
dalam pemakaian ruang, dapat menyimpan tanaman langka yang hampir punah,
dapat digunakan untuk tanaman yang tidak menghasilkan biji, bebas dari segala
gangguan hama dan penyakit, serta dapat disimpan dalam keadaan bebas penyakit
(Wattimena 1992).
Medium Kultur Jaringan
Keberhasilan penggunaan metoda kultur jaringan sangat bergantung pada
medium yang digunakan. Medium kultur jaringan tanaman tidak hanya terdiri atas
unsur hara makro dan mikro, tetapi juga karbohidrat yang pada umumnya berupa
gula untuk menggantikan unsur karbon yang biasanya dari atmosfer melalui
(1984) bahwa keberhasilan metode kultur jaringan sangat ditentukan oleh media
yang digunakan. Bahan -bahan yang ditambahkan pada media kultur tergantung
dari jenis dan fase pertumbuhan tanaman yang dikulturkan (Hartmann & Kester
1983).
Telah difahami bahwa media kultur in vitro mengandung bahan-bahan
esensial. Bahan esensial terdiri atas air, garam -garam anorganik, sumber karbon
dan energi, vitamin, dan zat pengatur tumbuh tanaman. Nitrogen diperlukan
tanaman dalam bentuk NO3- dan NH4+. Ketersediaan nitrogen dalam bentuk NH4+
lebih besar daripada NO3-, dengan perbandingan mendekati 4 : 1. NH4+ didapat
dari senyawa NH4+OH yang merupakan salah satu bahan yang terkandung dalam
komposisi media MS (Lampiran 3). Unsur P diambil oleh tanaman dalam bentuk
H2PO4- yang berasal dari KH2PO4 pada media MS. K dibutuhkan tanaman dalam
bentuk garam anorganik. S dan Mg pada media MS tersedia dalam senyawa
Mg2SO4.7 H20. Ca pada media MS dalam bentuk garam CaCl.2H20. Unsur –
unsur mikro yang diperlukan terdapat pada larutan stok C, E, dan F pada
komposisi media MS (Lampiran 3). Vitamin pada larutan stok G dan H.
Komposisi formulasi dari suatu medium, menurut Wetherell (1982), harus
mengandung hara esensial makro dan mikro serta sumber tenaga dan biasanya
ditambah ZPT serta agar-agar. Tiap tanaman membutuhkan 6 (enam) unsur hara
makro yaitu nitrogen, kalium, magnesium, kalsium, belerang, dan fosfor serta 7
(tujuh) unsur hara mikro yaitu besi, mangan, seng, tembaga, boron, molibden, dan
khlor dalam bentuk ikatan kimia dan perbandingan yang sesuai.
Banyak formulasi medium yang ada, masing-masing berbeda dalam hal
kuantitas maupun kualitas komponennya. Salah satu formulasi yang banyak
digunakan adalah Murashige & Skoog (MS) yang telah ditemukan dan dipublikasi
oleh Toshio Murashige dan Skoog pada tahun 1962. Formulasi dasar mineral dari
MS ternyata dapat digunakan untuk sejumlah besar spesies tanaman dalam
perbanyakan in vitro.
Medium kultur yang memenuhi syarat adalah medium yang mengandung
hara makro dan mikro dalam kadar serta perbandingan tertentu, serta sumber
tenaga (umumnya digunakan sukrosa). Seringkali mengandung satu atau dua
sukrosa merupakan sumber karbon terbaik. Konsentrasi sukrosa yang sering
digunakan berkisar antara 1 – 5%.
Sumber karbon yang dapat digunakan adalah sukrosa, glukosa, ataupun
fruktosa. Gunawan (1992) menyatakan bahwa vitamin yang sering digunakan
dalam media kultur adalah thiamin (B1), asam nikotinat (B3), dan piridoksin (B6).
Penambahan myo-inositol juga dapat memperbaiki pertumbuhan dan
morfogenesis tanaman. Gula pasir cukup memenuhi syarat untuk mendukung
pertumbuhan kultur (Gunawan 1988). Gula berperan sebagai sumber energi dan
berfungsi mengatur tekanan osmotik media. Pada media MS, setengah dari
potensial osmotiknya disebabkan oleh gula (George & Sherrington 1984).
Bhojwani dan Razdan (1983) menyatakan bahwa sukrosa yang diautoklaf
mempunyai pengaruh yang lebih baik daripada sukrosa yang disterilisasi dengan
filter. Selama diautoklaf ternyata sukrosa mengalami hidrolisis menjadi bentuk
gula yang kegunaannya lebih efisien. Proses ini terjadi karena kerja enzim
invertase yang terdapat dalam dinding sel (Burstorm 1957) atau enzim
ekstraseluler yang dilepaskan (Street 1977).
Kondisi Fisik Media
Kepadatan media merupakan kondisi fisik media yang memiliki pengaruh
besar terhadap pertumbuhan tanaman pada kultur in vitro. Kepadatan media dapat
berarti media berbentuk padat atau cair. Komposisi kimia antara media padat dan
cair adalah sama, yang membedakan adalah penambahan agar-agar sebagai bahan
pemadat pada media padat.
Media Murashige dan Skoog (MS) merupakan salah satu jenis media tanam
yang banyak digunakan dalam teknik kultur jaringan. Terdapat dua bentuk media
tanam yang sering digunakan yaitu media padat dan media cair. Menurut
Wattimena et al. (1992) beberapa keuntungan penggunaan media padat yaitu
apabila menggunakan eksplan berukuran kecil maka akan mudah terlihat, eksplan
berada di atas permukaan media sehingga tidak memerlukan alat bantu untuk
aerasi serta tunas dan akar akan tumbuh teratur pada medium yang diam.
Pierik (1987) menyatakan bahwa pertumbuhan dan diferensiasi organ
berbeda sama sekali antara medium cair dengan medium padat. Pada medium cair
terbentuk, berlawanan dengan pembentukan tunas-tunas tersebut pada medium
padat.
Media padat umumnya lebih disukai dalam kultur organ bahkan cenderung
menambah kalus (Stone 1963; Baker & Kinnaman 1973, diacu dalam Bhojwani &
Razdan 1983). Menurut Quak (1977) pada media padat konsentrasi agar-agar
yang biasa dipakai berkisar antara 0,6 – 0,8%. Agar-agar tidak dicerna oleh enzim
tanaman dan tidak bereaksi dengan senyawa-senyawa penyusun media (George &
Sherrington 1984). pH media kultur secara umum berkisar antara 5.8 – 6.0.
Kisaran pH tersebut mempengaruhi tekanan osmotik dan memungkinkan
pertukaran kation dan anion dari garam-garam anorganik antara media tanam dan
sel tanaman. Garam merupakan suatu zat yang dihasilkan karena bersatunya anion
dari asam dengan kation dari basa, sedangkan ion H+ dari asam dan ion OH- dari
basa bersenyawa merupakan air. pH juga mempengaruhi aktivitas enzim, pada pH
tertentu suatu enzim mengubah substrat menjadi hasil akhir. Perubahan pH dapat
membalik aktivitas enzim menjadi pengubah hasil akhir menjadi substrat
(Dwidjoseputro 1994).
Zat Pengatur Tumbuh
Wattimena (1988) menyatakan bahwa di dalam tubuh tanaman terdapat
senyawa khusus pembentuk organ seperti gula, pati, protein, asam-asam organik,
asam amino, dan asam nukleat. Selain senyawa-senyawa tersebut, tanaman juga
mengandung senyawa-senyawa pendorong dimulainya proses -proses biokimia.
Senyawa ini berfungsi sebagai zat pemicu (trigger substances). Zat pemicu
tersebut lebih dikenal dengan fitohormon.
Definisi fitohormon menurut Wattimena (1988) yaitu senyawa organik
bukan nutrisi tanaman yang aktif dalam jumlah kecil (10-6 – 10-5 M), disintesis
pada bagian tertentu tanaman dan umumnya ditranslokasi ke bagian lain dimana
zat tersebut menimbulkan respons biokimia, fisiologi, dan morfologi. Fitohormon
merupakan senyawa organik bukan nutrisi yang dalam konsentrasi rendah (< 1
mM) mendorong, menghambat atau secara kualitatif mengubah pertumbuhan dan
Semua hormon tanaman sintetik yang mempunyai sifat fisiologis dan
biokimia yang serupa dengan hormon tanaman adalah zat pengatur tumbuh
(Wattimena 1992). Dengan demikian, termasuk dalam zat pengatur tumbuh adalah
fitohormon dan fitohormon sintetik. Pertumbuhan dan morfogenesis tanaman
secara in vitro dikendalikan oleh keseimbangan dan interaksi ZPT yang berada di
dalam eksplan. Dengan demikian hal ini akan tergantung dari ZPT endogen dan
ZPT eksogen yang diserap dari media tumbuh.
Reinert dan Bajaj (1977) berpendapat bahwa rediferensiasi organ dapat
dimanipulasi dengan sasaran utamanya pada pengaruh interaksi hormon tanaman
dan unsur ZPT. Interaksi yang tidak kentara antara kelompok-kelompok hormon
tumbuh auksin, sitokinin, gibberelin, absisik, dan ethilen baik secara langsung
atau tidak langsung, sendiri atau dalam kombinasi sinergis telah memberikan
suatu wawasan hubungan timbal balik keberadaan sel-sel yang berbeda, jaringan
dan organ-organ, dalam perkembangan tanaman secara terintegrasi.
ZPT bertindak secara sinergis dalam tindakannya sebagai penyebab respons,
seperti yang dinyatakan Gardner et al. (1991). Dalam kultur jaringan, ada 2 (dua)
golongan ZPT yang sangat penting, yaitu auksin dan sitokinin. ZPT tersebut
mempengaruhi pertumbuhan dan morfogenesis dalam kultur sel, kultur jaringan,
dan kultur organ (Karjadi 1996).
Respons tanaman terhadap ZPT tergantung dari fase pertambahan dan
perkembangan tanaman serta genotipe tanaman (Wattimena 1992). ZPT
memegang peranan penting dalam pertumbuhan dan perkembangan kultur. Faktor
yang perlu mendapat perhatian dalam penggunaan ZPT antara lain yaitu jenis ZPT
yang digunakan, konsentrasi, urutan penggunaan, dan periode masa induksi dalam
kultur tertentu (Gunawan 1995).
Pertumbuhan dan morfogenesis tanaman secara in vitro dikendalikan oleh
keseimbangan dan interaksi dari ZPT yang berada di dalam eksplan. Jadi dalam
hal ini tergantung dari ZPT endogen dan eksogen yang diserap dari media
tumbuh. Auksin dan sitokinin merupakan kelompok ZPT yang penting untuk
meregenerasikan tanaman dari eksplan. Regenerasi tanaman dapat dilakukan
secara langsung atau melalui 2 (dua) tahap yaitu media induksi kalus dan media
George dan Sherrington (1984) menggambarkan suatu keseimbangan auksin
dan sitokinin dalam proses morfogenesis eksplan dalam kultur jaringan yang
merupakan perluasan dari konsep Skoog dan Miller pada tahun 1957. Beberapa
konsep tersebut yaitu embriogenesis memerlukan nisbah auksin -sitokinin yang
tinggi, pembentukan kalus dari tanaman dikotil tetap memerlukan sitokinin
disamping auksin yang tinggi. Pada tanaman monokotil pembentukan kalus hanya
membutuhkan auksin yang tinggi tanpa sitokinin, pembentukan tunas adventif di
samping memerlukan sitokinin dalam taraf konsentrasi yang tinggi tetap
diperlukan juga auksin dalam konsentrasi rendah, proliferasi tunas aksilar hanya
memerlukan sitokinin dalam konsentrasi yang tinggi tanpa auksin atau auksin
dalam konsentrasi sangat rendah, dan pembentukan akar pada stek in vitro hanya
memerlukan auksin tanpa sitokinin atau sitokinin dalam konsentrasi yang rendah
sekali.
Wattimena (1988) mengklasifikasi ZPT menjadi 6 (enam) golongan, yaitu
auksin, gibberelin, sitokinin, asam absisik (ABA), etilen, dan retardan.
Senyawa-senyawa poliamin (putresin, spermidin, spermin), polifenolik dan alkohol berantai
panjang (triakontanol) sering digolongkan ke dalam ZPT yang sangat penting
dalam kultur jaringan, yaitu auksin dan sitokinin.
Auksin
Auksin ditemukan oleh Frits Went pada tahun 1962 dari asal kata auxein
(bahasa Yunani yang berarti meningkatkan). Auksin tersebut diketahui sebagai
asam indolasetat (IAA). Kemudian kelompok hormon dan zat pengatur tumbuh
lain yang menimbulkan respons fisiologi seperti yang dihasilkan oleh IAA
digolongkan dalam kelompok auksin. Zat pengatur tumbuh yang digolo ngkan
auksin antara lain yaitu: asam α-naftalenasetat (NAA), asam
2,4-diklorofenoksiasetat (2,4-D), asam metil-4-klorofenoksiasetat (MCPA), asam
2-naftalosiasetat (NOA), asam 4-klorofenoksiasetat (4 -CPA), asam p
-klorofenoksiasetat (PCPA), asam 2,4,5-tri-klorofenoksiasetat (2,4,5-T), dan asam
3,6-dikloroanisik (dikamba), asam 4-amino -3,5,6-trikloropikolinik (pikloram).
Peran auksin sangat banyak berdasarkan laporan -laporan penelitian, antara
lain yaitu membesarkan sel, meningkatkan kandungan asam nukleat sel,
pembentukan dan degradasi sel, sebagai efektor alosterik beberapa enzim, dan
menginduksi terjadinya kalus. Selain itu, peran auksin secara umum pada tanaman
yaitu pembelahan sel, dominan si apikal, pembentukan akar baru, pembentukan
tunas, dan pembentukan buah partenokarpi (Davies 1995; Wattimena 1988).
Peran auksin yang pertama (Wetherell 1982) adalah merangsang
pembelahan dan pembesaran sel yang terdapat pada pucuk tanaman, dan
menyebabkan pertumbuhan pucuk-pucuk baru. Peran auksin yang kedua adalah
merangsang pembentukan akar. Beberapa eksplan memproduksi auksin secara
alami dalam jumlah cukup, tetapi kebanyakan membutuhkan tambahan, paling
tidak auksin yang tidak stabil. Penambahan auksin dalam jumlah yang lebih besar,
atau penambahan auksin yang lebih stabil, misalnya NAA atau 2,4 -D cenderung
menyebabkan terjadinya pertumbuhan kalus pada kultur in vitro dan menghambat
regenerasi pucuk tanaman.
Menurut Wattimena et al. (1992) auksin terutama untuk pertumbuhan kalus,
suspensi sel, pertumbuhan akar, bersama-sama dengan sitokinin dapat mengatur
tipe morfogenesis yang dikehendaki. Selain itu, auksin dalam kultur in vitro
berperan dalam pembentukan kalus, khlorofil, morfogenesis akar dan tunas, serta
embriogenesis. Bentuk-bentuk auksin yang biasa ditambahkan ke dalam media
kultur adalah 2,4-D, IBA, NAA, dan IAA.
Sitokinin
Sitokinin pertama kali ditemukan oleh Carlos Miller pada tahun 1954, yang
pada saat itu menemukan bahwa sitokinin merupakan senyawa sangat aktif yang
terbentuk dari hasil penguraian sebagian DNA tua sperma ikan hering atau DNA
yang diautoklaf yang menyebabkan kalus tembakau secara terus menerus. Pada
tahun 1958 Thimann dari universitas Harvard (diacu dalam Wetherell 1982),
menemukan bahwa hormon-hormon sitokinin mampu mengatasi pengaruh
dominansi apikal dan berhasil membuktikan bahwa kinetin memacu pertumbuhan
tunas lateral. Sitokinin alami ditemukan lebih dari 30 jenis dan terdapat dalam
bentuk sitokinin bebas sebagai glukosida atau ribosida. Sitokinin alami yang
paling banyak digunakan dalam kultur in vitro yaitu zeatin dan 2-iP
Sitokinin sintetik dapat dibuat dari senyawa-senyawa kimia yang analog
dengan sitokinin alami dan mempunyai aktivitas sitokinin yang tinggi. Sitokinin
sintetik yang banyak digunakan dalam kegiatan kultur in vitro yaitu kinetin, BA
(6-benzyladenin), PBA, 2Cl-4PU, 2,6Cl-4PU, dan thidiazuron. Secara
terminologi, sitokinin berfungsi dengan aktivitas yang berkaitan dengan proses
pembelahan sel (sitokinesis). Namun demikian masih banyak lagi peran sitokinin,
antara lain yaitu menstimulir pembelahan sel, proliferasi kalus, pembentukan
tunas, mendorong proliferasi meristem ujung, menghambat pembentukan akar,
mendorong pembentukan klorofil pada kalus. Peran sitokinin secara umum pada
tanaman yaitu menghambat penuaan, transport zat hara, mendorong proses
morfogenesis, pertunasan, pembentukan kloroplas, pembentukan umbi pada
kentang, pemecahan dormansi, pembukaan stomata, pembungaan, dan
pembentukan buah partenokarpi (Davies 1995; Wattimena 1988).
Sitokinin digunakan untuk merangsang pembentukan tunas dan memecah
dormansi sel (Hartmann & Kester 1983). Selain itu sitokinin juga merupakan ZPT
yang berperan dalam mendorong pembelahan sel. Sitokinin alami oleh tanaman
adalah zeatin. Sedangkan kelompok sitokinin sintetik yang biasa digunakan
diantaranya adalah BA (Wattimena 1988). Regenerasi terjadi melalui
perimbangan auksin dan sitokinin yang tepat.
Sitokinin merupakan turunan dari basa adenin, berperan dalam pengaturan
pembelahan sel dan jaringan, morfogenesis (Gunawan 1988), menghambat
pembentukan protein dan khlorofil serta menghambat penuaan (senescence)
(Wattimena 1988). Semakin tinggi konsentrasi sitokinin maka semakin banyak
tunas terbentuk, tetapi pertumbuhan masing -masing tunas terhambat (George &
Sherrington 1984; Wattimena 1988; dan Pierik 1987).
Sitokinin bersama-sama auksin diperlukan untuk menginduksi kalus
tanaman dikotil, sedangkan untuk tanaman monokotil sitokinin tidak terlalu
penting dan pada tanaman ini auksin diperlukan dalam jumlah yang lebih besar
(George 1993). Murashige (1974) menyatakan dalam penggunaan ZPT termasuk
auksin dan sitokinin harus diperhatikan macam dan konsentrasinya karena ZPT
yang berperan dalam semua fase perkembangan tanaman, dari pembelahan dan
pembesaran sel sampai pembentukan bunga dan buah (Skoog & Amstrong 1970).
Penelitian ini menggunakan ZPT NAA dan 2,4-D dari golongan auksin dan
BA dari golongan sitokinin. Hal ini didasarkan pada studi pustaka yang
memaparkan berbagai penelitian yang menggunakan ketiga ZPT ini pada berbag