SKRIPSI
OLEH : Larosa Harahap
110301008
PROGRAM STUDI AGROTEKNOLOGI FAKULTAS PERTANIAN
PENGARUH APLIKASI GA3 DALAM PERTUMBUHAN DAN PERKEMBANGAN TUNAS MIKRO TANAMAN KARET (Hevea brasiliensisMuell. Arg) SECARA IN VITRO
SKRIPSI
OLEH :
LAROSA HARAHAP/110301008 AGROEKOTEKNOLOGI
Skripsi Sebagai Salah Satu Syarat Untuk Mendapatkan Gelar Sarjana di Fakultas Pertanian Universitas Sumatera Utara, Medan
PROGRAM STUDI AGROTEKNOLOGI FAKULTAS PERTANIAN
Judul Penelitian : Pengaruh Aplikasi GA3 Dalam Pertumbuhan Dan Perkembangan Tunas Mikro Tanaman Karet (Hevea brasiliensisMuell. Arg)
Secara In Vitro
Nama : Larosa Harahap
NIM : 110301008
Program Studi : Agroekoteknologi
Minat Studi : Pemuliaan Tanaman
Disetujui oleh : Komisi Pembimbing
(Luthfi A. M Siregar, SP. MSc. Ph.D) (Dr. Diana Sofia Hanafiah, SP, MP
Ketua Anggota
)
Mengetahui :
(
ABSTRACT
LAROSA HARAHAP, 2015 : The effect application GA3 growth
and development of micro shoot of Rubber Tree(Hevea brasiliensisMuell. Arg.) in vitro supervised by Luthfi A. M Siregar and Diana Sofia Hanafiah.
The aim of the research was to know the effect application of GA3
in formation micro shoot induction through in vitro. The research was conducted
at the rubber plant microcutting PT Perkebunan Nusantara III Kebun Gunung
Pamela Laboratory, Tebing Tinggi, North Sumatera Indonesia from April 2015
to Juli 2015. The Completely randomize design was used with two factors,i.e.:
the addition of GA3 (GA3 0 mg/l; GA3 0.5 mg/l; GA3 1 mg/l; GA3 1.5 mg/l)
and the immersion of nodes (GA3 0 mg/l; GA3 5 mg/l; GA3 10 mg/l; GA3 15 mg/l)
with seven replications.
The result showed that the interraction the addition of GA3 and the
immersion of nodes, significantly affected the number of shoot, the shoot length
and the number of leaves will form. G2T2 was the best combination GA3 in
growth and development of micro shoot in vitro.
ABSTRAK
LAROSA HARAHAP, 2015 : Pengaruh Aplikasi GA3 Dalam Pertumbuhan Dan
Perkembangan Tunas Mikro Tanaman Karet (Hevea brasiliensisMuell. Arg)
Secara In Vitro,dibimbing oleh Luthfi A.M Siregar dan Diana Sofia Hanafiah. Penelitian ini bertujuan untuk mengetahui pengaruh GA3 dalam
pembentukan tunas tanaman Karet (Hevea brasiliensisMuell. Arg) secara
in vitro. Penelitian ini dilaksanakan di Laboratorium Microcutting Tanaman Karet PT. Perkebunan Nusantara III Kebun Gunung Pamela Tebing Tinggi,
Sumatera Utara, Indonesia. Dimulai pada bulan April 2015 sampai dengan
Juli 2015. Rancangan yang digunakan adalah rancangan acak lengkap dengan
2 faktor perlakuan yaitu penambahan GA3 dalam media dengan 4 taraf yaitu
GA3 0 mg/l; GA3 0.5 mg/l; GA3 1 mg/l; GA3 1.5 mg/l sedangkan perendaman
nodus dengan 4 taraf yaitu GA3 0 mg/l; GA3 5 mg/l; GA3 10 mg/l; GA3 15 mg/l
dengan 7 ulangan.
Hasil penelitian menunjukkan interaksi perlakuan penambahan GA3 dalam
media, perendaman nodus memberikan pengaruh sangat nyata terhadap jumlah
tunas, panjang tunas dan jumlah terbentuk bakal daun. G2T2 merupakan
kombinasi GA3 terbaik dalam pertumbuhan dan perkembangan tunas mikro
tanaman karet.
RIWAYAT HIDUP
Larosa Harahap dilahirkan di Kisaran pada tanggal 27 Oktober 1993,
putri dari pasangan Sabaruddin Harahap dan Jamilah. Penulis merupakan putri
keempat dari enam bersaudara.
Pendidikan formal yang pernah ditempuh adalah SD Negeri 010093 lulus
pada tahun 2005, SMP Negeri 1 Kisaran lulus tahun 2008 dan tahun 2011 penulis
lulus dari SMA Negeri 1 Kisaran dan pada tahun yang sama lulus seleksi
penerimaan mahasiswa baru melalui jalur SNMPTN (Seleksi Nasional Masuk
Perguruan Tinggi Negeri) pada program studi Agroekoteknologi, Fakultas
Pertanian Universitas Sumatera Utara, Medan.
Selama mengikuti perkuliahan, penulis berkesempatan membantu dosen
sebagai asisten dalam menjalankan praktikum di Laboratorium Genetika Populasi
dan Kuantitatif tahun 2015.
Penulis melaksanakan praktek kerja lapangan (PKL) Di PT Meskom Agro
KATA PENGANTAR
Puji dan syukur penulis ucapkan kepada Allah SWT karena atas berkat
dan rahmat-Nya penulis dapat menyelesaikan skripsi yang berjudul “Pengaruh Aplikasi GA3 Dalam Pertumbuhan Dan Perkembangan Tunas Mikro Tanaman Karet (Hevea brasiliensisMuell. Arg) Secara In Vitro” yang merupakan salah satu syarat untuk mendapatkan gelar sarjana di Program Studi
Agroteknologi Fakultas Pertanian Universitas Sumatera Utara, Medan.
Pada kesempatan ini penulis mengucapkan terima kasih kepada
Bapak Luthfi A. M. Siregar, SP. MSc. Ph.D selaku ketua komisi pembimbing dan
Ibu Dr. Diana Sofia Hanafiah, SP, MP selaku anggota komisi pembimbingyang
telah memberikan arahan serta bimbingan kepada penulis sehingga dapat
menyelesaikan skripsi ini. Ucapan terima kasih juga disampaikan kepada kedua
orang tua tercinta Ayahanda tercinta Sabaruddin Harahap dan Ibunda tercinta
Jamilah yang senantiasa mencurahkan kasih sayang, dorongan, semangat, dan
dukungan baik moril maupun materil serta do’a untuk penulis. Kemudian buat
Kakak, Abang, Adek tercinta Apriana Harahap, SPd, Milanti Harahap, SPd,
Putera Ramadhan Harahap, SPd, Zulkifli Harahap dan Zulinar Harahap yang telah
memberikan semangat, nasehat dan dukungan dalam penyelesaian skripsi ini.
Disamping itu ucapan terima kasih penulis saya sampaikan kepada
Bapak Irvin Fauzan Lubis, SP. MM Selaku staff urusan Inkubasi Bisnis Karet
PTPN III Kebun Gunung Pamela, Laboran Asni, SP, Heri Hidayat, SP,
Lidya Sundari, SP, dan Permata Sari Harahap, SP yang telah banyak memberikan
dukungan dan bantuan selama penulis melaksanakan peneltian dan juga kepada
SE, Herfita Rizki Hasanah Gurning, SE dan Khairunnisa Nasution, Amd dan
sahabat kuliah rika dan dedek yang telah banyak memberikan semangat dan
dukungan kepada penulis dan juga kepada seluruh teman-teman mahasiswa
Agroteknologi 2011 yang telah banyak membantu penulis dalam melaksanakan
penelitian.
Penulis menyadari bahwa skripsi ini masih banyak kekurangan sehingga
penulis mengharapkan kritik dan saran yang bersifat membangun demi
kesempurnaan skripsi ini.
Medan, November2015
DAFTAR ISI
Media Kultur Jaringan ... 12
Lingkungan In Vitro ... 13
Plant Growth Regulator ... 15
Kajian Kultur Jaringan Tanaman Karet ... 18
BAHAN DAN METODE Tempat dan Waktu Penelitian ... 20
Bahan dan Alat Penelitian ... 20
Metode Penelitian ... 20
PELAKSANAAN PENELITIAN Sterilisasi Alat-Alat ... 23
Pembuatan Media... 23
Pembuatan Media Perendaman GA3 ... 24
Sterilisasi Bahan Tanaman di Lapangan ... 25
Pengambilan Bahan Tanaman... 25
Sterilisasi Bahan Tanaman di Laboratorium... 25
Persiapan Ruang Tanam ... 26
Perendaman Nodus ... 26
Pemeliharaan Eksplan ... 27
Peubah Amatan ... 27
Umur Munculnya Tunas (Hari) ... 28
Persentase Munculnya Tunas (%) ... 28
Jumlah Tunas (tunas) ... 28
Panjang Tunas (cm) ... 28
Jumlah Terbentuk Bakal Daun (%)... 28
Jumlah Daun (helai) ... 28
Kehadiran Kalus (visual) ... 29
Warna Kalus (visual) ... 29
Morfogenesis... 29
HASIL DAN PEMBAHASAN Hasil Umur Munculnya Tunas (Hari) ... 30
Persentase Munculnya Tunas (%) ... 31
Jumlah Tunas (tunas) ... 32
Panjang Tunas (cm) ... 33
Jumlah Terbentuk Bakal Daun (%)... 35
Jumlah Daun (helai) ... 37
Pengaruh Aplikasi GA3 Dalam Induksi Tunas Mikro Tanaman Karet Secara In Vitro Terhadap Kehadiran Kalus ... 37
Kehadiran Kalus (visual) ... 37
Warna Kalus (visual) dan Morfogenesis... 37
Pembahasan Pengaruh Penambahan GA3 Dalam Media Terhadap Pertumbuhan dan Perkembangan Induksi Tunas Mikro Tanaman Karet ... 38
Pengaruh Perendaman Nodus Terhadap Pertumbuhan dan Perkembangan Induksi Tunas Mikro Tanaman Karet ... 42
DAFTAR TABEL
No. Hal.
1. Pengaruh Penambahan GA3dalam Media dan Perendaman Nodus Sebelum
Pengkulturan terhadap Umur Muncul Tunas (Hari) ... 30
2. Pengaruh Perlakuan Penambahan GA3dalam Media dan Perendaman Nodus
Sebelum Pengkulturan terhadap Persentase Muncul Tunas (%) ... 31
3. Pengaruh Perlakuan Penambahan GA3dalam Media dan Perendaman Nodus
Sebelum Pengkulturan terhadap Jumlah Tunas (tunas) ... 32
4. Pengaruh Perlakuan Penambahan GA3dalam Media dan Perendaman Nodus
Sebelum Pengkulturan terhadap Panjang Tunas (cm) ... 33
5. Pengaruh Perlakuan Penambahan GA3dalam Media dan Perendaman Nodus
Sebelum Pengkulturan terhadap Jumlah Terbentuknya BakalDaun ... 35
6. Pengaruh Perlakuan Penambahan GA3dalam Media dan Perendaman Nodus
Sebelum Pengkulturan terhadap Jumlah Daun (Helai) ... 37
7. Pengaruh Aplikasi GA3 Dalam Induksi Tunas Mikro Tanaman Karet
DAFTAR GAMBAR
No. Hal.
1.a. Eksplan Sebelum Membentuk Tunas (2 MST) ... 31
b. Eksplan Sesudah Membentuk Tunas (6 MST) ... 31
2. Panjang Tunas (6 MST) ... 34
3. Eksplan Membentuk Bakal Daun ... 35
DAFTAR LAMPIRAN
No. Hal.
1. Data Pengamatan Umur Munculnya Tunas (Hari) ... 54
2. Data Transformasi Umur Munculnya Tunas √x + 0.5 ... 55
3. Daftar Sidik Ragam Umur Munculnya Tunas ... 55
4. Data Pengamatan Persentase Munculnya Tunas (%) ... 56
5. Data Pengamatan Jumlah Tunas (Tunas) ... 57
6. Data Transformasi Jumlah Tunas (Tunas) √x + 0.5... 58
7. Daftar Sidik Ragam Jumlah Tunas ... 58
8. Data Pengamatan Panjang Tunas (cm) ... 59
9. Data Transformasi Panjang Tunas √x + 0.� ... 60
10.Daftar Sidik Ragam Panjang Tunas (cm) ... 60
11.Data Pengamatan Jumlah Terbentuk Bakal Daun ... 61
12.Data Transformasi Jumlah Terbentuk Bakal Daun√x + 0.5 ... 62
13.Daftar Sidik Ragam Jumlah Terbentuk Bakal Daun ... 62
14.Data Pengamatan Jumlah Daun (Helai) ... 63
15.Data Transformasi Jumlah Daun√x + 0.5 ... 64
16.Daftar Sidik Ragam Jumlah Daun (helai) ... 64
17.Komposisi Medium Woody Plant Medium (WPM) ... 65
18.Bagan Penelitian... 66
19.Kegiatan penelitian... 67
ABSTRACT
LAROSA HARAHAP, 2015 : The effect application GA3 growth
and development of micro shoot of Rubber Tree(Hevea brasiliensisMuell. Arg.) in vitro supervised by Luthfi A. M Siregar and Diana Sofia Hanafiah.
The aim of the research was to know the effect application of GA3
in formation micro shoot induction through in vitro. The research was conducted
at the rubber plant microcutting PT Perkebunan Nusantara III Kebun Gunung
Pamela Laboratory, Tebing Tinggi, North Sumatera Indonesia from April 2015
to Juli 2015. The Completely randomize design was used with two factors,i.e.:
the addition of GA3 (GA3 0 mg/l; GA3 0.5 mg/l; GA3 1 mg/l; GA3 1.5 mg/l)
and the immersion of nodes (GA3 0 mg/l; GA3 5 mg/l; GA3 10 mg/l; GA3 15 mg/l)
with seven replications.
The result showed that the interraction the addition of GA3 and the
immersion of nodes, significantly affected the number of shoot, the shoot length
and the number of leaves will form. G2T2 was the best combination GA3 in
growth and development of micro shoot in vitro.
ABSTRAK
LAROSA HARAHAP, 2015 : Pengaruh Aplikasi GA3 Dalam Pertumbuhan Dan
Perkembangan Tunas Mikro Tanaman Karet (Hevea brasiliensisMuell. Arg)
Secara In Vitro,dibimbing oleh Luthfi A.M Siregar dan Diana Sofia Hanafiah. Penelitian ini bertujuan untuk mengetahui pengaruh GA3 dalam
pembentukan tunas tanaman Karet (Hevea brasiliensisMuell. Arg) secara
in vitro. Penelitian ini dilaksanakan di Laboratorium Microcutting Tanaman Karet PT. Perkebunan Nusantara III Kebun Gunung Pamela Tebing Tinggi,
Sumatera Utara, Indonesia. Dimulai pada bulan April 2015 sampai dengan
Juli 2015. Rancangan yang digunakan adalah rancangan acak lengkap dengan
2 faktor perlakuan yaitu penambahan GA3 dalam media dengan 4 taraf yaitu
GA3 0 mg/l; GA3 0.5 mg/l; GA3 1 mg/l; GA3 1.5 mg/l sedangkan perendaman
nodus dengan 4 taraf yaitu GA3 0 mg/l; GA3 5 mg/l; GA3 10 mg/l; GA3 15 mg/l
dengan 7 ulangan.
Hasil penelitian menunjukkan interaksi perlakuan penambahan GA3 dalam
media, perendaman nodus memberikan pengaruh sangat nyata terhadap jumlah
tunas, panjang tunas dan jumlah terbentuk bakal daun. G2T2 merupakan
kombinasi GA3 terbaik dalam pertumbuhan dan perkembangan tunas mikro
tanaman karet.
PENDAHULUAN Latar belakang
Sumatera dan Kalimantan adalah daerah penghasilkaret terbesar di
Indonesia dengan sentra produksi tersebar di Sumatera Selatan (668 ribu hektar),
Sumatera Utara(465 ribu hektar), Jambi(444 ribu hektar), Riau (390 ribu hektar),
dan Kalimantan Barat (388 ribu hektar). Sementara Sulawesi Selatan adalah
provinsi yang memiliki luas perkebunan karet terbesar di Sulawesi yaitu sekitar
19 ribu hektar (Janudianto et al., 2013).
Tanaman karet merupakan tanaman tahunan yang mampu memberikan
manfaat dalam pelestarian lingkungan, terutama dalam hal penyerapan CO2 dan
penghasil O2. Bahkan ke depan, tanaman karet merupakan sumber kayu yang
potensial yang dapat mensubtitusi kebutuhan kayu hutan alam yang dari tahun ke
tahun ketersediaannya semakin menurun. Di masa depan, permintaan akan karet
alam dan karet sintetik masih cukup signifikan, karena didorong oleh
pertumbuhan industri otomotif yang tentunya memerlukan ban yang berbahan
baku karet alam (Nasir, 2013).
Perbanyakan bahan tanam karet saat ini dilakukan melalui okulasi
sehingga diperlukan ketersediaan batang bawah dan batang atas. Karena batang
bawah yang digunakan berasal dari biji maka terdapat keragaman antar individu
yang menyebabkan keragaman pada penampilan batang atas, baik dari segi
produksi maupun sifat sekunder lainnya.Batang atas adalah tanaman karet klonal
karena diperbanyak dari bagian vegetatif menggunakan mata tunas, sedangkan
bagian atas tanaman (klon batang atas), sedangkan secarametabolisme batang
bawah membantu penyerapan unsur hara dan air dari dalam tanah (Haris, 2013).
Untuk memenuhi kebutuhan dan meningkatkan kualitas batang bawah
yang homogen dan tidak tergantung musim adalah dengan kultur jaringan. Kultur
jaringan tanaman merupakan salah satu teknologi modern untuk perbanyakan
tanaman dengan kondisi aseptik untuk menghasilkan sejumlah besar tanaman
dalam waktu singkat dari satu tanaman yang dipilih. Microcutting adalah teknologi kultur jaringan tanaman yang telah digunakan untuk pembiakan karet,
biasanya dari batang muda untuk menghasilkan seluruh tanaman yang sama
dengan induknya (Pratama, 2008).
Keuntunganteknik tersebut adalah terbukanya peluang untuk
menghasilkan batang bawah klonalyang selama ini belum pernah ada
padatanaman karet. Penggunaan batang bawahklonal akan meningkatkan
keseragamanpertanaman karet di lapang, karena klonbatang atas didukung oleh
batang bawahyang sama dan lebih seragam, dibandingkandengan batang bawah
asal biji yangdigunakan saat ini. Di samping itu,teknologi perbanyakan tersebut
jugamembuka peluang untuk melakukanseleksi terhadap batang bawah sesuai
dengan karakter yang diinginkan (Haris et al., 2009).
Permasalahan yang muncul dalam proses induksi karet secara in vitro dari penelitian sebelumnya adalah kegagalanbeberapa eksplan untuk tumbuh dan
berkembangserta ukuran tunas yang muncul pendek. Aplikasi teknologi
Giberelin mempunyai peranan dalam mendukung perpanjangan sel
(Cell elongation), aktivitas kambium dan mendukung pembentukan RNA baru dalam sintesa protein (Abidin, 1985). Menurut (George dan Sherrington, 1984)
dalam teknik kultur jaringan GA3 dapat ditambahkan dalam medium karena
dengan penambahan GA3 akan menginduksi eksplan untuk mensintesis auksin
endogen. Konsentrasi GA3 dalam teknik in vitro pada tanaman dikotil yaitu antara 1-8 mg/l (Sodikin, 2005).
Giberelin digunakan pada kultur in vitro tanaman karet karena waktu muncul tunas lambat dan tunas dormansi, maka alternatif yang digunakan dengan
penambahan giberelin. Menurut Jaret, Paul dan Erickson (1980) menyatakan
bahwa penambahan GA3 secara eksogen kedalam media kultur sangat esensial
untuk inisiasi tunas (Warnita, 2011).
Untuk memperoleh tunas-tunas yang normal dari segi ukurannya ±2cm
maka diperlukan giberelin terhadap pembentukan tunas secara in vitro pada tanaman karet maka peneliti tertarik untuk melakukan perbanyakan tanaman karet
dengan pengaruh aplikasi giberelin dan perendaman giberelin sebelum
pengkulturan dalam induksi tunas karet secara in vitro.
Tujuan Penelitian
Untuk mengetahui pengaruh GA3 dalam pembentukan tunas tanaman karet
secara in vitro. Hipotesis Penelitian
Ada perbedaan pertumbuhan dan perkembangan tunas tanaman karetdari
Kegunaan Penelitian
Penelitian ini berguna untuk mendapatkan gelar sarjanadiFakultas
Pertanian Universitas Sumatera Utara, Medan dan sebagai bahan informasi bagi
TINJAUAN PUSTAKA Botani Tanaman
Sistematika bahan tanaman karet (Hevea brasiliensis Muell Arg.) menurut
Steenis (2005) ialah : Kingdom : Plantae, Divisio: Spermatophyta,
Subdivisio : Angiospermae, Kelas: Dicotyledoneae, Ordo : Euphorbiales,
Famili : Euphorbiaceae, Genus : Hevea, Spesies: Hevea brassiliensisMuell Arg.
Tanaman karet adalah anggota famili Euphorbiaceae. Berbentuk pohon, tinggi 10-20 m, bercabang dan mengandung banyak getah susu. Daun
berselang-seling, tangkai daun panjang, tiga anak daun yang licin bertangkai, petiola
pendek, hijau dan memiliki panjang 3.5-30 cm. Helaian anak daun bertangkai
pendek dan berbentuk elips atau bulat telur, pangkal sempit dan tegang, ujung
runcing, sisi atas daun hijau tua dan sisi bawah agak cerah, panjangnya 5-35 cm
dan lebar 2.5-12.5 cm (Sianturi, 2001).
Batang tanaman biasanya tumbuh lurus dan memiliki percabangan yang
tinggi. Dibeberapa kebun karet ada beberapa kecondongan arah tumbuh
tanamannya agak miring kearah utara. Batang tanaman ini mengandung getah
yang dikenal dengan nama lateks (Budiman, 2012).
Daun berselang-seling tangkai daun panjang, satu anak daun yang licin
berkilat. Petiola tipis, hijau dan berpanjang 3.5-30 cm. Helaian anak daun
bertangkai pendek dan berbentuk lonjong oblong atau oblong abovate, pangkal
sempit dan tegang, ujung runcing, sisi atas daun hijau tua dan sisi bawah agak
cerah, panjangnya 5-35 cm dan lebar 2.5-12.5 cm (Steenis, 2005).
banyak dibandingkan bunga betina (60-80 bunga jantan untuk 1 bunga betina).
Bunga jantan dan waktu mekar hanya satu hari kemudian luruh. Bunga betina
mekar selama 3-4 hari, pada waktu yang sama masih ada beberapa bunga jantan
yang mekar (Syamsulbahri, 1996).
Karet merupakan tanaman berbuah polong (diselaputi kulit yang keras)
yang sewaktu masih muda buah berpaut erat dengan rantingnya. Buah karet
dilapisi oleh kulit tipis berwarna hijau dan didalamnya terdapat kulit yang keras
dan berkotak. Tiap kotak berisi sebuah biji yang dilapisi tempurung, setelah tua
warna kulit buah berubah menjadi keabu-abuan kemudian mengering
(Budiman, 2012).
Biji karet besar sedikit padat, ukurannya 2-3.5 x 1.5-3 cm, mengkilat,
bobot satu biji antara 2-4 gram. Perkecambahan biji karet terjadi 7-10 hari
sesudah disemaikan. Bibit karet ataupun tanaman karet dewasa mempunyai
pertumbuhan yang berperiodik, setiap pertumbuhan daun dinamakan mupus atau
flush. Setiap periode pertumbuhan tunas juga dikenal sebagai pertumbuhan daun
payung (Syamsulbahri, 1996).
Kultur Jaringan
Kultur jaringan atau dikenal dengan kultur in vitro merupakan teknik memisahkan bagian dari tanaman seperti tunas terminal, tunas aksilar, daun,
batang atau embrio serta menumbuhkannya di dalam media buatan dalam kondisi
aseptik sehingga membentuk tanaman lengkap. Hal ini didasari oleh adanya daya
totipotensi sel. Terbentuknya tanaman lengkap dari eksplan potongan bagian
genotipe eksplan, media dasar, zat pengatur tumbuh serta lingkungan kultur
seperti pencahayaan maupun kelembaban dan suhu ruangan (Pardal, 2012).
Pada kultur jaringan callusatau struktur yang besar, regenerasi terutama menghasilkan keseragaman tanaman. Sebaliknya, regenerasi dari sel-sel
tumbuhan yang tunggal atau proptoplast seringkali disertai dengan perubahan
kecil atau besar pada fenotipe akhir tanaman. Keadaan ini diberi nama
variasi somaklonal dan banyak dilakukan sebagai cara untuk memperbaiki tanaman, khususnya yang berhubungan dengan hasil serta ketahanan terhadap
penyakit (Smith, 1995).
Teknik kultur jaringan memberikan alternatif terhadap usaha perbanyakan
tanaman secara vegetatif dalam skala yang lebih besar dalam upaya konservasi
dan pengembangan tanaman gaharu dimasa yang akan datang. Ada beberapa
kelebihan yang diperoleh dari perbanyakan tanaman dengan teknik kultur jaringan
diantaranya adalah dapat menghasilkan tanaman yang homogen, berkualitas
tinggi, jumlah yang tidak terbatas, bebas hama dan penyakit, menghasilkan klon
yang lebih unggul, dapat diperbanyak dalam waktu yang relatif singkat, tidak
dibatasi oleh waktu, tetapi membutuhkan keahlian khusus (Iskandaret al., 2006) Proses perbanyakan tanaman karetmelalui teknologi microcutting terdiri atasbeberapa tahap, yaitu kultur primer(primary culture), multiplikasi,
conditioning(hardening), induksi dan inisiasiperakaran serta aklimatisasi (Carron
et al., 2005 ; Haris et al., 2009). Eksplan padatahap kultur primer merupakan potonganbatang tanaman karet muda yangdipelihara dalam polibeg di rumah
dapat diperbanyak melalui subkultur berulang-ulang sehingga kultur primer
merupakan tahap yang menentukan untuk keberhasilan dan keberlanjutan
perbanyakan tanaman menggunakan teknologi tersebut (Haris et al., 2009).
Organogenesis yaitu diferensiasi meristem unipolar, menghasilkan ujung
tunas (shoot tip) yang akan menjadi tunas (caulogenesis) atau ujung akar (root tip) yang akan menjadi akar (rhizogenesis). Proses organogenesis memerlukan dua tahap induksi, masing-masing menggunakan media dengan zat pengatur tumbuh
yang berbeda. Embrio somatik yaitu proses diferensiasi meristem bipolar yang
berupa bakal tunas dan akar. Dua meristem diperlukan untuk pertumbuhan
tanaman utuh. Embrio yang terbentuk selanjutnya akan tumbuh dan berkembang
menjadi tanaman utuh (Yuliarti, 2010).
Organogenesis dan embriogenesis tanaman sangat tergantung ada
kemampuan sel dalam bergenerasi. Peneliti-peneliti terdahulu memulai penelitian
dan mengalami kegagalan dalam meregenerasikan suatu jaringan menjadi
tanaman. Keterbatasan pengetahuan tentang zat pengatur tumbuh menjadi
hambatannya. Setelah ditemukan auksin dan sitokinin serta zat pengatur tumbuh
lainnya, sangat berperan dalam proses diferensiasi sel menjadi organ tertentu,
maka kendala untuk organogenesis dan embriogenesis dapat dieliminir
(Harahap, 2011).
Penggandaan biakan dalamkultur jaringan dapat dilakukan melaluijalur
organogenesis dan embriogenesissomatik. Cara embriogenesissomatik banyak
mendapatBalitbiogenperhatian karena jumlah propagulayang dihasilkan tidak
terbatas dandapat diperoleh dalam waktu yanglebih singkat. Di samping itu,
genetika,penggunaan embrio somatik dapatmempercepat keberhasilan
denganpeluang transformasi yang lebihtinggi karena embrio somatik dapatberasal
dari satu sel somatik. Untukpenyimpanan jangka pendek maupunjangka panjang,
embrio somatikdianggap merupakan bahan tanamanyang ideal untuk
disimpankarena bila diregenerasikan dapat membentuk bibit somatik
(Purnamaningsih, 2006).
Eksplan
Kultur meristem adalah kultur jaringan makanan dengan menggunakan
eksplan (bahan tanaman). Bagian tanaman yang digunakan berupa jaringan
merismatik, misalnya daun muda, ujung akar, ujung batang, keping biji. Dalam
pelaksanaannya teknik kutur meristem, secara berurutan langkah kerja yang harus
dilakukan adalah sebagai berikut:
1. Pembuatan media kultur : media preparasi
2. Pembuatan bahan eksplan : inisiasi
3. Penanaman eksplan : inokulasi
4. Penumbuhan tanaman kultur : inkubasi
5. Pengadaptasian tanaman kultur : aklimatisasi
(Nugroho dan sugito, 2000).
Pada tanaman dikotil, pembelahan sel yang bertanggung jawab untuk
pemanjangan terjadi didalam daerah meristematik tepat dibawah ujung dan
bersamaan dengan diferensiasi jaringan pengangkut primer. Penebalan skunder
berlanjut dalam jaringan batang yang lebih tua tetapi pertumbuhan membujur
biasanya tidak nyata pada ruas-ruas yang memisahkan daun-daun yang telah
Dalam perbanyakan tanaman secara kultur jaringan, eksplan merupakan
faktor penting penentu keberhasilan. Umur fisiologis, umur ontogenetik, ukuran
eksplan, serta bagian tanaman yang diambil merupakan hal-hal yang harus
dipertimbangkan dalam memilih eksplan yang akan digunakan sebagai bahan
awal kultur. Umumnya, bagian tanaman yang digunakan sebagai eksplan adalah
jaringan muda yang sedang tumbuh aktif. Jaringan tanaman yang masih muda
mempunyai daya regenerasi lebih tinggi, sel-sel masih aktif membelah diri, dan
relatif lebih bersih (mengandung lebih sedikit kontaminan) (Yusnita, 2003).
Perbanyakan secara in vitro dapat menggunakanberbagai macam eksplan. Eksplan yang relatif mudahdiinduksi tunasnya adalah eksplan yang memiliki
jaringanmeristem atau bakal tunas seperti tunas terminaldan bakal tunas pada
buku. Untuk mengetahuieksplan yang paling mudah, paling cepat, dan
palingtinggi faktor multiplikasinya, induksi tunas dilakukandengan menggunakan
eksplan tunas terminal, bukusatu tunas dengan daun dan buku satu tunas tanpa
daun (Kosmiatin et al., 2005)
Beberapa genotipe bibit karet yang tersedia di rumah kaca akan digunakan
sebagai eksplan dalam pembiakanmicrocutting tanaman karet. Bahan-bahan karet yang digunakan ini harus diberi perlakuan yang berbeda dalam poses
microcutting. Sehubungan dengan itu hal ini untuk karakterisasi masing-masing genotipe untuk menentukan kualitas genotipe yang berkaitan dengan respon dan
kemampuan pertumbuhan selama proses microcutting. Juga batang bawah yang
digunakan untuk meningkatkan kualitas dan kuantitas dan mengidentifikasi
ciri-ciri morfologi untuk klon batang bawah yang menggunakan teknologi
Pembentukan kalus terjadi karena adanyapelukaan yang diberikan pada
eksplan, sehinggasel-sel pada eksplan akan memperbaiki sel-selyang rusak
tersebut. Pada awalnya terjadipembentangan dinding sel dan penyerapan
air,sehingga sel akan membengkak selanjutnya terjadipembelahan sel
(Sitorus et al., 2011).
Sel-sel pada jaringan atau organ tanaman tidak semua seragam. Berbagai
tipe sel dapat dijumpai dalam jaringan tanaman. Proses dimana sel-sel tumbuh
menjadi terspesialisasi disebut diferensiasi sedangkan proses pertumbuhan dan
diferensiasi individu tanaman disebut perkembangan. Istilah lain yang berkaitan
dengan perkembangan tanaman adalah morfogenesis (Lakitan, 1996).
Tahap multiplikasi diharapkan tunas akan mengalami pemanjangan
dengan demikian terjadi pertambahan ukuran tunas sebelum induksi akar, oleh
karena itu perlu dicari jenis dan konsentrasi zat pengatur tumbuh yang tepat untuk
dapat merangsang pemanjangan tunas. Pemanjangan tunas disertai dengan
membukanya primordia daun menjadi helaian daun. Terkadang pada tahap
pemanjangan tunas diikuti pula dengan multiplikasi tunas. Pada tahapan
pemanjangan tunas, terdapat dua zat pengatur tumbuh yang mempengaruhi yaitu
sitokinin dan gibberelin (Ariyanti, 2014).
Media Kultur Jaringan
Keberhasilan dalam teknologi serta penggunaan metode in vitro terutama disebabkan pengetahuan yang lebih baik tentang kebutuhan hara sel dan jaringan
yang dikulturkan. Hara terdiri dari komponen yang utama dan komponen
tambahan. Komponen utama meliputi garam mineral, sumber karbon, vitamin dan
asam organik, metabolit dan ekstrak tambahan tidak mutlak, tetapi dapat
menguntungkan ketahanan sel dan perbanyakannya (Wetter dan Constabel, 1991).
Media kultur merupakan salah satu faktor penentu keberhasilan
perbanyakan tanaman secara kultur jaringan. Berbagai komposisi media kultur
telah diformulasikan untuk mengoptimalkan pertumbuhan dan perkembangan
tanaman. Kebutuhan nutrisi mineral untuk tanaman yang dikulturkan secara
in vitro pada dasarnya sama dengan kebutuhan hara tanaman yang ditumbuhkan ditanah, meliputi hara-hara makro dan mikro (Yusnita, 2003).
Medium yang digunakan untuk kultur in vitro tanaman dapat berupa medium padat atau cair. Medium padat digunakan untuk menghasilkan kalus yang
selanjutnya diinduksi membentuk tanaman yang lengkap (plantlet), sedangkan medium cair biasanya digunakan untuk kultur sel. Medium yang digunakan
mengandung lima komponen utama, yaitu: senyawa anorganik, sumber karbon,
vitamin, zat pengatur tumbuh, dan suplemen organik (Yuwono, 2006).
Medium padat dapat digunakan untukproliferasi kalus karena
mempercepatpembentukan kalus sekunder dan pembentukankalus embriogenik
remah yanglebih banyak. Sementara pada SPS (sistem perendaman sesaat)
danmedium cair, pembentukan kalus embriogenikremah relatif sedikit,
sehinggaterbentuk lebih banyak sel embriogenikyang menunjang proses
pendewasaanmenjadi embrio somatik. Oleh karena itu, penggunaan medium cair
dan mediumSPS (sistem perendaman sesaat) dapat direkomendasikan
sebagaimedium tumbuh untuk pendewasaan kalusembriogenik menjadi embrio
Hasil penelitian Nursetiadi (2008) media WPM (Woody Plant Medium) merupakan media yang mampu dioptimalkan oleh eksplan untuk pembentukan
tunas. Muncul tunas tercepat yaitu pada media WPM (Woody Plant Medium) dengan konsentrasi BAP 0 ppm + IBA 0.5 ppm dan BAP 1 ppm + IBA 0.5 ppm
dan pada konsentrasi BAP 2 ppm + IBA 0.5 ppm merupakan konsentrasi yang
paling optimal pada panjang tunas dan jumlah daun.
Lingkungan In vitro
Pemuliaan tanaman in vitromencakup semua teknik kultur sel dan jaringan yang meliputi perbanyakan, pengamatan dan manipulasi genetik tanaman tanpa
melibatkan siklus seksual. Pada dasarnya kultur in vitro merupakan suatu proses perbanyakan sel, jaringan, organ atau proptoplas dengan teknik steril (Nasir,
2002).
Pekerjaan mengisiolasi dan mentransfer bahan tanaman biasanya
diruangan khusus atau didalam lemari dimana mikroorganisme dapat
dikecualikan. Lemari yang digunakan untuk isolasi dapat ditempatkan dalam
rancangan laboratorium, tetapi jauh lebih baik di ruangan inokulasi atau transfer
ruangan khusus yang disediakan. Pada saat ditempatkan di inkubator
pencahayaan, suhu dan kelembaban dapat dikontrol. Laju pertumbuhan tergantung
pada suhu dan juga pencahayaan yang diadopsi (George et al., 2007).
Kondisi lingkungan yang menentukan keberhasilan dalam pembiakan
tanaman dengan kulturjaringan meliputi cahaya, suhu, dan komponen atmosfer.
Cahaya dibutuhkan untuk mengatur proses morfogenetik tertentu. Dalam teknik
kultur jaringan, cahaya dinyatakan dengan dimensi lama penyinaran, intensitas,
kebutuhan penyinaran pada kultur jaringan tanaman merupakan pencerminan dari
kebutuhan periodisitas tanaman yang bersangkutan dilapangan. Kualitas cahaya
mempengaruhi diferensiasi jaringan (Yusnita, 2003).
Kualitas cahaya yang baik untuk perkembangan tanaman harus
diperhatikan. Lampu flourescens jauh lebih baik dibandingkan lampu pijar, karena
panasnya relatif rendah. Intensitas cahaya yang dibutuhkan berkisar
1000-4000 lux. Intensitas cahaya diatur menempatkan lampu dengan kekuatan
tertentu dengan jarak 40-50 cm dari tabung kultur untuk luas tertentu
(Harahap, 2011).
Suhu juga berpengaruh terhadap kesehatan tanaman yang dikulturkan.
Suhu yang umum digunakan untuk pengkulturan berbagai jenis tanaman adalah
26±20C. Untuk kebanyakan tanaman, suhu yang terlalu rendah (kurang dari 200C)
dapat menghambat pertumbuhan, dan suhu yang terlalu tinggi (lebih dari 320C)
menyebabkan tanaman merana. Namun, pada kultur tanaman yang biasanya
memerlukan suhu rendah untuk pertumbuhan terbaiknya (Yusnita, 2003).
Plant Growth Regulator
Sitokinin merupakan zat pengatur tumbuh yang mendorongpembelahan
(sitokinesis), pertumbuhan danperkembangan kultur sel tanaman. Sitokininjuga
menunda penuaan daun, bunga dan buahdengan cara mengontrol dengan baik
proseskemunduran yang menyebabkan kematian sel-seltanaman. Pada tumbuhan,
efek sitokinin seringdipengaruhi oleh keberadaan auksin, misalnyajumlah akar
yang banyak akan menghasilkan sitokinin dalam jumlah banyak.
Peningkatankonsentrasi sitokinin ini akan menyebabkansistem tunas membentuk
Giberelin sebagai hormon tumbuh pada tanaman sangat berpengaruh
terhadap sifat genetik (genetic dwarfism), pembungaan, penyinaran,
parthonecarphy, mobilisasi karbohidrat selama perkecambahan (germination)
dan aspek fisiologi lainnya (Abidin, 1985).
Pada banyak sistem, giberelin yang ditambahkan dapat menghalangi
efek-efek dorman. Hal ini menyatakan bahwa peranan giberelin didalam meristem
apikal mungkin hanyalah melindunginya dari efek-efek penghambat pertumbuhan
endogen yang menghambat seperti misalnya dorman (Wilkins, 1989).
Di antara hormon tumbuhan yang dikenal giberelin mempunyai
kemampuan khusus memacu pertumbuhan tanaman utuh pada banyak spesies,
terutama tumbuhan kerdil atau tumbuhan dwitahunan dalam fase roseta, giberelin
biasanya lebih banyak mendorong pemanjangan batang utuh dari pada potongan
batang, sehingga efeknya berlawanan dengan efek auksin
(Salisbury dan Ross, 1995).
GA3 merupakan yang paling banyak dijumpai di dalam tanaman. Asam
giberelat tidak begitu sering digunakan dalam kultur jaringan. Senyawa tersebut
tidak tahan panas dan tidak dapat diautoklaf. Oleh karena itu, harus ditambahkan
kedalam medium setelah diotoklaf dengan menggunakan filter milipore
(sterilisasi filter). Secara umum peranan asam giberelat didalam tanaman adalah
meningkatkan perkecambahan biji dan menginduksi pemanjangan ruas. Senyawa
itu digunakan didalam media kultur untuk meningkatkan pemanjangan
pucuk-pucuk yang sangat kecil dan merangsang pembentukan embrio dan kalus
Menurut Wareing dan Phillips (1970) dalam Mudyantini (2008) efek
fisiologis yang khas pada tanaman yangdiperlakukan dengan GA3 adalah
terjadinya pemanjanganbatang, akibat adanya aktivitas kambium di
internodus,sehingga tanaman yang diperlakukan menjadi lebih tinggidaripada
tanaman normal. Pemanjangan batang selaindipengaruhi oleh aktivitas kambium
juga disebabkan olehpeningkatan mitosis di daerah meristem subapikal
batang,sehingga jumlah sel pada masing-masing internodusmeningkat.
Peningkatan jumlah sel menyebabkanpertumbuhan batang lebih cepat, sehingga
dihasilkanbatang yang lebih panjang. Respon ini pada batangbiasanya hanya
berupa peningkatan panjang internodus,dan umumnya tidak meningkatkan jumlah
internodus yang terbentuk.
Kebanyakan hormon endogen ditanaman terdapat pada jaringan meristem
yaitu jaringan yang aktif tumbuh dan membelah. Sehingga pemberian hormon
eksogen sangat mempengaruhi kerja hormon endogen sebagai fungsinya dalam
proses cytokinesis(proses pembelahan sel) pada berbagai organ tanaman.
Pemberian hormon eksogen dengan konsentrasi yang melebihi kebutuhan
tanaman dapat menyebabkan pembentukan tunas terhambat (Azwin, 2007).
Pemberian GA3 pada tempat yangdapat mengangkutnya ke apeks
tajuk,peningkatan pembelahan dan pembesaran selakan nampak pada
pemanjangan danperkembangan daun muda, dengan terpacunyaperkembangan
daun yang cepat ini fotosintesisakan terpacu yang dapat menghasilkanpeningkatan
keseluruhan pertumbuhan.Perkembangan daun sangat penting padaproduksi
tanaman budidaya agar dapatmemaksimalkan penyerapan cahaya dan asimilasi
Pemberian NAA dan BAP terhadap regenerasi kentang hasil induksi
mutasi EMS dapat dirumuskan. Tidak terdapat interaksi antara NAA dan BAP
terhadap regenerasi kalus kentang menjadi planlet, waktu muncul rootlet, jumlah
rootlet, diameter kalus dan bobot kalus. Pemberian NAA memberikan pengaruh
berbeda nyata pada diameter kalus dan bobot kalus kentang. Warna kalus yang
dihasilkan adalah hijau keputihan, hijau kekuningan, putih kecoklatan, coklat dan
coklat kekuningan. Sedangkan tekstur kalus yang terbentuk adalah kompak
(Wartina, 2011)
Kajian Kultur Jaringan Tanaman Karet
Kultur In vitro embrio tanaman karet yang dilakukan dengan menggunakan konsentrasi yang berbeda Benzil Amino Purin (BAP) 0.075 mg/l dan 0.01 mg/l konsentrasi Napthalen Asam Asetat (NAA) untuk melengkapi Murashige dan Skoog (MS) medium dengan 0.075 mg/l BAP dan 0.01 mg/l NAA.
Perlakuan ini menghasilkan planlet karet dengan akar tunggang yang berkembang
dengan baik. Konsentrasi yang sama dari NAA dan konsentrasi BAP sedikit lebih
tinggi atau lebih dari 0.075 mg/l karet yang dihasilkan tunas dan akar lateral saja
(Dickson et al., 2011).
Pemberian kombinasi BAP dan NAA pada media WPM
(Woody Plant Medium) terhadap persentase munculnya tunas, jumlah tunas,
terbentuknya daun yang terbaik pada kombinasi konsentrasi
0.5 mg/l BAP + 0 mg/l NAA, sedangkan konsentrasi 0.5 mg/l BAP + 0.25 mg/l
NAA memberikan respon panjang tunas yang terbaik (Sundari et al., 2015).
Hasil penelitian (Harahap et al., 2015) Pemberian kombinasi BAP dan
BAP 0.5mg/l + NAA 0 mg/l dan eksplan membentuk tunas pada perlakuan BAP
1.5 mg/l + NAA 0.25 mg/l. Semakin tinggi konsentrasi BAP yang diberikan maka
jumlah tunas yang dihasilkan akan semakin tinggi, karena pemberian konsentrasi
BAP yang tertinggi pada perlakuan masih bisa direspon oleh tanaman sehingga
tanaman terdorong untuk melakukan pembelahan sel secara aktif (Sari, 2011).
Eksplan tunas muncul pada media yang ditambahkan dengan 0.5 mg/l dan
4.0 mg/l BAP dan 0.005, 0.1, 0.5, 0.1 mg/l IBA. Pertumbuhan tunas ketiak
ditemukan baik pada 0.5 mg/l BAP + 0.005 mg/l IBA, 0.5 mg/l BAP + 0.1 mg/l
IBA dan 4.0 mg/l BAP + 0.05 mg/l IBA. Dengan konsentrasi BAP 7-10 mg/l BAP
kultur menunjukkan jenis pertumbuhan dengan sejumlah besar tunas yang tumbuh
berdekatan, ketika dipisahkan dan disubkultur gagal berkembang menjadi tunas
BAHAN DAN METODE Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Microcutting Tanaman Karet PT. Perkebunan Nusantara III Kebun Gunung Pamela Tebing Tinggi, Sumatera
Utara, Indonesia. Penelitian ini dimulai pada bulan April 2015sampai dengan Juli
2015.
Bahan dan Alat Penelitian
Bahan eksplan yang digunakan dalam penelitian ini adalah nodus
berukuran ±2 cm dari bahan tanaman karet yang di tanam di rumah kasa,
komposisi media yang digunakan larutan stok media WPM sebagai media tumbuh
tanaman denganGA3 dan BAP sebagai zat pengatur tumbuh (ZPT) yang
digunakan, eksplan yang digunakan berasal dari klon GP 3 yang merupakan
koleksi PTPN III. Bahan penyusun media lainnya, agar, akuades steril, dan bahan
lainnya yang mendukung penelitian ini.
Alat yang digunakan dalam penelitian ini adalah Laminar Air Flow Cabinet (LAFC), tabung uji, autoklaf, steri box, timbangan analitik, rak kultur, hot plate dengan magnetic stirer, erlenmeyer, gelas ukur, pipet ukur, pinset, gunting, scalpel, lampu bunsen, pH meter, oven, kertas plano, kaca tebal,
aluminium foil, kompor gas, minisar, mikropipet, tip, pipet tetes, danalat-alat lainnya yang mendukung penelitian ini.
Metode Penelitian
Penelitian ini dilakukan dengan menggunakan Rancangan Acak Lengkap
(RAL) dengan dua faktor perlakuan yaitu :
G1 : GA3 0 mg/l
G2 : GA3 0.5 mg/l
G3 : GA3 1 mg/l
G4 : GA3 1.5 mg/l
Faktor II : Perendaman nodus sebelum pengkulturan selama 2 jam 30 menit
dengan 4 taraf
T1 : GA3 0 mg/l
T2 : GA3 5 mg/l
T3 : GA3 10 mg/l
T4 : GA3 15 mg/l
Sehingga diperoleh kombinasi perlakuan sebagai berikut:
G1T1 G2T1 G3T1 G4T1
G1T2 G2T2 G3T2 G4T2
G1T3 G2T3 G3T3 G4T3
G1T4 G2T4 G3T4 G4T4
Jumlah perlakuan : 16
Jumlah ulangan : 7
Jumlah eksplan tiap tabung uji : 1
Jumlah seluruh eksplan : 112
Jumlah seluruh tanaman : 112
Adapun model liner dari sidik ragam penelitian sebagai berikut:
Yijk = Nilai pengamatan unit percobaan pada perlakuan GA3 ke-i, Perendaman nodus sebelum pengkulturan ke-j, dan ulangan ke-k
µ = Nilai tengah umum
αi = PengaruhGA3 ke-i
βj = Pengaruh Perendaman nodus sebelum pengkulturan ke-j
(αβ)ij = Nilai tambah pengaruh interaksi GA3 ke-i dan Perendaman nodus
sebelum pengkulturan ke-j
εijk = Galat percobaan
Jika perlakuan (konsentrasi GA3, konsentrasi perendamannodussebelum
pengkulturan dan interaksi) berbeda nyata dalam sidik ragam maka dilanjutkan
dengan Uji Jarak Berganda Duncan pada α = 5%
PELAKSANAAN PENELITIAN Sterilisasi Alat-Alat
Sebelum semua alat-alat disterilisasi dan alat-alat kaca digunakan untuk
kultur in vitro maka terlebih dahulu dicuci dan dikeringkan. Kemudian bungkus tabung dengan plastik tahan panas atau letakkan pada rak tabung, sedangkan
untuk botol biasanya bisa langsung diletakkan pada autoklaf. Disterilkan
tabung/botol dengan autoklaf pada suhu 121oC dengan tekanan 17,5 psi selama 60
menit. Setelah itu sterilkan secara kering tabung/botol di dalam oven pada suhu
150oC selama 1-2 jam.
Pembuatan Media
Media yang digunakan dalam penelitian ini adalah mediaWoody Plant Medium (WPM). Sebelum dilakukan pembuatan media WPM, dilakukan pembuatan larutan stok hormon BAP dan GA3. Larutan stok hormon
masing-masing dibuat 100mg/100ml. Kemudian larutan stok BAP dan GA3disaring
menggunakan minisar guna meningkatkan sterilitas dari hormon tersebut dan
dilakukan di Laminar Air Flow Cabinet (LAFC).
Pada pembuatan media WPM, tahap pertama adalah membuat larutan stok
bahan kimia hara makro dengan pembesaran 10x, hara mikro dengan pembesaran
100x, larutan iron dengan pembesaran 50x, larutan vitamin dengan pembesaran
100x, sukrosa 50 g, myo-inositol 0,1 g dan agar 5g. Tahap berikutnya, sukrosa
dimasukkan ke dalam beaker glass yang telah berisi akuades 1000 ml, lalu diaduk dengan menggunakan magnetik stirer sebagai pengaduk. Kemudian ditambahkan
myo-inositol diaduk hingga larut. Dimasukkan larutan stok hara makro 180ml,
ditepatkan menjadi 3600ml dengan menambahkan akuades. Keasaman diukur
dengan pH meter. pH yang dikehendaki adalah 5,8, untuk mengatur pH yaitu
menaikkan atau menurunkan pH dapat digunakan larutan KOH dan HCl 0,1 N.
Ditambahkan agar biotek dan dimasak di atas kompor gas sampai larutan
mendidih dan bening (semua agar telah larut). Larutan dipindahkan ke erlenmeyer
berukuran 5000ml dan ditutup dengan aluminium foil dan diikat dengan tali
plastik. Kemudian media WPM di sterilisasi dengan tekanan 17,5 psi pada
suhu 121°C selama 20 menit di autoklaf. Setelah proses sterilisasi selesai, media
dimasukkan ke ruang kultur dan dimasukkan keLaminar Air Flow Cabinet
(LAFC) untuk dibagikan ke 4 tabung erlenmeyer berukuran 2000ml dengan
masing-masing tabung berisi 900ml. Teteskan BAP dan GA3 ke masing-masing
tabung uji sesuai perlakuan. Dituangkan media ke dalam tabung uji berisikan
13ml/tabung dan ditutup kain kasa steril yang dibalut dan diikat benang. Sehingga
diperoleh ± 69 tabung uji dari setiap perlakuannya. Tabung uji diberi label sesuai
dengan perlakuan. Selanjutnya disimpan dalam ruang kultur sebelum digunakan.
Pembuatan Media Perendaman GA3
Pada pembuatan media perendaman, dimasukkan akuades 3000ml
kedalam erlenmeyer. Kemudian media disterilisasi dengan tekanan 17,5 psi pada
suhu 1210C selama 20 menit diautoklaf. Setelah proses sterilisasi selesai, media
dimasukkan keruang kulturdan dimasukkan keLaminar Air Flow Cabinet
(LAFC). Larutan dipindahkan ke 4 erlenmeyer berukuran 2000ml yang
masing-masing erlenmeyer berisi 750ml dan ditutup dengan almunium foil dan diikat
dengan tali plastik. Teteskan GA3 ke masing-masing tabung uji sesuai perlakuan.
perlakuannya dan ditutup dengan penutup botol. Sehingga diperoleh 75 tabung uji
dari setiap perlakuannya. Tabung uji diberi label sesuai dengan perlakuan.
Selanjutnya disimpan dalam ruang kultur sebelum digunakan.
Sterilisasi Bahan Tanaman di Lapangan
Bahan tanaman berasal dari rumah kasa tanaman karet PT. Perkebunan
Nusantara III, Kebun Gunung Pamela. Sterilisasi lapangan ialah dengan
memberikan fungisida (dithane) yang dicampurkan dengan air, kemudian
dioleskan pada bahan tanaman yang akan dijadikan eksplan di rumah kaca dengan
menggunakan kuas. Ditunggu selama 1 malam untuk fungisida bereaksi
mencegah jamur pada bahan tanaman. Dipotong bahan tanaman yang akan
dijadikan eksplan keesokan paginya dan diberi label.
Pengambilan Bahan Tanaman
Bahan tanaman yang digunakan ialah yang telah diberikan fungisida
dithane. Bahan tanaman yang digunakan ialah bibit karet yang telah latern (daun
terbuka sempurna) dan berwarna hijau terang, batang tanaman kokoh dan
berwarna hijau, serta berpayung dua. Batang bawah dari tanaman karet itu sendiri
berasal dari seedlingkaret pendukung klon tertentu yang selanjutnya diokulasi Bagian yang diambil ialah nodus yang terdapat dari setiap batang tersebut.
Pengambilan dilakukan pada pagi hari dengan menggunakan gunting.
Sterilisasi Bahan Tanaman di Laboratorium
Sterilisasi di laboratorium ialah dengan mecuci bahan tanaman
menggunakan air mengalir dengan menggunakan kuas untuk menghilangkan
olesan dithane. Bilas eksplan dengan cara memasukkan eksplan ke dalam tabung
alkohol dibuang dan toples diisi kembali dengan H2O2 dengan konsentrasi 17%
selama 20 menit. Setelah selesai larutan tersebut dibuang, tabung toples diisi
akuades dan diguncang selama 1 menit dan dibuang kembali. Rendam kembali
eksplan dengan akuades di dalam tabung toples selama 2 x 15 menit. Kemudian
air tersebut dibuang dari tabung toples. Dan eksplan sudah siap ditanam.
Persiapan Ruang Tanam
Seluruh permukaan laminar air flow cabinet sebelumnya dibersihkan terlebih dahulu dengan di lap menggunakan alkohol 96% lalu di sterilkan dengan
sinar Ultra Violet selama 1 jam sebelum proses penanaman dilakukan. Semua alat
dan bahan yang akan dipakai harus disemprot dengan alkohol 96% dan beberapa
alat seperti pinset, gunting, scalpel setelah disemprot lalu dibakar di dalam ke
dalam laminar air flow cabinet selama 1 menit. Hal ini dilakukan untuk menghindari resiko bahan penelitian terkontaminasi. Steri box dihidupkan dan disediakan alkohol 70% untuk membersihkan alat yang telah digunakan.
Perendaman Nodus
Perendaman nodus dilakukan sebelum penanaman. Nodus diambil
kemudian dimasukkan ke tabung uji masing-masing perlakuan perendaman yang
berisi akuades dengan penambahan GA3 sesuai konsentrasi setiap masing-masing
perlakuanke dalam tabung uji. Lama perendamannodus sebagai
perlakuandilakukan selama 2 jam 30 menit.
Penanaman
Eksplan yang digunakan adalah nodus dari bahan tanaman karet yang telah
di sterilisasi sebelumnyadengan standar yang dimiliki Laboratorium
mengalami perendaman GA3 selama 2 jam 30 menit, lalu langsung ditanam pada
tabung uji yang sudah berisikan media sebanyak 13ml/tabung uji. Eksplan yang
digunakan berukuran 1,5-2 cm, apabila ukuran eksplan belum
sesuai maka dipotong menggunakan gunting steril dan tajam. Eksplan yang akan
dikulturkan ke dalam media tanam diletakkan di piringan kaca tebal dengan alas
kertas plano. Kemudian eksplan ditanamkan ke dalam tabung uji sesuai dengan
perlakuan, setiap tabung uji terdiri dari 1 eksplan. Kemudian ujung tabung uji
ditutup dengan menggunakan kain kasa steril yang dibalut dan diikat benang.
Kegiatan penanaman dilakukan di dalam Laminar Air Flow Cabinet (LAFC) dan di bawah api bunsen. Tabung uji diletakkan di rak kultur di bawah cahaya dan
ruangan memiliki air conditioner dengan suhu 18oC.
Pemeliharaan Eksplan
Tabung-tabung uji diletakkan pada rak kultur di dalam ruang kultur.
Ruangan ini diusahakan bebas dari bakteri dan cendawan, dimana setiap hari
disemprot dengan alkohol 96% atau dan disemprot formalin agar bebas dari
organisme yang menyebabkan terjadi kontaminasi. Dalam penelitian ini suhu
ruangan kultur yang digunakan + 20-25°C, paling optimum 18oC dan intensitas
cahaya 2000 lux serta dengan kondisi ruangan memiliki air conditioner dengan hefa yang dibersihkan selama 6 bulan sekali. Apabila mengalami kontaminasi,
segera diambil dari rak kultur agar mencegah kontaminasi ke tabung lainnya.
Umur Muncal Tunas (hari)
Umur muncul tunas dihitung dari awal penanaman hingga terbentuknya
tunas dalam satuan hari
Persentase Muncul Tunas (%)
Pengamatan dilakukan pada akhir penelitian (6 MST) berdasarkan jumlah
tunas yang muncul dari keseluruhan ulangan.
Persentase muncul tunas = Jumlah tunas yang terbentuk Jumlah eksplan per perlakuan
x 100%
Jumlah Tunas (tunas)
Dihitung pada akhir penelitian (6 MST) dengan menghitung banyaknya
tunas baru yang terbentuk dari setiap eksplan.
Panjang Tunas (cm)
Panjang tunas diukur pada tunas tertinggi dengan menggunakan kertas
milimeter yang diukur dari tempat munculnya tunas (pangkal) sampai ujung tunas
tertinggi. Pengukuran dilakukan pada akhir penelitian.
Jumlah Terbentuk Daun
Jumlah terbentuk daun dihitung dari bakal daun yang terbentuk pada
eksplan. Pengamatan dilakukan pada akhir penelitian. Persentase terbentuk daun
dihitung dengan rumus:
Persentase terbentukdaun =
Jumlah eksplan per perlakuan Jumlah daun yang terbentuk
Jumlah Daun (helai)
Daun yang dihitung adalah daun yang trifoliat yang berwarna cokelat
kehijauan yang sudah kelihatan struktur atau tulang daunnya. Pengamatan
dilakukan pada akhir penelitian.
Kehadiran kalus dilihat dari ada atau tidaknya kemunculan kalus dari
bekas potongan/pelukaan eksplan atau dari bagian manapun dari eksplan.
Diobservasi kehadiran kalus pada akhir penelitian.
Warna Kalus
Dilihat dari penampakan warna kalus yang muncul. Warna kalus dilihat
pada akhir penelitian.
Morfogenesis
Kemunculan tunas di luar jaringan meristem aksilar (pangkal batang,
ujung batang bagian manapun dari eksplan).
Hasil
Berdasarkan hasil analisis data yang dilakukan, diperoleh bahwa interaksi
antara perlakuan penambahan GA3 dalam media dan perlakuan perendaman nodus
dalam GA3memberikan pengaruh yang nyata terhadap jumlah tunas, panjang
tunas dan jumlah terbentuk daun. Pada jumlah daun, umur muncul tunas,
kehadiran kalus, warna kalus dan morfogenesis tidak berpengaruh nyata pada
perlakuan penambahan GA3 dalam media dan perlakuan perendaman nodusdalam
GA3 serta interaksi antara perlakuan penambahan GA3 dalam media dan
perlakuan perendaman nodus dalam GA3.
Umur Muncul Tunas (hari)
Hasil pengamatan terhadap parameter rataan umur muncul tunas pada
perlakuan penambahan GA3 dalam media dan perendaman nodus dalam
GA3sebelum pengkulturan (Lampiran 1-3). Rataan umur muncul tunas dari
perlakuan penambahan GA3 dalam media dan perendaman nodus dalam
GA3sebelum pengkulturan dapat dlihat pada Tabel 1.
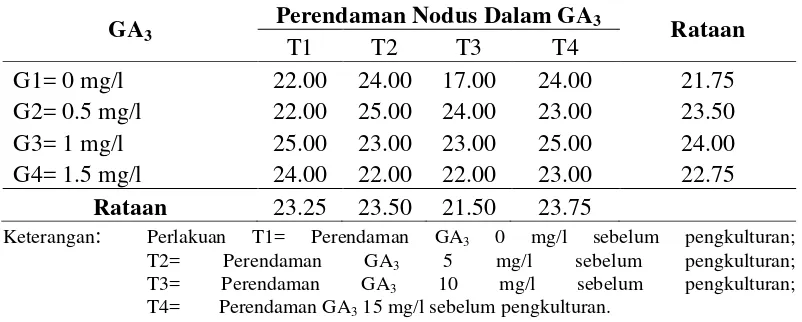
Tabel 1. Pengaruh perlakuan penambahan GA3 dalam media dan perendaman nodus dalam GA3sebelum pengkulturan terhadap umur muncul tunas (Hari).
T4= Perendaman GA3 15 mg/l sebelum pengkulturan.
Hasil pengamatan terhadap parameter rataan persentase muncultunas pada
perlakuan penambahan GA3dalammedia dan perendaman nodus dalam GA3
sebelum pengkulturan (Lampiran 4). Rataan persentase munculnya tunas dari
perlakuan penambahan GA3 dalam media dan perendaman nodus dalam
GA3sebelum pengkulturan dapat dilihat pada Tabel 2.
Tabel 2. Pengaruh penambahan GA3 dalam media dan perendaman nodus dalam GA3sebelum pengkulturan terhadap persentase munculnya tunas
(%).
GA3
Perendaman Nodus Dalam GA3
Rataan
T1 T2 T3 T4
G1= 0 mg/l 100.00 100.00 71.43 100.00 92.86
G2= 0.5 mg/l 100.00 100.00 100.00 100.00 100.00
G3= 1 mg/l 100.00 100.00 100.00 100.00 100.00
G4= 1.5 mg/l 100.00 100.00 100.00 100.00 100.00
Rataan 100.00 100.00 92.86 100.00
Keterangan: Perlakuan T1= Perendaman GA3 0 mg/l sebelum pengkulturan; T2= Perendaman
GA3 5mg/l sebelum pengkulturan; T3= PerendamanGA3 10 mg/l sebelum
pengkulturan; T4= PerendamanGA3 15 mg/l sebelum pengkulturan.
Gambar eksplan sebelum dan setelah membentuk tunas pada salah satu
perlakuan dapat dilihat pada Gambar 1a dan Gambar 1b.
Gambar 1. Eksplan (a) sebelum membentuk tunas(2 MST) (b) setelah membentuk tunas (6 MST)
Hasil pengamatan serta sidik ragam terhadap parameter rataan
jumlah tunas pada perlakuan penambahan GA3 dalam media dan perendaman
nodus dalam GA3 sebelum pengkulturan (Lampiran5-7), menunjukkan bahwa
interaksi perlakuan penambahan GA3 dalam mediadan perendaman nodus
sebelum pengkulturan memberikan pengaruh sangat nyata terhadap rataan jumlah
tunas pada 6 MST.
Rataan jumlah tunas dari perlakuan penambahan GA3 dalam media dan
perendaman nodus sebelum pengkulturan dapat dilihat pada Tabel 3.
Tabel 3. Pengaruh perlakuan penambahan GA3 dalam media dan perendaman nodus sebelum pengkulturan terhadap jumlah tunas (tunas) (6MST).
GA3
Keterangan: *Angka-angka yang diikuti huruf yang sama pada baris yang sama menunjukkan tidak berbeda nyata pada Uji Jarak Duncan pada taraf 5%.
**Perlakuan T1= Perendaman GA3 0 mg/l sebelum pengkulturan;
T2= Perendaman GA3 5 mg/l sebelum pengkulturan;
T3= Perendaman GA3 10 mg/l sebelum pengkulturan;
T4= Perendaman GA3 15 mg/l sebelum pengkulturan.
Tabel 3, memperlihatkan untuk perlakuan G1 (GA3 0 mg/l (tanpa
pemberian GA3), rataan jumlah tunas tertinggi terdapat pada perlakuan T1(GA3 0
mg/l), T2 (GA3 5 mg/l) dan T4 (GA3 15 mg/l) yaitu dengan rataan masing-masing
(1.00) sedangkan terendah pada perlakuan T3 (GA3 10 mg/l) yaitu dengan rataan
(0.71). Pada perlakuan G2 (GA30.5 mg/l), rataan jumlah tunas tertinggi terdapat
pada perlakuan T1 (GA3 0 mg/l), T2 (GA3 5 mg/l), T3 (GA3 10 mg/l) dan T4
(GA3 15 mg/l).Pada perlakuan G3 (GA31 mg/l), rataan jumlah tunas tertinggi
T4 (GA3 15 mg/l).Pada perlakuan G4 (GA31.5 mg/l), rataan jumlah tunas tertinggi
terdapat pada perlakuan T1 (GA3 0 mg/l), T2 (GA3 5 mg/l), T3 (GA3 10 mg/l) dan
T4 (GA3 15 mg/l).
Panjang Tunas (cm)
Hasil pengamatan serta sidik ragam terhadap parameter rataan panjang
tunas pada perlakuan penambahan GA3 dalam media dan perendaman nodus
dalam GA3sebelum pengkulturan (Lampiran 8-10), menunjukkan bahwa interaksi
penambahan GA3 dalam media dan perendaman nodus dalam GA3memberikan
pengaruh sangat nyata terhadap rataan panjang tunas pada6 MST.
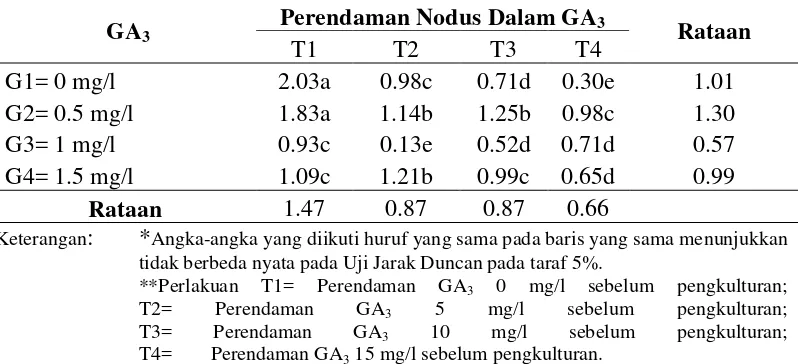
Tabel 4. Pengaruh penambahan GA3 dalam media dan perendaman nodus sebelum pengkulturan terhadap panjang tunas (cm) (6 MST).
GA3
Keterangan: *Angka-angka yang diikuti huruf yang sama pada baris yang sama menunjukkan tidak berbeda nyata pada Uji Jarak Duncan pada taraf 5%.
**Perlakuan T1= Perendaman GA3 0 mg/l sebelum pengkulturan;
T2= Perendaman GA3 5 mg/l sebelum pengkulturan;
T3= Perendaman GA3 10 mg/l sebelum pengkulturan;
T4= Perendaman GA3 15 mg/l sebelum pengkulturan.
Tabel 4, untuk perlakuan G1 (GA3 0 mg/l (tanpa pemberian GA3) rataan
panjang tunas tertinggi terdapat pada perlakuan T1 (GA3 0 mg/l) dengan rataan
(2.03) cm sedangkan terendah pada perlakuan T4 (GA3 15 mg/l) dengan rataan
(0.30) cm. Pada perlakuan G2 (GA30.5 mg/l), rataan panjang tunas tertinggi
terdapat pada perlakuan T1 (GA3 0 mg/l) dengan rataan 1.83 cm sedangkan
terendah pada perlakuan T4 (GA315 mg/l) yaitu dengan rataan (0.98) cm.Pada
T1 (GA3 0 mg/l) dengan rataan (0.93) cm sedangkan terendah pada perlakuan T2
(GA3 5 mg/l) dengan rataan (0,13) cm. Pada perlakuan G4 (GA3
1.5 mg/l), rataan panjang tunas tertinggi terdapat pada perlakuan T2 (GA3 5 mg/l)
yaitu dengan rataan (1,21) cm sedangkan terendah pada perlakuan T4 (GA3 15
mg/l) yaitu dengan rataan (0.65) cm.
Gambarpanjang tunas eksplan pada salah satu perlakuan dapat dilihat pada
Gambar 2.
Gambar 2. Panjang Tunas (6 MST)
Jumlah Terbentuk Daun
Hasil pengamatan sidik ragam terhadap parameter rataan jumlah
terbentuknya bakal daun terhadap perlakuan penambahan GA3 dalam media dan
perendaman nodus dalam GA3sebelum pengkulturan (Lampiran 11-13)
menunjukkan bahwa interaksi perlakuan penambahan GA3 dalam media dan
perendaman nodus dalam GA3sebelum pengkulturan memberikan pengaruh
sangat nyata terhadap rataan jumlah terbentuk daun pada 6 MST.
Gambar jumlah terbentuk daun pada salah satu perlakuan dapat dilihat
Gambar 3. Eksplan Membentuk Daun
Rataan jumlah terbentuk daun dari penambahan GA3 dalam media dan
perendaman nodus sebelum pengkulturan dapat dilihat pada tabel 5.
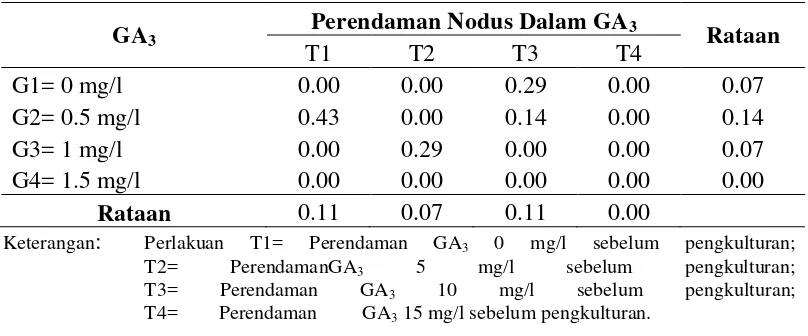
Tabel 5. Pengaruh perlakuan penambahan GA3 dalam media dan perendaman nodus sebelum pengkulturan terhadap jumlah terbentukdaun(6 MST).
GA3
Keterangan: *Angka-angka yang diikuti huruf yang sama pada baris yang sama menunjukkan tidak berbeda nyata pada Uji Jarak Duncan pada taraf 5%.
**Perlakuan T1= Perendaman GA3 0 mg/l sebelum pengkulturan;
T2= Perendaman GA3 5 mg/l sebelum pengkulturan;
T3= Perendaman GA3 10 mg/l sebelum pengkulturan;
T4= Perendaman GA3 15 mg/l sebelum pengkulturan.
Tabel 5, perlakuan G1 (GA3 0 mg/l (tanpa pemberian GA3) rataanjumlah
terbentuk daun tertinggi pada perlakuan T1 (GA30 mg/l) yaitu dengan rataan
(1.00) sedangkan terendah pada perlakuan T3 (GA3 10 mg/l) yaitu dengan rataan
(0.43). Pada Perlakuan G2 (GA3 0.5 mg/l) rataan jumlah terbentuk daun tertinggi
terdapat pada perlakuan T1 (GA3 0 mg/l), T2 (GA3 5 mg/l), T3 (GA3 10 mg/l)
yaitu dengan rataan (1.00) sedangkan terendah pada perlakuan T4 (GA3 15 mg/l)
yaitu dengan rataan (0.71). Pada perlakuan G3 (GA3 1.5 mg/l) rataan jumlah
mg/l) yaitu dengan rataan (1.00) sedangkan terendah pada perlakuan T3 (GA3 10
mg/l) yaitu dengan rataan (0.57). Pada perlakuan G4 (GA3 1.5 mg/l) rataan jumlah
terbentuk bakal daun tertinggi terdapat pada perlakuan T1 (GA3 0 mg/l) yaitu
dengan rataan (1.00) sedangkan terendah pada perlakuan T3 (GA3 10 mg/l) yaitu
dengan rataan (0.29).
Jumlah Daun (Helai)
Hasil pengamatan serta sidik ragam terhadap parameter rataan jumlah
daun terhadap perlakuan penambahan GA3 dalam media den perendaman nodus
sebelum pengkulturan (Lampiran 14-16), menunjukkan bahwa perlakuan
penambahan GA3 dalam media dan perendaman nodus dalam GA3sebelum
pengkulturan dan interaksi dari kedua perlakuan belum memberikan pengaruh
nyata terhadap rataan jumlah daun pada 6 MST. Gambar eksplan membentuk
daun dapat dilihat pada Gambar 4.
Gambar 4. Eksplan Membentuk Daun
Rataan jumlah daun dari penambahan GA3 dalam media dan perendaman
nodus sebelum pengkulturan dapat dilihat pada tabel Tabel 6.
GA3
T4= Perendaman GA3 15 mg/l sebelum pengkulturan.
Kehadiran kalus
Pada semua kultur yang dilakukan tidak ada satupun yang menunjukkan
kehadiran kalus. Ketidakhadiran kalus pada tunas mikro tanaman karet merupakan
hal yang diharapkan dalam penelitian ini, sebab microcutting pada tahapprimary culture merupakan tahapan awal sehingga tidak diharapkan kehadiran kalus dan hingga akhir penelitian tidak ditemukan kalus.
Warna kalus dan morfogenesis
Ketidakhadiran kalus hingga akhir penelitian menyebabkan tidak adanya
warna kalus yang diamati secara visual. Morfogenesis berdasarkan kemunculan
tunas mikro tanaman karet maka tidak diperoleh kemunculan tunas diluarjaringan
meristem aksilar (pangkal batang, ujung batang, bagian lain dari eksplan).
Tabel 7.Pengaruh Aplikasi GA3Dalam Induksi Tunas Mikro Tanaman KaretSecara In Vitro (6 MST) Terhadap Kehadiran Kalus.
Peubah Amatan Perlakuan
G T GXT
Kehadiran Kalus Tidak ada Tidak ada Tidak ada
Warna Kalus Tidak ada Tidak ada Tidak ada
Morfogenesis Tidak ada Tidak ada Tidak ada
Keterangan: G = Penambahan GA3
T = Perendaman nodus
GXT = Interaksi penambahan GA3 dengan perendaman nodus
Pengaruh penambahan GA3 dalam media terhadap pertumbuhan dan perkembangan induksi tunas mikro tanaman karet
Hasil analisis data secara statistik diketahui bahwa perlakuan penambahan
GA3 dalam mediamemberikan pengaruh sangat nyata terhadap jumlah tunas,
panjang tunas dan jumlah terbentuk daun tetapi belum berpengaruh nyata terhadap
jumlah daun, umur muncul tunas, kehadiran kalus, warna kalus dan morfogenesis.
Rataan jumlah tunas tertinggi diperoleh pada perlakuanG2 (GA3 0.5
mg/l)sedangkan rataan jumlah tunas terendah pada perlakuanG1 (GA30 mg/l). Hal
ini dapat dilihat dari hasil penambahan konsentrasi giberelin berpengaruh dalam
pertumbuhan jumlah tunas. Menurut SeneviratnadanWijesekera (1997) GA3
adalah zat pengatur tumbuh yang berpengaruh pada pertumbuhan dan morfologi
dari jaringan tanaman kultur untuk kultivar yang berbeda dari spesies yang
berbeda, kultivar yang berbeda dari spesies yang sama dan eksplan yang berbeda
dari tanaman yang sama. Menurut Mudyantini (2008) kehadirangiberelin tersebut
akan meningkatkan kandungan auksin.Mekanisme lain menyebutkan bahwa
giberelin akanmenstimulasi pemanjangan sel karena adanya hidrolisispati yang
dihasilkan dari giberelin akan mendukungterbentuknyaα-amilase.Sebagai akibat
dari prosestersebut, maka konsentrasi gula meningkat yangmengakibatkan
tekanan osmotik di dalam sel menjadi naik,sehingga ada kecenderungan sel
tersebut berkembang. Berdasarkan penelitian Ariyanti et al., (2010) rataan pertambahan jumlah tunas tertinggi terdapat pada perlakuan zeatin 3 mg/l dan
GA30,5 mg/ yaitu 1,00 ± 0,71. Pembentukan tunas tercepat ada pada perlakuan
BAP + GA3, hal ini diduga dikarenakan eksplan telah dapat beradapatasi dengan
cepat sehingga pada minggu pertama, eksplan telah dapat menyerap nutrisi dari
Peubah amatanrataan panjang tunas memperlihatkan bahwa tunas tertinggi
terdapat pada perlakuan G2 (GA3 0.5 mg/l)sedangkan rataan panjang tunas
terendah pada perlakuan G3 (GA3 1 mg/l) ini berarti penambahan GA3 dalam
media mempengaruhi perpanjangan batang tanaman. Menurut Gunatilleke dan
Chandra (1988) GA3 0.5 mg/l suboptimal untuk pertumbuhan tunas sedangkan 2
mg/l mungkin telah optimal untuk pertumbuhan tunas. Tingkat GA3 diantara
kedua mungkin efektif dalam meningkatkan perpanjangan tunas.Menurut Santoso
dan Fatimah (2001) GA dapat mempengaruhi pertumbuhan dan perkembangan
yaitu mempengaruhi pemanjangan batang atau ruas batang. Kegiatan kultur
jaringan tanaman tanpa penambahan GA sesungguhnya dapat berjalan dan proses
induksi serta diferensiasi dapat dilakukan, meski demikian tidak menutup bahwa
GA endogen dalam eksplan walaupun dalam kadar yang relatif kecil diduga tetap
merupakan komponen yang essensial.
Rataan jumlah terbentukdaun tertinggi terdapat pada perlakuan G2 (GA3
0.5 mg/l)sedangkan rataan jumlah terbentuk daun terendah pada perlakuanG1
(GA30 mg/l) pemberiankonsentrasi perlakuan G2 menghasilkan rataan jumlah
terbentuk daun tertinggi. Berdasarkan penelitian Farhatullah et al., (2007) perlakuan T4 (GA3 0.5 mg/l) meningkatkan pertumbuhan daun 90% pada eksplan
tanaman kentang.Ini berarti pemberian GA3 merangsang jumlah terbentuknya
bakal daun melalui perpanjangan batang tanaman. Menurut Sari et al., (2012) secara umum zat pengatur tumbuh dapat membantu peningkatan pertumbuhan
tanaman. Interaksi dan perimbangan antara zat pengatur tumbuh yang diberikan
dalam media dan yang diproduksi oleh sel secara endogen, menentukan arah
tumbuh dalam berbagai konsentrasi secara berbeda. Hal ini disebabkan oleh
perbedaan kandungan konsentrasi hormon endogen tumbuhan itu sendiri. Tunas
dikatakan sempurna apabila batang terus mengalami perpanjangan dan daun yang
terbentuk berwarna hijau tua.
Rataan jumlah daun tertinggi pada perlakuan G2 (GA3 0.5 mg/l)
sedangkan untuk perlakuan G4 (GA3 1.5 mg/l) daun belum terbentuk.Pada
perlakuan GA3dapat dikatakan GA3belum merangsang pertumbuhan jumlah daun
karet. Karena satu efek fisiologis GA3 lebih banyak pengaruhnya pada
pertumbuhan ruas-ruas batang daripada pada pertumbuhan daun. Menurut
Salisbury dan Ross (1995) GA3 diketahui dapat memacu pertumbuhan seluruh
tanaman, termasuk daun dan akar. GA3 yang diberikan dengan cara apapun di
tempat yang dapat mengangkutnya ke ujung tajuk, maka akan terjadi peningkatan
pembelahan sel dan pertumbuhan sel yang mengarah kepada pemanjangan batang
dan perkembangan daun muda.
Umur muncul tunas adalah waktu yang dibutuhkan untuk melihat respon
tanaman dalam menghasilkan tunas baru. Dalam penelitian ini waktu tunas paling
lama terdapat pada perlakuan G3 (GA31 mg/l) yaitu berkisar 24 hari dan umur
muncul tunas tertinggi adalah pada perlakuan G1 (GA3 0 mg/l). Waktu
pembentukan tunas tanaman karet dihitung pada saat penanaman. Eksplan yang
digunakan buku satu tunas tanpa daun. Menurut penelitian Kosmiatin et al., (2005) waktu induksi tunas tercepat diperoleh dari eksplan buku tanpa daun.
Eksplan yang relatif lebih mudah diinduksi tunasnya adalah eksplan yang
memiliki jaringan meristem atau bakal tunas seperti tunas terminal dan bakal