ANALISIS KALSIUM DAN MAGNESIUM DALAM
AIR MINUM DARI MATA AIR DI KECAMATAN
GUNUNG SITEMBER SECARA
SPEKTROFOTOMETRI SERAPAN ATOM
SKRIPSI
OLEH :
ESRA BERUTU
131524118
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
ANALISIS KALSIUM DAN MAGNESIUM DALAM
AIR MINUM DARI MATA AIR DI KECAMATAN
GUNUNG SITEMBER SECARA
SPEKTROFOTOMETRI SERAPAN ATOM
SKRIPSI
Diajukan Sebagai Salah Satu Syarat Untuk Memperoleh Gelar Sarjana Farmasi Pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH :
ESRA BERUTU
131524118
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGESAHAN SKRIPSI
ANALISIS KALSIUM DAN MAGNESIUM DALAM AIR
MINUM DARI MATA AIR DI KECAMATAN GUNUNG
SITEMBER SECARA SPEKTROFOTOMETRI SERAPAN
ATOM
OLEH:
ESRA BERUTU
NIM 131524118
Dipertahankan di Hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal: 04 September 2015
Disetujui oleh: Pembimbing I,
Prof. Dr. Jansen Silalahi, M.App.Sc., Apt. NIP 195006071979031001
Panitia Penguji,
Prof. Dr. Siti Morin Sinaga, M.Sc., Apt. NIP 195008281976032002
Prof. Dr. Jansen Silalahi, M.App.Sc., Apt. NIP 195006071979031001
Drs. Nahitma Ginting, M.Si., Apt. NIP 195406281983031002
Sri Yuliasmi, S.Farm., M.Si., Apt. NIP 198207032008122002
Pembimbing II,
Dra. Tuty Roida Pardede, M.Si., Apt. NIP 195401101980032001
Medan, Oktober 2015 Fakultas Farmasi
KATA PENGANTAR
Puji syukur penulis ucapkan kepada Tuhan atas segala limpahan berkat,
kasih dan karunia-Nya, sehingga penulis dapat menyelesaikan penelitian dan
penyusunan skripsi ini.
Skripsi ini disusun untuk melengkapi salah satu syarat mencapai gelar
Sarjana Farmasi pada Fakultas Farmasi Universitas Sumatera Utara, dengan judul
“Analisis Kalsium dan Magnesium dalam Air Minum dari Mata Air di Kecamatan
Gunung Sitember”.
Pada kesempatan ini dengan kerendahan hati penulis mengucapkan terima
kasih kepada Ibu Dr. Masfria, M.S., Apt., selaku Pejabat Dekan Fakultas Farmasi
Universitas Sumatera Utara Medan, yang telah memberikan fasilitas sehingga
penulis dapat menyelesaikan pendidikan. Bapak Prof. Dr. Jansen Silalahi,
M.App.Sc., Apt., dan Ibu Dra. Tuty Roida Pardede, M.Si., Apt., yang telah
membimbing dan memberikan petunjuk serta saran-saran selama penelitian
hingga selesainya skripsi ini. Ibu Prof. Dr. Siti Morin Sinaga, M.Sc., Apt., Bapak
Prof. Dr. Jansen Silalahi, M.App.Sc., Apt., Bapak Drs. Nahitma Ginting, M.Si.,
Apt., dan Ibu Sri Yuliasmi, S.Farm., M.Si., Apt., selaku dosen penguji yang telah
memberikan kritik, saran dan arahan kepada penulis dalam menyelesaikan skripsi
ini. Bapak dan Ibu staf pengajar Fakultas Farmasi USU Medan yang telah
mendidik selama perkuliahan dan Ibu Dra. Suwarti Aris M.Si., Apt., selaku
penasehat akademik yang selalu memberikan bimbingan kepada penulis selama
Penulis juga mengucapkan terima kasih kepada Ayahanda Rasudin Berutu
dan Ibunda Roswita Saragih yang telah memberikan cinta kasih, doa yang tulus
serta pengorbanan baik materi maupun non materi. Kepada Kak Mona, Togu,
Betesda, Wahyu P., Nora, Kak Evi, Jessi, Petrika, Seven, Balilibra dan seluruh
keluarga yang selalu mendoakan dan memberikan semangat serta seluruh
teman-teman ekstensi 2013, terima kasih untuk dorongan, semangat dan kebersamaannya
selama ini.
Penulis menyadari sepenuhnya bahwa dalam penulisan skripsi ini masih
jauh dari kesempurnaan. Oleh karena itu penulis menerima kritik dan saran demi
kesempurnaan skripsi ini. Akhirnya, penulis berharap semoga skripsi ini dapat
memberi manfaat bagi kita semua.
Medan, September 2015 Penulis,
ANALISIS KALSIUM DAN MAGNESIUM DALAM AIR MINUM DARI MATA AIR DI KECAMATAN GUNUNG SITEMBER SECARA
SPEKTROFOTOMETRI SERAPAN ATOM
ABSTRAK
Mineral yang terkandung dalam air minum memiliki pengaruh terhadap kesehatan tubuh. Menurut (World Health Organization) WHO, kadar kalsium dalam air minum minimal 20 mg/l dan magnesium 10 mg/l, sedangkan Meskes RI No.01/Birhukmas/I/1975 hanya memberikan persyaratan maksimal kalsium dan magnesium yang dianjurkan dalam air minum 75 mg/l dan 30 mg/l. Jadi, penelitian ini bertujuan untuk mengetahui kandungan kadar kalsium dan magnesium pada air minum dari mata air di Kecamatan Gunung Sitember secara spektrofotometri serapan atom.
Sampel yang digunakan diambil dari air minum sebelum dan sesudah dididihkan. Identifikasi kalsium dilakukan dengan menggunakan pereaksi larutan asam sulfat 1N ditambahkan etanol 96%. Identifikasi magnesium dilakukan dengan menggunakan pereaksi larutan kuning titan 0,1 % b/v ditambahkan NaOH 2N. Analisis kuantitatif kalsium dan magnesium menggunakan spektrofotometer serapan atom nyala udara-asetilen, diukur pada panjang gelombang berturut-turut 422,7 nm dan 285,20 nm.
Dari hasil penelitian menunjukkan kadar kalsium dalam air minum sebelum dan sesudah dididihkan berturut-turut yaitu 62,8692 ± 1,2838 mg/l dan 2,0192 ± 0,0323 mg/l, magnesium masing-masing yaitu 14,8746 ± 0,1923 mg/l dan 0,5035 ± 0,0147 mg/l. Kadar kalsium dan magnesium dalam air minum sebelum dididihkan memenuhi persyaratan WHO dan Meskes RI No.01/Birhukmas/I/1975. Sedangkan kadar kalsium dan magnesium sesudah dididihkan hanya memenuhi persyaratan Meskes RI No.01/Birhukmas/I/1975 tetapi belum memenuhi persyaratan WHO.
ANALYSIS OF CALCIUM AND MAGNESIUM IN DRINKING WATER OF SPRING WATER IN THE DISTRICT GUNUNG SITEMBER WITH
ATOMIC ABSORPTION SPECTROPHOTOMETRY
ABSTRACT
Minerals contained in the water has an influence to the health of the body. According to (World Health Organization) WHO, the levels of calcium in the drinking water is 20 mg/l and magnesium is 10 mg/l, while Meskes RI No.01/Birhukmas/I/1975 only give a maximum requirement of calcium and magnesium in drinking water is 75 mg/l and 30 mg/l. So, the aim of this study is to determine the levels of calcium and magnesium in drinking water from spring water in the district of Gunung Sitember by atomic absorption spectrophotometry.
The samples used were taken from drinking water before and after boiled. Identification of calcium done by using the reagent solution of sulfuric acid 1N added ethanol 96%. Identification of magnesium done by using titan yellow reagent solution 0.1% w/v added NaOH 2N. Quantitative analysis of calcium and magnesium using atomic absorption spectrophotometer air-acetylene flame, measured at a wavelength of 422.7 nm respectively and 285.20 nm.
The results showed the levels of calcium in drinking water before and after the row that boiled is 62.8692 ± 1.2838 mg/l and 2.0192 ± 0.0323 mg/l, each magnesium is 14.8746 ± 0.1923 mg/l and 0.5035 ± 0.0147 mg/l. Levels of calcium and magnesium in drinking water before boiling meets the requirements of the WHO and Meskes RI No.01/Birhukmas/I/1975. While the levels of calcium and magnesium after boiling only eligible Meskes RI No.01/Birhukmas/I/1975 but do not meet the requirements of the WHO.
DAFTAR ISI
Halaman
JUDUL ... i
LEMBAR PENGESAHAN ... iii
KATA PENGANTAR ... iv
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xiv
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 4
1.3 Hipotesis ... 4
1.4 Tujuan Penelitian ... 5
1.5 Manfaat Penelitian ... 5
BAB II TINJAUAN PUSTAKA ... 6
2.1 Air Minum ... 6
2.2 Manfaat Mineral Dalam Air Minum ... 7
2.2.1 Kalsium ... 8
2.2.2 Magnesium ... 9
2.3 Kesadahan ... 10
2.5 Total Zat Padat ... 12
2.6 Sumber-Sumber Air Yang Diolah Menjadi Air Minum ... 12
2.6.1 Air Hujan ... 12
2.6.2 Air Permukaan ... 13
2.6.3 Air Tanah ... 13
2.7 Proses Pengolahan Air Minum ... 13
2.7.1 Klorinasi ... 13
2.7.2 Ozonasi ... 14
2.7.3 Filtrasi ... 14
2.7.4 Aerasi ... 14
2.7.5 Koagulasi Kimiawi ... 15
2.7.6 Adsorpsi Karbon Teraktivasi ... 15
2.7.7 Penukaran Ion ... 15
2.7.8 Proses Membran ... 16
2.8 Kadar Kalsium Dan Magnesium Dalam Air Minum ... 16
2.9 Dampak Negatif Air Minum Yang Rendah Mineral Dan Demineral ... 17
2.10 Analisis Kalsium Dan Magnesium ... 18
2.10.1 Titrasi Kompleksometri ... 18
2.10.2 Spektrofotometri Serapan Atom ... 19
2.11 Validasi Metode Analisis ... 20
BAB III METODE PENELITIAN ... 23
3.1 Sampel ... 23
3.3 Alat-alat ... 24
3.4 Prosedur Penelitian ... 24
3.4.1 Pengambilan Sampel ... 24
3.4.2 Pengukuran pH ... 24
3.4.3 Pembuatan Pereaksi ... 24
3.4.4 Proses Pembuatan Larutan Sampel ... 25
3.4.4.1 Sampel Air Minum Sebelum Didihkan ... ... .. 25
3.4.4.2 Sampel Air Minum Sesudah Dididihkan ... ... 25
3.4.5 Analisis Kualitatif ... 26
3.4.5.1 Identifikasi Kalsium dengan Asam Sulfat 1N ... 26
3.4.5.2 Identifikasi Magnesium dengan Larutan Kuning Titan 0,1% b/v ... 26
3.4.6 Analisis Kuantitatif Kalsium ... 26
3.4.6.1 Pembuatan Larutan Induk Baku Kalsium ... 26
3.4.6.2 Pembuatan Kurva Kalibrasi Kalsium ... 26
3.4.6.3 Penetapan Kadar Kalsium dalam Sampel Sebelum Dididihkan dan Sesudah Dididihkan ... 27
3.4.6.3.1 Sampel Air Minum Sebelum Dididihkan ... 27
3.4.6.3.2 Sampel Air Minum Sesudah Dididihkan ... 27
3.4.7 Analisis Kuantitatif Magnesium ... 28
3.4.7.1 Pembuatan Larutan Induk Baku Magnesium ... 28
3.4.7.2 Pembuatan Kurva Kalibrasi Magnesium ... 28
3.4.7.3.1 Sampel Air Minum Sebelum
Dididihkan ... 28
3.4.7.3.2 Sampel Air Minum Sesudah Dididihkan ... 29
3.4.8 Analisis Data Secara Statistik ... 29
3.4.9 Pengujian Beda Nilai Rata-Rata ... 30
3.4.10 Validasi Metode Analisis ... 31
3.4.10.1 Uji Kecermatan ... 31
3.4.10.2 Uji Keseksamaan ... 32
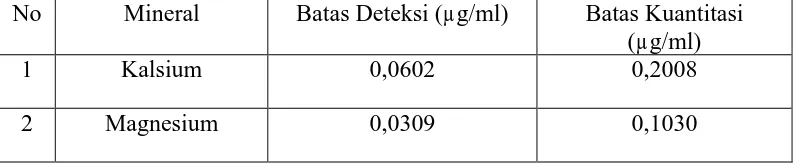
3.4.10.3 Penentuan Batas Deteksi dan Batas Kuantitasi 33
3.4.11 Analisis Total Zat Terlarut ... 34
3.4.12 Analisis Total Zat Padat ... 34
BAB IV HASIL DAN PEMBAHASAN ... 35
4.1 Analisis Kualitatif ... 35
4.2 Analisis Kuantitatif ... 36
4.2.1 Kurva Kalibrasi Kalsium dan Magnesium ... 36
4.2.2 Kadar Kalsium dan Magnesium dalam Sampel ... 38
4.2.3 Analisis Data Secara Statistika ... 40
4.2.4 Validasi Metode ... 41
BAB V KESIMPULAN DAN SARAN ... 43
5.1 Kesimpulan ... 43
5.2 Saran ... 43
DAFTAR PUSTAKA ... 45
DAFTAR TABEL
Tabel Halaman
2.1 Baku Mutu Air Minum Menurut Permenkes RI No.492/
Menkes/Per/IV/2010 ... 6
2.2 Kadar Kalsium dan Magnesium dalam Sampel ... 17
4.1 Hasil pengukuran pH air minum sebelum dan sesudah
dididihkan ... 35
4.2 Hasil analisis kualitatif kalsium dan magnesium dalam sampel .. 36
4.3 Kadar kalsium dan magnesium dalam sampel ... 38
4.4 Hasil uji akurasi dalam air minum sebelum dididihkan ... 41
4.5 Hasil uji keseksamaan dalam air minum sebelum
dididihkan ... 42
DAFTAR GAMBAR
Gambar Halaman
4.1 Kurva kalibrasi larutan baku kalsium ... 37
DAFTAR LAMPIRAN
Lampiran Halaman
1. Lokasi Pengambilan Sampel ... 48
2. Alat pH meter Hanna Instruments ... 50
3. Hasil Analisis Kualitatif Kalsium dan Magnesium dalam
Sampel ... 51
4. Bagan Alir Proses Pembuatan Larutan Sampel ... 52
5. Bagan Alir Proses Penetapan Kadar Sampel ... 54
6. Bagan Alir Proses Penentuan Total Zat Terlarut
dalam Air Minum Sebelum dan Sesudah Dididihkan ... 56
7. Bagan Alir Proses Penentuan Total Zat Padat
dalam Air Minum Sebelum dan Sesudah Dididihkan ... 57
8. Data Kalibrasi Kalsium dengan Spektrofotometer Serapan
Atom ... 58
9. Data Kalibrasi Magnesium dengan Spektrofotometer Serapan Atom, Perhitungan Persamaan Regresi dan Koefisien Korelasi ... 60
10. Hasil Analisis Kadar Kalsium dan Magnesium dalam Sampel 62
11. Contoh Perhitungan Kadar Kalsium dan Magnesium dalam Sampel Air Minum Sebelum Dididihkan ... 63
12. Perhitungan Statistik Kadar Kalsium dalam Sampel Air
Minum Sebelum dan Sesudah Dididihkan ... 65
13. Perhitungan Statistik Kadar Magnesium dalam Sampel Air
Minum Sebelum dan Sesudah Dididihkan ... 68
14. Perhitungan Batas Deteksi dan Batas Kuantitasi Kalsium .... 73
15. Perhitungan Batas Deteksi dan Batas Kuantitasi Magnesium 74
16. Hasil Uji Akurasi Kadar Kalsium dan Magnesium
17. Contoh Perhitungan Uji Akurasi Kadar Kalsium dalam
Air Minum Sebelum Dididihkan ... 76
18. Contoh Perhitungan Uji Akurasi Kadar Magnesium dalam
Air Minum Sebelum Dididihkan ... 77
19. Perhitungan Uji Presisi Kadar Kalsium dalam
Air Minum Sebelum Dididihkan ... 78
20. Perhitungan Uji Presisi Kadar Magnesium dalam
Air Minum Sebelum Dididihkan ... 79
21. Pengujian Beda Nilai Rata-Rata Kadar Kalsium pada
Air Minum Sebelum dan Sesudah Dididihkan ... 80
22. Pengujian Beda Nilai Rata-Rata Kadar Magnesium pada
Air Minum Sebelum dan Sesudah Dididihkan ... 83
23. Hasil Analisis Total Zat Terlarut Dan Total Zat Padat
dalam Air Minum Sebelum dan Sesudah Dididihkan ... 85
24. Contoh Perhitungan Analisis Total Zat Terlarut dan Total Zat Padat dalam Air Minum Sebelum dan
Sesudah Dididihkan ... 86
25. Alat Spektrofotometer Serapan Atom Hitachi Z-2000 ... 87
26. Alat Oven Fischer ... 90
27. Baku Mutu Air Minum Menurut Meskes RI No.01/Birhukmas /I/1975 ... 89
28. Tabel Distribusi t ... 90
ANALISIS KALSIUM DAN MAGNESIUM DALAM AIR MINUM DARI MATA AIR DI KECAMATAN GUNUNG SITEMBER SECARA
SPEKTROFOTOMETRI SERAPAN ATOM
ABSTRAK
Mineral yang terkandung dalam air minum memiliki pengaruh terhadap kesehatan tubuh. Menurut (World Health Organization) WHO, kadar kalsium dalam air minum minimal 20 mg/l dan magnesium 10 mg/l, sedangkan Meskes RI No.01/Birhukmas/I/1975 hanya memberikan persyaratan maksimal kalsium dan magnesium yang dianjurkan dalam air minum 75 mg/l dan 30 mg/l. Jadi, penelitian ini bertujuan untuk mengetahui kandungan kadar kalsium dan magnesium pada air minum dari mata air di Kecamatan Gunung Sitember secara spektrofotometri serapan atom.
Sampel yang digunakan diambil dari air minum sebelum dan sesudah dididihkan. Identifikasi kalsium dilakukan dengan menggunakan pereaksi larutan asam sulfat 1N ditambahkan etanol 96%. Identifikasi magnesium dilakukan dengan menggunakan pereaksi larutan kuning titan 0,1 % b/v ditambahkan NaOH 2N. Analisis kuantitatif kalsium dan magnesium menggunakan spektrofotometer serapan atom nyala udara-asetilen, diukur pada panjang gelombang berturut-turut 422,7 nm dan 285,20 nm.
Dari hasil penelitian menunjukkan kadar kalsium dalam air minum sebelum dan sesudah dididihkan berturut-turut yaitu 62,8692 ± 1,2838 mg/l dan 2,0192 ± 0,0323 mg/l, magnesium masing-masing yaitu 14,8746 ± 0,1923 mg/l dan 0,5035 ± 0,0147 mg/l. Kadar kalsium dan magnesium dalam air minum sebelum dididihkan memenuhi persyaratan WHO dan Meskes RI No.01/Birhukmas/I/1975. Sedangkan kadar kalsium dan magnesium sesudah dididihkan hanya memenuhi persyaratan Meskes RI No.01/Birhukmas/I/1975 tetapi belum memenuhi persyaratan WHO.
ANALYSIS OF CALCIUM AND MAGNESIUM IN DRINKING WATER OF SPRING WATER IN THE DISTRICT GUNUNG SITEMBER WITH
ATOMIC ABSORPTION SPECTROPHOTOMETRY
ABSTRACT
Minerals contained in the water has an influence to the health of the body. According to (World Health Organization) WHO, the levels of calcium in the drinking water is 20 mg/l and magnesium is 10 mg/l, while Meskes RI No.01/Birhukmas/I/1975 only give a maximum requirement of calcium and magnesium in drinking water is 75 mg/l and 30 mg/l. So, the aim of this study is to determine the levels of calcium and magnesium in drinking water from spring water in the district of Gunung Sitember by atomic absorption spectrophotometry.
The samples used were taken from drinking water before and after boiled. Identification of calcium done by using the reagent solution of sulfuric acid 1N added ethanol 96%. Identification of magnesium done by using titan yellow reagent solution 0.1% w/v added NaOH 2N. Quantitative analysis of calcium and magnesium using atomic absorption spectrophotometer air-acetylene flame, measured at a wavelength of 422.7 nm respectively and 285.20 nm.
The results showed the levels of calcium in drinking water before and after the row that boiled is 62.8692 ± 1.2838 mg/l and 2.0192 ± 0.0323 mg/l, each magnesium is 14.8746 ± 0.1923 mg/l and 0.5035 ± 0.0147 mg/l. Levels of calcium and magnesium in drinking water before boiling meets the requirements of the WHO and Meskes RI No.01/Birhukmas/I/1975. While the levels of calcium and magnesium after boiling only eligible Meskes RI No.01/Birhukmas/I/1975 but do not meet the requirements of the WHO.
BAB I
PENDAHULUAN
1.1 Latar Belakang
Air merupakan kebutuhan yang sangat utama bagi kehidupan manusia, oleh
karena itu jika kebutuhan air belum terpenuhi baik secara kuantitas maupun
kualitas, maka akan menimbulkan dampak yang besar terhadap kesehatan maupun
kehidupan sosial dan ekonomi masyarakat (Marsidi, 2011). Air dapat melarutkan
banyak zat sehingga berfungsi sebagai medium terjadinya reaksi kimia dan
merupakan komponen utama dari tubuh manusia. Tidak ada proses biologi tanpa
melibatkan air di dalam kehidupan. Manusia dapat bertahan selama beberapa
minggu tanpa makanan tetapi tanpa air manusia hanya dapat bertahan selama
beberapa hari karena air tidak disimpan di dalam tubuh sebagai cadangan
(Wardlaw dan Hampl, 2007; Silalahi, 2014).
Air minum adalah air yang melalui proses pengolahan atau tanpa proses
pengolahan yang memenuhi syarat kesehatan dan dapat langsung di minum
(Kepmenkes, RI., 2002). Secara fisik air minum harus jernih, tidak berwarna dan
tidak berbau. Namun air yang jernih, tidak berwarna dan tidak berbau belum tentu
aman dikonsumsi (Permenkes, RI., 2010).
Salah satu parameter kimia dalam persyaratan kualitas air minum adalah
jumlah kandungan unsur kalsium dan magnesium dalam air, yang keberadaannya
biasa disebut dengan kesadahan air. Tingginya tingkat kesadahan sementara
memanaskan air. Hal ini dikarenakan semakin tinggi temperatur air maka
kelarutan kalsium dan magnesium dalam air semakin berkurang (Marsidi, 2011).
Air minum harus mengandung mineral utama seperti kalsium dan
magnesium. Air minum yang berasal dari alam mengandung zat-zat terlarut
seperti mineral (Kozisek, 2005). Kalsium dan magnesium adalah mineral
essensial yang diperlukan tubuh, sekitar 20 % berasal dari air minum. Sekitar 99
% dari kalsium di dalam tubuh terdapat di dalam tulang dan gigi, dan tulang
terdiri dari 40 % kalsium . Disamping itu ion kalsium berperan dalam regulasi
metabolisme di dalam sel, mengurangi resiko kanker kolon dan menurunkan
tekanan darah. Asupan maksimum kalsium adalah 2500 mg per hari (Wardlaw
dan Hampl, 2007; Silalahi, 2014).
Magnesium terdapat di dalam tulang sekitar 50-60%. Magnesium berperan
dalam memelihara tonus vaskular yang normal dan sensitivitas insulin, juga
menjadi kofaktor untuk lebih dari 350 reaksi enzimatis, serta berperan dalam
metabolisme energi, sintesa protein, dan metabolisme kalsium. Kebutuhan akan
magnesium berkisar 300- 400 mg per hari pada umur sampai 30 tahun dan akan
meningkat pada usia diatas 30 tahun. Kurangnya asupan magnesium akan
menyebabkan denyut jantung yang tidak teratur disertai dengan kondisi lemah,
mual, muntah, disorientasi, mempercepat terjadinya aterosklerosis dan
menginduksi agregasi trombosit yang merupakan faktor resiko pada penyakit
kardiovaskular (Wardlaw dan Hampl, 2007; Silalahi, 2014).
Menurut World Health Organization (WHO) persyaratan minimal mineral
dalam air minum masing-masing yaitu 20 mg/l kalsium dan 10 mg/l magnesium.
maksimal kalsium yang dianjurkan dalam air 75 mg/l, kadar maksimal
magnesium yang dianjurkan 30 mg/l dan tidak ada persyaratan minimal. Jenis air
minum yang diizinkan beredar di Indonesia terdiri dari air mineral dan air
demineral seperti air minum reverse osmosis. WHO melalui penelitian para ahli
telah menyatakan bahwa air minum rendah mineral dan demineral seperti air
minum reverse osmosis tidak baik untuk kesehatan karena dapat meningkatkan
resiko penyakit kardiovaskular jika dikonsumsi dalam waktu lama sebagai air
minum setiap hari (Silalahi, 2014; WHO, 2005).
Kecamatan Gunung Sitember merupakan salah satu kecamatan yang
terdapat di Kabupaten Dairi yang sebagian besar terdiri dari dataran tinggi dan
berbukit-bukit yang terletak antara 98°00’- 98°30’ dan 2°15’ - 3°00’ Lintang
Utara. Kecamatan Gunung Sitember terletak pada ketinggian antara 400 – 1360
meter di atas permukaan laut (Silitonga, 2011). Ada beberapa faktor yang
mempengaruhi kadar kalsium dan magnesium di dalam air minum yaitu
penambahan bahan baku, pengaruh musim hujan dan musim kemarau, letak
pengambilan air minum serta pengolahan yang dilakukan (Silalahi, 2014;
Hartanty, 2015; Zahra, 2014).
Air minum yang di konsumsi masyarakat Gunung Sitember dan sekitarnya
terlebih dahulu dididihkan, didiamkan, dan akan terbentuk endapan putih yang
membuat rasa tidak nyaman saat mengkonsumsinya. Endapan tersebut
kemungkinan adalah kalsium dan magnesium yang mengendap. Sepengetahuan
penulis belum pernah dilakukan penelitian terhadap air minum ini. Oleh karena
minum yang berasal dari mata air di Kecamatan Gunung Sitember secara
Spektrofotometri Serapan Atom.
1.2 Perumusan Masalah
Berdasarkan uraian di atas, diperoleh perumusan masalah sebagai berikut :
1. apakah air minum dari mata air di Kecamatan Gunung Sitember mengandung
kalsium dan magnesium yang memenuhi persyaratan kesehatan Baku Mutu
Air Minum menurut Meskes RI No.01/Birhukmas/I/1975 dan WHO ?
2. apakah terdapat penurunan kadar kalsium dan magnesium pada air minum
dari mata air di Kecamatan Gunung Sitember sesudah dididihkan dan
dilakukan penyaringan ?
1.3 Hipotesis
Berdasarkan uraian di atas, diperoleh hipotesis sebagai berikut :
1. air minum dari mata air di Kecamatan Gunung Sitember mengandung
kalsium dan magnesium yang memenuhi persyaratan kesehatan Baku Mutu
Air Minum menurut Meskes RI No.01/Birhukmas/I/1975 dan WHO ?
2. terdapat penurunan kadar kalsium dan magnesium pada air minum dari mata
air di Kecamatan Gunung Sitember sesudah dididihkan dan dilakukan
1.4 Tujuan Penelitian
Berdasarkan uraian di atas, diperoleh tujuan penelitian sebagai berikut :
1. untuk mengetahui apakah air minum dari mata air di Kecamatan Gunung
Sitember mengandung kalsium dan magnesium memenuhi persyaratan yang
ditentukan.
2. untuk mengetahui penurunan kadar kalsium dan magnesium dari mata air di
Kecamatan Gunung Sitember sesudah dididihkan dan dilakukan penyaringan.
1.5 Manfaat Penelitian
Dari hasil penelitian ini diharapkan dapat memberi informasi kepada
masyarakat yang mengkonsumsi air minum dari mata air di Kecamatan Gunung
Sitember mengenai kandungan kalsium dan magnesium apakah memenuhi
BAB II
TINJAUAN PUSTAKA
2.1 Air Minum
Air minum adalah air yang melalui proses pengolahan atau tanpa proses
pengolahan yang memenuhi syarat kesehatan dan dapat langsung di minum
(Kepmenkes, RI., 2002). Air minum yang baik dan aman untuk kesehatan jika
memenuhi persyaratan fisika, mikrobiologis dan kimiawi sesuai dengan parameter
yang ditentukan oleh Permenkes RI No.492/Menkes/Per/IV/2010 yang dapat di
lihat pada Tabel 2.1
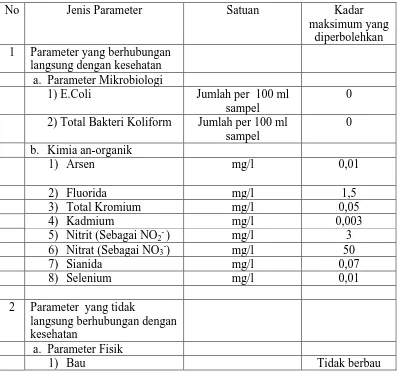
Tabel 2.1 Baku Mutu Air Minum Menurut Permenkes RI No.492/Menkes/Per/IV/2010
No Jenis Parameter Satuan Kadar maksimum yang
diperbolehkan 1 Parameter yang berhubungan
langsung dengan kesehatan a. Parameter Mikrobiologi
1) E.Coli Jumlah per 100 ml sampel
0
2) Total Bakteri Koliform Jumlah per 100 ml sampel
0
b. Kimia an-organik
1) Arsen mg/l 0,01
2) Fluorida mg/l 1,5
3) Total Kromium mg/l 0,05
4) Kadmium mg/l 0,003
5) Nitrit (Sebagai NO2- ) mg/l 3 6) Nitrat (Sebagai NO3-) mg/l 50
7) Sianida mg/l 0,07
8) Selenium mg/l 0,01
2 Parameter yang tidak
langsung berhubungan dengan kesehatan
a. Parameter Fisik
2) Warna TCU 15 3) Total Zat Padat
Terlarut (TDS)
mg/l 500
4) Kekeruhan NTU 5
5) Rasa Tidak Berasa
6) Suhu 0C Suhu udara ± 3
b. Parameter Kimiawi
1) Aluminium mg/l 0,2
2) Besi mg/l 0,3
3) Kesadahan mg/l 500
4) Khlorida mg/l 250
5) Mangan mg/l 0,4
6) pH 6,5-8,5
7) Seng mg/l 3
8) Sulfat mg/l 250
9) Tembaga mg/l 2
10) Amonia mg/l 1,5
Dari Tabel 2.1 di atas diuraikan tentang kesadahan dalam air minum yang
dikaitkan dengan adanya kalsium karbonat dan magnesium karbonat. Jika
kesadahan dalam air minum rendah maka akan meningkatkan resiko terkena
penyakit jantung (De Zuane, 1996).
2.2 Manfaat Mineral Dalam Air Minum
Air minum menjadi sumber air yang utama dibutuhkan oleh tubuh. Namun
harus di ingat, bahwa air di alam selalu mengandung zat-zat terlarut terutama
mineral. Maka secara alamiah air yang di minum harus memenuhi syarat tertentu,
yakni tidak mengandung zat-zat berbahaya, seperti racun khususnya logam-logam
toksis misalnya timbal, cadmium, merkuri, dan juga tidak boleh ada bakteri yang
patogen. Sebaliknya, air minum harus mengandung mineral utama seperti
kalsium, magnesium, dan kalium. Sedangkan natrium biasanya berasal dari
memenuhi syarat atau di proses melalui perusahaan air minum supaya memenuhi
syarat (Kozisek, 2005; Fox, 1998; Silalahi, 2014).
Air minum menjadi salah satu sumber beberapa mineral karena terdapat
secara alamiah atau ditambahkan. Ada beberapa mineral yang terdapat di dalam
air minum dengan kadar potensial untuk menopang kesehatan yakni kalsium,
magnesium, florida, selenium, kuprum, dan kalium. Kontribusi air minum sebagai
sumber mineral yang diperlukan dibandingkan dengan kontribusi makanan
lainnya berkisar 1-20 %. Mineral kalsium dan magnesium merupakan yang paling
banyak yakni sampai 20% dari yang diperlukan tubuh berasal dari air minum.
Tingkat penyerapan kalsium dari air minum yang mengandung kalsium yang
tinggi sebanding dengan penyerapan kalsium dari susu. Air minum yang
mengandung 300 mg kalsium per liter menyumbangkan kalsium yang setara
dengan kalsium dari satu gelas susu (WHO, 2005; Olivares dan Uauy, 2005;
Silalahi, 2014).
2.2.1 Kalsium
Kalsium merupakan mineral yang paling banyak terdapat di dalam tubuh
yaitu 1,5 % - 2 % dari berat badan orang dewasa atau kurang lebih sebanyak 1 kg.
Dari jumlah ini, 99% berada dalam jaringan keras yaitu tulang dan gigi. Di dalam
cairan ekstraselular dan intraselular kalsium memegang peranan penting dalam
mengatur fungsi sel seperti transmisi saraf, kontraksi otot, penggumpalan darah
dan menjaga permeabilitas membran sel. Kalsium mengatur pekerjaan
hormon-hormon dan faktor pertumbuhan (Almatsier, 2004).
Dalam keadaan normal sebanyak 30% - 50% kalsium yang dikonsumsi di
menurun pada proses menua. Kemampuan absorpsi pada laki-laki lebih tinggi
daripada perempuan pada semua golongan usia. Hal ini dikarenakan penyerapan
mineral dari air minum dipengaruhi oleh kondisi fisiologis pencernaan dan
komposisi makanan. Kalsium membutuhkan pH 6 agar dapat berada dalam
keadaan terlarut (Almatsier, 2004; Kozisek, 2005).
2.2.2 Magnesium
Magnesium adalah kation nomor dua paling banyak setelah natrium di
dalam cairan intraselular. Kurang lebih 60% dari 20-28 mg di dalam tubuh
terdapat di dalam tulang dan gigi, 26% di dalam otot dan selebihnya di dalam
jaringan lunak lainnya serta cairan tubuh. Magnesium memegang peranan penting
dalam lebih dari tiga ratus jenis sistem enzim di dalam tubuh. Magnesium
bertindak di dalam semua sel jaringan lunak sebagai katalisator dalam reaksi
biologi termasuk reaksi yang berkaitan dengan metabolisme energi, karbohidrat,
lipida, protein, dan asam nukleat serta dalam sintesis, degradasi, dan stabilitas
bahan gen DNA. Sebagian besar reaksi ini terjadi dalam mitokondria sel
(Almatsier, 2004).
Di dalam cairan sel ekstraselular magnesium berperan dalam transmisi
saraf, kontraksi otot dan pembekuan darah. Dalam hal ini peranan magnesium
berlawanan dengan kalsium. Kalsium merangsang kontraksi otot sedangkan
magnesium mengendorkan otot. Kalsium mendorong penggumpalan darah
sedangkan magnesium mencegah. Kalsium menyebabkan ketegangan saraf
sedangkan magnesium melemaskan saraf. Magnesium mencegah kerusakan gigi
2.3 Kesadahan
Kesadahan air berbeda di setiap tempat dan menggambarkan sifat lapisan
tanah yang kontak dengan air. Secara umum, air permukaan lebih lunak
dibandingkan dengan air tanah. Kesadahan disebabkan oleh logam atau kation
bervalensi dua. Kalsium dan magnesium adalah ion mayor penyebab kesadahan,
diikuti oleh besi, aluminium, mangan, stronsium dan zink sebagai komponen
minor (Gray, 2008; De Zuane, 1996).
Tingkat kesadahan air digolongkan sebagai berikut :
- lunak (soft) = 0 – 50 mg/l
- sedikit keras (moderately hard) = 50 – 150 mg/l
- keras (hard) = 150 – 300 mg/l
- sangat keras (very hard) = >300 mg/l (Gray, 2008; De Zuane, 1996).
Kesadahan air dibedakan menjadi dua macam yaitu kesadahan sementara
(temporary hardness) dan kesadahan permanen (permanent hardness). Kesadahan
sementara disebabkan oleh garam-garam karbonat dan bikarbonat dari kalsium
dan magnesium. Kalsium dan magnesium yang terlarut dapat dihilangkan dengan
cara pemanasan. Sedangkan kesadahan permanen disebabkan oleh adanya
garam-garam klorida dan sulfat dari kalsium dan magnesium. Kesadahan permanen tidak
dapat dihilangkan dengan cara pemanasan. Kesadahan dalam air minum ini
dikaitkan dengan rasa yang ditimbulkan karena ada nya za terlarut. Semakin
banyak zat terlarut maka kesadahan air minum akan meningkat (Gray, 2008; De
Menurut Chandra (2006), metode yang dapat digunakan untuk
menghilangkan kesadahan air antara lain :
1. Pemanasan
Pemanasan menyebabkan dikeluarkannya CO2 dari dalam air dan terbentuknya
endapan CaCO3
Ca(HCO3)2 + Panas CaCO3 + H2O + CO2
2. Penambahan Kapur
Penambahan kapur pada air yang sifat kesadahannya sementara dapat
mengabsorbsi CO2 dan membentuk endapan CaCO3.
Ca(OH)2 + Ca(HCO3) 2CaCO3 + 2H2O
3. Penambahan natrium karbonat dapat menghilangkan kesadahan sementara dan
permanen.
Na2CO3 + Ca(HCO3)2 2NaHCO3 + CaCO3
CaSO4 + Na2CO3 CaCO3 + Na2SO4
4. Proses pertukaran basa
Dalam melakukan pelunakan terhadap persediaan air dalam jumlah besar
digunakan proses permutit. Natrium permutit merupakan persenyawaan
kompleks dari natrium, aluminium, dan silika. Pada proses permutit akan
terjadi pertukaran kation Na dengan ion Ca dan Mg di dalam air. Semua ion Ca
dan Mg akan dilepas melalui reaksi pertukaran basa dan natrium permutit
akhirnya akan menjadi kalsium dan magnesium permutit. Dengan demikian air
2.4 Total Zat Terlarut
Di dalam air minum total zat terlarut (total dissolved solids) pada
umumnya disebabkan oleh adanya garam inorganik dan zat organik. Adanya
kontribusi ion karbonat, bikarbonat, klorida, sulfat, nitrat, natrium, kalium,
kalsium, dan magnesium. Total zat terlarut dalam air akibat adanya kontak dengan
batuan dan tanah, dan polusi di daerah perkotaan juga memberikan kontribusi
(Gray, 2008; De Zuane, 1996).
Total zat terlarut dapat dihubungkan dengan kesadahan. Dimana total
zat-zat terlarut dapat dihitung secara gravimetri dengan pengeringan dan pengukuran
residu dalam mg/l. Metode lain dalam penentuan total zat terlarut yaitu dengan
menggunakan konduktivitas (Gray, 2008; De Zuane, 1996).
2.5 Total Zat Padat
Total zat padat yaitu semua zat padat (total solids) yang terdapat di dalam
air minum yang dapat dihitung dengan penguapan dan pengeringan pada suhu 103
– 1050C. Total zat padat 500 mg/l merupakan batas maksimal yang diinginkan
(De Zuane, 1996).
2.6 Sumber-Sumber Air Yang Diolah Menjadi Air Minum
2.6.1 Air Hujan
Air hujan merupakan sumber utama air di bumi. Walaupun pada saat air
jatuh ke bumi merupakan air yang paling bersih, air tersebut cenderung
mengalami pencemaran ketika berada di atmosfer. Pencemaran yang berlangsung
di atmosfer itu dapat disebabkan oleh partikel debu, mikroorganisme, dan gas
2.6.2 Air Permukaan
Air permukaan meliputi badan-badan air seperti sungai, danau, telaga,
waduk, dan rawa. Sebagian besar air permukaan berasal dari air hujan yang jatuh
ke permukaan bumi (Chandra, 2006).
2.6.3 Air Tanah
Air tanah berasal dari air hujan yang jatuh ke permukaan bumi kemudian
mengalami penyerapan ke dalam tanah dan proses filtrasi secara alami.
Proses-proses yang telah dialami air hujan membuat air tanah menjadi lebih baik dan
lebih murni dibandingkan air permukaan. Sebelum mencapai lapisan tempat air
tanah, air hujan akan menembus beberapa lapisan tanah menyebabkan air
mengandung zat-zat mineral dan menyebabkan terjadinya kesadahan pada air.
Zat-zat mineral tersebut antara lain kalsium, magnesium, besi, dan mangan
(Chandra, 2006).
2.7 Proses Pengolahan Air Minum
2.7.1 Klorinasi
Klorinasi dapat dilakukan dengan menggunakan gas klorin cair, larutan
natrium hipoklorit atau butiran kalsium hipoklorit. Gas klorin cair dimasukkan ke
dalam tabung bertekanan. Gas dikeluarkan dari tabung dan ditakar ke dalam air
menggunakan klorinator yang sekaligus dapat mengendalikan dan mengukur laju
alir gas (WHO, 2004).
Klorinasi digunakan terutama untuk desinfeksi mikroba. Namun, klorin juga
bertindak sebagai oksidan dan dapat menghilangkan beberapa zat kimia misalnya
untuk membentuk produk tidak terlarut yang dapat disingkirkan melalui filtrasi
lanjut (WHO, 2004).
2.7.2 Ozonasi
Ozon adalah oksidasi yang kuat dan banyak kegunaannya dalam pengolahan
air, termasuk oksidasi zat kimia organik. Ozon dapat digunakan sebagai
desinfektan utama. Gas ozon (O3) dibentuk dengan melewatkan oksigen melalui
medan listrik bertegangan tinggi. Hasil udara kaya ozon dialirkan langsung ke
dalam air dengan alat penghambur berpori pada dasar kolam penghubung.
Pelarutan minimal 80 % ozon akan tercapai, sementara sisanya dalam bentuk gas
akan keluar yang dialirkan menuju penghancur ozon dan keluar menuju atmosfer
(WHO, 2004).
2.7.3 Filtrasi
Zat partikulat dapat disingkirkan dari air mentah melalui filter gravitasi
cepat, horizontal, bertekanan, dan filter pasir lambat. Filtrasi pasir lambat pada
dasarnya adalah proses biologis sedangkan lainnya adalah proses pengolahan
fisik. Filter gravitasi cepat, horizontal, dan bertekanan dapat digunakan untuk
filtrasi langsung air mentah tanpa pengolahan awal (WHO, 2004).
2.7.4 Aerasi
Proses aerasi didesain untuk mencapai pembuangan gas dan senyawa
mudah menguap melalui penipisan udara. Penipisan udara dapat digunakan untuk
menyingkirkan materi organik mudah menguap beberapa senyawa penyebab bau
dan rasa serta radon. Proses aerasi untuk mendapatkan penipisan udara harus
dilakukan dengan lebih teliti untuk memberikan kontak yang diperlukan antara
dalam tangki menara yang air nya dialirkan menuju semacam kincir air yang
digerakkan oleh tiupan udara (WHO, 2004).
2.7.5 Koagulasi Kimiawi
Pengolahan berbasis koagulasi merupakan metode paling umum digunakan
untuk mengolah air permukaan. Koagulan kimia biasanya garam aluminium atau
besi dialirkan ke dalam air mentah dalam kondisi yang terkendali untuk
membentuk hidroksida logam flokulen padat. Flok akan mengikat kontaminan
yang melayang dan terlarut melalui mekanisme netralisasi muatan, adsorpsi, dan
penangkapan. Efisiensi proses koagulasi bergantung pada mutu air mentah,
koagulan yang digunakan, dan faktor operasional termasuk kondisi pencampuran,
dosis koagulasi, dan pH (WHO, 2004).
2.7.6 Adsorpsi Karbon Teraktivasi
Karbon teraktivasi dihasilkan melalui termalisasi terkendali dari materi
karbon terutama kayu, tempurung kelapa dan sayuran busuk. Aktivasi tersebut
menghasilkan materi berpori yang luas (500-1500 m2/g) dan afinitas yang tinggi
terhadap senyawa organik. Karbon teraktivasi digunakan untuk menyingkirkan
pestisida dan zat kimia organik lain, senyawa berasa dan berbau, racun
sianobakterial, dan karbon organik total (WHO, 2004).
2.7.7 Penukaran Ion
Penukaran ion adalah proses ketika ion dengan muatan yang sama bertukar
antara fase air dan fase resin padat. Pelunakan air dicapai melalui penukaran
kation. Air dialirkan melalui kolam resin kation, ion kalsium serta ion magnesium
habis maka resin akan dibentuk kembali dengan menggunakan larutan natrium
klorida (WHO, 2004).
2.7.8 Proses Membran
Proses membran yang paling signifikan dalam pengolahan air adalah
osmosis balik (reverse osmosis), ultrafiltrasi, mikrofiltasi, dan nanofiltrasi. Proses
ini biasanya digunakan untuk menghasilkan air dalam aplikasi industri, farmasi
dan sekarang digunakan untuk pengolahan air minum (WHO, 2004).
Apabila dua larutan dipisahkan oleh membran semipermeabel, pelarut
biasanya mengalir dari larutan berkonsentrasi rendah ke larutan berkonsentrasi
tinggi. Namun, pelarut dapat dipaksa mengalir ke arah yang berlawanan dari
konsentrasi tinggi ke konsentrasi rendah dengan menaikkan tekanan pada larutan
berkonsentrasi tinggi. Selisih tekanan yang diperlukan disebut tekanan osmotik
dan proses nya dikenal sebagai reverse osmosis (WHO, 2004).
2.8 Kadar Kalsium Dan Magnesium Dalam Air Minum
Penelitian sebelumnya yang berkaitan dengan kandungan kalsium dan
magnesium dalam air minum telah dilakukan oleh Pasaribu (2013), Florencia
(2014), Zahra (2014), dan Hartanty (2015) dengan menggunakan metode
spektrofotometri serapan atom. Sampel air minum yang diteliti adalah air minum
isi ulang (AMIU), air minum dalam kemasan (AMDK), air minum dari sumur
bor, sumur galian dan PDAM Tirtanadi. Kadar kalsium dan magnesium yang
diperoleh dari sampel air minum secara spektrofotometri serapan atom dapat di
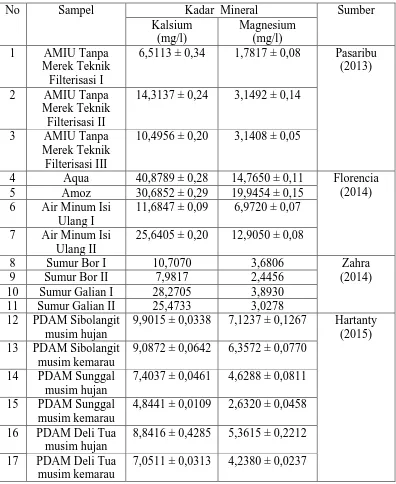
Tabel 2.2 Kadar Kalsium dan Magnesium dalam Sampel
No Sampel Kadar Mineral Sumber Kalsium
(mg/l)
Magnesium (mg/l) 1 AMIU Tanpa
Merek Teknik Filterisasi I
6,5113 ± 0,34 1,7817 ± 0,08 Pasaribu (2013)
2 AMIU Tanpa Merek Teknik
Filterisasi II
14,3137 ± 0,24 3,1492 ± 0,14
3 AMIU Tanpa Merek Teknik
Filterisasi III
10,4956 ± 0,20 3,1408 ± 0,05
4 Aqua 40,8789 ± 0,28 14,7650 ± 0,11 Florencia (2014) 5 Amoz 30,6852 ± 0,29 19,9454 ± 0,15
6 Air Minum Isi Ulang I
11,6847 ± 0,09 6,9720 ± 0,07
7 Air Minum Isi Ulang II
25,6405 ± 0,20 12,9050 ± 0,08
8 Sumur Bor I 10,7070 3,6806 Zahra (2014) 9 Sumur Bor II 7,9817 2,4456
10 Sumur Galian I 28,2705 3,8930 11 Sumur Galian II 25,4733 3,0278 12 PDAM Sibolangit
musim hujan
9,9015 ± 0,0338 7,1237 ± 0,1267 Hartanty (2015) 13 PDAM Sibolangit
musim kemarau
9,0872 ± 0,0642 6,3572 ± 0,0770
14 PDAM Sunggal musim hujan
7,4037 ± 0,0461 4,6288 ± 0,0811
15 PDAM Sunggal musim kemarau
4,8441 ± 0,0109 2,6320 ± 0,0458
16 PDAM Deli Tua musim hujan
8,8416 ± 0,4285 5,3615 ± 0,2212
17 PDAM Deli Tua musim kemarau
7,0511 ± 0,0313 4,2380 ± 0,0237
2.9 Dampak Negatif Air Minum Yang Rendah Mineral dan Demineral
Air minum dengan rendah mineral jika dikonsumsi dalam jangka waktu
lama akan menimbulkan masalah kesehatan, misalnya meningkatkan resiko
beberapa penyakit seperti kanker dan jantung koroner. Air rendah mineral dengan
pipa distribusi. Penyerapan logam-logam toksis seperti Pb di dalam pencernaan
akan meningkat jika mineral kalsium dan magnesium sangat rendah dalam air
minum. Jika dalam makanan terdapat logam toksis Pb walaupun dalam jumlah
sedikit, akan mudah diserap oleh tubuh apabila kadar kalsium dan magnesium
rendah di dalam air minum. Akan tetapi apabila kalsium dan magnesium cukup
dalam air minum maka penyerapan Pb, baik yang terdapat di dalam air minum
dan makanan lainnya akan dihambat atau tidak terjadi (Fox, 1998; Kozisek, 2005;
Silalahi, 2014).
Air minum bukanlah satu-satunya sumber mineral kalsium dan magnesium.
Akan tetapi jika kandungan kalsium dan magnesium dalam air minum sangat
rendah maka akan terjadi gangguan penyerapan kalsium dan magnesium yang
terdapat di dalam makanan lainnya. Berdasarkan fakta ini maka WHO telah
menganjurkan dan memberikan persyaratan mineral di dalam air minum,
masing-masing dengan syarat minimal 20 mg kalsium dan 10 mg magnesium dalam satu
liter air minum. Sedangkan menurut Depkes RI hanya menyatakan kandungan
maksimal kalsium dan magnesium yang dianjurkan dalam air minum yaitu 75
mg/liter dan 30 mg/l dan tidak ada syarat minimal (WHO, 2005; Permenkes, RI.,
1975; Silalahi, 2014).
2.10 Analisis Kalsium Dan Magnesium
2.10.1 Titrasi Kompleksometri
Titrasi kompleksometri digunakan untuk menentukan kandungan
garam-garam logam. Etilen diamin tetra asetat (EDTA) merupakan titran yang sering
membentuk kompleks yang tidak stabil pada pH rendah. Oleh karena itu titrasi
kalsium dan magnesium dengan EDTA dilakukan pada larutan buffer amonia pH
10 (Gandjar dan Rohman, 2007).
Untuk deteksi titik akhir titrasi digunakan indikator zat warna. Indikator zat
warna ditambahkan pada larutan logam pada saat awal sebelum dilakukan titrasi
dan akan membentuk kompleks berwarna. Pada saat titik akhir titrasi (ada sedikit
kelebihan EDTA) maka kompleks indikator-logam akan pecah dan akan
menghasilkan warna yang berbeda. Indikator yang dapat digunakan untuk titrasi
kompleksometri adalah hitam eriokrom, mureksid, jingga pirokatekol, jingga
xilenol, kalmagit, dan biru hidroksi naftol (Gandjar dan Rohman, 2007).
2.10.2 Spektrofotometri Serapan Atom
Metode spektrofotometri serapan atom didasarkan pada absorbsi cahaya
oleh atom. Atom-atom akan menyerap cahaya pada panjang gelombang tertentu
tergantung sifat unsurnya. Sebagai contoh kalsium menyerap cahaya pada panjang
gelombang 422,7 nm dan magnesium pada panjang gelombang 285,2 nm. Cahaya
pada panjang gelombang ini mempunyai cukup energi untuk mengubah tingkat
elektronik suatu atom (Khopkar, 1985).
Keberhasilan analisis ini tergantung pada proses eksitasi dan cara
memperoleh garis resonansi yang tepat. Oleh karena itu temperatur nyala yang
digunakan harus sangat tinggi. Nyala yang digunakan berfungsi sebagai pembakar
dan oksidator. Umumnya bahan bakar yang digunakan adalah propana, butana,
hidrogen dan asetilen sedangkan oksidator nya adalah udara, oksigen, N2O, dan
2.11 Validasi Metode Analisis
Validasi metode analisis adalah suatu tindakan penilaian terhadap parameter
tertentu berdasarkan percobaan laboratorium untuk membuktikan bahwa
parameter tersebut memenuhi persyaratan untuk penggunaannya. Hal ini
dilakukan untuk menjamin bahwa metode analisis akurat, spesifik, reprodusibel,
dan tahan pada kisaran analit yang akan dianalisis (Harmita, 2004 ; Gandjar dan
Rohman, 2007).
Beberapa parameter analisis yang harus dipertimbangkan dalama validasi
metode analisis adalah sebagai berikut :
1. Kecermatan
Kecermatan (accuracy) dinyatakan sebagai persen perolehan kembali
(recovery) analit yang ditambahkan. Untuk mencapai kecermatan yang tinggi
dapat dilakukan dengan cara menggunakan peralatan yang telah dikalibrasi,
menggunakan pereaksi dan pelarut yang baik, pengontrolan suhu, dan
pelaksanaannya yang cermat serta taat asas sesuai prosedur (Harmita, 2004).
Kecermatan ditentukan dengan dua cara yaitu :
- Metode simulasi (spiked-placebo recovery)
Dalam metode simulasi, sejumlah analit bahan murni ditambahkan ke dalam
campuran bahan pembawa sediaan farmasi (plasebo) lalu campuran tersebut
dianalisis dan hasilnya dibandingkan dengan kadar analit yang ditambahkan
(kadar yang sebenarnya) (Harmita, 2004).
- Metode penambahan baku (standard addition method)
Dalam metode penambahan baku, sampel dianalisis lalu sejumlah tertentu
dianalisis lagi. Selisih kedua hasil dibandingkan dengan kadar sebenarnya (hasil
yang diharapkan) (Harmita, 2004).
Dalam kedua metode tersebut, persen perolehan kembali dinyatakan sebagai
rasio antara hasil yang diperoleh dengan hasil yang sebenarnya. Metode adisi
dapat dilakukan dengan menambahkan sejumlah analit dengan konsentrasi
tertentu pada sampel yang diperiksa lalu dianalisis dengan metode tersebut.
Persen perolehan kembali ditentukan dengan menentukan berapa persen analit
yang ditambahkan tadi dapat ditentukan (Harmita, 2004).
Persen perolehan kembali dapat dihitung dengan menggunakan rumus di
bawah ini:
% Perolehan kembali = ��− ��
��∗ �100% Keterangan :
CA = Kadar mineral dalam sampel sebelum penambahan baku
CF = Kadar mineral dalam sampel setelah penambahan baku
C*A = Kadar larutan baku yang ditambahkan (Harmita, 2004).
2. Keseksamaan
Keseksamaan adalah ukuran yang menunjukkan derajat kesesuaian antara
hasil uji individual, diukur melalui penyebaran hasil individual dari rata-rata jika
prosedur diterapkan secara berulang pada sampel-sampel yang diambil dari
campuran yang homogen. Keseksamaan diukur sebagai simpangan baku atau
simpangan baku relatif (koefisien variasi). Keseksamaan dapat dinyatakan sebagai
adalah keseksamaan metode jika dilakukan berulang kali oleh analis yang sama
pada kondisi sama dan dalam interval waktu yang pendek (Harmita, 2004).
Menurut Harmita (2004), simpangan baku relatif dapat dihitung dengan
menggunakan rumus berikut ini :
RSD = ×100% X
SD
Keterangan : X = kadar rata-rata sampel (mg/l) −
SD = standar deviasi (mg/l)
Koefisien variasi meningkat dengan menurunnya kadar analit yang
dianalisis. Pada kadar satu per sejuta (ppm) RSD nya adalah 16 % dan pada kadar
part per billion (ppb) adalah 32 % (Harmita, 2004).
3. Batas Deteksi dan Batas Kuantitasi
Batas deteksi adalah jumlah analit terkecil dalam sampel yang dapat di
deteksi dan memberikan respon signifikan dibandingkan dengan blangko. Batas
kuantitasi merupakan parameter pada analisis dan diartikan sebagai kuantitas
analit terkecil dalam sampel yang masih dapat memenuhi kriteria cermat dan
seksama (Harmita, 2004).
Menurut Harmita (2004), batas deteksi (limit of detection, LOD) dan batas
kuantitasi (limit of quantification, LOQ) dihitung dengan menggunakan rumus
sebagai berikut:
Standar deviasi (��) = �∑(�−��)2 �−2
LOD = 3� (��) �����
BAB III
METODE PENELITIAN
Metode yang digunakan dalam penelitian ini adalah metode deskriptif yaitu
menganalisis kandungan kalsium dan magnesium dalam air minum dari mata air
di Kecamatan Gunung Sitember. Penelitian dilakukan di Laboratorium Kimia
Farmasi Kualitatif dan Laboratorium Penelitian, Fakultas Farmasi, Universitas
Sumatera Utara, Medan pada bulan Maret – Mei 2015.
3.1 Sampel
Sampel yang digunakan dalam penelitian ini adalah air minum yang berasal
dari mata air di Kecamatan Gunung Sitember. Air minum dialirkan menggunakan
pipa besi dan pipa plastik sampai ke tempat masyarakat mengambil air minum dan
sampel yang diperiksa diambil dari tempat masyarakat mengambil air minum
sebanyak 9 liter di Jl. Barisan pakpak. Hal ini dapat dilihat pada Lampiran 1
halaman 48-49.
3.2 Bahan-Bahan
Bahan yang digunakan dalam penelitian ini adalah asam nitrat pekat (65%
b/v), natrium hidroksida 2 N, asam sulfat 1 N, etanol (96% v/v), larutan kuning
titan 0,1 % b/v, larutan standar kalsium (1000 μg/ml), larutan standar magnesium
(1000 μg/ml), larutan buffer pH 7 (kalium dihidrogen posfat ditambahkan NaOH),
3.3 Alat-Alat
Spektrofotometer Serapan Atom Hitachi Z-2000 lengkap dengan lampu
katoda kalsium dan magnesium, nyala udara-asetilen, alat–alat gelas (Pyrex dan
Oberoi), hot plate, kertas saring Whatman no. 42, mikroskop Boeco, pH meter
Hanna Instruments, timbangan analitik, oven Fisher, termometer.
3.4 Prosedur Penelitian
3.4.1 Pengambilan Sampel
Metode pengambilan sampel adalah metode purposif yang ditentukan atas
dasar pertimbangan bahwa sampel yang tidak diteliti memiliki karakteristik yang
sama dan telah terwakilkan oleh sampel yang diteliti. Sampel air minum yang
diperiksa diambil dari tempat masyarakat mengambil air minum sebanyak 9 liter
di Jl. Barisan pakpak (Teddlie dan Yu, 2007).
3.4.2 Pengukuran pH
Alat pH meter dikalibrasi dengan larutan buffer pH 7 dan pH 4 setiap kali
akan melakukan pengukuran. Dicelupkan elektroda yang telah dibersihkan dengan
air suling ke dalam sampel yang akan diukur pH nya. Dicatat nilai pH yang
terukur. Pengukuran diulangi sebanyak tiga kali (SNI, 2006).
3.4.3 Pembuatan Pereaksi
Pereaksi yang digunakan dalam penelitian ini adalah larutan asam sulfat 1 N
, larutan natrium hidroksida 2 N dan larutan kuning titan 0,1 % b/v.
Larutan asam sulfat 1 N dibuat dengan cara mengencerkan larutan asam
sulfat 96 % v/v sebanyak 3 ml dalam 100 ml air suling. Larutan natrium
dalam air suling hingga 100 ml (Ditjen POM, 1995). Larutan kuning titan 0,1 %
dibuat dengan cara melarutkan 0,1 g kuning titan dalam 100 ml air suling (Vogel,
1979).
3.4.4 Proses Pembuatan Larutan Sampel
3.4.4.1 Sampel Air Minum Sebelum Dididihkan
Sampel air minum sebelum dididihkan (SBD), sebanyak 100 ml
dimasukkan ke dalam erlemeyer 250 ml lalu ditambahkan 5 ml HNO3 pekat,
dipanaskan di atas hot plate hingga volumenya tinggal ± 30 ml dari volume awal.
Kemudian didinginkan dan dimasukkan ke dalam labu tentukur 100 ml,
diencerkan dengan akuademineralisata sampai garis tanda, homogenkan. Disaring
dengan kertas saring Whatman No. 42 dan ± 10 ml larutan pertama dibuang untuk
menjenuhkan kertas saring. Larutan hasil penyaringan ditampung dan digunakan
untuk uji kuantitatif (SNI, 2006). Bagan alir proses pembuatan larutan sampel
dapat dilihat pada Lampiran 4 halaman 52.
3.4.4.2Sampel Air Minum Sesudah Dididihkan
Sampel air minum sebanyak 500 ml dididihkan selama 15 menit pada suhu
950C, disaring dengan kertas saring Whatman No. 42. Kemudian sebanyak 100 ml
filtrat dimasukkan ke dalam erlemeyer 250 ml lalu ditambahkan 5 ml HNO3 pekat,
dipanaskan di atas hot plate hingga volumenya tinggal ± 30 ml dari volume awal.
Kemudian didinginkan dan dimasukkan ke dalam labu tentukur 100 ml,
diencerkan dengan akuademineralisata sampai garis tanda, homogenkan. Disaring
dengan kertas saring Whatman No. 42 dan ± 10 ml larutan pertama dibuang untuk
untuk uji kuantitatif (SNI, 2006). Bagan alir proses pembuatan larutan sampel
dapat dilihat pada Lampiran 4 halaman 53.
3.4.5 Analisis Kualitatif
3.4.5.1 Identifikasi Kalsium dengan Asam Sulfat 1 N
Larutan sampel diteteskan 1-2 tetes pada objek gelas, kemudian ditetesi
dengan larutan asam sulfat 1N dan etanol 96%, akan terbentuk endapan putih
CaSO4 lalu diamati di bawah mikroskop. Jika terdapat ion kalsium akan terlihat
kristal berbentuk jarum (Vogel, 1979).
3.4.5.2 Identifikasi Magnesium dengan Larutan Kuning Titan 0,1% b/v
Larutan sampel sebanyak 1 ml dimasukkan ke dalam tabung reaksi,
ditambah 2 tetes NaOH 2N dan 3 tetes larutan kuning titan 0,1% b/v. Jika terdapat
ion magnesium maka akan terbentuk endapan merah terang (Vogel, 1979).
3.4.6 Analisis Kuantitatif Kalsium
3.4.6.1 Pembuatan Larutan Induk Baku Kalsium
Larutan baku kalsium (1000 μg/ml) dipipet sebanyak 1,0 ml, dimasukkan ke
dalam labu tentukur 100 ml dan dicukupkan hingga garis tanda dengan
akuademineralisata (konsentrasi 10 μg/ml).
3.4.6.2 Pembuatan Kurva Kalibrasi Kalsium
Larutan untuk kurva kalibrasi kalsium dibuat dengan memipet 3 ml; 3,5 ml;
4,0 ml; 4,5 ml; 5,0 ml larutan baku 10 μg/ml, masing-masing dimasukkan ke
dalam labu tentukur 25 ml dan dicukupkan hingga garis tanda dengan
akuademineralisata (larutan ini mengandung 1,2 μg/ml; 1,4 μg/ml; 1,6 μg/ml; 1,8
μg/ml dan 2,0 μg/ml). Diukur absorbansinya pada panjang gelombang 422,7 nm
terhadap konsentrasi. Kemudian ditentukan persamaan garis regresi dan koefisien
korelasinya.
3.4.6.3 Penetapan Kadar Kalsium dalam Sampel Sebelum Dididihkan dan Sesudah Dididihkan
3.4.6.3.1 Sampel Air Minum Sebelum Dididihkan
Larutan sampel air minum sebelum dididihkan (SBD), dipipet sebanyak 1
ml kemudian dimasukkan ke dalam labu tentukur 50 ml, ditepatkan volume nya
dengan akuademineralisata sampai garis tanda. Setelah itu diukur absorbansinya
dengan menggunakan spektrofotometer serapan atom pada panjang gelombang
422,7 nm. Nilai absorbansi yang diperoleh harus berada dalam rentang kurva
kalibrasi larutan baku kalsium. Konsentrasi kalsium dalam sampel ditentukan
berdasarkan persamaan garis regresi dari kurva kalibrasi. Bagan alir penetapan
kadar kalsium dalam sampel SBD dapat dilihat pada Lampiran 5 halaman 54.
3.4.6.3.2 Sampel Air Minum Sesudah Dididihkan
Larutan sampel air minum sesudah dididihkan (SSD), dipipet sebanyak 15
ml dan dimasukkan ke dalam labu tentukur 25 ml, ditepatkan volume nya dengan
akuademineralisata sampai garis tanda, di ukur absorbansinya dengan
menggunakan spektrofotometer serapan atom pada panjang gelombang 422,7 nm.
Nilai absorbansi yang diperoleh harus berada dalam rentang kurva kalibrasi
larutan baku kalsium. Konsentrasi kalsium dalam sampel ditentukan berdasarkan
persamaan garis regresi dari kurva kalibrasi. Bagan alir penetapan kadar kalsium
3.4.7 Analisis Kuantitatif Magnesium
3.4.7.1 Pembuatan Larutan Induk Baku Magnesium
Larutan baku magnesium (1000 μg/ml) dipipet sebanyak 1 ml, dimasukkan
ke dalam labu tentukur 100 ml dan dicukupkan hingga garis tanda dengan
akuademineralisata (konsentrasi 10 μg/ml).
3.4.7.2 Pembuatan Kurva Kalibrasi Magnesium
Larutan untuk kurva kalibrasi magnesium dibuat dengan memipet sebanyak
0,5 ml; 1 ml; 1,5 ml; 2 ml; dan 2,5 ml larutan baku 10 μg/ml, masing-masing
dimasukkan ke dalam labu tentukur 25 ml dan dicukupkan hingga garis tanda
dengan akuademineralisata (larutan ini mengandung 0,2 μg/ml; 0,4 μg/ml; 0,6
μg/ml; 0,8 μg/ml; dan 1,0 μg/ml) dan diukur absorbansinya pada panjang
gelombang 285,2 nm dengan nyala udara-asetilen. Hasil pengukuran dalam
bentuk grafik absorbansi terhadap konsentrasi. Kemudian ditentukan persamaan
garis regresi dan koefisien korelasi nya.
3.4.7.3 Penetapan Kadar Magnesium dalam Sampel Sebelum Dididihkan dan Sesudah Dididihkan
3.4.7.3.1 Sampel Air Minum Sebelum Dididihkan
Larutan sampel air minum sebelum dididihkan (SBD), dipipet sebanyak 1
ml kemudian dimasukkan ke dalam labu tentukur 25 ml, ditepatkan volume nya
dengan akuademineralisata sampai garis tanda, di ukur absorbansinya dengan
menggunakan spektrofotometer serapan atom pada panjang gelombang 285,2 nm.
Nilai absorbansi yang diperoleh harus berada dalam rentang kurva kalibrasi
berdasarkan persamaan garis regresi dari kurva kalibrasi. Bagan alir penetapan
kadar magnesium dalam sampel dapat dilihat pada Lampiran 5 halaman 55.
3.4.7.3.2 Sampel Air Minum Sesudah Dididihkan
Larutan sampel air minum sesudah dididihkan (SSD), di ukur absorbansinya
dengan menggunakan spektrofotometer serapan atom pada panjang gelombang
285,2 nm. Nilai absorbansi yang diperoleh harus berada dalam rentang kurva
kalibrasi larutan baku magnesium. Konsentrasi magnesium dalam sampel
ditentukan berdasarkan persamaan garis regresi dari kurva kalibrasi. Bagan alir
penetapan kadar magnesium dalam sampel dapat dilihat pada Lampiran 5 halaman
55.
3.4.8 Analisis Data Secara Statistik
Kadar kalsium dan magnesium yang diperoleh dari hasil pengukuran
masing-masing larutan sampel dianalisis secara statistik.
Menurut Sudjana, (2005) standar deviasi dapat di hitung dengan
menggunakan rumus sebagai berikut:
SD =
( )
1 -nX -Xi 2
∑
Keterangan : SD = standar deviasi
Xi = kadar sampel
X = kadar rata-rata sampel
n = jumlah pengulangan sampel
Kemudian dilakukan uji t untuk mengetahui apakah data ditolak atau diterima
thitung =
�
(Xi− X) ��
√�
�
�
Menurut Sudjana (2005), kadar kalsium dan magnesium di dalam sampel
dapat ditentukan dengan interval kepercayaan 99%, α = 0,01, dk = n-1, dapat
digunakan rumus:
µ = X ± t (½α,dk) x (SD/ √�)
Keterangan : µ = kadar sebenarnya (mg/l)
X = kadar rata-rata sampel (mg/l)
t = harga t tabel sesuai dengan dk = n-1
α = interval kepercayaan
dk = derajat kebebasan (dk = n-1)
SD = standar deviasi (mg/l)
n = jumlah pengulangan
3.4.9 Pengujian Beda Nilai Rata-rata
Menurut Sudjana (2005), sampel yang dibandingkan adalah independen dan
jumlah pengamatan masing-masing lebih kecil dari 30 dan varians (σ) tidak
diketahui sehingga dilakukan uji F untuk mengetahui apakah varians kedua
populasi sama (σ1 = σ 2) atau berbeda (σ1 ≠σ 2) dengan menggunakan rumus:
F0 = ��12 ��22
Keterangan : F0 = beda nilai yang dihitung
SD1= standar deviasi sampel 1 (mg/l)
Apabila dari hasil perhitungan diperoleh Fo tidak melewati nilai kritis F maka
dilanjutkan uji distribusi t dengan menghitung standar deviasi yang baru terlebih
dahulu menggunakan rumus :
Sp
=
�
(�1−1)��1 +2 (�
2−1)��22
�1+�2−2
to = (�1− �2) ���1/�1+1/�2
Keterangan : X1 = kadar rata-rata sampel 1(mg/l)
X2 = kadar rata-rata sampel 2 (mg/l)
Sp = standar deviasi (mg/l)
n1 = jumlah pengulangan sampel 1
n2 = jumlah pengulangan sampel 2
Dan jika Fo melewati nilai kritis F maka dilanjutkan uji dengan distribusi t dengan
rumus:
to =
(�1− �2)
�����12/�1+��22/�2
Kedua sampel dinyatakan berbeda apabila to yang diperoleh melewati nilai kritis t
dan sebaliknya.
3.4.10 Validasi Metode Analisis
3.4.10.1 Uji Kecermatan
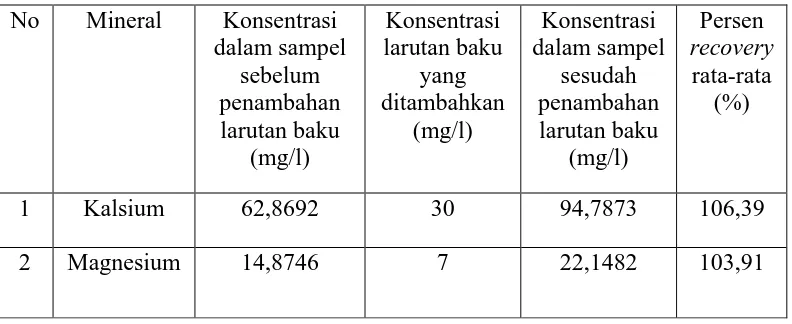
Kecermatan (accuracy) dinyatakan sebagai persen perolehan kembali
(recovery) analit yang ditambahkan. Uji perolehan kembali dilakukan dengan
sampel dianalisis terlebih dahulu, lalu sejumlah tertentu analit yang diperiksa
ditambahkan ke dalam sampel, dicampur, dan dianalisis lagi.
Uji perolehan kembali kalsium dalam air minum sebanyak 100 ml yang
sudah diketahui kadarnya, ditambahkan larutan baku kalsium 1000 µg/ml
sebanyak 3 ml, dihomogenkan, ditambahkan larutan HNO3 pekat sebanyak 5 ml,
kemudian dilanjutkan dengan prosedur penyiapan sampel seperti yang telah
dilakukan sebelumnya, diukur kadar kalsium dengan spektrofotometer serapan
atom pada panjang gelombang 422,7 nm.
Uji perolehan kembali magnesium dalam air minum sebanyak 100 ml yang
sudah diketahui kadarnya, ditambahkan larutan baku magnesium 1000 µg/ml
sebanyak 0,7 ml lalu dihomogenkan, ditambahkan larutan HNO3 pekat sebanyak
5 ml, kemudian dilanjutkan dengan prosedur penyiapan sampel seperti yang telah
dilakukan sebelumnya, diukur kadar magnesium dengan spektrofotometer serapan
atom pada panjang gelombang 285,2 nm.
Persen perolehan kembali dapat dihitung dengan menggunakan rumus di
bawah ini:
% Perolehan kembali = ��−��
��∗
�
100%Keterangan :
CA = Kadar mineral dalam sampel sebelum penambahan baku
CF = Kadar mineral dalam sampel setelah penambahan baku
3.4.10.2 Uji Keseksamaan
Keseksamaan (precision) merupakan ukuran keterulangan metode analisis
dan biasanya diekspresikan sebagai simpangan baku relatif dari sejumlah sampel
yang berbeda signifikan secara statistik (Gandjar dan Rohman, 2007).
Menurut Harmita (2004), simpangan baku relatif dapat dihitung dengan
menggunakan rumus berikut ini :
RSD = ×100% X
SD
Keterangan :
−
X = kadar rata-rata sampel (mg/l)
SD = standar deviasi (mg/l)
3.4.10.3 Penentuan Batas Deteksi dan Batas Kuantitasi
Batas deteksi merupakan jumlah terkecil analit dalam sampel yang dapat
dideteksi yang masih memberikan respon signifikan. Sedangkan batas kuantitasi
merupakan kuantitas terkecil analit dalam sampel yang masih dapat memenuhi
kriteria cermat dan seksama (Harmita, 2004).
Menurut Harmita (2004), batas deteksi (limit of detection, LOD) dan batas
kuantitasi (limit of quantification, LOQ) dihitung dengan menggunakan rumus
sebagai berikut:
Standar deviasi (��) =
�
∑(�−��)2
�−2
LOD = 3� (��) �����
LOQ = 10� (��)
3.4.11 Analisis Total Zat Terlarut
Sampel air minum sebelum dan sesudah dididihkan yang terlebih dahulu
disaring dengan kertas saring Whatman no.42, dipipet masing-masing sebanyak
50 ml. Kemudian dimasukkan ke dalam cawan penguap yang telah ditimbang
beratnya. Diuapkan di dalam oven pada suhu 1030C-1050C sampai kering. Setelah
kering didinginkan di dalam desikator dan ditimbang sampai diperoleh bobot tetap
atau perubahan berat tidak lebih dari 4% berat sebelumnya. Menurut SNI (2006),
rumus untuk menghitung zat terlarut yaitu :
zat terlarut (mg/l) = (�−�)�1000 �
keterangan : A = berat sisa kering + cawan penguap (mg)
B = berat cawan penguap kosong (mg)
V= volume sampel (ml)
Bagan alir proses penentuan total zat terlarut dapat di lihat pada Lampiran 6
halaman 56.
3.4.12 Analisis Total Zat Padat
Sampel air minum sebelum dan sesudah dididihkan, dipipet masing-masing
sebanyak 50 ml. Kemudian dimasukkan ke dalam cawan penguap yang telah
ditimbang terlebih dahulu. Diuapkan di dalam oven pada suhu 1030C-1050C
sampai kering. Setelah kering didinginkan di dalam desikator dan ditimbang
sampai diperoleh bobot yang tetap (De Zuane, 1996). Bagan alir proses penentuan
BAB IV
HASIL DAN PEMBAHASAN
4.1 Analisis Kualitatif
Analisis kualitatif dilakukan sebagai uji pendahuluan untuk mengetahui ada
atau tidak nya ion kalsium dan magnesium di dalam sampel. Sebelum dilakukan
identifikasi ion kalsium dan magnesium dalam sampel dengan reaksi kristal dan
warna, terlebih dahulu dilakukan pengukuran pH. Hasil pengukuran pH dapat
[image:52.595.113.510.346.439.2]dilihat pada Tabel 4.1
Tabel 4.1 Hasil pengukuran pH air minum sebelum dan sesudah dididihkan
Sampel air minum pH
Sebelum dididihkan Sesudah dididihkan
1 7,3 5,8
2 7,4 5,7
3 7,3 5,7
Rata-Rata 7,33 5,73
Tabel 4.1 di atas menunjukkan penurunan pH air minum sesudah
dididihkan. Sampel air minum sebelum dididihkan pH = 7,3 ( sedikit basa)
sedangkan sampel air minum sesudah dididihkan mengalami penurunan pH = 5,7
(asam). Dalam Permenkes RI No. 492/Menkes/Per/IV/2010, pH air minum yang
diperbolehkan yaitu 6,5-8,5. Hal ini menunjukkan air minum sesudah dididihkan
memiliki pH yang tidak memenuhi syarat. Nilai pH menunjukkan tinggi
rendahnya ion hidrogen dalam air yang berperan dalam menentukan sifat korosi,
semakin rendah pH maka sifat korosinya semakin tinggi. pH air yang lebih besar
dari 7 memiliki kecenderungan untuk membentuk kerak pada pipa. Nilai pH air
Hasil analisis kualitatif kalsium dan magnesium dalam sampel dapat di lihat pada
[image:53.595.111.526.167.277.2]Lampiran 3 halaman 51 dan Tabel 4.2
Tabel 4.2 Hasil analisis kualitatif kalsium dan magnesium dalam sampel
No Mineral yang dianalisis
Pereaksi yang digunakan
Hasil reaksi Keterangan
1 Kalsium Larutan H2SO4 1N + etanol 96%
Kristal berbentuk jarum
+
2 Magnesium Larutan kuning titan 0,1 % b/v + NaOH
2N
Endapan merah tua
+
Keterangan :
+ : mengandung mineral
Data yang terdapat dalam Tabel 4.2 menunjukkan bahwa di dalam sampel
terdapat ion kalsium dan magnesium. Identifikasi kalsium dengan larutan H2SO4
1N di tambah dengan etanol 96% membentuk kristal jarum menunjukkan adanya
ion kalsium. Uji magnesium dengan penambahan larutan kuning titan 0,1 % b/v di
tambah dengan NaOH 2N membentuk endapan merah tua yang menunjukkan
adanya ion magnesium.
Hasil pengukuran dengan spektrofotometer serapan atom menunjukkan
adanya absorbansi pada panjang gelombang kalsium 422,7 nm dan magnesium
285,2 nm. Hal ini turut membuktikan bahwa reaksi kristal maupun reaksi warna
menunjukkan bahwa sampel mengandung atom kalsium dan magnesium.
4.2 Analisis Kuantitatif
4.2.1 Kurva Kalibrasi Kalsium dan Magnesium
Kurva kalibrasi kalsium dan magnesium diperoleh dengan cara mengukur
422,7 nm dan 285,2 nm. Kurva kalibrasi kalsium dan magnesium dapat dilihat
[image:54.595.130.469.150.297.2]pada Gambar 4.1 dan Gambar 4.2 berikut ini :
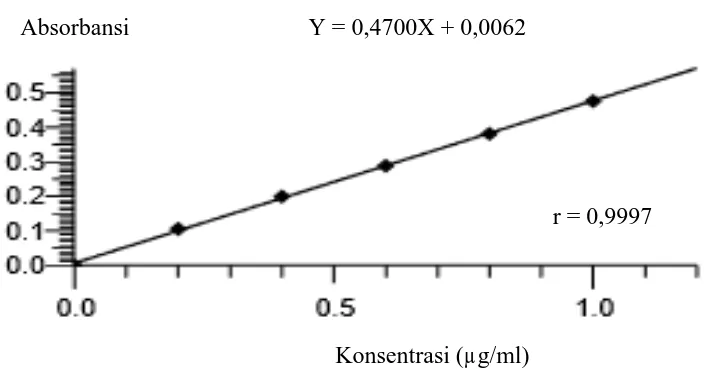
Gambar 4.1 Kurva Kalibrasi Larutan Baku Kalsium
Gambar 4.2 Kurva Kalibrasi Larutan Baku Magnesium
Hasil pengukuran kurva kalibrasi kalsium dan magnesium diperoleh
persamaan regresi Y = 0,0259X + 0,0011 dan Y = 0,4700X + 0,0062.
Kedua kurva diatas menunjukkan hubungan yang linear antara konsentrasi
dengan absorbansi. Dimana koefisien korelasi kalsium r = 0,9997 dan magnesium
r = 0,9997. Nilai r ≥ 0,97 dapat diterima dan memenuhi kriteria validasi (Ermer
KKKonsentrasi (µg/ml)
Konsentrasi (ppm)
Konsentrasi (µg/ml) Absorbansi Y = 0,0259X + 0,0011
r = 0,9997
Absorbansi Y = 0,4700X + 0,0062
[image:54.595.123.476.381.566.