ANALISIS KANDUNGAN KALSIUM, KALIUM, DAN
MAGNESIUM PADA DAUN KELOR (
Moringa oleifera
Lam.)
SEGAR DAN DIREBUS SECARA SPEKTROFOTOMETRI
SERAPAN ATOM
SKRIPSI
OLEH:
SRI WAHYUNI
NIM 111501048
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
ANALISIS KANDUNGAN KALSIUM, KALIUM, DAN
MAGNESIUM PADA DAUN KELOR (
Moringa oleifera
Lam.)
SEGAR DAN DIREBUS SECARA SPEKTROFOTOMETRI
SERAPAN ATOM
SKRIPSI
Diajukan Sebagai Salah Satu Syarat Untuk Memperoleh Gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
SRI WAHYUNI
NIM 111501048
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGESAHAN SKRIPSI
ANALISIS KANDUNGAN KALSIUM, KALIUM, DAN
MAGNESIUM PADA DAUN KELOR (
Moringa oleifera
Lam.)
SEGAR DAN DIREBUS SECARA SPEKTROFOTOMETRI
SERAPAN ATOM
OLEH:
SRI WAHYUNI
NIM 111501048
Dipertahankan di hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal : 18 Juni 2015
Pembimbing I, Panitia Penguji,
Dra. Sudarmi, M.Si., Apt. Prof. Dr. rer. nat. E. D. L. Putra, S.U., Apt.
NIP 195409101983032001 NIP 195306191983031001
Pembimbing II, Dra. Sudarmi, M.Si., Apt.
NIP 195409101983032001
Drs. Fathur Rahman Harun, M.Si., Apt. Dra. Tuty Roida Pardede, M.Si., Apt. NIP 195201041980031002 NIP 195401101980032001
Dra. Masria Lasma Tambunan, M.Si., Apt. NIP 195005081977022001
Medan, Juli 2015 Fakultas Farmasi
Universitas Sumatera Utara Wakil Dekan I
KATA PENGANTAR
Puji syukur ke hadirat Tuhan Yang Maha Kuasa yang telah memberikan berkah
karunia yang berlimpah sehingga penulis dapat meyelesaikan penyusunan skripsi
yang berjudul Analisis Kandungan Kalsium, Kalium, dan Magnesium pada Daun Kelor (Moringa oleifera Lam.) Segar dan Direbus Secara Spektrofotometri Serapan Atom. Skripsi ini diajukan untuk melengkapi salah satu syarat untuk memperoleh gelar Sarjana Farmasi di Fakultas Farmasi Universitas Sumatera
Utara.
Pada kesempatan ini, dengan segala kerendahan hati penulis mengucapkan terima
kasih kepada Bapak Prof. Dr. Sumadio Hadisahputra, Apt., selaku Dekan Fakultas
Farmasi yang telah menyediakan fasilitas kepada penulis selama perkuliahan di
Fakultas Farmasi. Penulis mengucapkan terima kasih kepada Ibu Prof. Dr. Julia
Reveny, M.Si., Apt., sebagai wakil Dekan I yang telah memberikan pengarahan
dan kemudahan untuk menyelesaikan skripsi ini. Penulis mengucapkan terima
kasih kepada Ibu Dra.Sudarmi, M.Si., Apt. dan Bapak Drs. Fathur Rahman Harun,
M.Si., Apt., selaku dosen pembimbing yang telah mengarahkan penulis dengan
penuh kesabaran dan tanggung jawab, memberikan petunjuk dan saran-saran
selama penelitian hingga selesainya skripsi ini. Penulis juga menyampaikan
ucapan terima kasih kepada Bapak Prof. Dr. rer. nat. Effendy De Lux Putra, S.U.,
Apt. selaku ketua penguji, Ibu Dra.Tuty Roida Pardede, M.Si., Apt., dan Ibu Dra.
Masria Lasma Tambunan, M.Si., Apt., selaku anggota penguji yang telah
memberikan saran dan arahan untuk menyempurnakan skripsi ini serta Bapak Drs.
Awaluddin Saragih, M.Si., Apt., selaku dosen penasehat akademik yang telah
Penulis mengucapkan terima kasih dan penghargaan yang tiada terhingga kepada
Ayahanda Husainy dan Ibunda Salmah yang telah memberikan cinta dan kasih
sayang yang tidak ternilai dengan apapun, pengorbanan baik materi maupun
motivasi beserta doa yang tulus yang tidak pernah berhenti serta seluruh keluarga
yang selalu mendoakan dan memberikan semangat. Penulis dengan tulus
mengucapkan terima kasih kepada abang-kakak senior, sahabat tercinta Juliyanti,
Linda Margata, Jeriko Anggono, dan sahabat lainnya yang tidak dapat disebutkan
satu persatu terutama kawan-kawan Farmasi angkatan 2011.
Penulis menyadari sepenuhnya bahwa dalam penulisan skripsi ini masih jauh dari
kesempurnaan, Oleh karena itu dengan segala kerendahan hati, penulis menerima
kritik dan saran demi kesempurnaan skripsi ini. Akhirnya, penulis berharap
semoga skripsi ini dapat memberi manfaat bagi kita semua.
Medan, 1 Juni 2015 Penulis,
ANALISIS KANDUNGAN KALSIUM, KALIUM, DAN MAGNESIUM PADA DAUN KELOR (Moringa oleifera Lam.) SEGAR DAN DIREBUS
SECARA SPEKTROFOTOMETRI SERAPAN ATOM
Abstrak
Moringa oleifera Lam yang kita kenal dengan nama Kelor adalah species yang paling terkenal dari tiga belas spesies genus Moringacae. Mineral yang terdapat dalam Kelor adalah Kalsium, Tembaga, Besi, Mangan, Magnesium, Fosfor, Kalium, Sodium, Sulphur, dan Zinc. Daun kelor sebagai sumber vitamin dan mineral dapat dikonsumsi dengan cara dimasak, atau dimakan mentah atau dikeringkan menjadi serbuk. Salah satu metode dengan pemasakan yaitu perebusan dalam air. Vitamin dan mineral yang mudah larut dalam air merupakan zat gizi yang cepat hilang pada saat merebus sayuran. Penelitian ini bertujuan untuk menentukan dan mengetahui perbedaan kadar kalsium, kalium, dan magnesium yang terkandung dalam daun kelor segar dan direbus.
Sampel daun kelor didestruksi kering dan dilakukan analisis kuantitatif terhadap kalsium, kalium, dan magnesium dengan menggunakan metode spektrofotometri serapan atom (AAS) yaitu kalsium pada panjang gelombang 422,7 nm, kalium pada panjang gelombang 766,5 nm, dan magnesium pada panjang gelombang 285,2 nm dengan tipe nyala udara-asetilen.
Dari hasil penelitian diperoleh bahwa kadar kalsium pada daun kelor segar adalah (873,4579 ± 2,2950)mg/100g; (606,1327 ± 13,9095)mg/100g untuk kalium; dan (117,7626 ± 0,9899)mg/100g untuk magnesium. Sedangkan kadar kalsium pada daun kelor rebus adalah (731,3755 ± 3,2586)mg/100g; (81,1258 ± 0,5593)mg/100g untuk kalium; dan (35,1865 ± 0,1608)mg/100g untuk magnesium. Secara statistik uji beda nilai rata-rata kandungan kalsium, kalium, dan magnesium dengan menggunakan distribusi F diperoleh bahwa terdapat perbedaan yang signifikan rata-rata kadar kalsium, kalium, dan magnesium antara daun kelor segar dan daun kelor rebus.
CONTENT ANALYSIS OF CALCIUM, POTASSIUM, AND MAGNESIUM IN LEAVES (Moringa oleifera Lam.) FRESH AND BOILED IN ATOMIC
ABSORPTION SPECTROPHOTOMETRY
Abstract
Moringa oleifera Lam that we know as Moringa is the best-known species of the thirteen species of the genus Moringacae. Minerals contained in Moringa are calcium, copper, iron, manganese, magnesium, phosphorus, potassium, sodium, sulphur, and zinc. Moringa leaves as a source of vitamins and minerals can be consumed in a way cooked, or eaten raw or dried into powder. One of the cooking method is boiling in the water. Vitamins and minerals are easily soluble in water is a nutrient that is quickly lost when boiling vegetables. This study aims to determine and know the differences in the levels of calcium, potassium, and magnesium in fresh Moringa leaves and boiled Moringa leaves.
Moringa leaves samples were dried destruction and a quantitative analysis of calcium, potassium, and magnesium were calculated using atomic absorption spectrophotometry (AAS) is calcium at a wavelength of 422.7 nm, potassium at a wavelength of 766.5 nm, and magnesium at a wavelength 285.2 nm with the type of air - acetylene flame.
The results showed that the level of calcium in the fresh Moringa leaves were (873.4579 ± 2.2950) mg / 100g; (606.1327 ± 13.9095) mg / 100g for potassium; and (117.7626 ± 0.9899) mg / 100g for magnesium. While the level of calcium in boiled Moringa leaves were (731.3755 ± 3.2586) mg / 100g; (81.1258 ± 0.5593) mg / 100g for potassium; and (35.1865 ± 0.1608) mg / 100g for magnesium. Statistically significant difference test average content levels of calcium, potassium, and magnesium using the F distribution is obtained that there is a significant difference on average levels of calcium, potassium, and magnesium between fresh Moringa leaves and boiled Moringa leaves.
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN JUDUL ... ii
LEMBAR PENGESAHAN ... iii
KATA PENGANTAR ... iv
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xiv
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Hipotesis ... 3
1.4 Tujuan Penelitian ... 4
1.5 Manfaat Penelitian ... 4
BAB II TINJAUAN PUSTAKA ... 5
2.1 Uraian Sampel ... 5
2.1.1 Sejarah Daun Kelor ... 5
2.1.2 Deskripsi Tanaman ... 5
2.1.3 Kandungan Kimia ... 7
2.1.5 Pemanfaatan Kelor ... 9
2.2 Mineral ... 10
2.2.1 Kalsium ... 10
2.2.2 Kalium ... 11
2.2.3 Magnesium ... 11
2.3 Spektrofotometri Serapan Atom ... 12
2.4 Validasi Metode Analisis ... 17
BAB III METODE PENELITIAN ... 20
3.1 Tempat dan Waktu Penelitian ... 20
3.2 Jenis Penelitian ... 20
3.3 Alat ... 20
3.4 Bahan ... 20
3.5 Metode Pengambilan Sampel ... 21
3.6 Identifikasi Sampel ... 21
3.7 Pembuatan Pereaksi ... 21
3.7.1 Larutan HNO3 (1:1) ... 21
3.7.2 Asam Pikrat 1% b/v ... 21
3.7.3 Larutan H2SO4 1N ... 21
3.7.4 Kuning Titan 0,1% b/v ... 21
3.7.5 Larutan NaOH 2N ... 22
3.8 Penyiapan Sampel ... 22
3.9 Proses Destruksi ... 22
3.10 Pembuatan Larutan Sampel ... 22
3.11.1 Kalsium ... 23
3.11.1.1 Uji Nyala Ni/Cr ... 23
3.11.1.2 Uji Kristal Kalsium dengan Asam Sulfat 1N ... 23
3.11.2 Kalium ... 23
3.11.2.1 Uji Nyala Ni/Cr ... 23
3.11.2.2 Uji Kristal Kalium dengan Asam Pikrat ... 24
3.11.3 Magnesium ... 24
3.11.3.1 Reaksi Kualitatif dengan Larutan Kuning Titan 0,1% b/v ... 24
3.12 Pemeriksaan Kuantitatif ... 24
3.12.1 Pembuatan Kurva Kalibrasi Kalsium ... 24
3.12.2 Pembuatan Kurva Kalibrasi Kalium ... 24
3.12.3 Pembuatan Kurva Kalibrasi Magnesium ... 25
3.13 Penetapan Kadar Kalsium, Kalium dan Magnesium dalam Sampel ... 25
3.13.1 Penetapan Kadar Kalsium ... 25
3.13.2 Penetapan Kadar Kalium ... 26
3.13.3 Penetapan Kadar Magnesium ... 26
3.14 Validasi ... 26
3.14.1 Simpangan Baku Relatif ... 26
3.14.2 Uji Perolehan Kembali (Recovery) ... 27
3.14.3 Penentuan Batas Deteksi (Limit of Detection) dan Batas Kuantitasi (Limit of Quantitation) ... 28
3.15 Analisis Data Secara Statistik ... 28
3.15.1 Penolakan Hasil Pengamatan ... 28
BAB IV HASIL DAN PEMBAHASAN ... 31
4.1 Hasil Identifikasi Tumbuhan ... 31
4.2 Analisis Kualitatif... 31
4.3 Analisis Kuantitatif ... 32
4.3.1 Kurva Kalibrasi Kalsium, Kalium, dan Magnesium ... 32
4.3.2 Analisis Kadar Kalsium, Kalium dan Magnesium dalam Sampel ... 34
4.3.3 Uji Perolehan Kembali (Recovery) ... 36
4.3.4 Simpangan Baku Relatif ... 37
4.3.5 Batas Deteksi dan Batas Kuantitasi ... 38
BAB V KESIMPULAN DAN SARAN ... 39
5.1 Kesimpulan ... 39
5.2 Saran ... 39
DAFTAR PUSTAKA ... 40
DAFTAR TABEL
Halaman
Tabel 2.1 Kandungan Nutrisi Polong, Daun Segar, dan Serbuk Daun
Kelor ... 8
Tabel 4.1 Hasil Analisis Kualitatif ... ... 31
Tabel 4.2 Hasil Analisis Kuantitatif Kadar Kalsium, Kalium, dan
Magnesium dalam Sampel ... 35
Tabel 4.3 Hasil Uji Beda Nilai Rata-rata Kadar Kalsium, Kalium,
dan Magnesium ... 36
Tabel 4.4 Persen Uji Perolehan Kembali (Recovery) Kadar Kalsium,
Kalium, dan Magnesium ... 37
Tabel 4.5 Simpangan Baku Relatif Kalsium, Kalium, dan
Magnesium ... 37
Tabel 4.6 Batas Deteksi dan Batas Kuantitasi Kalsium, Kalium, dan
DAFTAR GAMBAR
Halaman
Gambar 2.1 Komponen Spektrofotometer Serapan Atom ... 13
Gambar 4.1 Kurva Kalibrasi Larutan Standar Kalsium ... 32
Gambar 4.2 Kurva Kalibrasi Larutan Standar Kalium ... 32
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Hasil Identifikasi Sampel ... 42
Lampiran 2. Sampel Kelor (Moringa oleifera Lam.) ... 43
Lampiran 3. Gambar alat-alat yang Digunakan ... 45
Lampiran 4. Bagan Alir Proses Destruksi Kering (Daun Kelor Segar) ... 47
Lampiran 5. Bagan Alir Proses Destruksi Kering (Daun Kelor Rebus) .... 48
Lampiran 6. Bagan Alir Pembuatan Larutan Sampel ... 49
Lampiran 7. Hasil Analisis Kualitatif Kalsium, Kalium, dan Magnesium ... 50
Lampiran 8. Data Kalibrasi Kalsium dengan Spektrofotometer Serapan Atom, Perhitungan Persamaan Garis Regresi dan Koefisien Korelasi (r) ... 52
Lampiran 9. Data Kalibrasi Kalium dengan Spektrofotometer Serapan Atom, Perhitungan Persamaan Garis Regresi dan Koefisien Korelasi (r) ... 54
Lampiran 10. Data Kalibrasi Magnesium dengan Spektrofotometer Serapan Atom, Perhitungan Persamaan Garis Regresi dan Koefisien Korelasi (r) ... 56
Lampiran 11. Hasil Analisis Kadar Kalsium, Kalium, dan Magnesium dalam Daun Kelor Segar ... 58
Lampiran 12. Hasil Analisis Kadar Kalsium, Kalium, dan Magnesium dalam Daun Kelor Rebus ... 59
Lampiran 13. Contoh Perhitungan Kadar Kalsium, Kalium, dan Magnesium dalam Daun Kelor Segar ... 60
Lampiran 14. Perhitungan Statistik Kadar Kalsium dalam Sampel ... 63
Lampiran 15. Perhitungan Statistik Kadar Kalium dalam Sampel ... 67
Lampiran 17. Pengujian Beda Nilai Rata-rata Kadar Kalsium pada
Sampel Daun Kelor Segar dan Daun Kelor Rebus ... 76
Lampiran 18. Pengujian Beda Nilai Rata-rata Kadar Kalium pada
Sampel Daun Kelor Segar dan Daun Kelor Rebus ... 78
Lampiran 19. Pengujian Beda Nilai Rata-rata Kadar Magnesium pada
Sampel Daun Kelor Segar dan Daun Kelor Rebus ... 80
Lampiran 20. Hasil Analisis Kadar Kalsium, Kalium, dan Magnesium Sebelum dan Sesudah Penambahan Masing-Masing
Larutan Baku pada Daun Kelor Segar ... 82
Lampiran 21. Perhitungan Uji Perolehan Kembali Kadar Kalsium,
Kalium, dan Magnesium dalam Daun Kelor Segar ... 85
Lampiran 22. Perhitungan Simpangan Baku Relatif (RSD) Kadar
Kalsium, Kalium, dan Magnesium ... 106
Lampiran 23. Perhitungan Batas Deteksi (LOD) dan Batas Kuantitasi
(LOQ) ... 109 Lampiran 24. Tabel Distribusi t... 112
ANALISIS KANDUNGAN KALSIUM, KALIUM, DAN MAGNESIUM PADA DAUN KELOR (Moringa oleifera Lam.) SEGAR DAN DIREBUS
SECARA SPEKTROFOTOMETRI SERAPAN ATOM
Abstrak
Moringa oleifera Lam yang kita kenal dengan nama Kelor adalah species yang paling terkenal dari tiga belas spesies genus Moringacae. Mineral yang terdapat dalam Kelor adalah Kalsium, Tembaga, Besi, Mangan, Magnesium, Fosfor, Kalium, Sodium, Sulphur, dan Zinc. Daun kelor sebagai sumber vitamin dan mineral dapat dikonsumsi dengan cara dimasak, atau dimakan mentah atau dikeringkan menjadi serbuk. Salah satu metode dengan pemasakan yaitu perebusan dalam air. Vitamin dan mineral yang mudah larut dalam air merupakan zat gizi yang cepat hilang pada saat merebus sayuran. Penelitian ini bertujuan untuk menentukan dan mengetahui perbedaan kadar kalsium, kalium, dan magnesium yang terkandung dalam daun kelor segar dan direbus.
Sampel daun kelor didestruksi kering dan dilakukan analisis kuantitatif terhadap kalsium, kalium, dan magnesium dengan menggunakan metode spektrofotometri serapan atom (AAS) yaitu kalsium pada panjang gelombang 422,7 nm, kalium pada panjang gelombang 766,5 nm, dan magnesium pada panjang gelombang 285,2 nm dengan tipe nyala udara-asetilen.
Dari hasil penelitian diperoleh bahwa kadar kalsium pada daun kelor segar adalah (873,4579 ± 2,2950)mg/100g; (606,1327 ± 13,9095)mg/100g untuk kalium; dan (117,7626 ± 0,9899)mg/100g untuk magnesium. Sedangkan kadar kalsium pada daun kelor rebus adalah (731,3755 ± 3,2586)mg/100g; (81,1258 ± 0,5593)mg/100g untuk kalium; dan (35,1865 ± 0,1608)mg/100g untuk magnesium. Secara statistik uji beda nilai rata-rata kandungan kalsium, kalium, dan magnesium dengan menggunakan distribusi F diperoleh bahwa terdapat perbedaan yang signifikan rata-rata kadar kalsium, kalium, dan magnesium antara daun kelor segar dan daun kelor rebus.
CONTENT ANALYSIS OF CALCIUM, POTASSIUM, AND MAGNESIUM IN LEAVES (Moringa oleifera Lam.) FRESH AND BOILED IN ATOMIC
ABSORPTION SPECTROPHOTOMETRY
Abstract
Moringa oleifera Lam that we know as Moringa is the best-known species of the thirteen species of the genus Moringacae. Minerals contained in Moringa are calcium, copper, iron, manganese, magnesium, phosphorus, potassium, sodium, sulphur, and zinc. Moringa leaves as a source of vitamins and minerals can be consumed in a way cooked, or eaten raw or dried into powder. One of the cooking method is boiling in the water. Vitamins and minerals are easily soluble in water is a nutrient that is quickly lost when boiling vegetables. This study aims to determine and know the differences in the levels of calcium, potassium, and magnesium in fresh Moringa leaves and boiled Moringa leaves.
Moringa leaves samples were dried destruction and a quantitative analysis of calcium, potassium, and magnesium were calculated using atomic absorption spectrophotometry (AAS) is calcium at a wavelength of 422.7 nm, potassium at a wavelength of 766.5 nm, and magnesium at a wavelength 285.2 nm with the type of air - acetylene flame.
The results showed that the level of calcium in the fresh Moringa leaves were (873.4579 ± 2.2950) mg / 100g; (606.1327 ± 13.9095) mg / 100g for potassium; and (117.7626 ± 0.9899) mg / 100g for magnesium. While the level of calcium in boiled Moringa leaves were (731.3755 ± 3.2586) mg / 100g; (81.1258 ± 0.5593) mg / 100g for potassium; and (35.1865 ± 0.1608) mg / 100g for magnesium. Statistically significant difference test average content levels of calcium, potassium, and magnesium using the F distribution is obtained that there is a significant difference on average levels of calcium, potassium, and magnesium between fresh Moringa leaves and boiled Moringa leaves.
BAB I
PENDAHULUAN
1.1Latar Belakang
Moringa oleifera Lam (sinonim: Moringa pterygosperma Gaertner) yang kita kenal dengan nama Kelor adalah species yang paling terkenal dari tiga belas
spesies genus Moringacae. Kelor ini telah dibudidayakan di India sejak ribuan tahun yang lalu dan masyarakat kuno India mengetahui bahwa biji-bijian
mengandung minyak nabati serta menggunakannya untuk tujuan pengobatan.
Sekarang, masyarakat India pada umumnya memanfaatkan Kelor sebagai pakan
ternak atau sayuran (Krisnadi, 2015).
Tanaman Kelor telah dikenal selama berabad-abad sebagai tanaman multi
guna, padat nutrisi dan berkhasiat obat. Mengandung senyawa alami yang lebih
banyak dan beragam dibanding jenis tanaman lainnya. Tanaman Kelor mengandung
46 antioksidan kuat yang melindungi tubuh dari radikal bebas, mengandung 18 asam
amino (8 diantaranya esensial) yang dibutuhkan tubuh untuk membangun sel-sel
baru, 36 senyawa anti inflamasi, serta 90 nutrisi alami seperti vitamin dan mineral
(Krisnadi, 2015).
Bahan mineral mendominasi tanah yang diperoleh dari hasil pelapukan
batuan, media tempat tumbuh perakaran tanaman, dan penyedia unsur hara.
Komponen mineral adalah semua jenis bahan padat hasil pelapukan batuan induk,
termasuk mineral primer, mineral sekunder, dan bahan amorf yang mempunyai
bermacam-macam ukuran dan komposisi (Sutanto, 2005). Mineral merupakan
fungsitubuh baik pada tingkat sel, jaringan, organ, maupun fungsi tubuh secara
keseluruhan (Almatsier, 2004).
Kelor mengandung seluruh nutrisi yang dibutuhkan untuk
menyeimbangkan tekanan darah. Kalsium, Magnesium, Kalium, Seng, dan
Vitamin E juga ditemukan pada Kelor. Kalsium dibutuhkan untuk relaksasi otot
polos dan kontraksi, peningkatan konsumsi kalsium dapat memiliki efek langsung
pada pembuluh darah. Kelor mengandung kalium 15 kali lebih banyak dari
pisang(Krisnadi, 2015).Mineral kalium merupakan ion intraselular dan salah satu
mineral makro yang berperan dalam pengaturan keseimbangan cairan tubuh
(Almatsier, 2004). Kelor juga mengandung magnesium bersama dengan zinc dan vitamin E yang mengambil bagian dalam mengurangi tekanan darah bersama
dengan nutrisi lainnya (Krisnadi, 2015).
Daun kelor sebagai sumber vitamin dan mineral dapat dikonsumsi dengan
cara dimasak, atau dimakan mentah atau dikeringkan menjadi serbuk daun
kelor.Selain dapat disayur, daun kelor juga dapat dijadikan minuman bagi wanita
hamil dan anak-anak terutama selama musim hujan (Luthfiyah, 2012).Hampir
semua jenis sayur dapat diolah dengan cara direbus. Vitamin dan mineral yang
mudah larut dalam air merupakan zat gizi yang cepat hilang pada saat merebus
sayuran (Murdiati dan Amaliah, 2013).
Analisis logam kalium, kalsium, magnesium, dan natrium pada kulit
batang kelor (Moringa oleifera Lam.) secara spektrofotometri serapan atom telah diteliti oleh peneliti sebelumnya. Metode kompleksometri, spektrofotometri
serapan atom, dan gravimetri banyak digunakan untuk penetapan kadar kalsium
metode gravimetri dan spektrofotometri serapan atom (Jeffery et al., 1989).
Namun, pada penelitian ini dilakukan dengan menggunakan spektrofotometri
serapan atom karena mempunyai kepekaan yang tinggi (batas deteksi kurang dari
1 ppm) dan pelaksanaannya relatif cepat dan sederhana, dan interferensinya
sedikit (Gandjar dan Rohman, 2007).
Berdasarkan hal di atas, maka peneliti tertarik untuk melakukan penelitian
analisis kandungan kalsium, kalium, dan magnesium pada daun kelor (Moringa oleifera Lam.) segar dan direbus secara spektrofotometri serapan atom serta mengetahui apakah terdapat perbedaan kadar kalsium, kalium, dan magnesium
antara daun yang masih segar maupun yang telah mengalami perebusan.
1.2 Perumusan Masalah
1. Berapakah kadar kalsium, kalium, dan magnesium yang terkandung dalam
daun kelor segar dan direbus?
2. Apakah terdapat perbedaan kadar kalsium, kalium, dan magnesium antara
daun kelor segar dan daun kelor yang direbus?
1.3 Hipotesis
1. Daun kelor segar dan direbus mengandung mineral kalsium, kalium, dan
magnesium dalam jumlah tertentu.
2. Terdapat perbedaan kadar kalsium, kalium, dan magnesium antara daun
1.4 Tujuan Penelitian
1. Untuk menentukan kadar kalsium, kalium, dan magnesium yang
terkandung dalam daun kelor segar dan direbus.
2. Untuk mengetahui perbedaankadar kalsium, kalium, dan magnesium pada
daun kelor segar dan daun kelor yang direbus.
1.5Manfaat Penelitian
Untuk memberikan informasi kepada masyarakat tentang kandungan
mineral kalsium, kalium, dan magnesium yang terkandung dalam daun kelor segar
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Sampel
2.1.1 Sejarah Daun Kelor
Lowell Fuglie adalah seorang warga negara Prancis yang tinggal dan
bekerja di Senegal. Ia menjadi orang yang pertama kali meneliti kandungan nutrisi
pada daun kelor dan menemukan bukti bahwa ibu-ibu hamil yang mengalami gizi
buruk sekalipun masih bisa dibantu untuk memiliki bayi yang sehat dengan cara
mengonsumsi daun kelor (Pradana, 2013).
Hasil penelitian Lowell kemudian banyak dimanfaatkan oleh berbagai
negara untuk memerangi gizi buruk, terutama negara-negara berkembang di
Semenanjung Afrika. Program penggalakan penanaman daun kelor di Afrika
merupakan kampanye intensif melalui lembaga-lembaga pendidikan dan swadaya
masyarakat. Bahkan waktu itu Sekretaris Jenderal Perserikatan Bangsa -bangsa
(PBB) Kofi Annan mendukung sosialisasi penggunaan daun kelor untuk
memerangi gizi buruk (Pradana, 2013).
2.1.2 Deskripsi Tanaman
Tanaman kelor (Moringa oleifera L.) dapat berupa semak atau pohon dengan tinggi 12 m dan diameter 30 cm. Kayunya merupakan jenis kayu lunak
dan memiliki kualitas rendah (Pradana, 2013).
Menurut Tejas et al. (2012), klasifikasi taksonomi kelor adalah :
Kerajaan : Plantae
Divisi : Magnoliophyta
Kelas : Magnoliopsida
Sub-Kelas : Dilleniidae
Ordo : Capparales
Famili : Moringaceae
Genus : Moringa
Spesies : Moringa oleifera Lam
Ada sekitar 13 (tiga belas) spesies dari moringa dengan famili
Moringaceae yaitu Moringa oleifera, Moringa arborea, Moringa borziana, Moringa concanensis, Moringa drouhardii, Moringa hildebrandtii, Moringa longituba, Moringa ovalifolia, Moringa peregrina, Moringa pygmaea, Moringa rivae, Moringa ruspoliana, Moringa stenopetala (Mahmood et al., 2010). Perbedaan antara satu spesies dengan lainnya adalah bentuk batang, dan geografis
tempat tumbuh. Untuk daratan Asia, termasuk India dan Indonesia tanaman kelor
yang tumbuh masuk dalam spesies Moringaoleifera. Hal ini disebabkan ciri-ciri
fisik dan tempat tanaman tumbuh pada suhu dan lingkungan tropis di Benua Asia
(Luthfiyah, 2012).
Di Indonesia, tanaman kelor dikenal dengan berbagai nama. Masyarakat
Kelor termasuk jenis tumbuhan perdu yang dapat memiliki ketinggian
batang 7 - 12 meter. Merupakan tumbuhan yang berbatang dan termasuk jenis
batang berkayu, sehingga batangnya keras dan kuat. Bentuknya sendiri adalah
bulat (teres) dan permukaannya kasar. Akar tunggang, berwarna putih. Kulit akar berasa pedas dan berbau tajam, dari dalam berwarna kuning pucat, bergaris halus
tapi terang dan melintang. Daun majemuk, bertangkai panjang, tersusun berseling
(alternate), beranak daun gasal (imparipinnatus), helai daun saat muda berwarna hijau muda - setelah dewasa hijau tua, bentuk helai daun bulat telur, panjang 1 - 2
cm, lebar 1 - 2 cm, tipis lemas, ujung dan pangkal tumpul (obtusus), tepi rata, susunan pertulangan menyirip (pinnate), permukaan atas dan bawah halus. Bunga muncul di ketiak daun (axillaris), bertangkai panjang, kelopak berwarna putih agak krem, menebar aroma khas. Kelor berbuah setelah berumur 12 - 18 bulan.
Buah atau polong Kelor berbentuk segi tiga memanjang yang disebut klentang
(Jawa) dengan panjang 20 - 60 cm, ketika muda berwarna hijau - setelah tua
menjadi cokelat, biji didalam polong berbentuk bulat, ketika muda berwarna hijau
terang dan berubah berwarna coklat kehitaman ketika polong matang dan kering.
Biji berbentuk bulat dengan lambung semi-permeabel berwarna kecoklatan.
Lambung sendiri memiliki tiga sayap putih yang menjalar dari atas ke bawah
(Krisnadi, 2015).
2.1.3 Kandungan Kimia
Kandungan senyawa Kelor telah diteliti dan dilaporkan oleh While
Gopalan, et al. (Krisnadi, 2015). Senyawa tersebut meliputi Nutrisi, Mineral,
Vitamin dan Asam Amino. Menurut Krisnadi (2015), kandungan senyawa dari
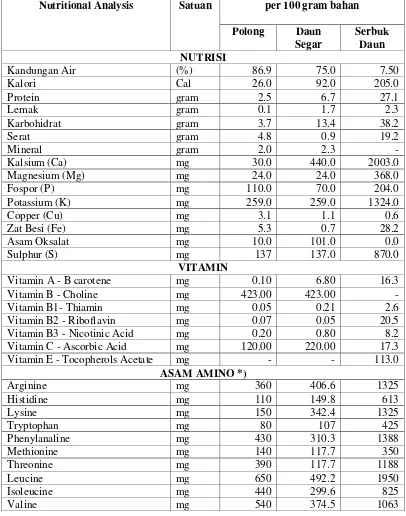
Tabel 2.1 Kandungan Nutrisi Polong, Daun Segar dan Serbuk Daun Kelor
Nutritional Analysis Satuan per 100 gram bahan Polong Daun
Segar
Serbuk Daun NUTRISI
Kandungan Air (%) 86.9 75.0 7.50
Kalori Cal 26.0 92.0 205.0
Protein gram 2.5 6.7 27.1
Lemak gram 0.1 1.7 2.3
Karbohidrat gram 3.7 13.4 38.2
Serat gram 4.8 0.9 19.2
Mineral gram 2.0 2.3 -
Kalsium (Ca) mg 30.0 440.0 2003.0
Magnesium (Mg) mg 24.0 24.0 368.0
Fospor (P) mg 110.0 70.0 204.0
Potassium (K) mg 259.0 259.0 1324.0
Copper (Cu) mg 3.1 1.1 0.6
Zat Besi (Fe) mg 5.3 0.7 28.2
Asam Oksalat mg 10.0 101.0 0.0
Sulphur (S) mg 137 137.0 870.0
VITAMIN
Vitamin A - B carotene mg 0.10 6.80 16.3
Vitamin B - Choline mg 423.00 423.00 -
Vitamin B1- Thiamin mg 0.05 0.21 2.6
Vitamin B2 - Riboflavin mg 0.07 0.05 20.5
Vitamin B3 - Nicotinic Acid mg 0.20 0.80 8.2
Vitamin C - Ascorbic Acid mg 120.00 220.00 17.3
Vitamin E - Tocopherols Acetate mg - - 113.0
ASAM AMINO *)
Arginine mg 360 406.6 1325
Histidine mg 110 149.8 613
Lysine mg 150 342.4 1325
Tryptophan mg 80 107 425
Phenylanaline mg 430 310.3 1388
Methionine mg 140 117.7 350
Threonine mg 390 117.7 1188
Leucine mg 650 492.2 1950
Isoleucine mg 440 299.6 825
Valine mg 540 374.5 1063
*While Gopalan, et al. Melaporkan kandungan asam amino dalam satuan per gram N (nitrogen), tabel ini telah dikonversi ke mg per 100 gram daun untuk memudahkan.
2.1.4 Kegunaan
Daun kelor dapat bermanfaat sebagai antibakteri, infeksi, infeksi saluran
kemih, virus Ebstein Barr (EBV), virus herpes simplek (HSV-1), HIV/AIDS,
cacingan, bronkhitis, luka eksternal/tukak, demam, gangguan hati, antitumor,
kanker prostat, radioprotektif, antianemia, antihipertensi, diabetes, diuretik,
hipokolestemia, tiroid, hepatorenal, radang usus besar, diare, disentri, gastritis,
rematik, sakit kepala, antioksidan, defisiensi karotenoid, zat besi, protein,
vitamin/mineral, laktasi, antiseptik, dan tonik (Tejas et al., 2012).
2.1.5 Pemanfaatan Kelor
Di Indonesia, khususnya di kampung atau pedesaaan, pohon kelor banyak
ditanam sebagai pagar hidup, berfungsi selain sebagai tanaman penghijau juga
sebagai tanda batas tanah atau ladang kepemilikan seseorang. Selama ini, daun
kelor muda banyak dimanfaatkan sebagai bahan sayuran oleh sebagian besar
penduduk kampung atau desa (Simbolon et al., 2008).
Selain itu, tanaman kelor juga dikenal luas di lingkungan pedesaan sebagai
tanaman obat berkhasiat; dengan memanfaatkan seluruh bagian tanaman ini,
mulai dari daun, kulit batang, biji hingga akarnya. Akar kelor dicampur dengan
kulit akar pepaya digiling dan dihancurkan; campuran ini banyak digunakan
sebagai obat luar (balur) untuk penyakit beri-beri dan sejenisnya. Daunnya
ditambah dengan kapur sirih, merupakan obat kulit seperti kurap, yang digunakan
dengan cara digosokkan. Sementara sebagai obat oral (diminum), rebusan akar
dan daun kelor ampuh sebagai obat rematik, epilepsi (ayan), skorbut (kekurangan
vitamin C), gangguan atau infeksi saluran kemih (melancarkan buang air kecil),
kulit jeruk dan buah pala, akan dapat dicampur sebagai “spiritus moringae
compositus” yang digunakan sebagai stimulans (obat perangsang), stomachikum (obat sakit perut), hingga diuretikum (Simbolon et al., 2008).
2.2 Mineral
Mineral merupakan salah satu unsur yang memegang peranan penting
dalam pemeliharaan fungsi tubuh baik pada tingkat sel, jaringan, organ, maupun
fungsi tubuh secara keseluruhan. Mineral digolongkan ke dalam mineral makro
dan mineral mikro. Mineral makro adalah unsur yang dibutuhkan tubuh dalam
jumlah lebih dari 100 mg/hari, sedangkan mineral mikro adalah unsur yang
dibutuhkan kurang dari 100 mg/hari. Yang termasuk mineral makro adalah
natrium, kalium, kalsium, fosfor, dan magnesium, sedangkan yang termasuk
mineral mikro, seperti besi (Almatsier, 2004).
2.2.1 Kalsium
Tubuh kita mengandung lebih banyak kalsium daripada mineral lain.
Diperkirakan 2% berat badan orang dewasa atau sekitar 1,0-1,4 kg terdiri dari
kalsium. Meskipun pada bayi kalsium hanya sedikit (25-30 g), setelah usia 20
tahun secara normal akan terjadi penempatan sekitar 1.200 g kalsium dalam
tubuhnya. Sebagian besar terkonsentrasi dalam tulang rawan dan gigi, sisanya
terdapat dalam cairan tubuh dan jaringan lunak (Winarno, 1992). Peningkatan
kebutuhan akan kalsium terjadi pada masa pertumbuhan, kehamilan, dan
menyusui. Jumlah kalsium yang dianjurkan per hari untuk anak-anak adalah
300-400 mg, remaja 600-700 mg, dewasa 500-800 mg, dan ibu hamil dan menyusui
Peranan kalsium dalam tubuh pada umumnya dapat dibagi dua, yaitu
membantu membentuk tulang dan gigi serta mengukur proses biologis dalam
tubuh. Kalsium yang berada dalam sirkulasi darah dan jaringan tubuh berperan
dalam berbagai kegiatan, di antaranya untuk transmisi impuls syaraf, kontraksi
otot, penggumpalan darah, pengaturan permeabilitas membran sel, serta keaktifan
enzim (Winarno, 1992).
2.2.2 Kalium
Kalium merupakan salah satu mineral makro yang berperan dalam
pengaturan keseimbangan cairan tubuh. Sebanyak 95% kalium berada di dalam
cairan intraseluler. Kalium merupakan bagian essensial semua sel hidup, sehingga
banyak terdapat daam bahan makanan. Kekurangan kalium karena makanan
jarang terjadi, sepanjang seseorang cukup makan sayuran dan buah segar
(Almatsier, 2004).
Kalium penting bagi sistem saraf, kontraksi otot, ikut dalam pelepasan
insulin, dan dapat menurunkan tekanan darah tinggi. Anjuran konsumsi kalsium
adalah 2000 mg/hari. Kekurangan kalium dapat menyebabkan lemah otot,
kembung, dan detak jantung tidak normal (Murdiati dan Amaliah, 2013).
2.2.3 Magnesium
Hampir 60% magnesium dalam tubuh terdapat pada tulang, 26% dalam
otot, dan sisanya ada dalam jaringan lunak serta cairan tubuh. Magnesium
memegang peranan penting dalam lebih dari tiga ratus sistem enzim di dalam
tubuh (Almatsier, 2004). Tubuh manusia mengandung kurang lebih 25 g
magnesium, 50-60% daripadanya dalam kerangka, sedangkan sisanya terdapat
Magnesium mengaktivasi banyak sistem enzim (misalnya alkali fosfatase,
leusin aminopeptidase) dan merupakan kofaktor yang penting pada fosforilasi
oksidatif, pengaturan suhu tubuh, kontraktilitas otot, dan kepekaan saraf (Dewoto,
2011). Di samping itu, magnesium berperanan penting pada metabolisme kalsium
dan juga diperlukan untuk sintesa protein yang terdapat dalam tulang. Penting
pula bagi absorpsi kalsium dan kalium. Kebutuhan seharinya diperkirakan
450-500 mg (WHO), yag diperoleh dari makanan (Tan dan Rahardja, 2008).
2.3 Spektrofotometri Serapan Atom
Metode Spektroskopi Serapan Atom (SSA) mendasarkan pada prinsip
absorpsi cahaya oleh atom. Atom-atom akan menyerap cahaya pada panjang
gelombang tertentu, tergantung pada sifat unsurnya. Cahaya pada panjang
gelombang ini mempunyai cukup energi untuk mengubah tingkat elektronik suatu
atom yang mana transisi elektronik suatu atom bersifat spesifik. Dengan
menyerap suatu energi, maka atom akan memperoleh energi sehingga suatu atom
pada keadaaan dasar dapat ditingkatkan energinya ke tingkat eksitasi (Gandjar dan
Rohman, 2007).
Spektroskopi serapan atom digunakan untuk analisis kuantitatif
unsur-unsur logam dalam jumlah sekelumit (trace) dan sangat kelumit (ultratrace). Cara analisis ini memberikan kadar total unsur logam dalam suatu sampel dan tidak
tergantung pada bentuk molekul dari logam dalam sampel tersebut. Cara ini cocok
untuk analisis kelumit logam karena mempunyai kepekaan yang tinggi (batas
deteksi kurang dari 1 ppm), pelaksanaannya relatif sederhana, dan interferensinya
sedikit. Spektroskopi serapan atom didasarkan pada penyerapan energi sinar oleh
Dalam garis besarnya prinsip spektroskopi serapan atom sama saja dengan
spektrofotometri sinar tampak dan ultraviolet. Perbedaannya terletak pada bentuk
spektrum, cara pengerjaan sampel, dan peralatannya (Gandjar dan Rohman,
2007).
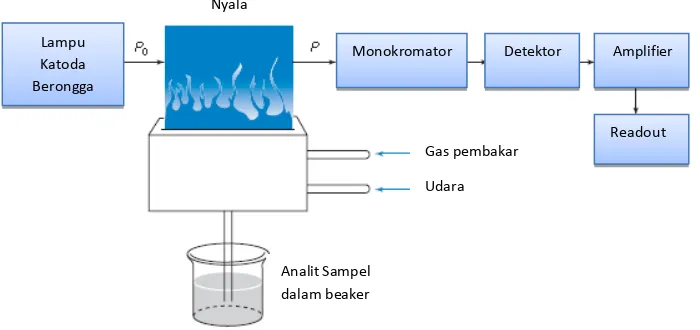
Menurut Harris (2007), sistem peralatan spektrofotometer serapan atom
[image:30.595.130.480.257.422.2]dapat dilihat pada gambar berikut ini :
Gambar 2.1 Komponen Spektrofotometer Serapan Atom
1. Sumber sinar
Sumber sinar yang lazim dipakai adalah lampu katoda berongga (hollow cathode lamp). Lampu ini terdiri atas tabung kaca tertutup yang mengandung suatu katoda dan anoda. Katoda sendiri berbentuk silinder berongga yang terbuat
dari logam atau dilapisi dengan logam tertentu (Gandjar dan Rohman, 2007).
2. Tempat sampel
Dalam analisis dengan spektrofotometri serapan atom, sampel yang akan
dianalisis harus diuraikan menjadi atom-atom netral yang masih dalam keadaan
asas. Ada berbagai macam alat yang dapat digunakan untuk mengubah suatu Lampu
Katoda Berongga
Nyala
Monokromator Detektor Amplifier
Readout
Analit Sampel dalam beaker
Gas pembakar
sampel menjadi uap atom-atom yaitu : dengan nyala (flame) dan dengan tanpa nyala (flameless) (Gandjar dan Rohman, 2007).
a. Nyala (Flame)
Nyala digunakan untuk mengubah sampel yang berupa padatan atau cairan
menjadi bentuk uap atomnya, dan juga berfungsi untuk atomisasi. Pada cara
spektrofotometri emisi atom, nyala ini berfungsi untuk mengeksitasikan atom dari
tingkat dasar ke tingkat yang lebih tinggi (Gandjar dan Rohman, 2007).
Suhu yang dapat dicapai oleh nyala tergantung pada gas-gas yang
digunakan, misalkan untuk gas batubara-udara, suhunya kira-kira sebesar 1800oC;
gas alam-udara 1700oC; asetilen-udara 2200oC; dan gas asetilen-dinitrogen oksida
(N2O) sebesar 3000oC. Sumber nyala yang paling banyak digunakan adalah
campuran asetilen sebagai bahan pembakar dan udara sebagai pengoksidasi
(Gandjar dan Rohman, 2007).
b. Tanpa nyala (Flameless)
Pengatoman dapat dilakukan dalam tungku dari grafit seperti tungku yang
dikembangkan oleh Masmann. Sejumlah sampel diambil sedikit (untuk sampel
cair diambil hanya beberapa µL, sementara sampel padat diambil beberapa mg),
lalu diletakkan dalam tabung grafit, kemudian tabung tersebut dipanaskan dengan
sistem elektris dengan cara melewatkan arus listrik pada grafit. Akibat pemanasan
ini, maka zat yang akan dianalisis berubah menjadi atom-atom netral dan pada
fraksi atom ini dilewatkan suatu sinar yang berasal dari lampu katoda berongga
sehingga terjadilah proses penyerapan energi sinar yang memenuhi kaidah analisis
Sistem pemanasan dengan tanpa nyala ini dapat melalui 3 tahap yaitu :
pengeringan (drying) yang membutuhkan suhu yang relatif rendah; pengabuan (ashing) yang membutuhkan suhu yang lebih tinggi karena untuk menghilangkan matriks kimia dengan mekanisme volatilasi atau pirolisis; dan pengatoman
(atomising) (Gandjar dan Rohman, 2007).
3. Monokromator
Pada SSA, monokromator dimaksudkan untuk memisahkan dan memilih
panjang gelombang yang digunakan dalam analisis. Di samping sistem optik,
dalam monokromator juga terdapat suatu alat yang digunakan untuk memisahkan
radiasi resonansi dan kontinyu yang disebut dengan chopper (Gandjar dan Rohman, 2007).
4. Detektor
Detektor digunakan untuk mengukur intensitas cahaya yang melalui
tempat pengatoman. Biasanya digunakan tabung penggandaan foton
(photomultiplier tube). Ada 2 cara yang dapat digunakan dalam sistem deteksi yaitu : (a) yang memberikan respon terhadap radiasi resonansi dan radiasi
kontinyu; dan (b) yang hanya memberikan respon terhadap radiasi resonansi
(Gandjar dan Rohman, 2007).
5. Readout
Readout merupakan suatu alat penunjuk atau dapat juga diartikan sebagai sistem pencatatan hasil. Pencatatan hasil dilakukan dengan suatu alat yang telah
dapat berupa angka atau berupa kurva dari suatu recorder yang menggambarkan absorbansi atau intensitas emisi (Gandjar dan Rohman, 2007).
Gangguan-gangguan yang dapat terjadi dalam SSA adalah sebagai berikut:
1. Gangguan yang berasal dari matriks sampel yang mana dapat mempengaruhi
banyaknya sampel yang mencapai nyala (Gandjar dan Rohman, 2007).
Sifat-sifat tertentu matriks sampel dapat mengganggu analisis yakni
matriks tersebut dapat berpengaruh terhadap laju aliran bahan bakar/gas
pengoksidasi. Sifat-sifat tersebut adalah : viskositas, tegangan permukaan, berat
jenis, dan tekanan uap (Gandjar dan Rohman, 2007).
2. Gangguan kimia yang dapat mempengaruhi jumlah/banyaknya atom yang
terjadi di dalam nyala (Gandjar dan Rohman, 2007).
Terbentuknya atom-atom netral yang masih dalam keadaan azas di dalam
nyala sering terganggu oleh dua peristiwa kimia yaitu :
a. Disosiasi senyawa-senyawa yang tidak sempurna disebabkan terbentuknya
senyawa-senyawa yang bersifat refraktorik (sukar diuraikan di dalam nyala
api) (Gandjar dan Rohman, 2007).
b. Ionisasi atom-atom di dalam nyala dapat terjadi jika suhu yang digunakan
untuk atomisasi terlalu tinggi. Prinsip analisis dengan SSA adalah mengukur
absorbansi atom-atom netral yang berada dalam keadaan azas. Jika terbentuk
ion maka akan mengganggu pengukuran absorbansi atom netral karena
spektrum absorbansi atom-atom yang mengalami ionisasi tidak sama dengan
3. Gangguan oleh absorbansi yang disebabkan bukan oleh absorbansi atom yang
dianalisis; yakni absorbansi molekul-molekul yang tidak terdisosiasi di dalam
nyala (Gandjar dan Rohman, 2007).
4. Gangguan oleh penyerapan non-atomik (non-atomic absorption)
Penyerapan non-atomik dapat disebabkan adanya penyerapan cahaya oleh
partikel-partikel padat yang berada di dalam nyala (Gandjar dan Rohman, 2007).
2.4 Validasi Metode Analisis
Validasi metode analisis adalah suatu tindakan penilaian terhadap
parameter tertentu berdasarkan percobaan laboratorium untuk membuktikan
bahwa parameter tersebut memenuhi persyaratan untuk penggunaannya (Harmita,
2004). Beberapa parameter analisis yang harus dipertimbangkan dalam validasi
metode analisis adalah sebagai berikut :
a. Kecermatan
Kecermatan adalah ukuran yang menunjukkan derajat kedekatan hasil
analisis dengan kadar analit yang sebenarnya. Kecermatan dinyatakan sebagai
persen perolehan kembali (recovery) analit yang ditambahkan (Harmita, 2004). Kecermatan ditentukan dengan dua cara, yaitu :
- Metode simulasi
Metode simulasi (Spiked-placebo recovery) merupakan metode yang dilakukan dengan cara menambahkan sejumlah analit bahan murni ke dalam suatu
bahan pembawa sediaan farmasi (plasebo), lalu campuran tersebut dianalisis dan
hasilnya dibandingkan dengan kadar analit yang ditambahkan (kadar yang
- Metode penambahan baku
Metode penambahan baku (standard addition method) merupakan metode yang dilakukan dengan cara menambahkan sejumlah baku dengan konsentrasi
tertentu pada sampel yang diperiksa, lalu dianalisis dengan metode yang akan
divalidasi. Hasilnya dibandingkan dengan sampel yang dianalisis tanpa
penambahan sejumlah baku. Persen perolehan kembali ditentukan dengan
menentukan berapa persen baku yang ditambahkan ke dalam sampel dapat
ditemukan kembali (Harmita, 2004). Menurut Ermer dan Miller (2005), suatu
metode dikatakan teliti jika nilai recoverynya antara 80-120%. Recovery dapat ditentukan dengan menggunakan metode standar adisi.
b. Keseksamaan (presisi)
Keseksamaan atau presisi diukur sebagai simpangan baku relatif atau
koefisien variasi. Keseksamaan atau presisi merupakan ukuran yang menunjukkan
derajat kesesuaian antara hasil uji individual ketika suatu metode dilakukan secara
berulang untuk sampel yang homogen. Nilai simpangan baku relatif yang
memenuhi persyaratan menunjukkan adanya keseksamaan metode yang
dilakukan. Nilai simpangan baku relatif dikatakan memenuhi kriteria seksama dan
teliti jika RSDnya tidak lebih dari 2% (Harmita, 2004).
c. Selektivitas (Spesifisitas)
Selektivitas atau spesifisitas suatu metode adalah kemampuannya yang
hanya mengukur zat tertentu secara cermat dan seksama dengan adanya kmponen
d. Linearitas dan rentang
Linearitas adalah kemampuan metode analisis yang memberikan respon
baik secara langsung maupun dengan bantuan transformasi matematika,
menghasilkan suatu hubungan yang proporsional terhadap konsentrasi analit
dalam sampel. Rentang merupakan batas terendah dan batas tertinggi analit yang
dapat ditetapkan secara cermat, seksama, dan dalam linearitas yang dapat diterima
(Harmita, 2004).
e. Batas deteksi dan batas kuantitasi
Batas deteksi merupakan jumlah terkecil analit dalam sampel yang dapat
dideteksi yang masih memberikan respon signifikan, sedangkan batas kuantitasi
merupakan kuantitas terkecil analit dalam sampel yang masih dapat memenuhi
kriteria cermat dan seksama (Harmita, 2004).
f. Ketangguhan metode (ruggedness)
Ketangguhan metode adalah derajat ketertiruan hasil uji yang diperoleh
dari analisis sampel yang sama dalam berbagai kondisi uji normal, seperti
laboratorium, analisis, instrumen, bahan pereaksi, suhu, hari yang berbeda, dll.
Ketangguhan metode ditentukandengan menganalisis beningan suatu lot sampel
yang homogen dalam lab yang berbeda oleh analis yang berbeda menggunakan
kondisi operasi yang berbeda, dan lingkungan yang berbeda tetapi menggunakan
prosedur dan parameter uji yang sama (Harmita, 2004).
g. Kekuatan (Robustness)
Untuk memvalidasi kekuatan suatu metode perlu dibuat
perubahanmetodologi yang kecil dan terus menerus dan mengevaluasi respon
BAB III
METODE PENELITIAN
3.1.Tempat dan Waktu Penelitian
Penelitian dilakukan di Laboratorium Kimia Farmasi Kualitatif dan
Laboratorium Penelitian Fakultas Farmasi Universitas Sumatera Utara. Penelitian
dilakukan pada bulan Oktober 2014 – Desember 2014.
3.2. Jenis Penelitian
Jenis penelitian yang dilakukan adalah penelitian deskriptif yang bertujuan
menggambarkan sifat dari suatu keadaan secara sistematis, yaitu untuk memeriksa
kandungan mineral kalium, kalsium, dan magnesium pada daun kelor (Moringa oleifera Lam.) segar dan yang direbus.
3.3. Alat
Alat-alat yang digunakan adalah spektrofotometer serapan atom (Hitachi
Z-2000) dengan tipe nyala udara-asetilen, alat tanur, hot plate, neraca analitik,
kertas saring Whatman no. 42, krus porselen, dan alat-alat gelas.
3.4. Bahan
Bahan-bahan yang digunakan berkualitas pro analisis keluaran E.Merck
yaitu asam nitrat 65% b/v, asam pikrat, asam sulfat 96% v/v, etanol 96%, natrium
hidroksida, kuning titan, larutan standar kalium 1000 µg/ml, larutan standar
kalsium 1000 µg/ml, larutan standar magnesium 1000 µg/ml kecuali akuabides
3.5.Metode Pengambilan Sampel
Pengambilan sampel daun kelor dilakukan secara purposif yaitu tanpa
membandingkan dengan daun kelor yang sama dari daerah yang lain. Sampel
yang digunakan adalah daun kelor (Moringa oleifera Lam.) tepatnya bagian helai daun yang berasal dari daerah Binjai.
3.6. Identifikasi Sampel
Identifikasi sampel (daun kelor) dilakukan di Pusat Penelitian Biologi LIPI
Bogor.
3.7.Pembuatan Pereaksi
3.7.1 Larutan HNO3 (1:1)
Larutan HNO3 65% b/v sebanyak 500 ml diencerkan dengan 500 ml air
suling (Isaac, 1990).
3.7.2 Asam Pikrat 1% b/v
Sebanyak 1 gram asam pikrat dilarutkan dalam air suling hingga 100 ml
(Manan, 2009).
3.7.3 Larutan H2SO4 1 N
Sebanyak 3 ml larutan H2SO4 96% v/v diencerkan dengan akuades hingga
100 ml (Ditjen POM, 1979).
3.7.4 Kuning Titan 0,1% b/v
Larutan kuning titan 0,1% b/v dibuat dengan cara melarutkan 0,1 g titan
3.7.5 Larutan NaOH 2 N
Sebanyak 80,02 gram NaOH dilarutkan dengan air suling hingga 1000 ml
(Ditjen POM, 1979).
3.8. Penyiapan Sampel
Sebanyak 1 kg daun kelor (Moringa oleifera Lam.) yang segar dicuci bersih, ditiriskan, dikeringkan dengan cara diangin-anginkan. Daun kelor
kemudian dibagi menjadi 2 bagian, masing-masing 500 gram, bagian pertama
dihaluskan dengan cara dipotong kecil-kecil dan bagian kedua direbus di dalam
panci yang berisi akuademineralisata sebanyak 750 ml pada suhu 100oC selama ±
6 menit lalu ditiriskan dan dihaluskan dengan cara dipotong kecil-kecil.
3.9. Proses Destruksi
Sampel ditimbang seksama sebanyak 10 gram dalam krus porselen,
diarangkan di atas hotplate, lalu diabukan dalam tanur dengan temperatur awal
100°C dan perlahan-lahan temperatur dinaikkan hingga suhu 500°C dengan
interval 25oC setiap 5 menit. Pengabuan dilakukan selama 60 jam untuk daun
kelor segar, 36 jam untuk daun kelor rebus dan dibiarkan hingga dingin pada
desikator (prosedur modifikasi) (Isaac, 1990).
3.10. Pembuatan Larutan Sampel
Sampel hasil destruksi dilarutkan dalam 10 ml HNO3 (1:1), lalu
dituangkan ke dalam labu tentukur 50 ml dan diencerkan dengan
akuademineralisata hingga garis tanda (Isaac, 1990). Kemudian disaring dengan
menjenuhkan kertas saring kemudian filtrat selanjutnya ditampung ke dalam
botol. Larutan ini digunakan untuk analisis kualitatif dan kuantitatif.
3.11 Pemeriksaan Kualitatif
3.11.1 Kalsium
3.11.1.1 Uji nyala Ni/Cr
Kawat Ni/Cr dibersihkan dengan HCl pekat lalu dipijar pada api bunsen
sampai tidak memberikan warna khusus pada nyala bunsen. Kemudian kawat
dicelupkan pada sampel lalu dipijar pada api bunsen, amati warna yang terjadi.
Jika terdapat kalsium, akan terbentuk warna merah-kekuningan pada nyala bunsen
(Vogel, 1979).
3.11.1.2 Uji Kristal Kalsium dengan Asam Sulfat 1 N
Larutan zat diteteskan 1-2 tetes pada object glass kemudian ditetesi dengan larutan asam sulfat dan etanol 96% akan terbentuk endapan putih lalu
diamati di bawah mikroskop. Jika terdapat kalsium akan terlihat kristal berbentuk
jarum (Vogel, 1979).
3.11.2 Kalium
3.11.2.1 Uji nyala Ni/Cr
Kawat Ni/Cr dibersihkan dengan HCl pekat lalu dipijar pada api bunsen
sampai tidak memberikan warna khusus pada nyala bunsen. Kemudian kawat
dicelupkan pada sampel lalu dipijar pada api bunsen, amati warna yang terjadi.
Jika terdapat kalium, akan terbentuk warna lembayung (lila) pada nyala bunsen
3.11.2.2 Uji Kristal Kalium dengan Asam Pikrat
Larutan zat diteteskan 1-2 tetes pada object glass kemudian ditetesi dengan larutan asam pikrat, dibiarkan ± 5 menit lalu diamati di bawah mikroskop.
Jika terdapat kalium akan terlihat kristal berbentuk jarum besar (Vogel, 1979).
3.11.3 Magnesium
3.11.3.1 Reaksi Kualitatif dengan Larutan Kuning Titan 0,1% b/v
Ke dalam tabung reaksi dimasukkan 2 ml larutan sampel, ditambah 5 -6
tetes NaOH 2 N dan 3 tetes pereaksi kuning titan. Dihasilkan endapan merah
terang (Vogel, 1979).
3.12Pemeriksaan Kuantitatif
3.12.1 Pembuatan Kurva Kalibrasi Kalsium
Larutan baku kalsium (1000 µg/ml) dipipet sebanyak 5 ml, dimasukkan ke
dalam labu tentukur 100 ml dan dicukupkan hingga garis tanda dengan
akuademineralisata (konsentrasi 50 µg/ml).
Larutan untuk kurva kalibrasi kalsium dibuat dengan memipet 1, 2, 3, 4,
dan 5 ml larutan baku 50 µg/ml, masing-masing dimasukkan ke dalam labu
tentukur 50 ml dan dicukupkan hingga garis tanda dengan akuademineralisata
(larutan ini mengandung 1,0 µg/ml; 2,0 µ g/ml; 3,0 µ g/ml; 4,0 µ g/ml dan 5,0
µg/ml) dan diukur pada panjang gelombang 422,7 nm.
3.12.2 Pembuatan Kurva Kalibrasi Kalium
Larutan baku kalium (1000 µg/ml) dipipet sebanyak 5 ml, dimasukkan ke
dalam labu tentukur 100 ml dan dicukupkan hingga garis tanda dengan
Larutan untuk kurva kalibrasi kalium dibuat dengan memipet 1, 2, 3, 4,
dan 5 ml larutan baku 50 µg/ml, masing-masing dimasukkan ke dalam labu
tentukur 50 ml dan dicukupkan hingga garis tanda dengan akuademineralisata
(larutan ini mengandung 1,0 µg/ml; 2,0 µ g/ml; 3,0 µ g/ml; 4,0 µ g/ml dan 5,0
µg/ml) dan diukur pada panjang gelombang 766,5 nm.
3.12.3 Pembuatan Kurva Kalibrasi Magnesium
Larutan baku magnesium (1000 µg/ml) dipipet sebanyak 1 ml,
dimasukkan ke dalam labu tentukur 100 ml dan dicukupkan hingga garis tanda
dengan akuademineralisata (konsentrasi 10 µ g/ml).
Larutan untuk kurva kalibrasi magnesium dibuat dengan memipet 1, 2, 3,
4, dan 5 ml larutan baku 10 µg/ml, masing-masing dimasukkan ke dalam labu
tentukur 50 ml dan dicukupkan hingga garis tanda dengan akuademineralisata
(larutan ini mengandung 0,2 µg/ml; 0,4 µ g/ml; 0,6 µ g/ml; 0,8 µ g/ml dan 1,0
µg/ml) dan diukur pada panjang gelombang 285,2 nm.
3.13 Penetapan Kadar Kalsium, Kalium, dan Magnesium dalam Sampel
3.13.1 Penetapan Kadar Kalsium
Larutan sampel hasil destruksi dipipet sebanyak 0,1 ml untuk daun kelor
segar dan 0,1 ml untuk daun kelor rebus, dimasukkan ke dalam labu tentukur 50
ml dan dicukupkan hingga garis tanda dengan akuademineralisata. Kemudian
diukur absorbansinya dengan menggunakan spektrofotometer serapan atom pada
panjang gelombang 422,7 nm. Nilai absorbansi yang diperoleh harus berada
dalam rentang kurva kalibrasi larutan baku kalsium. Konsentrasi kalsium dalam
3.13.2 Penetapan Kadar Kalium
Larutan sampel hasil destruksi dipipet sebanyak 0,1 ml untuk daun kelor
segar dan 0,5 ml untuk daun kelor rebus, dimasukkan ke dalam labu tentukur 50
ml dan dicukupkan hingga garis tanda dengan akuademineralisata. Kemudian
diukur absorbansinya dengan menggunakan spektrofotometer serapan atom pada
panjang gelombang 766,5 nm. Nilai absorbansi yang diperoleh harus berada
dalam rentang kurva kalibrasi larutan baku kalium. Konsentrasi kalium dalam
sampel ditentukan berdasarkan persamaan garis regresi dari kurva kalibrasi.
3.13.3 Penetapan Kadar Magnesium
Larutan sampel hasil destruksi dipipet sebanyak 0,1 mluntuk daun kelor
segar dan 0,2 ml untuk daun kelor rebus, dimasukkan ke dalam labu tentukur 50
ml dan dicukupkan hingga garis tanda dengan akuademineralisata. Kemudian
diukur absorbansinya dengan menggunakan spektrofotometer serapan atom pada
panjang gelombang 285,2 nm. Nilai absorbansi yang diperoleh harus berada
dalam rentang kurva kalibrasi larutan baku magnesium. Konsentrasi magnesium
dalam sampel ditentukan berdasarkan persamaan garis regresi dari kurva kalibrasi.
Kadar kalsium, kalium, dan magnesium dalam sampel dapat dihitung
dengan cara sebagai berikut :
Kadar (µ g/g) = K µ / V F
B
3.14 Validasi
3.14.1 Simpangan Baku Relatif
Keseksamaan atau presisi diukur sebagai simpangan baku relatif atau
derajat kesesuaian antara hasil uji individual ketika suatu metode dilakukan secara
berulang untuk sampel yang beragam. Nilai simpangan baku relatif yang
memenuhi persyaratan menunjukkan adanya keseksamaan metode yang
dilakukan.
Menurut Harmita (2004), rumus untuk menghitung simpangan baku relatif
adalah:
RSD = SD
X x 100%
Keterangan : X̅ = Kadar rata-rata sampel SD = Standar Deviasi
RSD = Relative Standard Deviation (Simpangan Baku Relatif)
3.14.2 Uji Perolehan Kembali (Recovery)
Uji perolehan kembali atau recovery dilakukan dengan metode penambahan larutan baku (standard addition method). Dalam metode ini, kadar logam dalam sampel ditentukan terlebih dahulu, selanjutnya dilakukan penentuan
kadar logam dalam sampel setelah penambahan larutan baku dengan konsentrasi
tertentu (Ermer dan McB. Miller, 2005).
Daun kelor yang telah dihaluskan ditimbang secara seksama sebanyak 10
gram, lalu ditambahkan 8 ml larutan baku kalsium (konsentrasi 1000 µg/ml), 12
ml larutan baku kalium (konsentrasi 1000 µg/ml), dan 5 ml larutan baku
magnesium (konsentrasi 1000 µg/ml), kemudian dilanjutkan dengan prosedur
destruksi kering seperti yang telah dilakukan sebelumnya. Prosedur pengukuran
uji perolehan kembali dilakukan sama dengan prosedur penetapan kadar sampel.
Menurut Harmita (2004), persen perolehan kembali dapat dihitung dengan
Persen Perolehan Kembali = CF- CA
C*
A ×100%
Keterangan : CA= Kadar logam dalam sampel sebelum penambahan baku
(mg/100g)
CF= Kadar logam dalam sampel setelah penambahan baku
(mg/100g)
C*
A= Kadar larutan baku yang ditambahkan (mg/100g)
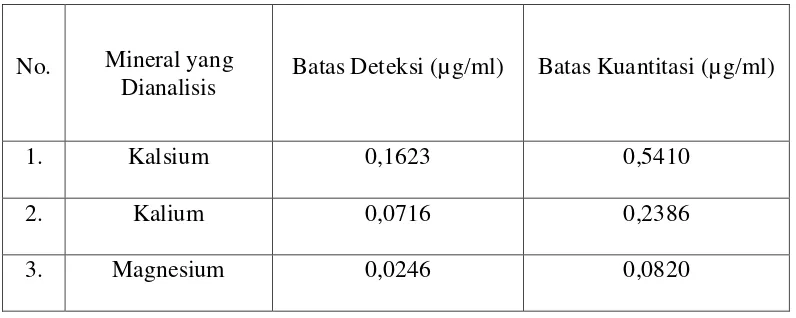
3.14.3 Penentuan Batas Deteksi (Limit of Detection) dan Batas Kuantitasi (Limit of Quantitation)
Batas deteksi merupakan jumlah terkecil analit dalam sampel yang dapat
dideteksi yang masih memberikan respon signifikan. Sedangkan batas kuantitasi
merupakan kuantitas terkecil analit dalam sampel yang masih dapat memenuhi
kriteria cermat dan seksama.
Menurut Harmita (2004), batas deteksi dan batas kuantitasi ini dapat
dihitung dengan rumus sebagai berikut:
Simpangan Baku (� ⁄ = √∑ − � −
Batas deteksi (LOD) = �� ⁄ �� �
3.15 Analisis Data Secara Statistik
3.15.1 Penolakan Hasil Pengamatan
Menurut Sudjana (2005), kadar kalsium, kalium, dan magnesium yang
diperoleh dari hasil pengukuran masing-masing larutan sampel dianalisis dengan
metode standar deviasi dengan rumus:
SD = √∑ X −X̅ −
Keterangan : Xi = Kadar sampel
X̅ = Kadar rata-rata sampel
n = Jumlah perulangan
Untuk mencari thitung digunakan rumus :
thitung = SD/√X−X̅
dan untuk menentukan kadar logam di dalam sampel dengan interval kepercayaan
99%, � = 0.05, dk = n-1, dapat digunakan rumus : Kadar logam : � = X̅ ± (t(�/2, dk) x SD/√n
Keterangan : X̅ = Kadar rata-rata sampel SD = Standar Deviasi
dk = Derajat kebebasan (dk = n-1)
� = interval kepercayaan n = jumlah perulangan
3.15.2 Pengujian Beda Nilai Rata-rata Antar Sampel
Menurut Sudjana (2005), sampel yang dibandingkan adalah independen
diketahui sehingga dilakukan uji F untuk mengetahui apakah varians kedua
populasi sama (σ1=σ2) atau berbeda (σ1≠σ2) dengan rumus :
F0 = � �
Keterangan : F0 = Beda nilai yang dihitung
S1 = Standar Deviasi sampel 1
S2 = Standar Deviasi sampel 2
Apabila dari hasilnya diperoleh F0 tidak melewati nilai kritis F maka dilanjutkan
uji dengan distribusi t dengan rumus :
t0 = − � √� +�
SP=
√
− � + − �
+ −
Keterangan : X1 = kadar rata-rata sampel 1
X2 = kadar rata-rata sampel 2
Sp = simpangan baku
n1 = jumlah perlakuan sampel 1
n2 = jumlah perlakuan sampel 2
S1 = Standar Deviasi sampel 1
S2 = Standar Deviasi sampel 2
Kedua sampel dinyatakan berbeda apabila t0yang diperoleh melewati nilai kritis t,
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Identifikasi Tumbuhan
Identifikasi tumbuhan dilakukan oleh Herbarium Bogoriense, Bidang
Botani, Pusat Penelitian dan Pengembangan Biologi, Lembaga Ilmu Pengetahuan
Indonesia (LIPI), Bogor. Disebutkan bahwa tumbuhan yang digunakan adalah
daun kelor (Moringa oleifera Lam.) suku Moringaceae. Hasil identifikasi tumbuhan dapat dilihat pada Lampiran 1, halaman 42.
4.2 Analisis Kualitatif
Analisis kualitatif dilakukan sebagai analisis pendahuluan untuk
mengetahui ada atau tidaknya kalsium, kalium, dan magnesium dalam sampel.
Data dapat dilihat pada Tabel 4.1 dan Lampiran 7, halaman 50-51.
Tabel 4.1 Hasil Analisis Kualitatif
No. Mineral yang
dianalisis Perlakuan Hasil Reaksi Keterangan
1. Kalsium Uji nyala Merah bata +
Asam Sulfat 1 N Kristal jarum +
2. Kalium
Uji nyala Lembayung +
Asam Pikrat Kristal jarum
besar +
3. Magnesium Larutan Kuning
Titan 0,1% b/v
Endapan
merah terang +
Keterangan :
Dari tabel di atas menunjukkan bahwa larutan sampel yang diperiksa
mengandung kalsium, kalium, dan magnesium. Sampel dikatakan positif
mengandung kalsium apabila menghasilkan nyala merah bata ketika dilakukan uji
nyala dengan kawat Ni/Cr dan kristal jarum dengan penambahan asam sulfat 1 N,
mengandung kalium apabila menghasilkan nyala lembayung dengan kawat Ni/Cr
dan kristal jarum besar dengan penambahan asam pikrat, serta mengandung
magnesium apabila menghasilkan endapan merah terang dengan penambahan
larutan kuning titan 0,1% b/v. Berdasarkan hasil reaksi dari masing-masing
mineral tersebut membuktikan bahwa larutan sampel mengandung kalsium,
kalium, dan magnesium.
4.3 Analisis Kuantitatif
4.3.1 Kurva Kalibrasi Kalsium, Kalium, dan Magnesium
Kurva kalibrasi kalsium, kalium dan magnesium diperoleh dengan cara
mengukur absorbansi dari larutan standar pada panjang gelombang
masing-masing.
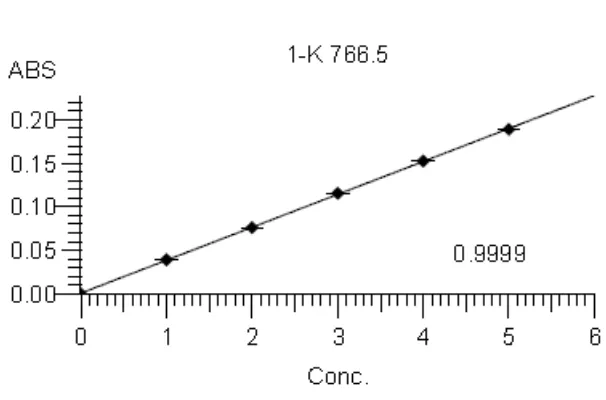
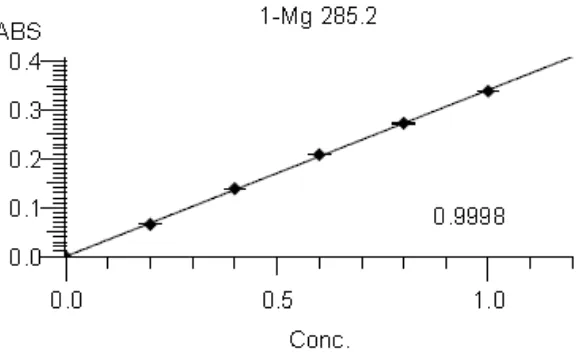
Dari pengukuran kurva kalibrasi diperoleh persamaan garis regresi yaitu
Y= 0,0241X - 0,0015 untuk kalsium, Y= 0,0379X + 0,0005 untuk kalium, Y=
0,3402X + 0,0002 untuk magnesium.
Kurva kalibrasi larutan standar kalsium, kalium, dan magnesium dapat
Gambar 4.1 Kurva Kalibrasi Seri (1,0; 2,0; 3,0; 4,0; 5,0 µ g/ml) LarutanStandar Kalsium
[image:50.595.159.462.391.591.2]Gambar 4.3 Kurva Kalibrasi Seri (0,2; 0,4; 0,6; 0,8; 1,0µg/ml) LarutanStandar Magnesium
Berdasarkan kurva di atas diperoleh hubungan yang linear antara konsentrasi
dengan absorbansi, dengan koefisien korelasi (r) kalsium sebesar 0,9997, kalium
sebesar 0,9999, dan magnesium sebesar 0,9998. Nilai r ≥ 0,97 menunjukkan
adanya korelasi linier yang menyatakan adanya hubungan antara X (Konsentrasi)
dan Y (Absorbansi) (Ermer dan McB. Miller, 2005). Data hasil pengukuran
absorbansi larutan standar kalsium, kalium, dan magnesium dan perhitungan
persamaan garis regresi dapat dilihat pada Lampiran 8-10, halaman 52-57.
4.3.2 Analisis Kadar Kalsium, Kalium, dan Magnesium dalam Sampel
Penentuan kadar kalsium, kalium, dan magnesium dilakukan secara
spektrofotometri serapan atom dimana sampel terlebih dulu didestruksi kering
dengan HNO3 kemudian dilarutkan dan diukur pada spektrofotometri serapan
atom. Konsentrasi mineral kalsium, kalium, dan magnesiumdalam sampel
ditentukan berdasarkan nilai absorbansi yang dimasukkan ke dalam persamaan
garis regresi kurva kalibrasi larutan standar masing-masingmineral. Data dan
Hasil analisis kuantitatif kadar kalsium, kalium, dan magnesium dalam
sampel dapat dilihat pada Tabel 4.2.
Tabel 4.2 Hasil Analisis Kuantitatif Kadar Kalsium, Kalium, dan Magnesium dalam Sampel
No Sampel Kadar Kalsium
(mg/100 g)
Kadar Kalium (mg/100 g)
Kadar Magnesium (mg/100 g)
1. Daun Kelor
Segar 873,4579 ± 2,2950 606,1327 ± 13,9095 117,7626 ± 0,9899
2. Daun Kelor
Rebus 731,3755 ± 3,2586 81,1258 ± 0,5593 35,1865 ± 0,1608
Berdasarkan tabel 4.2 di atas, dapat diketahui bahwa kadar kalsium,
kalium, dan magnesium pada daun kelor yang direbus lebih rendah dibandingkan
pada daun kelor segar di mana terjadi penurunan sebesar 16,27% untuk kalsium,
86,62% untuk kalium, dan 70,12% untuk magnesium. Hal ini dapat disebabkan
kalsium, kalium, dan magnesium membentuk garam-garam dengan oksalat yang
terdapat dalam tumbuhan yang bersifat larut maupun tidak larut. Garam yang larut
dapat terbentuk ketika kalium, natrium, dan magnesium berikatan dengan oksalat
di mana kelarutan magnesium oksalat lebih rendah dibandingkan garam kalium
dan natrium. Sedangkan garam yang tidak larut dihasilkan ketika kalsium dan besi
berikatan dengan oksalat. Dengan adanya pemasakan seperti perebusan dapat
mengurangi kandungan garam oksalat yang sifatnya larut (Poeydomenge dan
Savage, 2007).
Analisis dilanjutkan dengan perhitungan statistik (Perhitungan dapat
dilihat pada Lampiran 14-16,halaman 63-75).
Data yang didapat kemudian digunakan untuk menghitung uji beda nilai
rata-rata kadar kalsium, kalium, dan magnesium antar sampel daun kelor segar
76-81. Hasil uji beda nilai rata-rata kadar kalsium, kalium, dan magnesium antar
[image:53.595.116.513.166.348.2]sampel dapat dilihat pada tabel 4.3.
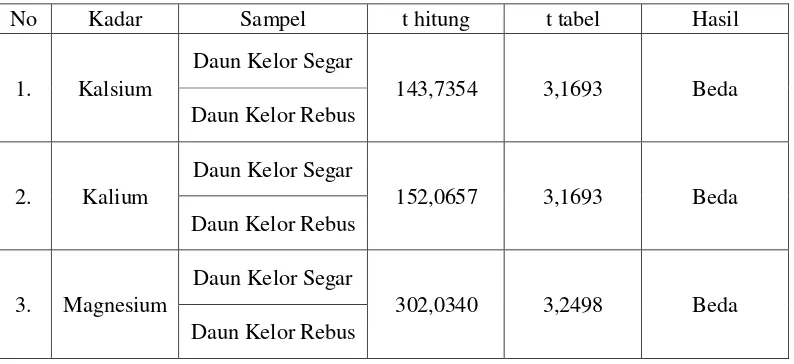
Tabel 4.3 Hasil Uji Beda Nilai Rata-rata Kadar Kalsium, Kalium, dan Magnesium
No Kadar Sampel t hitung t tabel Hasil
1. Kalsium
Daun Kelor Segar
143,7354 3,1693 Beda
Daun Kelor Rebus
2. Kalium
Daun Kelor Segar
152,0657 3,1693 Beda
Daun Kelor Rebus
3. Magnesium
Daun Kelor Segar
302,0340 3,2498 Beda
Daun Kelor Rebus
Berdasarkan pada Tabel 4.3 di atas, dapat dilihat bahwa kadar kalsium,
kalium, dan magnesium yang terdapat dalam daun kelor segar dan direbus
mempunyai perbedaan yang signifikan.
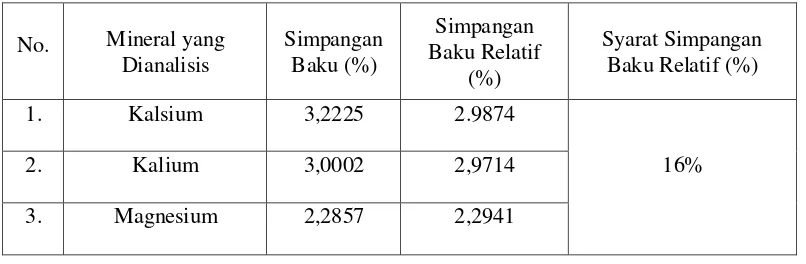
4.3.3 Uji Perolehan Kembali (Recovery)
Hasil uji perolehan kembali (recovery) kadar kalsium, kalium, dan magnesium setelah penambahan masing-masing larutan standar kalsium, kalium,
dan magnesium dalam sampel dapat dilihat pada Lampiran 20-21,halaman
Tabel 4.4 Persen Uji Pe