NURHAIMI. Ekspresi gen-gen responsif terhadap Corynespora cassiicola pada tanaman karet (Hevea brasiliensis Muell. Arg.). HAJRIAL ASWIDINNOOR, MAGGY T. SUHARTONO, ANTONIUS SUWANTO, NURITA TORUAN-MATHIUS, dan AGUS PURWANTARA.
Penyakit gugur daun yang disebabkan cendawan Corynespora cassiicola
merupakan penyakit penting di perkebuana karet. Penelitian bertujuan untuk mendapatkan transkrip/gen/bagian gen yang berperan dalam respon pertahanan tanaman karet terhadap patogen tersebut. Beberapa tahap penelitian dilakukan, yaitu: (1) mengidentifikasi gejala dan menetapkan tingkat resistensi klon karet serta mengidentifikasi kemiripan genetik klon karet untuk penentuan klon resisten dan rentan yang digunakan dalam studi ekspresi gen, (2) mengembangkan metode cDNA-AFLP pada tanaman karet, (3) mengidentifikasi transkrip yang diekspresikan secara diferensial pada klon karet resisten dan rentan selama terjadi interaksi tanaman-patogen melalui metode cDNA-AFLP serta kloning dan sekuensing fragmen asal transkrip , dan (4) konstruksi pustaka cDNA dari daun klon karet resisten. Aplikasi metode cDNA-AFLP dilakukan dengan memberikan tekanan berupa infeksi patogen pada daun untuk menginduksi ekspresi transkrip/gen/bagian gen yang berperan dalam res pon pertahanan. Hasil penelitian menunjukkan gejala bercak mulai terlihat hari kedua setelah daun diinokulasi, baik pada klon resisten maupun rentan. Perkembangan gejala berlanjut pada klon rentan, setelah 12 hari hampir seluruh bagian daun rusak, namun pada klon resisten gejala penyakit tidak berkembang. Klon BPM 1 menunjukkan respon sangat resisten, klon IRR 100, RRIC 100, AVROS 2037, PR 255 adalah resisten dan klon RRIC 103, PPN 2444, IAN 873 adalah sangat rentan. Klon resisten AVROS 2037 dan klon rentan PPN 2444, yang memiliki kemiripan genetik 88,0%, dipilih untuk studi ekspresi gen. Konstruksi pustaka cDNA berhasil mendapatkan koloni transforman, 93% di antaranya mengandung sisipan fragmen cDNA dengan panjang antara 200 - 2000 bp, namun fragmen terbanyak antara 500 – 800 bp. Analisis cDNA-AFLP pada cDNA asal daun klon AVROS 2037 dan PPN 2444 yang diinfeksi C. cassiicola menghasilkan 35 fragmen asal transkrip (TDF) dengan pola ekspresi berbeda. Seluruh fragmen diklon dan disekuen. Pengelompokan berdasarkan homologi sekuennya menghasilkan 19 contigs dan 9 macam sekuen individu. Beberapa contig dan sekuen terlalu pendek, terdiri atas beberapa nukleotida saja. Sebanyak 10 contigs
dan 5 sekuen memiliki homologi dengan gen yang telah dikenal ya ng terdapat di data base gene bank, seperti putative Ran binding protein, protein transporter, regulator transkripsi pada beberapa organisme; arginase, GTP-binding protein,
heat shock protein (HSP) dan aconitase pada beberapa spesies tanaman. Ran binding protein , GTP-binding protein , dan protein transporter mer upakan protein yang terdapat pada membran sedangkan aconitase merupakan enzim yang ekspresinya diregulasi oleh nitric oxide (NO). Transkrip lainnya seperti arginase diregulasi oleh pelukaan dan fitotoksin. Keberadaan enzim yang berhubungan dengan NO menimbulkan dugaan bahwa respon pertahanan tanaman karet terhadap C. cassiicola kemungkinan diperantarai oleh NO.
NURHAIMI. Expression of pathogen responsive genes toward Corynespora cassiicola in rubber plant (Hevea brasiliensis Muell. Arg.). HAJRIAL ASWIDINNOOR, MAGGY T. SUHARTONO, ANTONIUS SUWANTO, NURITA TORUAN-MATHIUS, and AGUS PURWANTARA.
Leaf fall disease caused by Corynespora cassiicola fungus is an important disease in rubber plantation. This research aims to identify and isolate genes or part of genes involved in plant defense response in rubber clones. There were several research activities, (1) selection resista nt and susceptible clones for gene expression study which consist of identification of disease symptons, examination of the resistance level of rubber clones to the pathogen, and analysis of genetic similarity of several rubber clones, (2) establishment of cDNA-AFLP method for rubber plant, (3) identification of transcripts differentially expressed in response to the pathogen infection in both resistant and susceptible clones, and (4) construction of the cDNA library from Hevea leaf of resistant clone. Application of cDNA-AFLP method in gene expression study starte d by pathogen infection of the leaves to induce the expression of genes involved in resistance mechanism. The results showed that disease symptons visually observed two days after pathogen inoculation, both in resistant and susceptible clones. In susceptible clones, 12 days after inoculation most of surface of the leaves damaged. In contrary, no significant development of symptons were observed on resistant clones. Among these clones, BPM 1 showed the strongest resistance; IRR 100, RRIC 100, AVROS 2037, and PR 255 were resistance; and RRIC 103, PPN 2444, IAN 873 were susceptible. AVROS 2037 and PPN 2444 clones with have 88% genetic similar ity were choosen for gene expression study. The cDNA library construction resulted in many colonies, 93% of which contained cDNA insert with size 200 – 2000 bp. Most of the fragments, however, were 500 - 800 bp. The cDNA-AFLP analysis of cDNA from leaves of AVROS 2037 and PPN 2444 clones infected with C. cassiicola resulted in 35 transcript-derived fragments (TDFs) with have different ial expression patterns. All of these fragments were cloned and sequenced. The homology-based grouping of these sequences resulted in 19 contigs and 9 individual sequences. Some contigs and sequences were very short, only contain several few nucleotides. Among these, 10 contigs and 5 sequences have significant sequence homology with known genes in ge ne bank data base, such as Ran binding protein, protein transporter and transcriptional regulators of some organisms; arginase, GTP -binding protein, heat shock protein (HSP) and aconitase of some plants species. Among these, Ran binding protein , GTP-binding protein and protein transporter were known as a membrane protein, while aconitase included in nitric oxide (NO) -regulated enzyme. The other such as arginase were regulated by wounding and phytotoxin. The presence of enzyme related to NO emerge speculation that rubber plant defense could be mediated by NO.
EKSPRESI GEN-GEN RESPONSIF
TERHADAP
Corynespora cassiicola
PADA
TANAMAN KARET (
Hevea brasiliensis
Muell.Arg.)
NURHAIMI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
NURHAIMI. Ekspresi gen-gen responsif terhadap Corynespora cassiicola pada tanaman karet (Hevea brasiliensis Muell. Arg.). HAJRIAL ASWIDINNOOR, MAGGY T. SUHARTONO, ANTONIUS SUWANTO, NURITA TORUAN-MATHIUS, dan AGUS PURWANTARA.
Penyakit gugur daun yang disebabkan cendawan Corynespora cassiicola
merupakan penyakit penting di perkebuana karet. Penelitian bertujuan untuk mendapatkan transkrip/gen/bagian gen yang berperan dalam respon pertahanan tanaman karet terhadap patogen tersebut. Beberapa tahap penelitian dilakukan, yaitu: (1) mengidentifikasi gejala dan menetapkan tingkat resistensi klon karet serta mengidentifikasi kemiripan genetik klon karet untuk penentuan klon resisten dan rentan yang digunakan dalam studi ekspresi gen, (2) mengembangkan metode cDNA-AFLP pada tanaman karet, (3) mengidentifikasi transkrip yang diekspresikan secara diferensial pada klon karet resisten dan rentan selama terjadi interaksi tanaman-patogen melalui metode cDNA-AFLP serta kloning dan sekuensing fragmen asal transkrip , dan (4) konstruksi pustaka cDNA dari daun klon karet resisten. Aplikasi metode cDNA-AFLP dilakukan dengan memberikan tekanan berupa infeksi patogen pada daun untuk menginduksi ekspresi transkrip/gen/bagian gen yang berperan dalam res pon pertahanan. Hasil penelitian menunjukkan gejala bercak mulai terlihat hari kedua setelah daun diinokulasi, baik pada klon resisten maupun rentan. Perkembangan gejala berlanjut pada klon rentan, setelah 12 hari hampir seluruh bagian daun rusak, namun pada klon resisten gejala penyakit tidak berkembang. Klon BPM 1 menunjukkan respon sangat resisten, klon IRR 100, RRIC 100, AVROS 2037, PR 255 adalah resisten dan klon RRIC 103, PPN 2444, IAN 873 adalah sangat rentan. Klon resisten AVROS 2037 dan klon rentan PPN 2444, yang memiliki kemiripan genetik 88,0%, dipilih untuk studi ekspresi gen. Konstruksi pustaka cDNA berhasil mendapatkan koloni transforman, 93% di antaranya mengandung sisipan fragmen cDNA dengan panjang antara 200 - 2000 bp, namun fragmen terbanyak antara 500 – 800 bp. Analisis cDNA-AFLP pada cDNA asal daun klon AVROS 2037 dan PPN 2444 yang diinfeksi C. cassiicola menghasilkan 35 fragmen asal transkrip (TDF) dengan pola ekspresi berbeda. Seluruh fragmen diklon dan disekuen. Pengelompokan berdasarkan homologi sekuennya menghasilkan 19 contigs dan 9 macam sekuen individu. Beberapa contig dan sekuen terlalu pendek, terdiri atas beberapa nukleotida saja. Sebanyak 10 contigs
dan 5 sekuen memiliki homologi dengan gen yang telah dikenal ya ng terdapat di data base gene bank, seperti putative Ran binding protein, protein transporter, regulator transkripsi pada beberapa organisme; arginase, GTP-binding protein,
heat shock protein (HSP) dan aconitase pada beberapa spesies tanaman. Ran binding protein , GTP-binding protein , dan protein transporter mer upakan protein yang terdapat pada membran sedangkan aconitase merupakan enzim yang ekspresinya diregulasi oleh nitric oxide (NO). Transkrip lainnya seperti arginase diregulasi oleh pelukaan dan fitotoksin. Keberadaan enzim yang berhubungan dengan NO menimbulkan dugaan bahwa respon pertahanan tanaman karet terhadap C. cassiicola kemungkinan diperantarai oleh NO.
NURHAIMI. Expression of pathogen responsive genes toward Corynespora cassiicola in rubber plant (Hevea brasiliensis Muell. Arg.). HAJRIAL ASWIDINNOOR, MAGGY T. SUHARTONO, ANTONIUS SUWANTO, NURITA TORUAN-MATHIUS, and AGUS PURWANTARA.
Leaf fall disease caused by Corynespora cassiicola fungus is an important disease in rubber plantation. This research aims to identify and isolate genes or part of genes involved in plant defense response in rubber clones. There were several research activities, (1) selection resista nt and susceptible clones for gene expression study which consist of identification of disease symptons, examination of the resistance level of rubber clones to the pathogen, and analysis of genetic similarity of several rubber clones, (2) establishment of cDNA-AFLP method for rubber plant, (3) identification of transcripts differentially expressed in response to the pathogen infection in both resistant and susceptible clones, and (4) construction of the cDNA library from Hevea leaf of resistant clone. Application of cDNA-AFLP method in gene expression study starte d by pathogen infection of the leaves to induce the expression of genes involved in resistance mechanism. The results showed that disease symptons visually observed two days after pathogen inoculation, both in resistant and susceptible clones. In susceptible clones, 12 days after inoculation most of surface of the leaves damaged. In contrary, no significant development of symptons were observed on resistant clones. Among these clones, BPM 1 showed the strongest resistance; IRR 100, RRIC 100, AVROS 2037, and PR 255 were resistance; and RRIC 103, PPN 2444, IAN 873 were susceptible. AVROS 2037 and PPN 2444 clones with have 88% genetic similar ity were choosen for gene expression study. The cDNA library construction resulted in many colonies, 93% of which contained cDNA insert with size 200 – 2000 bp. Most of the fragments, however, were 500 - 800 bp. The cDNA-AFLP analysis of cDNA from leaves of AVROS 2037 and PPN 2444 clones infected with C. cassiicola resulted in 35 transcript-derived fragments (TDFs) with have different ial expression patterns. All of these fragments were cloned and sequenced. The homology-based grouping of these sequences resulted in 19 contigs and 9 individual sequences. Some contigs and sequences were very short, only contain several few nucleotides. Among these, 10 contigs and 5 sequences have significant sequence homology with known genes in ge ne bank data base, such as Ran binding protein, protein transporter and transcriptional regulators of some organisms; arginase, GTP -binding protein, heat shock protein (HSP) and aconitase of some plants species. Among these, Ran binding protein , GTP-binding protein and protein transporter were known as a membrane protein, while aconitase included in nitric oxide (NO) -regulated enzyme. The other such as arginase were regulated by wounding and phytotoxin. The presence of enzyme related to NO emerge speculation that rubber plant defense could be mediated by NO.
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa disertasi Ekspresi Gen-gen Responsif terhadap Corynespora cassiic ola pada Tanaman Karet (Hevea brasiliensis, Muell. Arg.) adalah karya saya sendiri dengan bimbingan dari Komisi Pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, Juni 2006
Hak cipta milik Nurhaimi, tahun 2006 Hak Cipta dilindungi
TERHADAP
Corynespora cassiicola
PADA
TANAMAN KARET (
Hevea brasiliensis
Muell.Arg.)
NURHAIMI
Disertasi
Sebagai salah satu syarat untuk memperoleh gelar Doktor
pada Program Studi Agronomi Institut Pertanian Bogor
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Nama
Nomor Pokok
Program Studi
:
:
:
cassiicola pada Tanaman Karet (Hevea brasiliensis, Muell. Arg.)
Nurhaimi
P03600007
Agronomi
Disetujui Komisi Pembimbing
Dr. Ir. Hajrial Aswidinnoor, M.Sc. Ketua
Prof. Dr. Ir. Maggy T. Suhartono Prof. Dr. Ir. Antonius Suwanto, M.Sc. Anggota Anggota
Dr. Nurita Toruan-Mathius, M.S. Dr. Ir. Agus Purwantara
Anggota Anggota
Diketahui
Ketua Program Studi Agronomi Dekan Sekolah Pascasarjana
Dr. Ir. Satriyas Ilyas, M.S. Dr. Ir. Khairil Anwar Notodiputro, M.S.
Puji dan syukur yang tak terhingga penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini dapat diselesaikan. Disertasi ini memuat 6 bab, beberapa bab merupakan pengembangan dari naskah artikel yang diajukan ke jurnal ilmiah. Terdapat 2 bab yang telah diterbitkan di jurnal ilmiah, yaitu bab 3 dengan judul “Kemiripan Genetik Klon Karet (Hevea brasiliensis) Berdasarkan Metode Amplified Fragment Length Polymorphisms
(AFLP)” (Menara Perkebunan No. 1, 2003) dan Bab 4 dengan judul “Konstruksi Pustaka cDNA dari Daun Klon Karet AVROS 2037 yang Diinfeksi Corynespora cassiicola” (Menara Perkebunan No 2, 2005).
Ucapan terima kasih dan penghargaan disampaikan kepada Komisi Pembimbing, Dr. Ir. Hajrial Aswidinnoor, M.Sc. selaku Ketua serta Prof. Dr. Ir. Maggy T. Suhartono, Prof. Dr. Ir. Antonius Suwanto, M.Sc., Dr. Nurita Toruan-Mathius, M.S. dan Dr. Ir. Agus Purwantara, masing-masing sebagai Anggota, yang memberikan arahan dan dorongan sehingga disertasi ini dapat diselesaikan.
Ucapan terima kasih disampaikan pula kepada:
1. Ketua Komisi Pembinaan Tenaga Badan Penelitian dan Pengembangan
Pertanian dan Pimpinan beserta Staf Proyek PAATP Badan Penelitian dan Pengembangan Pertanian atas kesempatan dan dukungan dana yang diberikan kepada penulis selama mengikuti pendidikan S3.
2. Direktur Eksekutif Lembaga Riset Perkebunan Indonesia, Kepala Balai Penelitian Bioteknologi Perkebunan Indonesia atas izin yang diberikan kepada penulis untuk menempuh pendidikan S3.
3. Dekan Sekolah Pascasarjana beserta staf, Ketua Program Studi Agronomi Sekolah Pascasarjana IPB, dan seluruh staf pengajar yang telah membekali dan memperkaya penulis dengan berbagai ilmu.
4. Dr. Pascal Montoro dan Dr. Valerie Pujade-Renaud (CIRAD-Montpellier, Perancis) atas bantuan serta supervisi bagian akhir penelitian yang dilaksanakan di laboratorium CIRAD Montpelier.
5. Dr. Ir. Utut Widyastuti, M.Si. selaku Penguji Luar Komisi pada Ujian Tertutup serta Dr. Ir. Didiek Hadjar Goenadi, M.Sc, APU dan Dr. Ir. Suharsono DEA, selaku Penguji Luar Komisi pada Ujian Terbuka.
6. Rekan-rekan mahasiswa S3 Program Studi Agronomi, Sekolah Pascasaarjana IPB atas kerjasamanya dalam proses penyelesaian studi dan disertasi ini. 7. Dr. Aron Situmorang (Balai Penelitian Karet Sembawa) dan rekan-rekan di
laboratorium Biologi Molekuler BPBPI yang senantiasa memberikan perhatian dan dukungan penuh selama penelitian dan penulisan berlangsung.
Penghargaan dan terima kasih penulis sampaikan kepada suami tercinta Dr. Ir. Uhendi Haris, M.Si., ananda Pramita Fitri, Risa Guntari dan Farid Rahman Permana atas segala pengertian, kesabaran dan dorongan yang diberikan selama penulis menempuh pendidikan. Terima kasih kepada adik-adik tersayang yang senantiasa menunjukkan toleransi selama penulis menghadapi masa -masa berat penyelesaian pendidikan. Terima kasih tak terhingga penulis sampaikan kepada ayahanda Nursad Sutan Mangkuto dan ibunda Hainah Karim, berkat didikan beliaulah penulis mampu menempuh pendidikan formal hingga jenjang tertinggi.
Semoga karya ilmiah ini bermanfaat.
Penulis dilahirkan di Padang Panjang, Sumatera Barat pada tanggal 15 Mei 1958 sebagai anak pertama dari tujuh bersaudara, dari pasangan Nursad Sutan Mangkuto dan Hainah Karim. Menikah dengan Dr. Ir. Uhendi Haris, M.Si., peneliti di Balai Penelitian Teknologi Karet Bogor, penulis dikarunia 3 orang anak yakni Pramita Fitri (19), Risa Guntari (16) dan Farid Rahman Permana (10).
Penulis menyelesaikan pendidikan dasar di SD Negeri No. 1 Padang Panjang pada tahun 1970, sekolah menengah pertama di SMP Negeri No. 1 Padang Panjang pada tahun 1973, dan sekolah menegah atas di SMA Negeri 1 Bukittinggi (Sumatera Barat) pada tahun 1976. Pada tahun 1977 melalui saringan ujian masuk SKALU (Sistem Kerjasama Antar Lima Universitas), penulis diterima di Fakultas Biologi Universitas Gadjah Mada, Yogyakarta dan lulus sebagai Sarjana Biologi pada tahun 1983. Tahun 1991 penulis mendapat kesempatan mengikuti International Training Course in Biotechnology of Tropical Crops di South China Academy of Tropical Crops (SCATC), Hainan, RRC. Dua tahun kemudian penulis mendapat kesempatan yang sama untuk mengikuti Plant Tissue Culture Training Program di Queensland University of Technology, Brisbane, Australia.
Dengan dana beasiswa dari Balai Penelitian Bioteknologi Perkebunan, pada tahun 1996 penulis mendapat kesempatan untuk melanjutkan pendidikan pascasarjana S2 pada Program Studi Bioteknologi di Institut Pertanian Bogor dan lulus tahun 1999. Pada tahun 2000 penulis melanjutkan pendidikan S3 di Program Studi Agronomi, Institut Pertanian Bogor, dengan pendalaman minat pada Biologi Molukuler melalui pendanaan dari proyek PAATP, Badan Penelitian dan Pengembangan Pertanian. Melalui proyek yang sama penulis mendapat kesempatan untuk melakukan bagian akhir penelitian ini di laboratorium CIRAD, Montpellier, Perancis dari awal September sampai akhir November 2005.
Penulis mulai bekerja tahun 1984 di Pusat Penelitian Karet yang lokasinya berada di Sungei Putih, Sumatera Utara. Setelah terjadi re-organisasi Balai-Balai Penelitian Perkebunan, mulai tahun 1993 penulis bertugas sebagai staf peneliti dalam kelompok Biologi Molekuler dan Rekayasa Genetika Tanaman di Balai Penelitian Bioteknologi Perkebunan Indonesia yang berkedudukan di Bogor.
ix
Halaman
DAFTA R TABEL ………..
DAFTAR GAMBAR ……….
DAFTAR LAMPIRAN ………..
1. PENDAHULUAN ……….. Latar Belakang ………. Tujuan Penelitian ………. Ruang Lingkup Penelitian ……….. Manfaat Penelitian ………..
2. PERKEMBANGAN GEJALA PENYAKIT DAN PENGUJIAN TINGKAT RESISTENSI KLON KARET (Hevea brasiliensis)
TERHADAP INFEKSI Corynespora cassiicola ………
Abstrak ……… Pendahuluan ……… Bahan dan Metode ………... Hasil ………. Perkembanga n Geja la Penyakit Gugur Daun ……….. Tingkat Resistensi Sepuluh Klon Karet terhadap Infeksi
C. cassiicola ………
Pembahasan ………. Kesimpulan ………..
3. ISOLASI DNA DAN KEMIRIPAN GENETIK SEPULUH KLON
KARET BERDASARKAN METODE AMPLIFIED FRAGMENT
LENGTH POLYMORPHISM (AFLP) ……….... Abstrak ………... Pendahuluan ……….. Bahan dan Metode ……….. Hasil ……… DNA daun karet ………. Modifikasi visua lisasi produk AFLP ………. AFLP dari DN A asal daun karet ………... Pembahasan ……… Kesimpulan ……….
4. KONSTRUKSI PUSTAKA cDNA DARI DAUN KARET KLON AVROS 2037 YANG DIINFEKSI DENGAN CENDAWAN PATOGEN
Corynespora cassiicola ………
Abstrak ……….. Pendahuluan ………... Bahan dan Metode ………..
x
RNA dan cDNA dari daun karet klon AVROS 2037 ………. Fraksinasi cDNA ……… Waktu kultur dan seleksi vektor modifikasi ……… Konstruksi pustaka cDNA pada vektor pGEM-T Easy-Oligo Sfi . Pembahasan ……… Kesimpulan ……….
5. PENGUJIAN METODE cDNA-AFLP NON-RADIOAKTIF UNTUK IDENTIFIKASI TRANSKRIP ASAL DAUN KARET ……… Abstrak ……….. Pendahuluan ……….. Bahan dan Metode ……….. Hasil ……… Isolasi RNA total dan mRNA serta sintesis cDNA dari
da un karet ………... cDNA-AFLP menggunakan pasangan enzim restriksi
EcoRI-MseI ……….
cDNA-AFLP menggunakan pasangan enzim restriksi
VspI-TaqI ………
Seleksi primer selektif untuk cDNA-AFLP menggunakan enzim
restriksi VspI-TaqI ……….
Pembahasan ……… Kesimpulan ……….
6. IDENTIFIKASI TRANSKRIP PADA TANAMAN KARET YANG DIEKSPRESIKAN DALAM INTERAKSI DENGAN CENDAWAN PATOGEN Corynespora cassiicola MELALUI ANALISIS cDNA- AFLP ……….. Abstrak ………... Pendahuluan ………... Bahan dan Metode ……….. Hasil ……… ….. Optimasi isolasi RNA dan sintesis cDNA dari daun karet ………. Analisis cDNA-AFLP ……… Isolasi dan kloning fragmen asal transkrip ………. Analisis sekuen terhadap fragmen cDNA yang diisolasi ………... Pembahasan ………... Kesimpulan ………
7. PEMBAHASAN UMUM ………...
8. KESIMPULAN DAN SARAN ………..
xi Halaman 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16
Perkembangan gejala penyakit gugur daun pada klon karet PR 300, AVROS 2037 dan PPN 2444 ……….
Gejala dan intensitas penyakit pada pengujian terkontrol klon karet
terhadap cendawan patogen C. cassiicola ………..
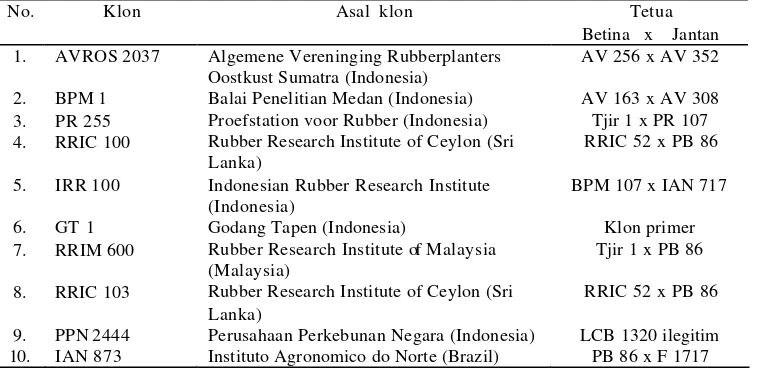
Asal dan tetua sepuluh klon karet ………
Pasangan primer EcoRI dan MseI untuk amplifikasi selektif DNA asal daun karet ………
Program PCR untuk reaksi amplifikasi selektif pada analisis AFLP ….
Komposisi 6% poliakrilamid gel untuk dua macam ukuran gel ………..
Jumlah fragmen DNA teramplifikasi dengan 10 pasang primer AFLP pada 10 klon karet ……….
Perbandingan a ntara vektor dengan cDNA sisipan ……….
Jumlah koloni E. coli DH5α selama waktu kultur ……….
Perbandingan molaritas vektor dan cDNA sisipan dalam proses ligasi ..
Jumlah koloni hasil transformasi yang ditumbuhkan pada media seleksi serta titernya ……….
Susunan oligonukleotida adapter, primer preselektif dan primer selektif untuk cDNA yang dipotong dengan enzim restriksi EcoRI-MseI ……...
Susunan oligonukleotida adapter, primer preselektif dan primer selektif untuk cDNA yang dipotong dengan enzim restriksi Vsp I-Taq I ………
Konsentrasi dan kemurnian RNA total hasil isolasi dari daun karet klon AVROS 2037 dan PPN 2444 ……….
Pasangan primer selektif untuk amplifikasi cDNA-AFLP klon PPN 2444 ……….
Hasil pengukuran konsentrasi dan kemurnian RNA dari daun klon AVROS 2037 dan PPN 24 pada beberapa waktu setelah inokulasi dengan Corynespora cassiicola menggunakan kit Plant RNA Reagent ..
xii 18
19
cDNA asal daun karet menggunakan metode cDNA-AFLP …………...
Pola ekspresi dan ukuran fragmen cDNA pada gel poliakrilamid ……...
Analisis sekuen TDF yang diperoleh melalui analisis cDNA-AFLP dari daun karet klon AVROS 2037 dan PPN 2444 ……….
118
123
xiii Halaman 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16
Alir penelitian, tujuan dan hasil yang diharapkan pada setiap
tahapan penelitian ………
Pembentukan miselia Corynespora cassiicola pada media ASK dan pembentukan konidia pada permukaan daun ………..
Penampakan gejala penyakit gugur daun pada klon karet resisten (AVROS 2037) dan rentan (PPN 2444) akibat infeksi C. cassiicola …
Sensitivitas DNA hasil isolasi terhadap pemotongan dengan enzim
restriksi EcoRI ………
Pola AFLP pada gel poliakrilamid ukuran 7 x 9 cm (I) dan 12 x 14,5 cm (II) dengan pewarnaan perak nitrat ……….
Produk AFLP dengan primer EACC-MCTA dan EACT -MCAG pada DNA daun 10 klon karet ………
Dendrogram kemiripan genetik 10 klon karet berdasarkan analisis AFLP menggunakan 10 pasang primer selektif ………
Peta vektor pGEM-T Easy ……….
RNA total dan cDNA dari daun karet klon AVROS 2037 ………
Fraksinasi fragmen cDNA pada 1,1% gel agarose menggunakan klom CHROMA SPIN-400 ………
Pemotongan plasmid pGEM -T Easy-Oligo Sfi dengan enzim restriksi
Rsa I dan Sfi I ………
Replika contoh koloni hasil transformasi vektor rekombinan pada
bakteri E. coli DH5α ………
Amplifikasi contoh koloni dengan primer T7 dan SP6 pada 2% gel agarose dengan pewarnaan etidium bromida ………....
Distribusi ukuran cDNA sisipan pada pustaka cDNA dari daun klon karet AVROS 2037 ………
RNA total dan cDNA dari daun karet ………
Hasil cDNA-AFLP klon PPN 2444 menggunakan pasangan enzim restriksi EcoRI-MseI dengan 20 kombinasi pasangan primer selektif ..
xiv 17
18
19
20
21
22
23
24
25
26
27
Hasil cDNA-AFLP klon AVROS 2037 dan PPN 2444 menggunakan pasangan enzim restriksi VspI-TaqI dengan 4 kombinasi pasangan primer selektif ………
Hasil cDNA-AFLP klon AVROS 2037 dan PPN 2444 menggunakan pasangan enzim restriksi VspI-TaqI dengan variasi pada pengenceran
hasil preamplifikasi dan Taq DNA polimerase ………
Hasil cDNA-AFLP klon PPN 2444 menggunakan pasangan enzim restriksi VspI-TaqI dengan 45 kombinasi pasangan primer selektif …
RNA total dari daun karet klon AVROS 2037 dan PPN 2444 ……….
RNA dari daun klon AVROS 2037 dan PPN 2444 yang diisolasi dengan Plant RNA Reagent pada beberapa waktu setelah inokulasi petogen ………...
Hasil preamplifikasi cDNA menggunakan primer standar VspI dan
TaqI dengan tiga cara penyiapan RNA ………..
Pola transkrip klon karet resisten terhadap C. cassiicola (AVROS 2037, A) dan rentan (PPN 2444, P) berdasarkan analisis cDNA-AFLP dengan 4 kombinasi primer (V16/T16, V16/T17, V16/T19, V16/T20)..
Pola transkrip klon karet resisten terhadap C. cassiicola (AVROS 2037, A) dan rentan (PPN 2444, P) berdasarkan analisis cDNA-AFLP dengan 2 kombinasi primer (V16/T21, V16/T24)………..
Hasil re -amplifikasi fragmen cDNA menggunaka n primer yang sesuai untuk masing-masing fragmen (V16/T21)………..
Hasil PCR koloni 35 fragmen cDNA dengan primer SP6/T7, 5 sampel untuk setiap fragmen ………..
Hasil PCR koloni 35 fragmen cDNA dengan primer SP6/T7, 5 sampel untuk setiap fragmen ………..
90
91
94
113
115
117
121
122
124
125
xv
Halaman
1
2
Pengelompokan Transcript-Deriv ed Fragment (TDF) asal daun karet berdasarkan kesamaan sekuennya ………..
BlastX fragmen cDNA asal daun karet ………..
157
PENDAHULUAN
Latar Belakang
Karet (Hevea brasiliensis Muell.Arg.) adalah salah satu tanaman tahunan penting, karena di antara spesies Hevea yang ada hanya spesies tersebut menghasilkan getah (lateks) dengan kualitas baik, yang dikenal sebagai karet alam. Bagi Indonesia, tanaman karet memiliki arti ekonomi dan sosial yang amat penting ditinjau dari luasnya areal pertanaman serta banyaknya petani, tenaga kerja dan pengusaha yang terlibat di dalam pengusahaan karet alam. Sampai tahun 2004, total areal perkebunan karet di Indonesia tercatat seluas ± 3,3 juta hektar dengan produksi mencapai hampir 2,1 juta ton. Sebagian besar produksi tersebut diekspor dalam bentuk bahan mentah atau setengah jadi, dengan nilai mencapai sekitar 2,2 milyar US dolar (Ditjenbun 2004; Gapkindo 2005). Dengan produksi seperti di atas maka Indonesia tercatat sebagai negara penghasil karet alam nomor dua terbesar di dunia, setelah Thailand.
Di dalam budidayanya, tanaman karet dihadapkan pada serangan patogen yang berperan besar dalam penurunan produksi serta dapat meningkatkan biaya produksi. Oleh karena itu tujuan pemuliaan tanaman karet di samping menghasilkan genotipe unggul dari segi produksi juga untuk menghasilkan genotipe tahan penyakit. Salah satu cendawan patogen pada tanaman karet adalah
Corynespora cassiicola (Berk. & Curt.) Wei penyebab penyakit gugur daun. Pentingnya penyakit tersebut ditandai oleh kemampuan patogen untuk menyerang pada berbagai tingkat perkembangan daun dan tingkat perkembangan tanaman (Chee 1988). Apabila kondisi lingkungan mendukung, serangan dapat terjadi sepanjang tahun sehingga sangat mempengaruhi pertumbuhan serta produksi tanaman. Patogen tersebut memiliki kisaran inang cukup luas karena terdapat pada tanaman lain seperti kedelai, ubi jalar dan pepaya.
Gambaran kerugian ekonomis yang nyata akibat gangguan C. cassiicola
dalam kurun waktu 1980 – 1988 sekitar 1.200 ha tanaman karet terserang berat, 400 ha di antaranya dibongkar dan dimusnahkan (Sinulingga et al. 1996). Di Sri Lanka pembongkaran tanaman karet yang terserang oleh patogen yang sama mencapai 4.600 ha (Jayasinghe dan Silva 1996). Dari penelitian terdahulu (Situmorang dan Budiman 1984) diperkirakan bahwa serangan C. cassiicola dapat menurunkan produksi hingga 20%. Dengan produksi 2,1 juta ton per tahun maka secara nasional penyakit ini berpotensi menyebabkan kehilangan produksi sekitar 420.000 ton. Membaiknya harga karet dunia belakangan ini, yaitu mencapai sekitar 2 US dolar per kg menyebabkan potensi kerugian tersebut setara dengan nilai sekitar 840 juta US dolar per tahun.
Dari berbagai laporan diketahui bahwa klon karet memiliki kisaran respon yang sangat luas terhadap serangan patogen tersebut, mulai dari yang terinfeksi berat sampai sama sekali tidak terinfeksi. Klon RRIC 103, KRS 21 dan RRIM 725 yang masuk ke Indonesia melalui Pertukaran Klon Internasional pada tahun 1974 tercatat sebagai klon yang sangat rentan, demikian juga klon seri PPN seperti PPN 2058, PPN 2444, dan PPN 2447 yang merupakan hasil seleksi lokal (Sinulingga et al. 1996; Suwarto et al. 1996). Hadi (2003) melaporkan bahwa beberapa klon seperti AVROS 2037, BPM 24, PPN 2058, PPN 2447, PR 300, PR 303, RRIC 110, RRIM 600 dan RRIM 712 memperlihatkan respon yang berbeda terhadap masing-masing isolat virulen. Akan tetapi beberapa klon seperti BPM 1, PB 260, PR 261, RRIC 100 dan RRIM 712 selalu menunjukkan respon ketahanan yang tinggi sedangkan klon PPN 2444 dan RRIC 103 selalu memberikan respon sangat rentan terhadap setiap isolat C. cassiicola yang diuji. Di samping jenis klon karet dan isolat patogen, tingkat keparahan penyakit juga ditentukan oleh kondisi lingkungan. Situmorang (2002) mengemukakan bahwa berdasarkan kondisi iklim, Sumatera dan Kalimantan Selatan merupakan daerah yang kondusif bagi berkembangnya penyakit gugur daun Corynespora.
Salah satu cara mencegah kerugian yang ditimbulkan oleh Corynespora
oleh C. cassiicola (Tan et al. 1992). Klon RRIM 600 yang ditanam di Sumatera, Riau dan Jambi juga mengalami kerusakan berat akibat serangan patogen tersebut (Situmorang 2002). Di Indonesia, kasus serupa ditemukan pada klon GT 1 yang merupakan klon anjuran skala besar dan telah ditanam secara luas, namun ternyata tingkat resistensinya berubah terhadap infeksi patogen tersebut (Sinulingga et al. 1996; Situmorang et al. 1996). Oleh karena itu untuk mengontrol penyakit secara lebih terarah, upaya untuk mengetahui hal yang mendasari resistensi klon-klon tertentu terhadap infeksi Corynespora perlu dilakukan.
Dalam interaksi H. brasiliensis/C. cassiicola dilaporkan bahwa penetrasi cendawan terjadi dalam waktu 12 jam setelah inokulasi dan tidak terdapat perbedaan kecepatan penetrasi pada klon resisten dan rentan (Breton et al. 2000). Patogen berarti mampu menembus lapisan epidermis daun, baik pada klon resisten maupun klon rentan, namun respon selanjutnya berbeda antara kedua jenis klon tersebut. Serangan pada klon rentan menyebabkan kerusakan pada sel epidermis, nukleus dan organel lain sehingga menimbulkan kerusakan parah pada daun. Pada klon resisten kolonisasi cendawan terbatas hanya pada beberapa sel di sekitar hifa cendawan. Sejauh ini dilaporkan bahwa C. cassiicola menghasilkan toksin, pertama kali diketahui melalui perlakuan filtrat kultur pada daun tomat (Onesirosan et al. 1975). Hal yang sama juga dikemukakan oleh Liyanage dan Liyanage (1986), Purwantara (1987), Suwarto (1989), dan Breton et al. (1996). Toksin ini kemudian disebut sebagai ‘cassiicoline’ yang merupakan host-selective toxins (HST), hanya toksik terhadap tanaman tertentu (rentan), namun tidak toksik terhadap tanaman resisten atau tanaman bukan inang (Breton et al. 2000).
Cassiicoline yang dihasilkan oleh C. cassiicola merupakan glikoprotein , larut dalam air , memiliki berat molekul sekitar 6,5 kDa dan tersusun ata s 23 residu asam amino (Breton et al. 1996). Seperti kebanyakan HST lainnya,
Di samping C. cassiicola, sejauh ini telah dikenal sebanyak 20 jenis cendawan lain penghasil HST, dan HST tersebut bervariasi mulai dari senyawa dengan berat molekul rendah sampai dengan protein. Toksin yang demikian dikenal sebagai ‘agen kompatibilitas’ karena merusak tanaman dan kerusakan tersebut memfasilitasi patogenesis yang ditunjukkan melalui induksi kematian sel inang (Walton 1996). Pada sebagian besar kasus, sensitivitas tanaman inang terhadap suatu HST ditentukan oleh gen tunggal, dan penyakit tidak akan muncul apabila tidak ada sensitivitas terhadap toksin tersebut (Wolpert et al. 2002). Sebagai contoh adalah sensitivitas tanaman gandum terhadap viktorin, suatu HST yang dihasilkan oleh cendawan Cochliobolus victoriae, penyebab penyakit
Victoria blight pada tanaman tersebut. Adanya sensitivitas yang ditunjukkan oleh kerentanan tanaman terhadap patogen dikendalikan oleh alel dominan pada lokus
Vb. Semua genotipe Vb dominan, sensitif terhadap viktorin dan rentan terhadap patogennya, sedangkan semua genot ipe homozigot resesif (vb vb) tidak sensitif terhadap viktorin dan tanaman resisten. Dengan demik ian penyakit Victoria blight hanya tejadi apabila isolat C. victoriae menghasilkan viktorin dan tanaman gandum membawa alel dominan pada lokus Vb.
Demikian juga pada AAL toksin, yaitu suatu HST yang diproduksi oleh
Alternaria alternate f. sp. lycopersici, suatu cendawan patogen penyebab kanker batang pada tanaman tomat (Gilchrist dan Grogan 1976). Lokus Asc menentukan resistensi terhadap penyakit maupun sensitivitas terhadap toksin. Genotipe homozigot dominan memiliki sifat resisten, genotipe homozigot resesif sangat sensitif dan genotipe heterozigot bersifat intermediet (Clouse dan Gilchrist 1987). Penelitan yang lebih rinci telah dilakukan pada interaksi tanaman jagung dengan cendawan patogen Cochliobolus carbonum ras 1 yang menghasilkan HC-toksin, penyebab penyakit ‘leaf spot’ dan ‘ear rot’ pada jagung. Resistensi tanaman jagung terhadap patogen tersebut ditentukan oleh alel dominan pada lokus Hm1. Gen Hm1 menyandikan suatu karbonil reduktase, yaitu HC-toksin reduktase (HCTR) (Johal dan Briggs 1992) yang memiliki kemampuan untuk menginaktivasi toksin melalui reaksi enzimatik dengan cara reduksi (Meeley et al.
jagung resisten sedangkan pada tanaman rentan toksin menginduksi gejala penyakit melalui penghambatan histon deasetilase (Brosch et al. 1995). Inaktivasi toksin yang diproduksi oleh patogen juga telah dilaporkan pada bakteri Pantoea dispersa SB1403, yang mampu mendetoksifikasi albicidin, suatu toksin yang dihasilkan oleh Xanthomonas albilineans penyebab penyakit ‘leaf scald’ pada tanaman tebu. Produk gen albD pada P. dispersa yaitu protein AlbD, menunjukkan aktivitas esterase yang sangat kuat dan mampu mendetoksifikasi albicidin (Zhang dan Birch 1997).
Molekul atau gen yang berperan dalam resistensi klon karet terhadap C. cassiicola sampai sejauh ini belum diketahui, namun berdasarkan penelitian Breton et al. (2000), terdapat indikasi bahwa resistensi kemungkinan diperoleh melalui detoksifikasi toksin seperti pada kasus HC-toksin dan albicidin. Hal ini diperkuat oleh hasil penelitian Suwarto (2003), yang menginformasikan bahwa toksin asal C. cassiicola dapat diinaktifkan secara in vitro oleh beberapa senyawa pereduksi seperti N2S2O4 dan 2-merkaptoetanol serta oleh serum B lateks asal klon rentan IAN 873. Hal ini mengindikasikan bahwa klon karet tertentu
memiliki senyawa yang bersifat sebagai antitoksin sehingga mampu
menginaktifkan toksin yang dip roduksi oleh patogen. Oleh karena itu dengan mempelajari transkrip/gen yang diekspresikan secara diferensial pada saat terjadinya interaksi inang-patogen akan membuka peluang untuk mengidentifikasi transkrip/gen yang berperan dalam resistensi tanaman.
ekspresinya pada suatu percobaan yang sama. Selain itu metode tersebut menjadi populer untuk mengidentifikasi gen-gen baru karena tidak diperlukan informasi tentang sekuen genom tanaman.
Pada interaksi Hevea/Corynespora, identifikasi transkrip dengan metode cDNA-AFLP dapat dilakukan dengan membandingkan pola ekspresi transkrip pada tanaman karet resisten maupun rentan selama beberapa waktu interaksi. Pemanfaatan metode cDNA-AFLP dalam studi ekspresi gen diawali dengan memberikan suatu tekanan berupa infeksi C. cassiicola virulen pada daun sehingga menginduksi ekspresi transkrip/gen yang berperan dalam resistensi maupun kerentanan tanaman karet. Daun tersebut merupakan sumber RNA serta mRNA, dan selanjutnya cDNA disintesis dengan menggunakan mRNA sebagai cetakan. Untuk mengidentifikasi transkrip yang terinduksi maupun tertekan ekspresinya selama terjadi interaksi Hevea/Corynespora, digunakan daun yang diambil dari beberapa periode waktu setelah inokulasi.
Strategi tersebut di atas telah banyak digunakan untuk mengidentifikasi gen-gen yang diekspresikan secara diferensial selama terjadi interaksi antara beberapa tanaman dengan patogennya (Cooper 2001; Durrant et al. 2000; Neveau
et al. 2003; Petters et al. 2002; Santaella et al. 2004; Zhang et al. 2003). Di samping itu, gen-gen yang berperan dalam patogenisitas juga dapat diidentifikasi dengan metode yang sama, seperti pada Erwinia carotovora dan Xanthomonas campestris (Dellagi et al. 2000; Noel et al. 2001). Beberapa transkrip asal cendawan mirip dengan kitinase dan arabinitol dehidrogenase sedangkan transkrip asal tanaman menyerupai katanin dan cell enlargement protein (Zhang et al. 2003). Beberapa transkrip lain diinformasikan menyerupai heat shock protein
seperti hsp60, hsp70, hsp90 dan hsp100 (Avrora et al. 2003).
length cDNA, di antaranya adalah melalui skrining tehadap pustaka (library) cDNA (Zhang et al. 2003), atau dengan metode Rapid Amplification of cDNA Ends (RACE) (van der Biezen 2000).
Dalam rangkaian penelitian ini konstruksi pustaka cDNA yang berasal dari daun klon karet resisten yang diberi perlakuan patogen dilaksanakan dengan pertimbangan pada tahap lanjut pustaka tersebut dapat digunakan untuk memperoleh full length cDNA. Pustaka cDNA terdapat dalam bentuk klon-klon cDNA dan merupakan bank yang mengandung informasi genetik tanaman karet. Pustaka tersebut merepresentasikan gen-gen yang diekspresikan dalam suatu jaringan, waktu, atau kondisi tertentu. Pustaka cDNA umumnya diperoleh melalui proses kloning sehingga ratusan gen berbeda memungkinkan untuk dikoleksi dan diperbanyak secara terus menerus. Selanjutnya cDNA spesifik diseleksi dan ditapis (screening) melalui proses hibridisasi (Cowel 1998; Glick dan Pasternak 1994; Kleinsmith dan Kish 1995).
Dalam konstruksi pustaka cDNA, DNA polimerase yang memerlukan RNA (RNA-dependent DNA polymerase) yakni reverse transcriptase (RT)
digunakan untuk meng-copy messenger RNA (mRNA) menjadi molekul
complementary DNA (cDNA) utas ganda. Berbeda dengan mRNA yang dengan mudah terdegradasi dan menggambarkan proses transkripsi dari gen-gen yang aktif pada suatu jaringan atau sel tertentu, cDNA merupakan molekul yang lebih stabil sehingga sesuai untuk disisipkan ke dalam vektor kloning, baik berupa plasmid, cosmid, atau bakteriofage. Populasi mRNA yang telah di copy menjadi cDNA tersebut apabila diklon akan menghasilkan pustaka cDNA yang bersifat permanen. Keuntungan pustaka cDNA adalah hanya mengandung sekuen-sekuen yang terekspresi dalam bentuk mRNA dalam suatu kondisi atau waktu tertentu (Kleinsmith dan Kish 1995). Di samping itu, pustaka cDNA merupakan koleksi informasi genetik tanaman sehingga ketersediaannya akan sangat bermanfaat dalam studi ekspresi gen lainnya.
dalam sistem pertahanan klon karet tertentu terhadap cendawan C. cassiicola, penyebab penyakit gugur daun karet. Berdasarkan informasi tersebut diharapkan dapat diketahui mekanisme resistensi atau kerentanan pada tanaman karet sehingga dapat dijadikan landasan penyusunan strategi untuk mengontrol penyakit secara lebih terarah.
Tujuan Penelitian
Penelitian ini bertujuan untuk mendapatkan transkrip/gen atau bagian gen yang diekspresikan secara diferensial pada klon karet resisten atau klon rentan sebagai respon terhadap infeksi cendawan C. cassiicola. Untuk mencapai tujuan tersebut dilakukan beberapa tahap penelitian sebagai berikut :
(1) Mengidentifikasi perkembangan gejala penyakit dan menetapkan tingkat resistensi beberapa klon karet melalui pengujian inokulasi cendawan C. cassiicola secara terkontrol menggunakan isolat patogen tertentu, sebagai salah satu dasar untuk penetapan waktu pengambilan sampel serta penentuan klon resisten dan rentan yang akan digunakan dalam studi ekspresi gen.
(2) Menetapkan kemiripan genetik beberapa klon karet dengan tingkat resistensi berbeda melalui aplikasi metode AFLP untuk mengetahui latar belakang genetik klon karet yang diuji dan sebagai data pendukung untuk penentuan klon karet resisten dan rentan yang dipilih .
(3) Mengembangkan metode cDNA-AFLP untuk tanaman karet, isolasi
fragmen cDNA spesifik dan proses kloningnya pada vektor yang sesuai untuk digunakan dalam identifikasi transkrip pada tanaman karet.
(4) Mengidentifikasi dan mengisolasi fragmen cDNA spesifik yang
diekspresikan secara diferensial pada saat terjadi interaksi antara tanaman karet dengan C. cassiicola dalam upaya mendapatkan kandidat transkrip/gen atau bagian gen yang berperan dalam mekanisme resistensi tanaman karet terhadap patogen tersebut.
Ruang Lingkup Penelitian
Berdasarkan tujuan penelitian yang akan dicapai, maka kegiatan penelitian untuk pengujian terkontrol tingkat resistensi klon karet dilaksanakan dengan menggunakan sepuluh klon karet (Hevea brasiliensis) yang di lapang telah diketahui tingkat resistensinya terhadap infeksi C. cassiicola. Sebagai patogen digunakan satu isolat virulen C. cassiicola yang telah teruji tingkat virulensinya terhadap berbagai klon karet yang ada. Selanjutnya analisis kemiripan genetik
berdasarkan metode Amplified Fragment Length Polymorphism (AFLP)
dilaksanakan terhadap sepuluh klon karet yang sama. Beberapa pelaksanaan prosedur AFLP dimodifikasi terlebih dahulu untuk mendapatkan kondisi optimal yang sesuai bagi DNA tanaman karet. Dari analisis ini akan diperoleh informasi tentang tingkat kemiripan genetik klon karet resisten, moderat dan rentan yang diuji serta dapat ditentukan satu klon karet resisten dan satu klon rentan untuk digunakan dalam studi ekspresi gen.
Untuk mengidentifikasi transkrip yang berperan dalam resistensi atau kepekaan klon karet terhadap C. cassiicola, digunakan analisis cDNA-AFLP. Analisis cDNA-AFLP dilakukan dengan membandingkan pola ekspresi antara klon karet resisten dan rentan dalam beberapa waktu setelah perlakuan inokulasi patogen. Fragmen cDNA yang diekspresikan secara diferensial, baik antara klon karet resisten dan rentan ataupun antara perlakuan waktu inokulasi patogen pada klon yang sama , akan diisolasi dari gel kemudian diklon pada vektor kloning dan dirunut sekuennya melalui proses sekuensing. Sekuen fragmen cDNA akan dilacak homologinya dengan sekuen yang telah dipublikasi di pangkalan data (database) Genbank sehingga diperoleh gambaran tentang kemungkinan peran transkrip tersebut dalam interaksi inang-patogen. Di samping itu, konstruksi pustaka cDNA dilakukan untuk menyediakan berbagai cDNA asal daun karet yang digunakan untuk mendapatkan full length cDNA melalui proses hibridisasi dengan fragmen cDNA kandidat yang diperoleh melalui analisis cDNA-AFLP.
Gambar 1. Alir penelitian, tujuan dan output pada setiap tahap penelitian
Ekspresi gen-gen responsif terhadap Corynespora cassiicola pada tanaman karet (Hevea brasiliensis Muell.Arg.)
Tujuan : Mendapatkan transkrip/gen/bagian gen yang berhubungan dengan proes pertahanan tanaman karet terhadap C. cassiicola.
Out put : Kandidat transkrip/gen/bagian gen yang berkorelasi dengan resistensi klon karet.
Percobaan 1. Perkembangan gejala penyakit dan pengujian tingkat resistensi klon karet terhadap infeksi C. cassiicola Tujuan : M endapatkan informasi tentang perkembangan gejala penyakit dan tingkat resistensi beberapa klon karet untuk penetapan waktu pengambilan sampel serta
penentuan klon resisten dan rentan yang akan digunakan lebih lanjut
Percobaan 2. Keragaman genetik sepuluh klon karet berdasarkan metode Amplified Fragment Length Polymorphism (AFLP)
Tujuan : Klasifikasi klon karet yang memiliki resistensi berbeda terhadap C. cassiicola
berdasarkan kemiripan genetik sebagai data pendukung penentuan klon resisten dan rentan yang akan digunakan lebih lanjut
Percobaan 4. Konstruksi pustaka cDNA dari daun karet klon AVROS 2037 yang diinfeksi dengan C. cassiicola
Tujuan : M enyediakan material genetik asal daun klon karet resisten Out put : D iperolehnya
pustaka cDNA yang
merepreseantasik an gen yang diekspresikan dalam kondisi tertentu
Percobaan 3. Pengujian metode cDNA-AFLP non-radioaktif untuk identifikasi transkrip asal daun karet
Tujuan : M endapatkan kondisi visualisasi produk cDNA-AFLP asal daun karet Out put : Kondisi optimum yang dapat diterapkan
untuk analisis cDNA-AFLP asal daun karet
Percobaan 5. Identifikasi transkrip pada tanaman karet yang diekspresikan dalam interaksi dengan cendawan Corynespora cassiicola melalui analisis cDNA-AFLP
Tujuan : Identifikasi transkrip/gen/bagian gen yang berhubungan dengan resistensi maupun sensitivitas klon karet terhadap infeksi C. cassiicola
Out put : Kandidat transkrip.gen/bagian gen yang berhubungan dengan mekanisme resistensi klon karet terhadap cendawan C.
cassiicola.
Manfaat Penelitian
Dalam beberapa tahun terakhir ini, terutama dengan berkembang pesatnya teknik-teknik dalam bidang biologi molekuler, berbagai penelitian untuk memahami mekanisme yang mendasari resistensi atau kerentanan tanaman tertentu terhadap infeksi suatu patogen telah banyak dilakukan. Pengetahuan tersebut digunakan sebagai dasar untuk mengatasi serangan patogen secara lebih terarah dan lebih efisien. Namun analisis molekul yang mendasari resistensi atau kerentanan klon karet terhadap infeksi cendawan C. cassiicola belum mendapat perhatian yang cukup sehingga sampai saat ini belum diperoleh informasi yang memadai tentang dasar variasi tingkat resistensi berbagai klon karet di lapang. Dengan adanya potensi kehilanga n produksi secara nasional yang mencapai sekitar 420.000 ton per tahun atau setara dengan nilai sekitar 840 juta US dolar maka pemahaman akan mekanisme resistensi tanaman akan sangat berarti di dalam menetapkan strategi penanggulangan penyakit secara efisie n dan lebih terarah sehingga timbulnya kerugian dapat dicegah.
Di samping sebagai marka , gen tersebut juga dapat diintroduksikan ke berbagai klon karet yang memiliki potensi produksi tinggi namun rentan terhadap
C. cassiicola , sehingga klon dengan produksi tinggi tersebut akan memiliki sifat positif lainnya yaitu resisten terhadap patogen. Secara keseluruhan penerapan hasil penelitian ini untuk riset-riset mendatang yang ditujukan untuk memperbaiki kualitas tanaman karet akan berdampak positif terhadap perkembangan indus tri perkaretan di tanah air.
PERKEMBANGAN GEJALA PENYAKIT DAN PENGUJIAN
TINGKAT RESISTENSI KLON KARET (
Hevea brasiliensis
)
TERHADAP INFEKSI
Corynespora cassiicola
ABSTRAK
Corynespora cassiicola memiliki kemampuan menginfeksi daun tanaman karet dan menyebabkan penyakit gugur daun. Studi ekspresi gen untuk mempelajari transkrip atau gen yang berperan dalam resistensi klon karet terhadap
C. cassiicola memerlukan informasi tentang perkembangan gejala penyakit serta tingkat resistensi klon. Oleh karena itu dalam percobaan ini evaluasi dilakukan terhadap kedua hal tersebut. Informasi yang diperoleh digunakan sebagai salah satu dasar untuk menentukan waktu pengambilan sampel serta jenis klon resisten dan rentan yang dapat dipilih untuk studi ekspresi gen selanjutnya. Penga matan perkembangan gejala penyakit dilakukan terhadap tiga klon, yaitu klon AVROS 2037, PR 300 dan PPN 2444, sedangkan pengujian tingkat resistensi klon dilakukan terhadap sepuluh klon yaitu klon AVROS 2037, BPM 1, PR 255, RRIC 100, IRR 100, GT 1, RRIM 600, RRIC 103, PPN 2444, dan IAN 873. Isolat C. cassiicola cGT1 SS yang telah teruji virulensinya digunakan untuk menginfeksi daun karet umur dua minggu pada bibit di polibeg yang pertumbuhannya telah memiliki dua unit daun. Hasil penelitian menunjukkan bahwa gejala berupa bercak mulai terlihat hari kedua setelah daun diinokulasi dengan konidia C. cassiicola, baik pada klon resisten maupun rentan. Perkembangan gejala berlanjut pada klon rentan sampai akhirnya lebih dari setengah daun mengalami nekrosis, namun gejala terhenti atau tidak berlanjut pada klon resisten. Intensitas penyakit dari klon karet yang diuji berkisar antara 0%-86%. Berdasarkan intensitas penyakit tersebut, klon karet dapat dikelompokkan menjadi sangat resisten (BPM 1), resisten (IRR 100, RRIC 100, AVROS 2037, PR 255), moderat rentan (RRIM 600), dan sangat rentan (RRIC 103, PPN 2444, IAN 873).
Kata kunci: Penyakit gugur daun, Corynespora cassiicola, intensitas penyakit, tingkat resistensi, Hevea brasiliensis.
PENDAHULUAN
Sumatera dan Jawa (Soepena 1983; Situmorang dan Budiman 1984; Hadi et al. 1990). Belakangan dilaporkan bahwa patogen yang sama terdapat pada hampir semua wilayah pertanaman karet di Indonesia, karena juga ditemukan di Kalimantan Barat dan Kalimantan Selatan (Suwarto et al. 1996; Sinulingga et al.
1996; Situmorang 2002).
Penyakit gugur daun dapat menimbulkan kerugian yang amat be sar pada perkebunan karet karena serangan pada klon rentan menyebabkan pengguguran daun secara terus menerus sehingga tajuk tanaman menjadi gundul. Keadaan yang demikian menyebabkan tanaman mengalami pertumbuhan yang sangat terhambat dan apabila serangan terjadi pada tanaman belum menghasilkan maka kriteria matang sadap sangat sulit dicapai sehingga lateks sebagai produk utama dari pohon karet tidak dapat dipanen. Serangan pada tanaman dewasa menyebabkan penurunan produksi lateks secara nyata, dapat mencapai 20 persen, dan apabila serangan berlanjut dapat menyebabkan kematian tanaman secara total (Sabu et al. 2000; Situmorang dan Budiman 1984; Soepena et al. 1996).
Daun adalah organ utama yang diserang oleh C. cassiicola, meskipun dilaporkan juga bahwa infeksi dapat terjadi pada bagian lain tanaman seperti tangkai daun, pucuk serta ranting dan cabang tanaman (Wei 1950; Soepena 1983, Situmorang dan Budiman 1984). Gejala awal serangan terlihat berupa bercak coklat atau hitam pada helaian daun yang menandakan bahwa patogen telah melakukan penetrasi ke jaringan daun. Selanjutnya C. cassiicola mensekresikan toksin ‘cassiicoline’, yang merupakan suatu host-selective toxin (HST) (Breton et al. 1996; Liyanage dan Liyanage 1986).
diduga lebih stabil karena hanya bisa diatasi oleh patogen melalui peningkatan fungsinya (gain of function) (Zhang dan Birch 1997). Berbeda dengan klon resisten, pada klon rentan bercak selanjutnya akan melebar sepanjang tulang daun sehingga terbentuk struktur yang menyerupai sirip tulang ikan. Pada tahap berikutnya sebagian besar daun mengalami nekrosis dan kemudian gugur. Menurut Breton et al. (1996), gejala kerusakan jaringan tanaman karena pengaruh toksin pada klon rentan terjadi dalam waktu relatif singkat, yaitu sekitar 24 jam setelah patogen menginfeksi daun.
Berbagai klon karet yang tersedia saat ini memiliki tingkat resistensi yang berbeda terhadap infeksi C. cassiicola, mulai dari ya ng sangat resisten sampai sangat rentan. Ketersediaan klon karet dengan respon yang demikian memberi peluang untuk mempelajari transkrip atau gen yang diekspresikan secara diferensial oleh klon resisten maupun klon rentan selama terjadi interaksi dengan patogen tersebut.
Metode yang relatif sederhana untuk mengamati perbedaan profil ekspresi gen adalah cDNA-amplified fragment length polymorphism (cDNA -AFLP), yang didasarkan pada reaksi amplifikasi terhadap populasi cDNA secara selektif (Bachem et al. 1996; Bachem et al. 1998). Menurut Zhang et al. (2003) keberhasilan analisis cDNA-AFLP dalam interaksi inang-patogen sangat ditentukan oleh proses pengambilan sampel yang tepat, yaitu sesuai dengan perkembangan gejala penyakit pada tanaman yang diinfeksi.
BAHAN DAN METODE
Bahan tanam karet
Untuk mengamati perkembangan gejala penyakit gugur daun Corynespora, digunakan dua klon karet resisten yaitu PR 300 dan AVROS 2037 serta satu klon rentan PPN 2444 yang dipilih secara acak berdasarkan informasi tingkat resistensinya di lapang. Bahan tanam karet yang digunakan untuk mengevaluasi respon ketahanan klon karet terhadap satu isolat C. cassiicola terdiri atas 10 klon yang ditanam dalam kantong plastik hitam (polibeg) dan diper sia pkan dengan cara okulasi. Kesepuluh klon tersebut adalah AVROS 2037, BPM 1, PR 255, RRIC 100, IRR 100, GT 1, RRIM 600, RRIC 103, PPN 2444, dan IAN 873.
Okulasi dilaksanakan di kebun Cikasungka PT Perkebunan Negara VIII (Jawa Barat) dengan cara menempelkan mata tunas batang atas masing-masing klon ke batang bawah yang berasal dari biji klon GT 1. Duplikat setiap klon dibuat paling tidak sebanyak 10 tanaman. Semua bahan tanam ditumbuhkan di dalam kantong plastik hitam berisi campuran tanah dan pupuk kandang (3 : 1) dan dipelihara di rumah kaca. Tanaman disiram setiap hari, serta dipupuk dengan pupuk N, P, K dan Mg sekali dalam sebula n, dengan dosis 10 gr/tanaman. Untuk menginduksi pembentukan tunas-tunas baru dilakukan pemangkasan sedangkan untuk mencegah serangan hama dan patogen, terutama pada daun-daun muda yang baru tumbuh dilakukan penyemprotan dengan belerang dan obat anti hama.
Isolat C. cassiicola
Sebanyak 8 - 10 potong biakan isolat tersebut (diameter 5 mm) diletakkan dengan posisi terbalik pada permukaan bawah daun karet steril dalam cawan Petri sehingga bagian miselia dapat kontak secara langsung dengan permukaan daun. Daun yang digunakan adalah daun dari klon karet asal isolat agar patogenitas isolat dapat dipertahankan. Dengan demikian untuk memproduksi konidia dalam percobaan ini digunakan daun karet klon GT 1 karena isolat diisolasi dari daun klon tersebut. Setelah 3 - 4 hari daun dibalikkan dan 4 - 5 hari kemudian konidia akan terbentuk pada bagian atas permukaan daun (Gambar 2 B).
A B
Gambar 2. (A) Pembentukan miselia Corynespora cassiicola pada media ASK, (B) Pembentukan konidia pada permukaan daun (tanda panah)
Untuk mengumpulkan konidia dari permukaan daun terlebih dahulu daun dikering-anginkan selama satu hari agar pelepasan konidia dari tangkainya lebih mudah. Konidia dilepaskan dari permukaan daun dengan menggunakan kuas, dimasukkan dalam erlenmeyer berisi air dan kemudian disaring dengan kasa nilon untuk memisahkan konidia yang menggumpal. Konsentrasi konidia di dalam air dibuat sekitar 4 x 104 konidia/ml, yang dihitung dengan menggunakan
haemocytometer melalai pengamatan dengan mikroskop.
Inokulasi, skoring gejala dan penentuan tingkat kerusakan daun
kondisi pertumbuhan yang demikian pada masing-masing unit daun umumnya terdapat 9 tangkai daun dan setiap tangkai daun mendukung tiga daun (trifoliat). Inokula si konidia untuk masing-masing klon dilakukan pada 12 daun yang memiliki umur relatif sama . Daun yang telah diinokulasi kemudian disungkup dengan kantong plastik transparan sekitar 2-3 hari, sungkup plastik selanjutnya dilepas dan inkubasi diteruskan sampai hari ke dua belas. Pengamatan gejala penyakit dilakukan pada hari ke 0, 1, 2, 3, 4, 8 dan 12 hari setelah inokulasi sedangkan skoring gejala dilakukan pada hari ke-12.
Penentuan tingkat kerusakan daun didasarkan pada empat skala, yaitu: 0 : tidak ada gejala klorosis/nekrosis, 1 : ada gejala bercak coklat kehitaman, 2 : 1 – 50% daun kuning kecoklatan, 3 : 51 – 100% daun kuning kecoklatan atau gugur.
Hasil skala serangan dimasukkan ke rumus Towsendt dan Hueberger (Unterstenhover, 1963), sbb :
Σ(n x v)
I = --- x 100% Z x N
dengan keterangan, I n v Z N
= = = = =
Indeks tingkat kerusakan daun/intensitas penyakit Banyaknya daun dalam setiap kategori kerusakan Nilai kategori kerusakan
Nilai kategori kerusakan tertinggi Banyaknya daun yang diamati
Dari nilai di atas kemudian dapat ditentukan kelompok masing-masing klon, yaitu :
0% = tanaman sangat resisten
> 0 – 33% = tanaman resisten 34 – 67% = tanaman moderat rentan 68 – 100% = tanaman sangat rentan
HASIL
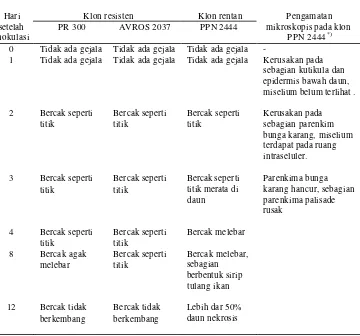
Perkembangan Gejala Penyakit Gugur Daun
[image:37.612.144.504.301.637.2]Pengamatan secara makroskopis pada permukaan daun klon AVROS 2037, PR 300 dan PPN 2444 pada hari pertama setelah inokulasi tidak menunjukkan adanya gejala penyakit. Gejala bercak seperti titik berwarna coklat tua dan kadang-kadang hitam mulai terlihat pada hari kedua setelah inokulasi, baik pada klon resisten AVROS 2037 dan PR 300, maupun pada klon rentan PPN 2444 (Tabel 1).
Tabel 1. Perkembangan gejala penyakit gugur daun pada klon karet PR 300, AVROS 2037 dan PPN 2444.
Klon resisten Klon rentan Hari setelah inokulasi
PR 300 AVROS 2037 PPN 2444
Pengamatan mikroskopis pada klon
PPN 2444 *) 0 1 2 3 4 8 12
Tidak ada gejala Tidak ada gejala
Bercak seperti titik
Bercak seperti titik
Bercak sep erti titik
Bercak agak melebar
Bercak tidak berkembang
Tidak ada gejala Tidak ada gejala
Bercak seperti titik Bercak seperti titik Bercak seperti titik Bercak seperti titik Bercak tidak berkembang
Tidak ada gejala Tidak ada gejala
Bercak seperti titik
Bercak seperti titik merata di daun Bercak melebar Bercak melebar, sebagian berbentuk sirip tulang ikan
Lebih dar 50% daun nekrosis
-
Kerusakan pada sebagian kutikula dan epidermis bawah daun, miselium belum terlihat .
Kerusakan pada sebagian parenkim bunga karang, miselium terdapat pada ruang intraseluler.
Parenkim a bunga karang hancur, sebagian parenkima palisade rusak
*) Sumber Rouli (1987).
yang berarti pada klon AVROS 2037 dan PR 300. Dengan bertambahnya waktu, gejala bercak pada klon PPN 2444 semakin melebar, beberapa di antaranya berkembang di sekitar tulang daun sehingga menyerupai sirip tulang ikan dan setelah 12 hari lebih dari setengah permukaan daun mengalami gejala nekrosis dan kemudian daun menggulung (Gambar 3). Umumnya dalam kondisi yang demikian daun tidak mampu bertahan dan kemudian gugur. Sebaliknya gejala pada klon AVROS 2037 dan PR 300 hampir tidak berkembang, setelah 8 hari hanya terlihat sedikit bercak, beberapa bercak agak melebar, namun setelah itu tidak terjadi perkembangan lebih lanjut.
Gejala nekrotik AVROS 2037 PPN 2444
Gambar 3. Pe nampakan gejala penyakit gugur daun pada klon karet resisten (AVROS 2037) dan rentan (PPN 2444) akibat infeksi C. cassiicola
pada permukaa n bawah daun karet, setelah 12 hari inokulasi.
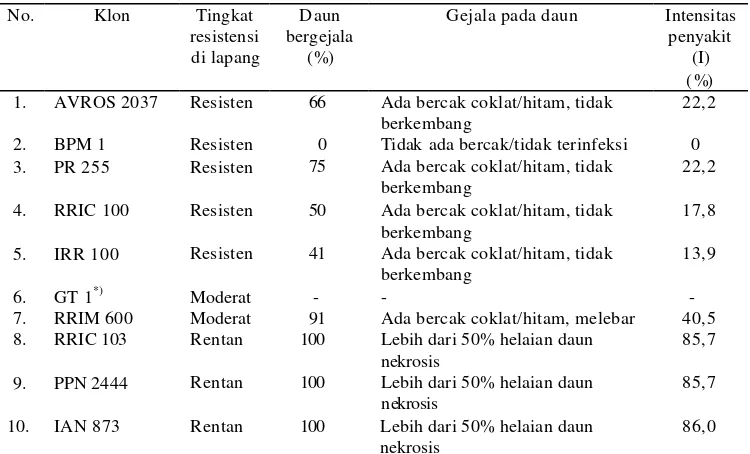
Tingkat Resistensi Sepuluh Klon Karet terhadap Infeksi C. cassiicola
Secara umum klon yang dilaporkan memiliki resistensi tinggi di lapang ternyata juga menunjukkan respon yang sama dalam pengujian terkontr ol dengan isolat yang digunakan dalam penelitian ini. Demikian juga hal-nya klon yang digolongkan rentan di lapang juga memberikan respon kerentanan yang tinggi (Tabel 2).
[image:38.612.224.434.293.460.2]klon resisten, klon BPM 1 menunjukkan intensitas penyakit paling rendah (I = 0%), yang mengindikasikan bahwa klon tersebut memiliki resistensi paling tinggi karena tidak ditemukan adanya infeksi patogen pada permukaan daun. Kemudian diikuti oleh klon IRR 100, RRIC 100, AVROS 2037 dan PR 255 (0% I 33%), klon moderat RRIM 600 (34% I 67%), dan 3 klon sangat rentan yaitu RRIC 103, PPN 2444 dan IAN 873 (68% I 100%) (Tabel 2). Berdasarkan persentase intensitas penyakit tersebut, maka klon karet yang diuji dapat digolongkan dalam kelompok sangat resisten (BPM 1), resisten (IRR 100, RRIC 100, AVROS 2037, PR 255), moderat rentan (RRIM 600), dan sangat rentan (RRIC 103, PPN 2444, IAN 873).
Tabel 2. Gejala dan intensitas penyakit pada pengujian terkontrol klon karet terhadap C. cassiicola.
No. Klon Tingkat resistensi
di lapang
D aun bergejala
(%)
Gejala pada daun Intensitas penyakit (I) (%) 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. AVROS 2037 BPM 1 PR 255 RRIC 100 IRR 100
GT 1*) RRIM 600 RRIC 103 PPN 2444 IAN 873 Resisten Resisten Resisten Resisten Resisten Moderat Moderat Rentan Rentan Rentan 66 0 75 50 41 - 91 100 100 100
Ada bercak coklat/hitam, tidak berkembang
Tidak ada bercak/tidak terinfeksi Ada bercak coklat/hitam, tidak berkembang
Ada bercak coklat/hitam, tidak berkembang
Ada bercak coklat/hitam, tidak berkembang
-
Ada bercak coklat/hitam, melebar Lebih dari 50% helaian daun nekrosis
Lebih dari 50% helaian daun nekrosis
Lebih dari 50% helaian daun nekrosis 22,2 0 22,2 17,8 13,9 - 40,5 85,7 85,7 86,0
*) Tidak diinokulasi karena daun umur ± 2 minggu tidak tersedia
PEMBAHASAN
telah mulai pada lapisan kutikula dan epidermis bawah daun (Tabel 1). Meskipun demikian miselium cendawan belum terlihat pada ruang sel. Pada hari kedua setelah inokulasi, kerusakan berlanjut pada sebagian parenkima bunga karang sedangkan miselium cendawan mulai terlihat pada ruang intraseluler. Hari berikutnya kerusakan lapisan jaringan daun semakin banyak, dimana lapisan parenkima bunga karang hancur dan kerusakan terjadi pada sebagian lapisan parenkima palisade. Hal tersebut sejalan dengan pengamatan secara visual yang dilakukan dalam penelitian ini.
Pengujian tingkat resistensi menunjukkan bahwa 5 klon yaitu klon AVROS 2037, BPM 1, PR 255, RRIC 100 dan IRR 100 me miliki kemampuan untuk mengatasi infeksi C. cassiicola isolat cGT1 SS. Selain BPM 1, ke-empat klon lainnya dapat diinfeksi oleh patogen, yang ditandai dengan terbentuknya bercak coklat atau hitam pada helaian daun, namun bercak tidak berkembang lebih lanjut. Pada klon RRIM 600 bercak melebar yang menandakan terjadinya perkembangan patogen, namun masih terbatas pada beberapa bagian helaian daun. Perkembangan patogen yang sangat signifikan dengan kerusakan daun terjadi pada 3 klon, yaitu RRIC 103, PPN 2444 dan IAN 873, dimana hampir seluruh permukaan daun mengalami nekrosis.
BPM 1 terinfeksi ringan oleh tiga isolat C. cassiicola virulen yang diinokulasikan pada daun (Hadi 2003) .
Laporan tentang tingkat resistensi klon AVROS 2037 di berbagai lokasi perkebunan karet tidak banyak ditemukan. Namun di Jambi dilaporkan bahwa klon tersebut tidak terserang oleh C. cassiicola dan dalam klasifikasi tingkat resistensi klon yang dilaporkan oleh Pusat Penelitian Karet (1992), klon AVROS 2037 termasuk klon yang sangat resisten. Pada pengujian secara terkontrol dengan menggunakan tiga macam isolat C. cassiicola, respon klon AVROS 2037 dilaporkan bervariasi (Hadi 2003). Hal tersebut ditunjukkan dari intensitas penyakit klon AVROS 2037 terhadap isolat Cc1 (isolat dari Kalimantan Selatan) adalah 20%, terhadap isolat Cc2 (isolat Jawa Tengah) adalah 30% dan terhadap isolat Cc3 (isolat Sumatera Selatan) adalah 43%. Hasil penelitian ini menunjukkan klon AVROS 2037 memiliki intensitas penyakit sebesar 22,2%.
Di berbagai sentra perkebunan karet dilaporkan bahwa klon PR 255 tidak terserang oleh C. cassiicola (Suwarto et al. 1996; Situmorang 2002). Dalam daftar klon anjuran, klon PR 255 tergolong dalam klon dengan resistensi tinggi terhadap infeksi C. cassiicola dan termasuk dalam klon anjuran skala besar (Pusat Penelitian Karet 1992). Hal yang sama juga dilaporkan pada klon RRIC 100 yang juga termasuk klon anjuran skala besar dengan tingkat resistensi tinggi terhadap infeksi patogen yang sama (Pusat Penelitian Karet 1992). Pengamatan di berbagai sentra perkebunan di Indonesia menunjukkan bahwa klon RRIC 100 tidak terserang C. cassiicola (Suwarto et al. 1996; Situmorang 2002). Hadi (2003) melaporkan bahwa klon RRIC 100 menunjukkan respon resistensi tinggi terhadap 3 isolat C. cassiicola yang berbeda. Klon RRIM 600 meskpun sebelumnya termasuk dalam klon anjuran skala besar (Pusat Penelitian Karet 1992), namun belakangan diketahui merupakan klon yang mengalami kerusakan cukup berat di beberapa sentra perkebunan karet (Sinulingga et al. 1996; Suwarto et al. 1996; Situmorang 2002).
perkembangan patogen ke areal tanaman sehat. Saat ini klon RRIC 103 dan beberapa seri PPN hanya dite mukan di lembaga penelitian dan penggunaannya terbatas hanya untuk aktivitas penelitian.
Heath (1980) mengemukakan bahwa dari sisi tanaman, resistensi terhadap patogen umumnya diikuti oleh suatu reaksi yang dapat dideteksi. Reaksi tersebut dapat dibedakan atas dua kategori, pertama adalah perubahan tanaman secara morf ologi dan kedua adalah perubahan fungsi yang berhubungan dengan proses metabolisme atau fisiologis tanaman. Perubahan morfologi biasanya hanya dapat diamati melalui penggunaan mikroskop karena gejala penyakit seperti yang terjadi pada tanaman rentan tidak muncul pada tanaman resisten. Salah satu perubahan morfologi tanaman setelah diinokulasi dengan cendawan patogen adalah tejadinya penebalan pada dinding sel akibat deposisi bahan yang terbentuk antara dinding sel dan membran sel, dan secara umum disebut sebagai papila. Komponen papila sangat bervariasi, antara lain bisa berupa kalose, selulose, pektin, suberin , tilose maupun lignin (Heath 1980; Ride dan Pearce 1979). Pembentukan papila dapat terjadi pada tanaman resisten dan rentan, namun juga dapat terjadi hanya pada tanaman resisten (Bushnell dan Berquist 1975; Vance dan Sherwood 1976). Perubahan pada tingkat fisiologi dan metabolisme sering berhubungan dengan sintesis suatu protein, enzim ataupun senyawa fenolik dan fitoaleksin.
Dalam interaksi H. brasiliensis/C. cassiicola, antara klon resisten dan rentan tidak terdapat perbedaan kecepatan penetrasi cendawan. Artinya patogen yang sama memiliki kemampuan untuk menembus lapisan permukaan daun, baik pada klon resisten maupun klon rentan dan kemudian masuk ke dalam jaringan tanaman. Oleh karena itu dapat dipahami bahwa ketebalan kutikula, epidermis ataupun pembentukan lapisan lignin pada dinding sel bukan merupakan mekanisme yang digunakan klon karet resisten untuk bertahan terhadap serangan patogen tersebut (Breton et al. 2000).
menimbulkan dugaan bahwa klon resisten memiliki suatu molekul yang disandikan oleh suatu gen tertentu sehingga mampu mengenal atau langsung mengatasi perkembangan cendawan. Hal ini diperkuat oleh kenyataan bahwa ketika menginfeksi tanaman karet, C. cassiicola mengeluarkan toksin (Onesirosan
et al., 1975; Liyanage dan Liyanage 1986; Purwantara 1987; Suwarto 1989; Breton et al. 1996; Breton et al. 2000) . Toksin yang disebut sebagai ‘cassiicolin’ diduga merupakan faktor penentu utama dalam patogenisitas C. cassiicola.
Cassiicolin merupakan Host-selectiv e toxins (HST), termasuk dalam kelompok glikoprotein dengan berat molekul sekitar 21 kDa (Breton dan d’Auzac 1999).
Kemampuan tanaman resisten mengatasi penyebaran toksin melalui aktivasi gen telah dilaporkan pada interaksi antara tanaman jagung yang memiliki alel dominan pada lokus Hm1 dengan cendawan patogen Cochliobolus carbonum
ras 1. Gen Hm1 menyandikan karbonil reduktase, HC-