SKRIPSI
MEMPELAJARI PERTUMBUHAN Clostridium butyricum PADA PATI RESISTAN BERAS DAN SAGU SERTA PROFIL ASAM LEMAK RANTAI
PENDEK YANG DIHASILKANNYA
Oleh
PRIYANKA PRIMA DEWI F24051954
2009
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
MEMPELAJARI PERTUMBUHAN Clostridium butyricum PADA PATI RESISTAN BERAS DAN SAGU SERTA PROFIL ASAM LEMAK RANTAI
PENDEK YANG DIHASILKANNYA
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN pada Departemen Ilmu dan Teknologi Pangan
Fakultas Teknologi Pertanian Institut Pertanian Bogor
Oleh
PRIYANKA PRIMA DEWI F24051954
2009
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
MEMPELAJARI PERTUMBUHAN Clostridium butyricum PADA PATI RESISTAN BERAS DAN SAGU SERTA PROFIL ASAM LEMAK RANTAI
PENDEK YANG DIHASILKANNYA
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN pada Departemen Ilmu dan Teknologi Pangan
Fakultas Teknologi Pertanian Institut Pertanian Bogor
Oleh
PRIYANKA PRIMA DEWI F24051954
Dilahirkan pada tanggal 28 Desember 1986 di Bojonegoro, Jawa Timur
Tanggal Lulus : 9 Desember 2009
Menyetujui,
Prof. Maggy Thenawidjaja Suhartono Dosen Pembimbing
Mengetahui,
Dr. Ir. Dahrul Syah
Priyanka Prima Dewi. F24051954. Mempelajari Pertumbuhan Clostridium butyricum Pada Pati Resistan Beras dan Sagu serta Profil Asam Lemak Rantai Pendek yang dihasilkannya. Di bawah bimbingan Maggy T. Suhartono. 2009
Ringkasan
Beberapa tahun terakhir ini, kanker kolon menjadi perhatian masyarakat karena termasuk dalam 3 (tiga) besar penyebab kematian di dunia. Adanya peningkatan kasus tersebut mendorong masyarakat untuk lebih memperhatikan kesehatan saluran pencernaan. Salah satu cara untuk menjaga kesehatan saluran pencernaan dan mencegah kanker kolon adalah dengan menjaga pangan yang dikonsumsi serta menjalani pola hidup sehat. Pati resistan telah diteliti dapat berperan sebagai serat pangan dan prebiotik. Di kolon, pati resistan difermentasi dan menghasilkan asam lemak rantai pendek (SCFA) yang memiliki efek fisiologis bagi tubuh, terutama dalam menjaga kesehatan saluran pencernaan. Profil SCFA yang diproduksi tergantung jenis substrat, karakteristik substrat serta jenis bakteri yang memfermentasinya. Fermentasi pati resistan di kolon telah terbukti menghasilkan rasio butirat paling tinggi dibandingkan dengan serat pangan lain. Asam butirat berperan mencegah kanker kolon dan sebagai energi bagi colonocytes.
Salah satu sifat kimiawi penting yang berpengaruh pada proses fermentasi di kolon adalah rasio amilosa dan amilopektin pati. Beras dan sagu sebagai bahan pangan sumber karbohidrat yang banyak dikonsumsi masyarakat Indonesia memiliki perbedaan karakter baik secara fisik maupun kimia. Oleh karena itu, penelitian untuk mengetahui pengaruh karakter kimiawi substrat terhadap pertumbuhan Clostridium butyricum BCC B2571 dan profil metabolit yang dihasilkannya perlu dilakukan. Penelitian ini memanfaatkan sumber pati lokal yakni beras Cisokan dan sagu asal Sukabumi dalam bentuk pati resistan tipe 3.
Metodologi penelitian meliputi : 1) analisis kimiawi mencakup kadar pati, kadar pati resistan, kadar amilosa, dan uji aktivitas enzim pendegradasi pati, 2) fermentasi pati resistan secara in vitro, dan 3) analisis metabolit SCFA menggunakan kromatografi gas. Uji statistik yang digunakan adalah uji univariate dan duncan dengan taraf signifikansi 5% menggunakan SPSS 15.
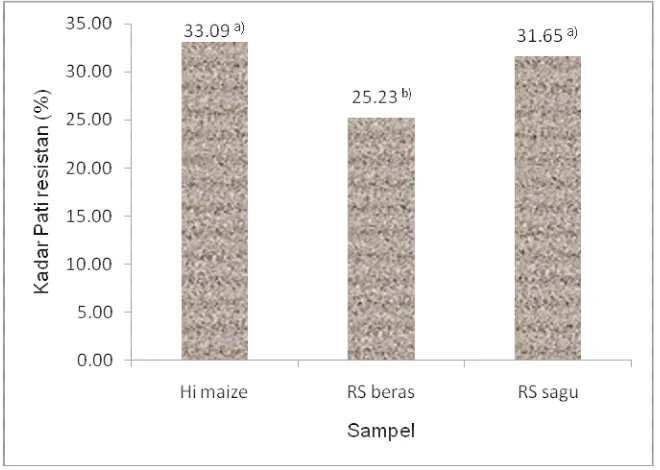
Hasil analisis amilosa pati sagu dan beras secara berurutan adalah 45.30% dan 38.93%. Sementara kadar pati resistan sagu dan beras yang terbentuk adalah 31.65% dan 25.23%. Proses pembuatan pati resistan (RS) yang diaplikasikan pada kedua pati tersebut adalah proses retrogradasi yang menyebabkan struktur amilosa membentuk kristal yang bersifat resistan terhadap enzim amilolisis. Sementara hasil uji menunjukkan kadar pati resistan kontrol yang digunakan, Hi maize adalah 33.09% dengan kadar amilosa 63.36%.
Pertumbuhan Clostridium butyricum BCC B2571 yang diamati dengan metode Total Plate Count menunjukkan jumlah koloni pada Hi maize dan RS sagu mencapai log 10 CFU/ml, sedangkan pada RS beras hanya log 5 CFU/ml. Kecepatan tumbuh bakteri pada pati Hi maize, RS sagu dan RS beras adalah 0.1915; 0.1456 dan 0.0730. Adanya pertumbuhan bakteri pada ketiga substrat menunjukkan bahwa Clostridium butyricum BCC B2571 mampu memanfaatkan pati beramilosa tinggi dengan kecepatan tumbuh yang berbeda.
amilase bakteri pada fermentasi jam ke-30 dan 48 diuji dengan metode agar plate. Aktivitas enzim tersebut akan menghasilkan zona bening yang luasannya diukur dengan plannimeter. Hasil uji menunjukkan pada jam ke-30 aktivitas amilase bakteri pada ketiga substrat uji menghasilkan zona bening dengan luasan yang tidak berbeda nyata, artinya bakteri memanfaatkan ketiga sumber pati dalam jumlah yang hampir sama. Pada jam ke-48, aktivitas amilase tertinggi adalah pada RS beras dengan luas zona bening sebesar 5.27 cm2. Nilai ini tidak berbeda nyata dengan RS sagu yang sebesar 4.86 cm2. Sementara zona bening pada kontrol Hi maize bernilai terendah yakni 3.42 cm2. Ini membuktikan RS sagu dan RS beras lebih mudah didegradasi oleh enzim amilase bakteri dan digunakan oleh bakteri untuk pertumbuhannya. Sementara Hi maize lebih bersifat resistan terhadap aktivitas enzim amilase bakteri, karena struktur granularnya yang stabil dan resistan terhadap enzim.
Penurunan pH yang terjadi selama fermentasi pada ketiga substrat mengindikasikan terbentuknya asam lemak rantai pendek (SCFA). Analisis SCFA dengan kromatografi gas menunjukkan bahwa asetat dan butirat pada Hi maize dan RS beras terbentuk dalam jumlah yang dapat terdeteksi oleh alat, namun tidak demikian halnya dengan RS sagu. Diketahui limit deteksi kromatografi gas yang digunakan adalah 10 mM, sehingga dapat disimpulkan bahwa kadar asetat dan butirat yang diproduksi RS sagu kurang dari 10 mM. Hasil analisa SCFA menunjukkan bahwa secara umum asetat diproduksi dalam jumlah yang lebih besar dibandingkan butirat pada kedua RS. Sementara kadar asetat dan butirat pada kontrol Hi maize dihasilkan lebih besar dibandingkan pada RS beras.
Selama fermentasi Hi maize, kadar asetat meningkat dari 83.17 mM menjadi 118.10 mM, sedangkan kadar butirat menurun dari 95.19 mM menjadi 40.24 mM. Sementara pada RS beras, kadar asetat menurun dari 95.68 mM menjadi 27.85 mM. Butirat pada jam ke-30 belum terbentuk dan mulai terbentuk pada jam ke-48 sebesar 16.29 mM. Berdasarkan jalur metabolisme glukosa secara anaerob oleh Clostridium butyricum, terdapat kemungkinan bahwa produksi kedua asam lemak tersebut melalui jalur aktivitas enzim Co-a transferase.
RIWAYAT HIDUP PENULIS
Nama lengkap penulis Priyanka Prima Dewi, anak pertama dari 2 bersaudara. Penulis dilahirkan di Bojonegoro, pada tanggal 28 Desember 1986. Setelah lulus dari SMA Negeri 1 Cilegon, penulis melanjutkan pendidikannya di Institut Pertanian Bogor dengan mayor Ilmu dan Teknologi Pangan melalui jalur PMDK.
Selama kegiatan perkuliahan penulis aktif di beberapa organisasi, antara lain Himpunan Mahasiswa Ilmu dan Teknologi Pangan, Food Chat Club dan Food Processing Club. Penulis juga sering mengikuti Seminar dan Training, seperti HACCP (2008), Training Food Safety Management System ISO 22000:2005 (2008) dan Journalistic Training (2007). Selain mengikuti seminar dan pelatihan, penulis juga menjadi asisten praktikum biologi dasar (2008).
Pada tahun 2008, penulis beserta timnya memperoleh dana PKMK dari Direktorat Jendral Pendidikan Tinggi Republik Indonesia. Beberapa karya penulis dipresentasikan pada ajang National Student Conference, UNIKA Semarang (2008) dan Symposium Go Organic, Bangkok (2009). Karya tulis penulis yang dipresentasikan dalam bentuk poster pada Symposium Go Organic meraih penghargaan silver dan dipublikasikan pada Asian Journal of Food and Agro-Industry.
KATA PENGANTAR
Syukur Alhamdulillah penulis panjatkan kepada Allah SWT, karena dengan izin-Nya penulis dapat merampungkan tugas akhir ini. Penelitian yang dilakukan penulis tidak akan dapat terlaksana dengan baik tanpa dukungan dan bantuan dari berbagai pihak, baik secara moral maupun finansial. Oleh karena itu, penulis menghaturkan terima kasih kepada :
1. Kedua orang tua; Mama dan Papa (alm) atas kasih sayang dan perhatian yang mereka berikan. Terima kasih karena selalu memotivasi penulis untuk maju dan menjadi pribadi yang lebih baik setiap waktu.
2. Adikku tersayang; Bastian Arifandi atas semangat dan hari-hari kehidupan yang dijalani bersama.
3. Ibu Maggy T. Suhartono atas bimbingan dan motivasinya selama masa perkuliahan dan penelitian penulis.
4. Ibu Endang Yuli P. atas dukungan, motivasi dan pelajaran hidup yang diberikan kepada penulis selama penelitian.
5. Ibu Suliantari dan Bapak Sukarno atas kesediaannya sebagai penguji.
6. Sahabat-sahabat penulis: Rian W.U, Dini M, Vera dan Bayu Dwi A atas waktu dan semangat yang mengisi hari-hari penulis dalam suka dan duka.
7. Saptiadi Oktora atas perhatian dan motivasi yang diberikan kepada penulis setiap waktu.
8. Teman-teman penulis; Icha, Mutiara, Fahmi, Tri O., Rino, Tuti, Yelita, Harist G, Mike, Pratiwi R., Yuni D.K, Aji, Hurry dan teman ITP lainnya atas
kebersamaan dan inspirasi yang diberikan selama ini, serta teman lab di FAPET; Putri, Risma dan Ajeng yang menemani penulis selama penelitian di FAPET, IPB.
9. Bapak Wahid, Pak Edi, Pak Rozak, Pak Sidik, Ibu Yani (Mikrobiologi, FAPET), Pak Yudi (Balai Paska Panen) dan teknisi laboratorium yang telah mengajarkan banyak hal kepada penulis selama melaksanakan penelitian. 10. Pihak-pihak lain yang tidak dapat penulis sebutkan pada lembar ini yang
‘Tak ada gading yang tak retak’, begitu pula dengan karya ini. Karena itu penulis memohon maaf jika terdapat kesalahan atau hal tidak berkenan. Semoga karya ini dapat bermanfaat dan menjadi inspirasi bagi para pembaca.
Bogor, November 2009
DAFTAR ISI
Kata Pengantar ... i
Daftar Isi ... iii
Daftar Tabel ... v
Daftar Gambar ... vi
Daftar Lampiran ... vii
I. PENDAHULUAN A. LATAR BELAKANG ... 1
B. TUJUAN PENELITIAN ... 2
C. MANFAAT PENELITIAN ... 2
II. TINJAUAN PUSTAKA A. PATI RESISTAN ... 3
B. BAKTERI Clostridium butyricum ... 5
C. ASAM LEMAK RANTAI PENDEK (SCFA) ... 7
III. METODOLOGI PENELITIAN A. BAHAN DAN ALAT ... 10
B. METODE PENELITIAN 1. Pembuatan Medium RCM ... 10
2. Aktivasi kultur dan fermentasi in vitro ... 11
C. METODE ANALISIS 1. Kadar air ... 13
2. Kadar abu ... 13
3. Kadar protein ... 14
4. Kadar lemak ... 14
5. Kadar karbohidrat ... 14
6. Kadar pati ... 15
7. Kadar amilosa ... 15
8. Persiapan sampel analisis kadar pati resistan ... 16
10. Analisis degradasi pati metode agar plate ... 17
11. Pengukuran pertumbuhan bakteri ... 18
12. Metode analisa SCFA ... 18
13. Analisis statistik ... 19
IV. HASIL DAN PEMBAHASAN A. Karakteristik kimiawi pati resistan ... 20
B. Pertumbuhan Clostridium butyricum BCC B2571 ... 25
C. Profil pertumbuhan bakteri Clostridium butyricum BCC B2571 ... 32
D. Profil metabolit SCFA hasil fermentasi pati resistan ... 34
V. KESIMPULAN DAN SARAN ... 43
A. KESIMPULAN ... 43
B. SARAN ... 44
DAFTAR PUSTAKA ... 45
SKRIPSI
MEMPELAJARI PERTUMBUHAN Clostridium butyricum PADA PATI RESISTAN BERAS DAN SAGU SERTA PROFIL ASAM LEMAK RANTAI
PENDEK YANG DIHASILKANNYA
Oleh
PRIYANKA PRIMA DEWI F24051954
2009
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
MEMPELAJARI PERTUMBUHAN Clostridium butyricum PADA PATI RESISTAN BERAS DAN SAGU SERTA PROFIL ASAM LEMAK RANTAI
PENDEK YANG DIHASILKANNYA
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN pada Departemen Ilmu dan Teknologi Pangan
Fakultas Teknologi Pertanian Institut Pertanian Bogor
Oleh
PRIYANKA PRIMA DEWI F24051954
2009
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
MEMPELAJARI PERTUMBUHAN Clostridium butyricum PADA PATI RESISTAN BERAS DAN SAGU SERTA PROFIL ASAM LEMAK RANTAI
PENDEK YANG DIHASILKANNYA
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN pada Departemen Ilmu dan Teknologi Pangan
Fakultas Teknologi Pertanian Institut Pertanian Bogor
Oleh
PRIYANKA PRIMA DEWI F24051954
Dilahirkan pada tanggal 28 Desember 1986 di Bojonegoro, Jawa Timur
Tanggal Lulus : 9 Desember 2009
Menyetujui,
Prof. Maggy Thenawidjaja Suhartono Dosen Pembimbing
Mengetahui,
Dr. Ir. Dahrul Syah
Priyanka Prima Dewi. F24051954. Mempelajari Pertumbuhan Clostridium butyricum Pada Pati Resistan Beras dan Sagu serta Profil Asam Lemak Rantai Pendek yang dihasilkannya. Di bawah bimbingan Maggy T. Suhartono. 2009
Ringkasan
Beberapa tahun terakhir ini, kanker kolon menjadi perhatian masyarakat karena termasuk dalam 3 (tiga) besar penyebab kematian di dunia. Adanya peningkatan kasus tersebut mendorong masyarakat untuk lebih memperhatikan kesehatan saluran pencernaan. Salah satu cara untuk menjaga kesehatan saluran pencernaan dan mencegah kanker kolon adalah dengan menjaga pangan yang dikonsumsi serta menjalani pola hidup sehat. Pati resistan telah diteliti dapat berperan sebagai serat pangan dan prebiotik. Di kolon, pati resistan difermentasi dan menghasilkan asam lemak rantai pendek (SCFA) yang memiliki efek fisiologis bagi tubuh, terutama dalam menjaga kesehatan saluran pencernaan. Profil SCFA yang diproduksi tergantung jenis substrat, karakteristik substrat serta jenis bakteri yang memfermentasinya. Fermentasi pati resistan di kolon telah terbukti menghasilkan rasio butirat paling tinggi dibandingkan dengan serat pangan lain. Asam butirat berperan mencegah kanker kolon dan sebagai energi bagi colonocytes.
Salah satu sifat kimiawi penting yang berpengaruh pada proses fermentasi di kolon adalah rasio amilosa dan amilopektin pati. Beras dan sagu sebagai bahan pangan sumber karbohidrat yang banyak dikonsumsi masyarakat Indonesia memiliki perbedaan karakter baik secara fisik maupun kimia. Oleh karena itu, penelitian untuk mengetahui pengaruh karakter kimiawi substrat terhadap pertumbuhan Clostridium butyricum BCC B2571 dan profil metabolit yang dihasilkannya perlu dilakukan. Penelitian ini memanfaatkan sumber pati lokal yakni beras Cisokan dan sagu asal Sukabumi dalam bentuk pati resistan tipe 3.
Metodologi penelitian meliputi : 1) analisis kimiawi mencakup kadar pati, kadar pati resistan, kadar amilosa, dan uji aktivitas enzim pendegradasi pati, 2) fermentasi pati resistan secara in vitro, dan 3) analisis metabolit SCFA menggunakan kromatografi gas. Uji statistik yang digunakan adalah uji univariate dan duncan dengan taraf signifikansi 5% menggunakan SPSS 15.
Hasil analisis amilosa pati sagu dan beras secara berurutan adalah 45.30% dan 38.93%. Sementara kadar pati resistan sagu dan beras yang terbentuk adalah 31.65% dan 25.23%. Proses pembuatan pati resistan (RS) yang diaplikasikan pada kedua pati tersebut adalah proses retrogradasi yang menyebabkan struktur amilosa membentuk kristal yang bersifat resistan terhadap enzim amilolisis. Sementara hasil uji menunjukkan kadar pati resistan kontrol yang digunakan, Hi maize adalah 33.09% dengan kadar amilosa 63.36%.
Pertumbuhan Clostridium butyricum BCC B2571 yang diamati dengan metode Total Plate Count menunjukkan jumlah koloni pada Hi maize dan RS sagu mencapai log 10 CFU/ml, sedangkan pada RS beras hanya log 5 CFU/ml. Kecepatan tumbuh bakteri pada pati Hi maize, RS sagu dan RS beras adalah 0.1915; 0.1456 dan 0.0730. Adanya pertumbuhan bakteri pada ketiga substrat menunjukkan bahwa Clostridium butyricum BCC B2571 mampu memanfaatkan pati beramilosa tinggi dengan kecepatan tumbuh yang berbeda.
amilase bakteri pada fermentasi jam ke-30 dan 48 diuji dengan metode agar plate. Aktivitas enzim tersebut akan menghasilkan zona bening yang luasannya diukur dengan plannimeter. Hasil uji menunjukkan pada jam ke-30 aktivitas amilase bakteri pada ketiga substrat uji menghasilkan zona bening dengan luasan yang tidak berbeda nyata, artinya bakteri memanfaatkan ketiga sumber pati dalam jumlah yang hampir sama. Pada jam ke-48, aktivitas amilase tertinggi adalah pada RS beras dengan luas zona bening sebesar 5.27 cm2. Nilai ini tidak berbeda nyata dengan RS sagu yang sebesar 4.86 cm2. Sementara zona bening pada kontrol Hi maize bernilai terendah yakni 3.42 cm2. Ini membuktikan RS sagu dan RS beras lebih mudah didegradasi oleh enzim amilase bakteri dan digunakan oleh bakteri untuk pertumbuhannya. Sementara Hi maize lebih bersifat resistan terhadap aktivitas enzim amilase bakteri, karena struktur granularnya yang stabil dan resistan terhadap enzim.
Penurunan pH yang terjadi selama fermentasi pada ketiga substrat mengindikasikan terbentuknya asam lemak rantai pendek (SCFA). Analisis SCFA dengan kromatografi gas menunjukkan bahwa asetat dan butirat pada Hi maize dan RS beras terbentuk dalam jumlah yang dapat terdeteksi oleh alat, namun tidak demikian halnya dengan RS sagu. Diketahui limit deteksi kromatografi gas yang digunakan adalah 10 mM, sehingga dapat disimpulkan bahwa kadar asetat dan butirat yang diproduksi RS sagu kurang dari 10 mM. Hasil analisa SCFA menunjukkan bahwa secara umum asetat diproduksi dalam jumlah yang lebih besar dibandingkan butirat pada kedua RS. Sementara kadar asetat dan butirat pada kontrol Hi maize dihasilkan lebih besar dibandingkan pada RS beras.
Selama fermentasi Hi maize, kadar asetat meningkat dari 83.17 mM menjadi 118.10 mM, sedangkan kadar butirat menurun dari 95.19 mM menjadi 40.24 mM. Sementara pada RS beras, kadar asetat menurun dari 95.68 mM menjadi 27.85 mM. Butirat pada jam ke-30 belum terbentuk dan mulai terbentuk pada jam ke-48 sebesar 16.29 mM. Berdasarkan jalur metabolisme glukosa secara anaerob oleh Clostridium butyricum, terdapat kemungkinan bahwa produksi kedua asam lemak tersebut melalui jalur aktivitas enzim Co-a transferase.
RIWAYAT HIDUP PENULIS
Nama lengkap penulis Priyanka Prima Dewi, anak pertama dari 2 bersaudara. Penulis dilahirkan di Bojonegoro, pada tanggal 28 Desember 1986. Setelah lulus dari SMA Negeri 1 Cilegon, penulis melanjutkan pendidikannya di Institut Pertanian Bogor dengan mayor Ilmu dan Teknologi Pangan melalui jalur PMDK.
Selama kegiatan perkuliahan penulis aktif di beberapa organisasi, antara lain Himpunan Mahasiswa Ilmu dan Teknologi Pangan, Food Chat Club dan Food Processing Club. Penulis juga sering mengikuti Seminar dan Training, seperti HACCP (2008), Training Food Safety Management System ISO 22000:2005 (2008) dan Journalistic Training (2007). Selain mengikuti seminar dan pelatihan, penulis juga menjadi asisten praktikum biologi dasar (2008).
Pada tahun 2008, penulis beserta timnya memperoleh dana PKMK dari Direktorat Jendral Pendidikan Tinggi Republik Indonesia. Beberapa karya penulis dipresentasikan pada ajang National Student Conference, UNIKA Semarang (2008) dan Symposium Go Organic, Bangkok (2009). Karya tulis penulis yang dipresentasikan dalam bentuk poster pada Symposium Go Organic meraih penghargaan silver dan dipublikasikan pada Asian Journal of Food and Agro-Industry.
KATA PENGANTAR
Syukur Alhamdulillah penulis panjatkan kepada Allah SWT, karena dengan izin-Nya penulis dapat merampungkan tugas akhir ini. Penelitian yang dilakukan penulis tidak akan dapat terlaksana dengan baik tanpa dukungan dan bantuan dari berbagai pihak, baik secara moral maupun finansial. Oleh karena itu, penulis menghaturkan terima kasih kepada :
1. Kedua orang tua; Mama dan Papa (alm) atas kasih sayang dan perhatian yang mereka berikan. Terima kasih karena selalu memotivasi penulis untuk maju dan menjadi pribadi yang lebih baik setiap waktu.
2. Adikku tersayang; Bastian Arifandi atas semangat dan hari-hari kehidupan yang dijalani bersama.
3. Ibu Maggy T. Suhartono atas bimbingan dan motivasinya selama masa perkuliahan dan penelitian penulis.
4. Ibu Endang Yuli P. atas dukungan, motivasi dan pelajaran hidup yang diberikan kepada penulis selama penelitian.
5. Ibu Suliantari dan Bapak Sukarno atas kesediaannya sebagai penguji.
6. Sahabat-sahabat penulis: Rian W.U, Dini M, Vera dan Bayu Dwi A atas waktu dan semangat yang mengisi hari-hari penulis dalam suka dan duka.
7. Saptiadi Oktora atas perhatian dan motivasi yang diberikan kepada penulis setiap waktu.
8. Teman-teman penulis; Icha, Mutiara, Fahmi, Tri O., Rino, Tuti, Yelita, Harist G, Mike, Pratiwi R., Yuni D.K, Aji, Hurry dan teman ITP lainnya atas
kebersamaan dan inspirasi yang diberikan selama ini, serta teman lab di FAPET; Putri, Risma dan Ajeng yang menemani penulis selama penelitian di FAPET, IPB.
9. Bapak Wahid, Pak Edi, Pak Rozak, Pak Sidik, Ibu Yani (Mikrobiologi, FAPET), Pak Yudi (Balai Paska Panen) dan teknisi laboratorium yang telah mengajarkan banyak hal kepada penulis selama melaksanakan penelitian. 10. Pihak-pihak lain yang tidak dapat penulis sebutkan pada lembar ini yang
‘Tak ada gading yang tak retak’, begitu pula dengan karya ini. Karena itu penulis memohon maaf jika terdapat kesalahan atau hal tidak berkenan. Semoga karya ini dapat bermanfaat dan menjadi inspirasi bagi para pembaca.
Bogor, November 2009
DAFTAR ISI
Kata Pengantar ... i
Daftar Isi ... iii
Daftar Tabel ... v
Daftar Gambar ... vi
Daftar Lampiran ... vii
I. PENDAHULUAN A. LATAR BELAKANG ... 1
B. TUJUAN PENELITIAN ... 2
C. MANFAAT PENELITIAN ... 2
II. TINJAUAN PUSTAKA A. PATI RESISTAN ... 3
B. BAKTERI Clostridium butyricum ... 5
C. ASAM LEMAK RANTAI PENDEK (SCFA) ... 7
III. METODOLOGI PENELITIAN A. BAHAN DAN ALAT ... 10
B. METODE PENELITIAN 1. Pembuatan Medium RCM ... 10
2. Aktivasi kultur dan fermentasi in vitro ... 11
C. METODE ANALISIS 1. Kadar air ... 13
2. Kadar abu ... 13
3. Kadar protein ... 14
4. Kadar lemak ... 14
5. Kadar karbohidrat ... 14
6. Kadar pati ... 15
7. Kadar amilosa ... 15
8. Persiapan sampel analisis kadar pati resistan ... 16
10. Analisis degradasi pati metode agar plate ... 17
11. Pengukuran pertumbuhan bakteri ... 18
12. Metode analisa SCFA ... 18
13. Analisis statistik ... 19
IV. HASIL DAN PEMBAHASAN A. Karakteristik kimiawi pati resistan ... 20
B. Pertumbuhan Clostridium butyricum BCC B2571 ... 25
C. Profil pertumbuhan bakteri Clostridium butyricum BCC B2571 ... 32
D. Profil metabolit SCFA hasil fermentasi pati resistan ... 34
V. KESIMPULAN DAN SARAN ... 43
A. KESIMPULAN ... 43
B. SARAN ... 44
DAFTAR PUSTAKA ... 45
DAFTAR TABEL
DAFTAR GAMBAR
Gambar 1. Kurva Pertumbuhan Bakteri ... 7 Gambar 2. Jalur Metabolisme Anaerob Clostridium butyricum ... .9 Gambar 3. Kadar amilosa pati native ... 20 Gambar 4. Kadar pati resistan hi maize dan pati resistan ... 22 Gambar 5. Kadar pati resistan sebelum dan sesudah autoclave ... 24 Gambar 6. Kurva pertumbuhan Clostridium butyricum ... 26 Gambar 7. Zona bening yang terbentuk pada agar plate ... 29 Gambar 8. Luas zona bening ... 29 Gambar 9. Penurunan pH selama fermentasi ... 32 Gambar 10. Kromatogram asetat dan butirat pada substrat
DAFTAR LAMPIRAN
I. PENDAHULUAN
A. Latar Belakang
Sistem pencernaan merupakan bagian penting dari metabolisme tubuh yang menunjang kesehatan seseorang. Di dalam saluran pencernaan, pangan dicerna, diserap dan dimanfaatkan tubuh. Tingginya kasus penyakit saluran pencernaan seperti konstipasi, diare, hemoroid, Inflammatory Bowel Disease, hingga kanker kolon saat ini mendorong kesadaran masyarakat untuk lebih memperhatikan kesehatan saluran pencernaan melalui pangan yang dikonsumsinya. Akhir-akhir ini, kasus kanker kolon mengalami peningkatan dan menjadi 3 (tiga) besar jenis kanker penyebab kematian tertinggi di dunia (Theodoratou, 2007).
Salah satu upaya pencegahan penyakit kanker kolon adalah dengan menerapkan gaya hidup sehat antara lain dengan mengkonsumsi pangan fungsional. Beberapa hasil penelitian membuktikan pati resistan sebagai salah satu komponen karbohidrat pangan yang dapat mendukung kesehatan pencernaan (Croghan, 1992). Hal ini dikarenakan sifat pati resistan yang tidak dapat dicerna oleh enzim pencernaan sehingga secara fungsional dapat bersifat seperti serat pangan dan berperan sebagai prebiotik di dalam saluran pencernaan.
Komponen pati resistan akan sampai ke usus besar dan difermentasi oleh mikroflora usus sebagai sumber karbon untuk pertumbuhannya. Fermentasi tersebut menghasilkan produk berupa karbon dioksida, hidrogen, metana dan asam lemak rantai pendek. Asam lemak rantai pendek (SCFA) terbukti berdampak baik bagi kesehatan (Nugent, 2005).
Pertumbuhan bakteri secara umum dipengaruhi oleh struktur, ukuran, dan komposisi biokimia substrat serta ketahanannya terhadap serum bakterisidal (Casciato et al., 1974). Sementara itu, Tovar et al. (1992) mengindikasikan perbedaan fraksi RS memiliki perbedaan kemampuannya untuk difermentasi. Beras dan sagu merupakan bahan pangan sumber karbohidrat yang banyak dikonsumsi masyarakat Indonesia dan memiliki perbedaan sifat baik secara fisik maupun kimia. Salah satu sifat kimiawi substrat yang berpengaruh terhadap fermentasi kolon dan pertumbuhan bakteri kolon adalah rasio amilosa : amilopektin pati. Oleh karena itu, penelitian mengenai pertumbuhan salah satu bakteri kolon yakni Clostridium butyricum terhadap pati resistan perlu dilakukan. Bakteri ini menghasilkan metabolit dominan berupa asam butirat dibandingkan dengan bakteri kolon lainnya. Penelitian ini dilakukan secara in vitro dengan memanfaatkan substrat berupa pati resistan beras Cisokan dan sagu asal Sukabumi. Profil SCFA yang dihasilkan dianalisis dengan kromatografi gas.
B. Tujuan Penelitian
Tujuan penelitian ini adalah untuk menganalisis pertumbuhan Clostridium butyricum pada substrat pati resistan beras Cisokan dan sagu asal
Sukabumi serta menganalisis profil SCFA yang dihasilkannya.
C. Manfaat Penelitian
II. TINJAUAN PUSTAKA
A. PATI RESISTAN
Pati merupakan komponen yang banyak ditemukan pada bahan pangan dan berperan sebagai penyedia energi lebih dari 50% dari total diet pada masyarakat agrarian. Komponen pati terdiri dari amilosa dan amilopektin. Amilosa adalah rantai lurus glukosa berikatan α-D-(1,4) glikosidik, sedangkan amilopektin berupa rantai dengan cabang yang berikatan α-D-(1-6) glikosidik. Pada beras rasio kandungan amilosa : amilopektin akan berpengaruh terhadap tekstur (Amelsvoort et al. 1996).
Di dalam saluran pencernaan, pati akan dihidrolisis oleh saliva dan enzim pankreatik kemudian diserap di usus halus, namun hidrolisis tersebut tidak selalu terjadi sempurna. Beberapa komponen pati yang tidak terhidrolisis akan mencapai kolon dan disebut sebagai pati tidak tercerna (non digestible starch). Goni dan Alonso (2000) menyebutkan bahwa salah satu bentuk pati
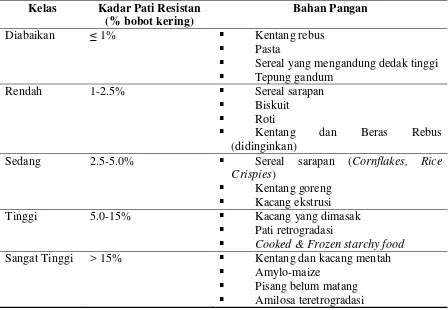
yang mampu melewati usus halus sehingga dapat mencapai kolon adalah pati resistan. Di kolon, pati resistan berperan sebagai substrat fermentasi bagi bakteri dan dapat memberi manfaat fisiologis bagi kesehatan karena perannya sebagai prebiotik (Croghan, 1992). Secara alami beberapa bahan pangan mengandung sejumlah pati resistan, namun proses pengolahan yang melibatkan gelatinisasi dan retrogradasi dapat mempengaruhi kadar pati resistan pada produk pangan (Sajilata et al. 2006). Goni et al. (1996) mengklasifikasikan bahan pangan berdasarkan kandungan pati resistan sebagaimana disajikan pada Tabel 1.
Berdasarkan sumbernya, pati resistan (RS) digolongkan menjadi 4 tipe; RS1 merupakan pati yang secara fisik tidak dapat dihirolisis, RS2 pati resistan
berbentuk granular, RS3 berupa pati retrogradasi, dan RS4 adalah pati
termodifikasi secara kimia. Salah satu tipe pati resistan yang paling banyak diteliti adalah RS3. RS3 terbentuk akibat proses retrogradasi yang
proses pengolahan pangan sehari-hari dan bersifat mudah dikooperasikan ke dalam struktur bahan pangan. Karena itulah, RS3 sangat luas diaplikasikan
dalam produk pangan seperti pada produk pemanggangan, sereal, pasta dan snack (Brouns et al. 2002).
Tabel 1. Klasifikasi Kadar Pati Resistan pada Bahan Pangan (Goni et al. 1996) Kelas Kadar Pati Resistan
(% bobot kering)
Bahan Pangan
Diabaikan ≤ 1% Kentang rebus
Pasta
Sereal yang mengandung dedak tinggi Tepung gandum
Rendah 1-2.5% Sereal sarapan
Biskuit Roti
Kentang dan Beras Rebus (didinginkan)
Sedang 2.5-5.0% Sereal sarapan (Cornflakes, Rice Crispies)
Kentang goreng Kacang ekstrusi Tinggi 5.0-15% Kacang yang dimasak
Pati retrogradasi
Cooked & Frozen starchy food Sangat Tinggi > 15% Kentang dan kacang mentah
Amylo-maize
Pisang belum matang Amilosa teretrogradasi
mengandung 9-20% dan beras beramilosa sangat rendah mengandung kurang dari 9% amilosa (Winarno, 1997). Kandungan amilosa tersebut mempengaruhi tekstur beras. Beras beramilosa tinggi memiliki tekstur pera dan keras, sedangkan beras beramilosa rendah bertekstur pulen dan lengket.
Kandungan pati sagu tergolong tinggi yakni 82.13%, sehingga berpotensi dikembangkan menjadi produk turunan pati ataupun diaplikasikan sebagai produk di industri. Selama ini pemanfaatan pati sagu di Indonesia hanya sekitar 10% dari potensi yang ada. Umumnya pati sagu digunakan sebagai bahan campuran pembuatan kue kering atau biskuit yang bertujuan agar kue lebih renyah.
B. BAKTERI Clostridium butyricum
Kolon merupakan habitat mikroflora, baik yang bermanfaat maupun patogen. Kolonisasi mikroflora di kolon dapat mencapai 1010 sampai 1012 CFU/ml dan didominasi oleh genus Bifidobacteria. Keseimbangan mikroflora dalam saluran pencernaan mempengaruhi status kesehatan seseorang dan dipengaruhi oleh jenis pangan yang dikonsumsi. Beberapa penelitian membuktikan konsumsi pangan prebiotik mampu mendukung pertumbuhan mikroflora baik karena berperan sebagai penyedia makanan bagi pertumbuhannya.
Salah satu bakteri kolon adalah Clostridium butyricum yang memiliki karakteristik berupa gram positif pembentuk spora, bersifat anaerob obligat dan hidup di usus besar manusia dan hewan, serta tanah. Sebagai salah satu mikroflora dalam tubuh, Clostridium butyricum berperan dalam menghasilkan asam lemak rantai pendek (SCFA), terutama asam butirat, asetat dan propionat serta sejumlah asam format dan laktat (Miwatani, 1990). Clostridium butyricum berperan biologis untuk mendukung pertumbuhan
bakteri menguntungkan lain dalam saluran pencernaan seperti Bacillus bifidus, Acidophilous bacterium acidi lactici dan Streptococcus faecium.
dengan bakteri lain. Hal ini dikarenakan fermentasi menggunakan Clostridium butyricum membutuhkan medium pertumbuhan yang sederhana,
dapat menghasilkan metabolit yang tinggi, dan mudah diisolasi. Penelitian sebelumnya membuktikan bakteri dari genus Clostridium dan Bifidobacterium di dalam usus mampu memfermentasi pati beramilosa tinggi,
namun kemampuan fermentasi Clostridium lebih tinggi (Wang et al. 1999). Pada kondisi optimumnya, setiap mikroorganisme dapat tumbuh dan berkembang dengan sangat baik. Beberapa faktor yang memperngaruhi pertumbuhan mikroorganisme adalah suhu, keberadaan oksigen dan nutrisi. Kondisi optimum pertumbuhan Clostridium butyricum adalah pada suhu 35-370C. Beberapa sumber karbon yang dapat digunakan sebagai nutrisi bakteri berasal dari laktosa whey, sukrosa dari molases, pati selulosa, tepung gandum dan limbah kentang.
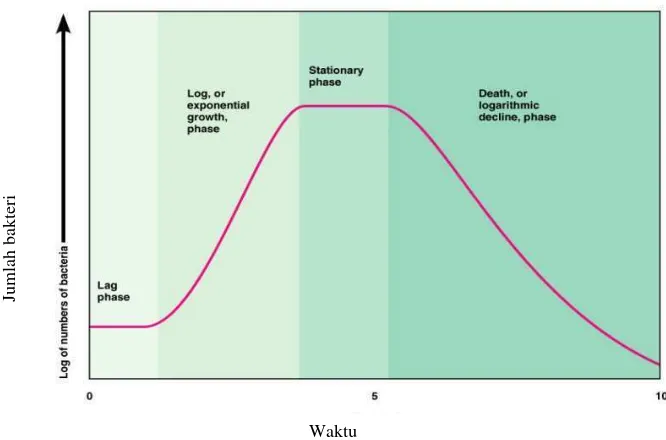
Pertumbuhan bakteri terdiri dari 4 fase, yakni fase lag (adaptasi), fase logaritmik, fase stasioner dan fase kematian sebagaimana yang digambarkan pada Gambar 1. Selama fase lag, bakteri beradaptasi dan mempersiapkan substansi untuk pertumbuhannya seperti RNA, enzim dan molekul lain. Pada fase lag belum terjadi pembelahan sel sehingga jumlah bakteri mungkin tetap, tetapi kadang-kadang menurun. Sementara fase logaritmik merupakan fase pertumbuhan secara logaritmik yang dipengaruhi oleh kondisi lingkungan dan media pertumbuhan. Selanjutnya fase stasioner terjadi akibat menurunnya nutrisi pada media pertumbuhan dan adanya akumulasi zat racun atau metabolit yang diproduksi bakteri. Pada fase ini jumlah sel yang tumbuh sama dengan jumlah sel yang mati sehingga tidak terjadi pertumbuhan. Fase akhir bakteri adalah fase kematian yang mengakibatkan kematian bakteri akibat kekurangan nutrisi (Todar, 2007).
Pertumbuhan bakteri bersifat spesifik begitu pula kecepatan tumbuhnya. Kecepatan tumbuh mikroorganisme tergantung pada tipe mikroorganisme, spesies dan lingkungan tumbuhnya. Kecepatan tumbuh ( ) mikroorganisme dapat diketahui dari persamaan matematis sebagai berikut: = (ln Xt – ln
Xo)/(t-to). dimana Xt dan Xo adalah jumlah mikroorganisme pada akhir dan
Gambar 1. Kurva pertumbuhan bakteri (Todar, 2007)
C. ASAM LEMAK RANTAI PENDEK (SCFA)
Short Chain Fatty Acids (SCFAs) merupakan asam lemak rantai pendek
yang terdiri dari asetat, propionat dan n-butirat. Asam lemak ini diproduksi dari proses fermentasi polisakarida, oligosakarida, protein, peptide, prekursor glikoprotein, turunan serat pangan dan pati resistan secara anaerobik di usus besar (Andoh et al. 2003). Hasil fermentasi lain selain SCFA adalah gas CO2,
H2 dan CH4 serta produk lain seperti laktat, etanol dan suksinat yang dibentuk
oleh tipe bakteri yang berbeda (Drochner et al. 2004).
Pada manusia, umumnya sebaran SCFA adalah asetat > propionate > butirat. Konsentrasi total SCFA biasanya antara 70-140 mM pada proximal colon dan 20-70 mM pada distal colon (Nugent, 2005). Beberapa penelitian
sebelumnya menunjukkan bahwa perbedaan struktur polisakarida dan serat menghasilkan asam lemak dengan rasio komposisi C2 – C4 yang berbeda
(Casterline et al. 1997), misalnya fermentasi pektin menghasilkan rasio asetat:propionat:butirat sebesar 80:12:8, polisakarida non pati 63:22:8, sedangkan pati resistan 62:15:23 (Cummings, 1997 dan Drochner et al. 2004). Estimasi produksi SCFA di kolon dapat dilakukan dengan fermentasi
Waktu
Ju
m
la
h
b
ak
te
in vitro. Hal ini dikarenakan absorbsi SCFA di dalam tubuh terjadi sangat cepat, sehingga sulit dilakukan secara in vivo. Selain itu, dengan fermentasi in vitro pola pertumbuhan bakteri dalam menggunakan substrat secara individu dapat diketahui.
Produksi asam lemak rantai pendek terbukti bermanfaat bagi kesehatan karena terkait dengan metabolisme kolesterol, glukosa dan pencegahan kanker kolon (Casterline et al. 1997). Asam butirat, salah satu asam lemak dengan empat karbon terbukti dapat mereduksi terjadinya kanker kolon melalui proses apoptosis, menghambat invasi sel kanker dan berperan sebagai antimikroba patogen usus seperti Escherichia coli, Salmonella spp. dan Clostridium spp. (Brouns et al. 2002 dan Montagne et al. 2003). Selain itu,
asam butirat berperan sebagai bahan bakar untuk respirasi sel-sel kolon (colonocytes). Sebuah penelitian menunjukkan oksidasi asam butirat dapat menghasilkan lebih dari 70% oksigen untuk kebutuhan jaringan kolon manusia. Oleh karena itu, asam butirat berperan sebagai sumber energi utama untuk proses pertumbuhan sel (Schwiertz et al. 2002). Sebuah penelitian menyebutkan bahwa pati resistan berkadar lebih dari 50% total pati menghasilkan butirat terbanyak (Kettlitz et al. 1997).
bakteri Bifidus, sementara butirat diproduksi oleh bakteri genus Clostridium dan Eubacterium (Sanz et al. 2005)
[image:32.595.153.510.136.623.2]III. METODOLOGI PENELITIAN
A. BAHAN DAN ALAT
Sampel pati resistan yang digunakan pada penelitian ini adalah pati resistan beras Cisokan dan pati sagu asal Sukabumi yang diperoleh dari Balai Besar Penelitian Pasca Panen. Pati resistan yang digunakan merupakan RS tipe 3 hasil retrogradasi dan hidrolisis enzimatik dengan enzim pullulanase (160 NPUN/g substrat). Kontrol yang digunakan adalah pati resistan komersial High Maize dengan merek dagang Novelose 260 (National Starch). Bakteri fermentatif yang digunakan adalah Clostridium butyricum BCC B2571 yang berasal dari kultur Balai Besar Veteriner.
Bahan yang digunakan adalah yeast extract, beef extract, peptone, glukosa, soluble starch, sodium klorida, sodium asetat, cystein hidrocloride, bacto agar, indikator potensial redox resazurin, gas CO2, K2SO4, HgO, H2SO4
pekat, NaOH, H2BO3, HCl, KOH 2 M, amilosa murni, etanol 95%, asam asetat
1 N, larutan iod, KI, buffer KCl-HCl pH 1.5, buffer Trismaleate 0.1 M pH 6.9, akuades, larutan α-amilase, larutan amiloglukosidase, pepsin, buffer sodium asetat 0.4 M pH 4.75, fenol 5%, standar butirat (Fluka) dan standar asetat (Fluka).
Alat yang digunakan adalah kromatografi gas (Agilent technologies 7890 A), anoxomat, spektofotometer, inkubator, mikropipet, tabung reaksi, syringe 1 ml, cawan petri, pipet, timbangan analitik, sentrifus, tabung sentrifus, cawan aluminium, oven, desikator, cawan porselen, labu kjedahl 100 ml, alat destilasi, labu lemak, kertas saring, soxhlet, water-bath bergoyang, dan autoclave.
B. METODE PENELITIAN
1. Pembuatan medium RCM (Reinforced Clostridial Medium)
basal. Seluruh bahan tersebut, kecuali cystein hidrocloride, dicampur, kemudian pH medium di atur menjadi 6.8 dan ditambahkan indikator potensial redoks resazurin sebesar 0.1 ml/100 ml. Penambahan resazurin akan menyebabkan warna medium menjadi merah muda saat dipanaskan. Campuran medium tersebut dididihkan hingga indikator resazurin berubah warna dari merah muda menjadi tidak berwarna, kemudian didinginkan dengan dihembus gas CO2. Setelah dingin, cystein hidroclorida
[image:34.595.171.452.354.512.2]ditambahkan dan diaduk rata. Medium dimasukkan ke dalam tabung reaksi bertutup butyl rubber, kemudian disterilisasi pada 1210C selama 20 menit. Media dapat disimpan pada suhu beku (frezeer) sebelum digunakan.
Tabel 2. Komposisi medium basal Reinforced Clostridial Medium (RCM)
Bahan Jumlah
(g/L)
Yeast Extract 3,0
Beef Extract powder 10,0
Pepton 5,0
Glucose 1,0
Soluble Starch 2,0 Sodium Chlorida 5,0 Sodium Acetate 3,0 Cystein hidrocloride 0,5 pH medium 6,8 ± 0,2
2. Aktivasi dan fermentasi in vitro Clostridium butyricum BCC B2571 (Teknik Hungate)
Fermentasi in vitro dilakukan untuk mengamati pertumbuhan bakteri pada substrat uji (Hi maize, pati resistan sagu dan pati resistan beras). Fermentasi dilakukan dengan menggunakan teknik hungate untuk menjaga kondisi anaerob berdasarkan metode Sanz et al. (2005). Substrat berupa Hi maize, RS beras dan RS sagu masing-masing sebanyak 2% ditambahkan ke medium basal sebagai pengganti soluble starch. Medium fermentasi dimasukkan ke dalam tabung fermentasi sebanyak 4.5 ml, disterilisasi 1210C selama 20 menit kemudian diinokulasikan dengan 0.5 ml kultur bakteri segar (berumur 24 jam). Fermentasi dilakukan selama 48 jam dan diamati pertumbuhannya pada jam ke- 3, 24, 30, 38, 42 dan 48. Perhitungan dilakukan dengan metode Total Plate Count (TPC) yakni koloni di antara 25-250 (Harrigan, 1998) . Perhitungan sebagai berikut:
Keterangan:
n1 = jumlah cawan pengenceran pertama yang dihitung
n2 = jumlah cawan pengenceran kedua yang dihitung
FP = Faktor pengenceran
C. METODE ANALISIS
1.Analisis Kadar Air, Metode Oven (AOAC, 1995)
Cawan aluminium kosong dikeringkan dalam oven suhu 105 0C selama 15 menit lalu didinginkan dalam desikator. Cawan ditimbang dan dicatat beratnya. Sampel ditimbang sebanyak 5 g di dalam cawan tersebut, kemudian dikeringkan di dalam oven sampai beratnya konstan (perubahan berat tidak lebih dari 0.003 g). Setelah itu cawan didinginkan di dalam desikator. Ditimbang berat akhirnya. Dihitung kadar air dengan persamaan berikut :
Kadar air (% b/b) = (x-y) x 100% (x-a)
Keterangan :
x = berat cawan dan sampel sebelum dikeringkan (g) y = berat cawan dan sampel setelah dikeringkan (g) a = berat cawan kosong (g)
2.Analisis Kadar Abu, Metode Oven (AOAC, 1995)
Cawan porselen dibakar dalam tanur selama 15 menit kemudian didinginkan di dalam desikator. Setelah dingin cawan kosong ditimbang dan sampel sebanyak 5 g dimasukkan ke dalam cawan lalu diabukan di dalam tanur hingga diperoleh abu berwarna putih yang beratnya tetap. Pengabuan dilakukan dalam 2 tahap yaitu tahap pertama pada suhu 400 0C lalu dilanjutkan pada suhu 550 0C, kemudian didinginkan di dalam desikator lalu ditimbang.
Perhitungan : Kadar abu (%b/b) = W2 x 100%
W1
Keterangan :
W1 = berat sampel (g)
3.Analisis Kadar Protein, Metode Kjeldahl (AOAC, 1995)
Sampel sebanyak 0.1 – 0.2 g dimasukkan ke dalam labu kjedahl 100 ml, lalu ditambahkan 2 g K2SO4, 40 mg HgO, dan 2.5 ml H2SO4 pekat.
Setelah itu, didestruksi selama 30 menit sampai cairan berwarna jernih dan dibiarkan sampai dingin. Selanjutnya ditambahkan air suling secukupnya dan 10 ml NaOH pekat sampai berwarna coklat kehitaman dan didestilasi. Hasil destilasi ditampung dalam erlenmeyer 125 ml yang berisi H2BO3 dan
indikator, kemudian dititrasi dengan HCl 0.02 N. Larutan blanko juga dianalisis seperti sampel. Kadar nitrogen dihitung berdasarkan rumus :
% Nitrogen = (HCl – Blanko) ml x N HCl x 14,007 x 100%
mg contoh
Kadar protein (%) = % Nitrogen x faktor konversi 4.Kadar Lemak, Metode Soxhlet (AOAC, 1995)
Labu lemak yang telah bebas lemak dikeringkan di dalam oven kemudian ditimbang setelah dingin. Sampel sebanyak 5 g dibungkus dalam kertas saring kemudian ditutup kapas yang bebas lemak. Sampel dimasukkan ke dalam alat ekstraksi soxhlet, kemudian pasang kondensor dan labu pada ujung-ujungnya. Pelarut heksana dimasukkan ke dalam alat lalu sampel direfluks selama 5 jam. Setelah itu, pelarut didestilasi dan ditampung pada wadah lain. Labu lemak dikeringkan di dalam oven pada suhu 1050C sampai diperoleh berat tetap, kemudian labu lemak dipindahkan ke desikator, lalu didinginkan dan ditimbang.
Perhitungan :
Kadar lemak (%b/b) = W2 x 100%
W1
Keterangan :
W1 = Berat sampel (g)
W2 = Berat lemak (g)
5.Analisis Karbohidrat, By Difference (AOAC, 1995)
Kadar karbohidrat (%) = 100% - (kadar protein + kadar lemak + kadar abu (%bk))
6.Analisis kadar pati metode luff schoorl (SNI 01-2892-1992)
Sebanyak 0.1 g sampel ditambah 20 ml aquades dan 5 ml HCl 25% dalam erlenmenyer diinkubasi pada waterbath 1000C selama 2.5 jam. setelah itu didinginkan. indikator PP ditambahkan, lalu larutan dinetralkan dengan NaOH 45% hingga berwarna merah muda. Larutan ditera hingga 100 ml, kemudian disaring. Sebanyak 5 ml filtrat diambil, ditambah 5 ml larutan luff school dan 5 ml aquades. Larutan didinginkan balik dan dipanaskan dalam keadaan mendidih selama 10 menit. Setelah itu didinginkan dengan cepat. Larutan ditambah 3 ml KI 20% dan 5 ml H2SO4
26.5%, kemudian dititrasi dengan Na2SO4 0.1 N hingga berwarna kuning
kunyit, kemudian ditambahkan indikator pati 3 tetes. Titrasi dilanjutkan hingga larutan berwarna putih susu. Blanko dibuat tanpa larutan sampel.
Kadar pati dihitung berdasarkan perbandingan volume titran sampel dengan blanko. Tabel interpolasi jumlah glukosa pada perhitungan ini dilampirkan pada Lampiran 2.
7.Analisis amilosa dan amilopektin (Apriyantono et al. 1989)
Pengukuran larutan standar amilosa dengan melarutkan 40 mg amilosa murni ke dalam tabung reaksi dan tambahkan 1 ml etanol 95% dan 9 ml NaOH 1N. Larutan dipanaskan dalam air mendidih selama 10 menit hingga seluruh bahan membentuk gel, kemudian didinginkan dan dipindahkan ke dalam labu takar 100 ml, kemudian ditambahkan asam asetat 1N masing-masing 0.2 ; 0.4 ; 0.6 ; 0.8 dan 1 ml dan larutan iod 2 ml (0.2 g iod dan 2 g KI dilarutkan dalam 100 ml akuades). Larutan didiamkan selama 20 menit. Intensitas warna biru yang terbentuk diukur dengan spektrofotometer pada panjang gelombang 625 nm. Plotkan absorbansi pada kurva standar.
tera. Sebanyak 5 ml larutan sampel dipipet ke dalam labu takar 100 ml, kemudian ditambahkan 1 ml asam asetat 1 N dan 2 ml larutan iod dan ditera dengan akuades. Larutan didiamkan selama 20 menit hingga terbentuk warna biru. Ukur absorbansi larutan pada panjang gelombang 620 nm. Kadar amilosa diperoleh dengan cara memplotkan absorbansi pada kurva standar. Standar beras Lusi dan Ciherang digunakan sebagai pembanding untuk menentukan klasifikasi amilosa sampel. Kadar amilopektin diperoleh dengan rumus:
Kadar amilopektin (%) = kadar pati (%) – kadar amilosa (%) 8.Persiapan sampel analisis kadar pati resistan (Goni et al. 1996)
Sampel bebas lemak sebanyak 50 mg dimasukkan ke tabung sentrifus, kemudian ditambahkan 5 ml KCl-HCl buffer pH 1.5. Larutan dihomogenisasi. Setelah itu ditambahkan 0.1 ml larutan pepsin (1 g pepsin/10 ml buffer KCl-HCl) dan dihomogenkan. Larutan diinkubasi bergoyang pada 400C selama 60 menit, kemudian didinginkan. Setelah dingin larutan ditambahkan 4.5 ml buffer trismaleate 0.1 M pH 6.0 dan larutan α-amilase 0.5 ml (40 mg α-amilase/ml buffer trismaleate). Larutan diaduk rata dan diinkubasi bergoyang pada 370C selama 16 jam. Setelah itu, disentrifus pada 3000g, 15 menit. Larutan dicuci dengan 5 ml akuades, disentrifuse dan dibuang supernatannya. Sampel pelet pada tabung sentrifus ditambahkan 1.5 ml KOH 4M, dicampur rata dan diinkubasi pada suhu ruang selama 30 menit dengan pengadukan konstan. Setelah itu ditambahkan 2.25 ml HCl 2 M ; 1.5 ml buffer sodium asetat 0.4 M pH 4.75, dan larutan amiloglukosidase 50 l lalu dicampur rata dan diinkubasi 45 menit pada water bath 600C dengan pengadukan konstan. Setelah itu larutan disentrifus 3000g, 15 menit lalu diambil supernatannya dan simpan pada labu takar. Residu dicuci residu dengan 3 ml akuades dan disentrifus. Supernatan yang terbentuk dicampur dengan supernatan yang telah disimpan sebelumnya. Filtrat tersebut kemudian ditera hingga 10 ml dan diuji total gula dengan metode fenol sulfuric acids (AOAC, 1990).
disterilisasi 1210C selama 20 menit. Sampel tersebut kemudian disentrifus 3000g, 15 menit. Residu yang terbentuk kemudian diperlakukan sesuai prosedur yang dijelaskan diatas.
9.Analisis total gula metode fenol-sulfuric acids (AOAC, 1990)
Sebanyak 1 ml sampel yang sudah diencerkan dipindahkan ke tabung reaksi, kemudian ditambah 0.5 ml fenol 5% dan 2.5 ml H2SO4 pekat.
Larutan didiamkan 20 menit, lalu diukur absorbansi pada 490 nm. Kurva standar glukosa dibuat dengan menggunakan larutan glukosa berkonsentrasi 10, 20, 30, 40 dan 50 ppm. Konsentrasi glukosa pada sampel dihitung berdasarkan kurva standar, sedangkan kadar pati resitan diperoleh dari rumus jumlah mg glukosa x 0.9 x faktor pengenceran.
10.Uji degradasi pati metode agar plate (Wang et al. 1999)
Medium fermentasi yang mengandung substrat Hi maize, RS sagu dan RS beras masing-masing sebanyak 2% dan bacto agar 2% disterilisasi pada suhu 1210C selama 20 menit. Medium tersebut dituang ke cawan steril masing-masing 30 ml dan dibiarkan memadat. Setelah menjadi padat, dibuat sumur dengan diameter 0.625 mm pada masing-masing cawan. Inokulasikan 0.03 ml kultur Clostridium butyricum berumur 24 jam ke dalam sumur, kemudian cawan diinkubasi dalam anoxomat jar dengan kondisi anaerob obligat pada inkubator 370C. Komposisi udara dalam jar yang tercatat adalah 9.9 % H2 ; 80% N2 ; 0.2% O2 dan 9.9%
CO2.
Luas zona bening yang terbentuk diukur setelah inkubasi selama 30 jam dan 48 jam. Penentuan luas zona bening dibantu dengan meneteskan larutan I2KI (0.15% I2 dan 1.5% KI). Untuk memudahkan pengukuran
11.Pengukuran pertumbuhan bakteri (Todar, 2007)
Pengukuran pertumbuhan bakteri dilakukan dalam periode waktu tertentu. Perhitungan tersebut menggunakan metode pour plate (metode tuang). Pertumbuhan Clostridium butyricum ditandai dengan koloni putih pada media agar RCM. Pertumbuhan bakteri digambarkan pada kurva hubungan jumlah sel dan waktu inkubasi. Kecepatan pertumbuhan spesifik ( ) bakteri pada masing-masing media saat fase log diukur menggunakan persamaan berikut:
= (ln Xt – ln Xo)/(t-to).
Sementara pengukuran jumlah generasi dan waktu generasi dinyatakan dalam persamaan berikut:
Dimana: = kecepatan pertumbuhan spesifik
Keterangan :
Xt = jumlah sel pada waktu t
Xo = jumlah sel pada waktu to
(t-to) = selang waktu fase log pertumbuhan (jam)
G = Waktu generasi (jam)
12.Metode analisis SCFA (Jensen et al. 1995 modifikasi)
Sampel dianalisis dengan kromatografi gas (GC). Kondisi kromatografi gas disajikan pada lampiran 7. Cairan sampel hasil fermentasi disentrifugasi pada 10.000 rpm selama 15 menit, kemudian di filtrasi dengan mikrofilter 0.45 m. Sebanyak 96 l filtrat di campur dengan standar butirat dan asetat masing-masing 2 l. Larutan sampel diinjeksikan sebanyak 1 l ke port GC. Kurva standar dibuat dengan menginjeksikan 1 l campuran standar asam asetat dan butirat berkonsentrasi 10, 20, 30, 40 l/ml. Besar konsentrasi asetat dan butirat pada sampel dihitung berdasarkan kurva standar dan dikonversi menjadi satuan mM.
13.Analisis Statistik
IV. HASIL DAN PEMBAHASAN
A.Karakteristik kimiawi pati resistan
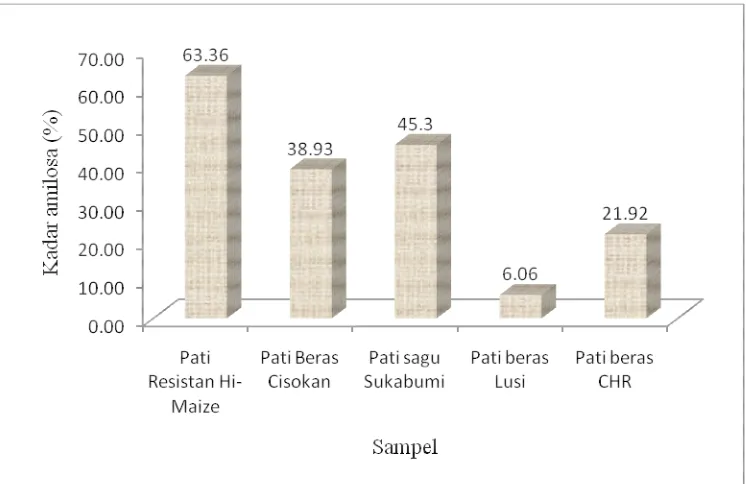
[image:43.595.134.507.289.531.2]Penelitian ini dilakukan untuk mengetahui pengaruh karakteristik kimiawi pati resistan terhadap kemampuan fermentasinya sebagai substrat bagi pertumbuhan bakteri kolon, yakni Clostridium butyricum BCC B2571. Karakteristik kimiawi yang memiliki pengaruh terhadap sifat fermentatif pati dan kadar pati resistan adalah rasio amilosa : amilopektin. Kadar amilosa pati native beras dan sagu disajikan pada Gambar 3.
Gambar 3. Kadar amilosa Hi Maize, pati beras, sagu, standar pati beras Lusi dan Ciherang (CHR).
Pengukuran amilosa pada penelitian ini juga menggunakan standar beras beramilosa rendah dan sedang, yakni Lusi dan Ciherang (CHR). Standar beras tersebut digunakan sebagai pembanding untuk menentukan klasifikasi beras sampel berdasarkan kadar amilosanya. Berdasarkan klasifikasi beras oleh Winarno (1997) dapat disimpulkan bahwa pati beras Cisokan yang digunakan sebagai substrat termasuk dalam klasifikasi beras beramilosa tinggi yakni dengan kadar amilosa 38.93%.
Pengujian amilosa juga dilakukan terhadap pati beras dan sagu yang telah diproses menjadi RS tipe 3. Hasil pengujian menunjukkan kadar amilosa beras dalam bentuk pati resistan bernilai lebih rendah dibandingkan pati native-nya. Kadar amilosa RS beras adalah 31.83% (Lampiran 3). Hal ini dapat dijelaskan sebagai akibat aktivitas pemotongan rantai polisakarida oleh enzim pullulanase yang diaplikasikan pada saat pembuatan pati resistan. Enzim pullulanase merupakan debranching enzim yang mampu memotong ikatan α-1.6 glikosidik pada pullulan, amilopektin dan polisakarida lain. Pemotongan rantai pati oleh pullulanase akan menghasilkan rantai linier dan komponen berbobot rendah (Pongjanta et al. 2009).
Salah satu komponen pati yakni amilopektin dapat diklasifikasikan berdasarkan distribusi panjang rantainya, yakni amilopektin berantai panjang (long-chain) dan rantai pendek (short chain). Keduanya berbeda dalam hal derajat polimerisasi (DP). Sasaki et al (2009) mengklasifikasikan amilopektin dengan DP ≤ 13 ke dalam rantai pendek, sedangkan DP ≥ 13 termasuk rantai panjang. Dengan demikian, rendahnya kadar amilosa pada pati resistan beras yang terukur kemungkinan disebabkan oleh distribusi rantai amilopektin yang pendek pada pati native-nya, sehingga proses hidrolisis enzim pullulanase menghasilkan rantai-rantai polisakarida pendek yang tidak mampu menjerat iodine pada saat pengukuran amilosa.
yang mengandung amilosa tinggi. Hal ini dikarenakan komponen amilosa akan membentuk kristal pada saat retrogradasi, sehingga bersifat resistan. Secara komersial, pati resistan tipe 3 dibuat dari pati tergelatinisasi yang mengandung lebih dari 40% amilosa.
[image:45.595.155.485.292.527.2]Berdasarkan hasil uji amilosa, maka dapat disimpulkan bahwa bahan baku pembuatan pati resistan pada penelitian ini termasuk kategori pati beramilosa tinggi. Dengan demikian diharapkan proses retrogradasi saat pembuatan RS tipe 3 akan menghasilkan pati resistan berkadar tinggi. Hasil pengukuran pati resistan disajikan pada Gambar 4.
Gambar 4. Kadar pati resistan Hi maize, RS beras dan RS sagu.
Menurut Wasserman et al. (2007) proses pembuatan pati resistan tipe 3 melalui dua tahap, yakni (1) gelatinisasi menyebabkan struktur granula mengembang akibat penyerapan air yang berlebih selama pemanasan, (2) retrogradasi pati yang mengakibatkan rekristalisasi rantai amilosa dan amilopektin. Proses gelatinisasi menyebabkan pati lebih mudah tercerna dibandingkan dalam bentuk mentahnya. Namun gel pati tersebut tidak stabil dan membentuk kristal saat pendinginan. Peristiwa tersebut dinamakan retrogradasi. Retrogradasi pati akan menghasilkan polimer linier berrantai pendek yang tidak larut dan bersifat resistan terhadap enzim pencernaan. Oleh karena itu, sumber pati beramilosa tinggi akan memiliki kadar RS yang tinggi pula. Salah satu syarat pembentukan RS adalah rantai glukosa dengan panjang rantai minimum 30-40 residu, namun adanya kompleksitas rantai tersebut dengan lipid dapat menghambat pembentukan RS (Mangala et al. 1999).
Proses kristalisasi dipengaruhi oleh beberapa faktor, antara lain kadar amilosa dan panjang rantai, suhu autoclave, waktu penyimpanan dan suhu gelatinisasi (Ozturk et al. 2009). Penelitian Escarpa et al. (1996) membuktikan bahwa proses kristalisasi tidak hanya terjadi pada rantai amilosa, tapi juga pada rantai amilopektin, namun kecepatannya lebih rendah dibandingkan retrogradasi amilosa. Walaupun begitu, proses retrogradasi amilopektin tidak dapat diabaikan karena turut berkontribusi dalam pembentukan pati resistan.
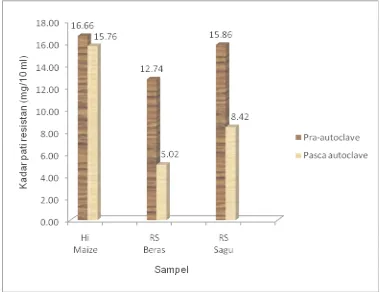
Kadar RS pada bahan pangan juga dipengaruhi oleh proses termal. Oleh karena itu pengaruh autoclaving terhadap pati resistan yang akan digunakan sebagai bagian dari medium tumbuh bakteri pada penelitian ini pun diuji. Autoclaving dilakukan pada 1210C selama 20 menit dengan tujuan sterilisasi.
Gambar 5. Kadar pati resistan sebelum dan sesudah autoclave.
Stabilitas panas pati selama proses autoclave terkait dengan suhu leleh komponen pati. Wasserman et al. (2007) menyatakan terdapat kecenderungan bahwa sumber beramilosa tinggi memiliki suhu leleh yang tinggi pula. Suhu leleh amilosa mencapai 1400C, sementara amilopektin dapat meleleh pada suhu 60-700C. Pada saat suhu leleh tersebut struktur kristal amilosa dan amilopektin rusak.
Kadar pati resistan pada ketiga substrat uji memiliki penurunan dengan kecenderungan yang sama seperti kadar pati resistan sebelum autoclave. Walaupun mengalami penurunan, kadar pati resistan Hi maize setelah autoclave masih tertinggi, yakni 15.76 mg/10ml, sedangkan RS sagu 8.42 mg/10ml dan RS beras 5.02 mg/10ml. Penurunan kadar RS setelah autoclave kemungkinan terjadi akibat rusaknya struktur kristalin pati, sehingga pati tidak lagi bersifat resistan.
merupakan RS tipe 2. Strukturnya yang kompak membatasi akses enzim pencernaan untuk menghidrolisis ikatannya.
Pati resistan tipe 3 dari sampel RS beras dan RS sagu mengalami penurunan kadar RS yang drastis setelah diautoclave. Pada proses pembuatan pati resistan tipe 3 ini (Lampiran 8) pati di autoclave dan disimpan pada suhu 40C. Pada proses ini pati mengalami kristalisasi. Proses kemudian dilanjutkan dengan hidrolisis enzimatik dengan debranching enzim pullulanase. Jika struktur amilopektin yang dimiliki oleh kedua pati adalah amilopektin bercabang banyak dan pendek, maka diperkirakan produk yang terbentuk dari hidrolisis adalah rantai pendek yang bercabang pula. Penyimpanan pati selama beberapa lama akan memberi peluang bagi rantai amilopektin untuk membentuk kristalin.
Retrogradasi pada molekul amilopektin bersifat refersibel bila diberi panas, tetapi tidak demikian dengan retrogradasi amilosa. Karena itulah, berdasarkan data yang diperoleh, kemungkinan pati resistan yang terbentuk pada RS sagu dan RS beras adalah hasil dari retrogradasi amilopektin. Lehman et al. (2002) menyebutkan panjang rantai linier pun mempengaruhi retrogradasi. Untuk pembuatan RS tipe 3 sangat optimal menggunakan α-poliglukan dengan derajat polimerisasi 20.
B.Pertumbuhan Clostridium butyricum BCC B2571 pada pati resistan
Komponen karbohirat yang tidak terserap oleh tubuh saat metabolisme di usus halus akan diteruskan ke usus besar. Beberapa faktor yang mempengaruhi pencernaan karbohidrat dalam usus halus antara lain daya cerna pati, bentuk fisik bahan pangan, perlakuan bahan, rasio komponen pati (amilosa : amilopektin), keberadaan antinutrien (α-amilase inhibitor), waktu transit, keberadaan lemak dan protein. Sesampainya di usus besar, karbohidrat menjadi substrat bagi pertumbuhan koloni bakteri.
Beberapa genus bakteri yang hidup dalam saluran pencernaan, terutama di usus besar antara lain adalah Lactobacillus, Clostridium sp., Eubacterium, Bifidobacterium, dan Bacteroidaceae (Roberfroid, 2001). Keseimbangan
status kesehatan seseorang. Oleh karena itu konsumsi pangan yang bersifat prebiotik sangat baik bagi kesehatan karena dapat mendorong pertumbuhan bakteri baik (menguntungkan) dan menghambat pertumbuhan bakteri patogen.
Clostridium butyricum merupakan salah satu bakteri kolon yang mampu
memanfaatkan karbohidrat sebagai sumber karbon bagi kehidupannya. Bakteri ini dapat diisolasi dan ditumbuhkan pada medium RCM (Reinforced Clostridial Medium). Sebagai sumber karbon, substrat pati terlarut (soluble
starch) pada medium basal disubtitusi dengan sampel pati resistan uji.
Substitusi ini bertujuan untuk mengetahui kemampuan bakteri Clostridium butyricum BCC B2571 untuk tumbuh pada tiga sumber karbon yang berbeda, yakni Hi-maize, RS beras dan RS sagu.
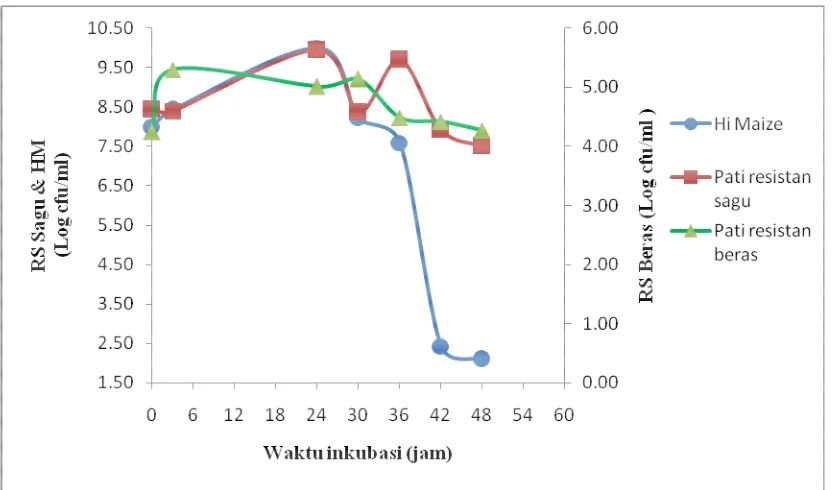
[image:49.595.114.532.413.658.2]Pertumbuhan Clostridium butyricum BCC B2571 selama 48 jam diamati pada rentang waktu tertentu dan dihitung secara Total Plate Count. Pertumbuhan bakteri pada substrat Hi maize, RS sagu dan RS beras diplotkan pada kurva pertumbuhan yang disajikan pada Gambar 6.
Berdasarkan kurva pertumbuhan bakteri di atas fase lag, fase logaritmik, fase stationer dan fase kematian bakteri Clostridium butyricum BCC B2571 dapat diketahui. Pada 3 jam pertama, bakteri pada substrat Hi maize dan RS beras langsung mengalami pertumbuhan. Hal ini menunjukkan kondisi lingkungan tumbuh sesuai dengan kebutuhan bakteri. Sedangkan pada RS sagu terjadi penurunan jumlah mikroba yang mengindikasikan adanya proses adaptasi organisme terhadap lingkungan tumbuhnya yang baru (Sarles et al. 1956). Lamanya fase lag tergantung pada kondisi lingkungan tumbuh dan jumlah inokulum yang digunakan. Setelah fase lag, organisme mengalami pertumbuhan atau dapat disebut telah memasuki fase logaritmik.
Fase logaritmik diindikasikan dengan peningkatan jumlah bakteri akibat pembelahan sel yang polanya mengikuti kurva logaritmik. Berdasarkan kurva pertumbuhan diatas, fase logaritmik Clostridium butyricum BCC B2571 pada substrat Hi maize dan RS sagu terjadi hingga jam ke- 24, sedangkan pada RS beras pertumbuhan berlanjut hingga jam ke-30. Perbedaan pertumbuhan ini disebabkan akibat adanya perbedaan jumlah nutrisi yang tersedia pada medium untuk pertumbuhan bakteri (Sarles et al. 1956). Melihat pola pertumbuhan kurva diatas, maka dapat disimpulkan bahwa pada substrat RS beras masih mengandung nutrisi sehingga masih dapat menunjang pertumbuhan bakteri hingga jam ke-30 inkubasi.
Pada substrat Hi maize penurunan jumlah bakteri terjadi sangat drastis setelah jam ke- 36. Kemungkinan pada jam tersebut nutrisi pada media tidak lagi tersedia bagi bakteri. Pelczar dan Chan (2005) menyatakan bahwa saat memasuki fase kematian, terjadi penurunan populasi jasad renik yang diakibatkan oleh beberapa faktor antara lain berkurangnya ketersediaan nutrien pada medium serta energi cadangan di dalam sel, akumulasi racun, dan perubahan pH medium (Frobisher, 1962). Fase ini dapat juga dikatakan sebagai fase pertumbuhan negatif. Setelah nutrisi yang tersedia pada medium telah berkurang, pertumbuhan bakteri akan terhambat, akibatnya jumlah sel yang tumbuh lebih rendah dibandingkan dengan jumlah sel yang mati.
sudah memasuki fase kematian. Pada substrat Hi maize, fase ini terlihat dari penurunan jumlah bakteri yang sangat drastis pada jam ke-48, sementara pada substrat RS sagu dan RS beras jumlah bakteri pada jam ke-48 belum menurun secara drastis. Dengan demikian dapat disimpulkan bahwa masih terdapat kemungkinan terjadinya pertumbuhan bakteri pada kedua substrat tersebut jika inkubasi dilanjutkan lebih dari 48 jam.
Berdasarkan kurva pertumbuhan diatas, maka disimpulkan bahwa akhir fase logaritmik berada pada jam ke-30. Pada jam tersebut diperkirakan bakteri mulai memproduksi metabolit SCFA. Sementara itu, sebagai pembanding untuk mempelajari jalur produksi SCFA selama fermentasi dipilih waktu inkubasi selama 48 jam untuk mengetahui profil SCFA yang diproduksi bakteri.
Fase pertumbuhan logaritmik jasad renik memiliki kecepatan pertumbuhan yang sangat dipengaruhi oleh kondisi medium tempat tumbuhnya, seperti pH, kandungan nutrien, suhu dan kelembaban udara. Pada penelitian ini pertumbuhan Clostridium butyricum BCC B2571 diamati pada tiga medium fermentasi yang berbeda sumber karbonnya.
Penggunaan pati sebagai sumber karbon bagi pertumbuhan bakteri Clostridium butyricum BCC B2571 diuji dengan melihat aktivitas degradasi
pati oleh enzim amilase bakteri. Metode yang digunakan adalah metode pencawanan dengan mengamati terbentuknya zona bening disekitar sumur (lubang) yang ditanam kultur bakteri. Zona bening tersebut menunjukkan luasan aktivitas hidrolisis pati menjadi glukosa oleh bakteri. Perubahan warna yang terjadi (zona bening yang terbentuk) sejalan dengan penurunan ukuran molekular pati. Metode ini sangat sensitif dan mampu mengukur aktivitas pemecahan ikatan α (1 4) glikosidik secara kualitatif.
Pengamatan zona bening dibantu dengan meneteskan larutan I2KI yang
Gambar 7. Zona bening yang terbentuk pada agar plate
[image:52.595.127.527.438.701.2]Luas zona bening yang terbentuk pada ketiga substrat uji disajikan pada Gambar 8. Diagram zona bening tersebut menunjukkan aktivitas tertinggi degradasi pati oleh enzim amilase pada jam ke-30 (akhir fase logaritmik) terjadi pada substrat RS sagu. Hal tersebut diindikasikan dari luasnya zona bening yang terbentuk, namun uji statistik menunjukkan luas zona bening pada RS sagu tidak berbeda nyata dengan RS beras dan Hi maize (Lampiran 6).
Pada fermentasi 48 jam, luas zona bening yang dihasilkan pada ketiga pati lebih besar dibandingkan dengan fermentasi 30 jam. Hal ini karena semakin banyak pati yang didegradasi oleh enzim amilase bakteri untuk memenuhi nutrisi selama pertumbuhannya. Gambar 8 menunjukkan aktivitas degradasi setelah 48 jam bernilai tertinggi adalah pada RS beras, namun secara statistik luas tersebut tidak berbeda nyata dengan luas zona bening pada RS sagu. Luas zona bening pada RS beras adalah 5.27 cm2 dan RS sagu 4.86 cm2. Sementara luas zona bening pada Hi maize pada jam ke-48 hanya sebesar 3.42 cm2. Luasan pada Hi maize ini tidak berbeda nyata dengan yang terbentuk pada jam ke-30.
Hidrolisis pati oleh Clostridium butyricum BCC B2571 disebabkan oleh aktivitas enzim ekstraselular α-amylase yang diproduksi bakteri (Whelan dan Nasr, 1950). Enzim tersebut menghidrolisis polisakarida menjadi dekstrin yang terdiri dari 6-9 unit glukosa. Aktivitas enzim secara umum dipengaruhi oleh suhu, substrat, pH dan keberadaan inhibitor. Aktivitas degradasi pati oleh α-amilase juga dipengaruhi oleh proporsi rantai unit amilopektin. Disebutkan bahwa ikatan dengan rantai cabang yang banyak dan pendek (DP 6-12) memiliki tingkat susceptibility yang tinggi terhadap hidrolisis enzim (Wong et al. 1997). Atas dasar teori tersebut maka diprediksi terdapat pengaruh
perbedaan distribusi unit rantai amilopektin pada ketiga substrat terhadap aktivitas hidrolisis pati oleh α-amylase bakteri. Sementara itu, proses autoclave yang menyebabkan rusaknya struktur kristal pati juga mengakibatkan pati dapat lebih mudah diakses oleh enzim amilase. Kedua hal inilah yang kemungkinan menjadi dasar tingginya aktivitas degradasi pati pada substrat RS sagu dan RS beras.
aktivitas enzim degradasi pati pada jam ke-48 kemungkinan juga disebabkan oleh sudah berhentinya metabolisme bakteri.
Sebuah penelitian mengenai degradasi amilopektin dan amilosa oleh bakteri kolon menyebutkan adanya beberapa faktor yang mempengaruhi aktivitas degradasi tersebut antara lain derajat gelatinisasi, sumber pati, rasio amilosa-amilopektin, interaksi pati-protein, interaksi pati-lemak, persentase pati teretrogradasi dan keberadaan amilase inhibitor. Konformasi granula dan rasio amilosa-amilopektin juga berpengaruh terhadap degradasi pati.
Koloni bakteri kolon menggunakan amilopektin dan amilosa pada pati dengan level yang berbeda (Wang et al. 1999). Pada penelitian tersebut dibuktikan bahwa granula pati beramilopektin tinggi lebih mudah didegradasi oleh berbagai spesies bakteri, sedangkan granula pati amilosa hanya dapat didegradasi oleh strain Bifidobacterium dan Clostridium. Hal ini pun diperkuat oleh penelitian Lehmann et al. (2002) yang menyatakan granula pati beramilopektin tinggi adalah substrat yang baik untuk fermentasi dibandingkan dengan pati beramilosa tinggi. Selain itu, karena degradasi pati terjadi akibat adanya aktivitas enzim maka konformasi substrat juga mempengaruhi suspectibility enzim terhadap substrat.
Aktivitas degradasi pati oleh Clostridium butyricum pada Gambar 8 menunjukkan bahwa setelah 48 jam fermentasi, RS beras didegradasi lebih besar dibandingkan RS sagu, walaupun nilainya tidak berbeda nyata. Berdasarkan hasil uji kimiawi, kadar pati resistan RS beras lebih rendah dibandingkan dengan RS sagu. Sehingga RS beras memiliki struktur pati yang lebih mudah didegradasi oleh bakteri. Dengan demikian pada penelitian ini, struktur kristalin pati memiliki pengaruh terhadap aktivitas enzim amilase.
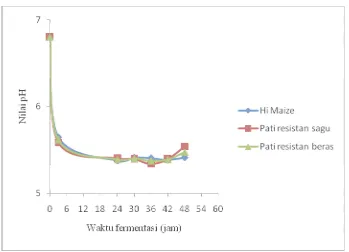
Penelitian Sayar et al. (2007) pada fermentasi in vitro dengan substrat oats menunjukkan adanya penurunan pH medium secara signifikan setelah 4 jam fermentasi. Sementara pada penelitian ini, penurunan pH t