AVANTY WIDIAS MAHAR
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
AVANTY WIDIAS MAHAR. Deteksi Serologi Bean Common Mosaic Virus
(BCMV) dari Benih Kacang Panjang (Vigna sinensis L.) Komersial dan Petani. Dibimbing oleh TRI ASMIRA DAMAYANTI.
Kacang panjang (Vigna sinensis L) merupakan tanaman hortikultura yang banyak ditanam di Indonesia. Salah satu pembatas produksi kacang panjang adalah virus mosaik Bean common mosaic virus (BCMV), BCMV bersifat tular benih dan dapat ditularkan melalui kutudaun. Penelitian ini bertujuan untuk mengetahui kesehatan benih kacang panjang komersial dan petani serta membandingkan dua teknik deteksi serologi untuk BCMV yaitu Indirect-Enzyme-linked immunosorbent assay (I- ELISA) dan Tisue blot immunosorbent assay
(TBIA). Varietas komersial yang dideteksi antara lain Parade, New Jaliteng, Long Silk, Pilar, 777, Maharani, dan Lousiana, serta varietas dari petani yang dideteksi yaitu Lokal asal Indramayu. Sebanyak 100 benih dari setiap varietas ditumbuhkan pada media tanah di baki (growing on test) sampai berumur 4 minggu. Deteksi BCMV dilakukan terhadap 20 sampel komposit untuk tiap varietas dengan I-ELISA. Sampel komposit yang positif kemudian dideteksi ulang secara individu untuk mendapatkan persentase BCMV terbawa benih. Deteksi BCMV dengan TBIA diuji sensitivitasnya melalui penggunaan antiserum dengan pengenceran 1:3 000, 1:5 000, 1:7 000, 1:10 000, 1:13 000, dan 1:15 000. Hasil deteksi TBIA dari benih selanjutnya dibandingkan dengan hasil deteksi I-ELISA. Persentase BCMV terbawa benih tertinggi sampai terendah ditunjukkan berturut-turut oleh varietas Parade (73%), varietas 777 (30%), varietas Maharani (25%), varietas
Long Silk (5%), varietas Pilar (4%), varietas New Jaliteng (3%), dan terakhir varietas Lousiana (2%). Hal ini menunjukkan sebagian besar benih-benih komersial tidak bebas BCMV. Persentase terbawa benih diduga terkait dengan ketahanan tanaman terhadap BCMV. Deteksi BCMV menggunakan TBIA menunjukkan semakin tinggi pengenceran antiserum waktu yang dibutuhkan semakin lama pada reaksi pewarnaan. Namun sensitivitas hasil deteksi TBIA masih mampu mendeteksi BCMV sampai pengenceran 1:15 000. Diantara
pengenceran antiserum yang diuji menunjukkan bahwa pengenceran 1:3 000 – 1:7 000 memberikan hasil deteksi yang terbaik dalam waktu yang
singkat. Perbandingan hasil deteksi I-ELISA dan TBIA pada varietas Parade menunjukkan hasil yang hampir sama. Jika dibandingkan keduanya, deteksi BCMV menggunakan TBIA lebih cepat, murah, dan mudah dibandingkan I-ELISA. Kecepatan diagnosa TBIA jauh lebih singkat (± 3 jam) dibandingkan I-ELISA (22-26 jam), serta pengujian langsung di lapang lebih mudah dan lebih memungkinkan dibandingkan ELISA.
AVANTY WIDIAS MAHAR
A34070086
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian pada Departemen Proteksi Tanaman, Fakultas Pertanian
Institut Pertanian Bogor
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
Nama Mahasiswa : Avanty Widias Mahar NRP : A34070086
Disetujui, Dosen Pembimbing
Dr. Ir. Tri Asmira Damayanti, M.Agr NIP 19681017 199302 2 001
Diketahui, Ketua Departemen
Dr. Ir. Abdjad Asih Nawangsih. M.Si NIP 19650621 198910 2 001
Penulis dilahirkan di Ngawi pada tanggal 16 Maret 1988 sebagai anak pertama dari dua bersaudara pasangan Bapak Joko Irin Suharto dan Ibu Endang Puji Astuti.
Penulis menempuh pendidikan dasar di SDN Jogorogo 5 pada tahun 2000. Pada tahun 2000-2004 penulis menempuh pendidikan di Pondok Pesantren Darussalam Gontor Putri, Ngawi Jawa Timur. Pada tahun 2004 penulis melanjutkan pendidikan di MAN Paron sampai lulus pada tahun 2007. Selama menempuh pendidikan penulis aktif dalam kegiatan Organisasi Siswa Intra Sekolah (OSIS). Pada tahun 2007 penulis melanjutkan pendidikan di Institut Pertanian Bogor (IPB) melalui jalur Seleksi Penerimaan Mahasiswa Baru (SPMB) dan diterima di Departemen Proteksi Tanaman.
Segala puji syukur hanya bagi ALLAH Subkhanahuwata’ala yang telah memberikan kesempatan bagi penulis untuk menyelesaikan penelitian dan penulisan skripsi berjudul “Deteksi Serologi Bean Common Mosaic Virus
(BCMV) dari Benih Kacang Panjang (Vigna sinensis L.) Komersial dan Petani”. Banyak pihak yang terlibat dalam penyelesaian penelitian dan penulisan skripsi ini. Penulis mengucapkan terima kasih sebesar-besarnya kepada orangtua (Joko Irin Suharto & Endang Puji Astuti), dan Adik (Widimayang Sari Riantin) tercinta yang selalu memberi semangat, nasihat, motivasi, dukungan, dan doanya kepada penulis. Tidak lupa ucapan terima kasih penulis kepada Dr. Ir. Tri Asmira Damayanti, M.Agr selaku dosen pembimbing yang selalu sabar dalam memberi masukan, saran, arahan, bimbingan, perhatian, dan koreksi dalam penulisan skripsi ini. Terima kasih kepada Dr. Ir. Ali Nurmansyah, M.Si selaku pembimbing akademik, dan staf Laboratorium Virologi Tumbuhan: Bapak Edi Supardi dan Mba Tuti Legiastuti yang telah banyak membantu dan memberikan arahannya dalam melaksanakan penelitian.
Penulis juga mengucapkan terima kasih kepada teman-teman yang telah membantu terlaksananya penelitian ini: seluruh anggota HPT 44, seluruh anggota Laboratorium Virologi Tumbuhan 44, Alice Mayella, M Julyanda, Tenri Angke Riliandra dan terutama kepada Rizki Ramadhan dan Harwan Susetio yang banyak membantu ketika penelitian di Laboratorium. Terima kasih kepada seseorang yang telah memberikan motivasi, dukungan, semangat, dan keceriaan selama proses penyelesaian tugas akhir. Penelitian dan skripsi ini penulis persembahkan kepada Who give me advice that comes straight from the bottom of heart.
Akhir kata, semoga hasil skripsi ini dapat bermanfaat dan bermaslahat bagi pembaca, petani, dan institusi dalam bidang pertanian. Amin.
Bogor, Februari 2012
DAFTAR ISI
Klasifikasi dan Budidaya Tanaman Kacang Panjang (Vigna sinensis L)... 3
BCMV (Bean common mosaic virus)... 4
Enzyme-linked immunosorbent assay (ELISA)... 4
Tissue blot immunosorbent assay (TBIA)... 6
BAHAN DAN METODE... 7
Tempat dan Waktu Penelitian... 7
Metode Penelitian... 7
Penanaman Tanaman Uji... 7
Penyiapan sampel uji... 7
Persentase BCMV Terbawa benih... 8
Deteksi Serologi Virus Terbawa Benih... 8
Metode ELISA... 8
Metode TBIA... 9
Optimasi Konsentrasi Antiserum... 10
HASIL DAN PEMBAHASAN... 11
Hasil... 11
Uji virus Terbawa Benih... 11
Deteksi BCMV dengan Teknik TBIA... 12
Perbandingan Teknik Deteksi Terbawa Benih... 16
Deteksi Benih Hasil Growing On Test... 17
Kelebihan dan Kekurangan I-ELISA dan TBIA... 19
KESIMPULAN DAN SARAN... 21
Kesimpulan... 21
Saran... 21
DAFTAR PUSTAKA... 22
DAFTAR TABEL
Halaman
1 Hasil deteksi I-ELISA dari benih tanaman varietas Parade yang
ditumbuhkan... 15 2 Perbandingan antara teknik I-ELISA dan TBIA dalam deteksi
DAFTAR GAMBAR
Halaman 1 Benih disemai pada nampan persemaian. (a) 6 hari setelah tanam
(HST) dan (b) 4 MST...
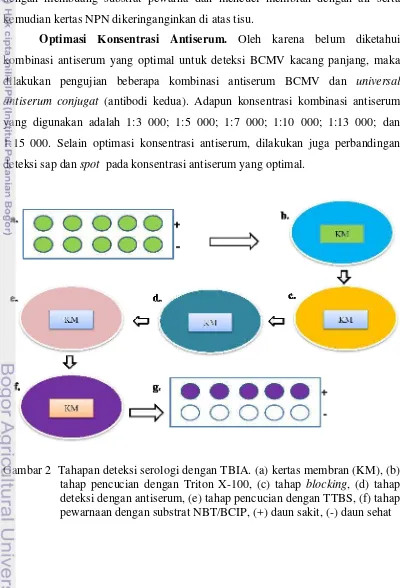
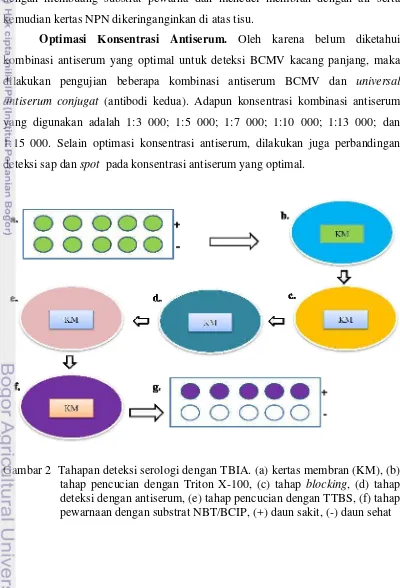
2 Tahapan deteksi serologi dengan TBIA. (a) kertas membran (KM), (b) tahap pencucian dengan Triton X-100, (c) tahap blocking, (d) tahap deteksi dengan antiserum, (e) tahap pencucian dengan TTBS, (f) tahap pewarnaan dengan substrat NBT/BCIP, (+) daun sakit, (-) daun sehat...
3 Persentase BCMV terbawa benih dari sampel komposit pada 7 varietas kacang panjang komersial. NJT : New Jaliteng; PLR : Pilar; LS : Long Silk; PRD : Parade; MHR : Maharani; LSA :
Lousiana; 777; Lokal... 11
4 Persentase BCMV terbawa benih pada 7 varietas kacang panjang komersial. NJT : New Jaliteng; PLR : Pilar; LS : Long Silk; PRD : Parade; MHR : Maharani; LSA : Lousiana; 777...
5 Optimasi hasil deteksi BCMV pada konsentrasi antiserum yang berbeda. (+) : tanaman sakit; (-) : tanaman sehat...
6 TBIA BCMV kacang panjang dengan menggunakan konsentrasi antiserum. (a) ; 1:3 000; (b) ; 1:5 000; (+) : tanaman/sap terinfeksi; (-) : tanaman/sap sehat...
1 Tabel Nilai absorban ELISA (NAE) sampel individu varietas
Lousiana dan Long Silk... 26 2 Tabel Nilai absorban ELISA (NAE) sampel individu varietas New
Jaliteng dan Pilar... 26 3 Tabel Nilai absorban ELISA (NAE) sampel individu varietas
Parade... 27 4 Tabel Nilai absorban ELISA (NAE) sampel individu varietas
Maharani... 28 5 Tabel Nilai absorban ELISA (NAE) sampel individu varietas
777... 29
PENDAHULUAN
Latar Belakang
Kacang panjang (Vigna sinensis L.) merupakan salah satu tanaman hortikultura yang sering ditemui di pasar tradisional atau swalayan, menempati urutan ke- 8 dari 20 jenis sayuran yang dikonsumsi di Indonesia. Kacang panjang merupakan komoditas yang dapat dikembangkan untuk perbaikan gizi keluarga. Tanaman ini berumur pendek, tumbuh baik pada dataran sedang sampai dataran rendah, dapat ditanam di lahan sawah, tegalan atau pekarangan pada setiap musim. Usahatani kacang panjang dapat diandalkan sebagai usaha agribisnis yang mampu meningkatkan pendapatan petani (Suryadi et al. 2003).
Luas panen kacang panjang mengalami penurunan sebanyak 12% (sekitar 70 000 ha) dengan kemampuan produksi yang tergolong rendah, yaitu 275,73 ton dan 10,09 ton/ha untuk berturut-turut rataan produksi dan produktivitas nasional. Salah satu faktor penyebab masih rendahnya daya hasil tanaman sayuran di Indonesia adalah penggunaan benih sayuran dengan mutu genetik dan fisiologis yang kurang baik, dan beberapa gangguan penyakit tanaman. Penyakit penting kacang panjang di Indonesia diantaranya layu cendawan (Fusarium sp.), antraknosa (Colletotrichum sp.), puru akar (Meloidogyne sp.), dan mosaik yang disebabkan oleh beberapa jenis virus diantaranya Bean common mosaic virus
(BCMV), Bean yellow mosaic virus (BYMV), dan Cowpea aphid borne mosaic virus (CaBMV) (Anwar et al. 2005).
Pada tahun 2008-2009 dilaporkan terjadi ledakan penyakit mosaik kuning pada tanaman kacang panjang yang meluas di beberapa daerah di kawasan Jawa Barat dan Jawa Tengah. Penyebab terbanyak penyakit mosaik kuning di Jawa Barat (Bogor, Karawang, Subang, Indramayu, dan Cirebon) dan Jawa Tengah (Tegal dan Pekalongan) adalah BCMV-strain black eye cowpea (BCMV-BIC) yang menginfeksi secara tunggal atau bersama dengan Cucumber mosaic virus
(CMV) (Damayanti 2009, Damayanti et al. 2009).
ekonomis sangat penting karena ditularkan melalui benih dan menyebar secara alami melalui kutudaun secara non persisten (Morales & Bos 1988).
Strategi pengendalian virus, termasuk BCMV umumnya mengandalkan penggunaan benih sehat, menghilangkan tanaman terinfeksi, menggunakan varietas tahan, dan penyemprotan insektisida untuk mengendalikan serangga vektor (Saleh 1997). Penggunaan benih tahan dan sehat merupakan upaya terbaik mencegah infeksi virus yang terbawa benih.
Kenyataan masih tingginya intensitas serangan mosaik kuning di lapang sampai saat ini melatarbelakangi penelitian ini untuk mendapatkan informasi kesehatan benih petani dan komersial yang digunakan atau ditanam. Salah satu upaya untuk memperoleh benih sehat adalah dengan tersedianya teknik deteksi virus yang akurat dan mudah dilakukan secara rutin untuk seleksi benih sehat dan monitoring penyakit di lapang. Teknik deteksi serologi merupakan salah satu teknik deteksi yang banyak digunakan secara luas, terutama untuk deteksi virus dalam jumlah banyak. Dalam penelitian ini akan diuji kesehatan benih komersial dan petani terhadap BCMV dengan deteksi serologi I-ELISA, dan dilakukan juga optimasi deteksi BCMV dengan teknik TBIA.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui kesehatan benih kacang panjang komersial dan petani sebagai landasan dalam program sertifikasi benih serta membandingkan dua teknik deteksi serologi untuk BCMV yaitu ELISA dan TBIA.
Manfaat Penelitian
TINJAUAN PUSTAKA
Klasifikasi dan Budidaya Tanaman Kacang Panjang (Vigna sinensis L.)
Kacang panjang dalam taksonomi tumbuhan termasuk kingdom Plantae, subkingdom Tracheobionta (tumbuhan berpembuluh), super divisi Spermatophyta (menghasilkan biji), divisi Magnoliophyta (tumbuhan berbunga), kelas Magnoliopsida (berkeping dua atau dikotil), sub kelas Rosidae, ordo Fabales, famili Fabaceae (suku polong-polongan), genus Vigna, spesies Vigna sinensis
(L). ex Hassk (Wikipedia 2012).
Tanaman kacang panjang merupakan tanaman semak, menjalar, semusim dengan tinggi kurang lebih 2,5 m. Batang tanaman ini tegak, silindris, lunak, berwarna hijau dengan permukaan licin. Daunnya majemuk, lonjong, berseling, panjang 6-8 cm, lebar 3-4,5 cm, tepi rata, pangkal membulat, ujung lancip, pertulangan menyirip, tangkai silindris, panjang kurang lebih 4 cm, dan berwarna hijau. Bunga tanaman ini terdapat pada ketiak daun, majemuk, tangkai silindris, panjang kurang lebih 12 cm, berwarna hijau keputih-putihan, mahkota berbentuk kupu-kupu, berwarna putih keunguan, benang sari bertangkai, panjang kurang lebih 2 cm, berwarna putih, kepala sari kuning, putik bertangkai, berwarna kuning, panjang kurang lebih 1 cm, dan berwarna ungu. Buah tanaman ini berbentuk polong, berwarna hijau, dan panjang 15-25 cm. Bijinya lonjong, pipih, berwarna coklat muda. Akarnya tunggang berwarna coklat muda (Hutapea 1994).
Bean common mosaic virus (BCMV)
BCMV termasuk ke dalam famili Potyviridae, genus Potyvirus. Potyvirus
merupakan kelompok virus tumbuhan terbesar yang diketahui saat ini (Agrios 2005).
Partikel BCMV mempunyai panjang 720 – 770 nm dan lebar 12 – 15 nm. Partikel virusnya terdiri dari 95% protein dan 5% RNA utas tunggal. Kestabilan virus dalam sap tanaman tergantung dari strain virus dan waktu infeksinya. Virus ini mempunyai titik panas inaktivasi 50 – 60 οC, titik batas pengenceran 10-3-10-4 dan ketahanan in vitro virus 1-4 hari pada suhu ruang (CABI 2005).
BCMV dapat ditularkan secara mekanis melalui beberapa spesies kutudaun secara nonpersisten dan melalui benih. Adapun beberapa spesies kutudaun yang dapat menjadi vektor BCMV antara lain Aphis gossypii, A. craccivora, A. medicanigis, A. rumicis, Hyalopterus atriplicis, Macrosiphum
ambrosiae, M. pisi dan M. solanifolii. Infeksi BCMV pada benih terjadi sebelum fase inisiasi bunga. Fenomena ini tampaknya terkait dengan transmisi serbuk sari ketika virus masuk ke dalam sel telur pada saat pembuahan (Sutic et al. 1999). BCMV mengalami perkembangan di dalam ovul dan kotiledon, tetapi tidak pada kulit benih. BCMV mampu mempertahankan infektivitas dalam biji selama 30 tahun (Morales & Bos 1988).
Tanaman yang terinfeksi secara sistemik, khususnya dari infeksi benih menunjukkan gejala daun dengan pola mosaik, daun menggulung dan mengerut sepanjang tulang daun. Gejala pada tanaman terinfeksi menunjukkan gejala daun belang, mosaik, jaringan tulang daun klorosis dan malformasi daun pada daun-daun muda. Secara umum tanaman yang diinokulasi dengan virus biasanya gejala akan muncul pada 7-10 hari setelah inokulasi (Djikstra & De Jager 1998).
Enzyme-linked immunosorbent assay (ELISA)
antigen dengan antibodi di dalam suatu sampel dengan menggunakan enzim sebagai pelapor (Lequin 2005). Menurut Djikstra & De Jager (1998) Beberapa keunggulan ELISA sebagai tes serologi untuk virus tumbuhan adalah :
• Konsentrasi virus yang digunakan sangat sedikit (1-10 ng/ml) dapat terdeteksi.
• Antibodi yang digunakan sangat sedikit.
• Metode ini dapat digunakan untuk deteksi sampel virus skala besar.
• Uji ini dapat digunakan menggunakan panduan standar yang sudah ditentukan.
• Hasil deteksi ELISA dapat diukur secara kuantitatif.
Umumnya ELISA dibedakan menjadi dua jenis yaitu, standard (direct) double antibody sandwich (DAS)-ELISA dan indirect ELISA (I-ELISA). Metode DAS-ELISA diperkenalkan pertama kali oleh Clark dan Adams pada tahun 1977 untuk deteksi virus tumbuhan dan uji ini pertama kali dilakukan pada plat 96 sumur berbahan polystyrene. Tahapan DAS-ELISA, pertama sumuran plat dicoating dengan menggunakan antibodi primer. Setelah plat dicuci, sampel virus dimasukkan ke dalam sumuran. Setelah dicuci kembali dengan Phosphat buffer saline tween (PBST), enzyme konjugat (antibodi kedua) diisikan ke dalam sumuran. Setelah dicuci kembali, enzyme substrat PNP (P-nitrophenylphosphate) dimasukkan ke dalam sumuran untuk pewarnaan (Djikstra & De Jager 1998).
Berbeda dengan DAS-ELISA, pada metode I-ELISA sampel virus (antigen) dimasukkan terlebih dahulu, setelah itu baru dimasukkan antibodi primer ke dalam sumuran dan selanjutnya tahapan prosedur sama dengan DAS-ELISA (Djikstra & De Jager 1998).
DAS-ELISA sangat dianjurkan untuk deteksi virus skala besar, tetapi untuk deteksi virus yang membutuhkan spesifikasi yang tinggi DAS-ELISA terkadang bermasalah dalam mendeteksi. Oleh karena itu dianjurkan menggunakan I-ELISA, karena hubungan serologi antar virus lebih stabil (Djikstra & De Jager 1998).
Tissue blot immunosorbent assay (TBIA)
TBIA merupakan uji serologi menggunakan membran Nitropure nitrocellulose (NPN) yang sangat efektif mendeteksi dan mendiagnosa virus tanaman. Teknik ini menggunakan bahan tanaman segar dan diblot pada kertas membran (Lin et al. 1990). Teknik TBIA merupakan kombinasi teknik ELISA dan Dot immunobinding assay (DIBA) serta mempunyai tingkat sensitivitas yang sama, prosedur yang digunakan sangat sederhana dan dapat digunakan untuk deteksi rutin dengan jumlah sampel yang banyak (Djikstra & De Jager 1998).
Pendekatan berbasis asam nukleat dipakai secara ekstensif untuk mendeteksi dan mengidentifikasi virus pada tanaman. Flinders Technology Associates (FTA) Cards membantu untuk mengoleksi dan menyimpan DNA dari tanaman untuk digunakan secara langsung maupun tidak langsung pada uji
Polymerase chain reaction (PCR). Teknik FTA cards efektif untuk mendeteksi RNA virus (Ndurungu et al. 2005). FTA cards dan membran NPN keduanya terbuat dari bahan yang sama, sehingga membran NPN pada metode TBIA juga dapat digunakan untuk uji Reverse transcription-PCR (RT-PCR).
TBIA dilakukan pada kertas membran yang ukurannya dapat disesuaikan dengan jumlah sampel yang ada. Sampel yang akan dispot digulung dan diiris ujungnya menggunakan pengiris, lalu dispot pada kertas membran dan ditunggu minimal dua jam dengan suhu ruang (Karle et al. 2004).
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian dilakukan di Laboratorium Virologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian IPB. Penelitian dilakukan mulai bulan Agustus sampai Desember 2011.
Metode Penelitian
Penanaman Tanaman Uji
Sampel benih tanaman kacang panjang dikumpulkan dari berbagai sumber, yaitu dari petani dan dari toko bahan-bahan pertanian. Benih lokal didapat dari Indramayu Jawa Barat (varietas tidak diketahui) dan benih yang dibeli dari toko pertanian yaitu varietas Parade (Panah Merah), New Jaliteng (Mutiara Bumi), Long Silk (Ramza Seed), Pilar (PT Bogor Seed), 777 (Panah Merah), Maharani (Kapal Terbang-Chia Tai), Lousiana (Sang Hyang Seri).
Benih tersebut masing-masing disemai pada nampan persemaian dengan jumlah benih yang diuji adalah 100 benih untuk setiap varietas (Gambar 1).
b a
Gambar 1 Benih disemai pada nampan persemaian. (a) 6 hari setelah tanam (HST) dan (b) 4 MST
Penyiapan Sampel Uji
menggunakan tutup eppendorf untuk keseragaman ukuran sampel uji. Tiap lima sampel daun dari lima tanaman uji dibuat menjadi satu sampel komposit (SK). Sehingga total sampel komposit ada 20 SK untuk tiap varietas benih yang diuji.
Semua sampel diuji serologi dengan menggunakan metode I-ELISA menggunakan antiserum BCMV (Agdia, USA).
Persentase BCMV Terbawa Benih
Sampel komposit yang terdeteksi positif BCMV secara serologi, kemudian dideteksi ulang secara individu untuk mendapatkan jumlah nyata tanaman yang positif terinfeksi BCMV. Benih yang terbawa BCMV dihitung dengan rumus :
Persentase virus terbawa benih = X 100 % Σ bibit contoh
Σ bibit yang positif dengan uji I-ELISA
Deteksi Serologi Virus Terbawa Benih
Metode I-ELISA. Tahap ELISA diawali dengan penyiapan sap sebagai antigen. Sap disiapkan dengan menggerus tanaman sakit menggunakan mortar dengan bufer ekstraksi [1,59 g Na2CO5; 2,93 g NaHCO3; 0,20 g NaN3; 20 g PVP
yang dilarutkan dalam 1 L Aquabides, pH 9,6] dengan perbandingan 1:100 (v/v). Sebanyak 100 µl sap diisikan ke dalam sumuran ELISA. Plat diinkubasi semalam pada suhu 4 οC, setelah itu plat dicuci sebanyak tujuh kali dengan 1x PBST (Phosphate buffer saline tween 20) [NaCl 8 g, KH2PO4 2 g, Na2HPO4 1,15 g, KCl
0,2 g, NaN3 0,2 g, Tween 20 0,5 ml, yang dilarutkan dalam 1 L Aquabides, pH
7,4].
0,2% egg albumin (Sigma A- 5253)] dan diinkubasi selama satu jam pada suhu ruang. Plat kemudian dicuci dengan PBST sebanyak delapan kali.
Reaksi pewarnaan dilakukan dengan memberikan ke dalam setiap sumuran 100 µl substrat PNP (P-nitrophenylphosphate) 1 tablet PNP dalam 5 ml buffer PNP (diethanolamine 97 ml, H2O 600 ml, NaN3 0,2 g, dilarutkan dalam 1 L
Aquabides, dan pH 9,8) dan diinkubasi selam 30-60 menit pada suhu ruang dan gelap. Perubahan warna diamati pada masing-masing sumuran. Apabila warna telah berubah menjadi kuning, reaksi segera dihentikan dengan menambahkan 50 µl NaOH 3M. Hasil ELISA dianalisis secara kuantitatif dengan ELISA reader
(BIO-RAD Model 550) pada panjang gelombang 405 nm. Uji dinyatakan positif jika nilai absorban ELISA (NAE) sampel uji nilainya 1,5 x NAE kontrol negatif (tanaman sehat).
Metode TBIA. Tahapan TBIA menggunakan metode yang telah dimodifikasi oleh Lin et al. (1990) dan Chen et al. (2004). Sampel daun kacang panjang sebanyak dua lembar daun digulung, diiris/dipotes dengan silet dan dispotkan pada kertas membran Nitropure nitrocellulose (NPN-GE Water & Process Technologies). Pada tiap pengujian, dispotkan jaringan tanaman sehat sebagai kontrol negatif kemudian kertas NPN dikeringanginkan minimal 2 jam. Untuk keseragaman, diatas kertas membran dilarikkan kertas berpola bulatan dengan ukuran yang sama (Gambar 2).
Kertas membran yang telah kering dicuci dengan 5% Triton X-100 (octyphenolpoly(ethyleneglycolether)x) selama 10 menit di atas shaker dengan
kecepatan 200 rpm untuk menghilangkan sisa tanaman, dan warna hijau daun pada kertas membran.
Setelah itu kertas membran diblocking dengan bufer potassium phosphate salin tween (KPST) [0,02 M K2HPO4, 0,15 M NaCl, pH 7,4) yang di dalamnya
mengandung 0,05% Tween-20, 5% susu skim, dan 0,5% bovine serum albumin (BSA)] diatas shaker (200 rpm) selama 20 menit.
Setelah itu kertas membran dicuci menggunakan Tween Tris buffer saline (TTBS)(0,05 M Tris base, 0,15 M NaCl, 0,05% Tween, pH 7,6), sebanyak dua kali masing-masing selama 10 menit, lalu selama 5 menit. Kertas membran kemudian diwarnai dengan menggunakan substrat nitroblue tetrazolium/5-bromo-4-chloro-3-indolylphosphate (NBT/BCIP, Sigma) sampai spot pada kertas membran berwarna ungu untuk sampel yang positif BCMV. Reaksi dihentikan dengan membuang substrat pewarna dan mencuci membran dengan air serta kemudian kertas NPN dikeringanginkan di atas tisu.
Optimasi Konsentrasi Antiserum. Oleh karena belum diketahui kombinasi antiserum yang optimal untuk deteksi BCMV kacang panjang, maka dilakukan pengujian beberapa kombinasi antiserum BCMV dan universal antiserum conjugat (antibodi kedua). Adapun konsentrasi kombinasi antiserum yang digunakan adalah 1:3 000; 1:5 000; 1:7 000; 1:10 000; 1:13 000; dan 1:15 000. Selain optimasi konsentrasi antiserum, dilakukan juga perbandingan deteksi sap dan spot pada konsentrasi antiserum yang optimal.
HASIL DAN PEMBAHASAN
Hasil
Uji Virus Terbawa Benih
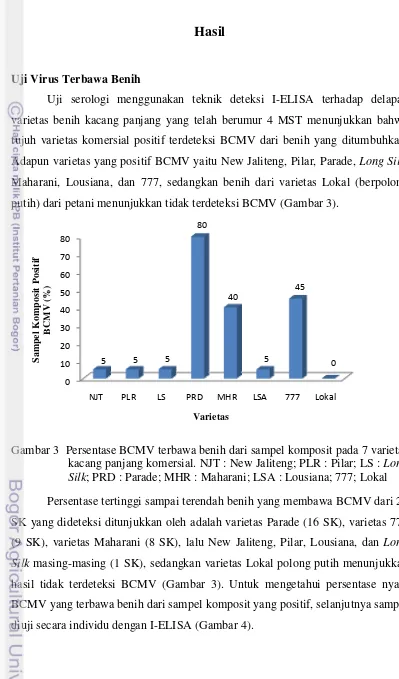
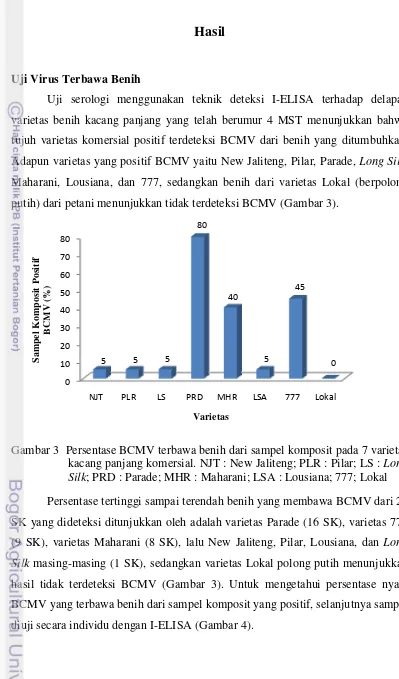
Uji serologi menggunakan teknik deteksi I-ELISA terhadap delapan varietas benih kacang panjang yang telah berumur 4 MST menunjukkan bahwa tujuh varietas komersial positif terdeteksi BCMV dari benih yang ditumbuhkan. Adapun varietas yang positif BCMV yaitu New Jaliteng, Pilar, Parade, Long Silk, Maharani, Lousiana, dan 777, sedangkan benih dari varietas Lokal (berpolong putih) dari petani menunjukkan tidak terdeteksi BCMV (Gambar 3).
0
NJT PLR LS PRD MHR LSA 777 Lokal 5 5 5
0
Gambar 4 Persentase BCMV terbawa benih pada 7 varietas kacang panjang komersial. NJT : New Jaliteng; PLR : Pilar; LS : Long Silk; PRD : Parade; MHR : Maharani; LSA : Lousiana; 777
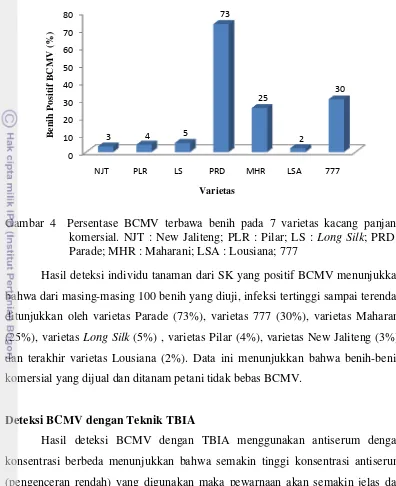
Hasil deteksi individu tanaman dari SK yang positif BCMV menunjukkan bahwa dari masing-masing 100 benih yang diuji, infeksi tertinggi sampai terendah ditunjukkan oleh varietas Parade (73%), varietas 777 (30%), varietas Maharani (25%), varietas Long Silk (5%) , varietas Pilar (4%), varietas New Jaliteng (3%), dan terakhir varietas Lousiana (2%). Data ini menunjukkan bahwa benih-benih komersial yang dijual dan ditanam petani tidak bebas BCMV.
Deteksi BCMV dengan Teknik TBIA
TBIA Konsentrasi Anti Serum
Waktu Warna Muncul (menit)
+
1 : 3 000 10 ‐
+
1 : 5 000 20 ‐
+
1 : 7 000 20 ‐
+
1 : 10 000 30 ‐
1 : 13 000 420
1 : 15 000 480
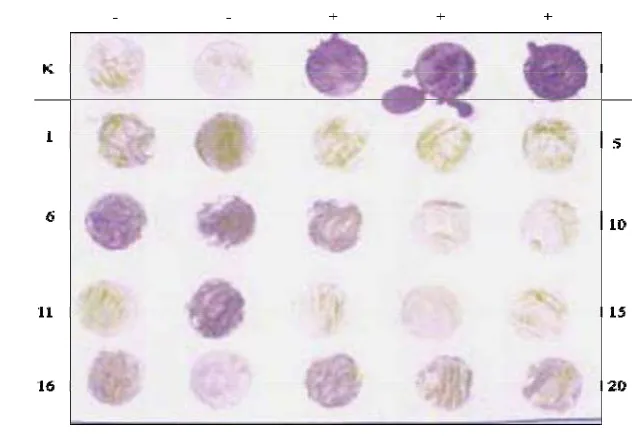
Gambar 5 Optimasi hasil deteksi BCMV pada konsentrasi antiserum yang berbeda. (+) : tanaman sakit; (-) : tanaman sehat
Gambar 6 TBIA BCMV kacang panjang dengan menggunakan konsentrasi antiserum. (a) ; 1:3 000; (b) ; 1:5 000; (+) : tanaman/sap terinfeksi; (-) : tanaman/sap sehat
Tabel 1 Hasil deteksi I-ELISA dari benih tanaman varietas Parade yang ditumbuhkan
No Rata-rata NAE Hasil*
Bufer 0,152 -
Kontrol (+) 2,864 +
Kontrol (-) 0,164 -
1* 0,169 - 2 0,211 - 3 0,212 - 4 0,239 - 5 0,316 + 6 0,273 + 7 0,260 +
8 0, 304 +
9 0,292 + 10 0,312 + 11 0,368 + 12 0,356 + 13 0,328 + 14 0,328 + 15 0,366 + 16 0,351 + 17 0,450 + 18 0,404 + 19 0,723 + 20 0,659 +
Gambar 7 Deteksi TBIA dari benih tanaman varietas Parade yang ditumbuhkan
Perbandingan Teknik Deteksi I-ELISA dan TBIA
Kelebihan dan kekurangan dua teknik ini ditabulasikan pada Tabel 2. Tabel 2 Perbandingan antara teknik I-ELISA dan TBIA dalam deteksi BCMV
Faktor Pembanding I-ELISA* TBIA*
Sensitivitas 0,01 g sampel daun Daun segar sedikit Objektivitas hasil Sedang-Tinggi Sedang Penggunaan alat bantu
otomatis
Banyak Sedikit
Media Plat ELISA 1 strip Kertas NPN 1,5 x 5 cm Antiserum BCMV (1 : 200) 4 µl 1µl
Antiserum 2nd 1µl 1µl
Penggunaan bufer Banyak Sedikit
Pewarna PNP 100 µl/sampel -
NBT/BCIP - Disesuaikan dengan kertas NPN (±1-3 ml) Kecepatan diagnosa ±22 -26 jam ±3 jam
Keterampilan yang dibutuhkan
Sedang Rendah
Prosedur pelaksanaan Banyak Sedikit Pengujian pada kondisi
lapang
Sedang Tinggi
Biaya Pengujian Rp 97.000,00 Rp 33.000,00
Perbandingan kedua metode dalam mendeteksi BCMV menunjukkan bahwa TBIA lebih mudah, murah, dan jauh lebih cepat dalam memberikan hasil deteksi dibandingkan I-ELISA. Dalam pengujian rutin, sering menggunakan jumlah sampel yang tidak banyak. Pada kondisi ini TBIA memberikan keleluasaan dan kemudahan dalam deteksi karena kertas membran yang digunakan dapat disesuaikan dengan jumlah sampel. Sedangkan pada I-ELISA jumlah sampel sedikit atau banyak dalam satu plat akan membutuhkan biaya yang sama dan lebih mahal dari TBIA.
Keunggulan pengujian teknik I-ELISA di laboratorium yaitu pembacaan hasil pengujian dapat dilakukan menggunakan ELISA reader, sehingga didapatkan hasil titer virus yang akurat secara kuantitatif. Sedangkan dengan teknik TBIA hanya dapat menentukan hasil deteksi virus secara kualitatif positif dan negatif saja.
Pembahasan
Deteksi Benih Hasil Growing On Test
Deteksi benih secara serologi pada delapan varietas kacang panjang menunjukkan tujuh varietas komersial positif BCMV, sedangkan varietas lokal menunjukkan tidak terdeteksi BCMV. Akan tetapi benih yang bereaksi positif pada I-ELISA tersebut belum memperlihatkan gejala pada saat dilakukan pengujian (4 MST). Hal tersebut membuktikan bahwa benih komersial yang ada di pasaran dan ditanam petani tidak bebas BCMV. Selain BCMV, penyebab mosaik kuning kacang panjang adalah CMV atau infeksi ganda BCMV dan CMV (Damayanti et al. 2009). Kemungkinan terdeteksi CMV dari benih ada karena CMV juga virus tular benih, namun dalam penelitian ini deteksi CMV tidak dilakukan.
salah satu upaya pengendalian BCMV adalah dengan penggunaan benih bebas virus dan tersedianya metode deteksi virus yang mudah dilakukan dalam deteksi rutin.
Dalam deteksi BCMV terbawa benih, sebaiknya benih ditumbuhkan sampai 4 MST. Hal ini karena sedikitnya virus yang terbawa benih sehingga tanaman perlu ditumbuhkan sampai virus mencapai konsentrasi yang terdeteksi dengan ELISA. Hasil deteksi dengan menumbuhkan benih sampai 2 MST pada varietas Maharani menunjukkan hasil negatif BCMV (data tidak diperlihatkan). Namun, setelah benih ditumbuhkan sampai 4 MST, varietas Maharani dari 100 sampel yang sama menunjukkan 25% benih yang diuji positif mengandung BCMV. Oleh karena itu, dalam seleksi benih bebas BCMV growing on test
(menumbuhkan benih) sampai 4 MST merupakan hal yang penting diperhatikan untuk mendapatkan hasil deteksi yang lebih akurat.
Deteksi serologi menggunakan sampel komposit dengan cara mencetak daun dengan tutup eppendrof merupakan cara yang mudah untuk keseragaman sampel uji dibandingkan pengambilan sampel yang tidak beraturan ukurannya. Sampel komposit (1 SK terdiri dari 5 tanaman yang berbeda) dengan ukuran yang sama memudahkan dalam pelaksanaan deteksi dan efisiensi penggunaan antiserum untuk deteksi sampel dalam jumlah banyak. Dengan bentuk daun yang sama dideteksi dalam bentuk sampel komposit, diharapkan sampel uji lebih homogen. Jika dari lima sampel uji, satu saja yang positif mengandung virus, akan positif terdeteksi walaupun dalam sampel komposit. Deteksi individu dari sampel komposit hanya dilakukan bila terdeteksi positif virus. Hal ini untuk efisiensi penggunaan antiserum.
Infeksi benih hanya terjadi saat BCMV menginfeksi tanaman sebelum pembentukan bunga, dan tidak terjadi setelah masa itu. Fenomena ini sepertinya terkait dengan transmisi BCMV melalui polen saat virus masuk ke dalam sel telur waktu fertilisasi. Selain itu tinggi rendahnya persentase BCMV terbawa benih juga dipengaruhi oleh waktu terjadinya infeksi virus. Semakin muda tanaman terinfeksi virus, semakin tinggi peluangnya terbawa benih (Sutic et al 1999).
Agrios (2005) berpendapat bahwa faktor genetik tidak hanya mempengaruhi gejala tetapi juga variasi dalam kerentanan terhadap patogen yang disebabkan perbedaan jenis dan jumlah gen yang mengatur ketahanan pada setiap jenis varietas. Tingginya persentase BCMV yang terdeteksi dari benih yang ditumbuhkan menunjukkan bahwa varietas komersial berpolong hijau diduga lebih rentan terhadap infeksi BCMV dibandingkan varietas yang berpolong putih asal petani dari Indramayu.
Kelebihan dan Kekurangan I-ELISA dan TBIA
Perbandingan kelebihan dan kekurangan dalam mendeteksi virus BCMV dengan menggunakan teknik I-ELISA dan TBIA membahas beberapa faktor utama. Kedua teknik deteksi tersebut dapat memberikan hasil deteksi yang baik.
Hasil deteksi kuantitatif I-ELISA dapat dilihat diukur menggunakan ELISA reader, sedangkan pada TBIA hasil deteksi hanya dapat dilihat dari pewarnaan kertas membran yang berwarna ungu untuk sampel positif virus dan tidak berwarna untuk kontrol sehat (kualitatif). Sehingga, pada deteksi TBIA tidak dapat diketahui titer virusnya dan adanya subjektivitas dalam penentuan warna ungu. Namun, TBIA memiliki kelebihan dalam deteksi dan identifikasi virus. Spot
Biaya yang dibutuhkan untuk deteksi virus dengan TBIA jauh lebih rendah dibandingkan I-ELISA karena penggunaan bufer-bufer dan antiserum uji sangat sedikit. Selain itu prosedur TBIA lebih mudah dan singkat dibandingkan I-ELISA (Gambar 2). Hal ini membuktikan TBIA dapat digunakan lebih banyak dalam deteksi rutin atau untuk mendeteksi sampel hasil survei karena prosedurnya mudah, murah, dan singkat. Namun, optimasi penggunaan antiserum spesifik virus dengan TBIA tetap harus dilakukan untuk mendapatkan hasil yang optimal.
KESIMPULAN DAN SARAN
Kesimpulan
Persentase BCMV terbawa benih komersial berkisar antara 2–73% tergantung varietas. Benih komersial yang berpolong hijau diduga lebih rentan terhadap infeksi BCMV dibanding benih lokal yang berpolong putih berdasarkan hasil deteksi benih yang ditumbuhkan.
Pengenceran kombinasi antiserum optimal untuk deteksi BCMV dengan TBIA berkisar 1:3 000 sampai 1:7 000, karena memberikan hasil deteksi yang tegas dan cepat dibandingkan dengan pengenceran antiserum yang lebih tinggi. Teknik deteksi BCMV dengan TBIA lebih mudah, murah, dan cepat dibandingkan I-ELISA serta lebih memungkinkan dilakukan di lapang, karena prosedur pelaksanaan yang digunakan lebih sedikit dibandingkan I-ELISA.
Saran
1. Perlu dilakukan penelitian terkait hubungan umur tanaman saat terinfeksi BCMV dengan persentase BCMV terbawa benih untuk mengetahui masa kritis tanaman terhadap infeksi BCMV.
2. Perlu diteliti upaya pengendalian BCMV pada benih terutama pada varietas yang rentan tetapi digemari konsumen.
DAFTAR PUSTAKA
Agrios GN. 2005. Plant Pathology. Ed. ke-5. New York: Academic Press. Anwar A, Sudarsono, Ilyas S. 2005. Indonesian vegetable seeds: Current
condition and prospects in business of vegetable seeds. Bulletin of Agronomy (33) (1): 38-47.
CABI [Central of Agricultural and Biosciences International]. 2005. Corp Protection Compendium. CAB International, Wallingford.
Chang Peta-Gaye S, Mclaughlin Wayne A, Tolin Sue A. 2010. Tissue blot immunoassay and direct RT-PCR of cucumoviruses and potyviruses from the same NitroPure nitrocellulose membrane. Journal of Virological Methods 117: 345-351.
Chen P, Buss GR, Tolin SA. 2004. Reaction of soybean to single and double inoculation with different Soybean mosaic virus strains. Crop Protection. 23: 965-971.
Damayanti TA. 2009. Kajian Sifat Bioekologi dan Biomolekuler Penyebab Outbreak Penyakit Kuning pada Kacang Panjang di Jawa Barat dan Jawa Tengah [abstrak]. J Bogor Agriculture University. http://www.repository. ipb.ac.id [31 Oktober 2011].
Damayanti TA, OJ Alabi, RA NAidu, Rauf A. 2009. Severe outbreak of a yellow mosaic disease on the yard long bean. In Bogor, West Java. Hayati Journal of Biosciences 16: 78-82
Djikstra J, De Jagger. 1998. Practical Plant Virology: Protocol and Exercise. Boston: Springer.
Hutapea JR. 1994. Inventaris Tanaman Obat Indonesia (III). Departemen Kesehatan: Jakarta.
Karle R, Holder F, Smith M. 2004. Application of FTA-based technology for sample collection, transport, purification and storage of PCR-ready plant DNA.WhatmanInc.http//www.whatman.com/References/WGI_1397_Plant Poster_V6.pdf. [08 Februari 2010].
Kartiningtyas. 2005. Deteksi Turnip mosaic virus (TuMV) pada benih dan jaringan daun. [skripsi]. Bogor: Fakultas Pertanian, Institut Pertanian Bogor.
Morales FJ, Bos L. 1988. Bean common mosaic virus/AAB Description of Plant Viruses. Virus Research 337.
Ndurungu J, Taylor NJ, Yadav J. Aly H, Legg JP, Aveling T, Thompson G, Fauquet CM. 2005. Application or FTA technology for sampling recovery and molecular characterization of viral pathogens and virus-derived transgenes from plant tissues. Virology. 2: 45, doi:10.1186/1743-422X-2-45. [PROSEA] Plant Resources South East Asia. 1996. Legume Genetic Resources: The PROSEA Manual for Authors, Editors, and Publishers. Ed ke-10. Oshkosh: University of Wisconsin.
Saleh N. 1997. Pengaruh biji belang dan pengendalian vektor terhadap intensitas serangan Soybean stunt virus dan hasil kedelai. Komponen teknologi peningkatan produksi tanaman kacang-kacangan dan umbi-umbian. Edisi Khusus Balitkabi 9: 82-89.
Setyastuti L. 2008. Tingkat ketahanan sembilan kultivar kacang panjang terhadap infeksi Bean common mosaic virus (BCMV). [skripsi]. Bogor: Fakultas Pertanian, Institut Pertanian Bogor.
Suryadi, Luthfy, Kusandriani Y, Gunawan. 2003. Karakteristik dan Deskripsi Plasma Nutfah Kacang Panjang. Buletin Plasma Nutfah 9(1): 1-10.
Susetio H. 2011. Penyakit mosaik kuning kacang panjang: respons varietas kacang panjang (Vigna sinensis L.) dan efisiensi penularan melalui kutudaun (Aphis craccivora Koch.). [skripsi]. Bogor: Fakultas Pertanian, Institut Pertanian Bogor.
Sutic DD, Ford RE, Tosic MT. 1999. Handbook of Plant Virus Diseases. CRC Press: 174-176.
Lampiran 1 Tabel Nilai absorban ELISA (NAE) sampel individu varietas Lousiana dan Long Silk
No Var. Lousiana No Var. Long Silk
NAE Keterangan* NAE Keterangan* Kontrol (-) 0,193 Kontrol (-) 0.099
1* 0,186 - 1* 0,391 +
2 0,183 - 2 0,410 +
3 0,167 - 3 0,390 +
4 0,526 + 4 0,435 +
5 0,436 + 5 0,418 +
*Uji positif jika NAE var. Lousiana > 0.289; Uji positif jika NAE var. Long Silk > 0,148
Lampiran 2 Tabel Nilai absorban ELISA (NAE) sampel individu varietas New Jaliteng dan Pilar
No Var. New Jaliteng No Var. Pilar
NAE Keterangan* NAE Keterangan* Kontrol (-) 0,099 Kontrol (-) 0,191
1* 0,310 + 1* 0,511 +
2 0,371 + 2 0,194 -
3 0,264 + 3 0,478 +
4 0,104 - 4 0,653 +
5 0,097 - 5 0,460 +
Lampiran 3 Tabel Nilai absorban ELISA (NAE) sampel individu varietas Parade
No NAE Keterangan* No NAE Keterangan*
Kontrol (-) 0,099 41 0,483 +
Lampiran 4 Tabel Nilai absorban ELISA (NAE) sampel individu varietas Maharani
No NAE Keterangan* No NAE Keterangan*
Kontrol (-) 0,193 21 0,602 +
1* 0,135 - 22 0,638 +
2 0,114 - 23 0,532 +
3 0,145 - 24 0,505 +
4 0,228 - 25 0,605 +
5 0,146 - 26 0,506 +
6 0,181 - 27 0,579 +
7 0,178 - 28 0,411 +
8 0,147 - 29 0,825 +
9 0,140 - 30 0,783 +
10 0,115 - 31 0,675 +
11 0,171 - 32 0,621 +
12 0,693 + 33 0,763 +
13 0,660 + 34 0,726 +
14 0,172 - 35 0,863 +
15 0,602 + 36 0,823 +
16 0,170 - 37 0,795 +
17 0,159 - 38 0,788 +
18 0,130 - 39 0,669 +
19 0,699 + 40 0,729 +
20 0,479 +
Lampiran 5 Tabel Nilai absorban ELISA (NAE) sampel individu varietas 777
No NAE Keterangan* No NAE Keterangan*
Kontrol (-) 0,193 23 0,411 +
1* 0,478 + 24 0,672 +
2 0,348 + 25 0,892 +
3 0,435 + 26 0,328 +
4 0,730 + 27 0,979 +
5 0,436 + 28 0,612 +
6 0,164 - 29 0,400 +
7 0,179 - 30 0,330 +
8 0,172 - 31 0,933 +
9 0,150 - 32 0,791 +
10 0,123 - 33 0,900 +
11 0,157 - 34 0,431 +
12 0,220 - 35 0,885 +
13 0,155 - 36 0,401 +
14 0,162 - 37 0,956 +
15 0,174 - 38 0,701 +
16 0,154 - 39 0,181 -
17 0,612 + 40 0,185 -
18 0,328 + 41 0,147 -
19 0,551 + 42 0,721 +
20 0,432 + 43 0,801 +
21 0,620 + 44 0,203 -
22 0,892 + 45 0,413 +
*Uji positif jika NAE > 0,289.
AVANTY WIDIAS MAHAR
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
AVANTY WIDIAS MAHAR. Deteksi Serologi Bean Common Mosaic Virus
(BCMV) dari Benih Kacang Panjang (Vigna sinensis L.) Komersial dan Petani. Dibimbing oleh TRI ASMIRA DAMAYANTI.
Kacang panjang (Vigna sinensis L) merupakan tanaman hortikultura yang banyak ditanam di Indonesia. Salah satu pembatas produksi kacang panjang adalah virus mosaik Bean common mosaic virus (BCMV), BCMV bersifat tular benih dan dapat ditularkan melalui kutudaun. Penelitian ini bertujuan untuk mengetahui kesehatan benih kacang panjang komersial dan petani serta membandingkan dua teknik deteksi serologi untuk BCMV yaitu Indirect-Enzyme-linked immunosorbent assay (I- ELISA) dan Tisue blot immunosorbent assay
(TBIA). Varietas komersial yang dideteksi antara lain Parade, New Jaliteng, Long Silk, Pilar, 777, Maharani, dan Lousiana, serta varietas dari petani yang dideteksi yaitu Lokal asal Indramayu. Sebanyak 100 benih dari setiap varietas ditumbuhkan pada media tanah di baki (growing on test) sampai berumur 4 minggu. Deteksi BCMV dilakukan terhadap 20 sampel komposit untuk tiap varietas dengan I-ELISA. Sampel komposit yang positif kemudian dideteksi ulang secara individu untuk mendapatkan persentase BCMV terbawa benih. Deteksi BCMV dengan TBIA diuji sensitivitasnya melalui penggunaan antiserum dengan pengenceran 1:3 000, 1:5 000, 1:7 000, 1:10 000, 1:13 000, dan 1:15 000. Hasil deteksi TBIA dari benih selanjutnya dibandingkan dengan hasil deteksi I-ELISA. Persentase BCMV terbawa benih tertinggi sampai terendah ditunjukkan berturut-turut oleh varietas Parade (73%), varietas 777 (30%), varietas Maharani (25%), varietas
Long Silk (5%), varietas Pilar (4%), varietas New Jaliteng (3%), dan terakhir varietas Lousiana (2%). Hal ini menunjukkan sebagian besar benih-benih komersial tidak bebas BCMV. Persentase terbawa benih diduga terkait dengan ketahanan tanaman terhadap BCMV. Deteksi BCMV menggunakan TBIA menunjukkan semakin tinggi pengenceran antiserum waktu yang dibutuhkan semakin lama pada reaksi pewarnaan. Namun sensitivitas hasil deteksi TBIA masih mampu mendeteksi BCMV sampai pengenceran 1:15 000. Diantara
pengenceran antiserum yang diuji menunjukkan bahwa pengenceran 1:3 000 – 1:7 000 memberikan hasil deteksi yang terbaik dalam waktu yang
singkat. Perbandingan hasil deteksi I-ELISA dan TBIA pada varietas Parade menunjukkan hasil yang hampir sama. Jika dibandingkan keduanya, deteksi BCMV menggunakan TBIA lebih cepat, murah, dan mudah dibandingkan I-ELISA. Kecepatan diagnosa TBIA jauh lebih singkat (± 3 jam) dibandingkan I-ELISA (22-26 jam), serta pengujian langsung di lapang lebih mudah dan lebih memungkinkan dibandingkan ELISA.
PENDAHULUAN
Latar Belakang
Kacang panjang (Vigna sinensis L.) merupakan salah satu tanaman hortikultura yang sering ditemui di pasar tradisional atau swalayan, menempati urutan ke- 8 dari 20 jenis sayuran yang dikonsumsi di Indonesia. Kacang panjang merupakan komoditas yang dapat dikembangkan untuk perbaikan gizi keluarga. Tanaman ini berumur pendek, tumbuh baik pada dataran sedang sampai dataran rendah, dapat ditanam di lahan sawah, tegalan atau pekarangan pada setiap musim. Usahatani kacang panjang dapat diandalkan sebagai usaha agribisnis yang mampu meningkatkan pendapatan petani (Suryadi et al. 2003).
Luas panen kacang panjang mengalami penurunan sebanyak 12% (sekitar 70 000 ha) dengan kemampuan produksi yang tergolong rendah, yaitu 275,73 ton dan 10,09 ton/ha untuk berturut-turut rataan produksi dan produktivitas nasional. Salah satu faktor penyebab masih rendahnya daya hasil tanaman sayuran di Indonesia adalah penggunaan benih sayuran dengan mutu genetik dan fisiologis yang kurang baik, dan beberapa gangguan penyakit tanaman. Penyakit penting kacang panjang di Indonesia diantaranya layu cendawan (Fusarium sp.), antraknosa (Colletotrichum sp.), puru akar (Meloidogyne sp.), dan mosaik yang disebabkan oleh beberapa jenis virus diantaranya Bean common mosaic virus
(BCMV), Bean yellow mosaic virus (BYMV), dan Cowpea aphid borne mosaic virus (CaBMV) (Anwar et al. 2005).
Pada tahun 2008-2009 dilaporkan terjadi ledakan penyakit mosaik kuning pada tanaman kacang panjang yang meluas di beberapa daerah di kawasan Jawa Barat dan Jawa Tengah. Penyebab terbanyak penyakit mosaik kuning di Jawa Barat (Bogor, Karawang, Subang, Indramayu, dan Cirebon) dan Jawa Tengah (Tegal dan Pekalongan) adalah BCMV-strain black eye cowpea (BCMV-BIC) yang menginfeksi secara tunggal atau bersama dengan Cucumber mosaic virus
(CMV) (Damayanti 2009, Damayanti et al. 2009).
ekonomis sangat penting karena ditularkan melalui benih dan menyebar secara alami melalui kutudaun secara non persisten (Morales & Bos 1988).
Strategi pengendalian virus, termasuk BCMV umumnya mengandalkan penggunaan benih sehat, menghilangkan tanaman terinfeksi, menggunakan varietas tahan, dan penyemprotan insektisida untuk mengendalikan serangga vektor (Saleh 1997). Penggunaan benih tahan dan sehat merupakan upaya terbaik mencegah infeksi virus yang terbawa benih.
Kenyataan masih tingginya intensitas serangan mosaik kuning di lapang sampai saat ini melatarbelakangi penelitian ini untuk mendapatkan informasi kesehatan benih petani dan komersial yang digunakan atau ditanam. Salah satu upaya untuk memperoleh benih sehat adalah dengan tersedianya teknik deteksi virus yang akurat dan mudah dilakukan secara rutin untuk seleksi benih sehat dan monitoring penyakit di lapang. Teknik deteksi serologi merupakan salah satu teknik deteksi yang banyak digunakan secara luas, terutama untuk deteksi virus dalam jumlah banyak. Dalam penelitian ini akan diuji kesehatan benih komersial dan petani terhadap BCMV dengan deteksi serologi I-ELISA, dan dilakukan juga optimasi deteksi BCMV dengan teknik TBIA.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui kesehatan benih kacang panjang komersial dan petani sebagai landasan dalam program sertifikasi benih serta membandingkan dua teknik deteksi serologi untuk BCMV yaitu ELISA dan TBIA.
Manfaat Penelitian
TINJAUAN PUSTAKA
Klasifikasi dan Budidaya Tanaman Kacang Panjang (Vigna sinensis L.)
Kacang panjang dalam taksonomi tumbuhan termasuk kingdom Plantae, subkingdom Tracheobionta (tumbuhan berpembuluh), super divisi Spermatophyta (menghasilkan biji), divisi Magnoliophyta (tumbuhan berbunga), kelas Magnoliopsida (berkeping dua atau dikotil), sub kelas Rosidae, ordo Fabales, famili Fabaceae (suku polong-polongan), genus Vigna, spesies Vigna sinensis
(L). ex Hassk (Wikipedia 2012).
Tanaman kacang panjang merupakan tanaman semak, menjalar, semusim dengan tinggi kurang lebih 2,5 m. Batang tanaman ini tegak, silindris, lunak, berwarna hijau dengan permukaan licin. Daunnya majemuk, lonjong, berseling, panjang 6-8 cm, lebar 3-4,5 cm, tepi rata, pangkal membulat, ujung lancip, pertulangan menyirip, tangkai silindris, panjang kurang lebih 4 cm, dan berwarna hijau. Bunga tanaman ini terdapat pada ketiak daun, majemuk, tangkai silindris, panjang kurang lebih 12 cm, berwarna hijau keputih-putihan, mahkota berbentuk kupu-kupu, berwarna putih keunguan, benang sari bertangkai, panjang kurang lebih 2 cm, berwarna putih, kepala sari kuning, putik bertangkai, berwarna kuning, panjang kurang lebih 1 cm, dan berwarna ungu. Buah tanaman ini berbentuk polong, berwarna hijau, dan panjang 15-25 cm. Bijinya lonjong, pipih, berwarna coklat muda. Akarnya tunggang berwarna coklat muda (Hutapea 1994).
Bean common mosaic virus (BCMV)
BCMV termasuk ke dalam famili Potyviridae, genus Potyvirus. Potyvirus
merupakan kelompok virus tumbuhan terbesar yang diketahui saat ini (Agrios 2005).
Partikel BCMV mempunyai panjang 720 – 770 nm dan lebar 12 – 15 nm. Partikel virusnya terdiri dari 95% protein dan 5% RNA utas tunggal. Kestabilan virus dalam sap tanaman tergantung dari strain virus dan waktu infeksinya. Virus ini mempunyai titik panas inaktivasi 50 – 60 οC, titik batas pengenceran 10-3-10-4 dan ketahanan in vitro virus 1-4 hari pada suhu ruang (CABI 2005).
BCMV dapat ditularkan secara mekanis melalui beberapa spesies kutudaun secara nonpersisten dan melalui benih. Adapun beberapa spesies kutudaun yang dapat menjadi vektor BCMV antara lain Aphis gossypii, A. craccivora, A. medicanigis, A. rumicis, Hyalopterus atriplicis, Macrosiphum
ambrosiae, M. pisi dan M. solanifolii. Infeksi BCMV pada benih terjadi sebelum fase inisiasi bunga. Fenomena ini tampaknya terkait dengan transmisi serbuk sari ketika virus masuk ke dalam sel telur pada saat pembuahan (Sutic et al. 1999). BCMV mengalami perkembangan di dalam ovul dan kotiledon, tetapi tidak pada kulit benih. BCMV mampu mempertahankan infektivitas dalam biji selama 30 tahun (Morales & Bos 1988).
Tanaman yang terinfeksi secara sistemik, khususnya dari infeksi benih menunjukkan gejala daun dengan pola mosaik, daun menggulung dan mengerut sepanjang tulang daun. Gejala pada tanaman terinfeksi menunjukkan gejala daun belang, mosaik, jaringan tulang daun klorosis dan malformasi daun pada daun-daun muda. Secara umum tanaman yang diinokulasi dengan virus biasanya gejala akan muncul pada 7-10 hari setelah inokulasi (Djikstra & De Jager 1998).
Enzyme-linked immunosorbent assay (ELISA)
antigen dengan antibodi di dalam suatu sampel dengan menggunakan enzim sebagai pelapor (Lequin 2005). Menurut Djikstra & De Jager (1998) Beberapa keunggulan ELISA sebagai tes serologi untuk virus tumbuhan adalah :
• Konsentrasi virus yang digunakan sangat sedikit (1-10 ng/ml) dapat terdeteksi.
• Antibodi yang digunakan sangat sedikit.
• Metode ini dapat digunakan untuk deteksi sampel virus skala besar.
• Uji ini dapat digunakan menggunakan panduan standar yang sudah ditentukan.
• Hasil deteksi ELISA dapat diukur secara kuantitatif.
Umumnya ELISA dibedakan menjadi dua jenis yaitu, standard (direct) double antibody sandwich (DAS)-ELISA dan indirect ELISA (I-ELISA). Metode DAS-ELISA diperkenalkan pertama kali oleh Clark dan Adams pada tahun 1977 untuk deteksi virus tumbuhan dan uji ini pertama kali dilakukan pada plat 96 sumur berbahan polystyrene. Tahapan DAS-ELISA, pertama sumuran plat dicoating dengan menggunakan antibodi primer. Setelah plat dicuci, sampel virus dimasukkan ke dalam sumuran. Setelah dicuci kembali dengan Phosphat buffer saline tween (PBST), enzyme konjugat (antibodi kedua) diisikan ke dalam sumuran. Setelah dicuci kembali, enzyme substrat PNP (P-nitrophenylphosphate) dimasukkan ke dalam sumuran untuk pewarnaan (Djikstra & De Jager 1998).
Berbeda dengan DAS-ELISA, pada metode I-ELISA sampel virus (antigen) dimasukkan terlebih dahulu, setelah itu baru dimasukkan antibodi primer ke dalam sumuran dan selanjutnya tahapan prosedur sama dengan DAS-ELISA (Djikstra & De Jager 1998).
DAS-ELISA sangat dianjurkan untuk deteksi virus skala besar, tetapi untuk deteksi virus yang membutuhkan spesifikasi yang tinggi DAS-ELISA terkadang bermasalah dalam mendeteksi. Oleh karena itu dianjurkan menggunakan I-ELISA, karena hubungan serologi antar virus lebih stabil (Djikstra & De Jager 1998).
Tissue blot immunosorbent assay (TBIA)
TBIA merupakan uji serologi menggunakan membran Nitropure nitrocellulose (NPN) yang sangat efektif mendeteksi dan mendiagnosa virus tanaman. Teknik ini menggunakan bahan tanaman segar dan diblot pada kertas membran (Lin et al. 1990). Teknik TBIA merupakan kombinasi teknik ELISA dan Dot immunobinding assay (DIBA) serta mempunyai tingkat sensitivitas yang sama, prosedur yang digunakan sangat sederhana dan dapat digunakan untuk deteksi rutin dengan jumlah sampel yang banyak (Djikstra & De Jager 1998).
Pendekatan berbasis asam nukleat dipakai secara ekstensif untuk mendeteksi dan mengidentifikasi virus pada tanaman. Flinders Technology Associates (FTA) Cards membantu untuk mengoleksi dan menyimpan DNA dari tanaman untuk digunakan secara langsung maupun tidak langsung pada uji
Polymerase chain reaction (PCR). Teknik FTA cards efektif untuk mendeteksi RNA virus (Ndurungu et al. 2005). FTA cards dan membran NPN keduanya terbuat dari bahan yang sama, sehingga membran NPN pada metode TBIA juga dapat digunakan untuk uji Reverse transcription-PCR (RT-PCR).
TBIA dilakukan pada kertas membran yang ukurannya dapat disesuaikan dengan jumlah sampel yang ada. Sampel yang akan dispot digulung dan diiris ujungnya menggunakan pengiris, lalu dispot pada kertas membran dan ditunggu minimal dua jam dengan suhu ruang (Karle et al. 2004).
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian dilakukan di Laboratorium Virologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian IPB. Penelitian dilakukan mulai bulan Agustus sampai Desember 2011.
Metode Penelitian
Penanaman Tanaman Uji
Sampel benih tanaman kacang panjang dikumpulkan dari berbagai sumber, yaitu dari petani dan dari toko bahan-bahan pertanian. Benih lokal didapat dari Indramayu Jawa Barat (varietas tidak diketahui) dan benih yang dibeli dari toko pertanian yaitu varietas Parade (Panah Merah), New Jaliteng (Mutiara Bumi), Long Silk (Ramza Seed), Pilar (PT Bogor Seed), 777 (Panah Merah), Maharani (Kapal Terbang-Chia Tai), Lousiana (Sang Hyang Seri).
Benih tersebut masing-masing disemai pada nampan persemaian dengan jumlah benih yang diuji adalah 100 benih untuk setiap varietas (Gambar 1).
b a
Gambar 1 Benih disemai pada nampan persemaian. (a) 6 hari setelah tanam (HST) dan (b) 4 MST
Penyiapan Sampel Uji
menggunakan tutup eppendorf untuk keseragaman ukuran sampel uji. Tiap lima sampel daun dari lima tanaman uji dibuat menjadi satu sampel komposit (SK). Sehingga total sampel komposit ada 20 SK untuk tiap varietas benih yang diuji.
Semua sampel diuji serologi dengan menggunakan metode I-ELISA menggunakan antiserum BCMV (Agdia, USA).
Persentase BCMV Terbawa Benih
Sampel komposit yang terdeteksi positif BCMV secara serologi, kemudian dideteksi ulang secara individu untuk mendapatkan jumlah nyata tanaman yang positif terinfeksi BCMV. Benih yang terbawa BCMV dihitung dengan rumus :
Persentase virus terbawa benih = X 100 % Σ bibit contoh
Σ bibit yang positif dengan uji I-ELISA
Deteksi Serologi Virus Terbawa Benih
Metode I-ELISA. Tahap ELISA diawali dengan penyiapan sap sebagai antigen. Sap disiapkan dengan menggerus tanaman sakit menggunakan mortar dengan bufer ekstraksi [1,59 g Na2CO5; 2,93 g NaHCO3; 0,20 g NaN3; 20 g PVP
yang dilarutkan dalam 1 L Aquabides, pH 9,6] dengan perbandingan 1:100 (v/v). Sebanyak 100 µl sap diisikan ke dalam sumuran ELISA. Plat diinkubasi semalam pada suhu 4 οC, setelah itu plat dicuci sebanyak tujuh kali dengan 1x PBST (Phosphate buffer saline tween 20) [NaCl 8 g, KH2PO4 2 g, Na2HPO4 1,15 g, KCl
0,2 g, NaN3 0,2 g, Tween 20 0,5 ml, yang dilarutkan dalam 1 L Aquabides, pH
7,4].
0,2% egg albumin (Sigma A- 5253)] dan diinkubasi selama satu jam pada suhu ruang. Plat kemudian dicuci dengan PBST sebanyak delapan kali.
Reaksi pewarnaan dilakukan dengan memberikan ke dalam setiap sumuran 100 µl substrat PNP (P-nitrophenylphosphate) 1 tablet PNP dalam 5 ml buffer PNP (diethanolamine 97 ml, H2O 600 ml, NaN3 0,2 g, dilarutkan dalam 1 L
Aquabides, dan pH 9,8) dan diinkubasi selam 30-60 menit pada suhu ruang dan gelap. Perubahan warna diamati pada masing-masing sumuran. Apabila warna telah berubah menjadi kuning, reaksi segera dihentikan dengan menambahkan 50 µl NaOH 3M. Hasil ELISA dianalisis secara kuantitatif dengan ELISA reader
(BIO-RAD Model 550) pada panjang gelombang 405 nm. Uji dinyatakan positif jika nilai absorban ELISA (NAE) sampel uji nilainya 1,5 x NAE kontrol negatif (tanaman sehat).
Metode TBIA. Tahapan TBIA menggunakan metode yang telah dimodifikasi oleh Lin et al. (1990) dan Chen et al. (2004). Sampel daun kacang panjang sebanyak dua lembar daun digulung, diiris/dipotes dengan silet dan dispotkan pada kertas membran Nitropure nitrocellulose (NPN-GE Water & Process Technologies). Pada tiap pengujian, dispotkan jaringan tanaman sehat sebagai kontrol negatif kemudian kertas NPN dikeringanginkan minimal 2 jam. Untuk keseragaman, diatas kertas membran dilarikkan kertas berpola bulatan dengan ukuran yang sama (Gambar 2).
Kertas membran yang telah kering dicuci dengan 5% Triton X-100 (octyphenolpoly(ethyleneglycolether)x) selama 10 menit di atas shaker dengan
kecepatan 200 rpm untuk menghilangkan sisa tanaman, dan warna hijau daun pada kertas membran.
Setelah itu kertas membran diblocking dengan bufer potassium phosphate salin tween (KPST) [0,02 M K2HPO4, 0,15 M NaCl, pH 7,4) yang di dalamnya
mengandung 0,05% Tween-20, 5% susu skim, dan 0,5% bovine serum albumin (BSA)] diatas shaker (200 rpm) selama 20 menit.
Setelah itu kertas membran dicuci menggunakan Tween Tris buffer saline (TTBS)(0,05 M Tris base, 0,15 M NaCl, 0,05% Tween, pH 7,6), sebanyak dua kali masing-masing selama 10 menit, lalu selama 5 menit. Kertas membran kemudian diwarnai dengan menggunakan substrat nitroblue tetrazolium/5-bromo-4-chloro-3-indolylphosphate (NBT/BCIP, Sigma) sampai spot pada kertas membran berwarna ungu untuk sampel yang positif BCMV. Reaksi dihentikan dengan membuang substrat pewarna dan mencuci membran dengan air serta kemudian kertas NPN dikeringanginkan di atas tisu.
Optimasi Konsentrasi Antiserum. Oleh karena belum diketahui kombinasi antiserum yang optimal untuk deteksi BCMV kacang panjang, maka dilakukan pengujian beberapa kombinasi antiserum BCMV dan universal antiserum conjugat (antibodi kedua). Adapun konsentrasi kombinasi antiserum yang digunakan adalah 1:3 000; 1:5 000; 1:7 000; 1:10 000; 1:13 000; dan 1:15 000. Selain optimasi konsentrasi antiserum, dilakukan juga perbandingan deteksi sap dan spot pada konsentrasi antiserum yang optimal.
HASIL DAN PEMBAHASAN
Hasil
Uji Virus Terbawa Benih
Uji serologi menggunakan teknik deteksi I-ELISA terhadap delapan varietas benih kacang panjang yang telah berumur 4 MST menunjukkan bahwa tujuh varietas komersial positif terdeteksi BCMV dari benih yang ditumbuhkan. Adapun varietas yang positif BCMV yaitu New Jaliteng, Pilar, Parade, Long Silk, Maharani, Lousiana, dan 777, sedangkan benih dari varietas Lokal (berpolong putih) dari petani menunjukkan tidak terdeteksi BCMV (Gambar 3).
0
NJT PLR LS PRD MHR LSA 777 Lokal 5 5 5
0
Gambar 4 Persentase BCMV terbawa benih pada 7 varietas kacang panjang komersial. NJT : New Jaliteng; PLR : Pilar; LS : Long Silk; PRD : Parade; MHR : Maharani; LSA : Lousiana; 777
Hasil deteksi individu tanaman dari SK yang positif BCMV menunjukkan bahwa dari masing-masing 100 benih yang diuji, infeksi tertinggi sampai terendah ditunjukkan oleh varietas Parade (73%), varietas 777 (30%), varietas Maharani (25%), varietas Long Silk (5%) , varietas Pilar (4%), varietas New Jaliteng (3%), dan terakhir varietas Lousiana (2%). Data ini menunjukkan bahwa benih-benih komersial yang dijual dan ditanam petani tidak bebas BCMV.
Deteksi BCMV dengan Teknik TBIA
TBIA Konsentrasi Anti Serum
Waktu Warna Muncul (menit)
+
1 : 3 000 10 ‐
+
1 : 5 000 20 ‐
+
1 : 7 000 20 ‐
+
1 : 10 000 30 ‐
1 : 13 000 420
1 : 15 000 480
Gambar 5 Optimasi hasil deteksi BCMV pada konsentrasi antiserum yang berbeda. (+) : tanaman sakit; (-) : tanaman sehat
Gambar 6 TBIA BCMV kacang panjang dengan menggunakan konsentrasi antiserum. (a) ; 1:3 000; (b) ; 1:5 000; (+) : tanaman/sap terinfeksi; (-) : tanaman/sap sehat
Tabel 1 Hasil deteksi I-ELISA dari benih tanaman varietas Parade yang ditumbuhkan
No Rata-rata NAE Hasil*
Bufer 0,152 -
Kontrol (+) 2,864 +
Kontrol (-) 0,164 -
1* 0,169 - 2 0,211 - 3 0,212 - 4 0,239 - 5 0,316 + 6 0,273 + 7 0,260 +
8 0, 304 +
9 0,292 + 10 0,312 + 11 0,368 + 12 0,356 + 13 0,328 + 14 0,328 + 15 0,366 + 16 0,351 + 17 0,450 + 18 0,404 + 19 0,723 + 20 0,659 +
Gambar 7 Deteksi TBIA dari benih tanaman varietas Parade yang ditumbuhkan
Perbandingan Teknik Deteksi I-ELISA dan TBIA
Kelebihan dan kekurangan dua teknik ini ditabulasikan pada Tabel 2. Tabel 2 Perbandingan antara teknik I-ELISA dan TBIA dalam deteksi BCMV
Faktor Pembanding I-ELISA* TBIA*
Sensitivitas 0,01 g sampel daun Daun segar sedikit Objektivitas hasil Sedang-Tinggi Sedang Penggunaan alat bantu
otomatis
Banyak Sedikit
Media Plat ELISA 1 strip Kertas NPN 1,5 x 5 cm Antiserum BCMV (1 : 200) 4 µl 1µl
Antiserum 2nd 1µl 1µl
Penggunaan bufer Banyak Sedikit
Pewarna PNP 100 µl/sampel -
NBT/BCIP - Disesuaikan dengan kertas NPN (±1-3 ml) Kecepatan diagnosa ±22 -26 jam ±3 jam
Keterampilan yang dibutuhkan
Sedang Rendah
Prosedur pelaksanaan Banyak Sedikit Pengujian pada kondisi
lapang
Sedang Tinggi
Biaya Pengujian Rp 97.000,00 Rp 33.000,00
Perbandingan kedua metode dalam mendeteksi BCMV menunjukkan bahwa TBIA lebih mudah, murah, dan jauh lebih cepat dalam memberikan hasil deteksi dibandingkan I-ELISA. Dalam pengujian rutin, sering menggunakan jumlah sampel yang tidak banyak. Pada kondisi ini TBIA memberikan keleluasaan dan kemudahan dalam deteksi karena kertas membran yang digunakan dapat disesuaikan dengan jumlah sampel. Sedangkan pada I-ELISA jumlah sampel sedikit atau banyak dalam satu plat akan membutuhkan biaya yang sama dan lebih mahal dari TBIA.
Keunggulan pengujian teknik I-ELISA di laboratorium yaitu pembacaan hasil pengujian dapat dilakukan menggunakan ELISA reader, sehingga didapatkan hasil titer virus yang akurat secara kuantitatif. Sedangkan dengan teknik TBIA hanya dapat menentukan hasil deteksi virus secara kualitatif positif dan negatif saja.
Pembahasan
Deteksi Benih Hasil Growing On Test
Deteksi benih secara serologi pada delapan varietas kacang panjang menunjukkan tujuh varietas komersial positif BCMV, sedangkan varietas lokal menunjukkan tidak terdeteksi BCMV. Akan tetapi benih yang bereaksi positif pada I-ELISA tersebut belum memperlihatkan gejala pada saat dilakukan pengujian (4 MST). Hal tersebut membuktikan bahwa benih komersial yang ada di pasaran dan ditanam petani tidak bebas BCMV. Selain BCMV, penyebab mosaik kuning kacang panjang adalah CMV atau infeksi ganda BCMV dan CMV (Damayanti et al. 2009). Kemungkinan terdeteksi CMV dari benih ada karena CMV juga virus tular benih, namun dalam penelitian ini deteksi CMV tidak dilakukan.
salah satu upaya pengendalian BCMV adalah dengan penggunaan benih bebas virus dan tersedianya metode deteksi virus yang mudah dilakukan dalam deteksi rutin.
Dalam deteksi BCMV terbawa benih, sebaiknya benih ditumbuhkan sampai 4 MST. Hal ini karena sedikitnya virus yang terbawa benih sehingga tanaman perlu ditumbuhkan sampai virus mencapai konsentrasi yang terdeteksi dengan ELISA. Hasil deteksi dengan menumbuhkan benih sampai 2 MST pada varietas Maharani menunjukkan hasil negatif BCMV (data tidak diperlihatkan). Namun, setelah benih ditumbuhkan sampai 4 MST, varietas Maharani dari 100 sampel yang sama menunjukkan 25% benih yang diuji positif mengandung BCMV. Oleh karena itu, dalam seleksi benih bebas BCMV growing on test
(menumbuhkan benih) sampai 4 MST merupakan hal yang penting diperhatikan untuk mendapatkan hasil deteksi yang lebih akurat.
Deteksi serologi menggunakan sampel komposit dengan cara mencetak daun dengan tutup eppendrof merupakan cara yang mudah untuk keseragaman sampel uji dibandingkan pengambilan sampel yang tidak beraturan ukurannya. Sampel komposit (1 SK terdiri dari 5 tanaman yang berbeda) dengan ukuran yang sama memudahkan dalam pelaksanaan deteksi dan efisiensi penggunaan antiserum untuk deteksi sampel dalam jumlah banyak. Dengan bentuk daun yang sama dideteksi dalam bentuk sampel komposit, diharapkan sampel uji lebih homogen. Jika dari lima sampel uji, satu saja yang positif mengandung virus, akan positif terdeteksi walaupun dalam sampel komposit. Deteksi individu dari sampel komposit hanya dilakukan bila terdeteksi positif virus. Hal ini untuk efisiensi penggunaan antiserum.
Infeksi benih hanya terjadi saat BCMV menginfeksi tanaman sebelum pembentukan bunga, dan tidak terjadi setelah masa itu. Fenomena ini sepertinya terkait dengan transmisi BCMV melalui polen saat virus masuk ke dalam sel telur waktu fertilisasi. Selain itu tinggi rendahnya persentase BCMV terbawa benih juga dipengaruhi oleh waktu terjadinya infeksi virus. Semakin muda tanaman terinfeksi virus, semakin tinggi peluangnya terbawa benih (Sutic et al 1999).
Agrios (2005) berpendapat bahwa faktor genetik tidak hanya mempengaruhi gejala tetapi juga variasi dalam kerentanan terhadap patogen yang disebabkan perbedaan jenis dan jumlah gen yang mengatur ketahanan pada setiap jenis varietas. Tingginya persentase BCMV yang terdeteksi dari benih yang ditumbuhkan menunjukkan bahwa varietas komersial berpolong hijau diduga lebih rentan terhadap infeksi BCMV dibandingkan varietas yang berpolong putih asal petani dari Indramayu.
Kelebihan dan Kekurangan I-ELISA dan TBIA
Perbandingan kelebihan dan kekurangan dalam mendeteksi virus BCMV dengan menggunakan teknik I-ELISA dan TBIA membahas beberapa faktor utama. Kedua teknik deteksi tersebut dapat memberikan hasil deteksi yang baik.
Hasil deteksi kuantitatif I-ELISA dapat dilihat diukur menggunakan ELISA reader, sedangkan pada TBIA hasil deteksi hanya dapat dilihat dari pewarnaan kertas membran yang berwarna ungu untuk sampel positif virus dan tidak berwarna untuk kontrol sehat (kualitatif). Sehingga, pada deteksi TBIA tidak dapat diketahui titer virusnya dan adanya subjektivitas dalam penentuan warna ungu. Namun, TBIA memiliki kelebihan dalam deteksi dan identifikasi virus. Spot
Biaya yang dibutuhkan untuk deteksi virus dengan TBIA jauh lebih rendah dibandingkan I-ELISA karena penggunaan bufer-bufer dan antiserum uji sangat sedikit. Selain itu prosedur TBIA lebih mudah dan singkat dibandingkan I-ELISA (Gambar 2). Hal ini membuktikan TBIA dapat digunakan lebih banyak dalam deteksi rutin atau untuk mendeteksi sampel hasil survei karena prosedurnya mudah, murah, dan singkat. Namun, optimasi penggunaan antiserum spesifik virus dengan TBIA tetap harus dilakukan untuk mendapatkan hasil yang optimal.
KESIMPULAN DAN SARAN
Kesimpulan
Persentase BCMV terbawa benih komersial berkisar antara 2–73% tergantung varietas. Benih komersial yang berpolong hijau diduga lebih rentan terhadap infeksi BCMV dibanding benih lokal yang berpolong putih berdasarkan hasil deteksi benih yang ditumbuhkan.
Pengenceran kombinasi antiserum optimal untuk deteksi BCMV dengan TBIA berkisar 1:3 000 sampai 1:7 000, karena memberikan hasil deteksi yang tegas dan cepat dibandingkan dengan pengenceran antiserum yang lebih tinggi. Teknik deteksi BCMV dengan TBIA lebih mudah, murah, dan cepat dibandingkan I-ELISA serta lebih memungkinkan dilakukan di lapang, karena prosedur pelaksanaan yang digunakan lebih sedikit dibandingkan I-ELISA.
Saran
1. Perlu dilakukan penelitian terkait hubungan umur tanaman saat terinfeksi BCMV dengan persentase BCMV terbawa benih untuk mengetahui masa kritis tanaman terhadap infeksi BCMV.
2. Perlu diteliti upaya pengendalian BCMV pada benih terutama pada varietas yang rentan tetapi digemari konsumen.