EVALU
Saccharomyces
KINERJA PERT
IKAN MAS
BA
DEPAR
FAKULTAS P
INST
LUASI PENAMBAHAN RAGI BIR
es cerevisiae
DALAM PAKAN TERHAD
RTUMBUHAN DAN DAYA TAHAN TU
S
Cyprinus carpio
TERHADAP INFEKS
AKTERI
Aeromonas hydrophila
TIRA SILVIANTI
RTEMEN BUDIDAYA PERAIRAN
S PERIKANAN DAN ILMU KELAUTA
STITUT PERTANIAN BOGOR
BOGOR
2013
ADAP
TUBUH
KSI
EVALU
Saccharomyces
KINERJA PERT
IKAN MAS
BA
sebagai salah satu sy Program Stud
Fa
DEPAR
FAKULTAS P
INST
LUASI PENAMBAHAN RAGI BIR
es cerevisiae
DALAM PAKAN TERHAD
RTUMBUHAN DAN DAYA TAHAN TU
S
Cyprinus carpio
TERHADAP INFEKS
AKTERI
Aeromonas hydrophila
TIRA SILVIANTI
SKRIPSI
syarat untuk memperoleh gelar Sarjana Perikanan udi Teknologi & Manajemen Perikanan Budidaya
Departemen Budidaya Perairan Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
RTEMEN BUDIDAYA PERAIRAN
S PERIKANAN DAN ILMU KELAUTA
STITUT PERTANIAN BOGOR
BOGOR
2013
DAP
TUBUH
KSI
an pada ya
PERNYATAAN MENGENAI SKRIPSI
DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi yang berjudul:
EVALUASI PENAMBAHAN RAGI BIR Saccharomyces cerevisiae DALAM
PAKAN TERHADAP KINERJA PERTUMBUHAN DAN DAYA TAHAN
TUBUH IKAN MAS Cyprinus carpio TERHADAP INFEKSI BAKTERI
Aeromonas hydrophila
adalah benar merupakan hasil karya yang belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Februari 2013
TIRA SILVIANTI
PENGESAHAN
Judul : Evaluasi Penambahan Ragi Bir Saccharomyces cerevisiae dalam Pakan terhadap Kinerja Pertumbuhan dan Daya Tahan Tubuh Ikan Mas Cyprinus carpio terhadap Infeksi Bakteri Aeromonas hydrophila
Nama : Tira Silvianti
NIM : C14080041
Disetujui,
Pembimbing I Pembimbing II
Dr. Dedi Jusadi Dr. Dinamella Wahjuningrum
NIP: 19621026 198803 1 001 NIP: 19700521 199903 2 001
Mengetahui,
Ketua Departemen Budidaya perairan
Dr. Sukenda
NIP. 19671013 199302 1 001
KATA PENGANTAR
Puji syukur penulis panjatkan kepada Allah SWT atas karunia dan rahmat yang telah diberikan sehingga penulis dapat menyelesaikan skripsi dengan judul “Evaluasi PenambahanRagi BirSaccharomyces cerevisiaedalam Pakan terhadap Kinerja Pertumbuhan dan Daya Tahan Tubuh Ikan MasCyprinus carpioterhadap Infeksi Bakteri Aeromonas hydrophila” ini sebagai salah satu prasyaratan dalam memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Penelitian ini dilaksanakan pada September sampai dengan November 2012. Analisis proksimat bahan baku, pakan dan ikan uji dilaksanakan di Laboratorium Nutrisi Ikan; pembuatan pakan dilaksanakan di Laboratorium Pembuatan Pakan Ikan; dan pemeliharaan ikan dilaksanakan di Laboratorium Basah Nutrisi Ikan, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Penulis mengucapkan terima kasih kepada Dr. Dedi Jusadi dan Dr. Dinamella Wahjuningrum selaku dosen pembimbing. Selain itu, penulis menyampaikan terimakasih kepada PT. Multi Bintang Indonesia dan PT. Suri Tani Pemuka yang telah membantu dalam penyedian bahan baku pakan penelitian kepada penulis. Ungkapan terima kasih juga disampaikan kepada Ayah, Ibu, Kakak-kakak dan Adik-adik atas segala doa dan kasih sayangnya, kepada Pak Wasjan dan Mbak Retno atas bimbingannya selama di Laboratorium, kepada Tiara selaku teman seperjuangan yang telah bekerjasama dan membantu penulis selama penelitian hingga proses penulisan skripsi, serta teman-teman khususnya M. Rijalul Fikri, Burhan, Nia, Radianus, Arin, Ai, Nisa, Pika, Hidayatullah, Dendi, Ipha, Sri, kak Azam, kak Fajar dan teman-teman PATMO tercinta atas bantuan, semangat dan persahabatannya.
DAFTAR RIWAYAT HIDUP
Penulis dilahirkan di Pringsewu pada tanggal 20 Juni 1990 dari pasangan Bapak Salim Akil dan Ibu Juairiyah. Penulis merupakan anak keempat dari enam bersaudara. Setelah menyelesaikan pendidikan di SMA Negeri 1 Pringsewu, Lampung pada tahun 2008, penulis melanjutkan pendidikan di IPB melalui jalur Undangan Seleksi Masuk IPB (USMI) pada Program Studi Teknologi dan Manajemen Perikanan Budidaya, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Selama masa perkuliahan, penulis aktif di organisasi kemahasiswaan Himpunan Mahasiswa Akuakultur periode 2010-2011 pada divisi Komunikasi dan Kesejahteraan Mahasiswa (KKM). Selain itu, penulis pernah magang di Balai Besar Pengembangan Budidaya Air Tawar (BBPBAT) Sukabumi, Jawa Barat pada komoditas ikan mas dan ikan hias (Tahun 2009) dan melakukan praktik lapang di Balai Layanan Usaha Produksi Perikanan Budidaya (BLUPPB) Karawang, Jawa Barat pada komoditas udang vaname (Tahun 2011). Penulis juga pernah menjadi asisten mata kuliah Nutrisi Ikan semester ganjil 2011/2012, Teknologi Pembuatan Pakan Alami, Bentos, dan Alga semester ganjil 2011/2012 serta Teknologi Pembuatan dan Pemberian Pakan Ikan semester ganjil 2012/2013. Penulis pernah mengikuti Pekan Kreativitas Mahasiswa yang berjudul: Pencegahan Koi Herves Virus (KHV) dengan Vaksin DNA: Distribusi DNA Vaksin pada Berbagai Jaringan Ikan Mas melalui Pakan (didanai DIKTI) Tahun 2011 dan Rekayasa Produksi Induk Ikan Nila Putih (yy): Transplantasi Sel Testikular Ikan Nila Putih (Oreochromis niloticus) ke Ikan Nila Hitam (Oreochromis niloticus) Triploid (didanai DIKTI, lolos PIMNAS XXV di Yogyakarta dan mendapat penghargaan setara perak) Tahun 2012, serta sebagai salah satu anggota dari sepuluh kelompok terbaik pada kegiatan TanotoReseach Student Award(Tahun 2012).
Tugas akhir dalam pendidikan tinggi diselesaikan dengan menulis skripsi yang berjudul ”Evaluasi Penambahan Ragi Bir Saccharomyces cerevisiae
dalam Pakan terhadap Kinerja Pertumbuhan dan Daya Tahan Tubuh Ikan
ABSTRAK
TIRA SILVIANTI. Evaluasi Penambahan Ragi Bir Saccharomyces cerevisiae dalam Pakan terhadap Kinerja Pertumbuhan dan Daya Tahan Tubuh Ikan Mas Cyprinus carpio terhadap Infeksi BakteriAeromonas hydrophila. Dibimbing oleh
DEDI JUSADIdanDINAMELLA WAHJUNINGRUM
Penelitian ini bertujuan untuk mengetahui pengaruh penambahan ragi bir S. cerevisiae dalam pakan terhadap kinerja pertumbuhan dan daya tahan tubuh ikan mas C. carpio terhadap infeksi bakteri A. hydrophila. Penelitian dilakukan dengan tiga kali ulangan, ikan yang digunakan yaitu ikan mas dengan bobot awal rata-rata 7,61±0,07 g. Ikan dipelihara dalam 15 akuarium dengan dimensi 50x40x35 cm pada sistem resirkulasi, dengan padat penebaran 15 ekor/akuarium. Selama pemeliharaan ikan diberi pakan dengan penambahan ragi bir 0%, 3%, 6%, serta penambahan bioyeast 3%. Pada hari ke-48 dilakukan uji tantang dengan A. hydrophila (106 cfu/ml). Hasil penelitian menunjukkan bahwa penambahan ragi bir di dalam pakan memberikan pengaruh yang sama terhadap kinerja pertumbuhan ikan mas. Namun berdasarkan jumlah limbah yang dihasilkan akibat dari nilai efisiensi pakan, penambahan 6% ragi bir adalah perlakuan yang menghasilkan limbah budidaya paling sedikit. Disisi lain, penambahan ragi bir dan bioyeast pada seluruh kadar yang diujikan mampu menekan kematian ikan akibat infeksi bakteri Aeromonas hydrophila. Dengan demikian, ragi bir paling baik digunakan sebanyak 6% di dalam pakan ikan mas.
ABSTRACT
TIRA SILVIANTI. Evaluation of Brewer’s YeastSaccharomyces cerevisiae in the Diet on Growth Performance and Body Endurance of Common CarpCyprinus carpioagainst Bacterial Infection ofAeromonas hydrophila. Supervised byDEDI
JUSADIandDINAMELLA WAHJUNINGRUM
The objective of this research was to know the effect of brewer’s yeast S. cerevisiae in the diet on growth performance and resistance of common carp C. carpio against A. hydrophila infection. A triplicate experiment was conducted using fish with an initial body weight of 7,61±0,07 g. Fish were stocked in 50x40x35 cm recirculating aquaria at a density of 15 fish/aquaria. During rearing period, fish were fed on the diet contained brewer’s yeast of 0%, 3%, 6 %, or 3 % bioyeast, respectively. On day 48, the fish were infected with A. hydrophila (106 cfu/ml). The results showed that the growth performance of fish were the same in all treatments. However, based on the calculation of feeding efficiency, fish fed on the diet containing6% brewer’s yeastproduced the minimal waste. On the other hand, the mortality rate of infected fish was reduced when fish fed on the diet contained either brewer’s yeast or bioyeast. It can be concluded that the supplementation of 6% brewer’s yeast in the diet was suitable for common carp.
DAFTAR ISI
Halaman
DAFTAR TABEL... x
DAFTAR GAMBAR... xi
DAFTAR LAMPIRAN... xii
I. PENDAHULUAN... 1
1.1 Latar Belakang ... 1
1.2 Tujuan... 3
II. BAHAN DAN METODE... 4
2.1 Persiapan Wadah... 4
2.2 Pakan Uji ... 4
2.2.1 Persiapan Ragi Bir danBioyeast... 4
2.2.2 Analisis Kimia... 6
2.3 Ikan Uji... 6
2.3.1Persiapan Ikan Uji ... 6
2.3.2 Uji LD50... 7
2.3.3 Uji Tantang ... 7
2.4 Parameter Uji... 8
2.4.1 Jumlah Konsumsi Pakan (JKP) ... 8
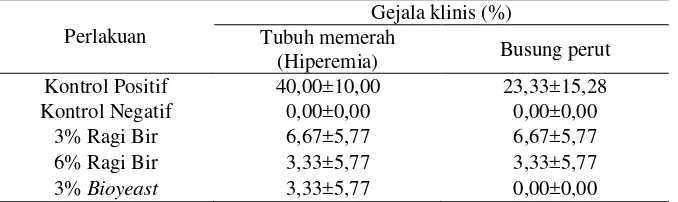
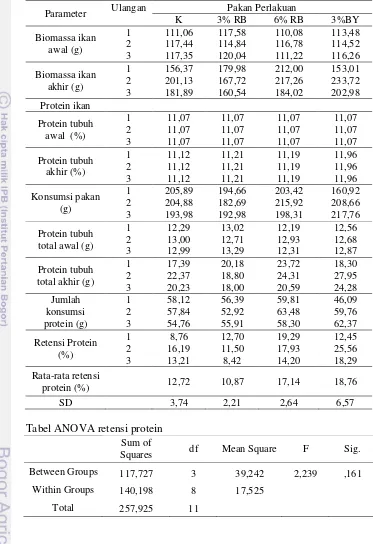
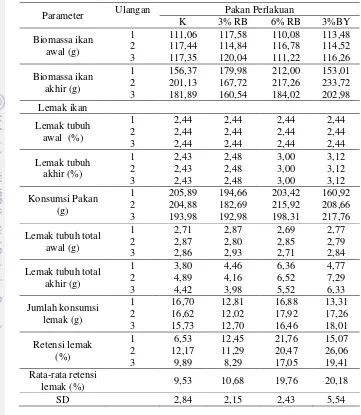
2.4.2 Retensi Protein (RP) ... 8
2.4.3 Retensi Lemak (RL) ... 9
2.4.4 Laju Pertumbuhan Harian (LPH) ... 9
2.4.5 Efisiensi Pakan (EP) ... 9
2.4.6 Tingkat Kelangsungan Hidup (TKH) ... 10
2.4.7 Gejala Klinis Ikan... 10
2.5 Analisis Data ... 10
III. HASIL DAN PEMBAHASAN... 11
3.1 Hasil ... 11
3.2 Pembahasan ... 15
IV. KESIMPULAN... 21
4.1 Kesimpulan ... 21
DAFTAR PUSTAKA... 22
DAFTAR TABEL
Halaman
1. Hasil proksimat ragi bir danbioyeast ... 4 2. Komposisi pakan uji ... 5 3. Hasil proksimat pakan perlakuan ... 5 4. Data kualitas air selama pemeliharaan ikan masCyprinus carpio.... 6 5. Jumlah konsumsi pakan (JKP), retensi protein (RP), retensi lemak
(RL), laju pertumbuhan harian (LPH), efisiensi pakan (EP), dan tingkat kelangsungan Hidup (TKH) ikan mas selama 40 hari masa pemeliharaan ... 12
xi
DAFTAR GAMBAR
Halaman
1. Peningkatan biomassa rata-rata ikan mas yang diberi pakan perlakuan ragi bir dengan kadar berbeda (0% ragi bir, 3% ragi bir,
6% ragi bir dan 3%bioyeast) setelah dipelihara selama 40 hari ... 11 2. Persentase tingkat kematian ikan per hari pasca infeksi
A. hydrophila ... 13 3. Tingkat kelangsungan hidup ikan mas di hari ke-10 pasca infeksi
DAFTAR LAMPIRAN
Halaman
1. Skema dan tata letak akuarium penelitian... 26
2. Perhitungan nilai LD50... 26
3. Prosedur analisis proksimat(Watanabe, 1988) ... 27
3.1 Prosedur analisis kadar abu ... 27
3.2 Prosedur analisis kadar air ... 27
3.3 Prosedur analisis kadar serat kasar ... 28
3.4 Prosedur analisis kadar protein ... 28
3.5 Prosedur analisis kadar lemak ... 30
4. Hasil Uji Statistik ... 31
4.1 Jumlah konsumsi pakan selama 40 hari pemeliharaan ... 31
4.2 Laju pertumbuhan harian selama 40 hari pemeliharaan ... 31
4.3 Tingkat kelangsungan hidup selama 40 hari pemeliharaan ... 32
4.4 Efisiensi pakan selama 40 hari pemeliharaan ... 32
4.5 Hasil proksimat tubuh ikan mas selama 40 hari pemeliharaan ... 32
4.6 Perhitungan retensi protein selama 40 hari pemeliharaan ... 33
4.7 Perhitungan retensi lemak selama 40 hari pemeliharaan ... 34
PENDAHULUAN
1.1 Latar Belakang
Selama ini sekitar 90% bahan baku pakan ikan yang beredar merupakan impor. Untuk mengurangi ketergantungan pada bahan baku impor, berbagai penelitian telah dilakukan untuk mencari bahan baku alternatif, yakni bahan baku lokal. Bahan baku lokal yang sudah diteliti sebagai bahan baku pakan antara lain biji karet, biji kapuk, kulit singkong, palm kernel meal (PKM), kopra (Edriani, 2011), kulit buah kakao (Kurniansyah, 2012), bungkil kelapa (Zuraida, 2012), tepung daun lamtoro (Fitriliyani, 2010). Hasil-hasil penelitian tersebut menunjukkan bahwa pemanfaatan berbagai bahan baku lokal berbasis bahan nabati dihadapkan pada kendala adanya zat anti nutrisi, rendahnya kandungan protein dan tingginya kandungan serat kasar yang menyebabkan kecernaan rendah.
Cara yang telah dilakukan untuk menurunkan kandungan serat kasar yaitu melalui proses hidrolisis atau fermentasi. Menurut penelitian yang telah dilakukan Edriani (2011), proses fermentasi mampu mengubah komposisi nutrisi pada bahan biji karet, biji kapuk, kulit singkong, PKM dan kopra dengan menggunakan Saccharomyces cerevisiae. Selain itu, penggunaan enzim cairan rumen domba telah banyak dilakukan untuk menurunkan serat kasar dan meningkatkan kecernaan pada bungkil kelapa (Zuraida, 2012), kulit buah kakao (Kurniansyah, 2012) dan tepung daun lamtoro (Fitriliyani, 2010). Namun penggunaan S. cerevisiae dan enzim cairan rumen domba untuk menurunkan serat kasar pada penelitian tersebut masih belum efisien untuk aplikasi skala komersil. Hal ini dikarenakan waktu fermentasi yang lama serta kendala dalam pengadaan rumen cairan domba.
Bahan baku alternatif lain yang memiliki prospek sebagai bahan baku pakan ikan adalah ragi birS.cerevisiae. Ragi bir merupakan hasil produk samping (limbah) dari industri pembuatan bir yang berpotensi digunakan sebagai bahan baku pembuatan pakan ikan. Gabungan Industri Minuman Malt Indonesia (GIMMI) mencatat produksi bir pada tahun 2011 berkisar 2.375.000 hektoliter (Rosita, 2011). Sedangkan jumlah ragi bir (limbah) yang dihasilkan dari salah satu produsen bir per hari yaitu mencapai 12 ton basah atau setara dengan 3 ton kering. Ragi bir memiliki kandungan nutrisi cukup baik, karena mengandung protein tinggi dan serat kasar rendah. Hasil proksimat awal dalam bobot kering, ragi bir memiliki kandungan abu 5,89 %, protein 56,37 %, serat kasar 0,44 %, lemak 1,29 % dan BETN 36,23%. Tingginya nilai protein dan rendahnya serat kasar tersebut, memberi peluang ragi bir sebagai sumber protein di dalam pakan bersama-sama bahan baku lain, seperti tepung kedelai, tepung ikan, meat bone meal, dan lain-lain.
Penggunaan ragi bir hingga 30% dalam pakan dapat meningkatkan efisiensi pakan untuk juvenil sea bass Dicentrarchus labrax berukuran 12 g (Oliva-Teles dan Goncalves, 2001). Sedangkan ragi bir sebanyak 2% di dalam pakan dapat meningkatkan pertumbuhan dan efisiensi pakan, serta daya tahan terhadap serangan penyakit pada juvenil hasil persilangan ikan striped bass Morone chrysopsdenganM.saxatilis(Li dan Gatlin, 2003).
Ragi bir juga berpotensi sebagai imunostimulan, karena mengandung asam nukleat dan polisakarida non pati, termasuk β-1,3 glukan. β-1,3 glukan efektif untuk meningkatkan fungsi imunitas dari beberapa spesies ikan budidaya seperti pada african catfish dengan dosis 1 g/kg pakan (Yoshida et al., 1995). Penelitian lainnya menunjukkan bahwa penambahan ragi bir dengan dosis 4-6% dapat meningkatkan kekebalan non spesifik tubuh juvenil ikan pikeperch Sander lucioperca(Jarmolowiczet al., 2011).
3
1.2 Tujuan
II. BAHAN DAN METODE
2.1 Persiapan Wadah
Prosedur penelitian melalui tahapan persiapan. Wadah budidaya ikan yang digunakan adalah akuarium berukuran 50x40x35 cm sebanyak 15 buah dan satu buah bak fiber berukuran 1.200ℓsebagai tandon. Akuarium dicuci hingga bersih lalu diisi dengan air hingga volume 60ℓdan tandon diisi air hingga volume 1.000 ℓ. Selanjutnya dilakukan instalasi aerator pada setiap akuarium dan sistem
resirkulasi. Pada sistem resirkulasi digunakan filter berupa kapas filter, batu zeolit dan karbon aktif. Sebelum digunakan untuk penelitian, dilakukan sterilisasi pada media pemeliharaan berupa pemberian klorin sebanyak 30 ppm dan disterilisasi dengan tiosulfat sebanyak 15 ppm. Setelah disterilisasi, air siap digunakan sebagai media budidaya. Pada tandon diberikanheateruntuk menjaga suhu air. Skema dan tata letak akuarium dapat dilihat pada Lampiran 1.
2.2 Pakan Uji
2.2.1 Persiapan Ragi Bir danBioyeast
Ragi bir yang baru didapat dari industri dikeringkan di bawah sinar matahari hingga terbentuk lapisan memadat, lalu dioven pada suhu 60oC hingga kering. Setelah kering, ragi bir dihaluskan hingga menjadi tepung dan siap dicampur dalam formulasi pakan uji. Bioyeast merupakan ragi komersial yang telah banyak dipasarkan sebagai produk suplemen untuk pakan ikan. Bioyeast diperoleh dari pabrik pakan dalam bentuk serbuk siap pakai. Penggunaanbioyeast dalam penelitian ini sebagai pembanding dari ragi bir. Hasil analisis proksimat ragi bir danbioyeastpada penelitian ini disajikan pada Tabel 1.
Tabel 1. Hasil proksimat ragi bir danbioyeast
Bahan Kadar Air
Kadar
Abu* Protein* Lemak*
Serat
Kasar* BETN*
Ragi bir 5,49 5,89 56,37 1,29 0,44 36,23
Bioyeast 4,20 15,30 52,71 7,94 18,44 1,41 Keterangan:
*dalam bobot kering
BETN = Bahan Ekstrak Tanpa Nitrogen
5 dengan oven. Kemudian pakan yang telah dibuat, dianalisis proksimat untuk mengetahui pemenuhan target protein, rasio energi protein, dan jumlah energi pakan. Hasil proksimat pakan perlakuan pada penelitian ini disajikan pada Tabel 3.
Tabel 2. Komposisi pakan uji
Bahan Baku Pakan Perlakuan (%)
0% Ragi Bir 3% Ragi bir 6% Ragi bir 3%Bioyeast
Jagung 1,94 1,94 1,94 1,94
Dedak 8,52 8,52 8,52 8,52
Tepung Gandum 11,48 11,48 11,48 11,48
Tapioka 20,00 20,00 20,00 20,00
Tepung Kedelai 31,76 28,86 25,98 28,86
Animal Pro 20,60 20,60 20,60 20,60
Minyak Ikan 1,06 1,00 0,92 1,00
Lisin 0,56 0,52 0,48 0,52
Metionin 0,22 0,22 0,22 0,22
Mineral Mix 2,62 2,62 2,62 2,62
Vitamin 0,02 0,02 0,02 0,02
Minyak Soya 1,22 1,22 1,22 1,22
Ragi Bir 0,00 3,00 6,00 0,00
Bioyeast 0,00 0,00 0,00 3,00
Total (%) 100 100 100 100
Tabel 3. Hasil proksimat pakan perlakuan
Parameter Pakan Perlakuan
0% Ragi Bir 3% Ragi bir 6% Ragi bir 3%Bioyeast
Kadar air (%) 10,38 6,98 6,75 9,11
Lemak (%) 8,10 6,58 8,30 8,27
Protein (%) 28,23 28,97 29,40 28,64
Serat kasar (%) 3,33 3,56 3,44 3,50
Kadar abu (%) 11,43 10,91 11,28 11,03
BETN (%) 38,53 43,00 40,83 39,45
GE (kkal/100g)1 392,20 400,38 410,06 399,87
c/p2 13,89 13,82 13,95 13,96
Keterangan :
1) GE =Gross Energy(Watanabe, 1988) 1 g protein = 5,6 kkal GE
1 g karbohidrat/BETN = 4,1 kkal GE 1 g lemak = 9,4 kkal GE
2.2.2 Analisis Kimia
Analisis proksimat dilakukan terhadap bahan, pakan dan ikan perlakuan. Analisis proksimat yang dilakukan meliputi kadar protein, lemak, serat kasar, abu, air, dan bahan ekstrak tanpa nitrogen (BETN). Analisis proksimat dilakukan di Laboratorium Nutrisi Ikan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Analisis proksimat untuk protein dilakukan dengan metode Kjeldahl, lemak dengan metode Soxchlet dan metode Folch, abu dengan pemanasan sampel dalam tanur bersuhu 600 oC, serat kasar menggunakan metode pelarutan sampel dengan asam dan basa kuat serta pemanasan, dan kadar air dengan metode pemanasan dalam oven bersuhu 105-110oC (Watanabe, 1988). Prosedur analisis proksimat pakan dan ikan dapat dilihat pada Lampiran 3.
2.3 Ikan Uji
2.3.1 Persiapan Ikan Uji
Ikan yang digunakan dalam penelitian ini berukuran 7,61±0,07 g. Ikan diperoleh dari petani ikan di Desa Situdaun, Bogor. Ikan ditebar dalam akuarium ukuran 50x40x35 cm dengan kepadatan 15 ekor per akuarium. Seluruh akuarium beserta sebuah tandon dirangkai menjadi satu sistem resirkulasi. Di dalam tandon air ukuran 1 ton disimpan 3 buah heater 350 watt, sehingga suhu di setiap akuarium ada di kisaran 28-31 ºC. Pemeliharaan ikan uji pada penelitian dilakukan selama 40 hari dengan diberi pakan uji. Pada hari ke-40 masa pemeliharaan, seluruh ikan ditimbang untuk evaluasi pertumbuhan. Selanjutnya pada hari ke-48 dilakukan uji tantang dengan cara injeksi bakteriA.hydrophila.
Selama pemeliharaan, ikan diberi pakan dengan metode at satiation (pemberian pakan sekenyangnya) dengan frekuensi pemberian tiga kali sehari, yaitu pukul 08.00 WIB, 12.00 WIB, dan 16.00 WIB. Kondisi kualitas air yang diukur selama penelitian dapat dilihat pada Tabel 4.
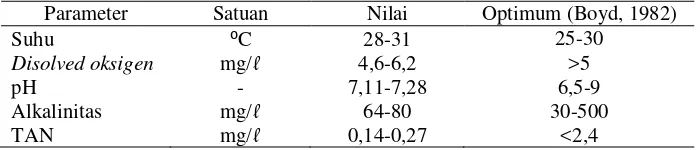
Tabel 4. Data kualitas air selama pemeliharaan ikan masCyprinus carpio Parameter Satuan Nilai Optimum (Boyd, 1982)
Suhu ⁰C 28-31 25-30
Disolved oksigen mg/ℓ 4,6-6,2 >5
pH - 7,11-7,28 6,5-9
Alkalinitas mg/ℓ 64-80 30-500
7
2.3.2 Uji LD50
Letal Dosis 50% (LD50) adalah suatu besaran yang diturunkan secara statistik, guna menyatakan dosis tunggal suatu senyawa yang diperkirakan dapat mematikan atau menimbulkan efek toksik yang berarti pada 50% hewan coba setelah perlakuan (Sulastry, 2009). Hal ini penting untuk mengetahui konsentrasi bakteri yang digunakan untuk melakukan uji tantang. Uji tantang dengan menggunakan bakteri A.hydrophila yang diperoleh dari Laboratorium Kesehatan Ikan Departemen Budidaya Perairan, Institut Pertanian Bogor. Bakteri yang diujikan diregenerasi terlebih dahulu sebelum digunakan. Bakteri stok dari kultur primer digores ulang pada cawan petri dengan goresan kuadran. Koloni tunggal dan homogen yang terbentuk diambil sebanyak satu ose, lalu diinokulasikan ke dalam tabung yang berisi 10 ml mediaTrypticase Soy Broth (TSB). Selanjutnya bakteri diinkubasi selama 24 jam pada suhu 29 oC dalam inkubator bergoyang (shaker).
Ikan uji yang digunakan dalam LD50 ini berukuran 12,71±1,59 g, setiap akuarium diisi sebanyak 8 ekor ikan. Ikan dipelihara dalam 8 buah akuarium berukuran 50x40x35 cm, dengan ulangan sebanyak 2 kali. Pada uji LD50, A. hydrophila yang digunakan dikultur pada media Trypticase Soy Broth (TSB), kemudian dicuci dengan menggunakan Posphat Buffer Saline (PBS) sebanyak 2 kali. Bakteri disuntikkan ke ikan dengan kepadatan 105sampai 108cfu/ml secara intraperitonial sebanyak 0,1 mℓ/ekor ikan. Pengamatan dilakukan dengan menghitung jumlah ikan yang masih hidup dan yang mati sampai hari ke sepuluh. Kemudian dilakukan penghitungan untuk mengetahui LD50, yaitu konsentrasi pada waktu ikan mati sebanyak 50% dari populasi (EHSC, 2001). Berdasarkan uji patogenitas dengan menghitung LD50 didapatkan konsentrasi bakteri yang mendekati kematian 50% dari populasi ikan mas selama sepuluh hari adalah bakteri dengan kepadatan 106cfu/mℓ(Lampiran 2).
2.3.3 Uji Tantang
1. K+ (kontrol positif) : perlakuan ragi bir 0%, diinjeksiA. hydrophila 2. K- (kontrol negatif) : perlakuan ragi bir 0%, diinjeksi PBS
3. 3% RB : perlakuan ragi bir 3%, diinjeksiA. hydrophila 4. 6% RB : perlakuan ragi bir 6%, diinjeksiA. hydrophila 5. 3% BY : perlakuanbioyeast3%, diinjeksiA. hydrophila
Ikan yang digunakan yaitu berukuran 13,20±1,43 g sebanyak 10 ekor ikan per akuarium yang dipelihara pada akuarium berukuran 50x40x35 cm. Setiap perlakuan diulang sebanyak 3 kali. Ikan diinfeksi dengan A.hydrophila pada hari ke-48 dengan dosis LD50. Selama uji tantang berlangsung resirkulasi dihentikan, namun ikan tetap diberi pakan sesuai perlakuan. Gejala klinis diamati setiap hari setelah ikan diinfeksi denganA. hydrophila.
2.4 Parameter Uji
2.4.1 Jumlah Konsumsi Pakan (JKP)
Pengukuran JKP ditentukan dengan menimbang jumlah pakan yang diberikan dikurangi jumlah pakan yang tidak dimakan selama 40 hari pemberian pakan uji.
JKP = Pm - Pt Keterangan :
JKP = Jumlah konsumsi pakan (g) Pm = Jumlah pakan yang diberikan (g) Pt = Jumlah pakan yang tidak dimakan (g)
2.4.2 Retensi Protein (RP)
Nilai retensi protein dihitung dengan persamaan sebagai berikut (Halver, 1989) :
RP = [(FP - I)/P] x 100% Keterangan :
RP = Retensi protein (%)
9
2.4.3 Retensi Lemak (RL)
Nilai retensi lemak dihitung dengan menggunakan persamaan sebagai berikut (Takeuchi, 1988):
RL = [(FL - I)/L] x 100%
Keterangan :
RL = Retensi lemak (%)
FL = Jumlah lemak pada tubuh ikan pada akhir pemeliharaan (g) I = Jumlah lemak pada tubuh ikan pada awal pemeliharaan (g) L = Jumlah lemak yang dikonsumsi ikan (g)
2.4.4 Laju Pertumbuhan Harian (LPH)
Pengukuran LPH ikan uji dihitung menggunakan persamaan berikut (Huisman, 1990):
LPH =
1 t
wo wt
% 100
Keterangan:
LPH = Laju pertumbuhan harian
wt = Rata-rata bobot individu akhir pemeliharaan (g) wo = Rata-rata bobot individu awal pemeliharaan (g) t = Lama waktu pemeliharaan (hari)
2.4.5 Efisiensi Pakan (EP)
Nilai efisiensi pakan dihitung dengan menggunakan persamaan sebagai berikut (Takeuchi, 1988):
EP = {[(Wt + D) - Wo] / F} x 100% Keterangan :
EP = Efisiensi pakan (%)
F = Jumlah pakan yang diberikan selama pemeliharaan (g) Wt = Biomassa akhir pemeliharaan (g)
2.4.6 Tingkat Kelangsungan Hidup atau (TKH)
Kelangsungan hidup ikan diamati selama 40 hari pemeliharaan ikan (pra infeksi bakteri) dan selama 10 hari pemeliharaan ikan (pasca infeksi bakteri). Kelangsungan hidup ikan dapat diketahui dengan persamaan sebagai berikut:
TKH = [Nt / No] x 100% Keterangan :
TKH = Tingkat kelangsungan hidup (%) Nt = Jumlah ikan akhir pemeliharaan (ekor) No = Jumlah ikan awal pemeliharaan (ekor)
2.4.7 Gejala Klinis Ikan
Gejala klinis diamati setiap hari setelah ikan diinfeksi denganA. hydrophila selama 10 hari. Gejala klinis yang diamati adalah kemerahan pada bagian tubuh (hiperemia) dan pembengkakan rongga perut (busung perut). Persentase gejala klinis dapat diketahui dengan persamaan sebagai berikut:
GK = [Gt / Go] x 100% Keterangan :
GK = Gejala klinis (%)
Gt = Jumlah ikan yang mengalami gejala klinis akhir pemeliharaan (ekor) Go = Jumlah ikan awal pemeliharaan (ekor)
2.5 Analisis Data
11
III. HASIL DAN PEMBAHASAN
3.1 Hasil
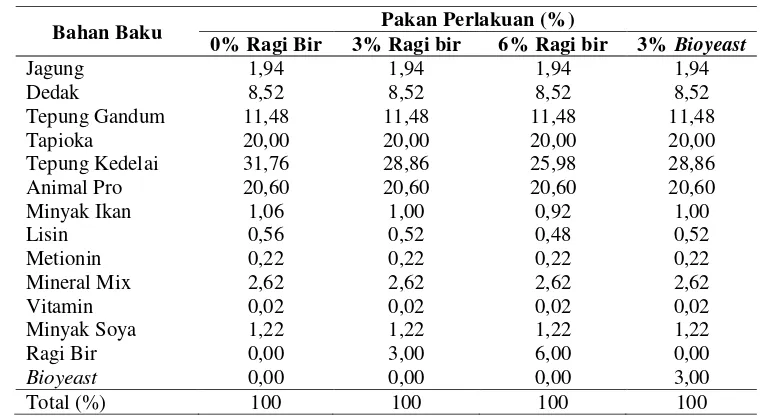
Penggunaan ragi pada pakan uji dengan kadar berbeda, yaitu 0% ragi bir (kontrol), 3% ragi bir, 6% ragi bir, dan 3% bioyeast yang diberikan selama 40 hari, menunjukkan pertumbuhan ikan mas. Hal ini ditandai dengan peningkatan biomassa ikan mas pada setiap perlakuan. Peningkatan tersebut dapat dilihat pada Gambar 1.
Keterangan: Huruf yang berbeda pada grafik menunjukkan pengaruh yang berbeda nyata (p<0,05).
Gambar 1. Peningkatan biomassa rata-rata ikan mas yang diberi pakan perlakuan ragi bir dengan kadar berbeda (0% ragi bir, 3% ragi bir, 6% ragi bir dan 3%bioyeast) setelah dipelihara selama 40 hari.
Peningkatan biomassa ikan mas di Gambar 1 menunjukkan hasil yang tidak berbeda secara signifikan pada setiap perlakuan. Perlakuan ragi bir 6% memiliki nilai peningkatan yang paling besar dibandingkan perlakuan lainnya yaitu sebesar 81%. Kemudian untuk perlakuan lainnya, yaitu kontrol, 3% ragi bir, dan 3% bioyeast secara berturut-turut terjadi peningkatan biomassa ikan sebesar 56%, 44%, dan 71%.
115,28 117,49 112,69 114,75 179,80 169,41 204,43 196,57 0,00 50,00 100,00 150,00 200,00 250,00
K 3%RB 6%RB 3%BY
B io m a sa a r a ta -r a ta ( g ) Perlakuan awal pemeliharaan akhir pemeliharaan
Tabel 5. Jumlah konsumsi pakan (JKP), retensi protein (RP), retensi lemak (RL), laju pertumbuhan harian (LPH), efisiensi pakan (EP), dan tingkat kelangsungan hidup (TKH) ikan mas selama 40 hari masa pemeliharaan
Parameter Uji Perlakuan
K 3% RB 6% RB 3% BY
JKP (g) 201,59±6,6a 190,11±6,48a 205,88±9,06a 195,78±30,53a RP (%) 12,72±3,74a 10,87±2,21a 17,14±2,64a 18,77±6,57a RL (%) 9,53±2,84a 10,68±2,15a 19,76±2,43b 20,18±5,54b LPH (%) 1,10±0,25a 1,35±0,28a 1,67±0,06a 1,44±0,35a EP (%) 38,03±11,74a 40,48±8,62a 50,68±0,89a 43,72±11,94a TKH (%) 86,67±17,64a 84,45±3,85a 93,33±6,67a 95,56±7,7a Keterangan: Nilai yang tertera merupakan nilai rata-rata ± standar deviasi. Huruf superskrip di belakang nilai
standar deviasi yang berbeda pada setiap baris menunjukkan pengaruh yang berbeda nyata (p<0,05).
Tabel 5 menunjukkan penggunaan ragi bir dan bioyeast pada pakan dengan dosis yang berbeda memberikan hasil yang tidak berbeda secara signifikan terhadap perlakuan kontrol (0% ragi bir) pada parameter jumlah konsumsi pakan, retensi protein, laju pertumbuhan harian, efisiensi pakan, dan tingkat kelangsungan hidup. Sedangkan penambahan dosis 6% ragi bir dan 3% bioyeast memberikan hasil yang berbeda secara signifikan dibandingkan kontrol (0% ragi bir) pada parameter retensi lemak. Uji statistik disajikan pada Lampiran 4.
0,00 13,33
40,00
46,67 50,00
6,67 3,33 6,67 3,33
0,00 10,00 20,00 30,00 40,00 50,00 60,00
0 1 2 3 4 5 6 7 8 9 10
T
in
g
k
a
t
k
em
a
ti
a
n
(%
)
Hari pasca infeksi
Keterangan : Huruf ya (p<0,05).
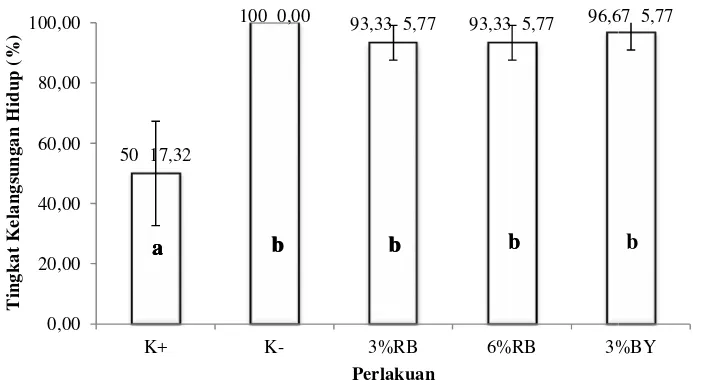
Gambar 3. Tingkat kela hydrophila.
Gejala klinis yan A. hydrophilapada ikan berbagai bagian tubuh busung perut (Gambar 4 hydrophila yaitu ikan m Ikan kontrol negatif ya berupa tidak nafsu maka sudah terlihat normal d Jumlah ikan yang menga
50 17,32 0,00 20,00 40,00 60,00 80,00 100,00 K+ T in g k a t K e la ng sung a n H id up (%)
a b b b b
yang berbeda pada grafik menunjukkan pengaruh yang berbeda ny
elangsungan hidup ikan mas di hari ke-10 pasca a.
ang ditimbulkan pada ikan yang mati akibat infek an mas yaitu munculnya warna kemerahan (hipere
h ikan, seperti perut, operkulum dan pangkal r 4). Gejala awal yang muncul saat ikan terserang mas mulai tidak mau makan dan berada di perm
yang disuntikkan PBS hanya menunjukkan ge akan selama dua hari. Pada hari ketiga, ikan kont
l dan bisa merespon pakan yang diberikan den galami gejala klinis dapat dilihat pada Tabel 6.
32
100 0,00 93,33 5,77 93,33 5,77 96,67
K- 3%RB 6%RB 3%B
Perlakuan
a b b b
nyata
ca infeksi A.
feksi bakteri eremia) pada al sirip dan ng infeksiA. rmukaan air. gejala awal ntrol negatif dengan baik.
,67 5,77
3%BY
15 Keterangan: (a), (b), (c) dan (d) yaitu kemerahan (hiperemia) pada sirip dada, sirip perut, operculum dan
sirip ekor, (e) busung perut.
Gambar 4. Gejala klinis ikan mas pasca infeksi bakteriA. hydrophila.
Tabel 6. Persentase ikan mati yang mengalami gejala klinis hiperemia dan busung perut
Perlakuan
Gejala klinis (%) Tubuh memerah
(Hiperemia) Busung perut Kontrol Positif 40,00±10,00 23,33±15,28
Kontrol Negatif 0,00±0,00 0,00±0,00
3% Ragi Bir 6,67±5,77 6,67±5,77
6% Ragi Bir 3,33±5,77 3,33±5,77
3%Bioyeast 3,33±5,77 0,00±0,00
Berdasarkan Tabel 6 terlihat bahwa ikan pada perlakuan kontrol positif menunjukkan gejala klinis yang jauh lebih banyak yaitu 40,00±10,00% menunjukkan hiperemia dan 23,33±15,28% busung perut. Sedangkan ikan di perlakuan lainnya (3% ragi bir, 6% ragi bir dan 3% bioyeast) hanya sedikit yang menunjukkan gejala tersebut; bahkan perlakuan kontrol negatif tidak menunjukkan gejala klinis.
3.2 Pembahasan
Penambahan ragi bir dengan dosis yang berbeda pada pakan ikan mas menunjukkan adanya peningkatan kinerja pertumbuhan. Pertumbuhan ikan uji terlihat secara kuantitatif dengan adanya penambahan bobot tubuh. Penambahan bobot tersebut menunjukan bahwa ikan mampu mencerna pakan dan menyerap semua nutrien yang terkandung dalam pakan dan mengkonversinya menjadi energi.
a
d e
c
Persentase penambahan biomassa ikan meningkat seiring dengan lamanya waktu pemeliharaan. Berdasarkan hasil yang didapatkan dalam penelitian ini, biomassa akhir yang dihasilkan pada semua perlakuan tidak menunjukkan perbedaan yang signifikan. Perlakuan 6% ragi bir memiliki nilai peningkatan yang paling tinggi dibandingkan perlakuan lainnya yaitu sebesar 81%. Hal ini menunjukkan bahwa semakin besar dosis ragi yang ditambahkan maka biomassa akhir yang dihasilkan akan semakin besar pula, selama dosis ragi bir masih dalam batas toleransi ikan tersebut. Hasil penelitian Li dan Gatlin (2003) memperlihatkan bahwa suplementasi ragi bir sebesar 1% dan 2% pakan dapat menghasilkan biomassa akhir lebih besar dibandingkan dengan kontrol pada ikan striped bass.
Peningkatan biomassa rata-rata pada penelitian ini sejalan dengan peningkatan laju pertumbuhan harian. Laju pertumbuhan harian tidak menunjukkan hasil yang berbeda secara signifikan pada semua perlakuan. Namun, hasil menunjukkan bahwa semakin tinggi dosis ragi yang diberikan makan laju pertumbuhan hariannya semakin besar pula. Pertambahan biomassa dan laju pertumbuhan harian yang tinggi pada perlakuan 6% ragi bir, diikuti dengan jumlah konsumsi pakan yang paling tinggi pada perlakuan tersebut.
Jumlah konsumsi pakan pada semua perlakuan menunjukkan nilai yang tidak berbeda secara signifikan terhadap perlakuan kontrol. Hal ini menandakan bahwa pakan memiliki nilai palatabilitas yang sama. Sesuai dengan hasil penelitian Olivia-Tales dan Goncalves (2001) bahwa penambahan ragi bir hingga 50% pada ikan sea bass tidak mempengaruhi palatabilitas pakan atau jumlah konsumsi pakan. Namun, nilai jumlah konsumsi pakan tertinggi yaitu pada perlakuan 6% ragi sebesar 205,88±9,06 g.
Tingginya jumlah konsumsi pakan diduga karena ragi bir mengandung mannan, nukleotida dan β glucan sebagai substrat mikro flora dalam usus
17 et al. (2005), maka pada perlakuan 6% ragi bir, pencernaan ikan bekerja lebih baik, sehingga penyerapan protein dan energi dari pakan untuk tumbuh menjadi lebih besar, pada gilirannya laju pertumbuhan menjadi lebih baik. Manoppo (2011) menyebutkan bahwa peningkatan pertumbuhan udang vaname terjadi karena nukleotida dan β–glukan yang ditambahkan dalam pakan dapat
meningkatkan nafsu makan sehingga efisiensi dan pengambilan pakan meningkat. Retensi protein secara tidak langsung menggambarkan jumlah protein pakan yang dikonsumsi dan digunakan untuk pertumbuhan dan membangun jaringan protein tubuh (Halver, 1989). Nilai retensi protein pada penelitian tidak berbeda secara signifikan pada semua perlakuan yakni berkisar antara 10,87-18,77% (Tabel 5). Hasil retensi protein yang tidak berbeda tersebut diduga bahwa pada ikan perlakuan, protein yang tersimpan di dalam tubuh lebih banyak digunakan untuk tumbuh dibandingkan untuk kegiatan aktivitas dan metabolisme.
Lemak merupakan penyumbang energi paling besar dibandingkan dengan energi yang dikandung protein dan karbohidrat. Nilai retensi lemak yang diperoleh pada penelitian berkisar 9,53-20,18%. Hasil penelitian menunjukkan nilai retensi lemak pada perlakuan 6% ragi bir dan 3%bioyeastmemberikan nilai yang berbeda secara signifikan dari perlakuan lainnya. Hal tersebut menunjukkan bahwa sumbangan lemak yang berasal dari pakan banyak disimpan dalam tubuh sementara pada perlakuan lainnya (0% dan 3% ragi bir) lemak lebih banyak digunakan untuk kegiatan metabolisme sehingga lemak yang tersimpan didalam tubuh lebih sedikit.
Semakin tinggi limbah pada media pemeliharaan dalam jangka panjang, dapat menyebabkan ikan stres, kerusakan insang atau jaringan (Charo-Karisa et al., 2006) bahkan kematian pada ikan.
Tingkat kelangsungan hidup ikan mas pada penelitian menunjukkan hasil yang tidak berbeda secara signifikan pada semua perlakuan (Tabel 5). Hal ini menandakan bahwa ragi bir tidak memberikan pengaruh yang negatif pada kelangsungan hidup dan dapat digunakan sebagai sumber protein dalam pakan ikan mas. Didukung dengan kondisi media perairan selama pemeliharaan dijaga melalui penyiponan dan penggantian air setiap hari untuk menciptakan kondisi air yang baik bagi ikan. Data kualitas air dapat dilihat pada Tabel 4.
Bakteri uji yang digunakan untuk uji tantang sudah dipastikan adalah bakteriA. hydrophila. Hasil dari LD50menunjukkan bakteriA. hydrophiladengan kepadatan 106 cfu/mℓ dapat mematikan 50% dari populasi ikan mas. Hal ini menunjukkan bahwa bakteri dengan kepadatan 106cfu/mℓlayak digunakan untuk uji tantang. Uji tantang ini dilakukan untuk mengetahui pengaruh dari pakan perlakuan yang diberikan terhadap kelangsungan hidup dan gejala klinis pada ikan yang ditimbulkan oleh infeksi bakteriA. hydrophila.
Perlakuan kontrol negatif tidak menunjukkan gejala klinis. Perlakuan ini hanya mengalami stres selama dua hari pasca infeksi dan tidak terjadi kematian. Hal ini dikarenakan, pada perlakuan ini ikan tidak diinjeksi dengan menggunakan bakteri A. hydrophila melainkan menggunakan PBS. Sehingga kelangsungan hidup yang dihasilkan 100±0.00% (Gambar 3) sampai akhir pemeliharaan. Pada perlakuan kontrol positif, terjadi kematian sangat tinggi pada hari ke-2 sebesar 40%, kematian mencapai 50% hingga hari ke-6 dan selanjutnya tidak ditemukan kematian hingga hari ke-10.
19 insang berwarna pucat, tubuh kembung, dan ulser pada kulit. Selain itu Maulinaet al. (2006), menyatakan bahwa ikan yang terinfeksi A. hydrophila mengalami gejala klinis berupa sirip ekor, sirip dada, dan sirip perut rusak, ikan lemah, dan pada permukaan tubuh terdapat bagian-bagian yang berwarna merah (hiperemia). Gejala yang timbul dikarenakan tidak adanya imunostimulator yang dapat meningkatkan kekebalan tubuh. Sehingga kelangsungan hidup yang dihasilkan hanya sebesar 50,00±15,72% (Gambar 3).
Perlakuan 3% ragi bir, 6% ragi bir dan 3%bioyeast tingkat kematian dan persentase gejala klinis yang ditimbulkan jauh sangat rendah dibandingkan dengan perlakuan kontrol positif yakni sebesar 3,33-6,67%. Kelangsungan hidup ikan pasca infeksi pada perlakuan tersebut menunjukkan nilai cukup tinggi yakni dengan nilai berturut-turut sebesar 93,33±5,77%, 93,33±5,77%, dan 96,67±5,77% (Gambar 3). Hal ini diduga pakan ragi bir maupun bioyeast mengandung imunostimulator seperti asam nukleat dan β glukan yang dapat meningkatkan kekebalan tubuh non spesifik ikan.
Siwicki et al. (1994), menyatakan bahwa ragi bir Saccharomyces cerevsiae adalah produk dari industri pembuatan bir yang mengandung berbagai senyawa imunostimulan sepertiβglucan, asam nukleat, mannan oligosakarida dan sedikit kitin. Senyawa imunostimulan tersebut telah terbukti untuk meningkatkan respon kekebalan tubuh.
Mekanisme kerja β glucan dalam ragi yaitu melalui fagositosis dengan cara mengaktifkan sel-sel darah putih, seperti makrofag, granulosit dan monosit, bertanggung jawab untuk pertahanan terhadap infeksi, dan membantu memperbaiki jaringan yang rusak. β glucan menginduksi sekresi molekul sitokin yang merangsang pembentukan sel darah putih baru (Raa, 1996dalamAndewset al., 2011). Induksi diduga karena β glucan dikenali oleh reseptor yang terdapat pada permukaan sel-sel fagosit. Sehingga sel fagosit menjadi lebih aktif dalam melakukan fagositosis terhadap patogen atau partikel asing (Manoppo, 2011).
21
IV. KESIMPULAN
DAFTAR PUSTAKA
Andews S. R., Sahu N. P., Pal A.K., Mukherjee S.C., Kumar S. 2011. Yeast extract, brewer’s yeast and spirulina in diets for Labeo rohita fingerlings affect haemato-immunological responses and survival followingAeromonas hydrophilachallenge. India. Research in Veterinary Science 91: 103–109. Anggraeni S. 2011. Penggunaan wheat bran sebagai bahan baku alternatif
pengganti jagung pada pakan ikan nila Oreochromis niloticus. [Skripsi]. Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Boyd and Linchtkoppler F. 1982. Water Quality Development series no 22. International Center for Aquaculture. Aquaculture Experiment Station. Auburn. Alabama.
Charo-Karisa H., Komen H., Reynolds S., Rezk M.A., Ponzoni R., Bovenhuis H. 2006. Genetic and environmental factors affecting growth of nile tilapia (Oreochromis niloticus) juveniles: modeling spatial correlations between hapas. Aquaculture 255, 586–596.
Edriani G. 2011. Evaluasi kualitas dan kecernaan biji karet, biji kapuk, kulit singkong, palm kernel meal, dan kopra yang ifermentasi oleh Saccharomyces cerevisiae pada pakan juvenil ikan mas Cyprinus carpio. [Skripsi]. Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
EHSC [Environment, health and safety committee]. 2001. LD50 (Lethal dose 50%). Environment, health and safety committee [EHSC]. London.
Fitriliyani I. 2010. Peningkatan kualitas nutrisi tepung daun lamtoro dengan penambahan ekstrak enzim cairan rumen domba pada pakan ikan nila Oreochromis sp. [Disertasi]. Program Pascasarjana, Institut Pertanian Bogor.
Ghosh K., Sukanta K. S., Arun K. R. 2005. Feed utilization efficiency and growth performance in rohu, Labeo rohita (Hamilton, 1822), fingerlings fed yeast extract powder supplemented diets. Acta Ichthyol, Piscat. 35 (2): 111-117.
Halver J. E. 1989. Fish Nutrition. Second edition. Academy Press Inc, New York.
Huisman E. A. 1990. Principles of Fish Production. Wageningen Agriculture University: The Netherland.
23 Kurniansyah A. 2012. Uji efektifitas penambahan enzim cairan rumen domba terhadap penurunan serat kasar dan nilai kecernaan kulit buah kakao sebagai bahan pakan ikan nila. [Skripsi]. Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Li P. dan Gatlin D.M. 2003. Evaluation of brewers yeast (Saccharomyces cerevisiae) as a feed supplement for hybrid striped bass (Morone chrysopsx M.saxatilis). Aquaculture 219, 681–692.
Manoppo H. 2011. Peran nukleotida sebagai imunostimulan terhadap respon imun nonspesifik dan resistensi udang vaname (Litopenaeus vannamei). [Disertasi]. Program Pascasarjana, Institut Pertanian Bogor.
Maulina I., Kiki H., Junianto. 2006. Pengaruh meniran dalam pakan untuk mencegah infeksi bakteri Aeromonas sp. pada benih ikan mas (Cyprinus carpio). Fakultas Perikanan dan Ilmu Kelautan. Universitas Padjajaran. Bandung.
Oliva-Teles A. dan Goncalves P. 2001. Partial replacement of fishmeal by brewers yeast (Saccaromyces cerevisae) in diets for sea bass (Dicentrarchus labrax) juveniles. Aquaculture 202: 269–278.
Rosita M. 2011. Konsumsi minuman beralkohol.
http://industri.kontan.co.id/xml/tahun-berganti-konsumsi-bir-meningkat-15%-kontan-online. [25 Februari 2012].
Sahan A dan Duman S. 2010.Effect of β glucan on haematology of common carp (Cyprinus carpio) infected by ectoparasites. Mediterranean Aquaculture Journal. 1(1): 1-7.
Siwicki A. K., Anderson D. P., Rumsey G. L. 1994. Dietary intake of immunostimulants by rainbow trout affects non-specific immunity and protection against furunculosis. Veterinary immunology and immunopathology 41, 125-139.
Sulastry F. 2009. Uji toksisitas akut yang diukur dengan penentuan LD50 ekstrak daun pegagang (Centella asiatica (L.) Urban) terhadap mencit balb/C. [Skripsi]. Fakultas Kedokteran. Universitas Diponegoro. Semarang.
Swann L. dan White M. R. 1989. Diagnosis and treatment of Aeromonas hydrophilaof fish. Aquaculture extention. Purdue University.
Takeuchi T. 1988. Laboratory Work- Chemical evaluation of dietary nutrients, P 179–233 In T, Watanabe, Editor. Fish Nutrition and Mariculture.
Departement of Aquatic Bioscience. Tokyo University of Fisheries.
Yoshida T., Kruger R., Inglis V. 1995. Augmentation of non-specific protection in African catfish, Clarias gariepinus (Burchell), by the long-term oral administration of immunostimulants. Journal of fish diseases 18: 195-198.
25
Lampiran 1. Skema dan tata letak akuarium penelitian 3% BY1 K+3 3% RB1 K+2 3% RB3 K-3 6% RB1 K-2 3% BY2 6% RB2 K-1 6% RB3 K+1 3% BY3 3% RB2 Keterangan :
K+ = perlakuan ragi bir 0%, diinjeksiA. hydrophila
K- = perlakuan ragi bir 0%, diinjeksi PBS 3% RB = perlakuan ragi bir 3%, diinjeksiA. hydrophila
6% RB = perlakuan ragi bir 6%, diinjeksiA. hydrophila
3% BY = perlakuanbioyeast3%, diinjeksiA. hydrophila
T = tandon
1,2,3 = ulangan perlakuan
Lampiran 2. Perhitungan nilai LD50
Bakteri Pengenceran Jumlah ikan Jumlah mati Jumlah hidup Total Kematian % Kematian Aha
108 8 8 0 8/8 100
107 8 8 0 8/8 100
106 8 6 2 6/8 75
105 8 0 8 0/8 0
Selang Proporsi = Kematian diatas 50% − 50
Kematian diatas 50% − Kematian dibawah 50%
=100 − 50 100 − 0 = 0,5
Log negatif LD50 = Log - Kematian diatas 50%+SP = Log - 106+ 0,5 = -5,5
= 10-5,5≈ 106cfu/mℓ
Dengan diperolehnya nilai LD50= 106, maka bakteri A. hydrophila pada
kepadatan 106cfu/mℓ dapat menyebabkan populasi ikan mas mati sebanyak 50%
dalam waktu 10 hari.
27 Lampiran 3. Prosedur analisis proksimat (Watanabe, 1988)
Lampiran 3.1 Prosedur analisis kadar abu
Kadar Abu =(X2 − X1)
A x 100%
Catatan : Cawan dari tanur dimasukan dalam desikator setelah suhu tanur turun sampai 1000C atau 2000C.
Lampiran 3.2 Prosedur analisis kadar air
Kadar Air =(X1 + A) − X2
A x 100%
Cawan porselen dipanaskan pada suhu 105-1100C selama 1 jam, dan kemudian didinginkan dalam desikator selama 30 menit dan ditimbang (X1)
Bahan ditimbang 2-3 g (A) lalu dimasukkan ke dalam cawan
Cawan dan bahan dipanaskan selama 4 jam pada suhu 105-1100C, didinginkan dalam desikator selama 30 menit dan ditimbang (X2)
Cawan dan bahan dipanaskan di dalam tanur dengan suhu 6000C, lalu didinginkan dalam desikator selama 30 menit dan ditimbang (X2)
Lampiran 3.3 Prosedur analisis kadar serat kasar
Kadar Serat Kasar =(X2 − X1 − X3)
A x 100%
Lampiran 3.4 Prosedur analisis kadar protein a. Tahap oksidasi
Kertas saring dipanaskan dalam oven 1100C selama 1 jam, lalu dinginkan dalam desikator selam 30 menit, dan
ditimbang (X1) Bahan ditimbang 0,5 g (A), lalu dimasukkan ke
dalam Erlenmeyer 250 mℓ
50 mℓH2SO40,3 N ditambahkan dalam
Erlenmeyer, lalu dipanaskan selama 30 menit di atashotplate
Tambahkan 25 mℓNaOH 1,5 N, lalu dipanaskan kembali selama 30 menit
Larutan disaring dengan bahan pembilasan secara berurutan sebagai berikut:
a. 50 mℓair panas b. 50 mℓH2SO4 c. 50 mℓair panas d. 25 mℓaceton
Kertas saring hasil penyaringan dimasukkan ke dalam cawan porselen
Cawan porselen dipanaskan pada suhu 105-1100C selama 1 jam lalu
didinginkan
Dipanaskan pada suhu 105-1100C selama 1 jam, didinginkan, dan ditimbang (X2)
Dipanaskan dalam tanur pada suhu 6000C hingga berwarna putih, didinginkan, dan
ditimbang (X3)
Kertas saring dipanaskan pada labu Buchner yang telah terhubung dengan
vacumm pump
H2SO4pekat 10 mℓ
Katalis (K2SO4+CuSO4.%H2O)
ditimbang 3 g Bahan ditimbang 0,5 g (A)
Dimasukan ke dalam labu Kjedhal dan dipanaskan sampai suhu 4000C selama 3-4 jam hingga berwarna hijau bening, didinginkan dengan air destilasi 25 mℓ, dan diencerkan hingga volume
29 b. Tahap destilasi
c. Tahap titrasi
Kadar Protein =0.0007 ∗ x (Vb − Vs) x 6.25 ∗∗ x 20
A x 100%
Keterangan :
Vb = mℓ0,05 N titran NaOH untuk blanko A = Bobot sampel (g) Vs = mℓ0,05 N titran NaOH untuk sampel ** = Faktor Nitrogen * = Setiap 0,05 NaOH ekivalen dengan 0,0007 g N
5 mℓlarutan hasil oksidasi dimasukkan ke dalam labu destilasi
Destruksi selama 10 menit dari tetesan pertama
Dimasukkan ke dalam gelas ukur 250mℓ 2-3 tetes indikatormethylen
blue(larutan B) 10 ml H2SO40,05 N
Hasil destilasi dititrasi dengan NaOH
Titrasi hingga larutan menjadi kehijauan.
Hitung ml titran yang dipakai dan catat (V)
Lampiran 3.5 Prosedur analisis kadar lemak a. Metode Soxchlet (sampel kering)
Kadar Lemak =(X2 − X1)
A x 100%
b. Metode Folch (sampel basah)
Labu dipanaskan pada suhu 104-1100C selama 1 jam, kemudian didinginkandalam desikator dan ditimbang (X1)
Bahan ditimbang 2-3 g (A) lalu dimasukkan ke dalam selongsong
Dimasukkan ke dalam Soxhlet dan diberi 100-150 mℓN-Hoxan hingga selongsong terendam. Sisa N-Hexan dimasukkan ke dalam
labu
Labu dipanaskan di atashotplatehingga larutan perendam selongsong dalam Soxhlet berwarna bening
Labu dan lemak yang tersisa dipanaskan dalam oven selama 15 menit, didinginkan, lalu ditimbang (X2)
Timbang sampel 2 g (A), tambahkan 40 mℓlarutan chloroform: methanol (2:1), homogenkan selama 5 menit (5000 rpm), saring
dengan menggunakanvacuum pump
Mg Cl2.6H2O2sebanyak 0,2 x volume
chloroform:methanol (2:1) yang digunakan
hasil saringan dimasukan ke dalam labu Pemisah dan saring kembali
lakukan pembilasan dengan larutan chloroform:methanol sebanyak 10 mℓ
selesai disaring labu pemisah ditutup dan diaduk hingga merata selama 1 menit
labu diuapkan menggunakan vacuum evaporator hingga larutan menguap semua
diamkan 1 malam hingga terjadi 2 lapisan, ambil larutan bawah dan disimpan dalam labu yang telah diketahui bobotnya (B)
timbang labu akhir (C) setelah dipastikan larutannya menguap semua
Kadar Lemak =(C − B)
31 Lampiran 4. Hasil Uji Statistik
Lampiran 4.1 Jumlah konsumsi pakan selama 40 hari pemeliharaan
JKP Pakan Perlakuan
Ulangan K 3% RB 6% RB 3% BY
1 205,89 194,66 203,42 160,92
2 204,88 182,69 215,92 208,66
3 193,98 192,98 198,31 217,76
Rata-rata 201,59 190,11 205,88 195,78 Standar
[image:43.612.131.426.121.229.2]Deviasi 6,60 6,48 9,06 30,53
Tabel ANOVA jumlah konsumsi pakan Sum of
Squares Df Mean Square F Sig.
Between Groups 425,253 3 141,751 ,516 ,683
Within Groups 2199,528 8 274,941
Total 2624,781 11
Lampiran 4.2 Laju pertumbuhan harian selama 40 hari pemeliharaan
LPH Pakan Perlakuan
Ulangan K 3% RB 6% RB 3% BY
1 0,86 1,64 1,65 1,11
2 1,35 1,31 1,74 1,80
3 1,10 1,09 1,63 1,40
Rata-rata 1,10 1,35 1,67 1,44
Standar
Deviasi 0,25 0,28 0,06 0,35
Tabel ANOVA laju pertumbuhan harian Sum of
Squares Df Mean Square F Sig.
Between Groups ,500 3 ,167 2,560 ,128
Within Groups ,520 8 ,065
Lampiran 4.3 Tingkat kelangsungan hidup selama 40 hari pemeliharaan
TKH Pakan Perlakuan
Ulangan K 3% RB 6% RB 3% BY
1 100 80 100 86,67
2 93,33 86,67 93,33 100
3 66,67 86,67 86,67 100
Rata-rata 86,67 84,45 93,33 95,56
Standar
[image:44.612.125.433.104.250.2] [image:44.612.134.471.601.670.2]Deviasi 17,64 3,85 6,67 7,7
Tabel ANOVA tingkat kelangsungan hidup Sum of
Squares Df Mean Square F Sig.
Between Groups 251,815 3 83,938 ,782 ,537
Within Groups 859,007 8 107,376
Total 1110,822 11
Lampiran 4.4 Efisiensi pakan selama 40 hari pemeliharaan
EP Pakan Perlakuan
Ulangan K 3% RB 6% RB 3% BY
1 24,66 47,68 50,1 34,22
2 46,63 42,83 50,24 57,13
3 42,81 30,92 51,7 39,82
Rata-rata 38,03 40,48 50,68 43,72
Standar
Deviasi 11,74 8,62 0,89 11,94
Tabel ANOVA efisiensi pakan Sum of
Squares Df Mean Square F Sig.
Between Groups 270,996 3 90,332 1,016 ,435
Within Groups 711,180 8 88,897
Total 982,176 11
Lampiran 4.5 Hasil proksimat tubuh ikan mas selama 40 hari pemeliharaan
Parameter Awal Pakan Perlakuan
K 3% RB 6% RB 3% BY
Protein (%) 11,07 11,12 11,21 11,19 11,96
Lemak (%) 2,44 2,43 2,48 3,00 3,12
33 Lampiran 4.6 Retensi protein selama 40 hari pemeliharaan
Parameter Ulangan Pakan Perlakuan
K 3% RB 6% RB 3%BY
Biomassa ikan awal (g)
1 111,06 117,58 110,08 113,48
2 117,44 114,84 116,78 114,52
3 117,35 120,04 111,22 116,26
Biomassa ikan akhir (g)
1 156,37 179,98 212,00 153,01
2 201,13 167,72 217,26 233,72
3 181,89 160,54 184,02 202,98
Protein ikan Protein tubuh
awal (%)
1 11,07 11,07 11,07 11,07
2 11,07 11,07 11,07 11,07
3 11,07 11,07 11,07 11,07
Protein tubuh akhir (%)
1 11,12 11,21 11,19 11,96
2 11,12 11,21 11,19 11,96
3 11,12 11,21 11,19 11,96
Konsumsi pakan (g)
1 205,89 194,66 203,42 160,92
2 204,88 182,69 215,92 208,66
3 193,98 192,98 198,31 217,76
Protein tubuh total awal (g)
1 12,29 13,02 12,19 12,56
2 13,00 12,71 12,93 12,68
3 12,99 13,29 12,31 12,87
Protein tubuh total akhir (g)
1 17,39 20,18 23,72 18,30
2 22,37 18,80 24,31 27,95
3 20,23 18,00 20,59 24,28
Jumlah konsumsi protein (g)
1 58,12 56,39 59,81 46,09
2 57,84 52,92 63,48 59,76
3 54,76 55,91 58,30 62,37
Retensi Protein (%)
1 8,76 12,70 19,29 12,45
2 16,19 11,50 17,93 25,56
3 13,21 8,42 14,20 18,29
Rata-rata retensi
protein (%) 12,72 10,87 17,14 18,76
[image:45.612.107.480.100.644.2]SD 3,74 2,21 2,64 6,57
Tabel ANOVA retensi protein Sum of
Squares df Mean Square F Sig.
Between Groups 117,727 3 39,242 2,239 ,161
Within Groups 140,198 8 17,525
Lampiran 4.7 Retensi lemak selama 40 hari pemeliharaan
Parameter Ulangan Pakan Perlakuan
K 3% RB 6% RB 3%BY
Biomassa ikan awal (g)
1 111,06 117,58 110,08 113,48
2 117,44 114,84 116,78 114,52
3 117,35 120,04 111,22 116,26
Biomassa ikan akhir (g)
1 156,37 179,98 212,00 153,01
2 201,13 167,72 217,26 233,72
3 181,89 160,54 184,02 202,98
Lemak ikan Lemak tubuh
awal (%)
1 2,44 2,44 2,44 2,44
2 2,44 2,44 2,44 2,44
3 2,44 2,44 2,44 2,44
Lemak tubuh akhir (%)
1 2,43 2,48 3,00 3,12
2 2,43 2,48 3,00 3,12
3 2,43 2,48 3,00 3,12
Konsumsi Pakan (g)
1 205,89 194,66 203,42 160,92
2 204,88 182,69 215,92 208,66
3 193,98 192,98 198,31 217,76
Lemak tubuh total awal (g)
1 2,71 2,87 2,69 2,77
2 2,87 2,80 2,85 2,79
3 2,86 2,93 2,71 2,84
Lemak tubuh total akhir (g)
1 3,80 4,46 6,36 4,77
2 4,89 4,16 6,52 7,29
3 4,42 3,98 5,52 6,33
Jumlah konsumsi lemak (g)
1 16,70 12,81 16,88 13,31
2 16,62 12,02 17,92 17,26
3 15,73 12,70 16,46 18,01
Retensi lemak (%)
1 6,53 12,45 21,76 15,07
2 12,17 11,29 20,47 26,06
3 9,89 8,29 17,05 19,41
Rata-rata retensi
lemak (%) 9,53 10,68 19,76 20,18
[image:46.612.113.474.98.513.2]SD 2,84 2,15 2,43 5,54
Tabel ANOVA retensi lemak
Sum of
Squares df Mean Square F Sig.
Between Groups 294,290 3 98,097 7,972 ,009
Within Groups 98,444 8 12,305
35 Tabel uji lanjut retensi lemak
PERLAKUAN N Subset for alpha = 0.05
1 2
Duncana
K 3 9,5300
3%RB 3 10,6767
6%_RB 3 19,7600
3%_BY 3 20,1800
Sig. ,699 ,887
Means for groups in homogeneous subsets are displayed a. Uses Harmonic Mean Sample Size = 3,000
Lampiran 5. Jumlah kematian ikan per hari pasca infeksi bakteriA. hydrophila
Hari
Jumlah ikan mati (ekor) per hari, selama 10 hari uji tantang
K+ K- 3% RB 6% RB 3% BY
1 2 3 1 2 3 1 2 3 1 2 3 1 2 3
1 1 2 1 1 1
2 3 3 2 1
3 4
5 1 1 1
6 1
7 1
8 9 10
Jumlah mati (ekor) 4 7 4 0 0 0 0 1 1 0 1 1 1 0 0
Jumlah hidup (ekor) 6 3 6 10 10 10 10 9 9 10 9 9 9 10 10
Total mati (ekor) 15 0 2 2 1
Total hidup (ekor) 15 30 28 28 29