Lampiran 1. Data Jumlah Koloni Kapang Hasil Isolasi Daun Waru
Ulangan ke Jumlah Koloni
1 4
2 3
3 5
Lampiran 2. Data Kadar Air Ampas Singkong dan Tahu
Contoh perhitungan untuk sampel ampas singkong: Berat sampel sebelum dikeringkan (w1) = 1,0222 g Berat sampel setelah dikeringkan (w2) = 0,9382 g
Lampiran 3. Data Viabilitas Spora pada Daun Waru
Swab Area ke
Jumlah Spora pada Kolom Rata-rata
Jumlah Spora/cm2
I II III IV V
1 60 36 30 45 49 44 1,1 x 105
2 411 360 340 384 365 372 9,3 x 105
3 62 40 45 67 66 56 1,4 x 105
4 59 65 68 49 79 64 1,6 x 105
Rata-rata 1,26 x 105
Perhitungan untuk data nomor 1: Total spora rata-rata = 44 sel
Ukuran hymocitometer = 0,2 mm x 0,2 mm = 0,04 mm2 = 0,0004 cm2
Lampiran 4. Data Viabilitas Spora pada Laru Tempe
Jumlah Spora pada Kolom
Rata-Perhitungan untuk data nomor 1: Berat sampel = 1 g Total spora rata-rata = 60 sel
Ukuran haemacytometer = 0,2 mm x 0,2 mm = 0,004 mm2 Faktor pengenceran = 103
Volume larutan yang diteteskan haemacytometer = 10-4 ml
Lampiran 5. Data TPC pada Laru Tempe
Perhitungan untuk data nomor 1:
Berat sampel = 1 g
Total jumlah koloni rata-rata = 5,0 Faktor Pengenceran = 106
TPC dalam 1 g sampel = Total jumlah koloni x faktor pengenceran = 5,0 CFU x 106
Lampiran 6. Data Kadar Air Laru Tempe
Perhitungan untuk sampel 1:
Berat sampel sebelum dikeringkan (w1) = 1,0235 g Berat sampel setelah dikeringkan (w2) = 0,9795g
Lampiran 7. Data Kadar Protein pada Tempe
Perhitungan untuk sampel 1:
Lampiran 8. Data Kadar Air pada Tempe
Perhitungan untuk sampel 1:
Berat sampel sebelum dikeringkan (w1) = 1,0404 g Berat sampel setelah dikeringkan (w2) = 0,5847g
Lampiran 9. Area swab Daun Waru
1
2
3 4
Lampiran 10. Gambar Proses Isolasi Kapang dari Daun Waru
Isolasi pada Daun Tua dan Muda (1 hari)
Isolasi pada Daun Tua dan Muda (2 hari)
Lampiran 13. Gambar Suspensi Rhizopus Sp.
Hari 1
Lampiran 14. Proses Inkubasi Rhizopus sp. dalam Kombinasi Ampas Singkong dan Tahu
100 % AS 1:1 1:2
1:3 2:1 3:1
Lampiran 16. Uji Viabilitas Spora dengan Hemocytometer
Ket: Memasukkan sampel ke dalam Hemocytometer
Lampiran 18. Tempe yang Dihasilkan
Jenis Sampel Gambar Pengamatan
Organoleptik
AS 100%
Tekstur : tidak kompak Aroma : khas tempe
Warna : putih tidak merata
AS:AT (3:1)
Tekstur : kompak Aroma : khas tempe Warna : putih merata
AS:AT (2:1)
Tekstur : kompak Aroma : khas tempe Warna : putih merata
AS:AT (1:1)
Jenis Sampel Gambar Pengamatan Organoleptik
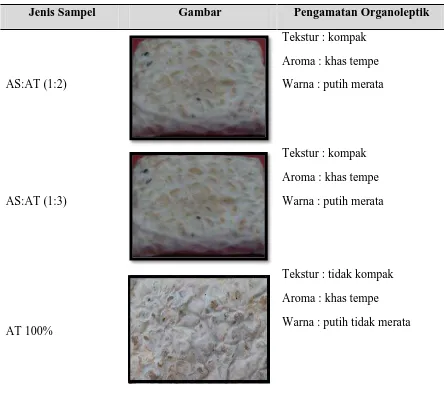
AS:AT (1:2)
Tekstur : kompak Aroma : khas tempe Warna : putih merata
AS:AT (1:3)
Tekstur : kompak Aroma : khas tempe Warna : putih merata
AT 100%
DAFTAR PUSTAKA
Astuti, Nurita Puji. 2009. Sifat Organoleptik Tempe Kedelai yang Dibungkus Plastik, Daun Pisang dan Daun Jati. Karya Tulis Ilmiah. Program Studi Gizi, Fakultas Kesehatan. Surakarta: Universitas Muhammadiyah Surakarta. Azizah. 2007. Formulasi Laru Tempe Terstandar Isolat Daun Waru. Fakultas
Pertanian, Institut Pertanian Bogor. Bogor.
Badan Standarisasi Nasional. 2009. SNI Tempe Kedelai. Badan Standarisasi Nasional. Jakarta.
Dwidjoseputro, D. dan F. T.Wolf, 1970. Microbiological Studies of Indonesian Fermented Foodstuff.
Fardiaz, S. 1989. Mikrobiologi Pangan. Gramedia Pustaka Utama, Jakarta.
Fransiska. 2010. Pemanfaatan Limbah Singkong Sebagai Biogas. Fakultas Teknik, Universitas Dipenogoro. 2007. Semarang.
Frazier, W. C. and D. C. Westhoff. 1981. Food Microbiology. Tata Mc Graw Hill Pub. Co. Ltd, New Delhi.
Hansen, P. J. 2005. Use of Haemacytometer.http:// www.animal. ufl.edu/hansen/ protocols/hemacytometer.html. [23 Januari 2007].
Hermana dan M. Karmini. 1996. Pengembangan Teknologi Pembuatan Tempe. Di dalam: Sapuan dan M. Sutrisno (eds.). Bunga Rampai Tempe Indonesia. Yayasan Tempe Indonesia. Jakarta.
Hermana dan Sutedja. 1970. Advances in the preparation of tempe. Gizi Indonesia, 2: 167.
Karmini, Mien dkk. 2009. Aktivitas Enzim Hidrolitik Kapang Rhizopus sp. Pada Proses Fermentasi Tempe. Fakultas Pertanian, Institut Pertanian Bogor. Bogor.
Kasmidjo, RB. 1989. Tempe Mikrobiologi dan Biokimia Pengolahan serta. Pemanfaatannya. UGM Press. Yogyakarta.
Martodisiswojo dan Rajakwangun. 1995. Tanaman Waru. Fakultas Farmasi, Camcer Chemoprevention Research Center, UGM. Yogyakarta.
Purnama, F. Ardian. 2010. Kadar Air, Abu, Protein dan Karbohidrat Pada Tahapan Pembuatan Tempe. Program Studi Kimia, Fakultas Sains dan Matematika, Universitas Kristen Satya Wacana. Salatiga.
Samson, R.A dan van Reenen-Hoekstra. 1988. Introduction to Food-borne Fungi. CBS, Baarn. Belanda.
Shurtleff, W. dan A. Aoyagi. 1979. The Book of Tempeh. Harper and Row Publ, New York.
Steinkrauss, K. H. 1983. Handbook of Indigenous Fermented Food. Marcell Dekker Inc, New York.
Sudiarso, F. D. 1993. Kajian Teknologis dan Finansial Produk Laru Tempe Kedelai. Skripsi Fakultas Teknologi Pertanian IPB, Bogor.
Suprapti, M. L. 2005. Teknologi Pengolahan Pangan. Kanisius. Yogyakarta. Suyanto, P. 1997. Prospect of tempe as functional food. Proceeding of The
International Tempe Symposium.
Syamsuhidayat, S.S dan Hutapea, J.R. 1991. Inventaris Tanaman Obat Indonesia. Departemen Kesehatan Republik Indonesia. Jakarta.
Syarief, R. dan H. Halid. 1989. Teknologi Penyimpanan Pangan. Pusat Antar Universitas Pangan dan Gizi IPB, Bogor.
Tim Penyusun. 1991. Komposisi Zat Gizi Pangan di Indonesia. Direktur Bina Gizi Masyarakat dan Puslitbang, Kementerian Kesehatan, Jakarta.
Walker, G. M. 1999. Media for industrial fermentation. Di dalam: Robinson, K, C. A. Batt, (eds.). Encyclopedia of Food Microbiology. Academic Press, New York.
Wang, H. L., E. W. Swain, dan C. W. Hesseltine. 1975. Mass production of Rhizopus oligosporus spores and their application in tempeh fermentation. J. of Food Sci. 40:15.
Warisno dan Kres Dahana. 2010. Meraup Untung dari Olahan Kedelai. Agro Media Pustaka: Jakarta.
BAB III
METODOLOGI
3.1.Alat dan Bahan 3.1.1. Alat
Aluminium foil Best Fresh
Autoclave Yamato Scientific SN 210 Batang Pengaduk 25 cm
Hotplate Thermilyte Kertas Saring Whatman No. 42
Inkubator Memmert
Labu Destilasi Pyrex
Labu Kjeldahl
Mikropipet Dragon Med
Mikroskop Olympus
Neraca Digital AS 220/C/2 Radwag
Object glass Sail Brand Orbital Shaker Golenhamp
Ose 20 cm
Oven Memmert
Pipet tetes 15 cm Sinar Klaten Plastik Cling Cling Wrap
Refrigerator Toshiba
Spatula 15 cm
Statif
3.1.1. Bahan Akuades
Ampas Tepung Singkong Ampas Tahu
Daun waru (usar) H2SO4 pekat Indikator Tashiro Kacang kedelai Kentang
Larutan NaOH 40 % Larutan Asam Boraks 2% Larutan HCl 0,0846 N Plastik pembungkus
PDA (Potatoe Dextrose Agar) PCA (Plate Count Agar) Selenium
3.2. Prosedur Penelitian
3.2.1. Pembuatan Tepung Ampas Singkong dan Ampas Tahu
Ampas singkong dan tahu dibersihkan. Ampas singkong atau tahu ditimbang dan dikeringkan dalam tempat terpisah dalam oven selama 24 jam pada suhu 40-50oC. Ampas singkong dan tahu tersebut digiling sampai ukuran 50 mesh. Ampas singkong dan tahu yang telah ditepungkan diukur kadar airnya. 3.2.2. Pembuatan PDA
Serbuk PDA ditimbang sebanyak 15,6 gram. Serbuk PDA dimasukkan dalam erlenmeyer dan kemudian dilarutkan dalam 400 ml air. Larutan PDA kemudian dipanaskan sampai kalis. Larutan PDA disterilisasi basah dengan autoclave suhu 121oC dengan tekanan 2 atm selama 15 menit.
3.2.3. Pembuatan PDB
40 gram kentang ditimbang dan dihaluskan. Kentang tersebut tambahkan air sebanyak 400 ml dan 2 gram dektrosa, kemudian dipanaskan hingga mendidih. Larutan PDB disaring. Larutan PDB disterilisasi basah dengan autoclave suhu 121oC dengan tekanan 2 atm selama 15 menit.
3.2.4. Isolasi Kapang
3.2.5. Identifikasi Kapang
Identifikasi kapang dilakukan dengan menggunakan metoda slide culture yaitu dengan mengambil sedikit bagian kultur murni dan menggoreskannya pada permukaan object glass yang telah ditetesi PDA, kemudian ditutup menggunakan cover glass. Preparat ini kemudian diletakkan di dalam cawan petri steril yang telah dialasi kertas saring bergliserol untuk menjaga kelembaban. Setelah diinkubasi, preparat ini kemudian diamati di bawah mikroskop, dimulai dengan perbesaran yang paling kecil kemudian dilanjutkan hingga perbesaran 1000 kali.
3.2.6. Pembuatan Suspensi Rhizopus sp.
Koloni murni kemudian ditumbuhkan pada media PBD yang telah disterilisasi. Suspensi yang terbentuk kemudian diinkubasi dalam suhu ruangan pada alat oriental sheker.
3.2.7. Pembuatan Laru
3.2.8. Aplikasi Laru terhadap Kacang Kedelai
Kacang kedelai disortir dan direbus selama 30 menit. Kacang kedelai yang bermutu direndam selama 22 jam dalam air bacem. Kacang kedelai kemudian dikupas dan dicuci hingga bersih dan direbus selama 60 menit. Kacang kedelai yang telah direbus didinginkan hingga kering. Kacang kedelai yang telah kering ditambahkan laru (sebanyak 1,00%) yang telah dibuat di atas dan fermentasi dalam wadah plastik selama 2-3 hari. Tempe mulai terbentuk dan dianalisa kualitasnya (diuji kadar air dan protein).
3.3. Metode Analisis
3.3.1. Total Plate Count (TPC) (Fardiaz, 1989)
Analisis TPC dilakukan dengan menggunakan metoda tuang. Sebanyak 1 gram laru tempe bubuk dilarutkan ke dalam 10 ml larutan pengencer (biasanya akuades yang steril), kemudian divortex dan diencerkan hingga pengenceran 10-8. Pemupukan dilakukan mulai pengenceran 10-6, 10-7, dan 10-8. Dari masing-masing pengenceran dipipet sebanyak 1 ml ke dalam cawan petri steril, kemudian dituangkan PCA (Plate Count Agar). Selanjutnya cawan diinkubasikan pada suhu 30ºC dalam posisi terbalik selama 3 hari. 3.3.2. Viabilitas Spora
Sebanyak 1 gram laru tempe bubuk dilarutkan dalam 10 ml akuades steril, kemudian diencerkan hingga pengenceran tertentu lalu dilakukan pengamatan dibawah mikroskop dengan menggunakan haemacytometer (Hansen, 2005). Gambar haemacytometer dapat dilihat pada Gambar 3.1.
Gambar 3.1. Penampakan haemacytometer
terdapat per mm2 luasan bidang hitung. Perhitungan dilakukan dengan rumusan sebagai berikut.
Keterangan: 10-4 ml merupakan volume larutan yang diteteskan ke haemacytometer
3.3.3. Kadar Air
Sebanyak 1 gram sampel ditempatkan dalam cawan alumunium kemudian dikeringkan di dalam oven bersuhu 105ºC selama 6 jam. Setelah 6 jam, kemudian dimasukkan ke dalam desikator selama 30 menit lalu ditimbang. Perhitungan kadar air dilakukan berdasarkan rumus berikut ini:
Keterangan: w1 = berat sampel sebelum dikeringkan (g)
W2 = berat sampel setelah dikeringkan (g)
3.3.4. Kadar Protein (BSN, 2011)
Sampel ditimbang 1 gram (w) dalam kaca arloji dan dimasukkan ke dalam labu Kjeldahl, kemudian ditambahkan 2 gram campuran Selenium dan 25 ml H2SO4 pekat. Campuran tersebut dipanaskan dalam pemanas listrik sampai mendidih dan larutan menjadi jernih kehijau-hijauan. Hasil pemanasan tersebut dibiarkan dingin, kemudian dimasukkan ke dalam labu ukur 100 ml diencerkan dengan akuades secukupnya. Larutan yang telah diencerkan ini dipipet 50 ml dan dimasukkan ke dalam alat destilasi. Larutan yang di dalam labu destilasi ditambahkan 75 ml larutan NaOH 40 %.
Larutan di atas didestilasi selama 10 menit. Destilat ditampung dalam 10 ml larutan asam boraks 2% yang sebelumnya telah dicampurkan dengan indikator tashiro. Sebelum dititrasi, ujung pendingin dibilas dengan akuades. Larutan campuran destilat tersebut kemudian dititrasi dengan larutan HCl 0,1000 N. Volume larutan HCl 0,1000 N dicatat. Hal yang sama juga dikerjakan terhadap blanko.
Keterangan:
V1 = Volume HCl 0,1000 N untuk titrasi contoh (ml). V2 = Volume HCl 0,1000 N untuk titrasi blanko (ml). N = Normalitas larutan HCl.
W = Bobot contoh, dinyatakan dalam miligram (mg). 14,007 = Bobot atom Nitrogen.
3.4. Bagan Penelitian
3.4.1. Bagan alir pembuatan tepung ampas singkong
Ampas singkong dibersihkan.
Dikeringkan dalam oven pada suhu 40-50oC Digiling dan diayak sampai 50 mesh.
Tepung Ampas Singkong
Uji Kadar Air Ampas Singkong
3.4.2. Bagan alir pembuatan tepung ampas tahu
Ampas singkong dibersihkan..
Dikeringkan dalam oven pada suhu 40-50oC Digiling dan diayak sampai 50 mesh.
Tepung Ampas Tahu
Uji Kadar Air Ampas Tahu
3.4.3. Bagan alir pembuatan PDA
Sebuk PDA dimasukkan dalam labu Erlenmeyer dan ditambahkan 400 ml akuades yang steril.
Dipanaskan hingga mendidih.
Disterilisasi dalam autoclave suhu 121oC dengan tekanan 2 atm selama 15 menit.
Media PDA
3.4.4. Bagan alir pembuatan PDB
Sebuk PDA dimasukkan dalam labu Erlenmeyer dan ditambahkan 400 ml akuades yang steril.
Dipanaskan hingga mendidih.
Disterilisasi dalam autoclave suhu 121oC dengan tekanan 2 atm selama 15 menit. Larutan PDB
Ditambahkan 2 g dektrosa.
Ampas kentang
Hasil (Media PDB)
Kentang 40 g
3.4.5. Isolasi, Identifikasi Kapang dan Pembuatan Suspensi
Diinokulasikan ke dalam cawan petri berisi PDA lalu diinkubasikan pada 30ºC selama 3 hari.
Masing-masing koloni diinokulasikan kembali ke dalam cawan petri berisi PDA lalu diinkubasikan pada 30ºC selama 3 hari.
Suspensi Kultur Murni Rhizopus sp.
Koloni murni kemudian ditumbuhkan pada media PBD yang telah disterilisasi.
Koloni Jamur
Diinkubasi dalam suhu ruangan pada alat oriental sheker.
3.4.6. Pembuatan Laru
Ditambahkan 10 ml akuades steril.
Diinokulasi dengan suspensi kultur murni dan kemudian diinkubasi 30 ºC, selama 3 hari.
Laru Tempe
Disterilisasi pada suhu 121ºC, 15 menit dalam autoclave.
Dikeringkan pada 37-40ºC selama 24 jam kemudian digiling.
Hasil
Dihitung dan diamati viabilitas spora, TPC dan kadar air
Kombinasi Substrat (10 g)
3.4.7. Aplikasi Laru terhadap Kacang Kedelai
Disortir dan direbus selama 30 menit. Direndam selama 22 jam.
Dikupas dan dicuci hingga bersih dan direbus selama 60 menit.
Tempe
Didinginkan dan dikeringkan.
Ditambahkan masing-masing laru yang telah dibuat di atas sebanyak 1,00 % dari berat kacang kedelai dan difermentasi selama 2-3 hari.
Kacang Kedelai 200 g
Hasil
3.4.8. Uji TPC pada Laru Tempe
Ditimbang 1 gram laru dilarutkan ke dalam 10 ml larutan pengencer (biasanya akuades yang steril),.
Divortex dan diencerkan hingga pengenceran 10-8. Pemupukan dilakukan mulai pengenceran 10-6, 10-7, dan 10-8.
Dari masing-masing pengenceran dipipet sebanyak 1 ml ke dalam cawan petri steril, kemudian dituangkan PCA.
Hasil
Cawan diinkubasikan pada suhu 30ºC dalam posisi terbalik selama 3 hari
3.4.9. Uji Viabilitas Spora pada Laru Tempe
Ditimbang 1 gram laru dilarutkan ke dalam 10 ml larutan pengencer (akuades steril). Divortex dan diencerkan hingga pengenceran 10-4. Pemupukan dilakukan mulai pengenceran 10-1, 10-2, 10-3 dan 10-4
.
Dari masing-masing pengenceran dipipet dan dilakukan pengamatan dibawah mikroskop dengan menggunakan haemacytometer.
Hasil
3.4.10.Uji Kadar Air pada Laru Tempe
Ditimbang 1 gram laru dalam cawan porselin dan dicatat sebagai w1.
Dikeringkan di dalam oven bersuhu 105ºC selama 6 jam
Dimasukkan dalam desikator dan ditimbang laru yang telah kering dalam dan dicatat sebagai w2.
Hasil
3.4.11.Uji Kadar Protein pada Tempe
Ditimbang 1 gram (w) dalam kaca arloji dan dimasukkan ke dalam labu Kjeldahl.
Ditambahkan 2 g campuran selenium dan 25 ml H2SO4 pekat.
Larutan jernih kehijau-hijauan Sampel Tempe
Dipanaskan dalam pemanas listrik sampai mendidih dan larutan menjadi jernih kehijau-hijauan.
Dibiarkan dingin, dimasukkan ke dalam labu ukur 100 ml dan kemudian diencerkan dengan akuades secukupnya dan ditambahkan 75 ml larutan NaOH 30 %
Ditambahakan 50 ml NaOH(aq) 40%
Larutan campuran destilat tersebut kemudian dititrasi dengan larutan HCl(aq) 0,1000 N. Dicatat volume HCl 0,1000 N
Larutan Ungu
Dipipet 50 ml larutan yang telah diencerkan dan dimasukkan ke dalam alat destilasi
Didestilasi selama 10 menit dan ditampung destilat di dalam 10 ml larutan asam boraks 2% yan telah dicampurkan sebelumnya dengan indikator tashiro.
Destilat dalam asam boraks 2%
Dibilas ujung pendingin dengan akuades
BAB IV
HASIL DAN PEMBAHASAN
4.1.Hasil Penelitian
4.1.1. Data Jumlah Koloni Kapang Hasil Isolasi Daun Waru
Jumlah koloni kapang hasil isolasi daun waru dapat dilihat dalam Tabel 4.1. di bawah ini:
Tabel 4.1. Data Jumlah Koloni Kapang Hasil Isolasi Daun Waru
Ulangan ke Jumlah Koloni
1 4
2 3
3 5
Rata-rata 4
4.1.2. Hasil Isolat Daun Waru
Hasil identifikasi menunjukkan bahwa kapang yang terdapat dalam daun waru adalah Rhizopus sp. hal ini dapat dilihat dari ciri-ciri mikroskopik Rhizopus sp. Penumbuhan koloni Rhizopus sp. pada cawan petri dapat dilihat
pada Gambar 4.1. di bawah ini.
Gambar 4.1. Penumbuhan koloni Rhizopus sp.
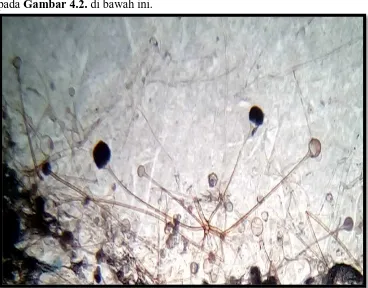
Penumbuhan koloni Rhizopus sp. secara mikroskopik dapat dilihat pada Gambar 4.2. di bawah ini.
Gambar 4.2. Rhizopus sp. dengan pembesaran mikroskop 1000 kali
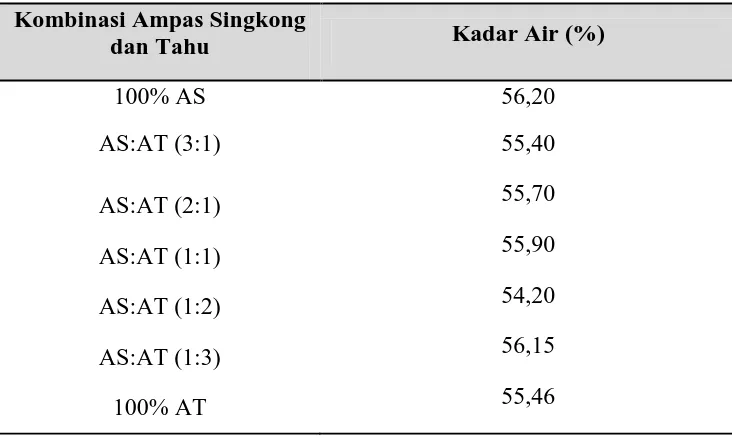
4.1.3. Kadar Air Ampas Singkong dan Tahu
Kadar air dari ampas singkong dan tahu yang telah ditepungkan dapat dilihat dalam Tabel 4.2. di bawah ini:
Tabel 4.2. Kadar Air Ampas Singkong dan Tahu
Jenis Ampas yang
Ditepungkan Kadar Air (%)
Ampas Singkong 8,22
4.1.4. Viabilitas Spora pada Daun Waru
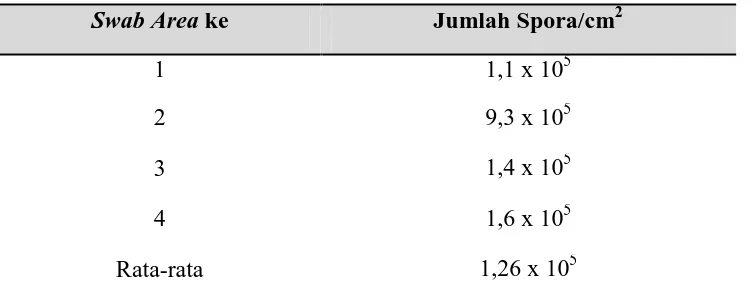
Viabilitas spora pada daun waru dapat dilihat dalam Tabel 4.3. di bawah ini:
Tabel 4.3. Viabilitas Spora pada Daun Waru
Swab Area ke Jumlah Spora/cm2
1 1,1 x 105
2 9,3 x 105
3 1,4 x 105
4 1,6 x 105
Rata-rata 1,26 x 105
4.1.5. Viabilitas Spora pada Laru Tempe
Viabilitas spora pada laru tempe yang telah diproduksi dapat dilihat dalam Tabel 4.4. di bawah ini:
Tabel 4.4. Viabilitas Spora pada Laru Tempe
Kombinasi Ampas Singkong
dan Tahu Jumlah Spora/ml
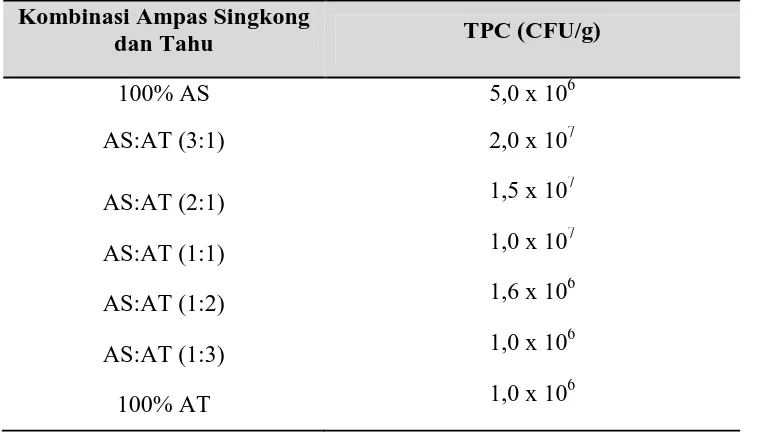
4.1.6. Total Plate Count (TPC)
Hasil perhitungan TPC pada laru tempe dapat dilihat dalam Tabel 4.5. di bawah ini:
Tabel 4.5. TPC pada Laru Tempe
Kombinasi Ampas Singkong
4.1.7. Kadar Air Laru Tempe
Hasil perhitungan kadar air laru tempe dapat dilihat dalam Tabel 4.6. di bawah ini:
Tabel 4.6. Kadar Air Laru Tempe
4.1.8. Kadar Protein pada Tempe
Hasil perhitungan kadar protein pada tempe dapat dilihat dalam Tabel 4.7. di bawah ini:
Tabel 4.7. Kadar Protein pada Tempe
Kombinasi Ampas Singkong
4.1.10.Kadar Air pada Tempe
Hasil perhitungan kadar air laru tempe dapat dilihat dalam Tabel 4.8. di bawah ini:
Tabel 4.8. Kadar Air pada Tempe
4.2.Koloni Kapang Hasil Isolasi Daun Waru 4.2.1. Isolasi Daun Waru
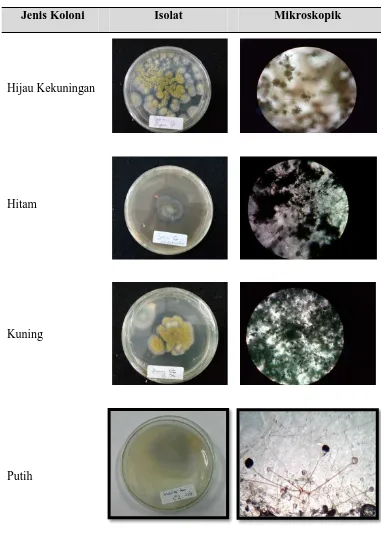
Tabel 4.9. Koloni dari Isolat Daun Waru
Jenis Koloni Isolat Mikroskopik
Hijau Kekuningan
Hitam
Kuning
Gambar 4.3. Struktur Rhizopus sp. sebagai pembanding
Gambar 4.4. Struktur Rhizopus sp. dari daun waru Rhizoid Stolon
R. oligosporus termasuk dalam
dalam pembuat oligosporus merupakan kapang dari filum
menghasilkan tubuh Rhizopus adalah mempunyai tiga tipe hifa (Azizah, 2007), yaitu: a. Stolon, hifa yang membentuk jaringan pada permukaan substrat
(misalnya roti).
b. Rhizoid, hifa yang menembus substrat dan berfungsi sebagai jangkar untuk menyerap makanan.
c. Sporangiofor, hifa yang tumbuh tegak pada permukaan substrat dan memiliki sporangium globuler di ujungnya
Rhizopus bereproduksi secara aseksual dan seksual. Reproduksi secara aseksual adalah dengan spora nonmotil yang dihasilkan oleh sporangium, sedangkan reproduksi seksualnya dengan konjugasi. Ciri-ciri Rhizopus secara mikroskopik (Samson dan Hoekstra, 1988) adalah:
a. Hifa senositik, sehingga tidak bersepta atau bersekat.
b. Dari hifa muncul cabang tegak ke atas yang dinamakan sporangiofor. c. Ujung sporangiofor menggelembung, berfungsi membentuk spora dan
disebut sporangium dan berwarna hitam (gelap). d. Sporangiofor tumbuh ke atas (ke udara).
e. Hifa yang mendatar dan berada di antara sporangiofor dinamakan stolon. f. Sepanjang stolon, tumbuh cabang-cabang halus menyerupai akar yang
disebut rizoid. Rhizoid tumbuh melawan arah sporangiofor. Identifikasi koloni pada daun waru dapat dilihat pada Tabel 4.10.
Tabel 4.10. Identifikasi Koloni
Jenis Koloni Isolat Mikroskopik
Hijau Kekuningan
Hifa tidak terlihat jelas, stolon tidak nampak.
Hitam
Sporangium dan spora tidak jelas terlihat.
Kuning
Hifa tidak terlihat jelas, stolon tidak nampak.
Putih
4.2.2. Identifikasi Isolat Daun Waru
Hasil identifikasi menunjukkan bahwa kapang yang terdapat dalam daun waru adalah Rhizopus sp. Hal ini dapat dilihat dari ciri-ciri mikroskopik Rhizopus sp. Penumbuhan koloni Rhizopus sp. pada cawan petri dapat dilihat
pada Gambar 4.5. di bawah ini.
Gambar 4.5. Kultur murni koloni Rhizopus sp.
Menurut Syarief (1999), koloni Rhizopus sp. dalam cawan petri berwarna abu-abu yang berangsur-angsur menjadi hitam kecokelatan. Perubahan warna tersebut disebabkan tumbuhnya spora dalam koloni tersebut. Spora Rhizopus sp berwarna hitam dan tumbuh setelah waktu 2-3 hari.
Penumbuhan koloni Rhizopus sp. secara mikroskopik dapat dilihat pada Gambar 4.6. di bawah ini.
Menurut Syarief (1999), identifikasi mikroskopik yang menunjukkan bentuk khas Rhizopus sp. adalah stolon, sporangiofora serta terbentuknya jumlah spora dalam jumlah banyak.
4.2.3. Kadar Air Ampas Singkong dan Tahu
Hasil perhitungan kadar air pada ampas singkong dan tahu yang telah ditepungkan dapat dilihat pada Gambar 4.7. di bawah ini:
Gambar 4.7. Grafik kadar air ampas Singkong dan tahu
4.2.4. Viabilitas Spora pada Daun Waru
Hasil perhitungan viabilitas spora pada daun waru dapat dilihat pada Tabel 4.11. di bawah ini:
Tabel 4.11. Viabilitas Spora pada Daun Waru
Swab Area ke Jumlah Spora/cm2
1 1,1 x 105
2 9,3 x 105
3 1,4 x 105
4 1,6 x 105
Rata-rata 1,26 x 105
Secara teori, daun waru dapat digunakan secara langsung menjadi laru, namun daya awetnya relatif rendah dan tidak murni sehingga proses fermentasi dapat dikontaminasi oleh kapang jenis lain (Syarief, 1999). Jumlah spora pada daun waru juga perlu diketahui untuk mengukur pertumbuhan spora pada laru tempe yang akan dibuat.
4.2.5. Viabilitas Spora pada Laru Tempe
Hasil perhitungan viabilitas spora pada laru tempe dapat dilihat pada Gambar 4.8. di bawah ini:
Gambar 4.8. Grafik viabilitas spora pada laru tempe
Viabilitas spora menyatakan jumlah spora dalam laru tempe. Viabilitas spora sangat dipengaruhi oleh umur biakan, faktor lingkungan (kandungan air, suhu dan cahaya matahari) dan kesuburan media biakan.
Dari Gambar 4.8. di atas dapat dilihat bahwa viabilitas spora yang paling tinggi adalah sampel dengan kombinasi substrat AS:AT (3:1). Kombinasi AS:AT (3:1) adalah ampas singkong 3:1 ampas tahu. Penggunaan substrat di atas dan di bawah 3:1 akan menghasilkan laru dengan viabilitas spora yang menurun.
Walker (1999) berpendapat bahwa substrat yang digunakan hendaknya dapat memenuhi minimal kebutuhan minimum pertumbuhan berupa karbon, nitrogen dan air. Artinya, komposisi AS:AT (3:1) sudah memenuhi kebutuhan pertumbuhan Rhizopus sp. Kebutuhan karbon diwakili oleh ampas singkong, sedangkan kebutuhan akan nitrogen diwakili oleh ampas tahu.
Penggunaan substrat di bawah dan di atas komposisi di atas kurang mendukung pertumbuhan Rhizopus sp. Penggunaan 100% ampas singkong dan 100% ampas tahu akan menurunkan viabilitas spora laru disebabkan kombinasi substrat yang tidak proporsional. Ampas singkong tidak mengandung nitrogen, sedangkan ampas tahu kekurangan karbohidrat.
Jika dibandingkan dengan viabilitas laru tempe dari substrat beras, maka viabilitas hasil kombinasi ampas singkong dan tahu lebih tinggi. Viabilitas laru tempe dengan substrat beras adalah 1,0 x 106 spora per gram laru (Sudiarso, 1993). Viabilitas laru dengan substrat beras yang lebih rendah disebabkan oleh kandungan protein (sebagai sumber N) pada beras yang sangat rendah.
Selain itu, terjadi kenaikan jumlah spora pada laru dibandingkan pada daun waru, hal ini membuktikan bahwa laru tempe hasil isolasi lebih murni dan dapat tumbuh dengan baik.
4.2.6. Total Plate Count (TPC)
Hasil perhitungan TPC pada laru tempe hasil isolasi dari daun waru dapat dilihat pada Gambar 4.9. di bawah ini:
Gambar 4.9. Grafik TPC pada laru tempe (x 106 CFU/g)
Total Plate Count (TPC) didasarkan pada asumsi bahwa setiap sel
5,0
Dari Gambar 4.9. di atas dapat dilihat bahwa TPC spora yang paling tinggi adalah sampel dengan kombinasi substrat AS:AT (3:1). Kombinasi AS:AT (3:1) adalah ampas singkong 3:1 ampas tahu. Penggunaan substrat di atas dan di bawah 3:1 akan menghasilkan laru dengan TPC spora yang menurun.
Penggunaan substrat di bawah dan di atas komposisi 3:1 kurang mendukung pertumbuhan Rhizopus sp. Penggunaan 100% ampas singkong dan 100% ampas tahu akan menurunkan TPC spora laru disebabkan kombinasi substrat yang tidak proporsional. Ampas singkong tidak mengandung nitrogen, sedangkan ampas tahu kekurangan karbohidrat.
Substrat yang digunakan dalam memproduksi laru tempe hendaknya dapat memenuhi minimal kebutuhan minimum pertumbuhan berupa karbon, nitrogen dan air (Walker, 1999). Artinya, komposisi AS:AT (3:1) sudah memenuhi kebutuhan pertumbuhan Rhizopus sp. Kebutuhan karbon diwakili oleh ampas singkong, sedangkan kebutuhan akan nitrogen diwakili oleh ampas tahu.
4.2.7. Kadar Air Laru Tempe
Hasil perhitungan kadar air laru tempe hasil isolasi dari daun waru dapat dilihat pada Gambar 4.10. di bawah ini:
Gambar 4.10. Grafik kadar air pada laru tempe
4,30
Kadar air menyatakan jumlah air yang terkandung di dalam laru tempe. Selain karbon dan nitrogen, Rhizopus sp. juga membutuhkan kandungan air dalam substrat untuk mendukung pertumbuhannya (Walker, 1999). Menurut Azizah (2007) dalam penelitiannya menyatakan bahwa kandungan air 4,00% adalah kandungan air optimal dalam menunjang pertumbuhan Rhizopus sp. dalam substrat. Kandungan air dalam laru yang diproduksi di atas adalah berkisar 4,10%-4,80%.
Kadar air yang terlalu tinggi pada laru tempe dapat menyebabkan masa simpan laru yang singkat dan terjadinya kontaminasi dari mikroba yang lain. Sementara kadar air yang minim dapat mencegah terjadinya pertumbuhan Rhizopus sp. pada substrat. Oleh sebab itu kadar air 4,00% adalah kadar air yang proporsional dalam mendukung daya simpan laru. 4.2.8. Kadar Protein pada Tempe
Hasil perhitungan kadar protein pada tempe hasil isolasi dari daun waru dapat dilihat pada Gambar 4.11. di bawah ini:
Gambar 4.11. Grafik kadar protein pada tempe
23,15
Kadar protein menyatakan jumlah protein yang terdapat dalam tempe. Menurut Purnama (2010), jumlah protein akan mengalami penurunan saat terjadi fermentasi, sedangkan jumlah asam amino bebas semakin mneingkat. Fermentasi kacang kedelai adalah proses dekomposisi (penguraian) protein menjadi asam-asam amino dengan adanya Rhizopus sp. yang menghasilkan enzim protease (Karmini, 2011).
Kadang protein kacang kedelai adalah 31,47% (Purnama, 2010). Dari Gambar 4.11. di atas dapat dilihat bahwa kadar protein pada semua sampel adalah berkisar 18,58-23,59%. Ini berarti bahwa telah terjadi penurunan kadar protein dalam proses fermentasi kacang kedelai menjadi tempe. Penurunan kadar protein tertinggi adalah pada perbandingan AS:AT (3:1) yakni 18,58%. Ini menunjukkan bahwa Rhizopus sp. dalam substrat 3:1 bekerja lebih efektif dalam melakukan proses fermentasi dibandingkan sampel yang lain. Substrat 3:1 lebih mampu mendukung aktivitas Rhizopus sp. saat terjadinya fermentasi.
Kombinasi substrat yang lain juga menunjukkan adanya aktivitas fermentasi, namun aktivitas Rhizopus sp. tidak sebaik pada sampel AS:AT (3:1) disebabkan karena suplai makanan pada substrat masih kurang memadai. Suplai nutrisi pada substrat pada perbandingan AS:AT (3:1) sebagai kombinasi yang proporsional dalam mendukung aktivitas Rhizopus sp. dalam melakukan fermentasi (Azizah, 2007).
4.2.9. Kadar Air pada Tempe
Hasil perhitungan kadar air pada laru tempe hasil isolasi dari daun waru dapat dilihat pada Gambar 4.12. di bawah ini:
Gambar 4.12. Grafik kadar air pada tempe
Kadar air menunjukkan jumlah air yang terdapat dalam tempe. Menurut Purnama (2010), dalam proses fermentasi kacang kedelai akan terjadi peningkatan kadar air yang signifikan. Kadar air kacang kedelai adalah 13,27% (Purnama, 2010), sedangkan menurut Warisno dan Kres Dahana (2010) kadar air kacang kedelai mencapai 7,5%. Sementara dari Gambar 4.12 di atas dapat dilihat bahwa kadar air semua sampel berada dalam kisaran 54,20-56,20%. Artinya, terjadi peningkatan kadar air dalam proses fermentasi.
Peningkatan kadar air dalam tempe ini terjadi dalam proses perendaman kacang kedelai selama 1 hari, di mana kacang kedelai akan menyerap air dalam jumlah yang cukup banyak (Purnama, 2010). Perendaman yang dimaksud bertujuan untuk melunakkan biji kedelai dan memberi kesempatan keping-keping kedelai menyerap air sehingga pertumbuhan kapang menjadi optimum (Purnama, 2010).
53,00
Menurut Sudarmadji dan Markakis (1977), kadar air kedelai pada saat fermentasi mempengaruhi pertumbuhan kapang Rhizopus sp. peningkatan kadar air disebabkan adanya penyerapan air oleh kacang kedelai saat perendaman. Selain itu, peningkatan kadar air juga terjadi pada saat fermentasi oleh Rhizopus sp.
Ditinjau dari SNI Tempe, maka kadar air pada semua sampel di atas masih memenuhi standar mutu, yakni maksimal 65%.
4.2.10.Perbandingan dengan Kualitas Tempe Daun Waru
Menurut Azizah (2007), Daun waru sendiri dapat langsung digunakan sebagai laru tempe. Berikut ini data pengamatan Tempe yang dihasilkan oleh daun waru dapat dilihat pada Tabel 4.12.
Tabel 4.12. Pengamatan Organoleptik Tempe dari Daun Waru
Ulangan Percobaan
ke
Gambar Pengamatan
Organoleptik
1
Hifa tidak kompak dan tidak merata
2
Hifa yang dihasilkan oleh daun waru tidak kompak dan merata. Hal ini disebabkan karena viabilitas kapang Rhizopus sp. yang dihasilkan daun waru sangat kecil (Azizah, 2007). Viabilitas spora daun waru hanya sekitar 1,25 x 106 spora/cm2. Viabilitas spora ini jauh lebih kecil dibandingkan dengan viabilitas spora laru tempe hasil isolasi yang mencapai 3,75 x 1011 spora/ml. Viabilitas spora ini menjadi alasan utama yang menyebabkan rendahnya mutu tempe hasil fermentasi langsung dari daun waru.
Selain itu, menurut Azizah (2007), daun waru mengandung banyak jenis kapang. Selain Rhizopus sp., terdapat Mucor sp. dan jenis kontaminan lainnya. Campuran kapang tersebut dan kontaminan menyebabkan Rhozopus sp. tidak dapat bekerja secara optimal dalam melakukan proses
BAB V
KESIMPULAN DAN SARAN
5.1.Kesimpulan
Dari perhitungan dan pembahasan di atas, maka dapat diberikan kesimpulan sebagai berikut:
1. Kombinasi ampas singkong dan tahu yang paling optimal dalam menghasilkan laru tempe dengan karakteristik terbaik adalah 3:1 (ampas singkong 75% : ampas tahu 25%) disebabkan kombinasi tersebut mampu menghasilkan sumber karbon dan nitrogen yang proporsional terhadap kelangsungan Rhizopus sp.
2. Karakteristik laru tempe dengan kombinasi 3:1 adalah jumlah spora 3,75 x 1011 spora/ml, TPC 3,75 x 107 CFU/g, dan kadar air 4,15%, sementara karakteristik tempe yang dihasilkan oleh laru ini berupa kadar protein 18,58% dan kadar air 55,40% serta memenuhi standar mutu tempe dalam SNI.
5.2.Saran
BAB II
TINJAUAN PUSTAKA
2.1.Tanaman Waru
Waru atau baru (Hibiscus tiliaceus merupakan tumbuhan asli tropik pasifik. Tumbuhan ini cepat tumbuh sampai tinggi 5-15 meter, garis tengah batang 40-50 cm; bercabang dan berwarna coklat. Daun merupakan daun tunggal, berangkai, berbentuk jantung, lingkaran lebar/bulat telur, tidak berlekuk dengan diameter kurang dari 19 cm. Daun menjari, sebagian dari tulang daun utama dengan kelenjar berbentuk celah pada sisi bawah dan sisi pangkal. Sisi bawah daun berambut abu-abu rapat. (Azizah, 2007). Gambar tumbuhan Waru dapat dilihat pada Gambar 2.1.
Gambar 2.1. Tanaman Waru
2.1.1. Habitat dan Penyebaran
Waru banyak terdapat di Indonesia, di pantai yang tidak berawa, ditanah datar, dan di pegunungan hingga ketinggian 1700 meter di atas permukaan laut. Tumbuhan ini anyak ditanam di pinggir jalan dan di sudut pekarangan sebagai tanda batas pagar. Pada tanah yang baik, batang tumbuhan ini lurus dan daunnya kecil. Pada tanah yang kurang subur, batangnya bengkok dan daunnya lebih lebar
2.1.2. Kandungan Kimia dan Kegunaan Waru
Dalam pengobatan tradisional, akar waru digunakan sebagai pendingin bagi sakit demam, daun waru membantu pertumbuhan rambut, sebagai obat batuk, obat diare berdarah/berlendir dan amandel. Bunga digunakan untuk obat trakhoma dan masuk angin Kandungan kimia daun dan akar waru adalah samping itu, daun waru juga paling sedikit mengandung lima senyawa fenol, sedang akar waru mengandung tanin Kegunaan waru juga sedang diteliti sebagai anti-kanker (Chen, 2006).
2.1.3. Sumber Rhizopus sp.
Daun waru adalah tempat spora Rhizopus sp. terdapat, sehingga banyak orang langsung menggunakannya sebagai laru. Secara alami, Rhizopus sp. tumbuh dalam daun waru. Masyarakat tradisional menggunakan daun waru secara langsung dalam membuat tempe (Azizah, 2007).
2.2.Laru Tempe
2.2.1. Kapang pada Laru Tempe
Kapang yang berperan dalam pembuatan tempe merupakan kapang yang berasal dari genus Rhizopus. Kemudian, dari genus tersebut, jenis yang paling sering ditemukan adalah Rhizopus oligosporus dan Rhizopus oryzae (Steinkraus, 1960).
Dwidjoseputro dan Wolf (1970) mengamati adanya beberapa perbedaan kapang yang tumbuh pada tempe dari daerah yang berbeda pula. Pada tempe Malang, kapang yang banyak ditemukan adalah jenis R. oryzae, R. arrhizus, R. oligosporus, dan Mucor rouxii. Sedangkan pada tempe dari
daerah Solo, ditemukan R. stolonifer dan R. oryzae. Sedangkan pada tempe yang terdapat di daerah Jakarta, ditemukan kapang Mucor javanicum dan Trichosporus pullulans. Menurut Shurtleff dan Aoyagi (1979) terdapat 120
jenis spesies dan varietas kapang yang dapat menghasilkna tempe. Untuk menghasilkan tempe yang baik, terdapat beberapa jenis spesies, yaitu; R. oligosporus, R. arrhizus, R. stolonifer, R. chlamydosporus, R. chinensis, dan
R. cohnii. Namun, R. oligosporus merupakan kapang utama dalam
pembuatan tempe.
Kapang yang digunakan untuk pembuatan laru haruslah memenuhi beberapa persyaratan, yaitu; (1) produktivitas spora tinggi, (2) viabilitas spora yang dihasilkan seragam dan memiliki stabilitas genetik dalam waktu beberapa bulan, (3) spora cepat terdispersi pada substrat, (4) spora mampu bergerminasi dalam waktu singkat, dan (5) bebas dari organisme kontaminan. Berikut ini adalah sifati-sifat dari beberapa jenis kapang yang umum ditemukan pada ragi tempe (Syarief, 1999);
a. Rhizopus oligosporus
Rhizopus oligosporus merupakan kapang pemeran utama dalam
fermentasi tempe. Di dalam sistematika (Samson dan Hoekstra, 1988), kapang ini memiliki sifat-sifat sebagai berikut:
1) Koloni tampak pucat berwarna abu-abu kecoklatan.
4) Rhizoid bercabang pendek dan tumbuh berlawanan dengan sporangiofora yaitu ke arah substrat dengan dinding sel halus atau agak kasar.
5) Sporangiofora yang telah masak beebentuk bulat berwarna coklat sampai hitam dengan diameter 100-180 mm, dan di dalam sporangiofora terbentuk spora sebagai alat perkembangbiakan.
6) Kolumela berbentuk bulat sampai subglobus dengan apofisis berbentuk cerobong.
7) Spora berupa sel-sel tunggal bentuk tidak beraturan antara bulat sampai oval dengan diameter 7-10 mm, berwarna kecoklatan dengan dinding sel halus.
8) Banyak terdapat khlamidospora baik tunggal maupun berangkau dengan bentuk rantai pendek, tak berwarna, mengandung granula berbentuk bulat sampai elips dengan ukuran 7-30 mm.
9) Khlamidospora terbentuk pada benang-benang hifa atau pada sporangiofora.
10) Temperatur optimum 32-35ºC, minimun 12ºC dan maksimum 42ºC. b. Rhizopus oryzae
Rhizopus oryzae adalah jenis kapang yang berpotensi pula dalam
fermentasi tempe, walaupun tingkat kecepatan fermentasinya lebih lambat dibandingkan dengan R. oligosporus (Samson dan Hoekstra, 1988). Adapun sifat-sifatnya adalah sebagai berikut:
1) Koloni berwarna putih yang berangsur-angsur menjadi abu-abu kecoklatan.
2) Stolon halus atau sedikit kasar dan tidak berwarna hingga kuning kecoklatan.
3) Sporangiofora tumbuh dari stolon dan mengarah ke udara baik tunggal maupun berkelompok (hingga 5 sporangiofora).
5) Sporangia globus atau subglobus dengan dinding berspinulosa (duri-duri pendek) yang berwarna coklat gelap sampai coklat hitam bila telah masak.
6) Kolumela oval hingga bulat dengan dinding halus atau sedikit kasar. 7) Spora bulat, atau berbentuk oval.
8) Temperatur optimal untuk pertumbuhan adalah 35ºC, minimal pada 5-7ºC dan maksimal pada 44ºC.
c. Rhizopus Stolonifer
Kapang ini memiliki kemampuan fermentasi kedelai lebih rendah daripada R.oryzae, karena kecepatan pertumbuhan yang lebih rendah (Samson dan Hoekstra, 1988). Ciri-ciri morfologinya adalah:
1) Koloni putih yang berangsur-angsur menjadi abu-abu kecoklatan oleh adanya perubahan pada sporangiofora dan sporangia.
2) Sporangiofora tunggal atau berkelompok (2-7), tidak berwarna hingga coklat gelap.
3) Rhizoid tubuh bercabang-cabang dengan posisi berlawanan terhadap arah pertumbuhan sporangiofora.
4) Sporangia yang telah dewasa berbentuk globos hingga subglobus berwarna coklat gelap.
5) Bentuk kolumela mengikuti bentuk sporangia (globos, subglobus, atau oval).
6) Spora tidak beraturan bentuknya dan poligonal, oval, globus dan elips. Zygospora berbentuk globus dengan permukaan tidak merata dan tidak simetris.
7) Temperatur optimal pertumbuhan adalah pada 25-26ºC, minimal pada 10ºC dan maksimal pada 35-37ºC.
2.3.Pembuatan Laru Tempe
2.3.1. Laru Tempe Tradisional
Secara tradisional, terdapat beberapa jenis laru, diantaranya: daun jati, daun waru, laru dari tempe, laru beras, dan laru singkong (Syarief, 1999).
a. Daun Jati dan Daun Waru
Daun jati dan daun waru yang langsung digunakan sebagai laru dalam fermentasi kacang kedelai disebut usar. Usar sebenarnya adalah daun jati atau daun waru yang permukaannya telah mengandung spora kapang. Cara pembuatan usar dilakukan melalui beberapa tahap, diantaranya; persiapan kedelai, persiapan daun, dan pemeraman (Suyanto, 1997).
Persiapan kedelai yang dilakukan sama halnya dengan persiapan kedelai untuk pembuatan tempe, yaitu melalui tahap: pencucian kedelai, perebusan, perendaman, pengupasan kulit, pengukusan, penirisan dan pendinginan, serta pemberian laru (Suyanto, 1997).
Tahapan persiapan daun dilakukan dengan melayukan daun yang akan digunakan, baik daun jati maupun daun waru. Kemudian pada bagian permukaan bawah daun (bagian yang berbulu) ditaburi kedelai yang telah dicampur laru. Selanjutnya daun tersebut disusun pada suatu wadah dengan sistem lapis yaitu saling menutup antara satu daun dengan daun yang lain. Bagian atasnya ditutup dengan kain saring atau plastik. Pemeraman tahap pertama dilakukan dengan kondisi menutup bagian atas rak selama 24-36 jam, kemudian diperam lagi. Pada pemeraman selanjutnya daun dibiarkan masing-masing dan dibiarkan terbuka selama 3 hingga 7 hari. Tahap ini sekaligus juga merupakan tahap pengeringan. Apabila kondisi cuaca basah, maka sesekali daun tersebut dikeringkan di bawah sinar matahari agar tidak membusuk (Hermana dan Karmini, 1996).
b. Laru dari tempe
Cara membuat tempe ini relatif sederhana, yakni dengan cara mengiris tipis-tipis tempe yang telah jadi. Irisan tempe tersebut kemudian ditebarkan pada wadah (tampah), dijemur di bawah sinar matahari atau dikeringkan menggunakan oven hingga kering. Irisan tempe yang telah kering tersebut selanjutnya digiling hingga halus. Hasil gilingan kemudian disaring hingga diperoleh bubuk yang halus. Bubuk halus ini dapat dipergunakan untuk pembuatan tempe selanjutnya (Hermana dan Karmini, 1996).
Kelemahan penggunaan metode ini adalah waktu fermentasi yang dihasilkan relatif lama dan kualitas tempe yang dihasilkan tidak optimal (Azizah, 2007). Metode ini menghasilkan miselium tempe yang tidak seragam disebabkan laru ini telah dikontaminasi oleh kapang jenis lain. c. Laru beras
Laru jenis ini merupakan laru yang paling banyak digunakan di Indonesia, seperti halnya laru yang diproduksi oleh LIPI atau KOPTI. Persiapan bahan baku antara lain yaitu beras dan laru tempe pasar atau kultur kapang (Azizah, 2007).
Tahap awal yang dilakukan adalah pencucian beras hingga bersih. Setelah itu ditambahkan air dengan perbandingan 1:1 lalu dikukus hingga matang. Setelah dingin, nasi tersebut kemudian dicampur dengan suspensi kapang atau suspensi laru tempe pasar yang telah ada. Nasi tersebut kemudian diperam 3-4 hari. Setelah diperam, nasi tersebut dikeringkan dibawah sinar matahari atau menggunakan oven hingga kering selanjutnya dilakukan penggilingan agar diperoleh laru berbentuk bubuk yang halus (Hermana dan Karmini, 1996).
d. Laru singkong
Tepung singkong yang telah disangrai dan didinginkan kemudian ditebarkan di tampah untuk selanjutnya diperciki air lalu diaduk rata sampai menjadi adonan yang tidak terlalu lembek. Selanjutnya ditambahkan laru, ditutup dengan daun atau kertas saring, lalu diperam 2-3 hari. Setelah kering, tepung singkong tersebut digiling dan dikemas (Azizah, 2007).
2.3.2. Substrat dalam Membuat Laru
Substrat merupakan media pertumbuhan mikroorganisme yang menyediakan zat-zat penting seperti karbon, nitrogen, ion organik, energi serta air untuk pertumbuhan mikroorganisme tersebut. Menurut Walker (1999), substrat yang digunakan hendaknya dapat memenuhi kebutuhan minimum pertumbuhan, kelangsungan hidup serta tidak terkontaminasi faktor penghambat.
Selam proses fermentasi, mikroorganisme menggunakan komponen-komponen kimia di dalam substrat. Namun, komponen-komponen tersebut terlebih dahulu dipecah menjadi fraksi-fraksi sederhana yang mudah dicerna oleh mikroorganisme tersebut. Aktivitas enzimatik mikroba mampu memecah komponen tersebut menjadi fraksi yang sederhana (Frazier, 1956).
2.4.Ampas Singkong
Singkong (Manihot esculenta) Crantz adalah tanaman adalah semak berkayu yang selalu hijau dengan akar dapat dimakan, yang tumbuh di daerah
tropis dan subtropis wilayah di dunia. Singkong merupakan salah satu
makanan pokok rakyat Indonesia, singkong dengan nama binomial Manihot
esculenta dari kerajaan plantae. Merupakan tumbuhan tropik dan subtropika
dari keluarga Euphorbiaceae.
Tabel 2.1. Kandungan Kimia Ampas Singkong (kering)
Kandungan Nilai (%)
Kadar Pati (Karbohidrat) 37,70 Gula Pereduksi (Karbohidrat) 31,30
Serat 21,00
Kadar Air 9,04
Protein 0,96
Sumber: Fransiska, 2007
2.5.Ampas Tahu
Ampas tahu merupakan limbah padat yang diperoleh dari proses pembuatan tahu dari kedelai. Tahu dibuat dari sari kedelai sedangkan ampas tahu merupakan limbah hasil penyaringan sari tahu. Ditinjau dari komposisi kimianya, ampas tahu dapat digunakan sebagai sumber protein. Komposisi kimia pada ampas tahu dapat dilihat pada Tabel 2.2. berikut:
Tabel 2.2. Kandungan Kimia Ampas Tahu (basah dan kering)
No. Kandungan Ampas Tahu
2.6.Aplikasi Laru Tempe dalam Fermentasi Kacang Kedelai 2.6.1. Proses Ferementasi
Fermentasi berasal dari kata Latin ”fervere” yang berarti mendidih, yang menunjukkan adanya aktivitas dari yeast pada ekstrak buah-buahan atau biji-bijian. Kelihatan seperti mendidih disebabkan karena terbentuknya gelembung-gelembung gas CO2 yang diakibatkan proses katabolisme atau biodegradasi secara anaerobik dari gula yang ada dalam ekstrak (Steinkraus, 1960).
Fermentasi ditinjau secara biokimia mempunyai perbedaan arti dengan mikrobiologi industri. Secara biokimia, fermentasi diartikan sebagai terbentuknya energi oleh proses katabolisme bahan organik, sedang dalam mikrobiologi industri, fermentasi diartikan lebih luas yaitu sebagai suatu proses untuk mengubah bahan baku menjadi suatu produk oleh massa sel mikroba. Dalam hal ini, fermentasi berarti pula pembentukan komponen sel secara aerob yang dikenal dengan proses anabolisme atau biosintesis (Karmini, 2009).
Mikrobiologi industri adalah fermentasi dalam pengertian yang lebih luas yang menguraikan macam-macam proses guna memperoleh hasil dalam skala industri dengan mass culture atau mikroba. Secara komersial, fermentasi dibagi menjadi 4 tipe (Steinkraus, 1960), yaitu :
1. Fermentasi yang menghasilkan sel mikroba atau biomassa. 2. Fermentasi yang menghasilkan enzim mikroba.
3. Fermentasi yang menghasilkan metabolit mikroba baik primer maupun sekunder.
4. Fermentasi yang memodifikasi bahan yang disebut pula dengan proses transformasi.
2.6.2. Kacang Kedelai
Kacang kedelai merupakan salah satu tanaman multiguna, karena dapat digunakan sebagai pangan, pakan, maupun bahan baku industri. Kedelai adalah salah satu tanaman jenis polong-polongan yang memiliki kandungan protein nabati. Protein dalam kacang kedelai menyuplai zat-zat yang dibutuhkan tubuh dan manfaatnya bagi kesehatan. Kedelai menjadi bahan dasar makanan seperti kecap, tahu dan tempe (Warisno dan Dahana, 2010).
Kedelai merupakan sumber gizi yang baik bagi manusia. Kedelai utuh mengandung 35-38% protein tertinggi dari kacang-kacangan lainnya. Sebagian besar kebutuhan protein nabati dapat dipenuhi dari kacang kedelai, salah satu produk olahan kedelai adalah tempe (Warisno dan Dahana, 2010). Kandungan kacang kedelai dapat dilihat apada Tabel 2.3.
Tabel 2.3. Kandungan Kacang Kedelai
No. Kandungan Kacang Kedelai
Jumlah Satuan
Sumber: Warisno dan Dahana (2010)
2.6.3. Fermentasi Kacang Kedelai
Fermentasi adalah suatu proses metabolisme yang menghasilkan produk-produk pecahan baru dan substrat organik karena adanya aktivitas atau kegiatan mikroba. Fermentasi kedelai menjadi tempe oleh Rhizopus Oligosporus terjadi pada kondisi anaerob. Hasil fermentasi tergantung pada
Selain meningkatkan mutu gizi, fermentasi kedelai menjadi tempe juga mengubah aroma kedelai yang berbau langu menjadi aroma khas tempe. Tempe segar mempunyai aroma lembut seperti jamur yang berasal dari aroma miselium kapang bercampur dengan aroma lezat dari asam amino bebas dan aroma yang ditimbulkan karena penguraian lemak. Semakin lama fermentasi berlangsung, aroma yang lembut berubah menjadi tajam karena terjadi pelepasan amonia (Hermana dan Sutedja, 1970).
Dalam proses fermentasi kedelai, substrat yang digunakan adalah keping-keping biji kedelai yang telah direbus, mikroorganismenya berupa kapang tempe Rhizopus oligosporus, Rhizopus oryzae, Rhizopus stolonifer (dapat kombinasi dua spesies atau tiga-tiganya) dan lingkungan pendukung yang terdiri dari suhu 30oC, pH awal 6,8 serta kelembaban nisbi 70-80% (Yusuf, 2010).
Dengan adanya proses fermentasi itu kedelai yang dibuat tempe rasanya menjadi enak dan nutrisinya lebih mudah dicerna tubuh dibandingkan kedelai yang dimakan tanpa mengalami fermentasi. Keuntungan lain dengan dibuat tempe adalah bau langu hilang serta cita rasa dan aroma kedelai bertambah sedap (Nurita Puji Astuti, 2009).
2.6.4. Faktor yang Mempengaruhi Fermentasi Kacang Kedelai
Beberapa faktor yang mempengaruhi proses fermentasi kacang kedelai (Wang, 1975) adalah sebagai berikut:
1. Oksigen
2. Uap Air
Uap air yang berlebihan akan menghambat pertumbuhan kapang. Hal ini disebabkan karena setiap jenis kapang mempunyai uap optimum untuk pertumbuhannya.
3. Suhu
Kapang tempe dapat digolongkan kedalam mikroba yang bersifat mesofilik, yaitu dapat tumbuh baik pada suhu ruang (25-27oC). Oleh karena itu, maka pada waktu pemeraman, suhu ruangan tempat pemeraman perlu diperhatikan.
4. Keaktifan Laru
Laru yang disimpan pada suatu periode tertentu akan berkurang keaktifannya. Karena itu pada pembuatan tempe sebaiknya digunakan laru yang belum terlalu lama disimpan agar dalam pembuatan tempe tidak mengalami kegagalan.
2.6.5. Perubahan yang terjadi Selama Fermentasi
Selama proses fermentasi, kedelai akan mengalami perubahan fisik maupun kimianya (Wang, 1975). Perubahan-perubahan tersebut diantaranya:
1. Peningkatan kadar nitrogen terlarut
Peningkatan ini disebabkan karena adanya aktivitas proteolitik kapang, yang menguraikan protein kedelai menjadi asam-asam amino, sehingga nitrogen terlarutnya akan mengalami peningkatan.
2. Peningkatan pH
Dengan adanya peningkatan nitrogen terlarut maka pH juga akan mengalami peningkatan. Nilai pH untuk tempe yang baik berkisar antara 6,3-6,5.
3. Kedelai menjadi mudah dicerna
4. Perubahan kadar air pada kedelai
Kadar air kedelai pada saat sebelum fermentasi mempengaruhi pertumbuhan kapang. Selama proses fermentasi akan terjadi perubahan pada kadar air dimana setelah 24 jam fermentasi, kadar air kedelai akan mengalami penurunan menjadi sekitar 61% dan setelah 40 jam fermentasi akan meningkat lagi menjadi 64%.
5. Berkurangnya kandungan oligosakarida
Selama fermentasi tempe terjadi pengurangan kandungan oligosakarida penyebab “flatulence”. Penurunan tersebut akan terus berlangsung sampai fermentasi 72 jam.
6. Peningkatan kadar amino bebas
Selama fermentasi, asam amino bebas juga akan mengalami peningkatan dan peningkatannya akan mengalami jumlah terbesar pada waktu fermentasi 72 jam (Murata, 1967).
7. Peningkatan serat kasar dan vitamin
Kandungan serat kasar dan vitamin akan meningkat pula selama fermentasi kecuali vitamin B1 atau yang lebih dikenal dengan thiamin (Shurtleff dan Aoyagi, 1979).
8. Pengurangan disakarida
9. Penurunan lemak
Fermentasi tempe juga mengakibatkan penurunan lemak. Hasil penelitian Kasmidjo (1989) menunjukkan bahwa setelah fermentasi 48 jam menggunakan inokulum Rhizopus sp., 20% lemak akan terhidrolisis oleh enzim lipase. Sedangkan komponen utama lemak kedelai, yaitu asam linoleat akan habis termetabolisasikan pada fermentasi hari ketiga (Kasmidjo, 1989)
2.6.6. Tempe Sebagai Produk Fermentasi
Tempe merupakan produk hasil fermentasi kedelai dalam kurun waktu 36-48 jam menggunakan kapang (Warisno dan Dahana, 2010). Selama proses fermentasi untuk menghasilkan tempe, terdapat perubahan komposisi zat gizi kedelai yang dapat dilihat pada Tabel 2.4.
Tabel 2.4. Komposisi zat gizi kedelai dan tempe (100 gram bahan bdd)
No. Zat Gizi Satuan
2.6.7. Khasiat Tempe
Seiring dengan meningkatnya perhatian masyarakat terhadap kesehatan yang diwakili melonjaknya perhatian terhadap pangan fungsional, tempe pun mulai banyak dilirik untuk diteliti lebih lanjut tentang khasiat yang dikandungnya. Ketertarikan untuk meneliti ini tak lepas berangkat dari kepercayaan akan khasiat tempe yang diceritakan turun-temurun dari generasi sebelumnya (Warisno dan Dahana, 2010).
Sebagai bahan makanan, tempe memiliki beberapa sifat yang menguntungkan bagi para konsumennya, diantaranya;
a. Mengandung protein tinggi serta mengandung 8 jenis asam amino esensial. b. Memiliki kandungan vitamin B12 yang tinggi (Steinkraus, 1960).
c. Rendah kandungan lemak jenuh.
d. Memiliki tekstur seluler yang unik sehingga mudah dicerna dan diserap oleh tubuh (Shurtleff dan Aoyagi, 1979).
e. Mempunyai kandungan zat berkhasiat antibiotok dan dapat menstimulasi pertumbuhan (Wang, 1969).
Selain beberapa keuntungan tersebut di atas, sejak lama tempe telah dipercaya dapat membantu mengatasi beberapa penyakit yang banyak, diantaranya: anemia gizi besi, infeksi dan hiperkolesterol.
2.6.8. Kualitas Tempe a. Kadar Air
b. Kadar Protein
Protein (asal kata protos dari bahasa Yunani yang berarti “yang paling utama”) adalah senyawa organik kompleks berbobot molekul tinggi yang
merupakan polimer dari monomer-monomer asam amino yang dihubungkan satu sama lain dengan ikatan peptida. Dalam tempe, protein merupakan komponen utama yang menyuplai gizi. Menurut SNI, kandungan protein dalam tempa minimal 16% (Fardiaz, 1989).
Analisa kadar protein yang paling umum adalah metode Kjeldahl. Prinsip kerja dari metode Kjeldahl adalah protein dan komponen organik dalam sampel didestruksi dengan menggunakan asam sulfat dan katalis. Hasil destruksi dinetralkan dengan menggunakan larutan alkali dan melalui destilasi. Destilat ditampung dalam larutan asam borat. Selanjutnya ion- ion borat yang terbentuk dititrasi dengan menggunakan larutan HCl (Purnama, 2010).
Metode Kjeldahl merupakan metode yang sederhana untuk penetapan nitrogen total pada asam amino, protein dan senyawa yang mengandung nitrogen. Sampel didestruksi dengan asam sulfat dan dikatalisis dengan katalisator yang sesuai sehingga akan menghasilkan amonium sulfat. Setelah pembebasan dengan alkali kuat, amonia yang terbentuk disuling uap secara kuantitatif ke dalam larutan penyerap dan ditetapkan secara titrasi. Metode ini telah banyak mengalami modifikasi. Metode ini cocok digunakan secara semimikro, sebab hanya memerlukan jumlah sampel dan pereaksi yang sedikit dan waktu analisa yang pendek. Analisa protein cara Kjeldahl pada dasarnya dapat dibagi menjadi tiga tahapan yaitu proses destruksi, proses destilasi dan tahap titrasi (Purnama, 2010).
1. Destruksi
ammonium bereaksi dengan ion sufat dari asam sulfat membentuk ammonium sulfat. Reaksi di katalisis dengan adanya garam kjeldahl. Garam kjeldahl berfungsi untuk mempercepat proses destruksi dengan menaikkan titik didih asam sulfat saat dilakukan penambahan H2SO4 pekat, serta mempercepat kenaikan suhu asam sulfat, sehingga destruksi berjalan lebih cepat dan lebih sempurna. Garam kjeldahl tersebut terdiri dari campuran Na2SO4 anhidrad dan CuSO4. Ion logam Cu akan menaikkan titik didih H2SO4 sedangkan Na2SO4 anhidrad akan menarik air yang terdapat pada sampel. Karena titik didih menjadi lebih tinggi, maka asam sulfat akan membutuhkan waktu yang lama untuk menguap. Karena hal ini, kontak asam sulfat dengan sampel akan lebih lama sehingga proses destruksi akan berjalan lebih efektif. Asam sulfat yang bersifat oksidator kuat akan mendestruksi sampel menjadi unsur-unsurnya. (Purnama, 2010). Selama proses destruksi, terjadi reaksi berikut:
Cu2SO4 + 2H2SO4 2CuSO4 + 2 H2O + SO2
protein/(CHON) + On + H2SO4 CO2 + H2O + (NH4)2SO4 2. Destilasi
Pada dasarnya tujuan destilasi adalah memisahkan zat yang diinginkan, yaitu dengan memecah amonium sulfat menjadi amonia (NH3) dengan menambah beberapa mL NaOH hingga tepat basa, kemudian larutan sampel ini dipanaskan. Prinsip destilasi adalah memisahkan cairan atau larutan berdasarkan perbedaan titik didih. Fungsi penambahan NaOH adalah untuk memberikan suasana basa karena reaksi tidak dapat berlangsung dalam keadaan asam (Purnama, 2010).
reaksi antara NaOH dengan (NH4)2SO4 yang merupakan reaksi yang sangat eksoterm sehingga energinya sangat tinggi. Ammonia yang dibebaskan selanjutnya akan ditangkap oleh larutan asam standar. Asam standar yang dipakai dalam percobaan ini adalah asam borat (Purnama, 2010).
Erlenmeyer yang berisi 100 ml asam borat 2 % + BCG-MR (campuran brom cresol green dan methyl red) atau Tashiro ditempatkan di bagian kanan bawah alat destilasi. Erlenmeyer ini digunakan untuk menangkap amoniak hasil reaksi NaOH dengan (NH4)2SO4. BCG-MR, Tashiro dan PP merupakan indikator yang bersifat amfoter, yaitu bisa bereaksi dengan asam maupun basa. Indikator ini digunakan untuk mengetahui asam dalam keadaan berlebih. Selain itu alasan pemilihan indikator ini adalah karena memiliki trayek pH 6-8 (melalui suasana asam dan basa / dapat bekerja pada suasana asam dan basa), yang berarti memiliki rentang trayek kerjanya yang luas (meliputi asam-netral-basa). Pada suasana asam, indikator akan berwarna merah muda, sedang pada suasana basa akan berwarna hijau-biru. Setelah ditambah BCG-MR, larutan akan berwarna merah muda karena berada dalam kondisi asam(Purnama, 2010).
Asam borat (H3BO3) berfungsi sebagai penangkap NH3 sebagai destilat berupa gas yang bersifat basa. Supaya ammonia dapat ditangkap secara maksimal, maka sebaiknya ujung alat destilasi ini tercelup semua ke dalam larutan asam standar sehingga dapat ditentukan jumlah protein sesuai dengan kadar protein bahan (Purnama, 2010).
Selama proses destilasi lama-kelamaan larutan asam borat akan berubah warna menjadi hijau kebiruan, hal ini karena larutan menangkap adanya ammonia dalam bahan yang bersifat basa sehingga mengubah warna merah muda menjadi biru. Reaksi yang terjadi :
3. Titrasi
Langkah terakhir dalam proses analisis protein adalah titrasi. Titrasi asam-basa digunakan untuk menentukan kadar protein dalam sampel. Karena NH3 yang terbentuk adalah asam lemah, digunakan HCl baku 0,1N untuk menitrasi asam borat yang sudah menangkap ammonia hasil destilasi, titik akhir di tandai dengan perubahan warna menjadi merah muda karena adanya indikator Tashiro atau Phenolptalein pada kondisi sedikit basa (mendekati netral). Reaksi yang terjadi:
BAB I
PENDAHULUAN
1.1. Latar Belakang
Rhizopus sp. merupakan kapang penyusun utama dalam pembuatan laru
tempe. Rhizopus sp. mampu menghasilkan enzim-enzim hidrolitik seperti protease dan lipase. Rhizopus sp. yang beredar di pasaran adalah dalam bentuk bubuk yang telah ditambahkan dengan substrat sebagai media penyuplai nutrisi. Substrat yang ditambahkan dapat menunjang pertumbuhan kapang. Kapang yang digunakan untuk pembuatan laru haruslah memenuhi beberapa persyaratan, yaitu; (1) produktivitas spora tinggi, (2) viabilitas spora yang dihasilkan seragam dan memiliki stabilitas genetik dalam waktu beberapa bulan, (3) spora cepat terdispersi pada substrat, (4) spora mampu bergerminasi dalam waktu singkat, dan (5) bebas dari organisme kontaminan (Syarief, 1999).
Sumber kapang Rhizopus sp. yang sering digunakan adalah usar. Usar sebenarnya berasal dari daun waru (Hibiscus tiliaceus) atau daun jati (Tectona grandis) yang telah ditumbuhi berbagai jenis kapang. Usar dibuat dengan cara menaburkan kedelai yang telah diberi laru pada permukaan bawah daun waru atau daun jati (Sudiarso, 1993). Menurut Azizah (2007), usar memiliki keragaman jenis kapang yang terdapat pada permukaannya. Beberapa jenis kapang yang umum terdapat pada permukaan usar antara lain; Rhizopus sp. dan Mucor sp.. Perbedaan jenis kapang ini akan menyebabkan
Saat ini para produsen tempe lebih banyak mempergunakan laru tempe berbentuk serbuk dengan alasan kepraktisan penggunaan. Selain itu, di pasaran pun kini laru tempe berbentuk serbuk lebih mudah diperoleh. Pada umumnya, laru tempe berbentuk serbuk dapat dibuat dengan menggunakan beras sebagi substrat. Namun, penggunaan beras ini memiliki kendala terutama dari segi finansial sehubungan dengan tingginya harga beras (Azizah, 2007).
Dalam mengurangi penggunaan beras, Azizah (2007) sudah melakukan penelitian kombinasi substrat dari onggok dan beras. Kualitas laru yang dihasilkan kurang optimal disebabkan kedua substrat kurang disuplai oleh protein. Oleh karena itu, penggunaan substrat lain dengan harga yang terjangkau perlu diuji coba guna memperoleh laru tempe dengan kualitas yang jauh lebih baik dan harga yang terjangkau, salah satunya adalah dengan memanfaatkan ampas singkong dan ampas tahu. Sudiarso (1993) juga telah membandingkan kualitas laru tempe dengan menggunakan substrat beras yang dinilai kurang mendapat suplai protein. Dalam penelitian ini diharapkan proporsional kandungan karbohidrat dan protein dapat menghasilkan laru dengan kualitas yang lebih baik.
Menurut penelitian Fransiska (2007), kandungan karbohidrat pada tepung singkong cukup tinggi yakni mencapai 69,00%. Sedangkan menurut penelitian Supriapti (2005), kandungan protein pada ampas tahu mencapai 23,39%. Kedua komponen ini berpotensi sebagai substrat pada pembuatan laru tempe. Oleh sebab itu, penulis mengambil judul penelitian
“KOMBINASI AMPAS SINGKONG DAN TAHU SEBAGAI
1.2.Permasalahan
1. Apakah kombinasi ampas singkong dan tahu dapat dijadikan sebagai substrat dalam pembuatan laru tempe dari isolat daun waru (Hibiscus tiliaceius)?
2. Kombinasi substrat manakah yang lebih optimal dalam menghasilkan laru tempe yang paling baik?
3. Bagaimanakah karakteristik dari laru tempe yang dihasilkan dari isolat daun waru dan bagaimanakah pengaruhnya terhadap kualitas tempe yang dihasilkan?
1.3.Pembatasan Masalah
1. Ukuran ampas singkong dan tahu yang ditepungkan adalah 50 mesh. 2. Dalam membuat suspensi kultur murni Rhizopus sp, waktu inkubasi dalam
media PDB adalah 3 hari dalam suhu 28-30oC.
3. Dalam membuat laru, waktu inkubasi suspensi kultur murni dalam masing-masing kombinasi substrat adalah 3 hari pada suhu 30 ºC.
4. Lamanya waktu pengeringan laru adalah 2 hari pada suhu 37-40oC.
5. Penggunaan laru yang diaplikasikan dalam fermentasi kacang kedelai adalah 1,00 % dan waktu fermentasi 2 hari.
5.1.Tujuan Penelitian
1. Mengetahui kombinasi substrat (ampas singkong : ampas tahu) yang paling baik dalam menghasilkan tempe yang paling berkualitas.
2. Mengetahui karakteristik laru tempe yang dihasilkan dari hasil isolat daun waru (Hibiscus tiliaceus) pada masing-masing substrat yang dikombinasikan dan mengetahui pengaruhnya terhadap kualitas tempe yang dihasilkan.
5.2.Manfaat Penelitian
5.3. Lokasi Penelitian
Penelitian dan analisanya (berupa TPC dan total kapang) dilakukan di Laboratorium Mikrobiologi, Departemen Biologi, FMIPA USU Medan. Analisa kadar air dan protein dilakukan di Laboratorium Kimia Fisika dan Laboratorium Mikrobiologi Industri, PTKI Medan.
5.4. Metodologi Penelitian
Ampas singkong dan ampas tahu ditepungkan kembali dengan cara mengeringkannya pada suhu 40-50oC dan digiling hingga halus (± 50 mesh). Kadar air tepung ampas singkong dan tahu tersebut kemudian diukur.
KOMBINASI AMPAS SINGKONG DAN TAHU SEBAGAI SUBSTRAT DALAM PRODUKSI LARU TEMPE DARI ISOLAT DAUN
WARU (Hibiscus tiliaceus) DAN APLIKASINYA PADA FERMENTASI KACANG KEDELAI
ABSTRAK
Kombinasi ampas singkong sebagai sumber karbon dan ampas tahu sebagai sumber nitrogen memiliki potensi yang kuat sebagai substrat dalam menunjang aktivitas Rhizopus sp. Oleh sebab itu, kajian ini perlu dilakukan dengan tujuan mengetahui karakteristik laru yang dihasilkan dari hasil isolat daun waru (Hibiscus tiliaceus) dan kombinasi substrat (ampas singkong : ampas tahu) yang paling baik. Tahapan penelitian meliputi isolasi Rhizopus sp. dari daun waru sampai diperoleh kultur murni, pembuatan laru dan fermentasi kacang kedelai. Laru yang dihasilkan kemudian diukur viabilitas spora, TPC dan kadar air. Tempe yang dihasilkan diuji kadar protein dan kadar air. Hasil penelitian menunjukkan bahwa kombinasi yang paling baik adalah 3:1 dengan jumlah spora 3,75 x 1011 spora/ml, TPC 3,75 x 107 CFU/g, dan kadar air 4,15% sedangkan karakteristik tempe yang dihasilkan adalah kadar protein 18,58% dan kadar air 55,40%.