APRIDAH CAMELIAWATI DJOHAN
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis Isolasi dan Identifikasi Bakteri Manolitik Laut dari Pulau Pari adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir Tesis ini.
Bogor, September 2012
APRIDAH CAMELIAWATI DJOHAN. Isolation and Identification of Manolytic Bacteria from Pari Island. Under direction of LAKSMI AMBARSARI and YOPI
Indonesia's tropical marine biodiversity of microorganisms have high potential and commercial value. This study focused on the isolation and identification of potential microbes which produce mannanase enzyme to hydrolyze mannan and eventually produce manno-oligosaccharides. Sampling was conducted in Pari island at Jakarta Bay area, the screening and observation of mannanase enzyme activity from those marine biodiversity have been conducted. The research succeed to collect 20 bacteria that could produce mannanase enzyme, three of them have the most high activity from qualitative analysis based on mannolytic index using congo red method for Pari 3, 4 dan 5 such as 4,33, 2,40, dan 2,60. Further quantitative analysis for these bacteria were conducted such as activity of mannanase using dinitrosalicylic acid method and resulted the highest activity is Pari 3 with 2,474 U/mL and Pari 4 with 1,193 U/mL both in the second day of fermentation, whereas Pari 5 with 1,087 U/mL in the third day of fermentation. Analysis 16S rRNA gene were showed that Pari 3, 4, and 5 are domain Bacteria, filum Firmicutes, class Bacilli, ordo Bacillaceae and genus Bacillus. For the spesific identification are using phylogenetic tree and concluded that Pari 3 has similar sequence 91.1% with Bacillus safensis and 92% Bacillus pumilus, from the both result showed the genetic relationship which is less than 97% in similarity therefore it was suggested that the bacteria Pari 3 is a new strain and can be further investigated. Whereas The results of Pari 4 identification has similar sequence 94.1% with Bacillus anthacis and 92.2% with the Bacillus cereus in the genetic relationship. The results of Pari 5 identification has similar sequence 97.1% with Bacillus anthracis and 95.2% with the Bacillus cereus in the genetic relationship.
APRIDAH CAMELIAWATI DJOHAN Isolasi Dan Identifikasi Bakteri Manolitik Laut Dari Pulau Pari. Dibimbing oleh LAKSMI AMBARSARI dan YOPI
Biodiversitas mikroorganisme laut tropis Indonesia mempunyai nilai potensi maupun komersial yang tinggi. Pengembangan ilmu bioteknologi memacu teknik biomolekuler sebagai dasar penelitian yang bertujuan untuk mengidentifikasi mikroorganisme yang telah diisolasi dari alam maupun dalam melakukan rekayasa genetik yang dapat memodifikasi urutan basa sehingga dapat diperoleh jenis enzim yang diinginkan. Sedangkan kemajuan teknik-teknik dalam bidang enzimologi dapat dimanfaatkan untuk menganalisis kualitas enzim secara kuantitatif untuk hasil yang lebih akurat.
Tesis ini terfokus pada identifikasi mikroba laut, pemanfaatan enzim laut penghidrolisis senyawa polisakarida dan memperoleh bakteri manolitik potensial penghasil enzim mananase. Sebagian besar enzim mananase komersial dihasilkan dari mikroba yang berasal dari daratan sehingga adanya ketertarikan untuk melakukan isolasi mikroba penghasil enzim mananase dari laut, tujuan melakukan isolasi yaitu selain memanfaatkan kekayaan biodiversitas asli Indonesia juga dapat melengkapi data mikroba potensial penghasil enzim mananase. Penelitian ini bertujuan untuk mengeksplorasi, mengisolasi, skrining dan identifikasi bakteri manolitik laut lokal dari pulau Pari Indonesia.
Pengambilan sampel dilakukan di kawasan pulau Pari teluk Jakarta, proses identifikasi dan pengamatan aktivitas enzim mannanase dilakukan menggunakan metode kualitatif dengan pewarnaan congo red. Sedangkan untuk analisis kuantitatif untuk menentukan besarnya aktivitas mananase yang dihasilkan oleh bakteri, digunakan metode asam dinitrosalisilat. Secara molekuler bakteri manolitik potensial dapat diidentifikasi genus, spesies serta pohon kekerabatannya dengan menganalisis gen 16S rRNA yang bersifat spesifik untuk setiap bakteri.
Hasil isolasi dan skrining telah berhasil diperoleh 20 bakteri yang dapat menghasilkan enzim mananase dan tiga diantaranya mempunyai aktivitas tertinggi berdasarkan analisis congo red yaitu Pari 3, 4 dan 5, dengan indeks manolitik berturut-turut 4,33; 2,40; dan 2,60. Hasil analisis aktivitas enzim mananase pada isolat Pari 3 pada hari kedua menunjukkan aktivitas tertinggi sebesar 2,474 U/mL, dengan tipe enzim yang disekresikan yaitu eksoenzim karena dari pola
pemanfaatan substrat mannan sesuai dengan pertumbuhan jumlah sel. Pari 4 mempunyai aktivitas tertinggi di hari kedua sebesar 1,193 U/mL.
bakteri Pari 3 merupakan strain baru dan dapat diteliti lebih lanjut. Hasil identifikasi bakteri Pari 4 mempunyai hasil kekerabatan 94,1% dengan Bacillus anthracis dan 92,2% dengan Bacillus cereus. Hasil identifikasi bakteri Pari 5 mempunyai hasil kekerabatan 97,1% dengan Bacillus anthracis dan 95,2% dengan Bacillus cereus. Menurut Schloss dan Handelsman 2004. bila kemiripan
maksimum ≥ λ7% maka dianggap satu spesies yang sama, maka dapat disimpulkan bahwa bakteri Pari 4 dan 5 merupakan Bacillus anthracis.
Penelitian ini sebagai langkah awal pemanfaatan dan eksplorasi biodiversitas mikroba laut lokal Indonesia sebagai sumber penghasil enzim pada umumnya dan enzim mananase pada khususnya. Akan sangat baik jika bakteri manolitik potensial yang telah diisolasi dapat pula diidentifikasi gen penyandi enzim mananasenya untuk dikembangkan secara rekayasa genetika dalam memproduksi enzim mananase untuk skala industri atau komersial.
© Hak Cipta milik IPB, tahun 2012
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutian tersebut tidak merugikan kepentingan yang wajar IPB
APRIDAH CAMELIAWATI DJOHAN
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Biokimia
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
NRP : G851100061
Disetujui
Komisi Pembimbing
Dr. Laksmi Ambarsari, MS. Dr. Yopi
Ketua Anggota
Diketahui
Ketua Program Studi Biokimia Dekan Sekolah Pascasarjana
Prof. Dr. drh. Maria Bintang, MS. Dr. Ir. Dahrul Syah, MS
Segala puji syukur penulis panjatkan kepada Tuhan Yang Maha Pengasih atas kasih karunia-Nya sehingga tesis yang berjudul “Isolasi dan Identifikasi Bakteri Manolitik Laut dari Pulau Pari” ini telah dapat diselesaikan. Tesis ini dibuat sebagai salah satu syarat mahasiswa pascasarjana program S2 untuk meraih gelar Magister pada Sekolah Pascasarjana Institut Pertanian Bogor. Penyusunan tesis ini melalui proses penelitian dan penulisan yang membutuhkan banyak dukungan serta bantuan secara intelektual dan teknisnya, untuk itu melalui kesempatan ini penulis menyampaikan terimakasih kepada berbagai pihak. Ucapan terimakasih yang sebesar-besarnya penulis haturkan kepada :
1. Tim komisi pembimbing yang terdiri: (1) Dr. Laksmi Ambarsari, MS., sebagai ketua komisi pembimbing yang telah banyak memberikan perhatian, bantuan,
dan meluangkan waktu untuk membimbing, dan berdiskusi. (2) Dr. Yopi, sebagai anggota komisi pembimbing serta pembimbing selama melakukan penelitian di Laboratorium Biokatalis dan Fermentasi di Pusat penelitian Bioteknologi LIPI Cibinong.
2. Bapak Dr. Ir. I Made Artika, M. App. Sc., yang telah meluangkan waktu dan berkenan menjadi penguji luar komisi serta memberi saran yang sangat bermanfaat bagi penulis.
3. Ibu Prof. Dr. Maria Bintang, MS., selaku ketua program studi S2 Biokimia yang telah meluangkan waktu dan berkenan menjadi moderator dalam ujian siding tesis dan untuk segala doa, bantuan dan dukungan selama penulis melaksanakan studi di program Magister Biokimia IPB.
4. Rekan-rekan di Laboratorium Biokatalis dan Fermentasi, Pusat Penelitian Bioteknologi Lembaga Ilmu Pengetahuan Indonesia (LIPI) di Cibinong, Ahmad Thontowi, M.Si., Nanik Rahmani, M.Si., Ade Andriani S.Si., Alex Prima, S.Si., dan Awan Purnawan, S.Si., terimakasih atas senyum, semangat, dukungan dan saran yang sangat membantu dalam menyelesaikan tesis ini.
7. Teman-teman Biokimia angkatan 2010, Sri Anggarini Rasyid, Elizabeth Situmorang, Martha Sari, Noni Mardian Trizana, dan Adios Boby serta teman-teman yang tidak sempat penulis sebutkan namanya satu persatu, Terimakasih atas persahabatan yang indah semasa menjadi mahasiswa Biokimia.
8. Terimakasih yang khusus dan mendalam penulis sampaikan kepada kedua orang tua penulis, papi Djohan Hartanto (alm) dan mami Lili Suhartini, atas segala doa, kasih sayang, dan dukungan selama membesarkan dan mendidik penulis sehingga berhasil menempuh pendidikan hingga jenjang Magister. 9. Kakak tersayang Felinawati Djohan, Djeppy Hartono Djohan dan Frangky
Hartono Djohan atas segala doa dan dukungannya selama penulis mengikuti pendidikan Magister di IPB.
10. Terimakasih untuk sahabat-sahabat terbaik dan terkasih, Michael H.B Lumintang, Lidya Huang Huang, Swastika Praharyawan dan Ashif Irvan Yusuf atas segala doa, dukungan serta semangatnya selama penulis menempuh pendidikan Magister di IPB.
Penulis menyadari dalam penulisan serta penyusunan tesis ini masih
banyak kekurangan dan keterbatasan dari segi materi maupun segi sistematika, oleh karena itu penulis dengan segala kerendahan hati terbuka untuk menerima kritik dan saran yang bersifat membangun demi penyempurnaan penyusunan tesis ini. Akhirnya semua budi baik yang diberikan kepada penulis semoga diterima dan dibalas berlipat ganda oleh Tuhan Yang Maha Esa. Penulis menyampaikan permohonan maaf apabila penulis melakukan kesalahan baik yang disengaja maupun tidak semasa menyelesaikan studi magister ini. Semoga tesis ini dapat bermanfaat bagi penulis khususnya maupun bagi rekan-rekan mahasiswa.
Bogor, September 2012
Halaman
Identifikasi 16S rRNA dengan Metode PCR... 14
Ribosomal Database Project (RDP) ………... 15
METODOLOGI…………... 17
Waktu dan Tempat penelitian... 17
Cara Kerja…………... 17
HASIL DAN PEMBAHASAN... 23
Isolasi dan Purifikasi akteri manolitik Laut…... 23
Aktivitas Enzim Mananase………... 27
DNA Genom... 30
Amplikon Gen 16S rRNA... 31
Pohon Filogenetik Pari 3………...…... 32
Pohon Filogenetik Pari 4 dan 5... 33
SIMPULAN DAN ARAN ………. 37
Simpulan ……….… 37
Saran ………... 38
DAFTAR PUSTAKA... 39
i
DAFTAR GAMBAR
Halaman
1. Hemiselulosa... 5
2. Pemotongan Heteromannan oleh Komplek Enzim Mananase... 7
3. Lokasi Sampling di Pulau Pari Kepulauan Seribu DKI Jakarta... 23
4. Bakteri Manolitik Laut Potensial Penghasil Enzim Mananase... 24
5. Hasil Analisis Kualitatif Bakteri Manolitik Metode Congo Red ….. 25
6. Aktivitas Mananase dan Jumlah Sel Bakteri Pari 3……….…... 28
7. Aktivitas Mananase dan Jumlah Sel Bakteri Pari 4... 29
8. Aktivitas Mananase dan Jumlah Sel Bakteri Pari 5... 29
9. Elektroforegram Genom Bakteri Manolitik Laut …... 30
10.Elektroforegram Amplikon Hasil Identifikasi 16S rRNA... 31
11.Pohon Filogenetik Bakteri Manolitik Laut Pari 3... 33
ii
DAFTAR LAMPIRAN
Halaman
1. Diagram Alir Penelitian ... 43
2. Hasil Contiq Bakteri Manolitik Laut Pari 3………. 44
3. Hasil Contiq Bakteri Manolitik Laut Pari 4………. 45
4. Hasil Contiq Bakteri Manolitik Laut Pari 5………. 46
5. Kromatogram Bakteri Manolitik Laut Pari 3………... 47
6. Kromatogram Bakteri Manolitik Laut Pari 4………... 48
7. Kromatogram Bakteri Manolitik Laut Pari 5………... 49
8. Analisis Identifikasi Bakteri Manolitik Laut Pari 3... 50
9. Analisis Identifikasi Bakteri Manolitik Laut Pari 4... 51
PENDAHULUAN
Latar Belakang
Indonesia merupakan negara bahari yang mempunyai kekayaan biodiversitas mikroorganisme laut yang potensial untuk pengembangan ilmu pengetahuan maupun nilai komersial dalam meningkatkan industri dalam negeri. Kemajuan bidang bioteknologi menstimulasi berkembangnya penelitian dan eksplorasi kekayaan biodiversitas mikroorganisme laut asli Indonesia untuk melengkapi database mikroorganisme potensial yang saat ini belum banyak dilakukan.
Pemanfaatan biodiversitas mikroba laut semakin diharapkan secara maksimal
untuk menghasilkan terobosan baru melalui produk hasil metabolisme, bioproses maupun kemampuannya menghasilkan jenis enzim yang spesifik. Tingginya
permintaan pasar akan produk-produk baru dan mempunyai tingkat efisiensi yang tinggi dalam proses produksi sangat dibutuhkan dalam bidang industri seperti pangan fungsional, farmasi, peternakan, bioenergi, lingkungan dan kesehatan. Saat ini pemanfaatan teknologi enzimatik dalam dunia industri sedang pesat dilakukan, salah satu enzim yang mempunyai peranan penting tersebut adalah enzim mananase. Enzim mananase merupakan enzim yang dapat mengkatalisis reaksi
hidrolisis dari ikatan β-1,4-manosidik dari rantai manan, glukomanan, dan galaktomanan. Enzim mananase dapat digunakan dalam aplikasi teknologi enzim pada industri yang beragam seperti makanan, pakan, farmasi, kertas maupun dalam industri gas sebagai stimulasi maupun perlakuan awal terhadap biomasa lignoselulosa sebagai bahan untuk biofuel generasi kedua (Songsiriritthigul et al. 2010).
Penelitian mengenai mikroorganisme penghasil enzim mananase dari darat, seperti actinomycetes, kapang, aspergillus, fungi dan bakteri telah banyak dilakukan sehingga informasi tentang gen yang menyandi enzim mananase yang telah dikloning maupun disekuen berasal dari mikroba darat dapat diperoleh, jenis
Indonesia yang masih jarang dilakukan. Mikroba mannolitk adalah mikroba yang dapat menghasilkan enzim mananase yang dapat menghidrolisis polisakarida kompleks menjadi molekul sederhana seperti manno-oligosakarida dan mannosa. Pada umumnya enzim mananase dihasilkan dari mikroorganisme seperti bakteri, namun adapula yang dihasilkan dari tanaman dan hewan. Enzim mananase yang dihasilkan oleh mikroorganisme mempunyai keunggulan tersendiri yaitu bersifat lebih ekonomis, mudah dan efisien dalam memproduksinya. Proses karakterisasi dan fermentasi enzim mananase dari mikroba mempunyai waktu proses yang lebih cepat dibandingkan dengan enzim dari tanaman dan hewan.
Senyawa polisakarida yang terdapat di perairan laut sangat bervariasi karena sesuai dengan jenis monomer yang menyusunnya yaitu agar, kitin, manan, xylan dan selulosa. Pemanfaatan produk polisakarida dalam negeri sangat terbatas walaupun sumbernya berlimpah karena Indonesia merupakan negara tropis yang kaya akan biodiversitas tanaman tropis, tingginya biaya pengembangan produk
polisakarida dan sistem pengolahan yang tradisional menyebabkan Indonesia seringkali menjual bahan mentah dan mengimpor produk yang sudah jadi dengan harga impor yang lebih mahal dari ekspor bahan mentah. Diharapkan dari penelitian ini dapat mengembangkan potensi mikroba lokal dan menghasilkan enzim potensial untuk industri serta mulai memanfatkan teknologi rekayasa genetik dan teknologi enzimatis sehingga dapat dengan maksimal memanfaatkan biomassa polisakarida, karena selain bersifat renewable, teknologi di atas lebih ramah lingkungan.
aktivitas enzim mananase yang cukup unik dalam mendegradasi sumber manan seperti galaktomannan pada substrat locust bean gum, mikroba manolitik laut ini telah diketahui menghasilkan enzim mananase glikosidasi famili 26 yang bersifat termofilik yaitu tahan hingga temperatur 85°C setelah melalui proses karakterisasi enzim dan analisis sekuen DNA (Politz et al. 2000). Mikroba penghasil enzim mananase dari darat dapat berupa aktinobakteri seperti Cellulomonas fimi, actinomicetes dari kelompok streptomicetes seperti Streptomyces galbus dan Streptomyces lividans yang mempunyai karakterisitik enzim yang unik karena
dapat mendegradasi berbagai jenis substrat manan (Stoll et al. 1999).
Tujuan Penelitian
Tujuan umum dari penelitian ini adalah untuk mengeksplorasi kekayaan biodiversitas mikroorganisme laut lokal Indonesia. Tujuan khusus penelitian ini antara lain 1) Mengetahui apakah mikroorganisme laut khususnya bakteri laut mempunyai kemampuan untuk menghasilkan enzim mananase potensial. 2) Mengisolasi, skrining dan mengidentifikasi bakteri manolitik laut lokal dari pulau Pari Indonesia. 3) Melengkapi data base mikroba potensial penghasil enzim mananase.
Hipotesis
Kekayaan biodiversitas mikroorganisme laut lokal Indonesia dapat menghasilkan enzim mananase potensial.
Manfaat Penelitian
TINJAUAN PUSTAKA
Manan
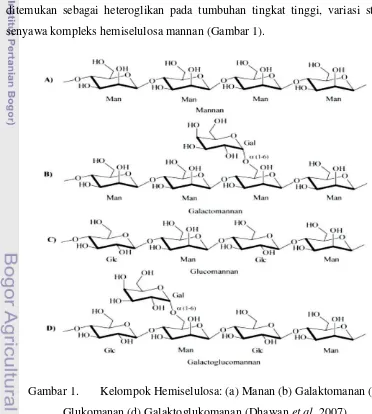
Manan merupakan senyawa hemiselulosa yang terdapat di alam dan merupakan polisakarida kedua yang sangat melimpah setelah selulosa. Manan dapat diklasifikasikan menjadi macam tipe dari mannopolisakarida yaitu linier manan, galaktoglukomanan, galaktomanan, dan glukomanan (Zahura et al. 2011). Manan terdiri atas susunan gula sederhana manosa, galaktomanan terdiri atas manosa dan galaktosa, glukomanan terdiri atas manosa dan glukosa, sedangkan galaktoglukomanan tersusun dari manosa, galaktosa dan glukosa (Sachselehner et al. 2000). Struktur manan berbentuk linier atau bercabang yang dapat pula
ditemukan sebagai heteroglikan pada tumbuhan tingkat tinggi, variasi struktur senyawa kompleks hemiselulosa mannan (Gambar 1).
Gambar 1. Kelompok Hemiselulosa: (a) Manan (b) Galaktomanan (c)
Manan terutama terdapat pada kayu lunak, endosperma kopra, kelapa sawit, kopi, dan locust bean gum. Locust bean gum adalah substrat yang mengandung galaktomanan yang berasal dari tanaman Ceratonia siliqua. Locust bean gum dapat menginduksi sekresi enzim mananase yang dapat menghidrolisis
rantai tulang punggung galaktomanan maupun rantai sampingnya. Locust bean
gum terdiri atas komponen galakto-D-manoglikan 88%, pentan 4%, protein 6%, selulosa 1%, dan mineral 1% (Sumardi 2004).
Enzim Mananase
Enzim adalah biokatalisator yang berfungsi untuk mempercepat laju reaksi kimia dalam suhu dan derajat keasaman yang spesifik. Enzim juga dapat berupa protein sederhana atau protein yang terikat pada gugus non-protein, enzim bersifat spesifik untuk substrat tertentu. Enzim dapat diklasifikasikan berdasarkan beberapa reaksi seperti reaksi oksidasi-reduksi, perpindahan komponen kimia,
hidrolisis, pengurangan atau penambahan suatu zat kimia, isomerasi, dan adanya unit substrat yg berikatan (polimerasi) (Lehninger et al. 2004).
Enzim merupakan biokatalisis yang penggunaannya dibatasi oleh suhu, tekanan, pH, dan kekuatan ion. Enzim juga merupakan zat yang dapat bereaksi di dalam sel hidup, enzim mengkatalisis semua aspek metabolisme sel seperti dalam proses pencernaan makanan yang meliputi hidrolisis senyawa protein, karbohidrat, dan lemak menjadi molekul yang lebih kecil; penyimpanan dan
perpindahan energi kimia serta pembentukkan struktur penyusun sel (Purawadaria et al. 1994).
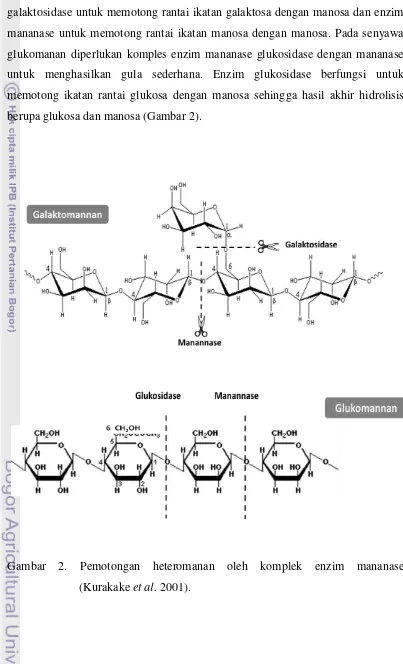
Enzim mananase merupakan enzim pengurai heteromanan menjadi manosa, glukosa, dan galaktosa. Enzim Mananase adalah enzim yang berfungsi untuk mengkatalisis proses hidrolisis manan yang merupakan senyawa polisakarida. Degradasi manan oleh bakteri, fungi, cendawan dan tanaman
manosa dan galaktosa (Duffaud et al. 1997). Proses hidrolisis dari senyawa heteromanan galaktomanan memerlukan komplek enzim mananase yaitu enzim galaktosidase untuk memotong rantai ikatan galaktosa dengan manosa dan enzim mananase untuk memotong rantai ikatan manosa dengan manosa. Pada senyawa glukomanan diperlukan komples enzim mananase glukosidase dengan mananase untuk menghasilkan gula sederhana. Enzim glukosidase berfungsi untuk memotong ikatan rantai glukosa dengan manosa sehingga hasil akhir hidrolisis berupa glukosa dan manosa (Gambar 2).
Enzim Mananase merupakan kelompok enzim glikosida hidrolase yang dapat mendegradasi manan dan heteromanan. Enzim glikosida hidrolase (E.C 3.2.1) merupakan kelompok enzim yang telah diketahui dapat menghidrolisis ikatan glikosidik pada oligo-dan polisakarida. Untuk menghidrolisis substrat karbohidrat yang mempunyai struktur kompleks maka dibutuhkan kombinasi berbagai macam enzim untuk dapat mendegradasi menjadi senyawa manooligosakarida. Enzim yang termasuk dalam kelompok glikosida hidrolase mempunyai sumber yang berbeda-beda yaitu bakteri, kapang maupun jamur sehingga enzim tersebut dapat diklasifikasikan menjadi kelas yang berbeda menurut urutan sekuen asam amino dan struktur tiga dimensi molekul enzimnya (Dhawanet al.2007).
Perbandingan hasil sekuen dari enzim β-mananase menunjukan bahwa ada dua famili yaitu famili 5 dan 26. Famili 5 merupakan perbandingan dari hasil sekuen bakteri Caldocellum saccharolyticum, Caldibacillus, Vibrio, Aspergillus
aculeatus, Trichoderma reesei dan Agaricus bisporus dan mananase dari kelompok eukariotik seperti Lycopersicon esculentum dan Mytilus edulis. Famili 26 terdiri atas hasil sekuen mananase dari Bacilli sp., Cellvibrio japonicus, Pseudomonas fluorescens dan Rhodothermus marinus. Adapun enzim mananase
dari bakteri dan eukariotik terdapat dalam daftar famili 5 dengan suatu pengecualian untuk beberapa fungi anaerobik, sedangkan untuk famili 26 sebagian besar terdiri atas bakteri origin. Namun dalam beberapa hal tertentu, enzim mananase yang dihasilkan dari mikroorganisme yang bergenus sama dapat diklasifikasikan pada kedua famili 5 dan 26 (Dhawanet al.2007).
Mikroba Manolitik
berada pada laut. Tingkat aktivitas mikroba laut dalam mendegradasi unsur karbon dapat diteliti berdasarkan keberadaan nutrisi yang tersedia di habitatnya. Karakteristik bakteri laut memerlukan air laut atau kadar garam, sehingga bakteri laut digolongkan ke dalam kelompok bakteri halofilik, diantaranya bakteri halofilik moderat yang membutuhkan 1% hingga 20% NaCl untuk pertumbuhannya dan bakteri halofilik ekstrem yaitu memerlukan 15% hingga 31% NaCl untuk pertumbuhannya (Ruyitno 2004).
Nutrisi karbon yang terdapat pada laut tidak seragam karena luasnya area perairan menyebabkan nutrisi yang terkandung mempunyai tingkat konsentrasi yang berbeda-beda. Tingkat kedalaman juga mempengaruhi jenis nutrisi yang terkandung pada bagian laut tertentu, misalnya pada laut dalam hanya dihasilkan nutrisi karbon yang berasal dari hasil degradasi mikroba yang berada pada endapan tanah dan tidak mempunyai aktivitas terhadap sinar matahari. Sedangkan untuk perairan laut dangkal mempunyai nutrisi yang lebih kaya karena mikroba
mendapatkan energi dari sinar matahari untuk melakukan aktivitas metabolisme dan adanya interaksi dari fitoplankton yang dapat mendegradasi senyawa organik. Oleh sebab itu mikroba pada permukaan air laut mempunyai kemampuan yang lebih beragam dalam mendegradasi sumber karbon (Lauroa et al. 2009).
Dasar dari ketertarikan untuk melakukan eksplorasi mikroba laut untuk memperkaya jenis enzim mananase karena selama ini eksplorasi lebih banyak dilakukan untuk mikroba darat. Penelitian yang dilakukan sebelumnya telah menghasilkan enzim mananase termofilik laut dari bakteri Rhodothermus marinus, mikroba ini diisolasi dari perairan laut yang mempunyai suhu tinggi
sehingga mempunyai aktivitas enzim mananase yang cukup unik dalam mendegradasi sumber manan seperti galaktomannan pada substrat locust bean gum, mikroba manolitik laut ini telah diketahui menghasilkan enzim mananase
glikosidasi famili 26 yang bersifat termofilik yaitu tahan hingga suhu 85° C
setelah melalui proses karakterisasi enzim dan analisis sekuen DNA (Politz et al. 2000).
asam amino, enzim glikosida hidrolase (GH) dan CBM diklasifikasikan menjadi famili 112 dan 52. Sistem klasifikasi membagi enzim β-mananase menjadi dua
famili yaitu GH 5 dan 26. Enzim β-mananase telah diisolasi dari berbagai jenis tanaman, fungi dan bakteri sehingga banyak pula literatur tentang gen yang menyandi enzim mananase yang telah dikloning maupun disekuen berasal dari mikroba darat, namun telah diketemukan mikroba laut Vibrio sp. Strain MA-138 penghasil enzim mananase yang telah dimurnikan dan diketahui memiliki enzim mananase terbaru yaitu famili 27 berdasarkan modul pengikat karbohidratnya yang menyandi enzim Man5C yaitu mempunyai wilayah terminal karbohidrat pada spesifik domain, jenis enzim ini mempunyai kemampuan untuk mengikat β -manan dan aktivitas katalitik yang tinggi dalam mendepolimerisasi substrat polisakarida (Tanaka et al. 2009).
Manfaat Enzim Mananase
Pemanfaatan enzim mananase pada dunia industri sangat beragam karena enzim ini mempunyai daya hidrolisis yang tinggi dan cukup stabil pada suhu
tinggi karena bersifat termostabil. keunggulan yang dimiliki oleh enzim mananase membuatnya cukup populer, namun selain keunggulan enzim tersebut adapula kekurangannya yaitu produksi enzim mananase cenderung membutuhkan biaya produksi yang tinggi. Hal ini pula yang menyebabkan para peneliti berusaha untuk mencari solusi untuk menekan biaya produksi dengan memanfaatkan mikroba potensial yang dapat menghasilkan enzim mananase dengan tingkat produksi yang tinggi dan kemurnian yang baik.
meningkatkan produksi telur dan berat telur. Enzim mananase juga digunakan sebagai pakan ternak yang dikombinasi dengan karbohidrat dalam diet ternak. Hasilnya menunjukkan perbaikan terhadap tingkat pertumbuhan dan daya cerna nutrisi (Dahwan et al. 2007).
Dalam industri makanan enzim mananase digunakan untuk produksi kopi instan karena enzim ini dapat mengurangi viskositas ekstrak kopi sehingga memudahkan proses hidrolisis manan kopi. Hal ini menyebabkan pengurangan biaya energi dalam proses pengeringan dalam produksi kopi instan, karena air yang terikat pada manan akan terlepas karena adanya degradasi enzim mananase. Selain itu mananase digunakan untuk menghasilkan monooligomer spesifik yang penting sebagai bahan pangan fungsional, seperti monooligomer yang berfungsi sebagai prebiotik (Sachslehner et al. 2000).
Enzim mananase juga digunakan dalam detergen, berfungsi dalam menfasilitasi penghilangan sisa kotoran dan kosmetika dari zat warna dan tanah.
Mananase pada detergen dapat berfungsi pula sebagai penstabil, pengembang dan penghalus. Untuk beberapa jenis detergen, aplikasi mananase juga dapat dikombinasikan dengan enzim-enzim lainnya seperti amilase, selulase, lipase, pektinase, protease dan endoglukanase (Kensch et al. 2008).
Enzim mananase berfungsi sebagai zat pemutih pada bubur kertas. Efektifitas enzimatis yang terjadi pada proses pemutihan selalu berdasarkan pada jenis kayu yang digunakan dan metode pembuburan kertas, karena enzim mananase hanya dapat bekerja apabila kadar ligninnya rendah (Zhang et al. 2000). Enzim mananase pada industri minyak dan gas dapat diaplikasikan sebagai stimulator untuk proses pematahan hidrolik, hal ini disebabkan sifat termostabil dari enzim yang cukup baik. Sistem kerja enzim ini ialah mengurangi tingkat viskositas larutan pada saat berlangsungnya proses pematahan hidrolik minyak dan gas pada suhu tinggi (Dhawanet al.2007).
D-mannosa. Manno-oligosakarida dapat memacu pertumbuhan probiotik (seperti Bifidobacteria dan Lactobacillus sp), dan menghambat pertumbuhan enterobacteria Salmonella, serta menetralkan sifat-sifat antinutrisi dari lectin (Yopi et al. 2007).
Bioinformatika
Bioinformatika merupakan ilmu yang dapat menghubungkan informasi yang meliputi biologi molekular, struktur biokimia, enzimologi, biologi sel, fisiologi dan patologi dengan menggunakan sistem komputerisasi berdasarkan data yang telah dikumpulkan. Definisi bioinformatika adalah ilmu yang dapat mengorganisir dan menganalisis data kompleks dengan ilmu biologi molekular dan biokimia modern berdasarkan pada informasi yang tersimpan di dalam sekuen nukleotida-DNA, sebagai dasar tersusunnya molekul kehidupan yaitu protein. National Center for Biotechnology Information (NCBI) merupakan organisasi
yang diperkenalkan pada tahun 1988 di Serikat yang bertujuan untuk memproses data secara komputerisasi dalam bidang biomedical dan biokimia. Pada saat itu
NCBI berada di dalam National Library of Medicine (NLM), yaitu badan yang menangani data base biomedikal. NCBI sendiri secara spesifik bergerak dalam bidang pengembangan alat analisis untuk membantu dalam mengerti proses genetik dan molekular maupun sifat-sifat patogenik. Organisasi NCBI mempunyai tujuan pokok, yaitu meliputi 1) menciptakan mekanisme otomatis yang dapat menganalisis dan menyimpan data yang berhubungan dengan biologi molekular, genetik dan biokimia. 2) memfasilitasi penggunaan data base dan perangkat lunak yang tersedia kepada komunitas sains, seperti peneliti, pekerja dalam bidang kesehatan maupun mahasiswa. 3) mengkoordinasi komunitas sains global di seluruh dunia untuk mengumpulkan data genetik dan 4) melakukan penelitian baru yang berhubungan dengan analisis struktur dan hubungan fungsional antara molekul biologis secara komputerisasi (Rashidi et al. 2000).
16S rRNA Ribosom
identik pada seluruh organisme. Ribosom merupakan kompleks ribonukleoprotein yang terdiri atas dua subunit yaitu subunit kecil (small subunit) dan subunit besar (large subunit). Terdapat tiga jenis RNA dalam ribosom prokariotik berdasarkan nilai koefisien sedimentasi, yaitu 5S, 16S, dan 23S rRNA. Gen 16S rRNA merupakan bagian dari subunit kecil ribosom dan berperan penting dalam pengenalan ujung 5’–mRNA serta memposisikan pada letak yang tepat dalam ribosom (Clarridge, 2004).
RNA ribosom pada semua sel memiliki daerah yang urutan basanya sangat lestari dan beberapa daerah yang urutan basanya variatif. Perbandingan urutan basa yang lestari berguna untuk mengkonstruksi pohon filogenetik karena mengalami perubahan dengan relatif lambat dan mencerminkan kronologi evolusi bumi. Sebaliknya, urutan basa yang bersifat variatif dapat digunakan untuk melacak keragaman dan menempatkan galur-galur dalam satu spesies (Pangastuti, 2006).
Dari tiga jenis rRNA yang dimiliki prokariot, gen penyandi 16S rRNA paling sering digunakan sebagai penanda molekular karena memiliki ukuran basa yang paling ideal dari segi analisis statistika dibandingkan gen penyandi 5S rRNA dan 23S rRNA. Molekul 5S rRNA memiliki ukuran basa yang terlalu pendek sehingga tidak ideal untuk analisis statistika, sementara molekul 23S rRNA memiliki struktur sekunder dan tersier yang cukup panjang sehingga menyulitkan analisis. Tingkat kelestarian yang tinggi dan kemudahannya untuk mengukur variasi dari 16S rRNA menjadikan gen penyandi 16S rRNA secara luas digunakan pada penentuan taksonomi, filogeni (hubungan evolusioner), dan memperkirakan laju penyebaran bakteri (Weisburg et al. 2001). Penelitian mengenai kekerabatan evolusioner di antara mikroorganisme berdasarkan perbandingan urutan basa 16S rRNA dipelopori oleh Carl Woese (Krane dan Raymer, 2003). Berdasarkan urutan basa 16S rRNA, Woese mengajukan tiga domain dalam sistem klasifikasi yaitu Archaea, Bacteria dan Eucarya. Dua bakteri dapat dikelompokkan dalam satu genus bila memiliki kemiripan maksimum (maximum identity) ≥ λ3%. Sementara dua bakteri dianggap sebagai satu spesies bila memiliki kemiripan
Identifikasi 16S rRNA dengan Metode Polymerase Chain Reaction (PCR)
Identifikasi molekuler digunakan untuk mempelajari kesamaan deoxyribonucleic acid (DNA) atau homologi genetik diantara organisme.
Kesamaan DNA dapat dipelajari dengan sekuensing terhadap basa DNA atau RNA dan hibridisasi DNA (Malik 2006). Penggunaan untai gen ribosomal RNA untuk klasifikasi mikroorganisme saat ini merupakan salah satu analisis yang cukup akurat untuk menentukan kekerabatan diantara mikroorganisme (Suryadi 2002). Situs DNA molekul 16S rRNA dikenal mempunyai informasi genetik yang cukup lengkap untuk melihat kekerabatan bakteri (Leblond et al. 1996).
Identifikasi 16S rRNA dapat dilakukan dengan metode Polymerase Chain Reaction (PCR). PCR merupakan suatu metode untuk membuat salinan segmen
spesifik dari suatu DNA. Metode ini jauh lebih cepat daripada pengklon gen dengan DNA plasmid atau DNA faga dan seluruhnya dilakukan in vitro
(Campbell 2002).
Gen pengkode 16S rRNA terdapat bagian penyimpan yang berguna untuk
mendisain primer universal PCR yang mampu memperbanyak beberapa fragmen 16S rRNA dari semua bakteri pathogen dan nonpatogen. Fragmen ini termasuk bagian hipervariable yang tidak mudah termutasi dan mengandung tanda urutan spesifik spesies yang berguna untuk mengidentifikasi bakteri hingga ke level spesies (Israhmadini 2008).
Proses PCR merupakan proses siklus yang berulang meliputi denaturasi, annealing dan ekstensi oleh enzim DNA polymerase. Setiap siklus dikondisikan pada temperature berbeda yang telah diprogram oleh mesin yang disebut thermal cycler. Dasar siklus PCR ada 30-35, siklus ini meliputi: denaturasi (95°C) untaian
ganda DNA dipisahkan, annealing (55-60°C) primer dibiarkan berikatan dengan ujung-ujung urutan target yang spesifik, dan ekstensi (72°C). Taq polimerase
menambahkan nukleotida pada ujung 3’ primer dengan menggunakan untai DNA
template DNA, buffer, dNTP (dATP, dCTP, dGTP, dTTP), primer dan unit taq polimerase.
Ribosomal Database Project (RDP)
METODOLOGI
Waktu dan Tempat Penelitian
Penelitian dilakukan dari bulan Agustus 2011 sampai Maret 2012 di Laboratorium Biokatalis dan Fermentasi pada Pusat Penelitian Bioteknologi
Lembaga Ilmu Pengetahuan Indonesia (LIPI) Cibinong-Bogor.
Bahan dan Alat
Alat yang digunakan adalah tabung analisis, cawan petri, oze, bunsen, kapas, gelas piala, mikrotips, erlenmeyer, neraca analitik, sentrifuge, mikropipet, tabung Eppendorf, thermometer, penangas air, pH meter Jenway 3505, magnetic stirer, hot stirer IKA RH basic 2, shaker incubator TAITEC Bioshaker BR-23FP,
laminar air flow Bioclean Bench Sanyo, autoclave Tommy SX-500, spreader,
inkubator bakteri SANYO, PCR ASTEC, elektroforesis Nyx Technik MIR-153, UV gel doc Scope WD, Freezer SANYO Ultra low. Bahan yang digunakan adalah sample air laut dengan media untuk proses pengkayaan dan identifikasi kualitatif menggunakan aquades, Artificial Sea Water, agar powder, substrat (Locust bean gum), pepton, ekstrak khamir, (NH4)2.SO4, KH2PO4, MgSO4.7H2O, CO (NH2)2, CaCl2, FeSO4.7H2O, MnSO4.7H2O, ZnSO4.7H2O, CoCl2, HCl, NaOH, NaCl, pewarna congo red. Bahan yang digunakan dalam proses analisis
enzim mananase secara kuantitatif adalah Reagen berupa reagen dinitrosalisilat (DNS) yang terdiri atas DNS, NaOH padat, fenol, Na2SO3, dan Kalium Natrium
Tartrat (KNa-tartrat). Bahan yang digunakan dalam proses identifikasi gen 16S rRNA dan kloning adalah strain bakteri potensial penyandi mananase,
InstaGene TM Matrix Biorad, agarosa, TAE (Tris Asetat EDTA), Etidium bromida, go taq®green master mix, primer 9F, primer 1510R.
Cara Kerja
Isolasi Mikroba Lautsampling (sampel berupa air laut). Bakteri penghasil mananase diisolasi dengan teknik pengayaan mengikuti Mandels dan Stemberg (1976) dengan memodifikasi sumber karbon. Komposisi media pengayaan, skrining, purifikasi dan identifikasi secara lengkap seperti berikut: Substrat Locust bean gum 0,5%; Pepton 0,075%; Ekstrak khamir 0,05%; Mineral (NH4)2.SO4 0,14%; KH2PO4 0,2%; MgSO4.7H2O 0,03%; CO (NH2)2 0,03%; CaCl2 0,03%; FeSO4.7H2O 0,0005%; MnSO4.7H2O 0,00016%; ZnSO4.7H2O 0,00014%; CoCl2 0,0002% dan pH media 6.0. Mikroba mannolitik diisolasi dari kultur pengkayaan dengan locust bean gum sebagai sumber substrat (sumber karbon berupa manan). Kultur pengkayaan yang telah diinokulasikan air laut hasil sampling diinkubasi dalam shaker incubator selama satu minggu, kecepatan putar 150 rpm pada suhu ruang. Proses isolasi dilakukan dengan cara menginokulasikan hasil kultur pengayaan sebanyak 20 µL dengan faktor pengenceran 10-4 dan 10-5 pada media padat dengan cara disebar dengan menggunakan spreader kemudian diinkubasi selama 24 jam pada suhu ruang.
Proses pemurnian isolat dilakukan dengan cara pick –up koloni tunggal yang telah tumbuh pada media isolasi dan ditumbuhkan pada media padat untuk proses identifikasi (Mandels dan Sternberg, 1976).
Uji Bakteri Manolitik Potensial
Identifikasi bakteri potensial penghasil enzim mananase dengan cara uji kualitatif dengan pewarnaan menggunakan metode congo red. Bakteri laut yang telah murni diinokulasikan pada media padat (komposisi media pengayaan dengan konsentrasi agar 1,5%) yang mengandung substrat manan (Locust Bean Gum 0,5%), kemudian diinkubasi selama 48 jam. Setelah itu ditambahkan larutan
Uji Aktivitas Enzim Mananase
Aktivitas enzim mananase diuji dengan memipet sebanyak 0,5 mL substrat locust bean gum 0,5% direaksikan dengan 0,5 mL enzim mananase lalu
diinkubasi selama 30 menit pada suhu ruang. Reaksi dihentikan dengan penambahan 1,5 mL reagen dinitrosalisilat (DNS). Perlakuan kontrol dengan cara substrat direaksikan dengan DNS lalu ditambahkan enzim. Sampel dan kontrol dididihkan selama 15 menit lalu didinginkan. Setelah dingin suspensi divorteks
dan diukur absorbansinya pada = 540 nm (Miller 1959). Pembuatan kurva standar dilakukan dengan mereaksikan berbagai konsentrasi manosa dari 0-10 mg/ml sebanyak 1 mL dengan 1,5 mL DNS lalu dididihkan selama 15 menit dan didinginkan. Setelah dingin suspensi divorteks dan diukur absorbansinya
pada = 540 nm. Satu unit aktivitas enzim mananase (U) didefinisikan sebagai sejumlah enzim yang dapat mengkatalisis konversi dari 1 mol substrat manan menjadi manosa dalam 1 menit (Bintang 2010).
Identifikasi Mikroba berdasarkan Analisis Gen 16S-rRNA
Isolasi Genom Total
Identifikasi bakteri manolitik diawali dengan mengisolasi DNA genom total menggunakan metode dari kit InstaGene TM Matrix BioRad. Koloni isolat
murni sebanyak satu ose dengan 250 µ L mili Q steril dan disentrifuge selama 1 menit dengan kecepatan 10,000 rpm. Supernatan dibuang sedangkan
Analisis PCR
DNA Template diamplifikasi dengan mengambil 2 µL (60 ng/1µL) template yang dicampur dengan 25 µ L “Gotaq”. Gotaq adalah campuran dNTP, primer dan buffer PCR. Selanjutnya ditambahkan masing-masing 1 µL primer forward 9F 50 µLM (5’-GGCTACCTTGTTACGACTT-) dan 1 µL primer reverse 1510R 50 µLM (5’-GAGTTTGATCCTGGCTCAG-) dan ditambahkan milli-Q steril hingga mencapai volume 50 µ L. Amplifikasi dilakukan dalam thermocycler dengan tahap pre denaturasi awal selama 2 menit pada suhu 95ºC, tahap denaturasi selama 30 menit pada suhu 95ºC tahap annealing selama 1 menit pada suhu 55ºC dan tahap extension selama 2 menit pada suhu 72°C. Banyaknya siklus amplifikasi yang digunakan yaitu 30 siklus.
Elektroforesis Hasil PCR
Proses amplifikasi dengan PCR telah selesai maka dilakukan analisis elektroforesis untuk mendeteksi DNA dan keberhasilan hasil proses amplifikasi.
Produk PCR sebanyak 3 µ L ditambahkan ke dalam sumur gel agarosa, sedangkan untuk marker sebanyak 0,5 µL ditambahkan 0,5 µL Loading dye Fermentas dan 2 µL milli-Q dan dicampur kemudian dimasukan dalam sumur yang berbeda.Proses elektroforesis dilakukan selama 60 menit dengan voltase 50 V dalam larutan Buffer TAE.
DNA hasil amplifikasi yang telah dielektroforesis divisualisaikan dengan perendaman agarosa yang mengandung DNA target ke dalam larutan etidium bromida selama 15 menit, setelah itu dibilas dengan aquades selama 10 menit. Dengan menggunakan UV transluminator, pita DNA akan terlihat dan dapat diketahui ukurannya berdasarkan penanda ukuran molekul yang dinyatakan dengan base pair (bp).
Konstruksi Pohon Filogenetika
pengeditan dengan menggunakan program Bioedit. Setelah diperoleh data hasil contiq urutan nukleotida berdasarkan amplifikasi dengan primer universal, maka
HASIL DAN PEMBAHASAN
Hasil Isolasi dan Pemurnian Bakteri Manolitik Laut
Penelitian ini diawali dengan proses sampling di perairan laut pulau Pari
kepulauan seribu kota Jakarta untuk mendapatkan bakteri manolitik potensial penghasil enzim mananase. Pulau Pari merupakan salah satu kelurahan di
kecamatan Kepulauan eribu elatan kabupaten Kepulauan eribu provinsi DKI Jakarta. Pulau Pari terletak di gugusan Kepulauan eribu dengan letak geografis 05 51 22 Lintang elatan dan 106 36 02 ujur Timur. Pulau Pari juga merupakan tempat wisata, budidaya rumput laut serta tempat penelitian kekayaan laut yang difasilitasi oleh Lembaga Ilmu Pengetahuan Indonesia (LIPI) yang bertujuan untuk melakukan berbagai penelitian demi kepentingan kelestarian alam di pulau ini (Gambar 3).
(a) (b)
(c) (d)
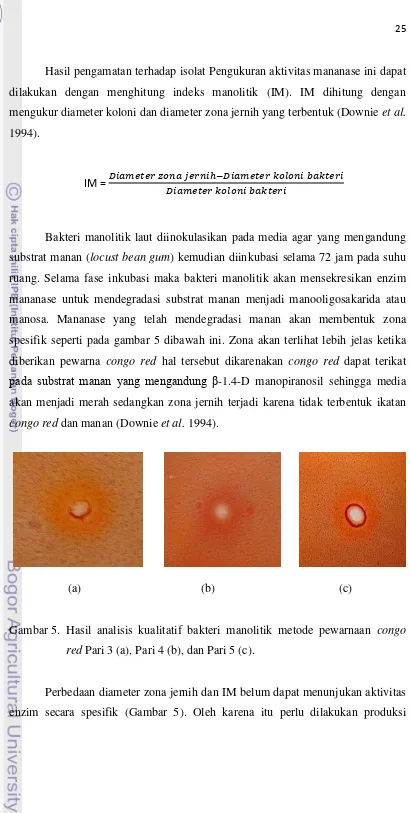
Hasil pengamatan terhadap isolat Pengukuran aktivitas mananase ini dapat dilakukan dengan menghitung indeks manolitik (IM). IM dihitung dengan mengukur diameter koloni dan diameter zona jernih yang terbentuk (Downie et al. 1994).
Bakteri manolitik laut diinokulasikan pada media agar yang mengandung substrat manan (locust bean gum) kemudian diinkubasi selama 72 jam pada suhu ruang. Selama fase inkubasi maka bakteri manolitik akan mensekresikan enzim mananase untuk mendegradasi substrat manan menjadi manooligosakarida atau manosa. Mananase yang telah mendegradasi manan akan membentuk zona spesifik seperti pada gambar 5 dibawah ini. Zona akan terlihat lebih jelas ketika
diberikan pewarna congo red hal tersebut dikarenakan congo red dapat terikat
pada substrat manan yang mengandung β-1.4-D manopiranosil sehingga media akan menjadi merah sedangkan zona jernih terjadi karena tidak terbentuk ikatan congo red dan manan (Downie et al. 1994).
(a) (b) (c)
Gambar 5. Hasil analisis kualitatif bakteri manolitik metode pewarnaan congo red Pari 3 (a), Pari 4 (b), dan Pari 5 (c).
Perbedaan diameter zona jernih dan IM belum dapat menunjukan aktivitas enzim secara spesifik (Gambar 5). Oleh karena itu perlu dilakukan produksi
mananase untuk mengukur aktivitas enzim secara kuantitatif agar data yang diperoleh lebih akurat.
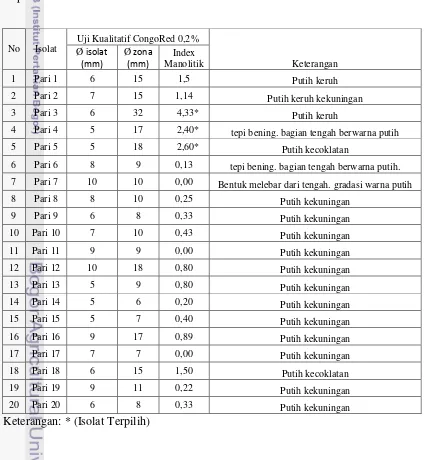
Hasil pengamatan aktivitas enzim mananase secara kualitatif berdasarkan indeks manolitik dapat dilihat pada tabel dibawah ini. Uji ini menujukkan 3 buah isolat potensial yang mempunyai nilai IM yang tinggi yaitu isolat Pari 3 mempunyai IM sebesar 4,33 dengan morfologi koloni putih keruh. Isolat Pari 4 mempunyai IM sebesar 2,40 dengan morfologi tepi koloni bening dan bagian tengah koloni berwarna putih. Sedangkan isolat pari 5 mempunyai IM sebesar 2,60 dengan keterangan morfologi berwarna putih kecokelatan.
Aktivitas Enzim Mananase
Aktivitas enzim mananase dilakukan pada ketiga bakteri potensial yaitu
isolat Pari 3, Pari 4 dan Pari 5 yang mempunyai nilai IM yang cukup tinggi hasil dari uji kualitatif dengan pewarnaan congo red. Penentuan aktivitas enzim mananase menggunakan metode dinitrosalicylic acid dengan locust bean gum sebagai substratnya. Pengukuran aktivitas enzim mananase berdasarkan satuan unit yaitu satu unit aktivitas enzim mananase didefinisikan sebagai banyaknya
enzim yang dapat memproduksi 1 µmol manosa dalam 1 menit (Lehninger et al. 2004). Perhitungan aktivitas enzim mananase adalah sebagai
berikut:
Keterangan: C = konsentrasi enzim p = faktor pengenceran t = waktu
BM = berat molekul
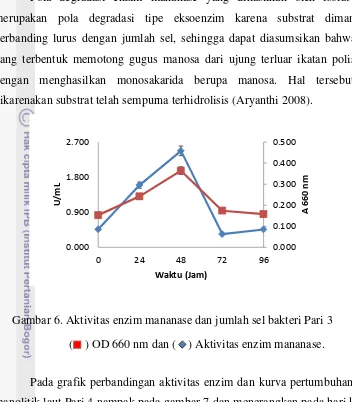
Hasil pengukuran aktivitas enzim mananase untuk isolat Pari 3 menunjukkan kurva pertumbuhan jumlah sel mempunyai pola yang sama dengan
aktivitas enzim mananasenya (Gambar 6). Data aktivitas enzim dilengkapi dengan data kurva pertumbuhan yaitu mengunakan metode pengukuran panjang gelombang 660 nm untuk mendapatkan hubungan antara kisaran jumlah sel bakteri yang tumbuh dengan tingkat aktivitas enzimnya selama masa fermentasi. Aktivitas enzim dengan pertumbuhan sel bakteri manolitik Pari 3 dapat dilihat pada gambar 6 dan diperoleh keterangan bahwa tingkat aktivitas enzim paling tinggi terlihat pada hari ke 2 yaitu 2,474 U/mL hal tersebut dapat terlihat pada grafik dibawah. Aktivitas enzim yang optimum sesuai dengan jumlah sel bakteri yang mencapai jumlah optimum atau mencapai puncak tertinggi pada hari kedua dan penurunan aktivitas enzimnya juga sesuai dengan jumlah sel yang semakin menurun.
Aktivitas enzim mananase (U/mL) =
Pola degradasi enzim mananase yang dihasilkan oleh isolat Pari 3 merupakan pola degradasi tipe eksoenzim karena substrat dimanfaatkan berbanding lurus dengan jumlah sel, sehingga dapat diasumsikan bahwa enzim yang terbentuk memotong gugus manosa dari ujung terluar ikatan polisakarida dengan menghasilkan monosakarida berupa manosa. Hal tersebut dapat dikarenakan substrat telah sempurna terhidrolisis (Aryanthi 2008).
Gambar 6. Aktivitas enzim mananase dan jumlah sel bakteri Pari 3
( ) OD 660 nm dan ( ) Aktivitas enzim mananase.
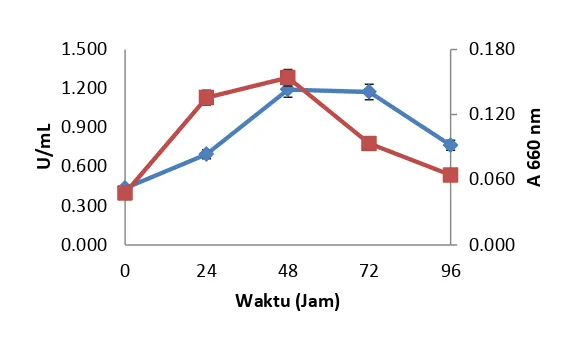
Pada grafik perbandingan aktivitas enzim dan kurva pertumbuhan bakteri manolitik laut Pari 4 nampak pada gambar 7 dan menerangkan pada hari ke 2 dan ke 3 memiliki nilai aktivitas yaitu 1,193 U/mL dan 1,174 U/mL. Aktivitas enzim dengan kurva pertumbuhan Pari 4 dan Pari 5 dapat disimpulkan bahwa kedua bakteri tersebut mempunyai fase optimum jumlah sel yang cukup stabil dan dari
banyaknya gula reduksi yang terbentuk bersifat tidak konstan maka dapat disimpulkan bahwa enzim yang dihasilkan merupakan enzim mananase tipe
Gambar 7. Aktivitas enzim mananase dan jumlah sel bakteri Pari 4
( ) OD 660 nm dan ( ) Aktivitas enzim mananase.
Pada gambar 8 dapat terlihat aktivitas enzim bakteri manolitik Pari 5 meningkat pada hari ke 3 yaitu sebesar 1,087 U/mL namun pada grafik jumlah sel hari ketiga menunjukan penurunan, hal ini dapat simpulkan bahwa substrat yang tersedia telah maksimal dihidrolisis oleh enzim secara random pada hari pertama hingga kedua menjadi golongan manobiosa atau manotriosa yang kemudian akan didegradasi secara sempurna menjadi monosakarida pada hari ketiga dan setelah seluruh substrat telah terdegradasi dengan sempurna menjadi monosakarida maka aktivitas enzim menurun pada hari ke empat.
Gambar 8. Aktivitas enzim mananase dan jumlah sel bakteri Pari 5
DNA Genom
Isolasi DNA genom bakteri manolitik laut dilakukan sesuai dengan prosedur
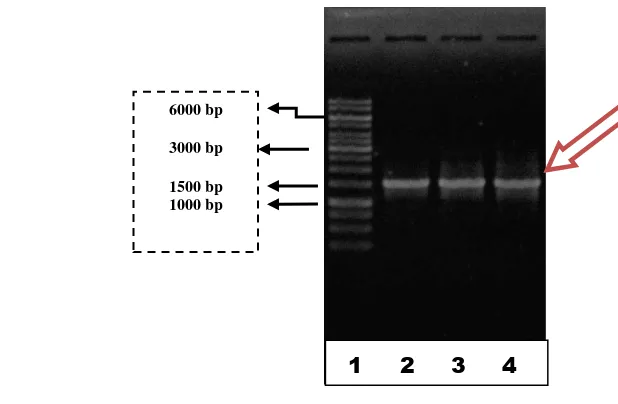
yang tertera pada Kit INSTAGENE BioRad. Hasil pengamatan dapat dilihat pita DNA genom pada elektroforesis gel agarose dengan agarose 1 % untuk mengetahui ukuran pasang basa yang pada genom maka digunakan standar yaitu marker 1 kb dari Gene Ruler ™ (Ladder) Fermentas. Hasil elektroforesis DNA genom menunjukkan keberhasilan dalam mengisolasi genom dari ketiga bakteri manolitik terpilih dengan ditandai oleh adanya pita-pita DNA yang nampak pada agarosa yang sesuai dengan Marker yang dijadikan acuan, yaitu di atas 6000 bp.
Gambar 9. Elektroforegram DNA genom bakteri manolitik laut Marker (1), Pari 3 (2), Pari 4 (3), dan Pari 5 (4).
Hasil elektroforesis menunjukkan pita yang terlihat mempunyai pola yang smear. Hal tersebut dikarenakan volume contoh yang dimasukan ke dalam sumur agarosa terlalu sedikit ataupun terlalu lamanya waktu perendaman dengan etidium bromida dan pada saat pencucian (Gambar 9).
Amplikon Gen 16S rRNA
DNA Genom yang telah berhasil diisolasi selanjutnya di PCR dengan
menggunakan universal primer forward λF (5’-GGCTACCTTGTTACGACTT-) dan primer reverse 1510R (5’-GAGTTTGATCCTGGCTCAG-). Amplifikasi dilakukan dalam thermocycler dengan kondisi pre-denaturasi awal selama 2 menit pada suhu 95ºC, tahap denaturasi selama 30 menit pada suhu 95ºC tahap annealing selama 1 menit pada suhu 55ºC dan tahap extension selama 2 menit pada suhu 72°C. Hasil amplifikasi gen 16S rRNA selanjutnya dapat dilihat dengan elektroforesis agarosa 1%. Proses elektroforesis dilakukan dengan menggunakan acuan marker 1 kb dari Gene Ruler ™ (Ladder) Fermentas.
Pita-pita penanda pada maker 1 kb memiliki 14 pita dengan ukuran terbesar yaitu 10.000 pasang basa sedangkan yang terkecil yaitu 250 pasang basa. Sedangkan pita bakteri manolitik laut Pari 3, Pari 4 dan Pari 5 yang telah melalui proses PCR berhasil diisolasi (Gambar 10) dengan menghasilkan pita pada elektroforegram sesuai dengan ukuran pasang basa untuk mengidentifikasi gen 16S rRNA yaitu dengan kisaran 1.500 pasang basa. Sehingga dapat disimpulkan bahwa primer serta kondisi PCR yang digunaka dapat mengamplifikasi amplikon dengan baik sesuai dengan target gen 16S rRNA (Lauroa et al. 2009).
Gambar 10. Elektroforegram amplikon hasil identifikasi 16S rRNA
Marker (1), Pari 3 (2), Pari 4 (3), Pari 5 (4).
6000 bp
3000 bp
1500 bp 1000 bp
Pohon Filogenetik Bakteri Manolitik Pari 3
Amplikon yang telah berhasil diisolasi selanjutnya akan ditentukan urutan
nukleotidanya dengan cara sekuensing. Sekuensing gen hasil PCR 16S rRNA dilakukan di Laboratorium 1st Base Singapura. Identifikasi gen 16S rRNA dari bakteri manolitik laut Pari 3 berdasarkan hasil sekuensing berupa data kromatogram dan urutan nukleotida, dari data kromatogram maka dapat terlihat puncak-puncak yang tidak sempurna (Lampiran 5), oleh sebab itu perlunya dilakukan pengeditan dengan program bioedit. Selanjutnya data urutan hasil pengeditan pada ujung forward dan reverse akan melalui proses contiq sehingga dapat diperoleh urutan gen 16S rRNA yang lengkap (Lampiran 2). Hasil urutan contiq akan diolah oleh program RDP yang akan dibandingan dengan data yang sudah pada data Gene Bank, selanjutnya dapat disimpulkan bahwa isolat Pari 3 tergolong atas domain Bacteria, filum Firmicutes, kelas Bacilli, ordo Bacillaceae dan genus Bacillus.
Untuk melihat kekerabatan Pari 3 berdasarkan perbandingan dengan bakteri yang telah diketahui susunan basannya pada Bank data Ribosomal Database Project sehingga untuk mempermudah mengetahui identitas bakteri tersebut dapat
terlihat pada pohon filogenetik (Gambar 11). Sedangkan untuk keterangan lebih spesifik yang diperoleh dari bank data dengan menggunakan perangkat RDP maka disimpulkan bahwa Pari 3 memiliki kekerabatan dekat dengan Bacillus safensis (FO-036b;AF234854) dengan nilai keidentikan sebesar 0,919 dengan urutan basa
yang sama sebanyak 1354 pasang basa dan Bacillus pumilus (ATCC 7061;AY876289) dengan nilai keidentikan sebesar 0,920 dengan urutan basa yang sama sebanyak 1352 pasang basa. Menurut Hagstrom 2002. Jika kemiripan ≥ λ3% maka dianggap satu spesies yang sama namun menurut Schloss dan Handelsman 2004. bila kemiripan maksimum ≥ λ7% maka dianggap satu spesies yang sama. Hasil identifikasi bakteri Pari 3 mempunyai hasil kekerabatan 91,1% dengan Bacillus safensis dan 92% dengan Bacillus pumillus.
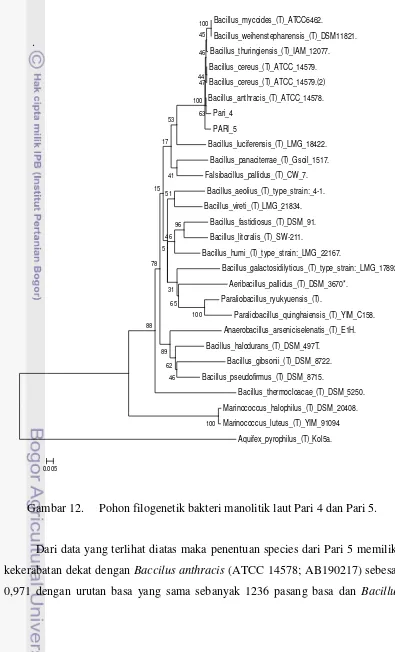
dengan Bacillus anthracis dan 92,2% dengan Bacillus cereus. Menurut Hagstrom 2000, jika kemiripan ≥ λ3% maka dianggap satu spesies yang sama, maka dapat diduga bahwa bakteri Pari 4 merupakan Bacillus anthracis.
.
Gambar 12. Pohon filogenetik bakteri manolitik laut Pari 4 dan Pari 5.
cereus (ATCC 14579;AE016877) sebesar 0,952 dengan urutan basa yang sama
sebanyak 1428 pasang basa. Hasil identifikasi bakteri Pari 5 mempunyai hasil kekerabatan 97,1% dengan Bacillus anthracis dan 95,2% dengan Bacillus cereus. Menurut Hagstrom 2002, jika kemiripan ≥ λ3% maka dianggap satu spesies yang sama, maka dapat diduga bahwa bakteri Pari 5 merupakan Bacillus anthracis.
SIMPULAN DAN SARAN
Simpulan
Penelitian ini telah berhasil mengisolasi 20 bakteri manolitik laut lokal Indonesia dari pulau Pari Kepulauan Seribu kota Jakarta yang dapat mendegradasi senyawa manan. Hasil karakterisasi enzim mananase secara kualitatif dengan metode congo red menunjukkan bahwa 3 bakteri diantaranya mempunyai aktivitas enzim tertinggi yaitu dengan kode isolat Pari 3, Pari 4, dan Pari 5. Hasil analisis aktivitas enzim mananase pada kedua isolat Pari 3 pada hari kedua mempunyai tingkat aktivitas tertinggi yaitu 2,474 U/mL dengan tipe degradasi substrat manan
yang bersifat eksoenzim karena enzim memotong dari ikatan luar rantai linier manan. Pari 4 dan Pari 5 menunjukan aktivitas enzim mananase tertinggi
berturut-turut 1,193 U/mL dan 1,087 U/mL dengan tipe degradasi substrat manan yang bersifat endoenzim atau enzim yang menghidrolisis rantai linier polimer secara random hingga menghasilkan gula reduksi monosakarida galaktosa dan manosa maupun disakarida seperti manobiosa. Analisis lebih lanjut dilakukan secara molekuler berdasarkan gen 16S rRNA untuk dapat mengidentifikasi genus dan spesies ketiga isolat potensial tersebut. Hasil dari sekuensing gen 16S rRNA telah menunjukkan urutan basa nukleotida yang harus melalui proses pengeditan dengan program bioedit sehingga didapatkan urutan contiq basa nukleotida. Hasil dari contiq akan dibandingkan oleh data pada Gene Bank (NCBI) dengan menggunakan program RDP. Hasil perngolahan data menunjukkan bahwa bakteri Pari 3 mempunyai kekerabatan 91,1% dengan Bacillus safensis dan 92% dengan Bacillus pumillus karena keduanya menunjukkan presentase kekerabatan yang
kurang dari 97%, maka dapat diduga bahwa bakteri Pari 3 merupakan strain baru dan dapat diteliti lebih lanjut. Hasil identifikasi bakteri Pari 4 mempunyai kekerabatan 94,1% dengan Bacillus anthracis dan 92,2% dengan Bacillus cereus. Sedangkan identifikasi bakteri Pari 5 mempunyai hasil kekerabatan 97,1% dengan
Bacillus anthracis dan 95,2% dengan Bacillus cereus, Menurut Hagstrom 2002,
jika kemiripan ≥ λ3% maka dianggap satu spesies yang sama, maka dapat diduga
Saran
DAFTAR PUSTAKA
Aryanthi. D. 2008. Uji kualitatif dan kuantitatif enzim mananase isolat bakteri laut dari perairan laut cilacap dan pantai marina. Laporan praktek kerja lapangan. Program Keahlian Analisis Kimia Direktorat Program Diploma – Institut Pertanian Bogor.
Campbell. Neil A.. Jane B. Reece. Lawrence. Mitchell. 2002. Biologi Edisi Kelima Jilid I. Erlangga. Jakarta: 438 hlm.
Clarridge III JE. 2004. Impact of 16S rRNA gene sequence analysis for identification of bacteria on clinical microbiology and infectious diseases. Clinical Microb Rev 17(4):840-862.
Cole JR. Wang Q. 2009. The Ribosomal Database Project: Improved alignments and new tools for rRNA analysis. Nucleic Acids Res: D141-D145.
Dhawan S. Kaur J. 2007. Microbial mananases: an overview of production and applications. Critical Reviews in Biotechnology. 27:197–216. 2007.
Downie B. Hilhorst HWM. Bewley JD. 1994. A New assay for quantifying
endo-β-D-Mannanase Activying Using Congo Red Dye. Pyhtochemistry 36: 829-835.
Duffaud GD et al. 1997. Purification and characterication of extremely thermostable mananase. mannosidase. and a-galactosidase from the hyperthermophilic eubacterium Thermotoga neapolitana 5068. Applied and Environ Microbiol 63:169-177.
Hagstrom CR. Wipat A. 2002. Genome management and analysis: Prokaryotes. di dalam : Ratledge C. Kristiansen B. editor. Basic Biotechnology. Ed- 2nd United Kingdom: Cambridge University Press. Hlm 17-44.
Henrissat et al. 1993. New families in the classification of glycosyl hydrolases based on amino acid sequence similarities. Biochem. J. 293: 781–788.
Hilge M et al. 1998. High-resolution native and complex structures of thermostable mananase from Thermomonaspora fusca substrate specificity in glycosyl hydrolase family 5. J. Structure 6:1433-1444.
Israhmadini U. 2008. Identifikasi dan karakterisasi bakteri laut penghasil selulose dengan metode 16S rRNA. [skripsi]. Jurusan Biologi FMIPA-Universitas Negeri Jakarta.
Kensch O. 2008. Mananase engineering for fibre degradation. Speciality Chemicals Magazine. hlm 18-19.
Kuchel. Philip W. Gregory B. Ralston. 1998. Biochemistry second edition. The McGraw-Hill Companies. United States of America: 595 hlm.
Kurakake M. Komaki T. 2001. Production of β-mananase and β-mannosidase from aspergillus awamori K4 and their properties. J Microbiology vol 42: 377-380.
Lauroa FM et al. 2009. The genomic basis of trophic strategy in marine bacteria. PNAS. Vol 106 ; 37: 15527-15533.
Leblond. Bourget N. Philipe HI. Decaris B. 1996. 16S rRNA and 16S to 23S Internal transcribed spacer sequence analysis reveal inter and intra spesific Bifidobacterium phylogeni. Int. J. Syst Bacteriol. 46: 102-111.
Lehninger. Albert L. 2004. Principles of Biochemistry. The John Hopkins University School of medicine. New York.
Malik A. 2006. Identifikasi bakteri asam laktat (BAL) penghasil eksopolisakarida (EPS) menggunakan gen penyandi 16S rRNA. Departemen Farmasi-Universitas Indonesia.
Mandels M. Sternberg D. 1976. Recent advances in cellulase technology. Ferment Technol 54:267-286.
Moreira LRS. Filho EXF. 2008. An overview of manan structure and manan-degrading enzyme systems. Appl Microbiol Biotechnol 70:165-178.
Pangastuti A. 2006. Definisi Spesies Prokaryota Berdasarkan Urutan Basa Gen Penyandi 16S rRNA dan gen Penyandi Protein. Biodiversitas 7(3): 292-296.
Politz OM et al. 2000. A highly thermostable endo-(1.4)-b-mannanase from the marine bacterium Rhodothermus marinus. Appl Microbiol Biotechnol 53: 715-721.
Purawadaria T. Haryati T. Darma J. 1994. Isolasi dan seleksi kapang mesofilik penghasil mananase. Majalah Jurnal Peternakan. hlm 26‐29.
Ruyitno. 2004. Bakteri laut dan peranannya dalam mendukung aktivitas manusia. Jakarta; Pusat Penelitian Oseanografi lembaga Ilmu Pengetahuan Indonesia.
Sachslehner A, Gabriele F, Nikolaus F, George G. Dietmar H. 2000. Hydrolysis of isolated coffee mannan and coffee extract by mannanase of Sclerotium roflsii. J. Biotechnology 80:127-134.
Stoll D, Stalbrand, Warren A. 1999. Manna degrading enzyme from Cellulomonas fimi. 10 hlm ( http://www.aem,asm.org), 01 September 2012, pk 08.30 WIB.
Sumardi. 2004. Isolasi. karakterisasi. dan produksi -mananase ekstraseluler dari Geobacillus strearothermophilus l-07 [disertasi]. Bogor: Program Pascasarjana. Institut Pertanian Bogor.
Suryadi. 2004. Isolasi. Karakterisasi dan produksi β-Mananase ekstraseluler dari Geobacillus strearothermaphilus 1-7. [disertasi]. Program Pascasarjana-Institut Pertanian Bogor.
Tamaru et al. 1995. Purification an characterization of an extracellular β -1.4-mananase from a marine bacterium. vibro sp. Strain MA-138. J Microbiology. hlm 4454-4458.
Tanaka M et al. 2009. Cloning and characterization of a β-1.4 mannanase 5C possessing family 27 carbohydrate-binding module from marine bacterium. Vibrio Sp. Strain MA-138. Biosci. Biotech. Biochem. 7 (1): 109-116.
Weisburg WG. Barns SM. Pelletier DA. Lane DJ. 1991. 16S ribosomal DNA amplification for phylogenetic study. J. Bact. 173 (2): 697-703.
Yopi et al. 2007. Study on hemicellulytic bacteria: production of oligosaccharides from palm kernel cake using fermentation. Proceedings “Advances in Biological Science: Contribution Towards a etter Human Prosperity”. Page 111-113.
Zahura UA et al. 2011. cDNA cloning and bacterial expression of an endo-β -1.4-mannanase. AkMan. from Aplysia kurodai. Comparative Biochemistry and Physiology. Part B 159: 227–235.
Lampiran 1. Diagram Alir Penelitian
Contoh Air Laut Hasil Sampling + Media
Inkubasi selama 1 minggu pada shaker inkubator pada suhu ruang, 150 rpm.
Isolasi Koloni Tunggal
(Inokulasi kultur pengayaan sebanyak 20 µL pada media padat)
Pemurnian Isolat Potensial (Metode direct pick-up colony)
Uji Manolitik
(Metode Pewarnaan Congo Red)
Analisis Gen 16S rRNA (Metode PCR)
Isolasi genom (Kit Instagene BioRad) Uji aktivitas Enzim mananase
(Metode spektrofotometer/DNS)
Elektroforesis PENELITIAN
TAHAP II PENELITIAN TAHAP I
Amplifikasi Gen 16S rRNA
Lampiran 2 Hasil Contiq Bakteri Manolitik Laut Pari 3
Lampiran 3 Hasil Contiq Bakteri Manolitik Laut Pari 4
1 TTAGGCGGCT GGCTCCAAAA AGGTTACCCC ACCGACTTCG GGTGTTACAA
Lampiran 4 Hasil Contiq Bakteri Manolitik Laut Pari 5
1 GAAGGGGGGG TGCTATACAT GCAAGTCGAG CGAATGGATT AAGAGCTTGC TCTTATGAAG TTAGCGGCGG ACGGGTGAGT AACACGTGGG TAACCTGCCC 101 ATAAGACTGG GATAACTCCG GGAAACCGGG GCTAATACCG GATAACATTT TGAACCGCAT GGTTCGAAAT TGAAAGGCGG CTTCGGCTGT CACTTATGGA 201 TGGACCCGCG TCGCATTAGC TAGTTGGTGA GGTAACGGCT CACCAAGGCA ACGATGCGTA GCCGACCTGA GAGGGTGATC GGCCACACTG GGACTGAGAC 301 ACGGCCCAGA CTCCTACGGG AGGCAGCAGT AGGGAATCTT CCGCAATGGA CGAAAGTCTG ACGGAGCAAC GCCGCGTGAG TGATGAAGGC TTTCGGGTCG 401 TAAAACTCTG TTGTTAGGGA AGAACAAGTG CTAGTTGAAT AAGCTGGCAC CTTGACGGTA CCTAACCAGA AAGCCACGGC TAACTACGTG CCAGCAGCCG 501 CGGTAATACG TAGGTGGCAA GCGTTATCCG GAATTATTGG GCGTAAAGCG CGCGCAGGTG GTTTCTTAAG TCTGATGTGA AAGCCCACGG CTCAACCGTG 601 GAGGGTCATT GGAAACTGGG AGACTTGAGT GCAGAAGAGG AAAGTGGAAT TCCATGTGTA GCGGTGAAAT GCGTAGAGAT ATGGAGGAAC ACCAGTGGCG 701 AAGGCGGACT TTTTTGGTCT GTAAACTGAC AATTGAGGCG GGGAAAGCGT GGGGAGCAAA CAGGATTAGA TACCCTGGTA GTCCACGCCG TAAACGATGA 801 GTGCTAAGTG TTAGAGGGTT TCCGCCCTTT AGTGCTGAAG TTACGCATTA AGCACTCCGC CTGGGGAGTA CGGCCGCAAG GCTGAAACTC AAAGGAATTG 901 ACGGGGGCCC GCACAAGCGG TGGAGCATGT GGTTTAATTC GAAGCAACGC GAAGAACCTT ACCAGGTCTT GACATCCTCT GACAACCCTA GAGATAGGGC 1001 TTCTCCTTCG GGAGCAGAGT GACAGGTGGT GCATGGTTGT CGTCAGCTCG TGTCGTGAGA TGTTGGGTTA AGTCCCGCAA CGAGCGCAAC CCTTGATCTT 1101 AGTTGCCATC ATTTAGTTGG GCACTCTAAG GTGACTGCCG GTGACAAACC GGAGGAAGGT GGGGATGACG TCAAATCATC ATGCCCCTTA TGACCTGGGC 1201 TACACACGTG CTACAATGGA CGGTACAAAG AGCTGCAAGA CCGCGAGGTG GAGCTAATCT CATAAAACCG TTCTCAGTTC GGATTGTAGG CTGCAACTCG 1301 CCTACATGAA GCTGGAATCG CTAGTAATCG CGGATCAGCA TGCCGCGGTG AATACGTTCC CGGGCCTTGT ACACACCGCC CGTCACACCA CGAGAGTTTG 1401 TAACACCCGA AGTCGGTGGG GTAACCTTTT TGGAGCCAGC CGCCTAAGGT
Lampiran 5 Kromatogram Bakteri Manolitik Laut Pari 3
Screen clipping taken: 9/21/2012, 2:39 AM
APRIDAH CAMELIAWATI DJOHAN. Isolation and Identification of Manolytic Bacteria from Pari Island. Under direction of LAKSMI AMBARSARI and YOPI
Indonesia's tropical marine biodiversity of microorganisms have high potential and commercial value. This study focused on the isolation and identification of potential microbes which produce mannanase enzyme to hydrolyze mannan and eventually produce manno-oligosaccharides. Sampling was conducted in Pari island at Jakarta Bay area, the screening and observation of mannanase enzyme activity from those marine biodiversity have been conducted. The research succeed to collect 20 bacteria that could produce mannanase enzyme, three of them have the most high activity from qualitative analysis based on mannolytic index using congo red method for Pari 3, 4 dan 5 such as 4,33, 2,40, dan 2,60. Further quantitative analysis for these bacteria were conducted such as activity of mannanase using dinitrosalicylic acid method and resulted the highest activity is Pari 3 with 2,474 U/mL and Pari 4 with 1,193 U/mL both in the second day of fermentation, whereas Pari 5 with 1,087 U/mL in the third day of fermentation. Analysis 16S rRNA gene were showed that Pari 3, 4, and 5 are domain Bacteria, filum Firmicutes, class Bacilli, ordo Bacillaceae and genus Bacillus. For the spesific identification are using phylogenetic tree and concluded that Pari 3 has similar sequence 91.1% with Bacillus safensis and 92% Bacillus pumilus, from the both result showed the genetic relationship which is less than 97% in similarity therefore it was suggested that the bacteria Pari 3 is a new strain and can be further investigated. Whereas The results of Pari 4 identification has similar sequence 94.1% with Bacillus anthacis and 92.2% with the Bacillus cereus in the genetic relationship. The results of Pari 5 identification has similar sequence 97.1% with Bacillus anthracis and 95.2% with the Bacillus cereus in the genetic relationship.