KAJIAN AKTINOMISET SEBAGAI AGENS HAYATI UNTUK
PENGENDALIAN Sclerotium rolfsii DAN PEMBIAKANNYA
PADA MEDIA LIMBAH ORGANIK PADAT
NURUL WIDYANTI
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
ABSTRAK
NURUL WIDYANTI. Kajian Aktinomiset Sebagai Agens Hayati untuk Pengendalian Sclerotium rolfsii dan Pembiakannya pada Media Limbah Organik Padat. Dibimbing olehGIYANTO.
Pengendalian patogen secara hayati merupakan pengendalian dengan memanfaatkan mikroorganisme yang bersifat antagonis. Mikroorganisme yang dapat digunakan sebagai agens hayati salah satunya adalah aktinomiset. Aplikasi aktinomiset dilapangan memiliki kendala dalam pembiakan secara massal karena penggunaan media di Laboratorium membutuhkan biaya yang cukup mahal sehingga dibutuhkan media alternatif yang murah dan mudah didapat. Tujuan penelitian ini untuk mengetahui kemampuan isolat aktinomiset dalam menekan pertumbuhan S. rolfsii serta melihat pertumbuhannya dalam media tumbuh alternatif berbahan dasar limbah organik serbuk gergaji dan dedak. Aktinomiset yang digunakan yakni APS 7, APS 9, APS 12, dan ATS 5. Biakan aktinomiset diremajakan dari kultur pembiakan lalu diuji secara in vitro terhadap S. rolfsii. Hasil penelitian menunjukkan bahwa dari keempat isolat aktinomiset yang digunakan hanya isolat APS 7 yang memiliki potensi sebagai agens pengendalian hayati terhadap S. rolfsii dengan nilai penghambatan sebesar 91.73% pada inkubasi minggu ketiga. Secara umum baik media serbuk gergaji maupun media dedak keduanya memiliki potensi dijadikan media tumbuh aktinomiset APS 7. Komposisi bahan pada media serbuk gergaji yang terdiri dari 45% serbuk gergaji, 44.3% ampas tahu, 2.7% kapur pertanian, 5% glukosa, 2.5% susu skim, dan 0.5% tepung limbah udang mampu mendukung pertumbuhan aktinomiset dengan nilai rata-rata populasi tertinggi sebesar 335106 cfu/g pada masa inkubasi minggu kedelapan. Begitu pula pada media dedak dengan komposisi bahan yang terdiri dari 45% dedak, 38.5% ampas tahu, 8.5% kapur pertanian, 5% glukosa, 2.5% susu skim, dan 0.5% tepung limbah udang juga mampu mendukung pertumbuhan aktinomiset dengan nilai rata-rata populasi sebesar 331106 cfu/g pada masa inkubasi minggu kedelapan.
KAJIAN AKTINOMISET SEBAGAI AGENS HAYATI UNTUK
PENGENDALIAN Sclerotium rolfsii DAN PEMBIAKANNYA
PADA MEDIA LIMBAH ORGANIK PADAT
NURUL WIDYANTI
A34070028
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian di Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
RIWAYAT HIDUP
Penulis bernama lengkap Nurul Widyanti, dilahirkan di Bekasi pada tanggal 7 Oktober 1989. Penulis merupakan anak bungsu dari dua bersaudara pasangan M. Abudin dan Elis Kurniasih. Penulis menyelesaikan pendidikan sekolah menengah atas di SMA PGRI 1 Bekasi (2004-2007).
Pada tahun 2007 penulis melanjutkan pendidikannya di Institut Pertanian Bogor (IPB) melalui jalur Undangan Seleksi Masuk IPB pada kurikulum berbasis mayor-minor. Penulis diterima sebagai mahasiswa Departemen Proteksi Tanaman, Fakultas Pertanian, IPB, dan mengikuti masa Tingkat Persiapan Bersama selama 1 tahun. Pada tahun berikutnya penulis melanjutkan pendidikannya dengan Mayor Proteksi Tanaman, Fakultas Pertanian, dan Minor Perlindungan Tanaman, Departemen Silvikultur, Fakultas Kehutanan, IPB.
Selama mengikuti perkuliahan, penulis telah menjadi asisten mata kuliah Hama dan Penyakit Tanaman Tahunan, Entomologi Umum dan Biologi Cendawan. Penulis juga aktif dalam beberapa organisasi yang berada di IPB antara lain pada tahun 2007-2008 penulis aktif di Ikatan Keluarga Mahasiswa Bekasi IPB (Kemsi-IPB). Pada tahun 2008-2009 penulis bergabung dalam Himpunan Mahasiswa Proteksi Tanaman (HIMASITA) sebagai bendahara Divisi Pengembangan Sumber Daya Manusia (PSDM). Penulis juga aktif dalam beberapa club mitra HIMASITA yakni sebagai anggota di Organic Farming Club
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Allah SWT karena berkat rahmat, hidayah serta kasih sayang Nya penulis dapat menyelesaikan skripsi yang berjudul “Kajian Aktinomiset Sebagai Agens Hayati untuk Pengendalian
Sclerotium rolfsii dan Pembiakannya pada Media Limbah Organik Padat”. Penelitian dan penulisan skripsi ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Pertanian di Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor. Penelitian dilaksanakan di Laboratorium Bakteriologi Tumbuhan, Departemen Proteksi Tanaman dari bulan Maret 2011 sampai Oktober 2011.
Ucapan terima kasih penulis sampaikan kepada:
1. Dr. Ir. Giyanto, M.Si. selaku dosen pembimbing yang telah memberikan banyak ilmu, pengetahuan, saran, dan motivasi.
2. Dr. Ir. Ruly Anwar, M.Si. selaku dosen penguji tamu yang telah memberikan saran dan motivasi.
3. Prof. Dr. Dadang, M.Sc. selaku dosen pembimbing akademik yang telah memberikan saran dan arahan.
4. Kedua orang tua dan kakak (Eko Budi Aji dan Darmawati) yang selalu memberikan dukungan dan motivasi.
5. Mushthofa Amd yang selalu sabar dan memberi motivasi setiap waktu.
6. Sahabat yang selalu ada dalam suka dan duka, Kurniatus Ziyadah S.P, Irma Utami Siagian S.P, dan Rahmah Waty.
7. Teman-teman seperjuangan yang bekerja di Laboratorium Bakteriologi Tumbuhan yakni Dr. Ir. Rustam M.Si., Ir. Haliatur M.Si, Adelia M.Si, Prasetyo M.Si, Ratdiana M.Si, Tita Wijayanti M.Si, Nur izza S.P, Yana S.P, Zenita Vinda S.P, Ida Parida S.P, Tatit dan Yayu.
8. Teman-teman Wisma Cantik yakni Emy, Ira, Rara, Laras, Oji, Arini, Ade, Ayu, dan Riska
9. Rasa terima kasih penulis sampaikan juga kepada seluruh mahasiswa Departemen Proteksi Tanaman, khususnya angkatan 44 atas semangat yang selalu berkobar.
Penulis menyadari bahwa dalam skripsi ini masih terdapat banyak kekurangan untuk itu penulis mengharapkan kritik dan saran yang membangun. Semoga skripsi ini dapat bermanfaat bagi perkembangan ilmu pengetahuan.
Bogor, Januari 2012
DAFTAR ISI
Halaman
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... ix
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan Penelitian ... 3
Manfaat Penelitian ... 3
TINJAUAN PUSTAKA ... 4
Sclerotium rolfsii ... 4
Pengendalian Hayati ... 5
Aktinomiset ... 5
Limbah Organik ... 6
Serbuk Gergaji ··· 6
Dedak ··· 7
Ampas Tahu ··· 8
Tepung Limbah Udang ··· 9
BAHAN DAN METODE ... 10
Tempat dan Waktu ... 10
Bahan ... 10
Peremajaan Aktinomiset dari Kultur Penyimpanan ... 10
Perbanyakan Sclerotium rolfsii dari Kultur Penyimpanan ... 10
Uji in vitro Penghambatan Sclerotium rolfsii oleh Aktinomiset ... 11
Pembiakan Populasi Aktinomiset pada Media Limbah Organik ... 12
Persiapan Media Limbah Organik ... 12
Pembuatan Media Limbah Oganik ··· 12
Pembiakan Aktinomiset ··· 13
Penghitungan Populasi Aktinomiset pada Media Limbah Organik ··· 14
Analisis Data ... 14
HASIL DAN PEMBAHASAN ... 15
Isolat Aktinomiset ... 15
Uji in vitro Penghambatan Sclerotium rolfsii oleh Aktinomiset ... 16
Penghitungan Populasi Aktinomiset pada Media Limbah Organik ... 18
KESIMPULAN DAN SARAN ... 22
Kesimpulan ... 22
Saran ... 22
DAFTAR PUSTAKA ... 23
DAFTAR TABEL
Halaman 1 Komposisi bahan media serbuk gergaji ... 13 2 Komposisi bahan media dedak ... 13 3 Persentase penghambatan senyawa bioaktif APS 7, APS 9, APS 12,
dan ATS 5 terhadap Sclerotium rolfsii ... ... ... 17 4 Rata-rata koloni aktinomiset APS 7 pada media serbuk gergaji dan
DAFTAR GAMBAR
Halaman 1 Koloni aktinomiset pada media agar WYE, APS 7 (A), APS 9
(B), APS 12 (C), dan ATS 5 (D) ... 15 2 Variasi aktivitas penghambatan pertumbuhan miselium S. rolfsii
oleh senyawa bioaktif aktinomiset APS 7 (A), APS 9 (B), APS
12 (C), ATS 5 (D), dan kontrol (E) ... 17 3 Perkembangan populasi aktinomiset APS 7 pada media serbuk
gergaji dan dedak dengan masa inkubasi dari minggu ke nol
DAFTAR LAMPIRAN
Halaman 1 Hasil analisis ragam penghitungan populasi aktinomiset pada
media limbah organik minggu ke-0 ... 28 2 Hasil analisis ragam penghitungan populasi aktinomiset pada
media limbah organik minggu ke-2 ... 28 3 Hasil analisis ragam penghitungan populasi aktinomiset pada
media limbah organik minggu ke-4 ... 28 4 Hasil analisis ragam penghitungan populasi aktinomiset pada
media limbah organik minggu ke-6 ... 28 5 Hasil analisis ragam penghitungan populasi aktinomiset pada
media limbah organik minggu ke-8 ... 29 6 Media tumbuh aktinomiset, pada media dedak (kiri) dan
PENDAHULUAN
Latar Belakang
Budi daya tanaman merupakan kegiatan yang kerap dilakukan untuk memenuhi kebutuhan pangan dan pakan. Pada proses budi daya kadang kala terdapat hambatan berupa serangan organisme pengganggu tanaman (OPT).
Sclerotium rolfsii merupakan salah satu jenis OPT yang memiliki kisaran inang luas. Kurang lebih 500 spesies inang seperti kubis, bawang merah, kacang hijau, kacang tanah, tomat, dan timun dapat diserang oleh patogen ini. Inang yang terserang akan mengalami rebah kecambah, busuk pangkal batang dan busuk akar sehingga proses fisiologi tanaman terganggu. Pada tanaman dewasa gejala yang ditimbulkan berupa bercak kuning hingga kemerahan pada pangkal batang dan menghasilkan sklerotium yang mampu bertahan hidup selama setahun di dalam tanah (Agrios 2005). Sebagaimana pengendalian pada patogen tular tanah lainnya, pengendalian S. rolfsii meliputi upaya memusnahkan inokulum cendawan seperti pembuangan sisa tanaman, solarisasi, rotasi tanaman, dan penggunaan fungisida. Pengendalian dengan rotasi tanaman memiliki kesulitan karena kisaran inang yang luas. Penggunaan fungisida sintetis yang kurang bijaksana dapat meningkatkan ketahanan patogen dan mengakibatkan peningkatan residu pada produk hasil.
2
tanaman (Barreto et al. 2008). Berbagai pengujian aktinomiset telah banyak dilakukan terhadap biji, bibit, dan media tanam untuk menekan perkembangan patogen rebah kecambah dan patogen tular tanah lainnya (Lahdenpera 2000). Beberapa isolat aktinomiset seperti Streptomyces sp. mampu menghambat pertumbuhan patogen Ralstonia solanacearum pada tanaman pangan (Akhdiya & Susilowati 2008), Xanthomonas oryzae pv. oryzae pada padi (Putra 2011), dan
Sclerotium rolfsii pada buncis (Reddy 2010).
Terlepas dari semua potensi yang dimiliki oleh aktinomiset, pembiakan aktinomiset secara massal memiliki hambatan tersendiri. Media pembiakan aktinomiset yang terdapat di Laboratorium harus diperoleh dengan harga yang cukup mahal. Jika media tersebut digunakan untuk pembiakan aktinomiset secara massal, maka akan membutuhkan biaya produksi yang tinggi. Oleh karena itu, diperlukan media alternatif yang bernilai ekonomis. Media tumbuh yang berasal dari alam dapat dijadikan alternatif pembiakan aktinomiset. Media tumbuh alternatif agens hayati dalam bentuk formulasi dengan bahan dasar limbah organik telah banyak diteliti dan diproduksi secara massal. Seperti penelitian yang telah dilakukan oleh Rismawan (2011) dan Ratdiana (2007) dengan membuat formulasi media berasal dari limbah organik cair dan limbah cair ternak untuk media pembiakan Pseudomonas fluorescens. Beberapa perusahaan yang bergerak dalam bidang pestisida kini telah banyak memproduksi biopestisida berbahan dasar mikroba antagonis seperti Mycostop merupakan produk biokotrol berbahan dasar
Streptomyces griseoviridis dan Actino-iron berasal dari Streptomyces lydicus
(Lahdenpera 2006).
3
Tujuan Penelitian
Penelitian ini bertujuan mengkaji kemampuan isolat aktinomiset dalam menekan pertumbuhan S. rolfsii serta melihat pertumbuhannya dalam media alternatif berbahan dasar limbah organik serbuk gergaji dan dedak.
Manfaat Penelitian
TINJAUAN PUSTAKA
Sclerotium rolfsii
Sclerotium rolfsii merupakan patogen penyebab penyakit busuk pangkal batang yang pada umumnya terdapat pada tanaman persemaian namun juga dapat menyerang tanaman dewasa. Cendawan ini bersifat polifag sehingga kisaran inangnya sangat luas antara 200-500 spesies. Beberapa tanaman yang kerap diserang patogen ini adalah kedelai, kacang tanah, tembakau, cabai, dan terong (Punja & Rahe 2011). Infeksi patogen ini menyebabkan kehilangan hasil hingga 32.3% (Fichtner 2006). Patogen pada umumnya berada pada daerah tropik beriklim panas namun lembab dengan suhu sekitar 20-30 ⁰C. Pada daerah subtropik cendawan ini dapat membentuk spora seksual berupa basidiospora yakni Corticium rolfsii dan Pellicularia rolfsii (Ferreira & Boley 2000). Proses pemencaran dan pertahanan diri dengan membentuk struktur yang dapat bertahan hidup selama setahun di dalam tanah (disebut sklerotium). Sklerotium berbentuk bulat (tidak beraturan) dengan ukuran diameter 0.5-2.0 µm dan pada umumnya tampak berwarna putih namun berkembang cepat menjadi kecoklatan (Semangun 1993).
Gejala awal pada tanaman yang terserang S. rolfsii berupa nekrosis dan kelayuan pada daun. Gejala berikutnya terlihat kumpulan hifa berwarna putih pada jaringan yang terinfeksi dan dapat menimbulkan kebusukan pada pangkal batang. Selain menyebabkan busuk pada pangkal batang, Wahyuni & Wiwiek (1979) melaporkan bahwa patogen ini dapat menyebabkan busuk akar rimpang kunyit di pembibitan.
Pengendalian patogen ini dapat dilakukan secara mekanik, fisik, kultur teknis, kimiawi dan hayati. Sclerotium rolfsii pada umumnya sulit untuk dilakukan pengendalian secara kultur teknis dan kimiawi karena memiliki kisaran inang yang luas. Pada pengendalian secara hayati, beberapa mikroorganisme seperti cendawan Trichoderma harzianum (Tindaon 2008), Pseudomonas flourescens (Rismawan 2011), Bacillus subtilis, Gliocladium virens, Penicillium
5
Pengendalian Hayati
Pengendalian hayati adalah pengurangan jumlah inokulum atau kegiatan patogen dalam menyebabkan suatu penyakit oleh satu atau lebih organisme antagonis selain manusia baik secara aktif maupun manipulasi lingkungan dan inang (Baker & Cook 1974). Pengendalian hayati bersifat ekologis dan berkelanjutan. Ekologis berarti pengendalian hayati harus dilakukan melalui pengelolaan ekosistem pertanian secara efisien dengan sedikit mungkin mendatangkan efek samping negatif bagi lingkungan hidup. Berkelanjutan dapat diartikan sebagai kemampuan agens hayati untuk bertahan dan menjaga agar upaya pengendalian tidak merosot atau terus berlangsung (Basukriadi2003).
Menurut Istikorini (2002), pengendalian hayati yang bersifat ekologis dan berkelanjutan mengacu pada bentuk pertanian dengan mengoptimalkan pemanfaatan sumber daya yang ada. Pemanfaatan mikroorganisme antagonis dapat menjaga keseimbangan ekologi karena sumber daya tersebut dikembalikan lagi ke alam sehingga kualitas lingkungan terutama tanah dapat dipertahankan.
Contoh mikroorganisme antagonis yang digunakan untuk pengendalian hayati yakni Pseudomonas fluorescens untuk mengendalikan Ralstonia solanacearum pada tanaman cabai (Ratdiana 2007). Trichoderma harzianum
mempunyai kemampuan menekan patogen penyebab busuk umbi dan hawar daun pada tanaman kentang Phythopthora infestan (Purwantisari et al. 2008).
Gliocladium sp. mampu mengendalikan Rhizoctonia solani pada tanaman jagung (Syatrawati 2005) dan menekan pertumbuhan jamur akar putih pada tanaman karet (Silalahi & Suriadi 2008). Pemanfaatan Streptomyces spp. dapat menekan serangan Fusarium oxysporum pada tanaman pisang (Sudarma 2010). Pengendalian dengan menggunakan musuh alami merupakan langkah yang tepat guna menunjang pertanian yang ramah lingkungan.
Aktinomiset
6
menunjukkan konsistensi berdebu dan melekat erat pada permukaan agar (Rao 1994 dalam Puryantiningsih 2009). Beberapa aktinomiset mampu menghasilkan beragam senyawa yang dapat berfungsi sebagai antimikroba dan memacu pertumbuhan pada tanaman. Berbagai senyawa antimikrob yang dihasilkan oleh aktiomiset, khususnya Streptomyces spp. berupa tetrasiklin, streptomisin, eritromisin, kloramfenikol, ivermektin, dan rifampisin (Todar 2008).
Aktinomiset juga mampu mensintesis banyak senyawa bioaktif berupa antibiotik, pestisida, antiseptik, selulase, dan xylanase (Oskay et al. 2004). Kemampuan aktinomiset menghasilkan antibiotik dan antimikrob dapat dibuktikan dengan adanya penelitian yang dilaporkan oleh Crawford (1993) yang menyatakan bahwa aktinomiset yang berasal dari rizosfer dan non rizosfer dapat bersifat antagonis pada tanaman selada yang terserang oleh patogen akar
Pythium ultimo. Penelitian lain dapat membuktikan bahwa isolat aktinomiset seperti Streptomyces sp. mampu menghambat pertumbuhan patogen Bacillus sp. dan Pyricularia oryzae pada tanaman padi (Prabavathy et al. 2006) serta menghambat perkecambahan uredospora Phakopsora Pachirizi pada tanaman kedelai (Kurniawan 2003).
Selain dapat menghasilkan senyawa aktif, aktinomiset juga dapat berperan sebagai pemicu pertumbuhan tanaman seperti penelitian yang telah dilakukan oleh Patil et al. (2011) bahwa aktinomiset mampu memicu pertumbuhan tanaman tomat dan menginduksi senyawa fenolat untuk menambah daya tahan terhadap serangan Rhizoctonia solani. Khamna et al. (2010) melaporkan Streptomyces viridis mampu meningkatkan perkecambahan dan panjang akar tanaman jagung serta memperbanyak polong pada tanaman kacang melalui dihasilkannya IAA.
Limbah Organik Serbuk Gergaji
7
2008). Limbah ini terdiri dari kulit kayu, potongan kayu dan serbuk hasil gergajian. Limbah berupa potongan kayu telah dimanfaatkan sebagai inti papan blok dan bahan baku papan partikel. Sedangkan limbah berupa serbuk kayu pemanfaatannya hanya digunakan sebagai bahan bakar tungku (dibakar begitu saja) tanpa penggunaan yang berarti atau dibiarkan menumpuk sehingga dapat menyebabkan pencemaran (Febrianto 1999).
Untuk mengurangi tingkat pencemaran, maka pemanfaatan serbuk gergaji harus dilakukan lebih optimal agar mempunyai nilai ekonomi. Kandungan nutrisi dan mineral yang terdapat di dalam 100 g serbuk gergaji yakni 35,3 g serat kasar, 31 g selulosa, 30,9 g lignin, 0.9 g protein kasar, dan 1.9 g lemak kasar (Suriawiria & Unus 2006). Beberapa pemanfaatan serbuk gergaji yang telah dilakukan berupa penggunaan serpihan dan potongan kayu untuk dijadikan arang (Amin 2000) dan media tanam jamur tiram (Sariyono 2008).
Masih banyak limbah serbuk gergaji yang belum dimanfaatkan secara maksimal. Oleh karena itu, pencarian alternatif untuk membuat limbah serbuk gergaji kayu lebih bermanfaat masih dilakukan. Salah satunya digunakan untuk media pembiakan massal aktinomiset. Aktinomiset seperti bakteri pada umumnya, membutuhkan sumber karbon (C), nitrogen (N), dan fosfat (P) untuk menunjang pertumbuhannya (Pelczar & Chan 2007). Zat-zat (karbohidrat dan lignin) yang terkandung di dalam serbuk gergaji dibutuhkan oleh aktinomiset untuk tumbuh. Aktinomiset memiliki kemampuan mendegradasi bahan organik seperti selolusa dan lignin (Xu et al. 1996).
Dedak
8
1999). Penggilingan satu ton gabah menghasilkan dedak sebanyak 60-80 kg (Goffman et al. 2003).
Dedak mengandung asam lemak tak jenuh esensial dan bermacam-macam vitamin (B1, B2, B3, B5, dan B6) serta mineral. Disamping zat gizi, dedak juga mengandung komponen bioaktif seperti antioksidan (tokoferol, tokotrienol, dan oryzanol) dan asam pangamik. Kandungan nutrisi yang terdapat di dalam 100 g dedak adalah 70 g karbohidrat, 12 g lemak, dan 16 g protein serta terdapat 0.2 g vitamin B15 (Blair 2008).
Berdasarkan kandungan nutrisi yang terdapat di dalam dedak, banyak peternak menggunakan dedak sebagai pakan untuk unggas. Selain sebagai pakan ternak, dedak berpotensi sebagai bahan pangan karena mengandung pati dan minyak. Pada proses pembiakan aktinomiset dedak dapat dijadikan sebagai sumber karbon (C), nitrogen (N), vitamin B1, dan B2.
Ampas Tahu
Tahu merupakan makanan tradisional sebagian besar masyarakat di Indonesia. Bahan utama pembuatan tahu adalah kacang kedelai (Glycine max).
Industri tahu dalam proses pengolahannya menghasilkan limbah, baik limbah padat maupun cair. Limbah padat yang lebih dikenal sebagai ampas tahu merupakan limbah padatan yang memiliki jumlah protein bervariasi tergantung pada proses pembuatannya.
Pembuatan tahu secara tradisional menghasilkan ampas tahu dengan protein yang lebih tinggi dibandingkan dengan pengolahan secara modern (Winarno & Fardiaz 1985). Kandungan nutrisi dan mineral yang terdapat di dalam 100 g ampas tahu yakni 17.4 g karbohidrat, 67.5 g protein, 10.6 g lemak, dan 4.499 g mineral (Sulistiani 2004).
9
kandungan nutrisi dan mineral yang terdapat pada ampas tahu maka bahan ini dapat dijadikan bahan tambahan dalam pembuatan media tumbuh aktinomiset.
Tepung Limbah Udang
Indonesia termasuk salah satu negara pengekspor udang terbesar di dunia. Data BPS (2009) menunjukkan produksi udang Indonesia sebesar 294.000 ton pada tahun 2008 dan produksi ini meningkat sebesar 25% per tahun. Apabila udang segar ini diolah menjadi udang beku, maka sebesar 35%-70% dari bobot utuh akan menjadi limbah udang (Mahata 2007). Limbah udang di Indonesia umumnya terdiri atas bagian kepala, ekor, dan cangkang udang serta udang yang rusak (Mirzah 1997).
BAHAN DAN METODE
Tempat dan Waktu
Penelitian dilaksanakan di Laboratorium Bakteriologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor (IPB) mulai Maret 2011 sampai Oktober 2011.
Bahan
Bahan yang digunakan adalah serbuk gergaji, dedak, ampas tahu, tepung limbah udang, kapur pertanian, susu skim, glukosa, media agar WYE (Water-yeast extract), media PDA (Potato Dextrose Agar), isolat aktinomiset APS 7, APS 9, APS 12, ATS 5, dan biakaan cendawan Sclerotium rolfsii.
Peremajaan Aktinomiset dari Kultur Penyimpanan
Isolat murni aktinomiset didapatkan dari Laboratorium Bakteriologi Tumbuhan Proteksi Tanaman. Isolat aktinomiset APS 7, APS 9, dan APS 12 berasal dari tanah bagian top soil sekitar perakaran sawit (Putra 2011) sedangkan aktinomiset ATS 5 berasal dari tanah persawahan (Himmah 2012). Perbanyakan isolat murni dilakukan dengan menumbuhkan inokulum pada media agar WYE (0.25 g yeast extract, 0.5 g K2HPO4, 18 g agar, dan 1 L aquades) (Crawford et al.
1993) dan diinkubasi pada suhu ruang 28 ⁰C selama 7-14 hari. Pertumbuhan isolat berhasil jika terdapat koloni aktinomiset yang tumbuh dan mengeluarkan spora seperti berdebu (merupakan eksospora yang terbentuk), mengandung pigmen tertentu, dan berbau khas tanah.
Perbanyakan Sclerotium rolfsii dari Kultur Penyimpanan
11
sklerotium, ini digunakan sebagai struktur bertahan pada kondisi lingkungan yang tidak mendukung.
Uji in vitro Penghambatan Sclerotium rolfsii oleh Aktinomiset
Pengujian antagonis aktinomiset menggunakan metode peracunan media tumbuh S. rolfsii. Media yang digunakan adalah PDA yang telah disterilisasi pada suhu 121 ⁰C selama 15 menit. Masing-masing aktinomiset berumur 14 hari sebanyak satu ose diinokulasikan ke dalam 15 ml media cair WYE ( 0.25 g yeast extract, 0.5 g K2HPO4, dan 1 L aquades) (Crawford et al. 1993) dan diinkubasi
pada inkubator bergoyang dengan kecepatan 100 rpm selama 7, 14, 21 dan 28 hari. WYE cair yang mengandung biakan aktinomiset, masing-masing sebanyak 1 ml dimasukkan ke dalam tabung ependorff lalu sentrifugasi dengan kecepatan 12.000 rpm selama 10 menit hingga didapatkan supernatan yang mengandung senyawa bioaktif aktinomiset.
Supernatan dimasukkan ke dalam erlenmayer steril 200 ml dan dipanaskan pada inkubator pemanas dengan suhu 65 ⁰C selama 30 menit. Selanjutnya didiamkan pada suhu ruang selama 60 menit lalu dipanaskan kembali selama 30 menit dengan suhu yang sama, hal ini bertujuan untuk mematikan sel vegetatif aktinomiset. Cairan yang mengandung senyawa bioaktif dicampurkan ke dalam media PDA yang telah dicairkan (suhu 50 ⁰C). Media PDA yang telah tercampur oleh senyawa bioaktif aktinomiset kemudian dimasukkan ke dalam cawan petri (diameter 9 cm). Setelah itu, pada pusat cawan petri diinokulasikan bulatan koloni
S. rolfsii (diameter 0.5 cm) berumur 7 haripada masing-masing perlakuan. Media biakan lalu diinkubasi selama 3 hari pada suhu ruang 28 ⁰C. Percobaan dilakukan sebanyak dua kali ulangan.
Pengamatan dilakukan terhadap pertumbuhan miselium pada setiap perlakuan. Persen penghambatan pertumbuhan S. rolfsii dihitung dengan persamaan:
Daya hambat (%) = Dk−Dp
Dk
100%
Keterangan:
12
Aktinomiset yang memiliki keefektifan tertinggi dalam menekan pertumbuhan
S. rolfsii digunakan sebagai pengujian pembiakan pada media limbah organik. Isolat yang terseleksi kemudian dilakukan perbanyakan.
Pembiakan Aktinomiset pada Media Limbah Organik Persiapan Media Limbah Organik
Bahan yang digunakan sebagai komposisi utama terdiri dari serbuk gergaji dan dedak. Serbuk gergaji berasal dari limbahvpabrik penggergajian yang merupakan jenis kayu kihiyang (Albizzia procerra) sedangkan dedak didapatkan dari toko pertanian. Serbuk gergaji dan dedak disaring guna mendapatkan bagian yang lebih halus dan dijemur agar terhindar dari serangan mikroorganisme gudang. Bahan tambahan untuk menunjang nutrisi terdiri dari ampas tahu, tepung limbah udang, kapur pertanian, glukosa, dan susu skim. Ampas tahu diperoleh dari pabrik pengolahan tahu yang terletak di daerah Cibanteng, Bogor. Ampas tahu diperas dengan saringan kain dan dijemur hingga kering kemudian dihaluskan menggunakan blender hingga menjadi tepung. Sedangkan tepung limbah udang berasal dari limbah udang yang terdiri dari kepala, ekor dan cangkang udang yang dijemur dan dikeringkan dengan oven lalu dihaluskan hingga menjadi tepung.
Pembuatan Media Limbah Oganik
13
Tabel 1 Komposisi bahan media serbuk gergaji
Bahan Komposisi bahan (g) Komposisi bahan (%) Serbuk gergaji 90.0 45.0
Ampas tahu 88.6 44.3 Kapur pertanian 5.4 2.7 Glukosa 10.0 5.0 Susu skim 5.0 2.5 Tepung limbah udang 1.0 0.5
Tabel 2 Komposisi bahan media dedak
Bahan Komposisi bahan (g) Komposisi bahan (%) Dedak 90.0 45.0
Ampas tahu 77.0 38.5 Kapur pertanian 17.0 8.5 Glukosa 10.0 5.0 Susu skim 5.0 2.5 Tepung limbah udang 1.0 0.5
Media tumbuh serbuk gergaji dan dedak kemudian disterilisasi pada suhu 120 ⁰C selama 15 menit untuk mengindari terjadinya kontaminasi. Media tumbuh disimpan pada suhu 28 ⁰C selama 24 jam sebelum diinokulasikan dengan biakan aktinomiset.
Pembiakan Aktinomiset
14
Penghitungan Populasi Aktinomiset pada Media Limbah Organik
Penghitungan populasi aktinomiset dilakukan dengan metode pengenceran berkala (100, 10-1, 10-2, 10-3, 10-4, dan 10-5) pada media tumbuh yang telah diinkubasi selama 0, 2, 4, 6, dan 8 minggu. Metode pengenceran dilakukan dengan memasukkan 1 g media limbah organik ke dalam tabung reaksi berisi 10 ml air steril sebagai pengenceran 100, Kemudian diambil sebanyak 1 ml larutan dari tabung pengenceran 100 dan dimasukkan ke dalam tabung reaksi berisi 9 ml air steril sebagai pengenceran 10-1 lalu pengenceran dilakukan pada tabung berikutnya. Setiap pengenceran 10-3, 10-4, dan 10-5 diambil masing-masing sebanyak 0.1 ml untuk disebar secara merata pada media agar WYE menggunakan glass bead. Setelah itu diinkubasi selama 3-7 hari untuk menghitung populasi koloni aktinomiset. Indikator adanya koloni aktinomiset yakni terdapat koloni tunggal berukuran 1-10 mm yang memiliki filamen berdebu seperti miselium dan berbau khas tanah. Data diambil berdasarkan penghitungan koloni yang terdapat pada media agar WYE, koloni dihitung menggunakan metode plate count berlatarbelakang hitam dengan kisaran 30-300 koloni/cawan menggunakan alat Handy Tally Counter (Hadioetomo 1990). Populasi aktinomiset APS 7 pada media limbah organik dihitung dengan persamaan:
Populasi bakteri= X V
p r g
Keterangan:
X = rataan koloni aktinomiset dengan faktor pengenceran ke- (cfu/ml) V = volume pengenceran media (ml)
p = faktor pengenceran ke-
r = volume suspensi yang disebar pada cawan (ml) g = bobot media yang digunakan (g).
Analisis Data
HASIL DAN PEMBAHASAN
Isolat Aktinomiset
Pada permukaan agar aktinomiset dapat dibedakan dengan mudah dari bakteri non aktinomiset (Rao 1994 dalam Puryantiningsih 2009). Aktinomiset merupakan bakteri Gram positif yang memiliki struktur berupa filamen lembut seperti hifa atau miselia (Madigan et al. 2006).
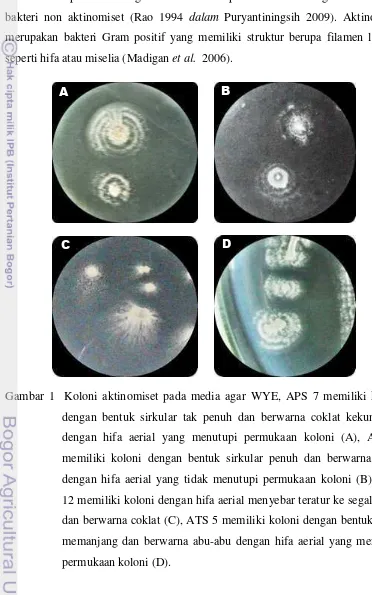
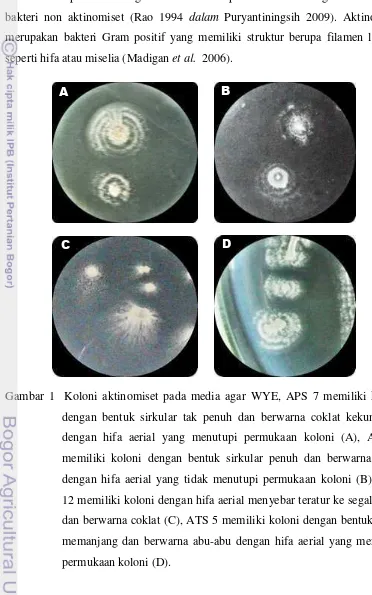
Gambar 1 Koloni aktinomiset pada media agar WYE, APS 7 memiliki koloni dengan bentuk sirkular tak penuh dan berwarna coklat kekuningan dengan hifa aerial yang menutupi permukaan koloni (A), APS 9 memiliki koloni dengan bentuk sirkular penuh dan berwarna putih dengan hifa aerial yang tidak menutupi permukaan koloni (B), APS 12 memiliki koloni dengan hifa aerial menyebar teratur ke segala arah dan berwarna coklat (C), ATS 5 memiliki koloni dengan bentuk pipih memanjang dan berwarna abu-abu dengan hifa aerial yang menutupi permukaan koloni (D).
A B
16
Pertumbuhan aktinomiset pada media agar khususnya media agar WYE menampakan karakter morfologi yang berbeda-beda pada tiap jenisnya (Gambar 1). Pertumbuhan aktinomiset pada permukaan agar sangat lambat. Mula-mula permukaan agar relatif licin kemudian membentuk tenunan hifa udara yang menunjukan konsistensi berdebu. Koloni aktinomiset melekat erat pada permukaan agar menghasilkan berbagai pigmen yang menimbulkan warna pada miselium vegetatif, miselium udara dan substrat (Schaad et al. 2000). Hal ini menunjukan bahwa aktinomiset menghasilkan eksospora berupa rantai spora (disebut konidia), yang hanya dimiliki oleh genus aktinomiset dari semua golongan bakteri. Isolat aktinomiset APS 7, APS 9, dan APS 12 merupakan isolat yang berasal dari tanah bagian top soil sekitar perakaran sawit (Putra 2011) sedangkan aktinomiset ATS 5 merupakan isolat yang berasal dari tanah persawahan (Himmah 2012).
Uji in vitro Penghambatan Sclerotium rolfsii oleh Aktinomiset
Uji kemampuan aktinomiset menghambat pertumbuhan miselium S. rolfsii
dilakukan pada media PDA yang telah diberi larutan senyawa bioaktif aktinomiset. Berbagai penelitian membuktikan bahwa aktinomiset mampu menghambat pertumbuhan berbagai patogen. Isolat Streptomyces sp. dibuktikan mampu menekan pertumbuhan Pythium ultimo pada tanaman selada (Crawford et al. 1993) dan Streptomyces nigrifaciens juga mampu menghambat pertumbuhan S. rolfsii pada tanaman buncis (Reddy 2010).
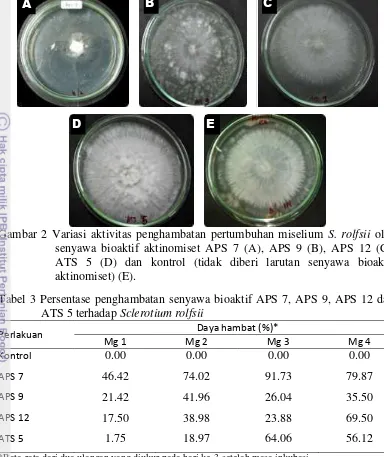
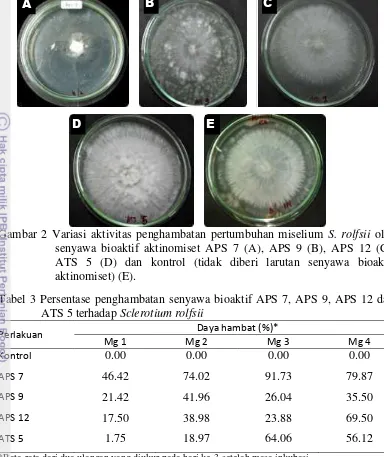
Pengaruh senyawa bioaktif aktinomiset terhadap pertumbuhan miselium cendawan S. rolfsii menunjukkan hasil yang bervariasi jika dibandingkan dengan kontrol (Gambar 2). Kemampuan daya hambat isolat aktinomiset terhadap pertumbuhan miselium cendawan S. rolfsii merupakan suatu akibat adanya aktivitas antimikroba yang dimiliki oleh aktinomiset.
17
Gambar 2 Variasi aktivitas penghambatan pertumbuhan miselium S. rolfsii oleh senyawa bioaktif aktinomiset APS 7 (A), APS 9 (B), APS 12 (C), ATS 5 (D) dan kontrol (tidak diberi larutan senyawa bioaktif aktinomiset) (E).
Tabel 3 Persentase penghambatan senyawa bioaktif APS 7, APS 9, APS 12 dan ATS 5 terhadap Sclerotium rolfsii
Perlakuan Daya hambat (%)*
Mg 1 Mg 2 Mg 3 Mg 4
Kontrol 0.00 0.00 0.00 0.00
APS 7 46.42 74.02 91.73 79.87
APS 9 21.42 41.96 26.04 35.50
APS 12 17.50 38.98 23.88 69.50
ATS 5 1.75 18.97 64.06 56.12
*Rata-rata dari dua ulangan yang diukur pada hari ke-3 setelah masa inkubasi. Mg = minggu.
Dari keempat isolat aktinomiset yang digunakan untuk pengujian antagonis terhadap cendawan hanya APS 7 yang memiliki daya hambat tertinggi pada pertumbuhan S. rolfsii (Tabel 3). Daya hambat APS 7 pada minggu pertama inkubasi sebesar 46.42% diikuti dengan nilai APS 9 dan APS 12 masing-masing sebesar 21.42% dan 17.50% sedangkan penghambatan terendah berada pada isolat ATS 5 sebesar 1.75%. Pada inkubasi minggu kedua nilai penghambatan tertinggi berada pada isolat APS 7 sebesar 74.02% sama seperti kondisi minggu sebelumnya isolat APS 9 memiliki nilai lebih tinggi dari pada isolat APS 12 sebesar 26.04% dan penghambatan terendah pada isolat ATS 5 sebesar 38.98%.
A B C
18
Semua isolat yang digunakan mengalami peningkatan kemampuan daya hambat dari minggu sebelumnya.
Pada inkubasi minggu ketiga APS 7 memiliki nilai penghambatan pertumbuhan miselium cendawan tertinggi sebesar 91.73%, kondisi sangat berbeda dari minggu sebelumnya bahwa ATS 5 berada pada nilai tertinggi setelah APS 7 sebesar 64.06%. Isolat APS 7 dan ATS 5 mengalami peningkatan nilai daya hambat sedangkan isolat APS 9 dan APS 12 mengalami penurunan nilai sebesar 26.04% dan 23.88% jika dibandingkan dengan minggu kedua. Peningkatan daya hambat pada masa inkubasi minggu keempat hanya terjadi pada isolat APS 12 dan APS 9 dengan nilai 69.50% dan 35.50%. Kondisi sebaliknya pada isolat APS 7 dan ATS 5 terjadi penurunan nilai sebesar 79.87% dan 56.12%. Walaupun kondisi demikian, isolat APS 7 tetap berada pada nilai tertinggi uji penghambatan pertumbuhan miselium Sclerotium rolfsii. Meningkat dan menurunnya persentase daya hambat setiap masa inkubasi, diduga karena perbedaan isolat aktinomiset mempengaruhi jenis dan efikasi senyawa bioaktif yang dihasilkan.
Penghitungan Populasi Aktinomiset pada Media Limbah Organik
Pembiakan aktinomiset APS 7 pada media tumbuh serbuk gergaji dan dedak menunjukkan adanya kondisi yang fluktuatif pada jumlah populasi (Gambar 3).
Gambar 3 Perkembangan populasi aktinomiset APS 7 pada media serbuk gergaji dan dedak dengan masa inkubasi dari minggu ke nol sampai minggu kedelapan. 6,00 6,50 7,00 7,50 8,00 8,50 9,00
0 2 4 6 8
L o g po pu la si ( cf u/g r m edia )
19
Media yang telah diinokulasikan oleh suspensi aktinomiset dilakukan analisis penghitungan koloni yang tumbuh dengan metode pengenceran berseri yang disertai dengan teknik pencawanan. Penghitungan kepadatan populasi dimulai pada inkubasi minggu ke nol hingga minggu kedelapan. Pengambilan data dilakuakan setiap dua minggu sekali.
Tabel 4 Rata-rata koloni aktinomiset APS 7 pada media serbuk gergaji dan dedak Media Rata-rata koloni aktinomiset (10
6
cfu/g media)* ± SD Mg 0 Mg 2 Mg 4 Mg 6 Mg 8 Serbuk gergaji 7.90a ± 5.28 71.50a ± 19,42 50.20a ± 15.05 148a ± 17.25 335a ± 128.93
Dedak 3.16a ± 1.49 34.75b ± 11.12 28.80a ± 15.72 143.5a ± 34.62 331a ± 206.22 *Angka selajur yang diikut oleh huruf yang sama tidak berbeda nyata berdasarkan uji Duncan pada taraf nyata ()= 5%.
SD = standar deviasi. Mg = minggu inkubasi.
Berdasarkan penghitungan yang telah dilakukkan (Tabel 2), diketahui bahwa terdapat perbedaan jumlah populasi aktinomiset APS 7 pada setiap minggunya. Pertumbuhan aktinomiset pada media serbuk gergaji dan dedak memiliki nilai yang tidak berbeda nyata. Hal ini dapat dikatakan bahwa media serbuk gergaji dan media dedak memiliki potensi yang sama dalam pembiakan aktinomiset. Media serbuk gergaji memiliki nilai log populasi aktinomiset sebesar 6.81 (7.9106 cfu/g media) pada inkubasi minggu ke nol. Peningkatan populasi terjadi dari minggu sebelumnya dengan nilai sebesar 7.84 (71.5106 cfu/g media). Pada masa inkubasi minggu keempat, terjadi penurunan nilai log populasi sebesar 7.68 (50.2106 cfu/g media). Kondisi terus meningkat pada inkubasi minggu keenam sebesar 8.16 (148106 cfu/g media) disusul dengan nilai 8.48 (335106 cfu/g media) pada inkubasi minggu kedelapan.
20
keenam dan kedelapan dengan nilai 8.16 (143.5106 cfu/g media) dan 8.45 (331106 cfu/g media).
Meningkatnya jumlah populasi aktinomiset diduga karena adanya nutrisi pada media kultur yang diperoleh dan digunakan untuk menunjang pertumbuhan aktinomiset. Sedangkan berkurangnya jumlah aktinomiset diduga karena pengurangan aktivitas yang disebabkan oleh adaptasi awal pemindahan bakteri ke medium kultur baru (media limbah organik), berkurangnya sumber hara esensial dan terbentuknya senyawa penghambat pertumbuhan.
Berdasarkan jumlah populasi dan rata-rata koloni aktinomiset pada masing-masing media uji, menunjukkan bahwa aktinomiset mampu beradaptasi dengan baik terhadap media alternatif yang terdiri dari beberapa komponen limbah organik. Perpaduan antara limbah serbuk gergaji/dedak, ampas tahu, tepung limbah udang serta penambahan bahan penunjang lainnya terbukti dapat mendukung pertumbuhan aktinomiset. Bahan penunjang yang digunakan untuk membuat media alternatif seperti glukosa, susu skim dan tepung limbah udang memiliki komposisi jumlah bahan yang sama pada setiap media uji kecuali jumlah ampas tahu dan kapur pertanian. Pada media serbuk gergaji terdapat 44.3% ampas tahu dan 2.7% kapur sedangkan pada media dedak hanya terdapat 38.5% ampas tahu dan 8.5% kapur.
Kandungan nutrisi dan mineral yang terdapat di dalam 100 g serbuk gergaji yakni 35,3 g serat kasar, 31 g selulosa, 30,9 g lignin, 0.9 g protein kasar, dan 1.9 g lemak kasar (Suriawiria & Unus 2006). Berdasarkan kandungan nutrisi yang terdapat di dalam serbuk gergaji, media ini dapat dijadikan bahan utama sumber karbon, fosfor, belerang, dan kalium yang telah tersedia dalam jaringan kayu. Sesuai dengan karakteristik aktinomiset yang mampu mendegradasi selulosa dan lignin di samping fungi, kapang, dan khamir (Xu et al. 1996), maka serbuk gergaji dapat dijadikan media tumbuh karena kandungan selulosa dan lignin yang tinggi.
21
yang cukup tinggi sehingga dapat dimanfaatkan untuk pertumbuhan aktinomiset, karena bila kekurangan protein atau salah satu asam amino esensial akan mengakibatkan penurunan pertumbuhan secara menyeluruh sesuai dengan derajat kekurangannya.
Pembiakan aktinomiset pada media dedak didasarkan pada kandungan nutrisi yang terdapat di dalamnya. Dalam 100 g dedak mengandung 70 g karbohidrat, 12 g lemak, dan 16 g protein serta terdapat 200 mg vitamin B15 (Blair 2008). Media ini menyumbang banyak karbohidrat untuk pertumbuhan aktinomiset dilihat dari jumlah kandungan karbohidrat dalam 100 g dedak. Pemberian kapur pada media berfungsi untuk mengontrol pH, selain itu kapur juga mengandung kalsium, kandungan kalsium dibutuhkan untuk pertumbuhan aktinomiset. Jumlah kapur pada media dedak yang tinggi menandakan bahwa media ini memiliki tingkat derajat keasaman yang tinggi pula. Aktinomiset dapat tumbuh pada pH 6.5-8.0, hal ini menujukkan bahwa bakteri ini hanya dapat hidup pada lingkungan yang memiliki pH netral sampai sedikit basa.
KESIMPULAN DAN SARAN
Kesimpulan
Dari keempat isolat aktinomiset (APS 7, APA 9, APS 12, dan ATS 5) hanya isolat APS 7 yang memiliki potensi sebagai agens pengendalian hayati terhadap Sclerotium rolfsii dengan nilai penghambatan sebesar 91.73% pada inkubasi minggu ketiga. Secara umum baik media serbuk gergaji maupun media dedak keduanya memiliki potensi dijadikan media tumbuh aktinomiset APS 7. Komposisi bahan pada media serbuk gergaji yang terdiri dari 45% serbuk gergaji, 44.3% ampas tahu, 2.7% kapur pertanian, 5% glukosa, 2.5% susu skim, dan 0.5% tepung limbah udang mampu mendukung pertumbuhan aktinomiset dengan nilai rata-rata populasi tertinggi sebesar 335106 cfu/g pada masa inkubasi minggu kedelapan. Begitu pula pada media dedak dengan komposisi bahan yang terdiri dari 45% dedak, 38.5% ampas tahu, 8.5% kapur pertanian, 5% glukosa, 2.5% susu skim, dan 0.5% tepung limbah udang juga mampu mendukung pertumbuhan aktinomiset dengan nilai rata-rata populasi sebesar 331106 cfu/g pada masa inkubasi minggu kedelapan.
Saran
Perlu dilakukan penelitian lanjutan untuk pengujian keefektifan aktinomiset menghambat pertumbuhan Sclerotium rolfsii pada tahap in vivo dan pembiakan aktinomiset pada media tumbuh limbah organik dengan aplikasi dilapangan serta melihat daya simpannya dalam jangka waktu tertentu.
DAFTAR PUSTAKA
Agrios GN. 2005. Plant Pathology. 5th ed. Sandiego: Academic Press.
Akhdiya A, Susilowati DN. 2008. Aktivitas penghambatan bakteriosin dari aktinomiset terhadap bakteri patogen dan patogen tular makanan.
Penelitian Tanaman Pangan 27:1.
Amin S. 2000. Penelitian berbagai jenis kayu limbah pengelolahan untuk pemilihan bahana baku briket arang. Jurnal Sains dan Teknologi Indonesia 2: 41-46.
Baker KF, Cook RJ. 1974. Biological Control of Plant Pathogens. San Francisco: Freeman & Co.
Barreto TR, Silva AC, Soares, Souza JT. 2008. Population densties and genetic diversity of actinomycetes associated to the rhizosphere of Theobroma
cacao. Brazilian Journal of Microbiology 7(39): 464-470.
Basukriadi A. 2003. Pengendalian hayati. http://ebook.ut.ac.id.html [21 Agustus 2011]
Blair R. 2008. Nutrition and Feeding of Organic Poultry. India: Cromwell Press. [BPS] Badan Pusat Statistik. 2009. Statistik Perdagangan Luar Negeri Indonesia. Jakarta: Badan Pusat Statistik.
Crawford DL, James ML, John MW, Margaret AO. 1993. Isolation and characterization of actinomycete antagonis of a fungal root pathogen.
Applied and Environmental Microbiology 59: 3899-3905.
Febrianto.1999. Potensi Pemanfaatan Limbah Kayu. http//www.cybertokoh.com. [24 Januari 2012].
Ferreira SA, Boley RA. 2006. Sclerotium rolfsii. http://www.extento.edu. [4 juni 2011]
Fichtner EJ. 2006. Sclerotium rolfsii Sacc. http://www/cals.ncsu.edu/rolfsii.html. [24 Januari 2012].
Goffman FD, Pinson S, Bergman C. 2003. Genetic diversity for lipid content and fatty acid profile in rice bran. J Am Oil Chem 20 (5): 485-490.
Hadioetomo RS. 1990. Mikrobiologi Dasar dalam Praktek Teknik dan Prosedur Dasar Laboraturium. Jakarta: Gramedia.
Hasegawa S, Akane M, Kazuiro T, Tomio N, Hitoshi K. 2005. Drought tolerance of tissue cultured seedlings of mountain Laurel (Kalmia latifolia L.) induced by an endophitic actinomycete. Actinomycetologica 19: 13-17. Himmah NF. 2012. Seleksi dan indentifikasi aktinomiset sebagai agens hayati
24
Istikorini, Y. 2002. Pengendalian penyakit tumbuhan secara hayati yang ekologis danberkelanjutan.http://rudyct.com/PPS702ipb/05123/yunik_istikorini.htm [15 September 2011].
Khamna S, Yokota A, Peberdy JF, Lumyong S. 2010. Indole-3-acetic acid production by Streptomyces sp. isolated from some Thai medicinal plant rhizosphere soils. EurAsia J BioSci 4: 23-32.
Kurniawan H. 2003. Penampisan Streptomyces spp. penghasil senyawa penghambat pertumbuhan Phakopsora pachyrizi secara in vitro dan in planta [skripsi]. Bogor : Institut Pertanian Bogor.
Lahdenpera ML. 2000. How mycostop acts in the control of fungal plant diseases. Infoletter Verdera 5: 1-2.
Made A, Andi EF. 2010. Potensi Dedak Sebagai Ingredient Pangan. http: //www. jonysipelajar.com. [24 Januari 2012].
Madigan MT, Martinko JM, Parker J. 2006. Biology of Microorganism. New Jersey: Pretince Hall.
Mahata ME. 2007. Perbaikan kualitas gizi limbah udang sebagai pakan unggas melalui hidrolisis enzim kitosanase dan kitinase dari bacterium Serratia marcescens [disertasi]. Padang: Pascasarjana Universitas Andalas.
McCaskill DR, Zhang F. 1999. Use of rice bran oil in foods. Food Technology 53 (2): 50–52
Mirzah. 1997. Pengaruh pengolahan tepung limbah udang dengan tekanan uap panas terhadap kualitas dan pemanfaatannya dalam ransum ayam broiler [disertasi]. Bandung: Pascasarjana Universitas Padjajaran.
Mirzah. 2006. Efek pemanasan limbah udang yang direndam dalam air abu sekam terhadap kandungan nutrisi dan energi metabolis pakan. Jurnal Peternakan 3: 47 – 54
Mustika L, Abidin S, Safitri L, Ramadhan IN. 2008. Pemanfaatan ampas tahu terstandar dalam minuman probiotik [laporan penelitian]. Bogor: Institut Pertanian Bogor.
Nonomura H, Ohara Y. 1969. Distribution of soil actinomycetes-culture method effective for both preferential isolation and enumeration of Microbispora and Streptosporangium strains in soil. Journal of Fermentation Technology 47: 463-469.
Oskay MO, Tamer U, Azeri C. 2004. Antibacterial activity of some actinomycetes isolated from farming soils of Turkey. African Journal of Biotechnology
3 (9): 441-446.
25
Pelczar MJ, Chan ECS. 2007. Dasar-dasar mikrobiologi. Jilid ke-1. Hadioetomo RS, Imas T, Tjitrosomo SS, Angka SL, penerjemah. Jakarta: UI Press. Terjemahan dari: Elements of Microbiology.
Prabavathy VR, Mathviana N, Murugesan K. 2006. Control of blast and shealth blight disease of rice using antifungal metabolites produced by Streptomyces sp. PM5. Biol Cont 39: 313-319.
Priyono. 2001. Potensi Pemanfaatan Limbah Kayu. http//www.cybertokoh.com. [6 Juli 2011].
Pudjiraharti S, Budiwati TA, Iskandar YM. 2000. Studi aplikasi ampas tahu untuk inokulum strain Rhizopus sp. protease tinggi. Prosiding Seminar Tantangan Penelitian Kimia. Bandung.
Punja ZK, Rahe JE. 2011. Methods for Research on Soilbourne Phytopathegenic Fungi. Minnesota: APS Press.
Purwaningsih S. 2000. Teknologi Pembekuan Udang. Jakarta: Penebar Swadaya. Purwantisari S, Fernia RS, Raharjo B. 2008. Pengendalian hayati penyakit lodoh
(busuk umbi kentang) dengan agens hayati jamur-jamur antagonis isolat lokal. Bioma 10 (2): 13-19.
Puryantiningsih RA. 2009. Isolasi Streptomyces dari rizosfer familia poaceae yang berpotensi menghasilkan antibiotik terhadap Escherichia coli
[skripsi]. Surakarta: Universitas Muhammadiyah Surakarta.
Putra MC. 2011. Kompatibilitas Bacillus spp. dan aktinomiset sebagai agens hayati Xanthomonas oryzae pv. oryzae dan pemicu pertumbuhan padi [skripsi]. Bogor: Institut Pertanian Bogor.
Ratdiana. 2007. Kajian pemanfaatan air kelapa dan limbah cair peternakan sebagai media alternatif perbanyakan Pseudomonas fluorescens serta uji potensi antagonismenya terhadap Ralstonia rolfsii [skripsi]. Bogor: Intitut Pertanian Bogor.
Reddy PP. 2010. Fungal Disease and their Managemant in Horticultural Crops. India: Scientific Publisher.
Rismawan AK. 2011. Keefektifan formulasi Pseudomonas fluorescens dalam limbah organik sebagai pestisida hayati dan pemicu pertumbuhan tanaman cabai [skripsi]. Bogor: Institut Pertanian Bogor.
Sariyono Y. 2008. Manfaat Serbuk Gergaji Anek Plantasia.cybermediaclips.html. [3 Oktober 2011].
Schaad NW, Jones JB, Chun W. 2000. Laboratory Guide for Identification of Plant Phatogenic Bacteria. Minnesota: APS Press.
Semangun H. 1993. Penyakit-penyakit Tanaman Pangan di Indonesia. Yogyakarta: UGM Press.
26
Sudarma IM. 2010. Seleksi dan pemanfaatan actinomycetes sebagai mikroba antagonis yang ramah lingkungan terhadap Fusarium oxysporum f.sp.
cubense secara in vitro.Ecotrophic 5 (2): 106.
Sulistiani. 2004. Pemanfaatan ampas tahu sebagai alternatif bahan baku pangan fungsional [skripsi]. Bogor: Institut Pertanian Bogor.
Suriawiria, Unus. 2001. Budidaya Jamur Shiitake. Jakarta: Penebar Swadaya.
Syatrawati. 2005. Parasitisme Gliocladium sp. terhadap Rhizoctonia solani sebagai penyebab penyakit rebah kecambah pada jagung secara in vitro. Prosiding Seminar Ilmiah. Bali.
Tindaon H. 2008. Pengaruh jamur antagonis Trichoderma harzianum dan pupuk organik untuk mengendalikan patogen tular tanah Sclerotium rolsfsii Sacc. Pada tanaman kedelai (Glycine max L.) di rumah kasa [skripsi]. Medan: Universitas Sumatra Utara.
Todar K. 2008. Antimicrobial agents used in treatment of infection disease [research report]. Madison: University of Wisconsin.
Wahyu J. 1992. Ilmu Nutrisi Unggas. Yogyakarta: UGM Press.
Wahyuni S, Wiwiek. 1979. Inventarisasi kelainan pada tanaman obat-obatan terutama yang termasuk famili zingiberaceae [laporan penelitian]. Yogyakarta. Universitas Gadjah Mada.
Winarno FG, Fardiaz. 1985. Biofermentasi dan Biosintesa Protein. Bandung: Angkasa Press.
Xu LH, QR Li, CL Jiang. 1996. Diversity of soil actinomycetes in Yunnan, China.
28
Lampiran 1 Hasil analisis ragam penghitungan populasi aktinomiset pada media limbah organik minggu ke-0
Sumber keragaman Derajat bebas (Db) Jumlah Kuadrat (JK) Kuadrat
Tengah (KT) F-hitung Pr>F Perlakuan 1 56.1690000 56.1690000 3.72 0.0898 Galat 8 120.7320000 15.0915000
Total terkoreksi
9 176.9010000
Lampiran 2 Hasil analisis ragam penghitungan populasi aktinomiset pada media limbah organik minggu ke-2
Sumber keragaman Derajat bebas (Db) Jumlah Kuadrat (JK) Kuadrat
Tengah (KT) F-hitung Pr>F Perlakuan 1 3376.406250 3376.406250 13.48 0.0063 Galat 8 2003.750000 250.468750
Total terkoreksi
9 5380.156250
Lampiran 3 Hasil analisis ragam pengitungan populasi aktinomiset pada media limbah organik minggu ke-4
Sumber keragaman Derajat bebas (Db) Jumlah Kuadrat (JK) Kuadrat
Tengah (KT) F-hitung Pr>F Perlakuan 1 1144.900000 1144.900000 4.83 0.0592 Galat 8 1895.600000 236.950000
Total terkoreksi
9 3040.500000
Lampiran 4 Hasil analisis ragam penghitungan populasi aktinomiset pada media limbah organik minggu ke-6
Sumber keragaman Derajat bebas (Db) Jumlah Kuadrat (JK) Kuadrat
Tengah (KT) F-hitung Pr>F Perlakuan 1 50.625000 50.625000 0.06 0.8201 Galat 8 7331.000000 916.375000
Total terkoreksi
29
Lampiran 5 Hasil analisis ragam penghitungan populasi aktinomiset pada media limbah organik mingguke-8
Sumber keragaman
Derajat bebas (Db)
Jumlah Kuadrat (JK)
Kuadrat
Tengah (KT) F-hitung Pr>F Perlakuan 1 40.0000 40.0000 0.00 0.9716 Galat 8 236620.0000 29577.5000
Total terkoreksi
9 236660.0000
Lampiran 6 Media tumbuh aktinomiset, pada media dedak (kiri) dan media serbuk gergaji (kanan)
ABSTRAK
NURUL WIDYANTI. Kajian Aktinomiset Sebagai Agens Hayati untuk Pengendalian Sclerotium rolfsii dan Pembiakannya pada Media Limbah Organik Padat. Dibimbing olehGIYANTO.
Pengendalian patogen secara hayati merupakan pengendalian dengan memanfaatkan mikroorganisme yang bersifat antagonis. Mikroorganisme yang dapat digunakan sebagai agens hayati salah satunya adalah aktinomiset. Aplikasi aktinomiset dilapangan memiliki kendala dalam pembiakan secara massal karena penggunaan media di Laboratorium membutuhkan biaya yang cukup mahal sehingga dibutuhkan media alternatif yang murah dan mudah didapat. Tujuan penelitian ini untuk mengetahui kemampuan isolat aktinomiset dalam menekan pertumbuhan S. rolfsii serta melihat pertumbuhannya dalam media tumbuh alternatif berbahan dasar limbah organik serbuk gergaji dan dedak. Aktinomiset yang digunakan yakni APS 7, APS 9, APS 12, dan ATS 5. Biakan aktinomiset diremajakan dari kultur pembiakan lalu diuji secara in vitro terhadap S. rolfsii. Hasil penelitian menunjukkan bahwa dari keempat isolat aktinomiset yang digunakan hanya isolat APS 7 yang memiliki potensi sebagai agens pengendalian hayati terhadap S. rolfsii dengan nilai penghambatan sebesar 91.73% pada inkubasi minggu ketiga. Secara umum baik media serbuk gergaji maupun media dedak keduanya memiliki potensi dijadikan media tumbuh aktinomiset APS 7. Komposisi bahan pada media serbuk gergaji yang terdiri dari 45% serbuk gergaji, 44.3% ampas tahu, 2.7% kapur pertanian, 5% glukosa, 2.5% susu skim, dan 0.5% tepung limbah udang mampu mendukung pertumbuhan aktinomiset dengan nilai rata-rata populasi tertinggi sebesar 335106 cfu/g pada masa inkubasi minggu kedelapan. Begitu pula pada media dedak dengan komposisi bahan yang terdiri dari 45% dedak, 38.5% ampas tahu, 8.5% kapur pertanian, 5% glukosa, 2.5% susu skim, dan 0.5% tepung limbah udang juga mampu mendukung pertumbuhan aktinomiset dengan nilai rata-rata populasi sebesar 331106 cfu/g pada masa inkubasi minggu kedelapan.
PENDAHULUAN
Latar Belakang
Budi daya tanaman merupakan kegiatan yang kerap dilakukan untuk memenuhi kebutuhan pangan dan pakan. Pada proses budi daya kadang kala terdapat hambatan berupa serangan organisme pengganggu tanaman (OPT).
Sclerotium rolfsii merupakan salah satu jenis OPT yang memiliki kisaran inang luas. Kurang lebih 500 spesies inang seperti kubis, bawang merah, kacang hijau, kacang tanah, tomat, dan timun dapat diserang oleh patogen ini. Inang yang terserang akan mengalami rebah kecambah, busuk pangkal batang dan busuk akar sehingga proses fisiologi tanaman terganggu. Pada tanaman dewasa gejala yang ditimbulkan berupa bercak kuning hingga kemerahan pada pangkal batang dan menghasilkan sklerotium yang mampu bertahan hidup selama setahun di dalam tanah (Agrios 2005). Sebagaimana pengendalian pada patogen tular tanah lainnya, pengendalian S. rolfsii meliputi upaya memusnahkan inokulum cendawan seperti pembuangan sisa tanaman, solarisasi, rotasi tanaman, dan penggunaan fungisida. Pengendalian dengan rotasi tanaman memiliki kesulitan karena kisaran inang yang luas. Penggunaan fungisida sintetis yang kurang bijaksana dapat meningkatkan ketahanan patogen dan mengakibatkan peningkatan residu pada produk hasil.
2
tanaman (Barreto et al. 2008). Berbagai pengujian aktinomiset telah banyak dilakukan terhadap biji, bibit, dan media tanam untuk menekan perkembangan patogen rebah kecambah dan patogen tular tanah lainnya (Lahdenpera 2000). Beberapa isolat aktinomiset seperti Streptomyces sp. mampu menghambat pertumbuhan patogen Ralstonia solanacearum pada tanaman pangan (Akhdiya & Susilowati 2008), Xanthomonas oryzae pv. oryzae pada padi (Putra 2011), dan
Sclerotium rolfsii pada buncis (Reddy 2010).
Terlepas dari semua potensi yang dimiliki oleh aktinomiset, pembiakan aktinomiset secara massal memiliki hambatan tersendiri. Media pembiakan aktinomiset yang terdapat di Laboratorium harus diperoleh dengan harga yang cukup mahal. Jika media tersebut digunakan untuk pembiakan aktinomiset secara massal, maka akan membutuhkan biaya produksi yang tinggi. Oleh karena itu, diperlukan media alternatif yang bernilai ekonomis. Media tumbuh yang berasal dari alam dapat dijadikan alternatif pembiakan aktinomiset. Media tumbuh alternatif agens hayati dalam bentuk formulasi dengan bahan dasar limbah organik telah banyak diteliti dan diproduksi secara massal. Seperti penelitian yang telah dilakukan oleh Rismawan (2011) dan Ratdiana (2007) dengan membuat formulasi media berasal dari limbah organik cair dan limbah cair ternak untuk media pembiakan Pseudomonas fluorescens. Beberapa perusahaan yang bergerak dalam bidang pestisida kini telah banyak memproduksi biopestisida berbahan dasar mikroba antagonis seperti Mycostop merupakan produk biokotrol berbahan dasar
Streptomyces griseoviridis dan Actino-iron berasal dari Streptomyces lydicus
(Lahdenpera 2006).
3
Tujuan Penelitian
Penelitian ini bertujuan mengkaji kemampuan isolat aktinomiset dalam menekan pertumbuhan S. rolfsii serta melihat pertumbuhannya dalam media alternatif berbahan dasar limbah organik serbuk gergaji dan dedak.
Manfaat Penelitian
TINJAUAN PUSTAKA
Sclerotium rolfsii
Sclerotium rolfsii merupakan patogen penyebab penyakit busuk pangkal batang yang pada umumnya terdapat pada tanaman persemaian namun juga dapat menyerang tanaman dewasa. Cendawan ini bersifat polifag sehingga kisaran inangnya sangat luas antara 200-500 spesies. Beberapa tanaman yang kerap diserang patogen ini adalah kedelai, kacang tanah, tembakau, cabai, dan terong (Punja & Rahe 2011). Infeksi patogen ini menyebabkan kehilangan hasil hingga 32.3% (Fichtner 2006). Patogen pada umumnya berada pada daerah tropik beriklim panas namun lembab dengan suhu sekitar 20-30 ⁰C. Pada daerah subtropik cendawan ini dapat membentuk spora seksual berupa basidiospora yakni Corticium rolfsii dan Pellicularia rolfsii (Ferreira & Boley 2000). Proses pemencaran dan pertahanan diri dengan membentuk struktur yang dapat bertahan hidup selama setahun di dalam tanah (disebut sklerotium). Sklerotium berbentuk bulat (tidak beraturan) dengan ukuran diameter 0.5-2.0 µm dan pada umumnya tampak berwarna putih namun berkembang cepat menjadi kecoklatan (Semangun 1993).
Gejala awal pada tanaman yang terserang S. rolfsii berupa nekrosis dan kelayuan pada daun. Gejala berikutnya terlihat kumpulan hifa berwarna putih pada jaringan yang terinfeksi dan dapat menimbulkan kebusukan pada pangkal batang. Selain menyebabkan busuk pada pangkal batang, Wahyuni & Wiwiek (1979) melaporkan bahwa patogen ini dapat menyebabkan busuk akar rimpang kunyit di pembibitan.
Pengendalian patogen ini dapat dilakukan secara mekanik, fisik, kultur teknis, kimiawi dan hayati. Sclerotium rolfsii pada umumnya sulit untuk dilakukan pengendalian secara kultur teknis dan kimiawi karena memiliki kisaran inang yang luas. Pada pengendalian secara hayati, beberapa mikroorganisme seperti cendawan Trichoderma harzianum (Tindaon 2008), Pseudomonas flourescens (Rismawan 2011), Bacillus subtilis, Gliocladium virens, Penicillium
5
Pengendalian Hayati
Pengendalian hayati adalah pengurangan jumlah inokulum atau kegiatan patogen dalam menyebabkan suatu penyakit oleh satu atau lebih organisme antagonis selain manusia baik secara aktif maupun manipulasi lingkungan dan inang (Baker & Cook 1974). Pengendalian hayati bersifat ekologis dan berkelanjutan. Ekologis berarti pengendalian hayati harus dilakukan melalui pengelolaan ekosistem pertanian secara efisien dengan sedikit mungkin mendatangkan efek samping negatif bagi lingkungan hidup. Berkelanjutan dapat diartikan sebagai kemampuan agens hayati untuk bertahan dan menjaga agar upaya pengendalian tidak merosot atau terus berlangsung (Basukriadi2003).
Menurut Istikorini (2002), pengendalian hayati yang bersifat ekologis dan berkelanjutan mengacu pada bentuk pertanian dengan mengoptimalkan pemanfaatan sumber daya yang ada. Pemanfaatan mikroorganisme antagonis dapat menjaga keseimbangan ekologi karena sumber daya tersebut dikembalikan lagi ke alam sehingga kualitas lingkungan terutama tanah dapat dipertahankan.
Contoh mikroorganisme antagonis yang digunakan untuk pengendalian hayati yakni Pseudomonas fluorescens untuk mengendalikan Ralstonia solanacearum pada tanaman cabai (Ratdiana 2007). Trichoderma harzianum
mempunyai kemampuan menekan patogen penyebab busuk umbi dan hawar daun pada tanaman kentang Phythopthora infestan (Purwantisari et al. 2008).
Gliocladium sp. mampu mengendalikan Rhizoctonia solani pada tanaman jagung (Syatrawati 2005) dan menekan pertumbuhan jamur akar putih pada tanaman karet (Silalahi & Suriadi 2008). Pemanfaatan Streptomyces spp. dapat menekan serangan Fusarium oxysporum pada tanaman pisang (Sudarma 2010). Pengendalian dengan menggunakan musuh alami merupakan langkah yang tepat guna menunjang pertanian yang ramah lingkungan.
Aktinomiset
6
menunjukkan konsistensi berdebu dan melekat erat pada permukaan agar (Rao 1994 dalam Puryantiningsih 2009). Beberapa aktinomiset mampu menghasilkan beragam senyawa yang dapat berfungsi sebagai antimikroba dan memacu pertumbuhan pada tanaman. Berbagai senyawa antimikrob yang dihasilkan oleh aktiomiset, khususnya Streptomyces spp. berupa tetrasiklin, streptomisin, eritromisin, kloramfenikol, ivermektin, dan rifampisin (Todar 2008).
Aktinomiset juga mampu mensintesis banyak senyawa bioaktif berupa antibiotik, pestisida, antiseptik, selulase, dan xylanase (Oskay et al. 2004). Kemampuan aktinomiset menghasilkan antibiotik dan antimikrob dapat dibuktikan dengan adanya penelitian yang dilaporkan oleh Crawford (1993) yang menyatakan bahwa aktinomiset yang berasal dari rizosfer dan non rizosfer dapat bersifat antagonis pada tanaman selada yang terserang oleh patogen akar
Pythium ultimo. Penelitian lain dapat membuktikan bahwa isolat aktinomiset seperti Streptomyces sp. mampu menghambat pertumbuhan patogen Bacillus sp. dan Pyricularia oryzae pada tanaman padi (Prabavathy et al. 2006) serta menghambat perkecambahan uredospora Phakopsora Pachirizi pada tanaman kedelai (Kurniawan 2003).
Selain dapat menghasilkan senyawa aktif, aktinomiset juga dapat berperan sebagai pemicu pertumbuhan tanaman seperti penelitian yang telah dilakukan oleh Patil et al. (2011) bahwa aktinomiset mampu memicu pertumbuhan tanaman tomat dan menginduksi senyawa fenolat untuk menambah daya tahan terhadap serangan Rhizoctonia solani. Khamna et al. (2010) melaporkan Streptomyces viridis mampu meningkatkan perkecambahan dan panjang akar tanaman jagung serta memperbanyak polong pada tanaman kacang melalui dihasilkannya IAA.
Limbah Organik Serbuk Gergaji
7
2008). Limbah ini terdiri dari kulit kayu, potongan kayu dan serbuk hasil gergajian. Limbah berupa potongan kayu telah dimanfaatkan sebagai inti papan blok dan bahan baku papan partikel. Sedangkan limbah berupa serbuk kayu pemanfaatannya hanya digunakan sebagai bahan bakar tungku (dibakar begitu saja) tanpa penggunaan yang berarti atau dibiarkan menumpuk sehingga dapat menyebabkan pencemaran (Febrianto 1999).
Untuk mengurangi tingkat pencemaran, maka pemanfaatan serbuk gergaji harus dilakukan lebih optimal agar mempunyai nilai ekonomi. Kandungan nutrisi dan mineral yang terdapat di dalam 100 g serbuk gergaji yakni 35,3 g serat kasar, 31 g selulosa, 30,9 g lignin, 0.9 g protein kasar, dan 1.9 g lemak kasar (Suriawiria & Unus 2006). Beberapa pemanfaatan serbuk gergaji yang telah dilakukan berupa penggunaan serpihan dan potongan kayu untuk dijadikan arang (Amin 2000) dan media tanam jamur tiram (Sariyono 2008).
Masih banyak limbah serbuk gergaji yang belum dimanfaatkan secara maksimal. Oleh karena itu, pencarian alternatif untuk membuat limbah serbuk gergaji kayu lebih bermanfaat masih dilakukan. Salah satunya digunakan untuk media pembiakan massal aktinomiset. Aktinomiset seperti bakteri pada umumnya, membutuhkan sumber karbon (C), nitrogen (N), dan fosfat (P) untuk menunjang pertumbuhannya (Pelczar & Chan 2007). Zat-zat (karbohidrat dan lignin) yang terkandung di dalam serbuk gergaji dibutuhkan oleh aktinomiset untuk tumbuh. Aktinomiset memiliki kemampuan mendegradasi bahan organik seperti selolusa dan lignin (Xu et al. 1996).
Dedak
8
1999). Penggilingan satu ton gabah menghasilkan dedak sebanyak 60-80 kg (Goffman et al. 2003).
Dedak mengandung asam lemak tak jenuh esensial dan bermacam-macam vitamin (B1, B2, B3, B5, dan B6) serta mineral. Disamping zat gizi, dedak juga mengandung komponen bioaktif seperti antioksidan (tokoferol, tokotrienol, dan oryzanol) dan asam pangamik. Kandungan nutrisi yang terdapat di dalam 100 g dedak adalah 70 g karbohidrat, 12 g lemak, dan 16 g protein serta terdapat 0.2 g vitamin B15 (Blair 2008).
Berdasarkan kandungan nutrisi yang terdapat di dalam dedak, banyak peternak menggunakan dedak sebagai pakan untuk unggas. Selain sebagai pakan ternak, dedak berpotensi sebagai bahan pangan karena mengandung pati dan minyak. Pada proses pembiakan aktinomiset dedak dapat dijadikan sebagai sumber karbon (C), nitrogen (N), vitamin B1, dan B2.
Ampas Tahu
Tahu merupakan makanan tradisional sebagian besar masyarakat di Indonesia. Bahan utama pembuatan tahu adalah kacang kedelai (Glycine max).
Industri tahu dalam proses pengolahannya menghasilkan limbah, baik limbah padat maupun cair. Limbah padat yang lebih dikenal sebagai ampas tahu merupakan limbah padatan yang memiliki jumlah protein bervariasi tergantung pada proses pembuatannya.
Pembuatan tahu secara tradisional menghasilkan ampas tahu dengan protein yang lebih tinggi dibandingkan dengan pengolahan secara modern (Winarno & Fardiaz 1985). Kandungan nutrisi dan mineral yang terdapat di dalam 100 g ampas tahu yakni 17.4 g karbohidrat, 67.5 g protein, 10.6 g lemak, dan 4.499 g mineral (Sulistiani 2004).
9
kandungan nutrisi dan mineral yang terdapat pada ampas tahu maka bahan ini dapat dijadikan bahan tambahan dalam pembuatan media tumbuh aktinomiset.
Tepung Limbah Udang
Indonesia termasuk salah satu negara pengekspor udang terbesar di dunia. Data BPS (2009) menunjukkan produksi udang Indonesia sebesar 294.000 ton pada tahun 2008 dan produksi ini meningkat sebesar 25% per tahun. Apabila udang segar ini diolah menjadi udang beku, maka sebesar 35%-70% dari bobot utuh akan menjadi limbah udang (Mahata 2007). Limbah udang di Indonesia umumnya terdiri atas bagian kepala, ekor, dan cangkang udang serta udang yang rusak (Mirzah 1997).
BAHAN DAN METODE
Tempat dan Waktu
Penelitian dilaksanakan di Laboratorium Bakteriologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor (IPB) mulai Maret 2011 sampai Oktober 2011.
Bahan
Bahan yang digunakan adalah serbuk gergaji, dedak, ampas tahu, tepung limbah udang, kapur pertanian, susu skim, glukosa, media agar WYE (Water-yeast extract), media PDA (Potato Dextrose Agar), isolat aktinomiset APS 7, APS 9, APS 12, ATS 5, dan biakaan cendawan Sclerotium rolfsii.
Peremajaan Aktinomiset dari Kultur Penyimpanan
Isolat murni aktinomiset didapatkan dari Laboratorium Bakteriologi Tumbuhan Proteksi Tanaman. Isolat aktinomiset APS 7, APS 9, dan APS 12 berasal dari tanah bagian top soil sekitar perakaran sawit (Putra 2011) sedangkan aktinomiset ATS 5 berasal dari tanah persawahan (Himmah 2012). Perbanyakan isolat murni dil