PENCIRIAN XILANASE DARI XILANOLITIK XJ18 YANG
MENGHASILKAN XILOBIOSA DARI XILAN TONGKOL
JAGUNG
KURRATAA’YUN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Pencirian Xilanase dari Xilanolitik XJ18 yang Menghasilkan Xilobiosa dari Xilan Tongkol Jagung adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2014
Kurrataa’yun
RINGKASAN
KURRATAA’YUN. Pencirian Xilanase dari Xilanolitik XJ18 yang menghasilkan Xilobiosa dari Xilan Tongkol Jagung. Dibimbing oleh ANJA MERYANDINI dan YOPI.
Tongkol jagung merupakan limbah berlignoselulosa yang memiliki kandungan xilan paling tinggi dibandingkan limbah pertanian lignoselulosa lainnya seperti bagasse, tembakau, dan jerami. Degradasi sempurna xilan membutuhkan kerja sinergis enzim keluarga xilanase. Xilanase telah banyak digunakan untuk mendegradasi xilan menjadi produk komersial seperti gula rendah kalori, prebiotik, dan biofuel. Berdasarkan aplikasinya yang luas, berbagai variasi karakter xilanase dibutuhkan. Walaupun xilanase telah dipelajari lebih dari 33 tahun yang lalu, xilanase yang menghasilkan xilobiosa dari xilan masih sangat sullit ditemukan.
Penelitian sebelumnya telah berhasil mengoleksi bakteri xilanolitik XJ18 dari TNBD, Jambi, Indonesia yang diharapkan dapat menghasilkan karakteristik xilanase yang unik. Pada penelitian ini, isolat XJ18 diidentifikasi berdasarkan analisis 16S rRNA. XJ18 ditemukan memiliki kesamaan 97% dengan
Paenibacillus terrae. Enzim yang diproduksi Paenibacillus terrae XJ18 dianalisis menggunakan metode pewarnaan menggunakan reagen DNS. Aktivitas xilanase
Paenibacillus terrae XJ18 mengalami peningkatan 4.59 kali setelah dipekatkan dengan 70% aseton (2.55 IU), sehingga diketahui enzim lebih bersifat asam dan hidrofilik. Berdasarkan hasil kromatografi lapis tipis (KLT) didapatkan satu spot produk yang nilai RFnya berbeda dengan xilosa maupun arabinosa dan mendekati standar disakarida, sehingga Paeninbacillus terrae XJ18 diprediksi menghasilkan xilobiosa dari xilan tongkol jagung 0.5%. Hasil tersebut mengindikasikan xilanase dari Paenibacillus terrae XJ18 hanya mengenali dua unit xilosa dari ujung akhir rantai utama xilan dan memediasi ikatan -1.4, sehingga memproduksi xilobiosa dan intermediet yang lebih besar.
SUMMARY
KURRATAA’YUN. Characterization of xylanase from xylanolytic XJ18 which produce xylobiose from corncob xylan. Supervised by ANJA MERYANDINI and YOPI.
Corncob is one of lignocellulose waste which has the highest xylan content than bagasse, tobacco, and straw. Its complete breakdown requires the action of xylanase. Xylanase has been used to breakdown xylan into commercial product as low calories sugar, prebiotic, and biofuel. Due its wide of application, many variation of xylanase’s characters are needed. Although xylanase have been studied for more than 33 years, there is a paucity of information regarding a xylanase that produces exclusively xylobiose from xylan.
The previous studies have collected XJ18 from TNBD forest, Jambi, Indonesia to gain a unique enzyme characteristic. In this study, XJ18 was identified by 16S rRNA analyzed and found has 97% similarity as Paenibacillus terrae. Xylanase assay was done by DNS method. The xylanase activity was increased about 4.59 times after being concentrated by acetone 70% (2.55 IU). Based on thin layer chromatography (TLC) result, the product’s spot showed different RF value from xylose and arabinose standard, thus xylanase from
Paenibacillus terrae XJ18 predicted produced xylobiose from 0.5% extracted corncob xylan. These results indicated that the xylanase from Paenibacillus terrae
XJ18 recognizes only two xylose units from one of the ends of the xylan backbone and mediates the hydrolysis of the adjacent -1.4-linkage, producing xylobiose and bigger intermediates.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Mikrobiologi
PENCIRIAN XILANASE DARI XILANOLITIK XJ18 YANG
MENGHASILKAN XILOBIOSA DARI XILAN TONGKOL
JAGUNG
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Karya ilmiah ini merupakan salah satu persyaratan untuk memperoleh gelar Magister Sains di Program Studi Mikrobiologi Sekolah Pascasarjana Institut Pertanian Bogor. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Oktober 2013 hingga April 2014 ini ialah enzim, dengan judul ―Pencirian Xilanase dari Xilanolitik XJ18 yang menghasilkan Xilobiosa dari Xilan Tongkol Jagung‖.
Terima kasih yang mendalam penulis ucapkan kepada Prof Dr Anja Meryandini, MS dan Dr Yopi selaku pembimbing atas bimbingan, ilmu pengetahuan, saran, serta kesabarannya selama penyusunan tesis ini. Penghargaan penulis sampaikan kepada Mba Nani dan Mba Lia yang telah memberikan ilmu dan pengarahan praktek kerja di laboratorium LIPI Cibinong; Ibu Dewi sebagai laboran Bioteknologi Hewan dan Biomedis Pusat Antar Universitas, PPSHB dan Ibu Fitri yang telah banyak membantu dalam proses penelitian secara teknik.
Ucapan terima kasih juga penulis sampaikan kepada teman seperjuangan, rekan kerja di laboratorium Bioteknologi Hewan dan Biomedis (Mba Tini, Mba Ira, Mba Novi, Mba Ami, Mba Anik, Mba Debby), rekan kerja di laboratorium biokatalis dan fermentasti LIPI Cibinong (Kak Azizah, Kak Wida, Kak Kholis, Kak Ari, dan Kak Gading), teman seperjuangan Fasttrack
(Ica, Feni, Ary, Hendri, dan Randi) yang telah banyak membantu dan menemani selama proses penelitian; Ikra Nugraha atas semangat dan dukungannya; keluarga MIK12, keluarga MIK13, keluarga Biologi 46; dan keluarga asrama NTB atas kebersamaannya.
Ungkapan terima kasih terbesar penulis sampaikan kepada ayah dan ibu atas do’a, kasih sayang, dan dukungannya hingga penulis dapat menyelesaikan studi strata dua ini dengan baik. Tidak lupa terima kasih kepada abang Man, Dela, dan Putri serta seluruh keluarga yang telah menghibur serta menemani penulis selama melaksanakan penelitian. Akhir kata, penulis berharap tesis ini bermanfaat untuk dunia sains dan pendidikan dimasa depan.
Bogor, Agustus 2014
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
TINJAUAN PUSTAKA 2
Jagung 2
Tongkol Jagung 4
Xilan 5
Xilanase 7
METODE 9
Tempat dan Waktu 9
Bahan 10
Alat 10
Ekstraksi Xilan dengan Metode Alkali 10
Identifikasi 16S rRNA Xilanolitik XJ18 Asal TNBD 10
Produksi Xilanase 11
Produksi dan Pemekatan Ekstrak Kasar Xilanase 11
Analisis Produk Hidrolisis secara Kualitatif 12
HASIL DAN PEMBAHASAN 13
Hasil 13
Pembahasan 16
SIMPULAN DAN SARAN 24
Simpulan 24
Saran 25
DAFTAR PUSTAKA 25
LAMPIRAN 33
DAFTAR TABEL
1. Produksi Jagung di berbagai negara di dunia 4
2. Komposisi tongkol jagung 5
3. Neraca massa proses ekstraksi xilan dari tongkol jagung secara alkali 13 4. Perbandingan analisis proksimat tepung tongkol jagung pra dan
pasca delignifikasi (%) 14
5. Optimasi pemekatan xilanase dari Paenibacillus terrae XJ18 dengan
amonium sulfat dan aseton 15
6. Perhitungan nilai derajat polimerisasi (DP) produk hidrolisis xilan
tongkol jagung oleh xilanase XJ18. 15
DAFTAR GAMBAR
1. Populasi penduduk dunia dan produksi jagung pada tahun 2001-2011 3
2. Tongkol jagung 4
3. Proses ekstraksi xilan dari tongkol jagung dengan metode Alkali 6 4. Situs kerja kompleks enzim xilanase terhadap struktur xilan 8
5. Elektroforegram DNA hasil PCR koloni 14
6. Produk hidrolisis tongkol jagung xilan 0.5% dengan xilanase XJ18
(1:1) dengan KLT pada plat silika gel 16
7. Proses siklus PCR 19
8. Struktur kimia xilan 21
9. Struktur unit penyusun xilan 22
10.Skema mekanisme kerja enzim xilanase Paenibacillus terrae XJ18 23 11.Mekanisme konversi xilosa menjadi xilitol dan turunannya 24
DAFTAR LAMPIRAN
1. Media peremajaan kultur xilanolitik 33
2. Media produksi enzim 33
3. Komposisi reagen Dinitrosalicylic acid (DNS) 33
4. Komposisi larutan Bradford 5X pekat 33
5. Kondisi PCR yang digunakan dalam PCR koloni 33
6. Sekuens basa nukleotida isolat XJ18 34
7. Hasil Blast sekuens basa nukleotida isolat XJ18 34
PENDAHULUAN
Latar Belakang
Limbah tongkol jagung merupakan limbah berlignoselulosa yang sulit terdegradasi secara alami di alam. Jumlahnya semakin meningkat seiring dengan peningkatan jagung sebagai salah satu komoditas pertanian pangan utama Indonesia. Selama kurun waktu lima tahun terakhir, terjadi peningkatan produksi jagung hampir mencapai 10% dengan jumlah produksi 18.8 juta ton dan produktivitas 4.23 ton/Ha pada tahun 2013 (BPS 2013). Hal tersebut akan berkorelasi terhadap peningkatan limbah jagung yang mencapai 54.2% dari jumlah produksi total, salah satunya limbah tongkol jagung (Igathinathane et al.
2006). Limbah berlignoselulosa dapat dikonversi menjadi berbagai produk komersial seperti biofuel, gula sederhana, dan xilitol (Jeevan et al. 2011; Kamat et al. 2013; Li et al. 2013).
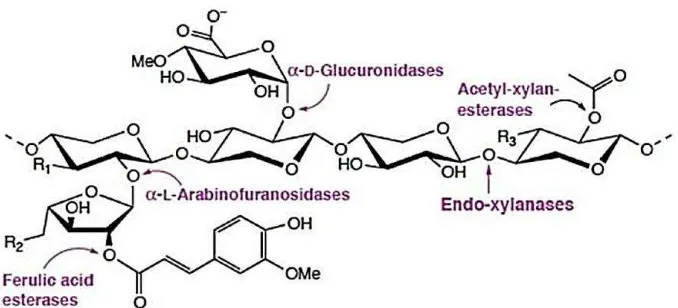
Tongkol jagung memiliki kandungan xilan paling tinggi dibandingkan limbah pertanian lainnya. Menurut Yang et al. (2005), xilan yang terkandung dalam limbah tongkol jagung mencapai 40 g/100 g dari bobot totalnya. Xilan merupakan komponen utama hemiselulosa yang memiliki kerangka dasar residu 1.4-D-xilopiranosil yang rantai sampingnya tersubstitusi dengan gugus asetil, asam 4-O-metil-D-glukuronosil dan α-arabinofuranosil. Hidrolisis xilan oleh enzim xilanase akan menghasilkan gula sederhana, tergantung jenis enzim xilanasenya. Jenis enzim xilanase yaitu Endo-1.4- -xilanase (E.C.3.2.18) yang menghidrolisis rantai utama xilan; 1.4- -D-xilosidase (E.C.3.2.1.37) memutus sebagian kecil oligosakarida; α-L-arabinofuranosidase (E.C.3.2.1.55), α -D-glukuronidase (E.C.3.2.1.139), galaktosidase (3.2.1.22) dan asetil xilan esterase (E.C.3.1.1.72) menghidrolisis rantai samping xilan (Subramaniyan dan Prema 2002).
Hasil hidrolisis xilan dalam bentuk monomer terdiri atas xilosa, arabinosa, dan asam glukuronik. Xilosa dan arabinosa telah diaplikasikan sebagai gula rendah kalori yang baik digunakan untuk penderita diabetes. Mikkelsen-Krog et al. (2011) melaporkan bahwa gula L-arabinosa menghambat aktivitas enzim sukrase dalam saluran pencernaan sehingga dapat mencegah hiperglikemia postprandial (pasca makan) pada penderita diabetes. Adapun oligosakaridanya, seperti xilo-oligosakarida (XOS) telah digunakan untuk aplikasi dalam bidang pangan dan kesehatan, khususnya sebagai prebiotik. Berbagai penelitian produksi XOS dari tongkol jagung sebagai prebiotik telah dilakukan (Aachary dan Prapulla 2011). Aplikasi enzimnya sendiri dalam bidang industri kertas telah digunakan sebagai substitusi klorin dalam pemutih pulp sehingga meningkatkan kekuatan kertas dalam kondisi lembab.
2
yaitu memiliki aktivitas pada rentang suhu dan pH yang luas. Ekstrak kasar enzim yang dihasilkan memiliki banyak puncak pada kondisi suhu ekstra panas dan normal, maupun pada kondisi pH asam dan netral. Aktivitas tertingginya terjadi pada kondisi ekstrem, yaitu pada suhu 90 oC dan pH 5.0. Salah satu puncak aktivitas enzim juga terjadi pada kondisi normal, yaitu pada suhu 40 oC dan pH 6.0. Walaupun penelitian tentang xilanase telah dilakukan lebih dari 33 tahun yang lalu (Reilly 1981), xilanase yang menghasilkan satu jenis produk hidrolisis masih sulit ditemukan.
Perumusan Masalah
Xilanase merupakan enzim yang memiliki aplikasi sangat luas sehingga dibutuhkan karakter yang bervariasi dan unik. Eksplorasi keragaman dan keunikan karakter berbagai xilanase terus dilakukan untuk mendapatkan xilanase yang sesuai dengan bidang aplikasinya. Walaupun xilanase telah lama dipelajari, sangat jarang ditemukan xilanase yang menghasilkan hanya satu jenis produk hidrolisis.
Tujuan Penelitian
Penelitian ini bertujuan untuk melakukan pencirian terhadap xilanase XJ18 dan menganalisis produk hidrolisisnya dari xilan tongkol jagung.
Manfaat Penelitian
Penelitian ini diharapkan dapat menemukan variasi karakter unik xilanase dari bakteri tanah.
TINJAUAN PUSTAKA
Jagung
Jagung telah menjadi salah satu komoditas pangan utama dunia. Berbagai penduduk benua Afrika, Asia, dan Amerika latin mengonsumsi jagung. Sementara di Amerika Utara dan di Asia menggunakan jagung sebagai pakan ternak. Sebanyak 50% penduduk sub-Sahara Afrika menggantungkan hidupnya pada jagung sebagai makanan pokoknya. Tanaman jagung menjadi komoditas penting bagi 70 juta keluarga petani di seluruh dunia. Hal tersebut dikarenakan jagung mengandung gizi yang cukup banyak. Kandungan gizi utama jagung adalah pati (72-73%), dengan nisbah amilosa dan amilopektin 25-30%:70-75%. Kadar gula sederhana jagung (glukosa, fruktosa, dan sukrosa) berkisar antara 1-3%. Protein jagung (8-11%) terdiri atas lima fraksi, yaitu: albumin, globulin, prolamin, glutelin, dan nitrogen non-protein. Asam lemak pada jagung meliputi asam lemak jenuh (palmitat dan stearat) serta asam lemak tidak jenuh, yaitu oleat (omega-9) dan linoleat (omega-6). Vitamin yang terkandung dalam jagung meliputi vitamin A dan E. Selain itu, jagung juga mengandung berbagai mineral esensial seperti K, Na, P, Ca, dan Fe (Suarni dan Widowati 2007). Oleh karena itu, selain sebagai bahan pangan dan pakan, jagung menjadi sumber produk industri seperti pati (Zhang et al. 2012), vitamin (Warman dan Harvard 1998), serat (Pandya dan Srinivisan 2012), minyak (Comin et al. 2012), dan etanol.
Jagung merupakan tanaman yang mudah dibudidayakan. Hal tersebut dikarenakan jagung berasal dari daerah tropis dan mudah beradaptasi dengan lingkungan non-tropis. Tanaman jagung dapat tumbuh pada berbagai macam tanah, seperti andosol (tanah berasal dari gunung merapi), latosol (tekstur lempung/liat), grumosol (tekstur berat), bahkan tanah berpasir. Jagung masih dapat tumbuh pada tanah yang kering dengan kisaran pH 5.6-7.5. Jagung dapat ditanami pada berbagai ketinggian, yaitu dari dataran rendah hingga daerah pegunungan (1,000-1,800 m dpl). Adapun kondisi pertumbuhan optimumnya pada ketinggian 0-600 m dpl dengan penyinaran sinar matahari cukup. Pada fase pembungaan, jagung membutuhkan pengairan yang cukup dengan curah hujan ideal yaitu sekitar 85-200 mm/bulan.
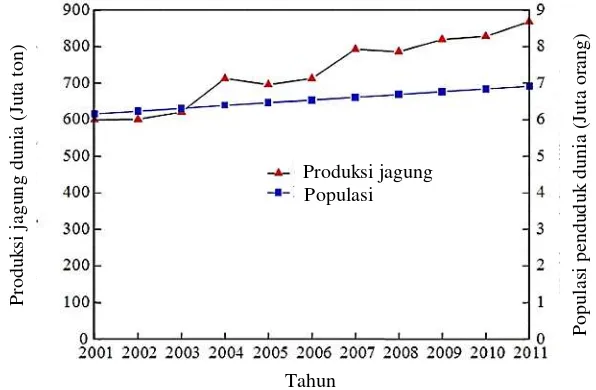
Gambar 1 Populasi penduduk dunia dan produksi jagung pada tahun 2001-2011
(USDA 2011)
Aplikasinya yang luas ditunjang dengan kemudahan dalam budidayanya, mendorong peningkatan produksi jagung dari tahun ke tahun. Peningkatan Produksi jagung dunia mengalami peningkatan yang drastis melebihi kecepatan pertumbuhan
4
populasi dunia. Produksi jagung mengalami peningkatan sebesar 44.74% dari tahun 2001-2011, yaitu dengan jumlah produksi 599.35-867.52 juta ton (USDA 2011); sementara populasi dunia hanya mengalami peningkatan sebesar 12.34%, yaitu sebanyak 6.16-6.92 milyar penduduk selama periode yang sama. US merupakan negara dengan produksi dan ekspor jagung tertinggi, yaitu sebanyak 313.92 juta ton/tahun, sementara produksi jagung di Indonesia sebesar 8.10 juta ton/tahun.
Tabel 1 Produksi Jagung di berbagai negara di dunia (USDA 2011)
Negara
2010). Tongkol jagung berbentuk tabung yang mengerucut pada ujungnya, dan merupakan sebagai tempat bulir-bulir jagung melekat (Gambar 2). Jumlah tongkol jagung yang dihasilkan dunia setiap tahunnya mencapai 130.13 juta ton. Tongkol jagung merupakan limbah lignoselulosa yang mengandung 45% selulosa, 35% hemiselulosa, dan 15% lignin (Howard et al. 2003).
Gambar 2 Tongkol jagung
Tongkol jagung telah diteliti dan memiliki kandungan xilan tertinggi dibandingkan limbah pertanian berlignoselulosa lainnya. Menurut Kumar et al.
bahkan untuk skala industri, terlebih dikarenakan ketersediaannya yang melimpah. Keberlimpahan limbah tongkol jagung yang tidak termanfaatkan dapat menyebabkan kerusakan lingkungan. Hingga saat ini, tongkol jagung telah digunakan oleh petani tradisional sebagai alas tidur ternak, landfill, dan substitusi kertas toilet. Selain itu, tongkol jagung mulai diteliti untuk dikembangkan sebagai material bangunan (Pinto et al. 2012), karbon aktif (Cao et al. 2006), etanol (Chen
et al. 2007), coating makanan (Li et al. 2011) dan obat dikarenakan sifatnya yang meningkatkan aktivitas mitogenic dan comitogenic, efek antiphlogistic, dan menghambat aktivitas mutagen (Oliveira et al. 2010).
Tabel 2 Komposisi tongkol jagung (Kumar et al. 2010)
Fraksi Bobot (%)
a. klason lignin (lignin tidak terlatur asam) 14.01
b. Lignin terlarut asam 2.02
Etanol benzena terlarut 4.33
Lainnya 6.64
Xilan
Hemiselulosa merupakan polimer hayati yang paling melimpah kedua setelah selulosa. Komposisinya mencapai 40% dari total massa tanaman annual maupun perennial. Polimer ini memiliki kekerabatan yang dekat dengan selulosa dan lignin yang berfungsi sebagai pemberi kekuatan dan sifat rigid pada dinding sel tanaman. Hemiselulosa memiliki komposisi gula yang bervariasi pada setiap tanaman. Gula yang menjadi penyusun hemiselulosa diantaranya manan, arabinan, galaktan, dan xilan (Belgacem dan Gandini 2008).
Xilan merupakan komposisi utama hemiselulosa pada tumbuhan berkayu. Jumlahnya dapat mencapai 30% dari total penyusun dinding sel. Xilan memiliki struktur yang bervariasi pada berbagai tumbuhan. Namun secara umum xilan tersusun dari kerangka dasar residu 1.4-D-xilopiranosil (gula pereduksi dengan lima atom karbon) yang rantai sampingnya tersubstitusi dengan gugus asetil, 4-O-metil-D-glukuronosil dan α-arabinofuranosil (Habibi dan Vignon 2005).
6
dilakukan ekstraksi dalam dua tahap, yaitu delignifikasi dengan NaOCl 0.5%, ekstraksi dengan NaOH 10% selama 24 jam dengan suhu ruang, dan pengendapan menggunakan etanol dengan perbandingan supernatan-etanol 1:3 (Gambar 3). Konsentrasi NaOH mengimprovisasi efisiensi dari ekstraksi xilan. Ketika konsentrasi NaOH lebih rendah, xilan yang terdapat di tongkol jagung tidak dapat larut seutuhnya, sehingga efisiensi ekstraksi akan rendah. Optimasi lebih lanjut dilakukan Yao (2011) yang menemukan konsentrasi ekstraksi optimum dengan perendaman menggunakan NaOH 25% pada suhu 94 oC selama 3 jam.
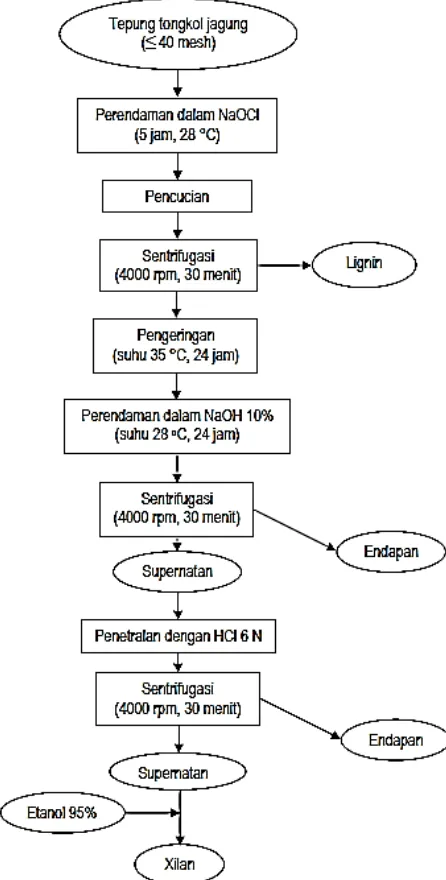
Gambar 3 Proses ekstraksi xilan dari tongkol jagung dengan metode Alkali (Richana et al. 2007)
berbeda. Klasifikasi xilan sering dilakukan berdasarkan rantai substitusinya (Ebringerová 2005, Sedlmeyer 2011), yaitu:
a. Homoxilan, yaitu polisakarida linier yang umumnya terdapat pada rumput laut
b. Glukuronoxilan, yaitu xilan yang dapat terasetilasi sebagian dan memiliki unit yang tersubstitusi dengan α-(12)-4-O-metil-D-glukopiranosil acid uronic (MeGlcUA). Xilan tersebut banyak dijumpai pada tumbuhan berkulit keras, tergantung dari perlakuan yang diberikan ketika proses ekstraksi xilan. c. Arabino (glukuronoxilan) memiliki substitusi α-(13)-L-arabinofuranosil
(ArbF)uronic yang dekat MeGlcUA. Jenis ini terdapat pada tumbuhan yang berkayu lunak (softwood).
d. Arabinoxilan dengan substitusi dengan kerangka -(14)-D-xilapiranosa pada posisi karbon 2 atau 3; dan ArbF yang teresterisasi parsial dengan asam fenolik. Tipe ini sering dijumpai pada endosperma berpati dan lapisan luar kulit serealia.
e. (Glukurono) arabinoxilan dapat tersubstitusi dengan unit ArbF, terasetilasi dan teresterisasi dengan asam ferulik. Tipe ini banyak dijumpai pada jaringan berlignin rumput-rumputan dan serealia
f. Heteroxilan tersubstitusi dengan berbagai mono atau oligosakarida dan dijumpai pada kulit padi, biji, dan getah.
Variasi struktur xilan dibutuhkan untuk penggunaan xilan yang bervariasi pada berbagai aplikasinya. Berbagai aplikasi xilan telah digunakan sebagai polimer kertas, bahan kosmetik, biofuel, dan telah digunakan pada bidang farmasi dan bidang industri pangan. Lapisan pada xilan memiliki permeabilitas yang rendah terhadap oksigen, sehingga xilan memiliki potensi aplikasi pada pengemasan makanan dan bidang farmasi. Aplikasi tersebut dilakukan dengan bantuan agen penghidrolisis xilan, yaitu xilanase (Yang et al. 2005; Oliveira et al.
2010).
Xilanase
8
Gambar 4 Situs kerja kompleks enzim xilanase terhadap struktur xilan (Shallom dan Shoham 2003)
Xilanase diklasifikasikan setidaknya dari tiga sifat, yaitu berdasarkan bobot molekul dan titik isolektriknya, struktur kristal, dan kinetikanya. Berdasarkan
database CAZy (http://www.cazy.org) xilanase (EC3.2.1.8) memiliki kekerabatan yang dekat dengan glikosida hidrolase (GH) keluarga 5, 7, 8, 9, 10, 11, 12, 16, 26, 30, 43, 44, 51 dan 62. Xilanase dapat diproduksi oleh berbagai mikroorganisme baik fungi maupun bakteri. Mikroorganisme xilanolitik yang paling berpotensial diantaranya Aspergillus, Trichoderma, Streptomyces, Phanerochaetes, Chytridiomycetes, Ruminococcus, Fibrobacteres, Clostridia dan Bacillus (Barry dan Dillon 1940; Wong et al. 1988; Kulkarni et al. 1999).
Aplikasi xilanase secara komersial telah digunakan dalam industri makanan dan pemanfaatan limbah pertanian untuk produksi xilosa. Xilosa merupakan gula rendah kalori yang dapat dikonsumsi penderita diabetes. Xilanase dapat menggantikan klorin yang digunakan dalam proses pemutihan bubur kertas pada industri kertas (Ruiz-Arribas et al. 1995). Selain itu xilanase telah diketahui dapat meningkatkan daya pembersih pada deterjen (Kumar et al. 2004); mengurangi viskositas saluran pencernaan ternak sehingga meningkatkan pencapaian berat dan efisiensi konversi makanannya (Adeola & Bedford 2004); serta meningkatkan kekuatan kertas pada kelembaban tinggi (Wong et al. 1988).
Sebanyak 90% produksi xilanase dilakukan dengan metode fermentasi sub-merged. Walaupun begitu, produksi dengan fermentasi solid menghasilkan enzim lebih tinggi (Agnihotri et al. 2010). Penggunaan metode sub-merged dipilih dikarenakan bersifat ekonomis, memiliki teknik yang mudah sehingga resiko kontaminasinya rendah, dan pengaturan kondisi fermentasi yang mudah (Pandey
et al. 1999; Beg et al. 2001). Adapun penggunaan teknik fermentasi solid dilakukan untuk mendapatkan enzim yang lebih murni. Beberapa faktor yang mempengaruhi produksi xilanase antara lain komposisi media nutrisi, karakteristik substrat sebelum diberi perlakuan, dan kondisi fermentasi. Pemilihan substrat dan komposisi nutrisi pada media merupakan faktor penting untuk keberhasilan dalam memproduksi xilanase. Komponen substrat yang sangat diperlukan adalah karbon dan sumber energi agar menghasilkan xilanase yang tinggi (Velkova et al. 2007).
menggunakan metode 3.5-dinitrosalicylic acid (DNS) atau Nelson-Somogyi (Miller 1959) menggunakan substrat xilan umum. Peneliti lain menggunakan substrat modifikasi 4-O-metilglukuronoxilan yang terikat secara kovalen dengan reagen Remazol brilliant blue (RBB xilan) dan pengujian aktivitas xilannya berdasarkan rilisnya fragmen dari pewarna (Biely et al. 1985). Selain itu juga terdapat banyak metode pengujian aktivitas xilanase yang dijual secara komersil, salah satunya berdasarkan metode fluorescence.
METODE
Kerangka Penelitian
Penelitian ini merupakan penelitian lanjutan menggunakan isolat xilanolitik yang telah dieksplorasi dan diisolasi berdasarkan penelitian sebelumnya (Kurrataa’yun β01γ). Proses penelitian ini dilakukan dengan pengumpulan data yang terdiri atas pengidentifikasian isolat XJ18 dan produksi enzim xilanasenya. Enzim xilanase yang diproduksi dipekatkan dan direaksikan dengan xilan tongkol jagung yang telah diekstraksi menggunakan metode alkali.
Gambar 5 Diagram alur penelitian Tempat dan Waktu
10
Bahan
Tongkol jagung yang digunakan berasal dari jagung varietas Dramaga silangan 3. Isolat yang digunakan merupakan isolat xilanolitik XJ18 asal Taman Nasional Bukit Duabelas (TNBD) Jambi, koleksi Laboratorium Bioteknologi Hewan dan Biomedis, PPSHB, PAU. Identifikasi 16S rRNA menggunakan primer
9F (5’-GAGTTTGATCCTGGCTCAG–γ’) dan 1510R (5’
-GGCTACCTTGTTACGA–γ’) (Govan et al. 1999), Taq DNA polimerase
Fermentas, agarosa 1%, bufer Tris-asetat-EDTA (TAE). Pengujian aktivitas enzim dan gula pereduksi menggunakan reagen 3.5-dinitrosalicylic acid (DNS) (Lampiran 3), bufer fosfat (50 mM, pH 6.0). Pengukuran kadar protein menggunakan larutan Bradford (Lampiran 4). Pengujian total gula menggunakan Asam sulfat (H2SO4) dan fenol 5%. Analisis produk hidrolisis menggunakan plat silika gel dan eluen yang terdiri atas asam asetat, n-butanol, dan akuades.
Alat
Aktivitas enzim diukur menggunakan spektrofotometer UV-VIS. Amplifikasi gen penyandi 16S rRNA dilakukan menggunakan mesin Polymerase Chain Reaction (PCR) dan visualisasi amplikonnya menggunakan perlengkapan elektroforesis. Produk hidrolisis dianalisis menggunakan peralatan kromatografi lapis tipis (KLT).
Ekstraksi Xilan dengan Metode Alkali (modifikasi dari Richana et al. 2007)
Tongkol jagung yang digunakan merupakan tongkol jagung yang telah digiling hingga berukuran 40 mesh. Ekstraksi xilan diawali dengan perlakuan delignifikasi. Delignifikasi dilakukan dengan merendam 2,500 g tepung tongkol jagung ke dalam 25 L pelarut natrium hipoklorit (NaOCl) 0.5% pada suhu ruang selama 5 jam. Setelah dicuci dengan air destilata, tepung tongkol jagung disentrifugasi dengan kecepatan 800 x g selama 25 menit untuk memisahkan lignin dari selulosa dan hemiselulosa. Ampas yang mengandung xilan dikeringkan menggunakan oven bersuhu 60 oC selama 48 jam. Tongkol jagung sebelum dan sesudah delignifikasi dilakukan uji proksimat meliputi serat kasar (hemiselulosa, selulosa, dan lignin) (Van-Soest 1963), kadar air, kadar abu, lemak, dan protein (AOAC 1990). Ampas hasil delignifikasi selanjutnya direndam dengan NaOH 10% pada suhu ruang selama 24 jam dan dilakukan penyaringan untuk memisahkan ampas dengan supernatan. Supernatan yang mengandung xilan dinetralkan terlebih dahulu dengan HCl 6 N dan disentrifugasi dengan kecepatan 600 x g selama 25 menit. Supernatan yang diperoleh ditambahkan etanol 95% dengan perbandingan sampel dan etanol 1:3 (v/v). Xilan yang mengendap dipisahkan dengan melakukan sentrifugasi pada kecepatan 300 x g selama 30 menit. Endapan dikeringkan untuk mendapatkan ekstrak kasar xilan tongkol jagung.
Identifikasi 16S rRNA Xilanolitik XJ18 Asal TNBD
10.3% (Meryandini et al. 2009). Bakteri xilanolitik XJ18 asal TNBD Jambi dikarakterisasi secara molekular menggunakan 16S rRNA dengan teknik
Polymerization Chain Reaction (PCR) koloni (Mirhendi et al. 2007). PCR dilakukan sebanyak 30 siklus dengan suhu annealing 55 oC menggunakan primer λF (5’-GAGTTTGATCCTGGC TCAG–γ’) dan 1510R (5’ -GGCTACCTTGTTACGA–γ’) (Govan et al. 1999). Kondisi PCR dilampirkan pada Lampiran 1. Hasil PCR divisualisasi dengan metode elektroforesis pada gel agarosa 1% dalam bufer TAE 1x (40 mM Tris-Asetat; 0.1 mM EDTA). Elektroforesis dilakukan dengan tegangan 50 V selama 45 menit. DNA hasil amplifikasi disekuens oleh jasa sekuens 1st Base. Hasil sekuens basa DNA kemudian disejajarkan dengan MEGA 5.0 dan dilakukan blast berdasarkan basis data bank gen koleksi NCBI (http://www.ncbi.nlm.nih.gov) untuk menentukan spesies bakteri xilanolitik.
Produksi Xilanase
Produksi enzim dilakukan dengan menginokulasikan 1% inokulum (0.6-0.8A, 600 nm) (1.275 x 109 sel) ke dalam 100 mL media xilan tongkol jagung 0.5% pH 6.0 (Lampiran 2). Media produksi enzim diinkubasi pada inkubator bergoyang dengan kecepatan 121 rpm selama 36 jam. Ekstrak kasar xilanase diperoleh dengan cara mensentrifugasi kultur pada kecepatan 800 x g selama 15 menit pada suhu 4 oC. Ekstrak kasar xilanase yang didapatkan diuji aktivitasnya dengan metode 3,5-Dinitrosalicylic acid (DNS) (Miller 1959). Nilai absorbansi dikonversi ke dalam konsentrasi xilosa dengan kurva standar xilosa. Aktivitas xilanase dikonversi ke dalam satuan U/mL ( mol/menit/mL) dengan formula di bawah ini. Satu unit aktivitas xilanase (1 U/mL) didefinisikan sebagai jumlah mol xilosa yang dihasilkan setiap volume mililiter enzim dalam waktu 1 menit. Aktivitas xilanase dihitung berdasarkan formula berikut:
Keterangan:
Xs = Konsentrasi xilosa pada sampel (mg/mL) t = waktu inkubasi (menit) Xk = Konsentrasi xilosa pada kontrol (mg/mL) BM xilosa = 150.3 (g/mol) FP = Faktor pengenceran
Produksi dan Pemekatan Ekstrak Kasar Xilanase
Pemekatan ekstrak kasar xilanase (0.55 U/mL) dilakukan dengan metode pengendapan. Optimasi metode pengendapan dilakukan menggunakan garam (NH4)2SO4 (amonium sulfat) dan aseton. Pengendapan menggunakan amonium sulfat dilakukan berdasarkan metode Kamble dan Jadhav (2012) dengan modifikasi. Pengendapan dilakukan dengan menambahkan 100 mL ekstrak kasar xilanase dengan amonium sulfat dingin secara bertahap dengan tingkat kejenuhan 0-30%, 30-40%, 40-50%, 50-60%, 60-70%, dan 70-80% (b/v). Penambahan amonium sulfat dilakukan pada suhu 4 oC dalam kondisi tetap teraduk dengan
12
suhu 4 oC. Endapan yang didapatkan dilarutkan dengan 1 mL bufer fosfat 50 mM pH 6.0 sebagai enzim pekat.
Pemekatan xilanase berdasarkan metode aseton dilakukan dengan menambahkan aseton dingin ke dalam ekstrak kasar enzim pada berbagai konsentrasi hingga didapatkan kondisi optimum pengendapan xilanase. Konsentrasi aseton yang diujikan yaitu pada konsentrasi 60-90% (interval 10%). Sebanyak 10 mL ekstrak kasar enzim ditambahkan dengan aseton dingin (4 oC) dengan volume tertentu berdasarkan Sana et al. (2008) sambil diaduk dengan
magnetic stirrer. Larutan tersebut kemudian disentrifugasi dengan kecepatan 600 x g di suhu 4 oC. Endapan yang terbentuk dilarutkan dalam 1 mL bufer fosfat 50 mM pH 6.0 sebagai enzim pekat. Enzim hasil pemekatan setiap konsentrasi hasil pengendapan dengan kedua metode tersebut diuji aktivitas enzimnya. Pengujian aktivitas enzim dilakukan pada suhu 40 oC, pH 6.0 dengan masa inkubasi enzim dan substrat selama 30 menit. Pengujian xilanase dilakukan dengan metode DNS (Miller 1959).
Aktivitas spesifik enzim (U/mg) dihitung dengan membandingkan aktivitas enzim terhadap kadar proteinnya. Setiap enzim hasil pemekatan pada berbagai konsentrasi amonium sulfat maupun aseton diukur kadar proteinnya menggunakan metode Bradford (1976). Sebanyak 50 L sampel enzim pekat dalam bufer fosfat 50 mM pH 6.0 direaksikan dengan β500 L larutan Bradford dalam tabung reaksi. Larutan kemudian dikocok dengan pelan dan diinkubasi selama 20 menit. Selanjutnya larutan diukur dengan spektrofotometer pada panjang gelombang 595 nm. Hasil pengukuran dimasukkan sebagai nilai y dalam persamaan regresi linier yang didapatkan dari kurva standar bovine serum albumin (BSA) (Lampiran 9). Selain itu, dihitung pula tingkat kemurnian serta yieldnya dengan formula sebagai berikut:
Analisis Produk Hidrolisis secara Kualitatif
bufer fosfat (50 mM, pH 6.0). Penotolan standar pada plat masing-masing sebanyak 1 L, sementara kontrol, ekstrak kasar xilanase pekat, substrat xilan dan bufer fosfat ditotol sebanyak 4 L. Adapun sampel produk hidrolisis ditotolkan sebanyak 2 L. Produk hidrolisis juga dianalisis derajat polimerisasinya. Derajat polimerisasi dihitung dengan membandingkan total gula terhadap gula pereduksinya. Pengujian total gula dilakukan dengan menggunakan metode fenol-sulfat (DuBois et al. 1956), sementara gula pereduksi menggunakan metode DNS (Miller 1959).
HASIL DAN PEMBAHASAN
Hasil
Ekstraksi Xilan dengan Alkali (modifikasi dari Richana et al. 2007)
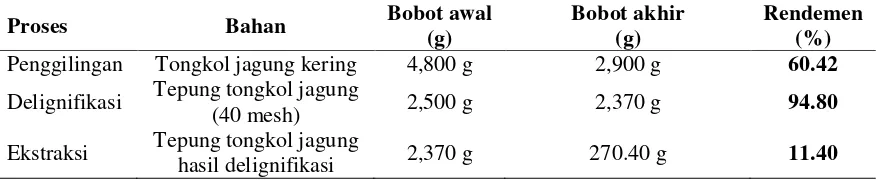
Ekstraksi xilan dengan metode alkali berhasil mendapatkan 10.82% ekstrak kasar xilan dari 2,500 g tepung tongkol jagung (Tabel 3). Metode delignifikasi dengan NaOCl 0.5% dapat mengurangi persentase lignin pada tepung tongkol jagung. Lignin pada tepung tongkol jagung yang telah didelignifikasi sebesar 16.70%. Berdasarkan uji proksimat, tongkol jagung mengandung hemiselulosa yang tinggi (37.92%), yang diduga sebagian besar sebagai xilan (Tabel 4).
Tabel 3 Neraca massa proses ekstraksi xilan dari tongkol jagung secara alkali. Delignifikasi menggunakan NaOCl 0.5% pada suhu ruang selama 1 jam. Ekstraksi menggunakan NaOH 10% pada suhu ruang selama 24 jam. Pengendapan xilan terlarut (pH netral) menggunakan etanol 95% (1:3 v/v).
Proses Bahan Bobot awal
(g)
Bobot akhir (g)
Rendemen (%)
Penggilingan Tongkol jagung kering 4,800 g 2,900 g 60.42
Delignifikasi Tepung tongkol jagung
(40 mesh) 2,500 g 2,370 g 94.80
Ekstraksi Tepung tongkol jagung
14
Tabel 4 Perbandingan analisis proksimat tepung tongkol jagung (40 mesh) pra dan pasca delignifikasi (%). Analisis proksimat terdiri atas pengujian terhadap kadar air, kadar abu, lemak, protein (AOAC 1990) dan serat kasar (van-Soest 1963).
Komposisi Delignifikasi
Pra Pasca
Serat kasar 25.15 26.09
a. Lignin 21.00 16.70
b. Selulosa 33.10 34.07
c. Hemiselulosa 17.90 37.92
Kadar air 7.99 5.11
Kadar abu 5.11 1.46
Lemak 0.54 1.53
Protein 3.23 2.00
Identifikasi 16S rRNA Xilanolitik XJ18 Asal TNBD
Hasil visualisasi gel agarosa 1% menunjukkan adanya amplikon pita DNA dengan ukuran 1500 pb (marker 1 Kb) (Gambar 6). Berdasarkan hasil sekuens basa nukleotida gen penyandi16S rRNA (Lampiran 6) didapatkan bahwa XJ18 merupakan Paenibacillus terrae (Max Ident: 97%; Query length: 1303 pb) (Lampiran 3).
Gambar 6 Elektroforegram DNA hasil PCR koloni dengan elektroforesis gel agarosa 1% (45 menit, 50V). M: Marker 1 Kb; S: Sampel isolat XJ18. Produksi dan Pemekatan Ekstrak Kasar Xilanase
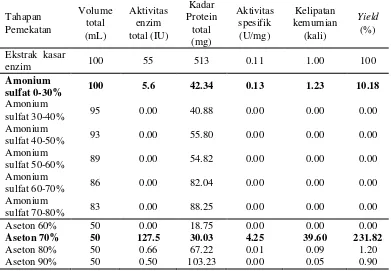
Xilanase Paenibacillus terrae XJ18 hasil pemekatan dengan amonium sulfat hanya menunjukkan aktivitas pada pengendapan menggunakan amonium sulfat 0-30% (5.6 10-2 U/mL) dengan aktivitas spesifik yang tidak mengalami peningkatan secara signifikan (0.13 U/mg). Adapun pemekatan xilanase XJ18 menggunakan aseton 70% menunjukkan peningkatan aktivitas spesifik yang meningkat hampir 5 kali (4.25 IU) dibandingkan ekstrak kasar enzim. Pemekatan xilanase XJ18 dengan menggunakan aseton 70% menunjukkan kondisi yang paling optimum dengan tingkat kemurnian yang paling tinggi dan nilai yield
sebesar 231.82% (Tabel 5).
S M
Tabel 5 Optimasi pemekatan xilanase dari Paenibacillus terrae XJ18 dengan amonium sulfat dan aseton. Aktivitas xilanase diukur menggunakan metode DNS (pH 6.0, suhu 40 oC, waktu inkubasi 30 menit)
Nilai DP xilan yang dihidrolisis menurun hingga mencapai 9 dari 74 sejak hidrolisis jam pertama dan tidak mengalami penurunan nilai DP hingga masa inkubasi jam ke-5 (Tabel 6).
Tabel 6 Perhitungan nilai derajat polimerisasi (DP) produk hidrolisis xilan tongkol jagung oleh xilanase XJ18
Sampel Total gula (mg/mL) Gula pereduksi
(mg/mL)
Ket: PH merupakan Produk hidrolisis yang direaksikan dengan enzim dengan variasi waktu inkubasi.
*Nilai merupakan hasil pembulatan
16
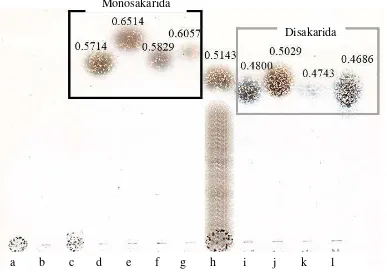
lebih rendah dibandingkan standar xilosa (RF: 0.6514) dan arabinosa (RF: 0.5829) (Gambar 7), sehingga diduga produk berupa xilobiosa. Hanya satu spot produk dan intermediet hasil pemotongan yang lebih besar muncul pada plat.
Gambar 7 Produk hidrolisis tongkol jagung xilan 0.5% dengan xilanase XJ18 (1:1) dengan KLT pada plat silika gel a. Enzim ekstrak kasar hasil pemekatan dengan aseton; b. bufer fosfat 50 mM pH 6.0; c. Substrat xilan tongkol jagung 0.5% (dalam bufer fosfat pH 6); d. Glukosa; e. Xilosa; f. Arabinosa; g. Manosa; h. Produk hidrolisis; i. Selobiosa; j. Sukrosa; k. Manobiosa; l. Maltosa.
Pembahasan
Ekstraksi xilan dengan Alkali
Hemiselulosa telah diketahui merupakan fraksi penyusun dinding sel tumbuhan. Hemiselulosa berasosiasi dengan selulosa dan lignin. Hemiselulosa mencapai hampir 40% dari total bobot kering tanaman (Yang et al. 2005). Xilan pada tongkol jagung terikat secara kovalen dengan lignin serta karbohidrat lainnya, sehingga dibutuhkan perlakuan untuk membuka ikatan tersebut dan mengekspos xilannya. Delignifikasi merupakan proses penghilangan lignin dari kompleks lignoselulosa, sehingga selulosa ataupun hemiselulosa yang saling terikat dapat terekspos dan dipisahkan. Delignifikasi dapat dilakukan dengan berbagai metode yaitu seperti metode fisik menggunakan oksigen dan tekanan, serta metode kimiawi. Metode kimiawi dapat dilakukan dengan asam klorin dan asam parasetik (Kumar et al. 2013). Metode delignifikasi oksigen menggunakan
prinsip aktivasi oksigen untuk menghilangkan lignin. Metode ini menghilangkan lignin mencapai 55%. Adapun metode kimiawi menggunakan asam klorin maupun asam parasetik dapat menghilangkan lignin mencapai 95%.
Penghilangan lignin tidak dapat dilakukan dengan sempurna. Hasil delignifikasi tongkol jagung varietas Dramaga silangan 3 menunjukkan masih terdapat 16.70% lignin. Hasil yang sama didapatkan dari penelitian Meryandini et al. (2009) yang masih menyisakan 21% lignin dari tepung tongkol jagung varietas Bisma yang diekstrak menggunakan NaOCl. Lignin dan selulosa berikatan kovalen sangat kuat, sehingga pemurnian salah satu dari bahan tersebut tidak dapat dilakukan secara sempurna (Kumar 2009).
Asam klorin berfungsi melarutkan sebagian besar dari lignin (lignin tidak larut asam). Pelepasan ikatan xilan dari lignin penting untuk mengakses xilan. Namun, penghilangan lignin secara total akan menghilangkan semua xilan dari sampel (Rowley et al. 2013). Ebringerová et al. (2005) menemukan bahwa penggunaan asam klorin (NaOCl) untuk pemutihan sebagai metode delignifikasi paling efektif, yaitu tidak menyebabkan de-asetilasi xilan secara berlebihan. Sementara penggunaaan NaOCl 7.5% dapat melarutkan xilan yang berdampak pada rendahnya tingkat ekstraksi xilan (Richana et al. 2007). Penggunaan asam parasetik akan menghilangkan lignin lebih selektif dibandingkan asam klorin pada sampel yang belum diberi perlakuan sebelumnya dan metode ini memiliki pengaruh yang sedikit terhadap struktur selulosa pada sampel. Adapun penggunaan asam klorin bersifat lebih selektif dalam menghilangkan lignin ketika sampel telah diberi pra-perlakuan menggunakan SO2 (Kumar et al. 2013).
Kandungan hemiselulosa tongkol jagung Dramaga silangan 3 lebih tinggi dibandingkan kandungan hemiselulosa tongkol jagung varietas Bisma maupun Hawaii. Kandungan hemiselulosa tongkol jagung varietas Bisma setelah didelignifikasi sebesar 30.38% dan tidak berbeda secara signifikan dengan kandungan hemiselulosa pada tongkol jagung varietas Hawaii sebesar 30.18%. Kedua varietas tongkol jagung tersebut memiliki kandungan selulosa yang tinggi yaitu mencapai 40% (Meryandini et al. 2008), sementara kandungan tongkol jagung Dramaga silangan 3 memiliki kandungan selulosa hanya sebesar 34.07%.
Ekstraksi xilan dari tongkol jagung telah diteliti menggunakan berbagai metode. Garrote et al. (2001) berhasil mengekstrak 28% xilan tongkol jagung secara fisik, yaitu menggunakan hydro-thermal dengan 6 pisau yang digerakkan oleh turbin. Yang et al. (2005) mengembangkan metode preparasi menggunakan asam sulfur terlarut untuk meningkatkan ekstraksi xilan. Hasilnya menunjukkan ekstraksi xilan dengan suhu tinggi meningkatkan tingkat ekstraksi, namun juga berdampak pada tingginya jumlah gula pereduksi yang dihasilkan. Selain itu, ekstraksi xilan juga telah diinvestigasi menggunakan kekuatan suara ultra (Yang
et al. 2009) dan microwave (Wanitwattanaramulg et al. 2012). Panthapulakkal dan Sain (2013) menggabungkan metode alkali dengan microwave dan mendapatkan ekstrak xilan dari Birchwood sebesar 72.5%.
18
KOH dan NaOH sering digunakan untuk mengekstraksi xilan (Ebringerová dan Heinze 2000). NaOH digunakan untuk melarutkan xilan dan menghilangkan α-selulosa yang bersifat tidak larut dalam NaOH. Richana et al. (2007) menemukan xilan lebih larut pada NaOH 10 % dibandingkan air panas. Xilan memiliki kelarutan lebih rendah pada air dingin, dan xilan tidak larut sama sekali pada asam (HCl 1N). Penelitian ekstraksi xilan dengan mengoptimasi konsentrasi alkali yang digunakan telah dilakukan. Semakin meningkatnya konsentrasi alkali yang digunakan akan menghasilkan tingkat ekstraksi yang tinggi. Richana et al. (2007) berhasil mendapatkan rendemen xilan sebesar 12.95% dari tongkol jagung dengan NaOH 10%, sementara Yao (2011) menggunakan NaOH 25% dan mendapatkan rendemen xilan sebesar 24.39%. Rendemen xilan yang berhasil diperoleh dari tepung tongkol jagung Dramaga silangan 3 (11.40%) lebih besar dibandingkan rendemen yang didapatkan dari varietas Bisma (9.26%) dan varietas Hawaii (9.94) menggunakan metode ekstraksi yang sama. Hal ini menunjukkan terdapat variasi komposisi tongkol jagung pada ketiga varietas jagung tersebut. Identifikasi 16S rRNA Xilanolitik XJ18 Asal TNBD
Ekstraksi xilanolitik XJ18 menggunakan teknik PCR koloni berhasil dilakukan. Prinsip mesin PCR adalah menggunakan siklus pemanasan dan pendinginan yang berulang untuk reaksi mendenaturasi DNA serta replikasi DNA secara enzimatis. Campuran reaksi dalam PCR mengandung beberapa komponen, yaitu DNA yang menjadi cetakan yang akan diamplifikasi; sepasang primer untuk menginisiasi titik mulai sintesis DNA; deoxynucleoside triphosphates (dNTPs) sebagai nukleotida yang akan digunakan dalam sintesis DNA baru; larutan bufer untuk menjaga lingkungan reaksi optimum; serta kation monovalen dan divalen sebagai kofaktor enzim yang digunakan dalam proses amplifikasi. Pada PCR koloni, DNA yang menjadi cetakan langsung berasal dari dalam sel yang dilisis, sehingga tidak dibutuhkan proses ekstraksi DNA. Cetakan DNA yang didapatkan dari proses denaturasi sel bersifat tidak murni, namun penggunaan primer yang bersifat spesifik untuk menempel pada daerah gen penyandi 16s rRNA akan mampu mengamplifikasi gen target spesifik.
Proses PCR umumnya terdiri atas 30 – 40 siklus berulang (Lampiran 5- Seg 3). Setiap siklus terdiri atas 3 proses utama, yaitu denaturasi DNA, penempelan primer (annealing), dan pemanjangan (elongasi) (Gambar 8). Denaturasi yaitu proses menjadikan DNA menjadi utas tunggal menggunakan mekanisme pemanasan mencapai 90 – 95 oC. Ketika proses pemanasan semua reaksi enzimatis akan terhenti, selanjutnya dilanjutkan dengan proses annealing.
Gambar 8 Proses siklus PCR (Vierstraete 2014).
Namun pada kenyataannya, efisiensi PCR tidak pernah mencapai 100% setiap siklusnya. Salah satu kesalahan yang muncul yaitu miss-match akibat kesalahan pemasangan nukleotida selama sintesis DNA. Berbagai tingkat eror telah dilaporkan untuk DNA polimerase yang berbeda (Keohavang dan Thilly 1989). Efisiensi juga tidak tercapai karena amplifikasi tidak selalu selesai dengan sempurna untuk setiap siklusnya. Hal teersebut dapat diakibatkan kegagalan primer dalam proses annealing atau kegagalan elongasi ketika primer berikatan dengan DNA cetakan pada posisi yang salah (Sun 1995). Ukuran target amplikon berhasil didapatkan sekitar 1500 pb. Setelah disekuens dilakukan pemilihan nukleotida yang dianggap memiliki tingkat akurasi tinggi, dan didapatkan 1303 pb yang digunakan untuk dibandingkan dengan basis data koleksi NCBI.
Xilanase telah banyak ditemukan diproduksi oleh berbagai mikroorganisme, baik dari cendawan maupun bakteri. Salah satu genus bakteri yang banyak ditemukan memproduksi xilanase yaitu Paenibacillus. Berdasarkan identifikasi 16S rRNA, XJ18 bukan merupakan spesies baru dan memiliki kesamaan 97% dengan Paenibacillus terrae. Paenibacillus merupakan genus yang bersifat anaerob fakultatif dan pembentuk endospora. Sebelum tahun 1993, genus ini disatukan dengan Bacillus dikarenakan kemiripannya, sehingga genus ini disebut
Paenibacillus. Kata Paene diambil dari Bahasa latin yang berarti hampir/mirip. Genus ini dapat ditemukan pada tanah, air, rhizosphere, bahan sayuran, pakan, larva serangga, hingga sampel klinis (McSpadden 2004; Montes et al. 2004; Ouyang et al. 2008; Lal dan Tabacchioni 2009).
20
tanaman dan berperan sebagai biofertilizer dan antagonis terhadap patogen akar seperti nematoda, bakteri, serta fungi (Govindasamy et al. 2011). Paenibacillus
menghasilkan metabolit yang dapat digunakan dibidang medis sebagai penghasil antimikroba (Fortes et al. 2006) dan polymyxin E (DeCrescenzo et al. 2007).
Paenibacillus telah banyak dilaporkan sebagai penghasil enzim ekstraseluler, seperti pektit liase (Boland et al. 2010) dan xilanase. Beberapa spesies yang telah dilaporkan memproduksi xilanase diantaranya yaitu seperti P. barcinonensis sp. (Sanchez et al. 2005), P. campinasensis BL11 (Han et al. 2010), P. thailandensis
sp., P. nanensis sp. (Khianngam et al. 2009), P. terrae (Shin et al. 2012) dan P. motaniterrae (Arora et al. 2013).
Produksi dan Pemekatan Ekstrak Kasar Xilanase
Pengendapan enzim merupakan metode yang ideal untuk memekatkan enzim. Tahapan ini merupakan tahapan awal dalam melakukan purifikasi enzim. Metode ini dapat dilakukan dalam skala besar dan tidak terpengaruh oleh bahan pengotor, dibandingkan dengan metode kromatografi. Beberapa bahan yang digunakan untuk pengendapan enzim yaitu amonium sulfat (Burgess 2009), dan pelarut organik seperti metanol, etanol, propanol, dan aseton (Mukerjea et al. 2010). Salting-out protein umumnya dilakukan dengan amonium sulfat dikarenakan kelarutannya yang tinggi, tidak bersifat korosif, toksisitasnya rendah, dan murah. Penambahan amonium sulfat meningkatkan kekuatan ikatan ionik dalam larutan karena amonium sulfat mereduksi efek tolak-menolak antara muatan molekul identik pada protein. Selain itu, amonium sulfat juga mereduksi mantel air sekeliling protein, sehingga kelarutan proteinnya menurun dan membentuk agregat antar-molekul protein. Hasil yang reproducible hanya didapatkan ketika konsentrasi protein, suhu, dan pH tetap konstan (Burgess 2009). Beberapa enzim tidak dapat bertahan ketika diendapkan dengan amonium sulfat. Hal ini dapat disebabkan, garam yang jenuh dapat mempengaruhi ikatan ionik yang membentuk struktur tersier/kuartener enzim dan menyebabkan perubahan konformasi situs aktif enzim. Penggunaan jenis garam lain dapat digunakan, namun penggunaan pelarut organik menjadi alternatif favorit. Pelarut organik dapat mengendapkan protein dengan mereduksi dielektrik pada media sehingga menurunkan kelarutan protein karena daya tarik menarik akan lebih besar antar-protein dibandingkan protein dan larutan. Xilanase Paenibacillus terrae XJ18 optimum dipekatkan dengan aseton 70%. Kondisi yang sama ditemukan pada xilanase dari Streptomyces spp. 234P-16 (Meryandini et al. 2009). Aseton mengendapkan protein yang bersifat lebih asam dan hidrofilik (Thongboonkerd et al. 2002). Hal tersebut menunjukkan bahwa xilanase dari
Paenibacillus terrae XJ18 memiliki residu protein yang bersifat asam dan hidrofilik.
Analisis Produk Hidrolisis secara Kualitatif
arabinoglukuronoxilan yang memiliki sedikit cabang, umumnya tidak larut dalam air (wis-X) dan struktur xilan yang memiliki banyak cabang dan merupakan heteroxilan yang larut air (ws-X). Ws-X dapat digunakan sebagai material tambahan dalam makanan dikarenakan aktivitas emulsinya dan kemampuannya untuk menstabilisasi pembentukan busa protein selama proses pemanasan. Struktur xilan wis-X memiliki kemampuan tetap utuh dalam lingkungan perut dan saluran pencernaan, sehingga material ini dapat digunakan dalam bidang kesehatan sebagai pembawa obat yang spesifik terhadap kolon (Silva et al. 2007; Oliveira et al. 2010).
Terdapat perbedaan yang kecil antar-keluarga rumput-rumputan dengan serealia berdasarkan variasi gula penyusunnya, namun terdapat variasi yang besar dari tipe ikatannya. Adapun xilan yang berasal dari kayu keras (hardwood) umumnya terikat dengan asam 4-O-metil- -D- glukuronik pada C2, sementara sebanyak 70% terasetilasi pada C2 dan C3 unit kerangka dasar xilopiranosanya (Gambar 9). Keberadaan gugus yang terikat dengan gugus ester (residu asetil, feruloil dan p-koumaril) akan terlarut dan hilang ketika xilan diekstraksi menggunaan metode alkali (Corral dan Ortega 2006). Berdasarkan hasil KLT pada plat, tidak terdapat produk berbentuk monosakarida (xilosa dan arabinosa) dan terlihat produk dengan ukuran yang lebih besar. Perbedaan nilai RF antar-standar disakarida dapat mengindikasikan produk hidrolisis sebagai 4-O- -D-xylopiranosil- -D-xilosa (xilobiosa), bentuk disakarida dari monomer xilosa (Gambar 10).
22
Gambar 10 Struktur unit penyusun xilan. a. xilosa; b. xilobiosa; c. xilotriosa (Kim dan Ralph 2014).
Penentuan total konsentrasi gula dalam suatu larutan penting dilakukan dalam berbagai bidang penelitian. Penentuan total gula dapat digunakan untuk menghitung nilai DP suatu larutan. Sejak dulu telah dikembangkan berbagai metode untuk mengukur total konsentrasi gula, diantaranya yaitu dengan kromatografi (Mason dan Slover 1971), elektroforesis kapiler (Cortacero-Ramirez
et al. 2004), Spektrofotometri IR (Wang et al. 2011), deteksi light scattering
(Zhang et al. 2008), dan spektroskopi nuclear magnetic resonance (NMR) (Duquesnoy et al. 2008). Metode-metode tersebut membutuhkan peralatan yang canggih, biaya yang besar, keahlian khusus, serta mengkonsumsi banyak waktu. Salah satu metode penentuan total gula yang murah, mudah, dan menggunakan alat sederhana yaitu metode pewarnaan yang menggunakan fenol (C6H5OH) (DuBois et al. 1956) dan anthrone (C14H10O) (Dreywood 1946). Prinsip metode pewarnaan ini yaitu menentukan konsentrasi karbohidrat berdasarkan reaksi karbohidrat yang terhidrolisis dengan reagen pewarna yang dapat dideteksi pada spektrum elektromagnetik sinar tampak. Metode fenol-sulfat merupakan metode yang paling banyak digunakan hingga saat ini. Metode tersebut bergantung pada dehidrasi dari sakarida yang terhidrolisis menjadi turunan furfural selama masa reaksi dengan asam sulfat pekat (Lima et al. 2010).
Nilai DP xilan tongkol jagung yang diekstraksi didapatkan sebesar 73. Menurut Kulkarni et al. (1999), Nilai DP kayu keras berkisar antara 150-200, sementara kayu lunak dan keluarga dari rumput-rumputan berkisar antara 70-130 residu b-xylopiranosa. Aktivitas enzim dalam menghidrolisis substrat optimum terjadi sejak hingga jam pertama inkubasi. Hal ini ditunjukkan dari nilai DP yang sama dari waktu inkubasi selama 1 jam hingga 5 jam. Nilai DP produk hidrolisis yang didapatkan mendukung hasil KLT. Nilai DP 9 hasil hidrolisis dengan xilanase dari Paenibacillus terrae XJ18 yang merupakan rerata jumlah xilobiosa (dua unit xilosa) yang terbentuk dan polimer xilan dengan ukuran yang masih besar (Gambar 7). Hasil tersebut mengindikasikan bahwa xilanase dari
Paenibacillus terrae XJ18 dengan pH optimum 6.0 dan suhu optimum 40 oC hanya mengenali dua unit xilosa dari ujung akhir rantai utama xilan dan memediasi hidrolisis ikatan -1.4, sehingga memproduksi xilobiosa dan intermediet yang lebih besar (Gambar 11a-b). Walaupun pada media produksi enzim digunakan sukrosa sebagai sumber karbon, setelah pemekatan enzim menggunakan aseton tidak terdapat spot produk sukrosa. Hasil analisis bufer
b). Xilobiosa
fosfat juga terlihat bersih dari produk gula. Pada substrat pun tidak terlihat spot yang termigrasi yang menunjukkan bahwa substrat masih memiliki ukuran yang besar sehingga tidak terbawa oleh migrasi eluen yang bersifat semi polar (Gambar 7). Hal tersebut mengindikasikan bahwa spot xilobiosa yang termigrasi pada plat merupakan hasil produk hidrolisis enzim xilanase dari Paenibacillus terrae XJ18 terhadap xilan tongkol jagung. Hal yang sama juga ditemukan oleh Kubata et al. (1994). Ia menemukan xilanase dari Aeromonas caviae ME-1 yang hanya memproduksi xilobiosa secara eksklusif dari xilan oat spelt dan birchwood.
Xilobiosa merupakan bentuk disakarida dari monomer xilosa (Gambar 10). Hingga saat ini, aplikasi penggunaan xilobiosa belum banyak dilakukan. Produksi ataupun sintesis xilobiosa telah dilakukan hanya sebatas sebagai bahan analisis laboratorium saja. Namun, pemanfaatan xilobiosa dapat dilanjutkan dengan menghidrolisisnya menjadi bentuk monomernya menggunakan enzim 1.4- -D-xilosidase yang akan memutus xilobiosa menjadi xilosa (Gambar 11b). Aplikasi xilosa telah banyak dilakukan sebagai material untuk memproduksi biofuel seperti etanol (Zhang dan Geng 2012; Watanabe et al. 2007). Selain itu, xilosa dapat direduksi menjadi xilitol secara enzimatis dengan xilosa reduktase (aldose reductase, EC 1.1.1.21) (Usvalampi 2013) (Gambar 12). Xilitol merupakan jenis poli-alkohol (poliol) yang memiliki 5 karbon gula alkohol. D-xilitol menarik perhatian dunia dikarenakan keunikan sifatnya dan potensi aplikasinya yang banyak. D-xilitol merupakan gula yang tingkat kemanisannya hampir sama dengan sukrosa, namun memiliki nilai indeks glikemik yang lebih rendah dibandingkan sukrosa. Sukrosa memiliki kalori sebesar 4.0 kal/g, sementara d-xilitol sebesar 2.4 kal/g (Mäkinen 2000). Sifatnya yang juga tidak dapat diabsorbsi sempurna oleh tubuh, menjadikan xilitol digunakan sebagai substitusi gula dalam produk pangan, terutama bagi pasien penderita diabetes dan penderita gangguan metabolisme lemak.
24
Xilitol banyak digunakan dalam industri odontologi dikarenakan sifatnya yang antikariogenik (menghambat pembentukan karies gigi), menghambat pertumbuhan bakteri penyebab kerusakan gigi, menghambat pertumbuhan plak, menekan keasaman plak, mempercepat proses pembentukan mineral gigi (Maguire dan Rugg-Gunn 2003). Dikarenakan memiliki 5 karbon gula, xilitol tidak dapat dimetabolisme dan tidak dapat menjadi gula sumber karbon untuk pertumbuhan bakteri. Maka xilitol digunakan sebagai pencegah infeksi telinga dan saluran pernapasan atas. Xilitol juga berperan dalam menjaga densitas tulang dan mencegah osteoporosis karena sifatnya yang meningkatkan penyerapan kalsium pada usus (Hämäläinen et al. 1985). Berdasarkan keuntungan-keuntungan tersebut, xilitol telah banyak digunakan sebagai pemanis untuk substitusi gula di berbagai industri, seperti industri permen karet, farmasi, serta berbagai produk kesehatan mulut (pelega tenggorokan, obat kumur, dan pasta gigi).
Gambar 12 Mekanisme konversi xilosa menjadi xilitol dan turunannya (Usvalampi 2013)
SIMPULAN DAN SARAN
Simpulan
Isolat XJ18 yang teridentifikasi sebagai Paenibacillus terrae menghasilkan xilanase yang diduga bersifat asam dan hidrofilik. Pemekatan xilanase dengan aseton 70% meningkatkan aktivitasnya sebesar 4.59 kali. Hidrolisis xilan tongkol jagung oleh xilanase dari Paenibacillus terrae XJ18 (pH optimum 6.0, dan suhu optimum 40 oC) diduga hanya menghasilkan xilobiosa. Xilanase dari
xilosa pada ujung akhir sehingga menghasilkan xilobiosa dan menyisakan polimer xilan yang masih berukuran besar.
Saran
Uji xilanase menggunakan substrat spesifik o- atau p-nitrophenyl- -D-xylo pyranoside (oNP-X or pNP-X), o- atau p-nitrophenyl- -D-xylooligosaccharides (oNP-Xn) dan o-Nitrophenyl- -D-xylobioside (oNP-X2) diperlukan untuk menegaskan jenis xilanase yang dihasilkan. Selain itu, diperlukan SDS PAGE untuk mengetahui jumlah jenis xilanase yang dihasilkan oleh Paenibacillus terrae
XJ18, sehingga dapat menegaskan jumlah enzim xilanase yang dihasilkan.
DAFTAR PUSTAKA
Aachary AA, Prapulla SG. 2011. Xylooligosachharides (XOS) as an emerging prebiotic: microbial synthesis, utilization, structural characterization, bioactive properties, and applicationsn [review]. Food Sci Food Saf. 10(1): 1-15. doi: 10.1111/j.1541-4337.2010.00135.x.
Adeola O, Bedford MR. 2004. Exogenous dietary xylanase ameliorates viscosity-induced anti-nutritional effects in wheat-based diets for white peckin ducks (Anas platyrinchos domesticus). Br J Nutr. 92:87-94. doi:10.1079/BJN20041180.
Agnihotri S, Dutt D, Tyagi CH, Kumar A, Upadhyaya JS. 2010. Production and biochemical characterization of a novel cellulase-poor alkali-thermo-tolerant xylanase from Coprinellus disseminatus SW-1 NTCC 1165. World J Microbiol Biotechnol. 26: 1349–1359.
[AOAC]. Association of Official Analytical Chemists. 1984. Official Methods of Analysis, 14th ed. Virginia (US): AOAC.
Arora A, Krishna P, Malik V, Reddy MS. 2013. Alkalistable xylanase production by alkalitolerant Paenibacillus montaniterrae RMV1 isolated from red mud.
J Basic Microbiol. doi: 10.1002/jobm.201300357 .
Bal A, Chanway CP. 2012. Evidence of nitrogen fixation in lodgepole pine inoculated with diazotrophic Paenibacillus polymyxa. Botany. 90(9):891-896.doi: 10.1139/b2012-044.
Barry V, Dillon T. 1940. Occurrence of xylans in marine algae. Nature. 146: 620-620.
Beg QK, Kapoor M, Mahajan L, Hoondal GS. 2001. Microbial xylanases and their industrial applications. Rev Appl Microbiol Biotechnol. 56(3-4):326-338.doi:10.1007/s002530100704.
Belgacem MN, Gandini A. 2008. Lignins as components of macromolecular materials. Monomers, polymers and composites from renewable resources. 1: 243-271. ISBN 978-0-08-045316-3.
26
Boland WE, Henriksen ED, Peterson JD. 2010. Characterization of two
Paenibacillus amylolyticus strain 27C64 pectate lyases with activity on highly methylated pectin. Appl Environ Microbiol. 76(17):6006-6009.doi: 10.1128/AEM. 00043-10.
[BPS] Badan Pusat Statistik. 2013. Produksi Tanaman Jagung Indonesia [terhubung berkala] http://www.bps.go.id/tnmn_pgn.php. Jakarta (ID): BPS RI.
Bradford MM. 1976. Rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 72(2): 248-254
Burgess RR. 2009. Protein precipitation techniques. Methods Enzymol. 463:331-342.doi: 10.1016/S0076-6879(09)63020-2.
Cao Q, Xie KC, Lv YK, Bao WR. 2006. Process effects on activated carbon with large specific surface area from corn cob. Biores Technol. 97:110-115. doi: 10.1016/j.biortech.2005.02.026
Chen M, Xia L, Xue P. 2007. Enzymatic hydroliysis of corncob and ethanol production from cellulosic hydrolysate. Int Biodet Biodeg. 59(2):85-89.doi: 10.1016/j.ibiod.2006.07.011.
Comin LM, Temelli F, Saldaña MDA. 2012. Impregnation of flax oil in pregelatinized corn starch using supercritical CO2. J Supercritical Fluids. 61: 221-228.doi: 10.1016/j.supflu.2011.08.013.
Corral OL, Ortega FV. 2006. Xylanases. Adv Agric Food Biotechnol. 37:305-322. ISBN: 81-7736-269-0.
Cortacero-Ramirez S, Segura-Carretero A, Cruces-Blanco C, de-Castro M, Fernandez-Gutierrez A. 2004. Analysis of carbohydrates in beverages by capillary electrophoresis with precolumn derivatization and UV detection.
Food Chem. 87(3): 471–476.
DeCrescenzo HE, Philips DR, Peterson JB. 2007. Polymyxin E production by P. amylolyticus. Lett Appl Microbiol. 45(5):491-496.
Dreywood R. 1946. Qualitative test for carbohydrate material. Ind Eng Chem Anal. 18:499.
DuBois M, Gilles K, Hamilton J, Rebers P, Smith F. 1956. Colorimetric method for determination of sugars and related substances. Anal Chem. 28(3):350– 356.
Duquesnoy E, Castola V, Casanova J. 2008. Identification and quantitative determination of carbohydrates in ethanolic extracts of two conifers using C-13NMR spectroscopy. Carbohydr Res. 343(5): 893–902.
Ebringerová A, Hromadkova Z, Kacurakova M, Antal M. 1994. Quaternized xylans: synthesis and structural characterization. Carbohydr Polym. 24(2): 301-308.
Ebringerová A, Heinze T. 2000. Xylan and xylan derivatives—biopolymers with valuable properties, 1—naturally occurring xylans structures, procedures and properties. Macromol Rapid Comm. 21(9):542–556.
Ebringerová A. 2005. Structural diversity and application potential of hemicelluloses. Macromol Symp. 232(1): 1-12. ISSN 1521-3900.
the rhizosphere of Kalanchoe brasiliensis. Microbiol Res. 163(2):200-207. doi: 10.1016/j.micres.2006.05.003.
Garrote G, Herminia D, Parajo JC. 2001. Kinetic modeling of corncob autohydrolysis. Process Biochem. 31: 571-578.
Govan VA, Allsopp MH, Davison S. 1999. A PCR detection method for rapid identification Panibacillus larvae. Appl Environ Microbiol. 65(5):2243-2245. Govindasamy V, Senthilkumar M, Magheshwaran V, Kumar U, Bose P, Sharma
V, Annapurna K. 2011. Bacillus and Paenibacillus spp.: potential PGPR for sustainable agriculture. Microbiol Monogr. 18:333-364.
Habibi Y, Vignon MR. 2005. Isolation and characterization of xylans from seed pericarp of Argania spinosa fruit. Carbohydr Res. 340(7): 1431-1436. ISSN 0008-6215.
Han CK, Lin Z, Tu J, Tsai C, Liu C, Chen H, Wang T. 2010. Xylanase production by Paenibacillus campinasensis BL11 and its pretreatment of hardwood kraft pulp bleaching. Int Biodet Biodeg. 64(1):13-19.
Hämäläinen MM, Mäkinen KK, Parviainen MT, Koskinen T. 1985. Peroral xylitol increases intestinal calcium absorption in the rat independently of vitamin D action. Miner Electrolyte Metab. 11(3):178-81.
Howard RL, Abotsi E, Jansen-van-Ransberg EL, Howard S. 2003. Lignocellulose biotechnology: issues of bioconversion and enzyme production. AJB. 2(12):602-619.
Igathinathane C, Womac AR, Sokhansanj S, Pordesimo LO. 2006. Mass and moisture distribution in aboveground components of standing corn plants.
ASABE. 49 (1): 97-106.
Iriany RN, Yasin HG, Takdir M. 2007. Asal, Sejarah, Evolusi, dan Taksonomi Tanaman Jagung. Balai Penelitian dan Pengembangan Pertanian. Bogor (ID): Pusat Penelitian dan Pengembangan Tanaman Pangan.
Jeevan P, Nelson R, Rena AE. 2011. Optimization studies on acid hydrolysis of corn cob hemicellulosic hydrolysate for microbial production of xylitol. J Microbiol Biotech Res. 1 (4): 114-123.doi: 73390362/2011.
Kamat S, Khot M, Zinjarde S, Ravi-Kumar A, Gade WN. 2013. Coupled production of single cell oil as biodiesel feedstock, xylitol and xylanase from sugarcane bagasse in a biorefinery concept using fungi from the tropical mangrove wetlands. Biores Technol. 135:246-253.
Kamble RD, Jadhav AR. 2012. Isolation, purification, and characterization of xylanase produced by a new species of Bacillus in solid state fermentation.
Int J Microbiol. 2012: 1-8. doi:10.1155/2012/683193.
Keohavang P, Thilly WG. 1989. Fidelity of DNA polymerases in DNA amplification. Proc Natl Acad Sci. 86:9253-9257.
Khianngam S, Akaracharanya A, Tanasupawat S, Lee KC, Lee J. 2009.
Paenibacillus thailandensis sp. nov. and Paenibacillus nanensis sp. nov., xylanase-producing bacteria isolated from soil. IJSEM. 59(3):564-568. Kim H, Ralph J. A gel-state 2D-NMR method for plant cell wall profiling and
analysis: a model study with the amorphous cellulose and xylan from ball-milled cotton linters. RSC Adv. 4:7549-7560.doi: 10.1039/C3RA46338A. Kubata BK, Suzuki T, Horitsu H, Kawai K, Takamizawa K. 1994. Purification
28
produces exclusively xylobiose from xylan. Appl Environ Microbiol 60(2): 531-535.
Kulkarni N, Shendye A, Rao M. 1999. Molecular and biotechnological aspects of xylanases. FEMS Microbiol Rev. 23: 411–456.
Kumar KB, Balakrishnan H, Rele MV. 2004. Compatibility of alkaline xylanases from an alkaliphilic Bacillus NCL (87-6-10) with commercial detergents and proteases. J Ind Microbiol Biotechnol. 31(2): 83-87.doi:10.1007/s10295-004-0119-8.
Kumar S, Negi YS, Upadhyaya JS. 2010. Studies on characterization of corn cob based nanoparticles. Adv Mat Lett. 1(3): 246-253.
Kumar R. Access of cellulase to cellulose and lignin for poplar solids produced by leading pretreatment technologies. Biotechnol Prog. 25(3):807-819.
Kumar R, Hu F, Hubbel CA, Ragauskas AJ, Wyman CE. 2013. Comparison of laboratory delignification methods, their selectivity, and impacts on physiochemical characteristics of cellulosic biomass. Biores Technol. 130:372-381.
Kurrataa’yun. β01γ. Isolasi dan Pencirian Xilanase dari Bakteri asal Tanah Hutan Taman Nasional Bukit Duabelas, Jambi, Indonesia [skripsi]. Bogor (ID): Bogor Agricultural University.
Lal S, Tabacchioni S. 2009. Ecology and biotechnological potential of
Paenibacillus polymyxa: a mini-review. Indian J Microbiol. 49:2-10.
Li X, Shi X, Wang M, Du Y. 2011. Xylan chitosan conjugate - A potential food preservative. Food Chem. 126(2): 520-525. ISSN 0308-8146.
Li Z, Qu H, Li C, Zhou X. 2013. Direct and efficient xylitol production from xylan by Saccharomyces cerevisiae through transcriptional level and fermentation processing optimizations. Biores Technol. 149:413-419.
Lima S, Antunes MM, Fernandes A, Pillinger M, Ribeiro MF, Valente AA. 2010. Acid-catalysed conversion of saccharides into furanic aldehydesin the presence of three-dimensional mesoporous al-tud-1. Molecules. 15(6):3863– 3877.
Ma Y, Zhan J, Chen S. 2007. Paenibacillus zanthoxyli sp. nov., a novel nitrogen-fixing species isolated from the rhizosphere of Zanthoxylum simulans.
IJSEM. 57(4):873-877.doi:10.1099/ijs.0.64652-0.
Maguire A, Rugg-Gunn AJ. 2003. Xylitol and caries prevention-is a magic bullet?. 2003. Brit Dent J. 194(8):429-436.
Mäkinen K. 2000. The rocky road of xylitol to its clinical application. J Dent Res. 79(6):1352-1355.
Mason BS, Slover HT. 1971. Gas-chromatographic method for the deter-mination of sugars in foods. J Agric Food Chem. 19(3):551–554.
McSpadden GBB. 2004. Ecology of Bacillus and Paenibacillus spp. in agricultural systems. Phytopatology. 94:1252-1258.
Meryandini A, Hendarwin T, Fahrrurozi, Akhdiya A, Saprudin D, Lestari Y. 2009. Characterization and purification a specific xylanase showing arabinofuranosidase activity from Streptomyces spp. 234P-16. Biodiversitas
9(3):115-119.