DOSIS EFEKTIF NA-TIOSULFAT SEBAGAI ANTIDOTUM
UNTUK KERACUNAN SIANIDA PADA MENCIT JANTAN GALUR SWISS
HALAMAN SAMPUL
SKRIPSI
Diajukan Untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Ilmu Farmasi
Oleh :
Andrew Arief Sudarmono NIM : 04 8114 132
FAKULTAS FARMASI
DOSIS EFEKTIF NA-TIOSULFAT SEBAGAI ANTIDOTUM
UNTUK KERACUNAN SIANIDA PADA MENCIT JANTAN GALUR SWISS
HALAMAN JUDUL
SKRIPSI
Diajukan Untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Ilmu Farmasi
Oleh :
Andrew Arief Sudarmono NIM : 04 8114 132
FAKULTAS FARMASI
DOSIS EFEKTIF NA-TIOSULFAT SEBAGAI ANTIDOTUM
HALAMAN PERSEMBAHAN
What is there that is not poison?
A ll things are poison and nothing (is)
without poison. S olely the dose
determines that a thing is not a poison
(P aracelcus, 1493- 1541)
With all my love, for
P api, M ami, K o George, K o Charles
A lmamaterku,
LEMBAR PERNYATAAN PERSETUJUAN
PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS
Yang bertanda tangan di bawah ini, saya mahasiswa Universitas Sanata Dharma : Nama : Andrew Arief Sudarmono
Nomor Mahasiswa : 04 8114 132
Demi pengembangan ilmu pengetahuan, saya memberikan kepada Perpustakaan Universitas Sanata Dharma karya ilmiah saya yang berjudul:
DOSIS EFEKTIF NA-TIOSULFAT SEBAGAI ANTIDOTUM UNTUK KERACUNAN SIANIDA PADA MENCIT JANTAN GALUR SWISS
beserta perangkat yang diperlukan (bila ada). Dengan demikian saya memberikan kepada Perpustakaan Universitas Sanata Dharma hak untuk menyimpan, mengalihkan dalam bentuk media lain, mengelolanya dalam bentuk pangkalan data, mendistribusikan secara terbatas, dan mempublikasikannya di Internet atau media lain untuk kepentingan akademis tanpa perlu meminta ijin dari saya maupun memberikan royalti kepada saya selama tetap mencantumkan nama saya sebagai penulis.
Demikian pernyataan ini yang saya buat dengan sebenarnya. Dibuat di Yogyakarta
Pada tanggal : 28 Juli 2008
Yang menyatakan
PRAKATA
Puji dan syukur penulis panjatkan kepada Bapa di Surga dan Tuhan Yesus
Kristus karena atas berkat, hikmat, kasih, kekuatan, dan cinta-nya yang diberikan
sehingga penulis dapat menyelesaikan skripsi yang berjudul ”Dosis Efektif Natrium Tiosulfat sebagai antidotum untuk keracunan sianida pada mencit jantan
galur swiss”.
Skripsi ini disusun sebagai tugas akhir untuk memenuhi salah satu syarat
guna memperoleh gelar Sarjana Strata satu Farmasi (S. Farm.), program Studi
Ilmu Farmasi Fakultas Farmasi Universitas Sanata Dharma, Yogyakarta. Sekaligus untuk menambah pengetahuan dalam dunia kefarmasian pada
umumnya.
Pada Kesempatan ini, penulis mengucapkan terima kasih atas segala
bantuan yang penulis terima baik secara langsung maupun tidak langsung
sehingga penulis dapat menyelesaikan skripsi ini.
Ucapan terima kasih yang tulus khususnya penulis tujukan kepada :
1. Bapa di surga atas kasih dan karunia-nya yang telah memberi kekuatan yang
tak terduga.
2. Rita Suhadi, M.Si., Apt. selaku Dekan Fakultas Farmasi Universitas Sanata
Dharma Yogyakarta.
3. Ipang Djunarko, S.Si., Apt. selaku dosen pembimbing yang telah
bersama penulis selama proses penelitian, penyusunan, hingga selesainya skripsi ini.
4. Drs. A. Tri Priantoro, M.For.Sc. selaku dosen penguji, yang telah memberikan
banyak dukungan, saran, dan kritikan yang membangun.
5. dr. Fenty, M.Kes., Sp.PK selaku dosen penguji, yang telah memberikan
banyak dukungan, saran, dan kritikan yang membangun.
6. dr.Luciana Kuswibawati, M.Kes selaku dosen pembimbing dalam pembacaan
histopatologi organ atas saran dan masukannya.
7. Rm. Drs. P. Sunu Hardiyanto, S.Si , S.J selaku dosen pembimbing dalam
analisis data statistik atas saran dan masukannya.
8. Yosef Wijoyo, M.Si., Apt selaku dosen pembimbing dalam penambahan literatur.
9. Papi terima kasih atas doa, bimbingan dan dukungannya untuk dapat
menyelesaikan skripsi ini dengan baik.
10.Mami yang selalu memberikan semangat dari surga, terima kasih atas doa dan
bimbingannya selama ini.
11.George dan Charles, kakak-kakakku, terima kasih atas dukungan, saran, kritik
dan doanya, Thank you for being my”super” brother
12.Mas Pardjiman, Mas Heru, Mas Kayat (laboran Laboratorium Farmakologi
dan Toksikologi), Mas Sigit dan Mas Wagiran (laboran Laboratorium Biologi
13.Pak Agus (laboran Laboratorium Farmakologi) Fakultas Farmasi Universitas Gadjah Mada, Pak Surono (UPHP) Fakultas Kedokteran Hewan Universitas
Gadjah Mada, atas bantuannya dalam menyediakan hewan uji.
14.Pak Dian di Laboratorium Patologi, Balai Penyidikan dan Pengujian Veteriner
Wilayah IV Daerah Istimewa Yogyakarta atas bantuannya dalam pembuatan
preparat histopatologi organ.
15.Untuk om-eg terima kasih atas dukungan,bimbingan dan
wejangan-wejangannya selama ini.
16.Untuk Shintia Legasari terima kasih atas kesabaran, dukungan, kasih, sayang
dan cinta-nya selama ini dan khususnya pendampingan pada saat penyusunan
skripsi ini.
17.Teman-teman senasib seperjuangan dalam rangkaian penelitian ini Tintuz,
Blian buat semua dukungan, kebersamaan, selama melakukan penelitian di
laboratorium.
18.Lidia-epez, Arie-Gozonk, Blian, Cin, Novi-kebo, Cika-tembong, Nike-Oneng,
Apri-Gajah, Fandy, Tice, Tintus, buat semua bantuan, tawa, air mata, kegilaan, kebersamaan, semangat, dukungan, serta kesediaan untuk jadi
tempat berbagi dan teman dikala senang dan duka.
19.Meri-Mace, Limdra-ndut, Arif-kentung, Adit, Budiaji, Yoyo, Maria, Ita,
Resty, Yasinta, Lala, Cawaz, Candhy, Lian ,Feri DS, Liza, Puipuin,
20.Ndut Reta, Nolen, Welly, Tami, Sinta-Lele, Cocow, Mas Punto, Erlin terima kasih sudah menjadi teamwork yang baik selama kepengurusan BPMF
periode 2006-2007.
21.Lia, Bang Jok, Dewi, Indri, Dima, Ndaru, Tato, Amel, Mitha, atas
kebersamaannya dalam Kuliah Kerja Nyata Universitas Sanata Drama
angkatan XXXIV kelompok XI di dusun Wonodoro, Bantul.
Semua pihak yang telah membantu penulis dalam menyelesaikan skripsi
ini yang tidak dapat penulis sebutkan satu-persatu.
Tak ada gading yang tak retak, demikian pula dalam penyusunan skripsi
ini. Penulis menyadari masih banyak kekurangan dan ketidaksempurnaan yang
ada dalam penyusunan skripsi ini. Untuk itulah penulis mengaharapkan kritik dan saran yang dapat membuat karya ini menjadi lebih baik. Akhir kata, semoga
penelitian skripsi yang telah dilakukan penulis dapat bermanfaat bagi
perkembangan ilmu kefarmasian.
PERNYATAAN KEASLIAN KARYA
Saya menyatakan bahwa sesungguhnya skripsi yang saya tulis ini tidak
memuat karya orang lain, kecuali yang telah disebutkan dalam kutipan dan daftar
pustaka sebagaimana layaknya karya ilmiah.
Yogyakarta, 16 Juni 2008
Penulis,
INTISARI
Keracunan sianida dapat berakibat fatal jika tidak segera dilakukan terapi antidotumnya, Keberhasilan Natrium tiosulfat sebagai terapi antidotum salah satunya ditentukan oleh ketepatan dosisnya.
Tujuan penelitian ini untuk mengetahui gejala, mekanisme, wujud, sifat, dan efek dari keracunan sianida, mengetahui seberapa besar kisaran dosis natrium tiosulfat ya ng efektif untuk keracunan sianida, mengetahui hubungan antara dosis natrium tiosulfat dengan efek penawaran racun pada keracunan sianida pada mencit.
Penelitian ini merupakan penelitian eksperimental murni dengan rancangan acak lengkap pola searah. Terdir i dari 7 kelompok : kelompok I diberi KCN dosis 26 mg/kgBB p.o, kelompok II diberi aquadest 25 mg/KgBB p.o, kelompok III diberi larutan natrium tiosulfat (Na2S2O3) dosis 160.720 mg/kgBB
diberikan secara i.p, kelompok IV-VII diberi larutan KCN secara p.o, kemudian diberi antidotum natrium tiosulfat dengan peringkat dosis berturut-turut : 0.468 mg/kgBB, 3.279 mg/kgBB, 22.960 mg/kgBB dan 160.720 mg/kgBB secara i.p.
Hasil penelitian didapatkan bahwa gejala dari keracunan sianida pada mencit meliputi : hilang kesadaran, gagal nafas, kejang, sampai menimbulkan kematian. Mekanisme keracunan sianida pada mencit adalah sianida berikatan dengan besi dalam feri sitokrom oksidase. Wujud efek toksik sianida berupa perubahan biokimia dan mungkin juga perubahan fungsional. Sifat dari keracunan sianida pada mencit adalah terbalikkan dan tidak terbalikkan. Dosis efektif natrium tiosulfat sebagai antidotum untuk keracunan sianida pada mencit sebesar 160.720 mg/KgBB intraperitoneal. Meningkatnya dosis natrium tiosulfat dapat meningkatkan efek pengawaracunan sianida pada mencit
ABSTRACT
Cyanide poisoning can cause fatal result if its antidote therapy is not done shortly., one of the successes Thiosulphate sodium as antidote therapy s is determined by its dose accuracy.
The research aims to know the indication, mechanism, configuration, characteristics, and effects of cyanide poisoning, to know how much effectiveness the dose estimation of thiosulphate sodium for cyanide poisoning, to know the relationship between thiosulphate sodium dose and the effect of poison antidote for cyanide poisoning toward mice.
The research is a pure experimental research with random unidirectional pattern program. Forty two male mice are divided into seven groups equally that consist of: group I is given resolvent that is aquadest 25mg/KgBB per oral, group II is given KCN solution with dosage 26mg/kgBB per oral as a poison positive control, group III is given thiosulphate Sodium solution (Na2S2O3) with dosage
160.720mg/kgBB given intraperitoneally (i.p), group IV-VII are given KCN solution per oral (p.o) and then given thiosulphate sodium antidote with dosage level in a row: 0.468 mg/kgBB, 3.279 mg/kgBB, 22.960 mg/kgBB and 160.720 mg/kgBB intraperitoneally.
From the research result, it can be seen that the indication of cyanide poisoning toward mice includes lost consciousness, fail breathing, spastic, and causing death. Mechanism of cyanide poisoning toward mice shows its toxicity especially because of its ability to react against iron in ferric sitokrom oxide. Because aerobe metabolism is depended on this enzyme system, so the tissue can no longer use oxygen and hypoxia. The configuration of cyanide toxic effect is biochemical alteration and functional alteration, too. The characteristic of cyanide poisoning toward mice is not capsized.
Effective dose thiosulphate sodium as antidote for cyanide poisoning toward mice is 160.720mg/KgBB intraperitoneal. The increase of thiosulphate sodium dosage can increase the effect of antidote of cyanide poisoning toward mice.
DAFTAR ISI
HALAMAN SAMPUL...i
HALAMAN JUDUL ...ii
HALAMAN PERSETUJUAN PEMBIMBING ...iii
HALAMAN PENGESAHAN ...iv
HALAMAN PERSEMBAHAN ...v
PRAKATA...vi
PERNYATAAN KEASLIAN KARYA ...x
INTISARI...xi
ABSTRACT...xii
DAFTAR ISI...xiii
DAFTAR TABEL...xvii
DAFTAR GAMBAR ...xviii
DAFTAR LAMPIRAN ...xxiii
BAB I. PENGANTAR ...1
A. Latar Belakang ...1
1. Permasalahan ...3
2. Keaslian penelitian...3
3. Manfaat penelitian...3
BAB II. PENELAAHAN PUSTAKA ...5
A. Sianida...5
1. Tinjauan sejarah...5
2. Sumber- sumber potensial sianida ...5
3. Jenis keracunan pada sianida ...8
4. Mekanisme keracunan sianida ...10
5. Pemeriksaan laboratorium...12
6. Detoksifikasi sianida secara biologis ...14
B. Terapi pada Keracunan Sianida ...14
1. Terapi suportif...14
2. Terapi antidot ...16
C. Natrium Tiosulfat ...17
1. Dasar pemikiran untuk memilih antidot ...17
2. Kelompok risiko...18
3. Nama dan rumus kimia ...18
4. Sifat fisiko-kimia...19
5. Mekanisme penawaracunan...21
6. Profil biokimia/farmakologi lain...22
7. Rute pemberian...27
8. Dosis ...27
9. Kontraindikasi...28
10. Efek samping...29
D. Anatomi Fisiologi ...29
1. Jantung ...29
2. Lambung ...30
3. Usus halus ...30
4. Hati...31
5. Ginjal...32
6. Paru ...32
E. Kerusakan Organ...33
F. Landasan Teori...34
F. Hipotesis ...34
BAB III. METODE PENELITIAN ...35
A. Jenis dan Rancangan Penelitian...35
B. Variabel dan Definisi Operasional...35
1. Variabel utama ...35
2. Variabel pengacau...35
C. Definisi Operasional ...36
D. Bahan Penelitian ...37
E. Alat dan Instrumen Penelitian...38
F. Tata Cara Penelitian...38
1. Pembuatan larutan dan penetapan dosis KCN ...38
2. Pembuatan larutan dan penetapan dosis natrium tiosulfat...39
3. Pengelompokkan hewan uji ...39
5. Pemeriksaan histopatologi ...40
G. Analisis Hasil ...41
BAB IV. HASIL DAN PEMBAHASAN...42
A. Potensi Sianida sebagai Racun...42
B. Potensi Natrium Tiosulfat sebagai Kontrol Positif Antidotum....44
C. Kisaran Dosis Natrium Tiosulfat sebagai Antidotum Sianida ...45
D. Pemeriksaan Histopatologi ...65
1. Hati...66
2. Ginjal...67
3. Paru ...67
4. Jantung ...73
5. Usus halus ...73
6. Lambung ...77
BAB V. KESIMPULAN DAN SARAN...82
A. Kesimpulan ...82
B. Saran...81
DAFTAR PUSTAKA ...83
BIOGRAFI PENULIS ...176
DAFTAR TABEL
Tabel I. Hidrogen sianida yang dihasilkan oleh pembakaran (Montgomery dkk.
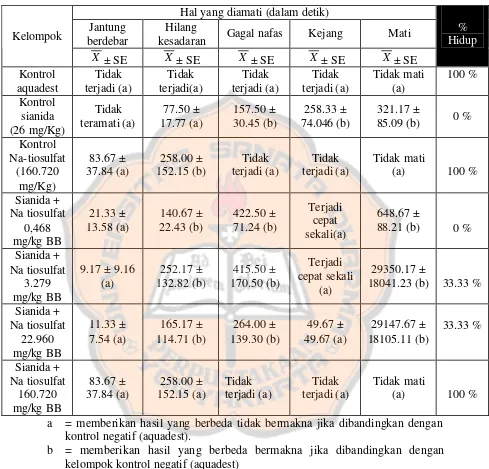
(1975))...7 Tabel II. Hasil pengamatan waktu gejala efek toksik sianida terhadap 7 kelompok
perlakuan...46
Tabel III. Hasil perbandingan antar kelompok pada gejala efek toksik jantung
berdebar...48
Tabel IV. Hasil perbandingan antar kelompok pada gejala efek toksik hilang kesadaran...51
Tabel V. Hasil perbandingan antar kelompok pada gejala efek toksik gagal nafas
...544
Tabel VI. Hasil perbandingan antar kelompok pada gejala efek toksik kejang...56
Tabel VII. Hasil perbandingan antar kelompok pada gejala efek toksik mati...58 Tabel VII. Hasil Pemeriksaan histopatologi beberapa organ mencit akibat
pemberian larutan KCN (sebagai senyawa racun) dan pada kelompok perlakuan
diberikan larutan KCN kemudian diteruskan dengan pemberian senyawa
antidotumnya, yaitu natrium tiosulfat. ...68
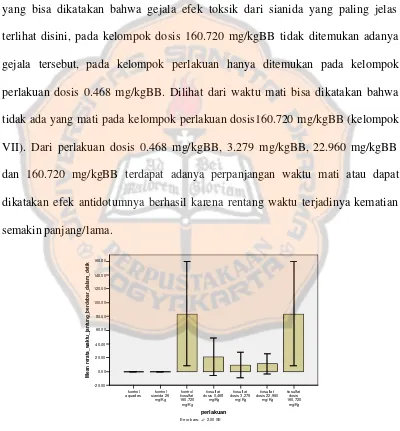
Gambar 1. Grafik mean ± 2 SE untuk gejala efek toksik berupa jantung berdebar
...47
Gambar 2. Grafik mean ± 2 SE untuk gejala efek toksik berupa hilang kesadaran ...50
Gambar 3. Grafik mean ± 2 SE untuk gejala efek toksik berupa gagal nafas ...53
Gambar 4. Grafik mean ± 2 SE untuk gejala efek toksik berupa kejang...55
Gambar 5. Grafik mean ± 2 SE untuk gejala efek toksik berupa mati ...59
Gambar 6. Pengubahan cyanmethemoglobin menjadi tiosianat oleh rodhanase dan tiosulfat (Cyanide Toxicity Review, 2003)...63
Gambar 7. Kurva hipotesis yang melukiskan hubungan antara kadar racun di dalam darah atau di tempat aksi lawan waktu dengan strategi terapi keracunan mempercepat eliminasi. ...64
Gambar 8. Gambaran histopatologi untuk organ hati mencit pembesaran 100X pengecatan hematoksislin-eosin pembedahan 24 jam, perlakuan : ...70
a.KCN 26 mg/kgBB. A. hiperemi lokal derajat 2 (++)...70
b... Aquadest, normal, tidak tampak adanya hiperemi, tidak ada manifestasi peradangan. ...70
c.Na2S2O3 dosis 160.720 mg/kg BB. A. hiperemi lokal derajat 2 (++) ...70
d.KCN dosis 26 mg/kg BB dengan Na2S2O3 dosis 0,468 mg/kg BB. A. hiperemi lokal derajat 1 (+) ...70
f. .... KCN dosis 26 mg/kg BB dengan Na2S2O3 dosis 22.960 mg/kg BB, normal,
tidak tampak adanya hiperemi, tidak ada manifestasi peradangan. ...70
g... KCN dosis 26 mg/kg BB dengan Na2S2O3 dosis 160.720 mg/kg BB, normal, tidak tampak adanya hiperemi, tidak ada manifestasi peradangan. ...70
Gambar 9. Gambaran histopatologi untuk organ ginjal mencit pembesaran 100X pengecatan hematoksislin-eosin pembedahan 24 jam, perlakuan : ...72
a.KCN 26 mg/kgBB. A. haemorrhagie ...72
b.Aquadest...72
c.Na2S2O3 dosis 160.720 mg/kg BB ...72
d...KCN dosis 26 mg/kg BB dengan Na2S2O3 dosis 0,468 mg/kg BB. A. haemorrhagie...72
e...KCN dosis 26 mg/kg BB dengan Na2S2O3 dosis 3.279 mg/kg BB. A. haemorrhagie...72
f. KCN dosis 26 mg/kg BB dengan Na2S2O3 dosis 22.960 mg/kg BB...72
g...KCN dosis 26 mg/kg BB dengan Na2S2O3 dosis 160.720 mg/kg BB. A. hiperemi ...72
Gambar 10. Gambaran histopatologi untuk organ paru mencit akibat pemberian KCN dosis 26 mg/kg BB pembesaran 100X pengecatan hematoksislin-eosin pembedahan 24 jam, perlakuan:...74
a... KCN 26 mg/kgBB, alveoli dan bronkeoli dalam batas normal. A. penebalan septa alveoli, B. sel radang. ...74
c...Na2S2O3 dosis 160.720 mg/kg BB. A. penebalan septa alveoli, B. sel radang.
...74
d...KCN dosis 26 mg/kg BB dengan Na2S2O3 dosis 0,468 mg/kg BB. A. penebalan septa alveoli, B. sel radang. ...74
e.KCN dosis 26 mg/kg BB dengan Na2S2O3 dosis 3.279 mg/kg BB. A. penebalan septa alveoli, B. sel radang. ...74
f.KCN dosis 26 mg/kg BB dengan Na2S2O3 dosis 22.960 mg/kg BB...74
g.KCN dosis 26 mg/kg BB dengan Na2S2O3 dosis 160.720 mg/kgBB ...74
Gambar 11. Gambaran histopatologi untuk organ jantung mencit akibat pemberian KCN dosis 26 mg/kg BB pembesaran 100X pengecatan hematoksislin-eosin pembedahan 24 jam, perlakuan :...75
a.KCN 26 mg/kgBB, miokardium dalam batas normal...75
b. Aquadest, miokardium dalam batas normal...75
c. Na2S2O3 dosis 160.720 mg/kg BB, miokardium dalam batas normal ...75
d.KCN dosis 26 mg/kg BB dengan Na2S2O3 dosis 0,468 mg/kg BB, miokardium dalam batas normal ...75
e. KCN dosis 26 mg/kg BB dengan Na2S2O3 dosis 3.279 mg/kg BB, miokardium dalam batas normal. ...75
f. ... KCN dosis 26 mg/kg BB dengan Na2S2O3 dosis 22.960 mg/kg BB, miokardium dalam batas normal...75
Gambar 12. Gambaran histopatologi untuk organ usus halus mencit akibat
pemberian KCN dosis 26 mg/kg BB pembesaran 100X pengecatan
hematoksislin-eosin pembedahan 24 jam,Perlakuan :...76
a... KCN 26 mg/kgBB. A. fili intestinal erosi dan mukosanya tidak normal ...76
b. ..Aquadest, fili intestinal dan mukosa dalam batas normal, mukosa muskularis,
serosa dan kelenjar nya juga normal. ...76
c. Na2S2O3 dosis 160.720 mg/kg BB. A. fili intestinal erosi dan mukosanya tidak
normal. ...76 d. ...KCN dosis 26 mg/kg BB dengan Na2S2O3 dosis 0,468 mg/kg BB. A. fili
intestinal erosi sedikit, dan juga terdapat adanya manifestasi peradangan derajat 2
(++). ...76
e. ...KCN dosis 26 mg/kg BB dengan Na2S2O3 dosis 3.279 mg/kg BB. A. fili
intestinal erosi sedikit, dan juga terdapat adanya manifestasi peradangan derajat 2 (++). ...76
f. ...KCN dosis 26 mg/kg BB dengan Na2S2O3 dosis 22.960 mg/kg BB. A. fili
intestinal erosi, dan juga terdapat adanya manifestasi peradangan derajat 1 (+). 76
g. ...KCN dosis 26 mg/kg BB dengan Na2S2O3 dosis 160.720 mg/kg BB. A. fili
intestinal erosi, dan juga terdapat adanya manifestasi peradangan derajat 1 (+). 76 Gambar 13. Gambaran histopatologi untuk organ lambung mencit akibat
pemberian KCN dosis 26 mg/kg BB pembesaran 100X pengecatan
a. ... KCN 26 mg/kgBB, aktivitas kelenjarnya meningkat, erosi mukosanya
...79
b. ...Aquadest, tunika mukosa muskularis normal, aktivitas kelenjarnya normal.
...79 c. ... Na2S2O3 dosis 160.720 mg/kg BB, mukosa lambung erosi, aktivitas
kelenjarnya meningkat. ...79
d. KCN dosis 26 mg/kg BB dengan Na2S2O3 dosis 0,468 mg/kg BB. A. mukosa
erosi. ...79
e. KCN dosis 26 mg/kg BB dengan Na2S2O3 dosis 3.279 mg/kg BB. A. mukosa lambung erosi (++) dan terdapat adanya manifestasi peradangan. ...79
f. KCN dosis 26 mg/kg BB dengan Na2S2O3 dosis 22.960 mg/kg BB. A. mukosa
lambung erosi (+) aktivitas kelenjarnya meningkat. ...79
g. ...KCN dosis 26 mg/kg BB dengan Na2S2O3 dosis 160.720 mg/kg BB. A.
mukosa lambung erosi (+). ...79
DAFTAR LAMPIRAN
Lampiran 1. Hasil pengamatan gejala efek toksik pada kelompok kontrol sianida
(dalam detik) ...97 Lampiran 2. Hasil pengamatan gejala efek toksik pada kelompok kontrol
aquadest (dalam detik) ...97
Lampiran 3. Hasil pengamatan gejala efek toksik pada kelompok kontrol natrium
tiosulfat (dalam detik) ...97
Lampiran 4. Hasil pengamatan gejala efek toksik pada kelompok kontrol sianida (dalam detik) ...98
Lampiran 5. Hasil pengamatan gejala efek toksik pada kelompok kontrol sianida
(dalam detik) ...98
Lampiran 6. Hasil pengamatan gejala efek toksik pada kelompok kontrol sianida
(dalam detik) ...99 Lampiran 7. Hasil pengamatan gejala efek toksik pada kelompok kontrol sianida
(dalam detik) ...99
Lampiran 8. Hasil perbandingan pengamatan gejala efek toksik sianida terhadap
kelompok kontrol (aquadest, sianida (26 mg/Kg), dan Na-tiosulfat (160,720
mg/Kg)) ...116 Lampiran 9. Hasil uji menggunakan analisis statistik Kruskal-Wallis dan
BAB I. PENGANTAR PENGANTAR
A. Latar Belakang
Sianida adalah zat beracun yang sangat mematikan. Efek dari sianida ini
sangat cepat dan dapat mengakibatkan kematian dalam jangka waktu beberapa menit. Sianida dalam dosis rendah dapat ditemukan di alam dan ada pada setiap
produk yang biasa kita makan atau gunakan. Sianida dapat diproduksi oleh
bakteri, jamur dan ganggang serta ditemukan pada rokok, asap kendaraan
bermotor, dan makanan seperti bayam, bambu, kacang, tepung tapioka dan
singkong. Selain itu juga dapat ditemukan pada beberapa produk sintetik. Sianida banyak digunakan pada industri terutama dalam pembuatan garam seperti
natrium, kalium atau kalsium sianida (Utama, 2006). Sianida dan hidrogen sianida
digunakan dalam elektroplating, metalurgi, produksi zat kimia, pengembangan
fotografi, pembuatan plastik dan beberapa proses pertambangan (Anonim, 2000).
Sianida dapat mengganggu kesehatan serta mengurangi bioavailabilitas nutrien di dalam tubuh. Sianida merupakan racun yang bekerja cepat, berbentuk
gas tak berbau dan tak berwarna, yaitu hidrogen sianida (HCN) atau sianogen
khlorida (CNCl) atau berbentuk kristal seperti sodium sianida (NaCN) atau
potasium khlorida (KCN). Racun ini menghambat sel tubuh mendapatkan oksigen
sehingga yang paling terpengaruh adalah jantung dan otak. Paparan dalam jumlah kecil mengakibatkan napas cepat, gelisah, pusing, lemah, sakit kepala, mual dan
muntah serta detak jantung meningkat. Paparan dalam jumlah besar menyebabkan
gangguan paru serta gagal napas hingga korban meninggal (Utama, 2006).
Jika sianida yang masuk ke dalam tubuh masih dalam jumlah yang kecil
maka sianida akan diubah menjadi tiosianat yang lebih aman dan diekskresikan
melalui urin. Selain itu, sianida akan berikatan dengan vitamin B12. Tetapi bila jumlah sianida yang masuk ke dalam tubuh dalam dosis yang besar, tubuh tidak
akan mampu untuk mengubah sianida menjadi tiosianat maupun mengikatnya
dengan vitamin B12 (Utama, 2006).
Masuknya sianida ke dalam tubuh tidak hanya melewati saluran
pencernaan tetapi dapat juga melalui saluran pernafasan, kulit dan mata. Yang dapat menyebabkan keracunan tidak hanya sianida secara langsung tetapi dapat
pula bentuk asam dan garamnya, seperti asam hidrosianik sekitar 2.500–5.000
mg.min/m3 dan sianogen klorida sekitar 11.000 mg.min/m3 (Utama, 2006).
Jalur terpenting dari pengeluaran sianida ini adalah dari pembentukan
tiosianat (SCN-) yang diekresikan melalui urin. Tiosianat ini dibentuk secara langsung sebagai hasil katalisis dari enzim rhodanese dan secara indirek sebagai
reaksi spontan antara sianida dan sulfur persulfida (Utama, 2006). Reaksi ini
membutuhkan sumber utama yaitu sulfur sulfan namun jumlahnya dalam tubuh
terbatas maka natrium tiosulfat dapat digunakan sebagai antidot dalam keracunan
sianida karena natrium tiosulfat dapat berfungsi sebagai pemasok sulfur. Natriun tiosulfat merupakan antidot pilihan jika diagnosisnya belum tentu jelas karena
keracunan sianida atau bukan, seperti dalam kasus yang disebabkan oleh asap
Sering kali secara tidak kita sadari, kita juga dapat terpapar sianida,
untuk itu kita perlu mengetahui kisaran dosis optimum dari natrium tiosulfat yang
digunakan sebagai antidot dalam keracunan sianida. Kisaran dosis sangatlah
penting karena menurut Meredith (1993), meskipun secara intrinsik natrium tiosulfat bersifat nontoksik tetapi produk hasil reaksi detoksifikasi antara natrium
tiosulfat dengan sianida dapat bersifat toksik
1. Permasalahan
Yang timbul dalam penelitian ini adalah :
1. Berapa besar dosis efektif natrium tiosulfat dengan cara pemberian i.p. untuk keracunan sianida pada mencit?
2. Bagaimana wujud dan sifat penawaracunan sianida oleh natrium tiosulfat
secara pengamatan fisik dan struktural?
2. Keaslian penelitian
Penelitian mengenai natrium tiosulfat sebagai antidot pada keracunan sianida sudah pernah dilakukan, yaitu : Ann (2005), meneliti natrium tiosulfat
untuk keracunan sianida akut pada tikus. Hasil penelitian yaitu efek terapi natrium
tiosulfat ditunjukkan pada dosis 225 mg/kgBB secara i.p.
Penelitian mengenai Dosis Efektif natrium tiosulfat sebagai antidotum
untuk keracunan sianida pada mencit jantan galur Swiss sepanjang pengetahuan penulis belum pernah ada yang melakukan. Perbedaan dengan pene litian tentang
na-tiosulfat sebelumnya terletak pada hewan uji yang digunakan.
Penelitian ini bermanfaat dalam pengembangan pengetahuan tentang
natrium tiosulfat sebagai antidotum keracunan sianida.
2. Manfaat metodologis
Penelitian ini dapat memberi informasi tentang dosis efektif natrium tiosulfat dengan cara pemberian i.p. sebagai antidotum dalam keracunan sianida
pada hewan uji mencit.
3. Manfaat praktis
Penelitian ini dapat digunakan untuk mengetahui berapa besar dosis
efektif dari natrium tiosulfat yang dapat digunakan pada manusia.
B. Tujuan Penelitian
Tujuan dari penelitian menge nai Dosis Efektif natrium tiosulfat sebagai
antidotum untuk keracunan sianida pada mencit jantan galur Swiss untuk
mengetahui
1. Seberapa besar dosis efektif natrium tiosulfat dengan cara pemberian i.p.
untuk keracunan sianida pada mencit.
2. Wujud dan sifat penawaracunan sianida oleh natrium tiosulfat secara
BAB II. PENELAAHAN PUSTAKA PENELAAHAN PUSTAKA
A. Sianida 1. Tinjauan sejarah
Sianida sudah dikenal sebagai racun dalam kenari yang pahit, ceri, daun
salam, dan singkong sejak jaman dahulu. Sebuah catatan pada sebuah lontar Mesir
dalam museum Louvre, Paris menuliskan bahwa Dioscorides pada abad pertama, SM, telah mengetahui adanya sesuatu yang beracun di dalam kenari yang pahit
(Sykes, 1981).
Mekanisme biokimia untuk menawaracunkan sianida telah dijelaskan
oleh Chen dkk. (1933, 1934). Mereka manganjurkan penggunaan sebuah
kombinasi amil nitrit, natrium nitrit, dan natrium tiosulfat, senyawa terakhir berfungsi sebagai donor sulfur untuk rhodanese (sulfur transferase). Rhodanese
mempercepat detoksifikasi sianida dengan membentuk metabolit tiosianat. Ini
menunjukkan perkembangan salah satu penawar racun pertama berdasarkan
alasan ilmu pengetahuan tentang racun yang ilmiah. Kombinasi penawar racun ini
telah teruji lama, dan masih menunjukkan kombinasi penawar racun yang paling mujarab untuk terapi keracunan akibat sianida.
2. Sumber- sumber potensial sianida a. Sumber-sumber dari industri
Sianida digunakan di industri dan untuk mengontrol serangga atau
bangunan, kapal dan pesawat yang terserang serangga atau binatang yang
merugikan. Garam sianida, seperti natrium sianida dan kalium sianida digunakan
dalam proses pembersihan, penguat, ekstraksi bijih pada pertambangan, serta
elektroplating (Henry, 1997).
Nitril adalah turunan siano dari senyawa organik. Asetonitril digunakan
sebagai pelarut dan sedikit mengandung racun (LD50 = 120 mg/kg) dibanding
hidrogen sianida (LD50 = 0,5 mg/kg), tetapi sering mengandung campuran racun
yang berkaitan dengan metabolisme sianida anorganik. Ketika nitril alifatik
mengalami metabolisme menjadi sianida anorganik, ikatan aroma nitril stabil in vivo. Akrilonitril adalah bahan kasar yang digunakan untuk pabrik plastik dan
serat sintetis. Bersinggungan dengan kulit dapat menyebabkan kulit melepuh.
Pembakaran menghasilkan hidrogen sianida. Akrilonitril dan propionitril sedikit
mengandung racun (LD50 = 35 mg/kg) dibanding butironitril (LD50 = 10 mg/kg).
Trikloroasetonitril (LD50 = 200 mg/kg) digunakan sebagai obat pembasmi serangga. Aroma nitril, bromoksinil (LD50 = 190 mg/kg) dan ioksinil (LD50 =
110 mg/kg), digunakan sebagai obat pembasmi tanaman liar. Sianamida, asam
sianoasetk, ferrisianida dan ferrosianida tidak mengeluarkan sianida. Sehingga
mereka mangandung sedikit racun (LD50 = 1000-2000 mg/kg) dibanding
senyawa sianogenik diatas, walaupun mereka mungkin menyebabkan keracunan dengan cara lain misalnya sianida yang dicampur dengan alkohol (Olson, 2007).
b. Sumber- sumber non- industri
Api dan pengatur polusi kendaraan dilengkapi dengan kegagalan
zat alami seperti wol, sutera, rambut kuda, dan tembakau serta bahan sintetis
modern seperti poliuretan dan poliakrilonitril, mengeluarkan sianida selama
pembakaran (Levine dkk., 1978; Birky dkk., 1979; Anderson & Harland, 1982;
Clark dkk., 1983 ; Alarie, 1985 ; Lowry dkk., 1985) (Tabel I)
Tabel I. Hidrogen sianida yang dihasilkan oleh pembakaran (Montgomery dkk. (1975))
Bahan µg HCN yang dihasilkan per gram bahan
Kertas 1100
Katun 130
Wol 6300
Nilon 780
Busa poliuretan 1200
c. Sumber- sumber alam
Sianida ditemukan dalam bahan makanan seperti kol, bayam, dan kenari,
dan sebagai amigdalin dalam biji apel, persik, kismis, ceri dan biji kenari. Dalam biji- biji itu sendiri, amigdalin tampak tidak berbahaya selama itu kering. Akan
tetapi, biji- biji mengandung sebuah enzim yang mampu mengatalisis reaksi
hidrolitis berikut ini ketika biji-biji itu dihancurkan dan dibasahi (Olson, 2007) :
C20H27NO11 + 2H2O -- > 2C6H12O6 + C6H5CHO + HCN
Amigdalin glukosa benzaldehid hidrogen sianida Reaksi itu lambat dalam asam tetapi cepat dalam larutan alkali.
Minyak alami dari kenari yang pahit mengandung 4% HCN. Kacang
lima putih Amerika mengandung 10 mg sianida/100 g kacang. Akar kering ketela
(tapioka) mungkin mengandung 245 mg sianida/100 g akar. Kandungan sianida
d. Sumber- sumber iatrogenik
Sianida juga dibentuk pada terapi menggunakan nitroprusida, terutama
ketika diperpanjang, karena takifilaksis kadang membutuhkan penggunaan dosis
yang lebih tinggi daripada dosis maksimum yang dianjurkan 10 µg/kg per min (Smith & Kruszyna, 1974; MacRae & Owen, 1974; Piper, 1975; Atkins, 1977;
Anon, 1978). Sianida mengakibatkan metabolisme menjadi tiosianat. Tiosianat
telah digunakan beberapa tahun yang lalu sebagai agen antihipertensi dan mereka
tampak sering digunakan karena sangat efektif. Sedangkan pada jenis efek akut
sedang, termasuk anoreksia, kelelahan, dan sistem gastrointestinal dan gangguan CNS, mendorong pada keburukan mereka.
Laetril, amigdalin berasal dari biji aprikot, telah digunakan sebagai
sebuah agen anti kanker, tetapi sekarang tidak terpakai karena efek pengobatan
tidak dapat dipraktekkan dalam pembelajaran retrospektif dan prospektif. Laetril
telah menyebabkan keracunan sianida yang fatal (Sadoff dkk., 1978). 3. Jenis keracunan pada sianida
a. Keracunan akut sianida
Secara umum, menghirup kira-kira 50 ml (konsentrasi 1,85 mmol/l) gas
hidrogen sianida fatal dalam beberapa menit. Keracunan hidrogen sianida lebih
sering secara tidak sengaja daripada sengaja. Sehingga keracunan sianida secara tidak sengaja mungkin terjadi pada pengasap dan ahli kimia yang menggunakan
hidrogen sianida selama jalannya pekerjaan mereka (Chen dkk., 1944).
Pada kebakaran, kombinasi keracunan HCN dan karbon monoksida (CO)
kefatalan. Menelan garam sianida yang secara sengaja biasanya terjadi pada orang
yang bekerja dengan sianida. Menelan sedikitnya 250mg garam sianida anorganik
mungkin bisa fatal (Peters dkk., 1982). Akan tetapi, kematian bisa ditunda
beberapa jam mengikuti proses pencernaan sianida pada perut yang penuh; first-pass effect yang terjadi di hati juga dapat menunda onset dari sianida (Naughton,
1974).
b. Keracunan kronis sianida
Neurotoksisitas kronis karena dosis rendah telah diteliti dengan
pendekatan epidemiologi pada populasi yang mengkonsumsi secara alami tanaman yang mengandung glikosida (Blanc dkk., 1985). Glikosida ini terdapat
dalam banyak jenis spesies tanaman, terutama tanaman singkong, bahan makanan
utama daerah tropis (Conn, 1973; Cook & Coursey, 1981; Ministry of Health,
Mozambique, 1984). Ketela telah dihubungkan dengan ataxic neuropati tropis
(Cook & Coursey, 1981). Paraparesis wabah kejang telah dihubungkan dengan sebuah kombinasi kadar sianida yang tinggi dan belerang rendah yang masuk dari
makanan yang didominasi oleh ketela yang kurang diproses dan suplemen yang
kurang protein (Rosling, 1989).
Neurotoksologi juga telah ditemukan pada tembakau yang berhubungan
dengan ambliopia (Grant, 1980) dan pada amigdalin yang berhubungan dengan neuropati perifer (Kalyanaraman dkk., 1983). Keracunan sianida jangka panjang
telah ditunjukkan berhub ungan dengan pembesaran dan gangguan pada kelenjar
dalam pekerjaannya (Blanc dkk., 1985), melalui makanan yang dikonsumsi (Cook
& Coursey, 1981), dan secara eksperimental (El Ghawabi dkk., 1975).
4. Mekanisme keracunan sianida
Sianida mempunyai afinitas khusus pada ion-ion besi yang ada dalam sitokrom oksidasi, enzim akhir pada respirasi oksidatif dalam mitokondria. Enzim
ini merupakan katalisator yang penting untuk penggunaan oksigen pada jaringan.
Ketika sitokrom oksidasi dihambat oleh sianida, histotoksik anoksia terjadi karena
metabolisme aerobik yang terhambat. Pada keracunan sianida besar-besaran,
mekanisme keracunan lebih rumit. Ini memungkinkan bahwa getaran bebas dari amina biogenic mungkin berperan dengan menyebabkan gagal jantung (Burrows
& Way, 1976).
Sianida dapat menyebabkan vasokonstriksi pembuluh paru-paru dan atau
pembuluh jantung, yang akan mengakibatkan, secara langsung dan tidak
langsung, pada gagal pemompaan dan penurunan volume darah pada sirkulasi didalam tubuh yang dipengaruhi oleh penurunan fungsi organ jantung. Teori ini
didukung oleh peningkatan yang tajam pada tekanan pembuluh darah pusat yang
telah diobservasi oleh Vick & Froelich (1985) pada waktu ketika tekanan
pembuluh darah arteri turun setelah pengambilan natrium sianida ke dalam
pembuluh darah pada anjing. Observasi bahwa phenoxybenzamine, sebuah alfa adrenergic menghalangi obat, secara terpisah mencegah perubahan awal (Vick &
Froelich, 1985) mendukung konsep getaran awal menyatakan tidak berhubungan
Bau kenari yang pahit dalam udara yang kadaluarsa adalah tanda penting
keracunan sianida. Namun banyak orang tidak mampu merasakan bau asam
hydrocyanic (Kalmus & Hubbard, 1960). Timbulnya “non-smeller” dilaporkan
menjadi 18% diantara laki- laki dan 5% diantara wanita (Kirk & Stenhouse, 1953; Fukumoto dkk., 1957).
Secepatnya setelah menelan sianida, gejala yang sangat awal, seperti
iritasi lidah dan selaput lender, mungkin dialami. Aspirasi darah kotor mungkin
diobservasi jika pencucian lambung dilakukan. Gejala awal dan tanda- tanda yang
terjadi setelah penghisapan HCN atau proses pencernaan garam sianida termasuk kegelisahan, sakit kepala, pusing, kebingungan, dan hiperpnea, diikuti oleh
dispnea, membiru, hipotensi, bradikardi, dan sinus atau aritmia simpul AV.
Pada tahap kedua keracunan, kesadaran yang lemah, koma dan gangguan
hebat terjadi dan kulit menjadi dingin, lembab, dan basah. Detak jantung menjadi
lebih lemah dan lebih cepat. Opisthotonos dan trismus mungkin diobservasi. Tanda terakhir dari keracunan sianida termasuk hypotension, arrythmias komplek,
gagal pembuluh darah jantung, oedema paru- paru dan kematian.
Bahwa pewarnaan kulit merah terang atau ketidakadaan pembiruan yang
disebutkan dalam buku pelajaran (Gosselin dkk., 1984; Goldfrank dkk., 1984)
jarang dijelaskan dalam laporan kasus keracunan sianida oleh sebab itu harus lebih ditekankan. Secara teori tanda ini bisa dijelaskan oleh oxyhaemoglobin yang
berkonsentrasi tinggi dalam pembuluh darah balik, tetapi, terutama pada
Kadang-kadang, pada awalnya pembiruan bisa diobservasi, ketika kemudian
pasien bisa menjadi merah muda terang (Hilmann dkk., 1974).
Patogenesis udem paru-paru bisa dimaksudkan untuk beberapa
mekanisme yang berbeda: (1) proses metabolisme intraselular yang bisa melukai alveolus dan pembuluh rambut epithelium secara langsung, menghasilkan
sindrom kebocoran pembuluh rambut; (2) udem paru-paru neurogenik atau, (3)
hampir sama, efek langsung pada miokardium mengarahkan ke kegagalan jantung
bagian kiri dan peningkatan tekanan pembuluh darah paru-paru. Otak secara jelas
adalah organ utama yang dilibatkan dalam keracunan sianida dan ini telah ditunjukkan bahwa sianida meningkatkan laktat otak dan menurunkan konsentrasi
ATP otak (Olsen & Klein, 1974).
5. Pemeriksaan laboratorium a. Asidosis laktat
Karena phosphorylation oksidasi ditutup, tingkat glikolisis ditingkatkan dengan jelas, dimana berubah mengarah pada asam susu. Tingkat asam susu bisa
dihubungkan dengan kehebatan keracunan sianida (Trapp, 1970; Naughton,
1974).
b. Konsentrasi sianida dalam darah dan plasma
Sebelum perawatan intravenous dengan penawar racun dimulai, penting mengumpulkan heparinise (bukan fluoride) contoh darah untuk menentukan
konsentrasi sianida. Hasil dari contoh yang dikumpulkan setelah perawatan
benar-benar tidak bisa dipercaya. Sebuah tes kuantitatif yang menggunakan sebuah
digunakan untuk tes kuantitatif, sehingga kehebatan racun bisa dievaluasi.
Pengukuran obat setelah perawatan penawar racun seharusnya didasarkan pada
kondisi klinis dari pasien daripada konsentrasi darah sianida (Berlin, 1971; Vogel
dkk., 1981; Peter dkk., 1982). Karena konsentrasi darah sampai 0,005-0,04 mg/l telah direkam pada kesehatan orang yang tidak merokok, dan 0,01-0,09 mg/l pada
perokok, hanya konsentrasi diatas jumlah ini sebelumnya dianggap racun (Vogel
dkk., 1981; Peters dkk., 1982). Lundquist dkk., (1985) melaporkan bahkan
konsentrasi lebih rendah: bukan perokok 3,4 µg/l (seluruh darah), 0,5 µg/l
(plasma), 6,0 µg/l (eritrosit); perokok 8,6 µg/l (seluruh darah), 0,8 µg/l (plasma), 17,7 µg/l (eritrosit).
Keracunan sianida yang fatal telah dilaporkan dengan seluruh konsentrasi
darah 3 mg/l dan keracunan parah dengan 2mg/l (Graham dkk., 1977). Akan
tetapi, ketika sianida masuk aliran darah, sampai 98% secara cepat memasuki sel
darah merah dimana itu menjadi ikatan yang kuat. Rasio Plasma ke perbandingan darah sebesar 1:10 sehingga seluruh konsentrasi darah sianida mungkin tidak
secara akurat mencerminkan konsentrasi sianida pada jaringan. Konsentasi sianida
dalam plasma mungkin menjadi lebih penting karena pada keracunan yang parah
itu terjadi jika konsentrasi dalam plasma berada dalam level sedang (Vesey dkk.,
1976). Akan tetapi, kelemahan dari penggunaan plasma dalam mendeteksi sianida dalam dugaan keracunan karena ketidakstabilan sianida dalam plasma (Lundquist
6. Detoksifikasi sianida secara biologis
Jalan kecil utama penghilangan endogen adalah pengubahan, dengan
menggunakan tiosulfat, menjadi tiosianat. Jalan kecil pengeluaran adalah
pengeluaran hidrogen sianida melalui paru-paru dan mengikat sistein atau hidroksokobalamin.
Penghilangan sianida terjadi secara perlahan pada tingkat 0,017 mg/kg
per min (McNamara, 1976). Enzim sulfurtransferase dibutuhkan untuk mengatalis
pengiriman atom sulfur dari pemberi tiosulfat sampai sianida. Teori klasik yang
menandakan bahwa mitokondrial tiosulfat sulfurtransferase adalah enzim terpenting dalam reaksi ini yang sekarang diragukan karena tiosulfat menembus
selaput lipid secara perlahan dan sehingga tidak siap sedia sebagai sumber sulfur
pada keracunan sianida. Konsep modern menganggap peranan yang lebih besar
pada komplek serum albumin- sulfane, yang penahan utama penghilangan sianida
yang berjalan pada metabolisme normal (Sylvester dkk., 1983). Enzim berikutnya, beta-merkaptopiruvat sulfurtransferase, juga mengubah sianida menjadi tiosianat
(Vesey dkk., 1974). Enzim ini ditemukan dalam eritrosit, tetapi dalam sel-sel
manusia aktifitasnya rendah.
B. Terapi pada Keracunan Sianida 1. Terapi suportif
Walaupun penawar racun yang efektif tersedia, pengukuran pendukung
umum seharusnya tidak diabaikan dan mungkin menjadi penyelamat hidup.
keracunan industri, penggunaan penawar racun tertentu ditunjukkan hanya dalam
kasus keracunan yang hebat dengan koma yang lama, biji mata yang tidak reaktif,
dan pernapasan yang kurang dalam kombinasi dengan kurangnya peredaran darah.
Pada pasien dengan keracunan yang lumayan hebat, yang hanya mengalami ketidaksadaran singkat, gangguan hebat, muntah, dan membiru, terapi terdiri dari
perawatan intensif dan memberikan natrium tiosulfat ke dalam pembuluh darah.
Pada kasus keracunan ringan dengan kepeningan, rasa mual, dan rasa mengantuk,
hanya oksigen dan istirahat yang digunakan.
Peden dkk. (1986) menjelaskan sembilan pasien yang keracunan hidrogen sianida dikeluarkan oleh kebocoran katup. Tiga diantaranya tidak sadar
sebentar tapi sembuh dengan cepat setelah dipindah dari daerah dimana mereka
bekerja. Pembuluh urat nadi seluruh darah konsentrasi sianida pada pintu masuk
adalah 3.5, 3.1 dan 2.8 mg/l, secara berturut- turut. Konsentrasi sianida pada kasus
lain berkisar antara 2.6 dan 0.93 mg/l. semua disembuhkan hanya dengan terapi pendukung.
Antara tahun 1970 dan tahun 1984, tiga relawan laki- laki diberikan
perlakuan yang sama; dua diantaranya menunjukkan hasil kehilangan kesadaran
yang singkat, dan dalam kasus ini konsentrasi sianida 30 min setelah pemejanan
adalah 7,7 dan 4,7 mg/L. Konsentrasi pada pasien yang lain adalah 1,6 mg/L. Ketiga pasien sembuh tanpa penggunaan penawar racun sianida. Sebagian kecil
pasien yang tidak sadar dengan potensi konsentrasi racun dalam darah yang
dilaporkan oleh Graham dkk. (1977), Edward & Thomas (1978), dan Vogel dkk.
(1981).
Jika pasien tidak sadar, sebuah penawar racun tidak penting untuk
ditangani secara cepat kecuali tanda yang penting/ mematikan memburuk. Pasien yang terkena hidrogen sianida yang sampai rumah sakit dengan kesadaran penuh
hanya membutuhkan observasi dan penenangan hati.
2. Terapi antidot a. Oksigen
Ini sangat sulit dimengerti bagaimana oksigen mempunyai efek bagus dalam keracunan sianida, karena pencegahan oksidasi sitokrom tidak kompetitif.
Akan tetapi, oksigen selalu dianggap sebagai sebuah ukuran pertolongan pertama
pada keracunan sianida, dan sekarang ada bukti yang bersifat percobaan bahwa
oksigen mempunyai aktifitas penawar racun yang penting. Oksigen mempercepat
reaksi oksidasi sitokrom dan melindungi terhadap pencegahan oksidasi sitokrom oleh sianida (Takano dkk., 1980). Meskipun demikian, ada kemungkinan tindakan
lain dan yang secara klinis penting untuk ditentukan.
Oksigen hiperbarik dianjurkan untuk korban penghirupan asap yang
menderita dari gabungan karbon monoksida dan keracunan sianida, karena dua
agen ini secara gabungan racun. Penggunaan oksigen hiperbarik pada keracunan sianida yang murni masih diperdebatkan.
b. Natrium tiosulfat
Jalan utama penghilangan sianida dalam tubuh adalah pengubahan
beta-mercaptopiruvat sulfurtransferase, mungkin juga dilibatkan. Reaksi ini
membutuhkan sumber sulfane sulfur, tapi penyedia endogen dari zat ini terbatas.
Keracunan sianida adalah proses intramitokondrial dan sebuah penyediaan sulfur
ke dalam pembuluh darah hanya akan menembus mitokondria secara perlahan. Sedangkan natrium tiosulfat mungkin cukup pada kasus ringan sampai berat, ini
seharusnya ditangani dengan penawar racun yang lain pada kasus keracunan yang
berat. Selain itu pemilihan penawar racun juga dibutuhkan ketika diagnosa racun
sianida tidak pasti, sebagai contoh pada kasus penghirupan asap. Natrium tiosulfat
dianggap pada dasarnya tidak beracun tetapi produk penghilang racun dibentuk dari sianida, tiosianat, mungkin menyebabkan keracunan pada pasien dengan
kelainan ginjal.
C. Natrium Tiosulfat
Penggunaan natrium tiosulfat sebagai penawar racun telah dicatat dalam kepustakaan tentang keracunan yang berkaitan dengan sianida, gas mustard,
mustard nitrogen, bromat, klorat, brom, yodium, sisplatin, dan obat-obatan
tertentu (Dactinomycin, Mechlorethamine, Mitomycin) ketika dipaksa keluar dari
pembuluh. Juga ada beberapa referensi tentang efeknya pada iodat dan racun
hipoklorit. Peranan utama natrium tiosulfat terletak pada perawatan keracunan sianida.
1. Dasar pemikiran untuk memilih antidot
Efek natrium tiosulfat sebagai penawar racun pada keracunan sianida
Beberapa pengarang percaya ini akan menjadi pemawar racun yang bekerja cukup
lambat, walaupun yang lain telah memperagakan bahwa ini bekerja lebih cepat
dibanding pemikiran yang sebelumnya, memungkinkan pengubahan sianida
menjadi tiosianat (Krapez dkk., 1981). Tiosulfat membantu menghilangkan sianida pada enzim rhodanese. Akan tetapi, rhodanese adalah sebuah enzim
intramitokondrial dan tiosulfat membatasi kemampuan untuk menembus sel dan
selaput mitokondrial. Sehingga penyaluran tiosulfat hampir secara ekslusif
ekstraseluler (Cardozo & Edelman, 1952), sedangkan kerja penawar racunnya
telah dianggap terjadi secara intraseluler. Gambaran ini sekarang sedang dipelajari kembali dalam keterangan bukti penelitian mutakhir.
2. Kelompok risiko
Tidak ada kelompok resiko khusus yang dapat diidentifikasi mengenai
penggunaan natrium tiosulfat. Akan tetapi, harus dicatat bahwa kemungkinan
terdapat pengurangan kemampuan untuk mengubah sianida menjadi tiosianat dalam beberapa penyakit, contohnya, racun ambliopia (pada tembakau ambliopia
tertentu) dan berhentinya pertumbuhan penglihatan turun-temurun Leber (Wilson,
1965; Darby & Wilson, 1967). Secara tidak normal aktifitas rhodanese yang
rendah dalam hati telah dijelaskan pada dua pasien dengan berhentinya
pertumbuhan penglihatan turun- temurun Leber (Grant, 1986). 3. Nama dan rumus kimia
Nama internasional tanpa kepemilikan: Natrii thiosulfas; natrium
thiosulfate (Thiosulfate); Thiosulfate de natrium; Natrium thiosulfuricum;
thiosulfate, pentahydrate (NIOSH, 1986); 7772-98-7 untuk natrium thiosulfate,
anhydrous, (NIOSH, 1986).
Nama IUPAC : Natrium Thiosulfate, pentahydrate
Perusahaan : siap tersedia di banyak Negara.
Nama Komersil : secara komersil tersedia sebagai natrium thiosulfate atau sama
di banyak Negara.
Formula : Na2S2O3.5H2O (Martindale, 1989)
Rata-rata berat molekul : 248.2 (Martindale, 1989)
Spesifikasi garam kimia yang digunakan: natrium tiosulfat mangandung tidak kurang 99.0% dan tidak lebih atau sama dengan 101.0% Na2S2O3.5H2O
(Farmakope Eropa, 1980); transparan, kristal yang tidak berwarna (Farmakope
Eropa, 1980); tidak berwarna, tidak berbau, (atau hampir tidak berbau) kristal
prisma monoklinik, atau serbuk kristal yang kasar denga n rasa garam (Martindale,
1989).
4. Sifat fisiko-kimia a. Titik lebur dan titik didih.
Natrium tiosulfat larut dalam air pengkristalannya sendiri kira-kira pada
49ºC (Farmakope Eropa, 1980; Martindale, 1989). Ini kehilangan seluruh airnya
pada 100ºC dan terurai pada suhu yang lebih tinggi (Windholz, 1983). Di atas 200-300ºC, ini terurai menjadi sulfat dan pentasulfida (Kirk-Othmer, 1969; Hager,
1977). Ketika dipanaskan sampai titik penguraian, uap dari sulfur oksida terpancar
(Sax, 1984; PoisIndex, 1987).
Kemampuan larut yang tinggi dalam air (2 bagian natrium tiosulfat
dalam 1 bagian air) (Martindale, 1989; Windholz, 1983).
c. Kestabilan
Memuai dalam panas (>30ºC) udara yang kering. Sedikit higroskopik di udara yang lembab (Windholz, 1983). Disimpan dalam wadah kedap udara
(Martindale, 1989). Pelarut yang encer membatasi kestabilan yang berkaitan
dengan kecenderungan untuk mengurai secara perlahan seperti reaksi berikut ini:
Na2S2O3 -- > Na2S2O3 + S (larutan netral atau asam)
Na2S2O3 + H2O -- > Na2SO4 + H2S (larutan alkali)
Reaksi pertama dipercepat oleh asam dan yang kedua oleh udara atau
oksigen. Larutan natrium tiosulfat yang encer mengurai lebih cepat dalam panas.
Penyimpanan dengan akse yang terbatas pada udara dan cahaya dalam lingkunga n
yang dingin meningkatkan kestabilan (Kirk-Othmer, 1969; Martindale, 1989;
Windholz, 1983).
Tiosulfat yang dapat disuntikkan disimpan dalam tempat kaca kecil yang
tersegel selama tiga tahun menunjukkan tidak adanya perubahan penting pada
komposisi.
d. Pembawa
Untuk tiosulfat yang dapat disuntikkan (0.15g/ml) : natrium fosfat dodekahidrat (Na2HPO4.12H2O) 1.2% (informasi dari Perusahaan Nasional
5. Mekanisme penawaracunan
Jalan utama penghilangan sianida dalam tubuh adalah pengubahan
menjadi tiosianat. Reaksi ini membutuhkan sumber sulfur sulfan (sulfur
dwivalensi terikat pada sulfur lain) dan dikatalis oleh sulfur transferase. Telah dianjurkan bahwa ada kelompok psikologi sulfur sulfane reaksi sianida menempel
pada albumin yang mungkin bekerja sebagai penyangga melawan produksi
endogen sianida (Westley dkk., 1983; Way dkk., 1984). Tiosulfat ada dalam tubuh
hanya dalam jumlah kecil, sebagian besar diperoleh dari sistin dan senyawa
mercapto yang lain. Cadangan psikologi yang tersedia untuk penghilangan sianida menjadi terbatas (Schulz dkk.1979b)
Rhodanase
Na2S2O3 + CN- SCN + Na2S2O3
Ini disalurkan ke seluruh tubuh, konsentrasi paling tinggi ditemukan
dalam hati, dan sebagian besar terletak dalam rahim mitokondria (Westley dkk., 1983). Keberadaan oksidasi tiosianat yang dapat mengoksidasi tiosianat kembali
menjadi sianida (Goldstein & Rieders, 1953) telah dipertanyakan. Akan tetapi, ini
sekarang terhubung dengan formasi artifaktual HCN selama pengujian kadar
logam (Vesey, 1979).
Natrium tiosulfat mengandung dwivalensi pemberi sulfur yang penting terikat pada sulfur yang lain dan ini adalah pemberi sulfur utama untuk rhodanese
dalam pengubahan sianida menjadi tiosianat. Sedangkan rhodanese tersedia
berlebih dalam tubuh, kekurangan pemberi sulfur yang cocok adalah faktor
adalah dasar pemikiran untuk pengambilan natrium tiosulfat pada keracunan
sianida sehingga kapasitas endogen penghilang racun tubuh ditingkatkan.
6. Profil biokimia/farmakologi lain a. Farmakokinetik
Ketika tiosulfat dosis tinggi disuntikkan pada mamalia, bagian yang lebih
besar dikeluarkan tidak diubah oleh pengeluaran ginjal tapi jumlah tertentu
dioksidasi menjadi sulfat. Bagian kecil terakhir meningkat karena dosis tiosulfat
menurun. Oksidasi tiosulfat menjadi sulfat terjadi dalam hati dengan dua langkah
jalan kecil enzim. Pembelajaran oleh Gilman dkk. (1946) membuktikan bahwa penyuntikan tiosulfat ke dalam pembuluh darah secepatnya disalurkan dalam
tempat cairan extracellular dan bahwa pembuangan ginjalnya terjadi penyaringan
syaraf ginjal. Percobaan hewan lebih lanjut telah menunjukkan bahwa sistem
pengangkutan tabung mungkin juga terjadi (Sörbo, 1972).
Tiosulfat disimpan dan diserap kembali dalam manusia dan anjing, menurut Bucht (1949) dan Foulks dkk. (1952). Pembersihan tiosulfat rendah, tapi
pada tingkat yang tinggi pembersihan sama dengan mutu penyaringan syaraf
ginjal. Ini berarti bahwa pada tingakatan plasma tiosulfat yang tinggi,
penyimpanan Tm (pengiriman maksimal) sama dengan penyerapan kembali Tm,
sedangkan pada tingkat plasma yang rendah seluruh penyaringan dan penyimpanan tiosulfat diserap kembali sehingga ada sebuah pengurangan nilai
pembersihan tiosulfat.
Volume penyaluran, seperti yang ditentukan pada berat anjing 8.5-14.4
Rhodanase
Na2S2O3 + CN- SCN + Na2S2O3
Reaksi katalis sulfurtransferase dimana sulfur sulfan diikutkan,
rhodanase adalah sulfurtransferase yang telah banyak dipelajari secara ekstensif. Rhodanase mengakatalis pengiriman sulfan.
Pembelajaran secara kinetik telah menunjukkan bahwa ada tempat
kationik pada rhodanase untuk pemberi anionik sulfur (Westley dkk,1983)
sebagian besar dosis tiosulfat yang disuntikkan dikeluarkan dan tidak mengalami
perubahan. Tiosulfat dianggap menyebar secara perlahan melalui selaput sel (Himwich dan Saunders, 1948; Sorbo,1962).
Menurut Crompton dkk, (1974), tiosulfat bisa menggunakan pembawa
dikarboksilat untuk memasuki mitokondria, seperti yang ditunjukkan pada
percobaan dengan menggunakan mitokondria pada hati tikus. Sistem ini khusus
pada senyawa anion valensi dua.
Telah ditunjukkan oleh Szczepkowski dkk,(1961) bahwa ketika
menggunakan tiosulfat yang dilabeli 2 atom sulfur mempunyai keuntungan yang
berbeda selama serangkaian proses metabolisme pada hewan. Pada tikus, atom
sulfur dalam dihilangkan sangat cepat dihilangkan dalam bentuk sulfat ketika
atom luar diubah menjadi sulfat lebih lambat, mungkin mulai melalui jumlah tingkat tahap tengah.
Ketika hewan percobaan disuntik dengan tiosulfat yang mengandung 35S
pada posisi sulfannya secara ekslusif. Ini seluruhnya dapat ditemukan berlabel
Percobaan pada anjing (Michefelder dan Tinker,1977; Schulz dkk,1979b)
telah menunjukkan bahwa kapasitas persediaan endogen tiosulfat untuk
menghilangkan sianida dilebihkan jika natrium nitroprusside diatur sebagai infus
yang terus menerus pada rata-rata lebih dari 0,5 mg/kg/jam ketika hewan percobaan menerima dosis yang lebih tinggi dari 0,5/mg/kg/jam, konsentrasi
darah sianida mereka meningkat secara bertahap. Hewan percobaan yang
menerima dosis yang sama mengalami kondisi yang sama tetapi dengan
pemberian infus tiosulfat tambahan 6 x (b/b) dosis natrium nitroprusside tidak
menunjukkan tanda yang tidak normal. Volume urin dalam anjing yang diberi tiosulfat diatas 48 jam periode kira-kira 2x hewan yang tidak diberi, barangkali
berhubungan dengan peningkatan rata-rata formasi tiosianat dan penghasil
osmotik diuresis. Hasil yang sama diperoleh dalam percobaan pada kelinci (Hobel
dkk, 1978).
b. Farmakodinamik
Setelah induksi natrium nitroprusida (SNP) akut. Pemejanan pada kelinci
secara injeksi bolus tiosulfat dan hidroksokbalamin (Vit B12a) pada SNP/
perbandingan konsentrasi molar penawar racun 1:5 sama efektifnya pada
pengurangan tanda awal keburukan asidosis metabolik (Pill dkk,1980). Selama
masa pengamatan berikutnya kelebihan dasar B12a sebagai penawar racun didapati lebih rendah daripada dengan tiosulfat, ketika 2 penawar racun diberikan
secara paralel dengan dosis SNP tinggi natrium tiosulfat terbukti lebih bagus dari
B12a. Pengarang menganjurkan bahwa untuk tujuan klinis SNP harus selalu
Sebuah molekul SNP mengandung 5 ion sianida, sehingga tiosulfat harus
diberikan dalam pervandingan molar paling tidak 5 : 1, yang cocok untuk dosis 4
bagian oleh berat natrium tiosulfat terhadap salah satu SNP. Schulz dkk. (1979b)
menganjurkan bahwa karena tiosulfat dimetabolis dan dihilangkan dengan cepat dari tubuh lebih baik untuk mengaturnya secara berlebih dengan infus yang
berkala.
Chen dkk, (1934) menunjukkan bahwa natrium tiosulfat menghilangkan
racun sianida sampai 3x dosis minimal yang mematikan (MLD), dosis tiosulfat
yang berbeda secara i.p untuk tikus pada waktu yang berbeda setelah penyuntikkan sub lethal atau lethal dosis sianida (Schubert dan Brill, 1968).
Ketika tiosulfat diberikan kepada tikus 5 menit setelah sianida, waktu setelah
penyembuhan dari keracunan sianida sangat diperpendek, tikus diberi tioslufat 10
menit setelah sianida (ketika pencegahan oksidasi sitokrom hati maksimal)
sembuh 5-10 menit kemudian sebagai pengganti 30-40 menit secara normal yang dibutuhkan tanpa perawatan.
c. Toksikologi
Penghilangan hasil sianida, tiosianat, dikeluarkan dalam air seni.
Konsentrasi tiosianat normalnya 1-4 mg/l dalam plasma bukan perokok dan 3-12
mg/l pada perokok. Tiosianat plasma setengah hidup pada pasien dengan fungsi ginjal normal adalah 4 h (Blaschle & Melmon, 1980), tapi pada ginjal yang tidak
normal ini secara jelas diperpanjang dan sehingga resiko keracunan pada para
pasien meningkat (Schulz dkk., 1978). Tingkat tiosianat yang lebih dari 100 mg/l
lemahnya kekejangan otot, rasa muak, penyimpangan orientasi, sakit jiwa, gerak
yang berlebihan, dan pingsan (Smith, 1973; Michenfelder & Tinker, 1977).
Keracunan mematikan pada konsentrasi yang lebih besar dari 180 mg/l telah
dilaporkan (Healy, 1931; Garvin, 1939; Russel & Stahl, 1942; Kessler & Hines, 1948; Domalski dkk., 1953). Haemodialysis dianjurkan sebagai sebuah cara yang
efektif menghilangkan thicyanate (Marbury dkk., 1982). Dialysance yang
berjumlah 82,8 ml/min (in vivo) dan 102,3 ml/min (in vitro) telah dicatat (Pahl &
Vaziri, 1982). Sedikit diketahui tentang sifat pengikat protein tiosianat, dan
haemoperfusion mungkin lebih efektif daripada haemodialisis.
Menurut NIOSH (1986) pemberian secara i.v dosis LD 50 pada tikus 250
mg/kg sedangkan pemberian secara i.v paling rendah mengeluarkan dosis yang
mematikan (LDLO) pada anjing 3000 mg/kg (Dennis dan Feltchef, 1966). Ketika
anjing diberikan 3000 mg/kg Natrium tiosulfat pentahidrat secara i.v (Dennis dan
Feltchef, 1966), efek berikut ini berkembang secara cepat. Metabolik asidosis hipoksemi, hipernatremia dan perubahan pada ECG dan dalam tekanan arteri dan
vena. Dalam percobaan ini kenaikan cepat dan langsung pada konsentrasi serum
natrium akan diharapkan karena isi natrium dalam natrium tiosulfat pentahidrat
kira-kira 24 MEQ/3000 mg dan anjing yang bertahan terhadap suntikan
menunjukkan tanda diuresis yang akan diperkirakan dari dosis osmotik besar yang dilakukan. Dianjurkan bahwa natrium tiosulfat pentahidrat (1500 mg/kg)
diberikan secara i.v pada rata-rata konstan diatas 30 menit/periode ditahan dengan
Selama pelaksanaan SNP kronis infus simultan tiosulfat mungkin
menunjukkan masalah karena akumulasi pembesaran plasma tiosianat dan bahaya
hipofolaemia (Michen Felder dan Tinker, 1977). Fesey dkk. (1985) menganjurkan
bahwa ini cukup untuk memberikan dosis bolus natrium tiosulfat jika hanya dosis SNP atau dosis rata-rata berlebihan. Disitu tampak tidak ada informasi yang
cenderung pada teratogen dan mutagenesis natrium tiosulfat
7. Rute pemberian
Pada keracunan sianida, natrium tiosulfat seharusnya diberikan secara i.v
(penyerapan sangat buruk setelah pelasanaan oral) sebagai penyuntikan bolus atau dengan infus melebihi paling tidak 10 min. Ketika digunakan untuk mencegah
keracunan sianida selama terapi SNP bisa diberikan secara simultan dengan infus
berkala atau , secara alternatif, sebagai penyuntikkan bolus yang lambat
8. Dosis
Dosis awal yang dianjurkan untuk orang dewasa dalam pembuktian keracunan sianida adalah 8-12,5 gram (Chen dkk; 1944; Chen dan Rose, 1952),
atau 0.2 g/kgBB (Sorbo, 1972). Dosis ini berdasarkan kasus individu dimana dosis
ukuran ini telah terbukti efektif data percobaan dan pertimbangan teoritikal
mendukung anjuran ini walaupun kebenaran ini kurang benar. Untuk anak-anak
relatifnya dosis yang lebih tinggi secara umum dianjurkan. Untuk anak-anak dengan konsentrasi hemoglobin normal, dosis kira-kira 410 mg/kgBB telah
dianjurkn (Berlin;1970) dan banyak buku panduan menganjurkan dosis rata-rata
membuat anjuran ini, natrium tiosulfat digunakan dalam kombinasi dengan
penawar racun yang lainnya, terutama natrium nitrit.
Resiko keracunan sianida pada pasien yang melakukan perwatan dengan
SNP didokumentasikan dengan baik, Natrium tiosulfat telah didapati ideal pada situasi ini dan telah dianjurka bahwa rasio B/B untuk SNP dan Natrium tosulfat
seharusnya paling tidak 1:4 (Schulz dkk;1979b) dan terutama untuk mendapat
kelebihan tiosulfat, 1/5-6. Penawar racun bisa diberikan juga dengan infus berkala
secara simultan dengan SNP (Schulz dkk; 1982) atau dengan suntikan bolus.
Dosis awal pada orang dewasa adalah (8-12,5 g natrium tiosulfat diberikan secara injeksi bolus i.v/infus diatas 10-15 min, secara alternatif total
dosis awal bisa dihitung sebagai 150-200 mg/kgBB. Dosis tambahan zat ditandai
menurut rangkaian klinis. Dosis awal pada nak-anak adalah 400 (300-500) mg/kg
BB diberikan secara i.v seperti yang diindikasikan diatas.
Untuk mencehak keracunan sianida selama terapi SNP natrium tiosulfat seharusnya diberikan oleh infus simultan dengan dosis 5-6X melebihi (b/b) dosis
SNP atau secara alternatif, suntikan bolus bisa digunakan.
9. Kontraindikasi
Tidak ada kontra indikasi khusus. Keracunan natrium tiosulfat adalah
rendah dan efek racun seharusnya tidak diharapkan kecuali dosisnya jauh melebihi yang dianjurkan. Pada pasien dengan gangguan fungsi ginjal, dialisis
bisa dianggap untuk penghilangan tiosianat yang lebih cepat (selama perawatan
jangka panjang). Dosis yang dianjurkan diatas seharusnya tidak diubah pada kaus
10. Efek samping
Efek samping adalah kecil dan tidak terlalu penting dibandingkan untuk
resiko jika dihubungkan dengan keracunan sianida. Injeksi cepat dari larutan
hiperosmolar natrium tiosulfat dapat menyebabkan nausea dan vomiting (Ivankovich dkk;1983). Adanya hipotensi keduanya dimungkinkan pada
pembentukan dari tiosianat, dimana diketahui untuk dapat terjadi nya hipotensif
(Done,1961) efek samping lainnya yang berhubungan dengan produksi tiosianat
adalah nausea, headache dan disorientasi. Jika tiosulfat telah diinjeksikan ke
anjing (Vesey dkk;1985) tidak ada efek samping dimana terlihat yang memperantarai hipotensi. Efek diuretik dan ga ngguan tekanan osmotik adalah
efek samping yang mungkin dapat terjadi (Martindale,1989).
11. Penggunaan pada kehamilan/menyusui
Termasuk dalam kategori C berdasarkan FDA (Olson, 2007), studi
terhadap binatang percobaan telah memeperlihatkan adanya efek samping pada janin (teratogenik atau embriosidal atau efek samping lainnya) dan tidak ada studi
terkontrol pada wanita hamil. Obat hanya diberikan jika manfaat yang diperoleh
lebih besar daripada risiko yang mungkin terjadi pada janin (Anonim, 2006).
D. Anatomi Fisiologi 1. Jantung
Fungsi utama jantung adalah sebagai pompa dalam sistem transport yang
lainnya dari satu bagian tubuh ke bagian tubuh lainnya. Jantung sebagai pompa
merupakan salah satu bagian dari sistem kardiovaskular disamping sistem
pembuluh darah dan darah. Ketiga komponen tersebut dapat dipengaruhi oleh zat
toksik (Stine and Brown, 1996)
Jantung Merupakan organ berotot yang memompa darah ke arteri.
Dindingnya terdiri dari 3 lapisan :
a. Endokardium (lapisan yang paling dalam, yang kontak dengan darah)
(Bergman, Adel, and Paul, 1996).
b. Miokardium terdiri dari otot jantung dan berhubungan dengan tunika media dari dinding pembuluh darah. (Bergman, 1996).
c. Epikardium (lapisan terluar) (Bergman, 1996).
2. Lambung
Lambung memiliki sejumlah fungsi disamping penyimpanan makanan
dan pengendalian pelepasannya kedalam duodenum. Asam hidroklorida membunuh banyak bakteri yang ditelan. Sel parietalis dalam mukosa lambung
juga mensekresi faktor intrinsik, suatu senyawa yang diperlukan bagi absorpsi
sianokobalamin (vitamin B 12) dari usus halus.
3. Usus halus
Terbagi menjadi 3 bagian, yaitu duodenum, bagian awal; bagian tengah, jejunum; dan bagian akhir adalah ileum. Lipatan mukosal dan submukosal nya
berbentuk plicae circulares, valves of keckring, atau valvulae conniventes.
Lipatan- lipatan tersebut tidak terdapat pada bagian awal duodenum, paling banyak
lapisan sama seperti yang ada di lambung, yaitu mukosa, submukosa, muskularis
eksterna, dan serosa (kecuali pada bagian duodenum, yang mana adalah
retroperitoneal dan karena itulah tidak terdapat lapisan terluar mesotelial, turunan
dari peritoneum) (Bergman, 1996).
Usus halus atau usus dua belas jari dan usus besar adalah bagian dari
usus. Panjang usus halus sekitar 4-7 meter, panjangnya bervariasi sejalan dengan
kontraksi dan relaksasi dinding otonya (Anonim, 1987). Usus halus dibagi
menjadi dupdenum, jejenum, dan ileum. Usus halus mempunyai dua fungsi utama
yaitu pencernaan dan absorpsi bahan-bahan nutrisi dan air. Mukosa pada usus halus terselubung dengan vili yang bentuknya seperti jari- jari, yang membuat
usus halus mempunyai permukaan yang luas (sekitar 10 m2 ). Terdapat sekitar
25-40 vili/mm2 , setiap vili panjangnya sekitar 1 mm. Pada duodenum dan jejenum,
mukosa terbenam di dalam lipatan- lipatan dan vili panjang-panjang dan sangat
rapat. Mengarah ke ileum, lapisan mukosanya lebih sedikit lipatannya, dindingnya lebih tipis, dan vilinya lebih pendek dan lebih jarang. Semua pencernaan dan
penyerapan yang penting terjadi didalam usus halus. Baik lambung maupun usus
besar dapat diangkat seluruhnya tanpa menyebabkan dampak yang serius.
Kira-kira sampai sepertiga usus halus dapat diangkat tanpa memberikan efek pada
pencernaan, dan daya tahan hidup masih dapat dimungkinkan dengan kira-kira 1 meter usus halus dalam keadaan utuh (Anonim, 1987b).
4. Hati
Hati mempunyai banyak fungsi kompleks, di antaranya pembentukan
protein plasma, pentak-aktifan sejumlah hormon polipeptida, pengurangan dan
konjugasi hormon korteks adrenalis dan steroid gonad. Sintesis
25-hidroksikolekalsiferol, detoksikasi banyak obat dan toksin, dan banyak fungsi
yang berhubungan dengan metabolisme lemak (Ganong, 1995). Ketika produk dari pencernaan mencapai hati, maka produk-produk ini dipecah menjadi
bentuk-bentuk senyawa anorganik baru:
Hati merupakan kelenjar terbesar pada tubuh manusia yang terdiri dari 4
bagian, lobus yang tidak lengkap yang terpisah, tertutup oleh selaput jaringan
penghubung (selaput Glisson) dan terselubungi secara tidak lengkap oleh peritoneum. Bagian selaput yang lebih tebal adalah pada bagian hilum (porta
hepatik), dimana pembuluh darah dan pembuluh limfa serta saluran empedu yang
keluar dan masuk hati (Bergman, 1996).
5. Ginjal
Ginjal berfungsi memfilter sampah nitrogen terutama sebagai urea dan toksin-toksin lain dari darah dan mengontrol kehilangan air dan elektrolit dalam
urine, dengan demikian mempertahankan keseimbangan yang tepat dari substansi
ini dalam tubuh. Dengan mengendalikan komposisi dan volume cairan
ekstraseluler, yang memelihara lingkungan yang diatur secara ketat yang
diperlukan oleh sel-sel yang strukturnya sangat rumit dan halus jika ingin sel-sel ini berfungsi dengan tepat (Anonim, 1987b).
6. Paru
Paru berfungsi sebagai alat pernafasan, Fungsi sistem pernafasan adalah