i
UJI AKTIVITAS ANTIOKSIDAN MENGGUNAKAN RADIKAL 1,1-DIFENIL-2-PIKRILHIDRAZIL (DPPH) DAN PENETAPAN KANDUNGAN FENOLIK TOTAL FRAKSI ETIL ASETAT EKSTRAK ETANOLIK DAUN BENALU (Dendrophthoe pentandra L. Miq.) DI POHON
KEPEL (Stelechocarpus burahol (Bl.) Hook. f.)
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh : Willigis Danu Patria
NIM: 098114028
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
i
UJI AKTIVITAS ANTIOKSIDAN MENGGUNAKAN RADIKAL 1,1-DIFENIL-2-PIKRILHIDRAZIL (DPPH) DAN PENETAPAN KANDUNGAN FENOLIK TOTAL FRAKSI ETIL ASETAT EKSTRAK ETANOLIK DAUN BENALU (Dendrophthoe pentandra L. Miq.) DI POHON
KEPEL (Stelechocarpus burahol (Bl.) Hook. f.)
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh : Willigis Danu Patria
NIM: 098114028
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
iv
HALAMAN PERSEMBAHAN
“Pusat terbaik adalah
prinsip
tetapi pusat yang terbaik adalah
Yesus dan Keselamatan.
Karena dalam penggambarannya semua pusat adalah
kacamata-kacamata
.
Namun pusatnya adalah Yesus yaitu sebagai
matanya
.
Kemungkinan kacamata prinsip adalah aplikatif yang berguna untuk di laksanakan”
Catatan seorang ayah (alm.)
Kupersembahkan Skripsi ini untuk :
Tuhan Yesus Kristus, Sang Jalan, Pelindung, dan Keselamatan, yang telah menuntun jalanku sampai saat ini.
Ibu dan Ayah (alm) yang telah merawat dan mendidik aku sampai saat ini, adik-adikku yang selalu ku sayangi.
“ Cintaku pada kalian selamanya”
Semua keluarga besar Eyang Suberta, Eyang Mangkuatmaja, Eyang Mujiran atas dukungan baik moril dan materil.
vii
PRAKATA
Puji syukur kepada Tuhan karena berkat rahmat dan karunia-Nya penulis dapat menyelesaikan skripsi yang berjudul “Uji Aktivitas Antioksidan Menggunakan Radikal 1,1-Difenil-2-Pikrilhidrazil (DPPH) dan Penetapan Kandungan Fenolik Total Fraksi Etil Asetat Ekstrak Etanolik Daun Benalu (Dandrophtoe Petandra L. Miq.) di Pohon Kepel (Stelechocarpus Burahol (Bl.) Hook. F.)” sebagai salah satu syarat guna memperoleh gelar Sarjana Farnasi Universitas Sanata Dharma Yogyakarta.
Dalam proses penelitian dan penyusunan skripsi ini tidak lepas dari bantuan dan dukungan dari semua pihak sehingga skripsi ini dapat terselesaikan dengan baik. Oleh karena itu, pada kesempatan ini penulis ingin mengucapkan terimakasih yang sebesar-besarnya kepada :
1. Prof. Dr. CJ. Soegihardjo, Apt. sebagai Dosen Pembimbing yang telah memberikan bimbingan, pengarahan serta ilmu dalam penelitian dan penyusunan skripsi ini.
2. Yohanes Dwiatmaka, M.Si. sebagai Dosen Penguji atas pengarahan dan kesediaannya menguji skripsi ini.
3. Lucia Wiwid Wijayanti, M.Si. sebagai Dosen Penguji atas pengarahan dan kesediaannya menguji skripsi ini.
4. Ipang Djunarko, M.Sc., Apt. sebagai Dekan Fakultas Farmasi Universitas Sanata Dharma.
viii
6. Gissela Haryuningtiyas yang selalu memberikan dukungan dan semangat kepada penulis.
7. DPPH team (Aldo Kristian, Mikhael Gustandy, dan Anthony Felix) terimakasih atas kerjasama yang telah dilewati bersama dalam penelitian ini. 8. Teman-teman Farmasi kelas A angkatan 2009 dan FST 2009 khususnya Hera
dan Wanda yang membantu dan memberi semangat disaat penulis merasa putus asa.
9. Semua pihak yang telah memberi dukungan dan bantuan yang tidak dapat disebutkan satu persatu.
Penulis menyadari bahwa penyusunan skripsi ini banyak kekurangan dan jauh dari sempurna, untuk itu dengan segala kerendahan hati penulis mengharapkan saran dan kritik guna perbaikan dan penyempurnaan skripsi ini. Harapan penulis semoga penelitian dan penyusunan skripsi ini bermanfaat bagi perkembangan ilmu pengetahuan khususnya di bidang Farmasi.
Yogyakarta, Januari 2013
ix
DAFTAR ISI
Halaman
HALAMAN JUDUL……….. i
HALAMAN PERSETUJUAN PEMBIMBING………. ii
HALAMAN PENGESAHAN……… iii
HALAMAN PERSEMBAHAN………. iv
PERYATAAN KEASLIAN PENULIS……….. v
LEMBAR PERYATAAN PERSETUJUAN PUBLIKASI KARYA……. vi
PRAKATA………. vii
DAFTAR ISI……….. ix
DAFTAR TABEL……….. xiv
DAFTAR GAMBAR……….. xvi
DAFTAR LAMPIRAN………... xviii
INTISARI………... xix ABSTRACT………... xx BAB I PENGANTAR………. 1 A. Latar Belakang……… 1 1. Permasalahan………. 3 2. Keaslian penelitian……… 3 3. Manfaat penelitian……….... 4
4. Tujuan umum dan khusus ... 5
BAB II PENELAAHAN PUSTAKA……….. 6
A. Tanaman Benalu………... 6
x
2. Morfologi tanaman…..……….. 6
3. Deskipsi tanaman……… 7
4. Penyebaran tanaman………... 7
5. Kandungan kimia benalu ……….. 7
B. Senyawa Fenolik………... 8
C. Antioksidan……….. 10
D. Metode DPPH………... 11
E. Metode Senyawa Fenolik Total ... 12
E. Ekstraksi ……… 12
F. Validasi Metode Analisis ………... 13
1. Akurasi ……….. 14 2. Presisi ……… 14 3. Linearitas ……….. 15 4. Selektivitas ……… 15 G. Spektrofotometri ………... 16 H. Landasan Teori ………. 17 I. Hipotesis ………... 18
BAB III METODOLOGI PENELITIAN……….. 19
A. Jenis dan Rancangan Penelitian………. 19
B. Variabel……….. 19
1. Variabel bebas………... 19
2. Variabel tergantung……… 19
xi
4. Variabel pengacau tak terkendali……….. . 20
C. Definisi Operasional... 20
D. Bahan dan Alat Penelitian ... 20
1. Bahan penelitian ... 20
2. Alat penelitian ... 20
E. Tatacara Penelitian ... 21
1. Determinasi tanaman ... 21
2. Pembuatan dan penyiapan bahan (simplisia) ... 21
3. Ekstraski simplisia ... 22
4. Pembuatan fraksi etil asetat ... 23
5. Pembuatan larutan pembanding uji ... 23
6. Uji pendahuluan ... 25
7. Optimasi metode uji aktivitas antioksidan ... 25
8. Uji aktivitas antioksidan ... 26
9. Optimasi metode penetapan kandungan fenolik total ... 27
10. Penetapan kandungan fenolik total ... 28
BAB IV HASIL DAN PEMBAHASAN ... 30
A. Hasil Determinasi Tanaman ... 30
B. Hasil Pengumpulan Bahan ... 30
C. Hasil Preparasi Sampel ... 31
1. Hasil ekstraksi sampel ... 31
2. Hasil fraksinasi ekstrak... 34
xii
1. Uji pendahuluan aktivitas antioksidan ……… 37
2. Uji pendahuluan senyawaan fenolik ……… 38
E. Hasil Optimasi Metode Uji Aktivitas Antioksidan……….. 39
1. Penentuan panjang gelombang serapan maksimum ( λ maks) …… 39
2. Penentuan Operating Time (OT)……… 40
F. Hasil Validasi Metode Uji Aktivitas Antioksidan………..……... 42
1. Lineritas metode uji antioksidan……….... 43
2. Presisi metode uji antioksidan……….... 45
3. Spesifisitas metode uji antioksidan………...……. 46
G. Hasil Estimasi Aktivitas Antioksidan dengan Radikal DPPH….……. 47
H. Hasil Optimasi Metode Penetapan Kandungan Fenolik Total…..…… 48
1. Penentuan operating time (OT)………...……... 58
2. Penentuan panjang gelombang maksimum………..…... 59
I. Hasil Validasi Metode Penetapan Kandungan Fenolat Total………... 59
1. Linearitas metode penetapan kandungan fenolik total……….. 60
2. Presisi metode penetapan kandungan fenolik total……… 60
3.Spesifisitas metode penetapan kandungan fenolik total………. 61
J. Estimasi Penetapan Kandungan Fenolik Total ..……… 61
BAB V KESIMPULAN DAN SARAN………. 64
A. Kesimpulan……… 64
B. Saran……….. 64
xiii
LAMPIRAN……… 69
xiv
DAFTAR TABEL
Halaman Tabel I. Kriteria nilai akurasi yang masih dapat diterima
menurut APVMA (2004) ... 14 Tabel II. Kriteria Nilai Presisi yang Masih dapat Diterima
menurut APVMA (2004) ... 15 Tebel III . Hasil Scanning panjang gelombang maksimum DPPH..….. 40 Tabel IV. Hasil pengukuran absorbansi seri baku kuersetin yang
direaksikan dengan DPPH ... 44 Tabel V. Hasil pengukuran absorbansi seri fraksi etil asetat ekstrak
etanolik daun benalu yang direaksikan dengan DPPH ... 44 Tabel VI. Nilai presisi uji aktivitas antioksidan kuersetin ...……….... 45 Tabel VIII. Nilai presisi uji aktivitas antioksidan fraksi etil asetat …… 46 Tabel VIII Hasil aktivitas antioksidan kuersetin dengan menggunakan
metode DPPH ... 51 Tabel IX. Hasil aktivitas antioksidan fraksi etil asetat ekatrak etanolik
daun benalu dengan metode DPPH………. 52 Tabel X. Hasil perhitungan IC50 rutin dan fraksi etil asetat ekstrak
etanolik daun benalu ... 53 Tabel XI. Perbandingan IC50 benalu dari berbagai inang... 57 Tabel XII. Penggolongan tingkat kekuatan antioksidan kuersetin dan
Fraksi etil asetat ekstrak etanol daun benalu ... 57 Tabel XIII. Hasil scanning panjang gelombang maksimum asam galat
xv
Tabel XIV. Hasil pengukuran absorbansi seri baku asam galat
yang direaksikan dengan folin ciocalteu ... 60 Tabel XV. Nilai presisi seri baku asam galat pada penetapan
kandungan fenolik total ... 61 Tabel XVI. Nilai penentuan jumlah fenolik total fraksi etil asetat
xvi
DAFTAR GAMBAR
Halaman Gambar 1. Struktur kimia dari beberapa tipe flavonoid
(Shandar et al., 2011) ………. 9 Gambar 2. 1,1-diphenyl-2-picrylhydrazyl (radikal bebas) dan
1,1-diphenyl-2-picrylhydrazyl (non radikal)
(Molyneux, 2003) ……… 12
Gambar 3. Persiapan ekstraksi (A= daun yang akan diserbukan,
B= daun yang telah diserbukan) ………. 33 Gambar 4. Pemakaian alat (A=Corong pisah, B= Integrasi vaccum
dan corong Buchner, C= vaccum rotary evaporator) ……. 37 Gambar 5. Hasil uji pendahuluan aktivitas antioksidan (A =
kontrol negatif [blanko], B = larutan uji [fraksi etil asetat ekstrak etanol daun benalu], C =kontrol positif
[kuersetin] ……….. 38
Gambar 6. Hasil uji pendahuluan fenolik (A = kontrol negatif [blanko], B = larutan uji [fraksi etil asetat ekstrak
etanolik daun benalu], C =kontrol positif [asam galat]) … 39 Gambar 7. Grafik penentuan OT kuersetin (Replikasi 2)………. 40 Gambar 8. Grafik penentuan OT fraksi etil asetat (Replikasi 2)…….. 41 Gambar 9. Pendekatan skema reaksi yang mungkin terjadi
antara radikal 2,2-difenil-1-pikril hidrazil (DPPH) dengan bentuk transformasi dengan DPPH ataupun
xvii
Gambar 10. Kurva persamaan regresi linier aktivitas
antioksidan kuersetin ………. 51
Gambar 11. Kurva persamaan regresi linier aktivitas antioksidan fraksi
etil asetat ………...……….. 53
Gambar 12. Diagram alur uji hipotesis variable numerik (Dahlan, 2012)….. 54 Gambar 13. Histogram rerata IC50 dari kuersetin dan fraksi etil
asetat dengan interval kepercayaan 95%……… 56 Gambar 14. Grafik penentuan OT asam galat (Replikasi 1)……… 58 Gambar 15. Kurva kalibrasi asam galat dalam penetapan fenolik total… 63
xviii
DAFTAR LAMPIRAN
Halaman Lampiran 1. Surat pengesahan determinasi tanaman benalu
(Dendrophthoe pentandra (L.) Miq.) ... ... 69
Lampiran 2. Gambar tanaman benalu yang diambil di kompleks Universitas Sanata Dharma ... 70
Lampiran 3 Perhitungan rendemen ... 71
Lampiran 4. Data penimbangan untuk pengujian aktivitas Antioksidan ... 72
Lampiran 5. Data perhitungan konsentrasi DPPH, larutan pembanding, dan larutan uji ... 73
Lampiran 6. Scanning pengkoreksi ... 74
Lampiran 7. Optimasi metode uji aktivitas antioksidan ... 79
Lampiran 8. Uji aktivitas antioksidan menggunakan radikal DPPH ... 86
Lampiran 9. Perhitungan nilai IC50 kuersetin dan fraksi etil asetat ekstrak etanol daun benalu124 ... 81
Lampiran 10. Penimbangan uji kandungan fenolik total ... 90
Lampiran 11. Scanning kontrol asam galat ... 91
Lampiran 12. Optimasi penentuan kandungan fenolik total ... 91
Lampiran 13. Penentuan kandungan fenolik total ... 95
Lampiran 14. Uji statistik ... 100
xix
INTISARI
Antioksidan memiliki kemampuan untuk menangkap radikal bebas. Radikal bebas ini dapat mengoksidasi asam nukleat, protein, lipid atau DNA sehingga menimbulkan penyakit degeneratif. Komponen antioksidan yang terdapat pada tanaman seperti asam fenolat, polifenol dan flavanoid akan menangkap radikal bebas seperti peroksida, hidroperoksida atau lipid peroksil dan juga menghambat mekanisme oksidatif yang menunjukan penyakit degeneratif. Benalu (Dendrophthoe pentandra (L.) Miq.) memiliki kandungan utama kuersetin dan kuersetin 3-o-rhamnosida, salah satu jenis flavonoid, yang mampu memberikan aktivitas antioksidan.
Daun benalu yang telah dikeringkan diekstrak dengan etanol 70%, kemudian dilanjutkan dengan fraksinasi dengan etil asetat. Aktivitas antioksidan fraksi etil ekstrak etanolik dihitung menggunakan metode DPPH dan didapatkan nilai IC50. Dilakukan juga penentuan fenolik total yang menunjukkan jumlah senyawa fenolik yang memengaruhi aktifitas antioksidan yang dinyatakan dengan nilai massa ekuivalen asam galat per massa fraksi (mg ekuivalen asam galat per g fraksi etil asetat esktrak etanol).
Hasil penelitian menunjukkan bahwa fraksi etil asetat ekstrak etanolik daun benalu mempunyai aktivitas antioksidan dengan nilai IC50 sebesar (12,57 ± 0,7) μg/mL (taraf kepercayaan 95%). dan tergolong dalam aktivitas antioksidan sangat kuat. Kandungan fenolik total sebesar (13,76±0,9) mg (taraf kepercayaan 95%) ekivalen asam galat per gram fraksi etil asetat ekstrak etanol daun benalu dan metode belum tervalidasi.
Kata kunci: Antioksidan, daun benalu (Dendrophthoe pentandra (L.) Miq.), fraksi etil asetat, DPPH, kandungan fenolik total
xx
ABSTRACT
Antioxidant have the ability to capture free radicals. These free radicals can oxidize nucleic acids, proteins, lipids or DNA, causing degenerative diseases. Antioxidants compound found in plants such as phenolic acids, polyphenols and flavanoids would capture free radicals such as peroxide, hydroperoxide or lipid peroxyl and also inhibit the oxidative mechanisms that show degenerative diseases. Chemical constituents from mistletoes (Dendrophthoe pentandra (L.) Miq.) are quercetin and quercetin 3-o -rhamnosida, one type of flavonoids, which are able to provide antioxidant activity.
Mistletoes dried and extracted with 70% ethanol, followed by fractionation with ethyl acetate. Antioxidant activity of ethyl acetate fraction from ethanol extract was calculated using DPPH method and obtained IC50 values. Do
also the determination of total phenolic compounds that show the amount of phenolic antioxidant activity that otherwise affect the value of the mass of gallic acid equivalents per mass fraction (mg gallic acid equivalent per g of ethyl acetate fraction of ethanol extracts).
The results showed that the ethyl acetate fraction from ethanolic mistletoes leaf extract has antioxidant activity with IC50 value of (12.57 ± 0.7) mg
/ mL (95% confidence interval), and belong to the very powerful antioxidant activity. The content of total phenolic (13.76±0.9) mg (95% confidence interval) gallic acid equivalents per gram of ethyl acetate fraction from ethanol extract of leaves of the mistletoes and the method not validated.
Keywords: Antioxidant, leaf parasite (Dendrophthoe pentandra (L.) Miq.), Ethyl acetate fraction, DPPH, total phenolic content
1
BAB I PENGANTAR A. Latar Belakang
Oksigen dibawa oleh darah untuk proses metabolime di dalam tubuh. Oksigen dapat membantu sel mengubah nutrisi menjadi energi, namun oksigen ini dapat teroksidasi sehingga terbentuk molekul yang tidak stabil karena metabolisme di dalam tubuh maupun faktor luar seperti merokok, polusi, dan lain sebagainya. Molekul tidak stabil tersebut lalu berubah menjadi sebuah radikal bebas. Radikal bebas ini sangat reaktif sehingga menimbulkan banyak penyakit pada manusia seperti kanker dan penyakit kardiovaskular serta dapat menyebabkan oksidatif yang menyerang protein, DNA, dan lipid (Jacobi and
Burri, 1996).
Karakteristik utama antioksidan adalah kemampuan untuk menangkap radikal bebas. Radikal yang terkandung dalam sistem biologis dapat mengoksidasi asam nukleat, protein, lipid atau DNA dan menimbulkan penyakit degenaratif. Komponen antioksidan yang terdapat pada tanaman seperti asam fenolat, polifenol dan flavanoid akan menangkap radikal bebas seperti peroksida, hidroperoksida atau lipid peroksil, dan juga menghambat mekanisme oksidatif yang menimbulkan penyakit degeneratif (Prakash, 2001).
Indonesia kaya akan berbagai keanekaragaman hayati yang berpotensi untuk dikembangkan sebagai obat atau bahan baku obat. Survei tentang obat di Amerika Serikat yang diakui oleh Food and Drug Administration pada periode 1983-1994 menunjukkan bahwa 157 dari 520 (30%) jenis obat berasal dari bahan
alam atau turunannya, dimana 61% senyawa antikanker yang diakui juga berasal dari bahan alam atau turunannya. Survei ini menunjukkan terdapat 119 senyawa yang digunakan sebagai obat yang berasal dari 90 spesies tumbuhan di dunia, dimana 77% dari hasil penelitian, tumbuhan digunakan secara tradisional (ethnomedicine) (Cordell, 2000). Oleh karena itu, perlu adanya eksplorasi aktivitas tanaman obat sehingga memperkaya informasi tanaman obat.
Benalu adalah tanaman yang kurang diperhatikan karena sifatnya sebagai tanaman parasit. Tanaman benalu secara empiris memiliki kasiat sebagai antikanker. Benalu (Dendrophthoe pentandra (L.) Miq.) juga memiliki aktivitas antioksidan, namun aktivitas antioksidannya dipengaruhi oleh tanaman inang yang ditumbuhinya. Benalu (Dendrophthoe pentandra (L.) Miq.) pada inang mangga teh, kenanga, dan belimbing memiliki nilai IC50 yang berbeda (Artanti, Widayati, dan Fajriah, 2009). Tanaman Kepel diketahui memiliki aktivitas antioksidan sangat kuat dengan IC50 sebesar 6,43 µg/mL (Sunarni, Pramono, dan
Asmah, 2007). Berdasarkan latar belakang tersebut, maka dalam penelitian ini ingin mengetahui seberapa besar aktivitas antioksidan benalu (Dendrophthoe pentandra (L.) Miq.) pada tanaman kepel (Stelechocarpus burahol (Bl)Hook. f.). Untuk mendukung hasil aktivitas antioksidan yang didapatkan maka pada penelitian ini juga dilakukan penentuan jumlah fenolik total untuk mempresentasikan jumlah fenolik yang menyebabkan aktivitas antioksidan. Menurut Huang, Boxin, and Prior (2005) fenolik total ini memiliki korelasi yang baik dengan aktivitas antioksidan sehingga dapat dilakukan penelitian terhadap keduanya.
1. Permasalahan
a. Nilai aktivitas antioksidan fraksi etil asetat ekstrak etanol daun benalu pada inang yang dinyatakan sebagai IC50 melalui pengujian menggunakan metode DPPH.
b. Kandungan fenolik total fraksi etil asetat ekstrak etanol daun benalu pada inang kepel yang dinyatakan dengan massa ekivalen asam galat.
2. Keaslian penelitian
Sejauh pengamatan penulis, penelitian tentang uji aktivitas antioksidan daun benalu (Dendrophthoe pentandra) pernah dilakukan:
a. Fajriah, Darmawan, Sundowo, dan Artanti(2007) “Isolasi Senyawa Antioksidan dari Ekstrak Etil Asetat Daun Benalu Dendrophthoe pentandra L. Miq. yang Tumbuh pada Inang Lobi-Lobi.”
Penelitian ini menggunakan benalu yang tumbuh pada pohon lobi-lobi yang di ekstrak dengan etil asetat kemudian dipisahkan dengan kromatografi cair menggunakan eluen bergradien n-heksana, etil asetat, dan metanol. Fraksi yang diperoleh dianalisis dengan kromatografi lapis tipis dan disemprot dengan DPPH untuk mengetahui aktivitas antioksidannya. Selanjutnya senyawa aktif diidentifikasi menggunakan FT-IR dan GC-MS.
b. Widowati, Mozef, Risdian, Ratnawati, Tjahjani, and Sandra(2011) “The Comparison of Antioxsidative and Proliferation Inhibitor Properties of Piper betle L., Catharanthus roseus (L) G. Don., Dendrophthoe pentandra L., Curcuma mangga Val. Extracts on T47D Cancer Cell Line”.
Tanaman benalu diambil dari pohon mangga yang ditanam di daerah Bogor. Benalu dan beberapa tanaman lainnya kemudian di uji aktivitas antioksidannya menggunakan DPPH dan uji aktivitas antikanker dengan uji MTS.
c. (Artanti, Widayati, dan Fajriah(2009) “Aktivitas Antioksidan dan Toksisitas Ekstrak Air dan Etanol daun Benalu (Dendrophthoe pentandra (L.) Miq yang Tumbuh pada Berbagai Inang.”
Tanaman benalu diambil dari berbagai inang diekstrak dengan air dan etanol kemudian dibandingkan aktivitas antioksidan dengan metode DPPH dan toksisitasnya dengan menghitung LC50 dari larva Artemia salina.
Perbedaan antara penelitian ini dengan penelitian sebelumnya adalah dalam penelitian ini benalu diambil dari pohon kepel yang terdapat pada kompleks Universitas Sanata Dharma Maguwoharjo, Sleman, Yogakarta, dengan keadaan dikeringkan untuk mendapatkan fraksi etil asetat dari ekstrak etanol daun benalu kemudian diuji aktivitas antioksidan menggunakan radikal DPPH dan ditetapkan kandungan fenolik totalnya dengan menggunakan instrumen spektrofotometer UV-VIS.
3. Manfaat penelitan
a. Manfaat praktis. Penelitian ini diharapkan dapat memberi informasi bagi penelitian lebih lanjut maupun masyarakat luas mengenai potensi ekstrak daun benalu pada pohon inang kepel.
b. Manfaat teoritis. Penelitian ini diharapkan dapat memberikan sumbangan pada perkembangan ilmu pengetahuan dalam bidang farmasi, khususnya tentang penggunaan metode DPPH dalam menguji aktivitas antioksidan bahan alam.
4. Tujuan umum dan khusus
a. Tujuan umum. Menguji aktivitas antioksidan fraksi etil asetat ekstrak etanol daun benalu pada pohon inang kepel menggunakan metode penangkapan radikal bebas DPPH.
b. Tujuan khusus. Mengetahui nilai aktivitas antioksidan fraksi etil asetat ekstrak etanol daun benalu pada pohon inang kepel dengan menggunakan radikal bebas DPPH yang dinyatakan dengan IC50 dan mengetahui nilai kandungan
fenolik total fraksi etil asetat ekstrak etanol daun benalu pada pohon inang kepel yang dinyatakan dalam mg ekivalen asam galat per gram fraksi etil asetat ekstrak etanolik.
6
BAB II
PENELAAHAN PUSTAKA
A.Tanaman Benalu 1. Klasifikasi tanaman
Klasifikasi tanaman benalu dalam sistematika tumbuhan adalah sebagai berikut.
Kingdom : Plantae (Tumbuhan)
Subkingdom : Tracheobionta (Tumbuhan berpembuluh) Super Divisi : Spermatophyta (Menghasilkan biji) Divisi : Magnoliophyta (Tumbuhan berbunga) Kelas : Magnoliopsida (berkeping dua / dikotil) Sub Kelas : Rosidae
Ordo : Santales Famili : Loranthaceae
Genus : Dendrophthoë Mart.
Spesies : Dendrophthoe pentandra (L.) Miq.
(Backer and Bakhuizen, 1965).
2. Morfologi tanaman
Benalu ini memiliki karakteristik batang agak tegar, gundul kecuali pada pucuk-pucuk muda. Daun tumbuh tersebar atau sedikit berhadapan, menjorong, panjangnya 6-13 cm, dan lebar 1,5-8 cm, pangkal menirus-membaji, ujung tumpul runcing, panjang tangkai daun 5-20 mm. Bunga yang tumbuh pada ruas-ruas,
tandan dengan 6-12 bunga. Jumlah mahkota bunga 5 meruas, menyudut atau bersayap dibagian bawah dan menyempit dibagian leher, dibagaian ujung tumpul, berwarna hijau atau kuning-orange, panjang tabung bunga 6-12 mm. Kepala sari dengan panjang 2-5 mm dan tumpul (Samiran, 2005).
3. Deskripsi tanaman
Benalu merupakan tanaman setengah parasit karena sifatnya yang dapat berfotosintesis. Pada benalu terdapat alat hisap yang disebut haustorium, yang sifatnya dapat mengambil nutrisi dari tanaman inangnya. Mekanisme tumbuhnya benalu diperantarai oleh burung. Burung akan memakan biji benalu,namun karena biji tersebut juga menghasilkan lendir yang lekat maka biji tersebut melekat pada paruh burung tersebut. Kemudian burung akan mengoleskan biji tersebut pada dahan pohon lain yang kemudian akan menjadi bibit tanaman benalu yang tumbuh pada pohon yang menjadi inangnya (Pracaya, 2007).
4. Penyebaran tanaman
Penyebarannya dari Indonesia sampai Cina; Semenanjung Malaya, Sumatra, Jawa, Kalimantan, Nusa Tenggara, dan Fillipina. Habitat benalu ini pada umumnya di hutan hujan atau di hutan-hutan yang terbuka dan di perkebunan dataran rendah sampai ketinggian 500 m dpl (Valkenburg, 2003).
5. Kandungan kimia benalu
Jenis flavonoid yang merupakan kandungan utama benalu adalah
quercetin 3-rhamnoside dan kaempferol 3-rhamnoside (Sukpondma, Rukachaisirikul, and Jasakul, 2000). Kadar kuersetin dari tanaman benalu yang didapat dari inang teh masing-masing sebesar 2,7 mg/g dan 9,6 mg/g untuk benalu
Macrosolen avenis dan Scurrula oortiana. Kadar kuersetin pada tanaman benalu
Scurrula oortiana dari Beunying yang tumbuh pada pohon kopi sebesar 6,1 mg/g ; Benalu Scurrula parasitica yang tumbuh di pohon Jure 5,1 mg/g; sedang pada benalu Dendrophthoe pentandra yang tumbuh pada puring sebesar 35,1 mg/g; dan pada tanaman randuuntuk benalu Dendrophthoe pentandra sebesar 39,8 mg/g (Rosidah, Yulinah, dan Gana,1999). Isolat yang diisolasi dari ekstrak air daun benalu D. pentandra adalah senyawa quercetin 3-o-ramnosida, yang merupakan salah satu senyawa aktif antioksidan dari golongan flavonoid dengan nilai IC50 9,4
ppm (Darmawan dan Artanti, 2006).
B.Senyawa Fenolik
Senyawa fenolik merupakan kelompok molekul yang besar dan beragam, seperti metabolit sekunder aromatik dari beberapa famili yang berbeda di suatu tanaman. Fenolik ini merupakan salah satu metabolit sekunder yang melimpah di suatu tanaman yang dapat diklasifikasikan menjadi senyawa yang tidak larut seperti tanin, lignin, asam hidroksisinamat, dan senyawa larut seperti asam fenolat, fenilpropanoid, favonoid dan kuinon (Harborne and Williams, 2000).
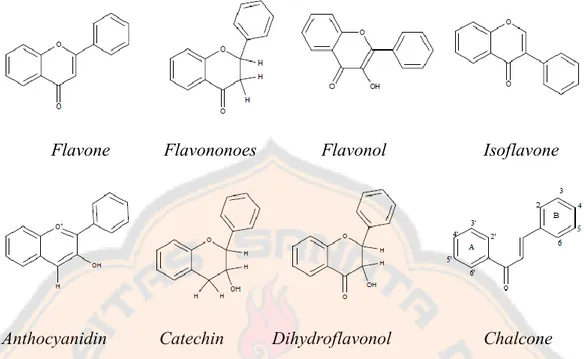
Flavonoid berbeda dalam penyusunan gugus hidroksil, metoksi dan bagian gugus glikosida dan dalam konjugasi antara cincin A dan B. Variasi dalam cincin C merupakan pembagian dalam subkelas. Dilihat dari struktur molekular mereka, maka dapat dibagi dari delapan kelas (Shandar, Kumar, Prasher, Tiwari, Shalhan, and Sharma, 2011).
Flavone Flavononoes Flavonol Isoflavone
Anthocyanidin Catechin Dihydroflavonol Chalcone
Gambar 1. Struktur kimia dari beberapa tipe flavonoid (Shandar, et al., 2011). Flavonoid (bagian glikosida) dapat terdegradasi oleh aksi enzim ketika diambil dari material tanaman yang masih segar atau tidak dikeringkan. Maka disarankan untuk dilakukan pengeringan ketika material akan digunakan, dan dibuat menjadi serbuk. Untuk ekstraksi, pelarut yang digunakan sesuai dengan tipe flavonoid yang terkandung. Polaritas sangat penting dibutuhkan disini. Flavanoid yang kurang polar (contoh: isoflavon, flavanon, metilasi flavon, dan flavonol) diekstraksi dengan kloroform, diklorometan, dietil eter, atau etil asetat, sedangkan flavonoids glikosida dan aglikon yang lebih polar diekstraksi dengan alkohol atau alkohol dengan campuran air. Glikosida yang mempunyai kelarutan yang tinggi di dalam air dan larutan alkohol-air yang sesuai (Andersen and
C. Antioksidan
Antioksidan adalah senyawa yang dapat secara langsung menahan pembentukan radikal bebas dan terbagi atas 3 jenis, yaitu: antioksidatif, penangkap radikal bebas, dan pengkelat. Antioksidan dan penangkap radikal bebas secara umum dikatakan sama, namun tidak selalu. Sebagai contoh, etanol adalah penangkap radikal bebas hidroksil tetapi tidak pernah ditujukan sebagai antioksidan. Pada pengertian awal, antioksidan dideskripsikan sebagai penghambat proses oksidatif, di mana dapat bereaksi dengan radikal peroksil (Desisov and Afanas’ev, 2005).
Karakteristik utama antioksidan adalah kemampuannya untuk menangkap radikal bebas. Reaktif radikal bebas dan spesies oksigen yang terkandung dalam sistem biologis yang ada di sistem biologis. Radikal bebas ini dapat mengoksidasi asam nukleat, protein, lipid atau DNA dan dapat menimbulkan penyakit degenaratif. Komponen antioksidan yang terdapat pada tanaman seperti asam fenolat, polifenol dan flavanoid akan menangkap radikal bebas seperti peroksida, hidroperoksida atau lipid peroksil dan juga menghambat mekanisme oksdiatif yang menunjukan penyakit degeneratif (Prakash, 2001).
Kapasitas antioksidan adalah menurunnya kecepatan dari antioksidan sehingga terjadi pemutuskan ikatan rantai. Aksi inhibitor dari antioksidan akan muncul setelah kita mengkonsumsi. Durasi efek inhibitor dalam mekanisme aksi antioksidan dan aktivitas di tempat reaksi akan hilang ketika antioksidan ini sangat sedikit dikonsumsi (Desisov and Afanas’ev, 2005).
D. Metode DPPH
Metode DPPH. merupakan cara yang cepat dan mudah untuk mengevaluasi aktivitas antiradikal pada antioksidan, tetapi juga menyajikan model kinetika reaksi DPPH yang stabil. Modifikasi metode pengukuran telah dilakukan pada metode DPPH• untuk setiap kasus kinetika. Beberapa senyawa bereaksi sangat cepatdengan DPPH•, dan mengurangi sejumlah DPPH• dengan molekul yang sama dengan jumlah gugus hidroksil yang tersedia. Namun, untuk sebagian besar senyawa diuji, reaksi berjalan sangat lambat dan kompleks (Bondet, 1996).
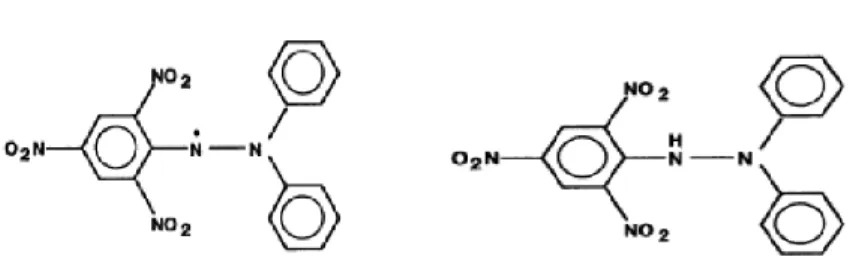
Molekul dari 1,1-diphenyl-2-picrylhydrazyl(α,α-diphenyl-β-picrylhydrazyl)
dikarakteristikan sebagai radikal bebas yang stabil yang terlihat dari penggambaran delokalisasi dari pembagian elektron secara keseluruhan oleh karena itu, molekul tidak dimerisasi akan sama pada kebanyakan dari radikal bebas yang lain. Dekolisasi juga menunjukkan warna violet, yang diabsorbsi pada larutan etanol pada panjang gelombang 520 nm (Molyneux, 2003).
Prinsip metode ini adalah melihat kemampuan antioksidan dengan mengukur pengurangan intensitas warna dari DPPH akibat penangkapan elektron radikal DPPH oleh antioksidan yang menjadi berikatan dengan hidrogennya DPPH-H. Hasil dari pengurangan warna ini merupakan stokiometri terhadap jumlah dari elektron yang ditangkap (Bondet, et al., 1997).
Gambar 2. 1,1-diphenyl-2-picrylhydrazyl (radikal bebas) (kiri) dan 1,1-diphenyl-2-picrylhydrazyl (non radikal) (kanan) (Molyneux, 2003).
E. Metode Senyawa Fenolik Total
Metode kolorimetri yang biasa digunakan adalah Folin Ciocalteu, salah satu metode yang memiliki reaksi oksidasi yang cepat dengan fenol dengan menggunakan alkali (biasanya sodium karbonat), dimana nilai yang didapat signifikan dengan konsentrasi ion fenolat (Cicco dan Latanzio, 2011). Estimasi kandungan fenolik total dilakukan dengan cara memberikan reagen Folin Ciocalteu dan reaksi yang terjadi adalah oksidasi dari ion fenolat senyawa uji oleh pereaksi fenol Folin-Ciocalteu, dimana oksidasi dari senyawa fenol oleh reagen molibdotungstat menghasilkan produk dengan warna biru sekitar panjang gelombang 745-750 nm (Ronald et al., 2005).
F. Ekstraksi
Ekstrak adalah sediaan pekat yang diperoleh dengan mengekstraksi zat aktif dari simplisia nabati atau simplisia hewani menggunakan pelarut yang sesuai, kemudian semua atau hampir semua pelarut diuapkan dan massa atau serbuk yang tersisa diperlakukan sedemikian hingga memenuhi baku yang ditetapkan (Depkes RI a, 1995).
Maserasi merupakan proses yang tepat dimana obat yang sudah halus direndam dengan pelarut sampai meresap dan melunakkan susunan sel, sehingga zat-zat yang mudah larut akan melarut. Dalam proses maserasi, bahan biasanya ditempatkan dalam wadah atau bejana bermulut lebar. Bersama pelarut yang sudah ditetapkan, bejana ditutup rapat, dan isinya dikocokberulang-ulang selama 2-14 hari. Penggojokan memungkinkan pelarut mengalir berulang-ulang keseluruh permukaan dari bahan yang sudah halus (Ansel, 1989).
Prinsip ekstraksi menggunakan prinsip like dissolve like. Komponen yang bersifat polar akan mudah larut dalam pelarut polar dan komponen yang bersifat non polar akan mudah larut dalam pelarut non polar. Kelarutan suatu komponen juga dipengaruhi oleh kemampuan zat pelarut untuk membentuk ikatan hidrogen dengan pelarut (Depkes RI, 1986)
Substansi fenolik dapat diekstraksi dari material tanaman menggunakan sebagian tanaman dengan melihat kepolarannya. Secara umum, pelarut yang baik dengan penurunan nilai kepolaran seperti: air, metanol 80% atau etanol 70%, aseton 80%, dan etil asetat. Fenolik antioksidan secara keseluruhan, dibagi berdasarkan kelas-kelasnya seperi asam fenolik, asam hidroksisinamat, flavonoids, dan keratenoid (Huang, Boxinand Prior, 2005).
G. Validasi Metode Analisis
Pada penggunaan metode yang berbeda harus digunakan validasi untuk melihat potensi dari metode tersebut sehingga sangat penting memahami objektivitas validasi untuk membuktikan prosedur yang digunakan sesuai untuk tujuan yang diharapkan (Chan, Lam, Lee andZhang, 2004).
1. Akurasi
Akurasi pada prosedur analisis menggambarkan kedekatan hasil yang kita dapatkan dengan nilai yang sebenarnya baik nilai yang kita dapatkan dan dari suatu referensi tertentu (Chan, et al., 2004). Kecermatan dinyatakan sebagai persen perolehan kembali (recovery).Untuk recovery dikatakan baik jika pada analit dengan konsentrasi kurang dari 0,1% (b/v) memiliki nilai sekitar 75-125% (Kingstone, 2004).
Tabel I. Kriteria Nilai Akurasi yang Masih dapat Diterima Menurut APVMA (2004)
Kadar zat aktif (%)
Nilai Recovery yang masih dapat diterima (%) > 10 98-102 1-10 90-110 0,1-1 80-120 <0,1 75-125 2. Presisi
Keseksamaan diukur sebagai simpangan baku atau simpangan baku relatif (koefisien variasi). Keseksamaan dapat dinyatakan sebagai keterulangan (repeatability) atau ketertiruan (reproducibility) (Harmita, 2004). Definisi ripitabilitas dari ICH adalah gambaran keterulangan dengan dibawah pengaruh dari operasi sistem yang sama setealah interval waktu yang singkat. Ripitabilitas metode dapat dideterminasi dari multiple replikasi preparasi dari sampel yang sama. Dilakukan dengan cara multiple preparasi sampel (n=6) pada eksperimen yang sama atau dengan menyiapkan tiga kali replikasi dengan tiga konsentrasi berbeda (Chan, et al., 2004).
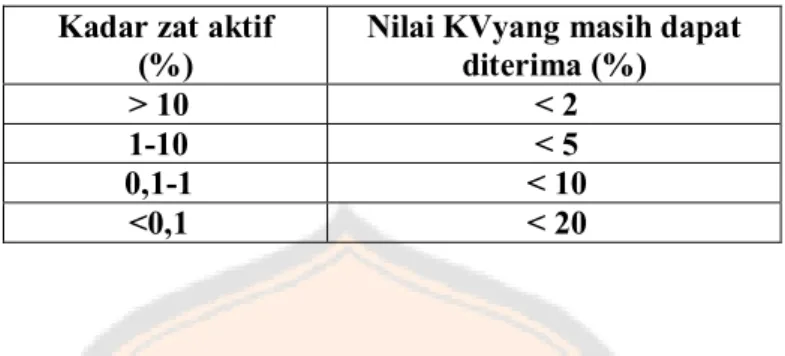
Tabel II. Kriteria Nilai Presisi yang Masih dapat Diterima Menurut APVMA (2004)
Kadar zat aktif (%)
Nilai KVyang masih dapat diterima (%) > 10 < 2 1-10 < 5 0,1-1 < 10 <0,1 < 20 3. Linearitas
Linearitas menunjukan ukuran seberapa baik kurva kalibrasi dalam garis lurus, terlihat dari respon yang sebanding dengan jumlah analit. Target konsentrasi dari analit dalam preparasi obat dengan lima larutan standar dalam kurva linearitas dengan jarak 0,5-1,5 kali konsentrasi analit. Setiap standar harus dipreparasi dan dianalisis sebanyak tiga kali (Harris, 2010).
4. Selektivitas (Spesifisitas)
Selektivitas atau spesifisitas suatu metode adalah kemampuannya yang hanya mengukur zat tertentu saja secara cermat dan seksama dengan adanya komponen lain yang mungkin ada dalam matriks sampel (Harmita, 2004). Spesifisitas dapat meliputi akurasi dan presisi, kemurnian reagen, toleransi alat, menggunakan bahan standar bersertifikat untuk analit dalam sampel yang akan dianalisis. Metode analisis harus menghasilkan jawaban yang dapat diterima mendekati nilai standar baku. Blanko yang terhitung akan menjadi pengganggu saat pengukuran analit pada saat penyiapan sampel dan saat analisis. Jumlah terhitung pada blanko yang terdeteksi ini mungkin merupakan sampel sebelumnya yang tertinggal pada alat kaca atau instrument (Harris, 2010).
H. Spektrofotometri
Spektrum tampak terdapat pada rentang panjang gelombang 400 nm (ungu) sampai 750 nm (merah), sedangkan spektrum ultraviolet terdapat pada rentang panjang gelombang 100 nm sampai 400 nm. Absorbansi cahaya ultraviolet atau cahaya tampak mengakibatkan suatu transisi elektronik yaitu promosi elektron-elektron dari orbital keadaan dasar yang berenergi rendah ke orbital keadaan tereksitasi yang berenergi lebih tinggi. Energi yang terserap selanjutnya terbuang sebagai kalor, sebagai cahaya, atau tersalurkan dalam reaksi kimia (Fessenden dan Fessenden, 1986).
Absorbsi energi direkam sebagai absorban. Absorban pada sutau panjang gelombang tertentu didefinisikan sebagai :
A= log 𝐼°
𝐼
Dengan: A = absorbans
Iº = Intensitas berkas cahaya rujukan
I = Intensitas berkas cahaya sampel
Absorban suatu senyawa pada suatu panjang gelombang tertentu bertambah dengan molekul yang mengalami transisi. Oleh karena itu absorban bergantung pada struktur elektronik senyawanya dan juga pada kepekatan sampel (Fessenden dan Fessenden, 1986).
Output dari spektrofotometri UV-Vis dapat berupa spekra UV-Vis yang dapat digunakan sebagai informasi kualitatif dan dapat digunakan untuk analisis kuantitatif Dari aspek kualitatif spektroskopi UV dan Vis menghasilkan data berupa panjang gelombang maksimal, intensitas, efek, pH, dan pelarut yang
kesemuanya dapat dibandingkan dengan data yang sudah dipublikasikan sebelumnya. Dari aspek kuantitatif suatu berkas radiasi dikenakan pada larutan sampel (cuplikan) yang akan diiukur dan intensitas sinar radiasi yang diteruskan tersebut kemudian diukur besarnya. Intensitas atau kekuatan radiasi cahaya sebanding dengan jumlah foton melalui satu satuan luas penampang per detik (Gandjar, dan Rohman, 2007).
I. Landasan Teori
Antioksidan adalah senyawa yang dapat secara langsung menahan pembentukan radikal bebas. Karakteristik utama antioksidan adalah kemampunnya untuk menangkap radikal bebas yang terkandung dalam sistem biologis. Radikal bebas ini dapat mengoksidasi asam nukleat, protein, lipid atau DNA dan dapat menimbulkan penyakit degenaratif seperti kanker. Komponen antioksidan yang terdapat pada tanaman benalu seperti kuersetin dan kamferol akan menangkap radikal bebas seperti peroksida, hidroperoksida atau lipid peroksil dan juga menghambat mekanisme oksdiatif yang menunjukan penyakit degeneratif.
Benalu adalah tanaman setengah parasit dengam memiliki alat hisap yang disebut haustorium, yang digunakan untuk mengambil nutrisi dari tanaman inangnya namun juga dapat menghasilkan fotosintesis. Benalu memiliki aktivitas antioksidan, namun aktivitas antioksidannya dipengaruhi inang dari benalu. Tanaman kepel memiliki aktivitas antioksidan yang tergolong sangat kuat.
Kemampuan antioksidan dilihat dengan mengukur pengurangan intensitas warna dari DPPH akibat penangkapan elektron radikal DPPH oleh antioksidan yang menjadi berikatan dengan hidrogennya DPPH-H. Hasil dari pengurangan warna ini merupakan stokiometri terhadap jumlah dari elektron yang ditangkap.
Estimasi kandungan fenolik total dilakukan dengan cara memberikan reagen Folin Ciocalteu dan reaksi yang terjadi adalah oksidasi dari ion fenolat senyawa uji oleh pereaksi Folin-Ciocalteu. Dimana oksidasi dari senyawa fenol oleh reagen molibdotungstat menghasilkan produk warna biru sekitar panjang gelombang 745-750 nm.
J. Hipotesis
Fraksi etil asetat ekstrak etanol daun benalu memiliki aktivitas antioksidan dinyatakan sebagai IC50 dan memiliki kandungan fenolik yang dinyatakan dengan massa ekivalen asam galat per gram fraksi etil asetat.
19
BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini termasuk jenis penelitian eksperimental murni.
B. Variabel
1. Variabel bebas berupa konsentrasi fraksi etil asetat ekstrak etanol benalu. 2. Variabel tergantung berupa kemampuan fraksi etil asetat ekstrak etanol
benalu untuk menangkap radikal DPPH (%IC).
3. Variabel pengacau terkendali berupa tempat tumbuh tanaman, waktu pemanenan, variasi jenis benalu.
4. Variabel pengacau tak terkendali berupa cahaya matahari, curah hujan, cuaca, kelembapan ruangan, umur daun, dan komposisi senyawa penyusun ekstrak.
C. Definisi Operasional
1. Ekstrak etanolik daun benalu adalah sari hasil proses maserasi daun benalu dengan penyari etanol 70%.
2. Fraksi etil asetat adalah fase non polar hasil fraksinasi ekstrak etanol daun benalu dengan menggunakan etil asetat.
3. Persen inhibition concentration (%IC) adalah persen yang menyatakan kemampuan fraksi etil asetat ekstrak etanolik daun benalu untuk menangkap
radikal DPPH dilihat dari pengurangan absorbansi menggunakan spektroskopi visible.
4. Persen inhibition concentration 50 (IC50) adalah nilai konsentrasi fraksi etil asetat ekstrak etanolik daun benalu yang menghasilkan penangkapan 50% radikal DPPH dilihat dengan pengurangan absorbansi menggunan spektroskopi
visible.
D. Bahan dan Alat Penelitian 1. Bahan penelitian
Bahan yang digunakan dalam penelitian ini adalah: daun benalu
(Dendrophthoe pentandra L. Miq) yang diambil dari pohon kepel (Stelechocarpus burahol (Bl) Hook. f.) yang terdapat di taman Universitas Sanata Dharma, kampus III, Paingan (Yogyakarta); akuades(Laboratorium Kimia Analisis Instrumental Fakultas Farmasi Universitas Sanata Dharma); bahan kualitas p.a. E. Merck, yaitu: metanol, bahan kualitas p.a. SigmaChem. Co., USA, yaitu: DPPH, reagen Folin-Ciocalteu, asam galat, dan kuersetin;bahan kualitas teknis Brataco Chemica, yaitu: wasbensin dan etil asetat; bahankualitas teknis CV. General Laboratorium, yaitu: etanol 70%; dan aluminium foil.
2. Alat penelitian
Alat yang digunakan dalam penelitian ini adalah: neraca analitik (Scaltec SBC 22, BP 160P), vacuum rotary evaporator (Junke & Kunkel), waterbath
(labo-tech, Heraeus), vortex (Janke & Kunkel), spektrofotometer UV-Vis (Perkin Elmer Lamda 20), blender, corong Buchner, oven, mikropipet 10-1000μL; 1-10
mL (Acura 825, Socorex), tabung reaksi bertutup, dan alat-alat gelas yang lazim digunakan di laboratorium analisis (Pyrex-Germany dan Iwaki).
E. Tata Cara Penelitian
1. Determinasi tumbuhan daun benalu (Dendrophthoe pentandra L. Miq)
Determinasi tanaman benalu dilakukan di Laboratorium Farmakognosi Fitokimia Universitas Sanata Dharma, Fakultas Biologi Universitas Sanata Dharma. Determinasi tanaman ini untuk memastikan bahwa tanaman yang digunakan untuk penelitian benar-benar tanaman benalu (Dendrophthoe pentandra L. Miq).
2. Pembuatan dan penyiapan bahan (simplisia)
a. Pengumpulan bahan.Tanaman benalu diperoleh dari taman Universitas Sanata Dharma (Yogyakarta). Pengumpulan pada musim kemarau bulan Juli tahun 2012. Pemanenan dilakukan pada tanaman yang menjelang berbunga saat pagi hari.
b.Sortasi basah. Bahan baku dipisahkan dari bahan-bahan pengganggu seperti tanah, krikil, rumput, bagian tanaman yang tidak dibutuhkan (tangkai, biji, dan bunga), bagian dari tanaman lain (tangkai, daun, bunga dan biji inang), bahan yang rusak dan lain-lain.
c.Pencucian. Pencucian herba benalu dilakukan dengan menggunakan air mengalir yang berasal dari air sumur. Sejumlah daun benalu dicuci dengan cara dialiri air sumur sambil dibersihkan kotoran yang melekat pada daun. Pencucian ini dilakukan sebanyak tiga kali.
d. Pengeringan. Daun benalu yang masih basah dikeringkan pada sinar matahari secara tidak langsung. Cara pengeringan adalah bahan dihamparkan di atas nampan bambu dengan diatur agar tidak terlalu menumpuk dan diusahakan agar bahan (daun) tidak menggulung, kemudian ditutup kain hitam dan dilakukan penjemuran di bawah sinar matahari pada pukul 09.00 (pagi) sampai pukul 15.00 (sore). Posisi daun harus sering dibalik sehingga pemanasan dapat merata. Akhir pengeringan ditandai dengan mudah dipatahkannya bahan simplisia.
e. Sortasi kering. Sejumlah simplisia yang sudah kering (ditandai dengan mudah hancur ketika diremas) dipisahkan dari bahan-bahan pengganggu seperti tanah, krikil, bahan yang rusak dan lain-lain (khususnya tanpa pencucian).
f. Perajangan atau penyerbukan simplisia. Simplisia yang telah kering dan disortasi basah ditumbuk sampai halus, kemudian dilakukan pengayakan untuk memperoleh serbuk yang lebih halus dengan ayakan dengan nomor mesh 40. g. Pengepakan dan penyimpanan. Sejumlah simplisia yang telah halus kemudian dibungkus dengan menggunakan kantong plastik kedap udara dengan cara dibungkus rapat. Penyimpanan dilakukan di suhu ruangan
3. Ekstraksi simplisia
Simplisia yang telah dihaluskan ditimbang sebanyak 30 g dan dituang kedalam bejana maserasi, ditambah etanol 70% sampai terendam sempurna, dan dicampur homogen. Campuran dimasersi pada suhu ruangan selama dua hari. Filtrat diperoleh melalui penyaringan dengan corong Buchner. Ampas penyaringan diremaserasi dengan etanol 70% secukupnya selama 2 hari kemudian
disaring. Lalu hasil penyaringan filtrat diuapkan pelarutnya hingga diperoleh ekstak etanol daun benalu.
4.Pembuatan fraksi etil asetat
Ekstrak etanol daun benalu ditambahkan 300 mL air hangat dan di ekstraksi cair-cair menggunakan wasbensin dengan perbandingan larutan ekstrak wasbensin (1:1 v/v), kemudian didiamkan hingga terpisah sempurna. Fase air akan berada pada paling bawah, sedangkan fase washbensin berada pada bagian atas.
Hasil partisi diperoleh dua fraksi, yaitu fraksi wasbensin dan fraksi air. Selanjutnya, fraksi air diekstraksi cair-cair lagi menggunakan etil asetat dengan perbandingan larutan fraksi air-etil asetat (1:1 v/v) sehingga didapatkan fraksi air dan etil asetat. Setelah dipisahkan fraksi etil asetat diuapkan dengan vacum rotary evaporator dan waterbath hingga didapakan ekstrak kental. Lalu hasil fraksi tersebut digunakan analisis lebih lanjut.
5. Pembuatan larutan pembanding dan uji
a. Pembuatan larutan DPPH. DPPH sebanyak 15,7 mg diambil dan dilarutkan metanol p.a ke dalam labu ukur 100 mL sehingga diperoleh larutan DPPH dengan konsentrasi 0,4 mM. Larutan tersebut ditutup dengan alumunium foil dan harus selalu dibuat baru.
b. Pembuatan larutan stok kuersetin. Kuersetin diambil 2,5 mg ke dalam labu takar 10,0 mL, kemudiandilarutkan dengan metanol p.a sampai batas tanda.
c. Pembuatan larutan pembanding.Larutan stok kuersetin diambil sebanyak 0,2; 0,3; 0,4; 0,5; 0,6 mL, kemudian ditambahkan metanol p.a sampai 10,0 mL,
sehingga diperoleh konsentrasi larutan standar kuersetin sebesar 5,0; 7,5; 10,0; 12,5; dan 15,0 μg/mL.
d. Pembuatan larutan uji
1) Larutan uji untuk aktivitas antioksidan. Fraksi etil asetat ditimbang sebanyak 25,0 mg ke dalam labu takar 25,0 mL, kemudiandilarutkan dengan metanol p.a sampai batas tandasebagai larutan stok. Larutan stok diambil sebanyak 2 mL ke dalam labu takar 10,0 mL, kemudian ditambahkan metanol p.a sampai batas tanda sebagai larutan intermediet. Larutan intermediet diambil sebanyak 0,6; 0,9; 1,2; 1,5; 1,8 mLke dalam labu takar 10,0 mL,kemudian ditambahkan metanol p.a sampai batas tanda. Konsentrasi larutan uji sebesar 6,05; 9,07; 12,10; 15,12; 18,14 μg/mL.
2) Larutan uji untuk penentuan kandungan fenolik total. Fraksi etil asetat ditimbang sebanyak 10,1 mg ke dalam labu takar 10,0 mL, lalu ditambahkan metanol p.a sampai batas tanda sehingga diperoleh konsentrasi larutan uji sebesar 141,7 μg/mL.
e. Pembuatan larutan asam galat. Larutan asam galat dibuat dengan konsentrasi 500 μg/mL dalam akuades : metanol (1:1). Larutan asam galat diambil sebanyak 1,0; 1,5; 2,0; 2,5; dan 3,0 mL ke dalam labu takar 10,0 mL, kemudian ditambahkan akuades : metanol (1:1) sampai batas tanda, sehingga diperoleh konsentrasi larutan baku asam galat sebesar 50; 75; 100; 125; dan 150 μg/mL.
6. Uji pendahuluan
a. Uji fenolik.Larutan uji dengan konsentrasi 750,0 μg/mL dan larutan pembanding asam galat 150,0 μg/mL diambil sebanyak 0,5 mLkemudian ditambahkan 2,5 mL pereaksi fenol Folin-Ciocalteu yang telah diencerkan dengan akuades (1:10 v/v) kedalam tabung reaksi laludidiamkan selama 10 menit. Larutan natrium karbonat 1 M ditambahkan sebanyak 7,5 mL, kemudian amati warna larutan tersebut.
b. Uji pendahuluan aktivitas antioksidan. Larutan DPPH diambil sebanyak 1 mL dimasukan ke dalam masing-masing tiga tabung reaksi. Larutan DPPH ditambahkan masing-masing dengan 1 mL metanol p.a, larutan pembanding kuersetin 37,5 μg/mL, dan larutan uji 200,0 μg/mL. Selanjutnya, larutan tersebut ditambahkan dengan 3 mL metanol p.a. Larutan tersebut kemudian divortex selama 30 detik. Setelah 30 menit, amati warna pada larutan tersebut.
7. Optimasi metode uji aktivitas antioksidan
a. Penentuan panjang gelombang serapan maksimum.Larutan DPPHdimasukan masing-masing 0,5; 1,0; 1,5 mLpada 3 labu ukur 10 mL,. Ditambahkan larutan tersebut dengan metanol hingga tanda batas sehingga konsentrasi DPPH menjadi 0,020; 0,040; dan 0,080 mM. Larutan tersebut kemudian divortex selama 30 detik. Diamkan selama OT. Lalu dilakukan scanning panjang gelombang serapan maksimum dengan spektrofotometer visibel pada panjang gelombang 400-600 nm.
b. Penentuan operating time (OT).Larutan DPPH sebanyak 2 mL dimasukan kedalam masing-masing tiga labu ukur 5 mL, ditambahkan masing-masing
dengan 1 mL larutan pembanding kuersetin 12,5; 37,5 dan 62,5 μg/mL. Selanjutnya larutan tersebut ditambahkan dengan metanol p.a hingga tanda batas. Larutan tersebut kemudian divortex selama 30 detik. Setelah itu dibaca absorbansinya denga spektrofotometer visibel pada panjang gelombang
scanninghasil dari serapan panjang gelombang selama 1 jam. Dilakukan demikian juga untuk larutan uji 100; 200; 300 μg/mL.
8. Uji aktivitas antioksidan
a. Pengukuran absorbansi larutan DPPH (kontrol).Larutan DPPHdimasukkan sebanyak 2 mLpada labu ukur 10 mL dan ditambahkan metanol p.a hingga tanda batas. Kemudian larutan tersebut dibaca absorbansinya pada saat OT dan panjang gelombang maksimum. Pengerjaan dilakukan sebanyak 3 kali. Larutan ini digunakan sebagai kontrol untuk menguji larutan pembanding dan uji.
b. Pengukuran absorbansi larutan pembanding dan uji.Larutan DPPH sebanyak 2 mL dimasukkan ke dalam labu ukur 10,0 mL kemudian ditambah dengan 2 mL larutan pembanding dan uji pada berbagai seri konsentrasi yang telah dibuat. Selanjutnya larutan tersebut ditambah dengan metanol hingga tanda batas. Larutan tersebut kemudian divortex selama 30 detik dan didiamkan selama OT. Larutan dibaca absorbansinya dengan spektrofotometer visibel pada panjang gelombang maksimum hasil optimasi. Pengujian dilakukan dengan 3 kali replikasi.
c. Validasi metode uji aktivitas antioksidan. Hasil dari prosedur 7 a dan b divalidasi presisi (%CV) spesipisitas (spektra kontrol), dan linearitas (nilai r).
% CV = 𝑆𝑡𝑎𝑛𝑑𝑎𝑟 𝐷𝑒𝑣𝑖𝑎𝑠𝑖 𝑆𝐷 𝑘𝑜𝑛𝑠𝑒𝑛𝑡𝑟𝑎𝑠𝑖 𝑡𝑒𝑟𝑢𝑘𝑢𝑟
9. Optimasi metode penetapan kandungan fenolik total
Optimasi metode penetapan kandungan fenolik total ditentukan dengan menggunakan metode spektrofotometri sesuai dengan penelitian Rollando ( 2012). a. Penentuan OT. Larutan asam galat sebanyak 0,5 mL 50; 100; dan 150 μg/mL ditambahkan dengan 5 mL reagen Folin-Ciocalteu yang telah diencerkan dengan air (1:10 v/v). Larutan selanjutnya ditambahkan dengan 4,0 mL natrium karbonat 1 M. Setelah itu, dibaca absorbansinya dengan spektrofotometer visibel pada panjang gelombang 750 nm selama 30 menit.
b. Penentuan panjang gelombang maksimum. Larutan asam galat diambil sebanyak 0,5 mL 50; 100; dan 150 μg/mL ditambahkan dengan 5 mL reagen Folin-Ciocalteu yang telah diencerkan dengan air (1:1 v/v). Larutan selanjutnya ditambahkan dengan 4,0 mL natrium karbonat 1 M. Diamkan selama OT,
absorbansinya dibaca pada λ maksimum dengan spektrofotometer visibel pada panjang gelombang 600-800 nm.
10. Penetapan kandungan fenolik total
a. Pembuatan kurva baku asam galat. Larutan asam galat diambil sebanyak 0,5 mL 50; 75; 100; 125; dan 150 μg/mL ditambah dengan 5 mL reagen Folin-Ciocalteu yang telah diencerkan dengan air (1:1 v/v). Larutan selanjutnya ditambah dengan 4,0 mL natrium karbonat 1M. Setelah OT, absorbansinya dibaca pada λ maksimum terhadap blanko yang terdiri atas akuades : metanol p.a (1:1), reagen Folin-Ciocalteu dan larutan natrium karbonat 1M. Pengerjaan dilakukan 3 kali.
b. Validasi metode penetapan kandungan fenolik total. Hasil dari prosedur 9 b, divalidasi presisi (%CV), spesipisitas (spektra kontrol), dan linearitas (nilai r).
% CV = 𝑆𝑡𝑎𝑛𝑑𝑎𝑟 𝐷𝑒𝑣𝑖𝑎𝑠𝑖 𝑆𝐷 𝑘𝑜𝑛𝑠𝑒𝑛𝑡𝑟𝑎𝑠𝑖 𝑡𝑒𝑟𝑢𝑘𝑢𝑟
𝑟𝑎𝑡𝑎 −𝑟𝑎𝑡𝑎 𝑘𝑜𝑛𝑠𝑒𝑛𝑟𝑎𝑠𝑖 𝑡𝑒𝑟𝑢𝑘𝑢𝑟 𝑥 100 %
c. Estimasi kandungan fenolik total larutan uji. Diambil 0,5 mL larutan uji 750 μg/mL, lalu masing-masing dimasukan ke dalam labu takar 10,0 mL dan dilanjutkan sebagaimana perlakuan pada pembuatan kurva baku asam galat . Kandungan fenolik total dinyatakan sebagai gram ekivalen asam galat (mg ekivalen asam galat per g fraksi etil asetat). Lakukan 3 kali replikasi.
F. Analisis Hasil
Aktivitas penangkapan radikal DPPH (%) dihitung dengan rumus : 𝐴𝑏𝑠𝑜𝑟𝑏𝑎𝑛𝑠𝑖(𝑙𝑎𝑟𝑢𝑡𝑎𝑛 𝑘𝑜𝑛𝑡𝑟𝑜𝑙 − 𝐴𝑏𝑠𝑟𝑜𝑏𝑎𝑛𝑠𝑖 𝑠𝑎𝑚𝑝𝑒𝑙 (𝑙𝑎𝑟𝑢𝑡𝑎𝑛 𝑝𝑒𝑚𝑏𝑎𝑛𝑑𝑖𝑛𝑔/𝑢𝑗𝑖)
𝐴𝑏𝑠𝑜𝑟𝑏𝑎𝑛𝑠𝑖 𝑙𝑎𝑟𝑢𝑡𝑎𝑛 𝑘𝑜𝑛𝑡𝑟𝑜𝑙 𝑥100 % Data aktivitas tersebut dianalisis dan dihitung nilai IC50 mengunakan persamaan regresi linear dengan sumbu x adalah konsentrasi larutan uji maupun pembanding, sedangkan sumbu y adalah %IC. Lalu dianalisis secara statistik untuk menentukan ada atau tidak adanya perbedaan bermakna antara IC50 larutan pembanding dan larutan uji.
Uji kandungan fenolik total menghasilkan nilai mg ekivalen asam galat dalam per g fraksi etil asetat. Nilai tersebut didapatkan dari analisis regresi linier dengan data kurva baku secara intrapolasi.
29
BAB IV
HASIL DAN PEMBAHASAN
A. Hasil Determinasi Tanaman
Determinasi tanaman adalah langkah awal yang harus dilakukan dari suatu penelitian dengan menggunakan suatu sampel berupa tanaman. Determinasi tanaman bertujuan untuk mengetahui dan memastikan kebenaran identitas tanaman yang akan digunakan dalam penelitian untuk menghindari terjadinya kesalahan dalam pengambilan sampel analisis fitokimia. Determinasi tanaman Benalu (Dendrophthoe pentandra (L.) Miq) telah dilakukan di Laboratorium Farmakognosi-Fitokimia, Fakultas Farmasi Universitas Sanata Dharma dengan acuan buku “Flora untuk Sekolah di Indonesia” karanganvan Steenis (1981). Pembuktian dikuatkan dengan surat determinasi (lampiran 1) tanaman yang dikeluarkan oleh Laboratorium Kebun Tanaman Obat Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
B. Hasil Pengumpulan Bahan
Daun benalu diperoleh dari beberapa pohon kepel yang ditumbuhi tanaman parasit benalu di kompleks Kampus Sanata Dharma, Desa Paingan, Kecamatan Maguwoharjo, Kabupaten Sleman, Yogyakarta. Tanaman benalu yang dipilih adalah benalu dengan spesies Dendrophthoe pentandra dengan mencocokan gambar yang telah dipastikan kebenarannya. Hal ini dilakukan untuk memudahkan membantu pengambilan tanaman agar tidak terjadi kesalahan dalam
pengambilan tanaman yang dimaksud. Kemudian tanaman benalu dideterminasi dengan Flora untuk Sekolah di Indonesia untuk memastikan kebenarannya. Daun benalu dipanen dengan kriteria-kriteria berikut ini, yaitu pada musim kemarau pada bulan Juli, saat tanaman berbunga pada pagi hari. Tanaman benalu dikumpulkan dan diambil daunnya yang masih segar, tidak kuning tanpa ada klasifikasi umur tanaman.
Pemanenan dilakukan pada pagi hari dengan tujuan agar daun dalam kondisi segar. Proses pemanenan tidak dilakukan pada siang hari karena akan mengakibatkan kandungan metabolit sekunder yang berfungsi sebagai antioksidan akan berkurang (Andayani, Lisawati dan Maimunah, 2008), senyawa-senyawa antioksidan seperti flavonoid yang terkandung dalam daun merupakan sistem pertahan pada infeksi jamur dan radiasi UV (Cusnie and Lamp, 2005). Daun yang diambil tidak terlalu muda karena kandungan metabolit sekunder yang belum sempurna. Tanman diambil yang belum terlalu tua (tidak berwarna kuning atau coklat), karena daun yang kuning atau coklat kandungan kimianya banyak yang sudah hilang (berkurang).
C. Hasil Preparasi Sampel 1. Hasil ekstraksi sampel
Tujuan dilakukan ekstraksi sampel adalah mengumpulkan senyawa kimia yang terkandung dalam daun benalu yang kemungkinan mengandung senyawa-senyawa sebagai antioksidan. Dalam proses penyarian digunakan tanaman yang telah dikeringkan dan diserbukan. Tanaman yang masih segar ataupun tanaman
yang telah dikeringkan dapat digunakan sebagai sumber untuk mengumpulkan senyawa pada tanaman (Tiwari et al., 2011). Penelitian ini digunakan tanaman yang telah dikeringkan dikarenakan senyawa dapat mengalami kerusakan bila senyawa segar dan tidak dikeringkan karena tanaman memiliki enzim yang dapat merusak senyawa antioksidan sehingga perlu dilakukan pengeringan terlebih dahulu untuk mengurangi kerusakan sanyawa yang terkandung (Andersen and
Markham, 2006).
Proses pengeringan dilakukan setelah penyortiran dan pencucian yang bertujuan untuk mengurangi kontaminasi dari benda asing yang mungkin akan menjadi pengacau dalam penelitian baik berupa debu, atau bagian tanaman lain. Proses pengeringan dengan cara diangin-anginkan dan ditutup dengan kain hitam. Tanaman ditutup kain hitam bertujuan untuk mengurangi UV yang mungkin dapat merusak senyawa antioksidan yang terdapat pada tanaman tersebut (Andayani, Lisawati dan Maimunah, 2008). Pengeringan dihentikan ketika daun sudah kering dengan tanda rapuh dan mudah dipatahkan. Daun yang telah kering tersebut kemudian diserbuk dengan menggunakan blender sampai halus. Kemudian serbuk diayak dengan nomor mess 40. Tujuan dari dilakukannya penyerbukan ini adalah untuk memperbesar luas permukaan simplisia yang akan kontak dengan cairan penyari. Luas permukaan yang besar ini akan mengoptimalkan pembasahan serbuk simplisia oleh cairan penyari sehingga hasil penyariannya juga akan optimal. Dan pengayakan dilakukan untuk penyeragaman partikel dengan ukuran yang telah ditentukan sehingga diharapkan didapatkan penyarian yang optimum.
Gambar 3 . Persiapan ekstraksi (A= daun yang akan diserbukan, B= daun yang telah diserbukan)
Kesuksesan dari hasil pengambilan komponen aktif dari tumbuhan didasarkan dari tipe pelarut yang digunakan dalam prosedur ekstraksi. Karakter dari pelarut yang baik adalah memiliki ketoksikan rendah, mudah diuapkan pada suhu rendah, mampu mengabsorbsi dengan baik, memiliki sifat pengawet, tidak memiliki kemampuan yang menyebabkan disosiasi atau kompleks dengan ekstrak (Ellof, 1998). Etanol dipilih sebagai pelarut dikarenakan etanol lebih mempresentasikan jumlah polifenol yang lebih baik dibandingkan dengan ekstrak air, lebih efisien dalam menembus dinding sel dan menarik polifenol untuk keluar dalam sel, dan bersifat preservative terhadap mikroorganisme (Lapornik et al.,
2005). Etanol dengan konsentrasi 70% dengan 30 % air dipilih karena komponen bioaktif flavonoid memiliki konsentrasi lebih besar dibandingkan dengan etanol secara murni (Biomakr, 2010). Hal terpenting penting dalam pemilihan etanol sebagai pelarut adalah ketoksikannya yang rendah dibandingkan metanol walaupun metanol memiliki kepolaran yang lebih tinggi, namun pada metanol memiliki sifat sitotoksik yang tidak sesuai dengan tujuan penelitian mengingat akan hazard yang ditimbulkan (Tiwari et al., 2011).
Proses ekstraksi menggunakan metode maserasi yaitu dengan cara menjaga pelarut tetap kontak dengan pelarut dengan suatu putaran pada beberapa waktu tertentu sampai seluruh senyawa terlarut. Metode ini cocok untuk senyawa yang tidak tahan terhadap suhu yang tinggi (Ncube et al., 2008).
Ekstraksi dengan maserasi dilakukan dengan merendam sampel daun benalu dalam cairan penyari, yaitu etanol 70% selama 5 hari pada temperatur kamar dengan perbandingan pelarut: serbuk (10:1) (Depkes RI, 1986). Maserasi dilakukan dengan menggunakan alat bantu berupa shaker yang digunakan untuk membantu proses maserasi, tujuannya adalah dengan bantuan energi mekanik yaitu penggojogan yaitu untuk mengoptimalkan pelarut yang kontak dengan serbuk sehingga tidak terjadi pengendapan atau settling. Pengendapan ini akan mengurangi daya untuk menyari senyawa pada serbuk, hal ini diakibatkan oleh luas kontak dengan solven semakin kecil karena partikel berikatan dengan kuat antar partikel tersebut. Selain itu penggojogan ini berfungsi untuk menjaga gradien konsentrasi supaya difusi cairan penyari dapat menyari secara optimal saat larutan mulai jenuh. Setelah 5 hari dilakukan maserasi kemudian penyari dicuci dengan sisa etanol sambil divakum dengan corong Buchner. Tujuannya adalah untuk mempercepat proses penyaringan dibandingkan dengan penyaringan biasa, dan mendapatkan hasil yang lebih banyak. Setelah itu, pelarut etanol
diuapkan menggunakan alat vaccum rotary evaporator pada suhu 80oC dan tekanan rendah hingga diperoleh ekstrak pekat etanol. Kemudian cawan porselin yang kosong ditimbang untuk mengetahui bobot ekstrak nantinya setelah pemekatan. Ekstrak pekat selanjutnya diuapkan lagi dengan waterbath hingga
diperoleh ekstrak kental etanol 70%. Penguapan dengan tekanan rendah akan mempercepat proses penguapan karena pelarut akan menguap pada suhu di bawah titik didihnya dan rusaknya zat aktif akibat kontak dengan panas berlebihan dapat dihindari. Bobot ekstrak etanol yang didapat adalah 14,7 g dan rendemen yang didapat dari ekstrak etanol daun benalu adalah 16,34 %. Hasil ekstrak yang berupa ekstrak kental tersebut disimpan di lemari pendingin untuk menjaga agar estrak tetap baik selama penyimpanan sampai dilakukan tahap selanjutnya.
2. Hasil fraksinasi ekstrak
Setelah didapatkan ekstrak kental etanol tersebut, kita harus mengekstraksi lagi senyawa tersebut dengan wasbensin. Hal ini dimaksudkan agar menghilangkan senyawa-senyawa yang tidak diinginkan pada tumbuhan seperti lipid dan klorofil. Menurut Snyder (1997) wasbensin memiliki indeks polaritas 3,8 yang berarti bersifat sangat non polar, sehingga dapat digunakan untuk mengekstraksi senyawa non polar seperti klorofil, vitamin, minyak, lemak dan aglikon flavonoid yang non polar misalnya aglikon isoflavon dan termetoksilasi (Harborne, 1987).
Pemisahan senyawa-senyawa non polar menggunakan wasbensin
menggunakan metode ekstraksi cair. Prinsip pemisahan dengan ekstraksi cair-cair adalah pemisahan senyawa berdasarkan kepolaran suatu senyawa dengan 2 pelarut yang berbeda kepolarannya. Ekstrak etanol dilarutkan dengan air hangat dan diektraksi dengan corong pisah dengan perbandingan 1:1. Kemudian digojog dengan perlahan sebanyak lima kali yang bertujuan untuk memudahkan dalam pemisahan dengan pencampuran. Kemudian pada corong pisah terdapat 2 fase, yaitu fase nonpolar yaitu yang terlarut dalam wasbensin dan fase polarnya yaitu yang terlarut
dengan wasbensin. Fase air-nya akan berada di bawah karena air memiliki berat jenis yang lebih besar, yaitu 1 pada suhu kamar dan wasbensin akan berada di atas karena berat jenisnya yang lebih kecil yaitu 0,730 dan air memiliki bobot jenis 0,996 (Depkes RI a, 1995). Fase airnya ini diekstraksi lagi dengan wasbensin sebanyak tiga kali. Hal ini dimaksudkan agar senyawa-senyawa non polar ini dapat terpisah sempurna ke dalam pelarut wasbensin tersebut.
Setelah dilakukan pemisahan senyawa yang tidak dinginkan tersebut kemudian dilakukan fraksinasi kembali dengan menggunakan etil asetat. Hal ini bertujuan untuk mengarahkan senyawa-senyawa yang lebih larut dengan etil asetat untuk kita uji aktivitas antioksidannya. Jenis flavonoid yang merupakan kandungan utama benalu adalah quercetin 3-rhamnoside dan kaempferol 3-rhamnoside(Sukpondma,et al, 2000). Kadar kuersetin yang terkuantitatif dalam benalu yang didapat dari Dendrophthoe pentandra inang pohon purring 35,1 mg/g; dan pada tanaman randuuntuk benalu Dendrophthoe pentandra sebesar 39,8 mg/g (Rosidah, dkk.,1999). Darmawan dan Artanti, (2006), juga mengatakan “Isolat yang berhasil diisolasi dari ekstrak air daun benalu D. pentandra adalah senyawa quercetin 3-ramnosida, yang merupakan salah satu senyawa aktif antioksidan dari golongan flavonoid dengan nilai IC50 9,4 ppm”. Kuersetin adalah
salah satu golongan flavones yang merupakan senyawa aglikon yang bersifat lebih non polar (Andersen and Markham, 2006), sehingga dengan adanya fraksinasi etilasetat tersebut lebih menspesifikan pada senyawa flavonoids dengan golongan
isoflavones, flavanones, methylated flavones, and flavonols (Andersen and Markham, 2006). Selain itu, adanya gula yang mungkin terkandung pada ekstrak ini akan menjadi interferensi dalam uji fenolik total (Leamsomron et al, 2009).






![Gambar 5. Hasil uji pendahuluan aktivitas antioksidan (A = kontrol negatif [blanko],B = larutan uji [fraksi etil asetat ekstrak etanol daun benalu]+DPPH, C](https://thumb-ap.123doks.com/thumbv2/123dok/2182602.2167238/59.893.328.609.169.357/gambar-pendahuluan-aktivitas-antioksidan-kontrol-negatif-larutan-ekstrak.webp)