LAPORAN
PRAKTIKUM KIMIA
ORGANIK I
Disusun oleh :
NAMA
: IFTIA AURILI MAKALALAG
NIM
: 44241601O
KELOMPOK
: 4
PRODI/KELAS
: KIMIA / B
JUDUL PERCOBAAN
: Isolasi Etil
-p-
metoksi
Sinamat dari Kencur (
Kaemferia galanga L
)
dan Sintesis Asam
p-
Metoksisinamat.
ANGGOTA KELOMPOK
:
1.
YULIA SURATINOYO
2.
ERVINA APRIANI
JURUSAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU
PENGETAHUAN ALAM
A. Judul :
Isolasi Etil-p-metoksi Sinamat dari Kencur (Kaemferia galanga L) dan Sintesis Asam
p-Metoksisinamat.
B. Tujuan :
1. Mahasiswa dapat menjelaskan prinsip dasar dan teknik isolasi dengan cara perkolasi 2. Mahasiswa dapat melakukan pemisahan dan pemurnian hasil isolasi dari bahan
tumbuhan
3. Mahasiswa dapat mahir dalam menganalisis data spektroskopi UV dan IR dan data fisik senyawa yang dihasilkan dibandingkan standar.
C. Dasar Teori :
Asam sinamat diperoleh dari fenilalanin berdasarkan eliminasi amonia secara enzimatikdilanjutkan dengan hidroksilasi aromatik dan metilasi. Mula pertama dipercayai bahwabiosintesis melalui jalan asam fenilpiruvat yang direduksi dan di dehidrasi, tetapi saat asamsinamat ditemukan terlihat bahwa dapat mengeliminasi amonia langsung dari asam amino, makajalan tersebut dinyatakan sebagai langkah utama. Reaksi ini dikategorikan sebagai reaksiberkesinambungan eliminasi – , dengan adanya pusat basa pada enzim yang mengikat -α β βproton. Asam sinamat dan benzoat kebanyakan terdapat sebagai ester glikosida karbohidrat,flavonoid, dan asam hidroksi karboksilat. Asam 3-kafeoilquinat (asam kloroquinat) telahdiisolasi oleh Payen pada tahun 1846 dalam bentuk kristal dari kopi dan ternyata senyawatersebut terdapat sebagai metabolit yang umum dalam tanaman (Harborne, 1989: 59).
dekat seperti khalkosa, streptosa mikaminosa, yang diketahui sebagai konstituen antibiotik dan diketemukan oleh pakar kimiaorganik dikategorikan sebagai metabolit sekunder. Asam amino pokok prolin dipandang sebagaimetabolit primer tetapi asam pepekolat cincin lingkar 6 yang analog dengan plorin diklasifikasikan sebagai metabolit sekunder atau dikenal sebagai alkaloid (Hardjono Sastrohamidjojo,1995 ).
Tanaman kencur (Kaemfria galanga L) dikenal sebagai cukup luas dalam masyarakatkita, karena manfaatnya yang sangat banyak. Di samping digunakan untuk penyedap makanan,kencur banyak digunakan dalam ramuan obat tradisional yang khasiatnya dapat mengobatiberbagai macam penyakit misalnya : masuk angin, radang lambung, batuk, nyeri perut, muntah –muntah, panas dalam dan lain – lain. Salah satu senyawa etil ester yang terdapat dalam kencuradalah etilparametoksi sinamat yang tergolong fenilpropanoid. Biosintesis senyawa ini mengikutijalur sinamat dan digunakan sebagai antifungi, analgesik dan antipiretik. Sintesis senyawa iniadalah sebagai berikut : Etil – para- metoksi sinamat. Kencur (Kaemfria galanga L) adalah salah satu empon – empon / tanaman obat yangtergolong dalam suku temu – temuan (Zingiberaceae). Rimpang atau rizoma tanaman inimengandung minyak atsiri dan alakaloid yanhg dimanfaatkan sebagai stimulan. Nama lainadalah cekur (Maloysia) dan pro tiom (Thailand). Dalam pustaka internasional (bahasa inggris)kerap terjadi kekacauan dengan menyebut kencur sebagai lesser galangal (Alpinia offieinarum)maupun zedoary (temu putih), yang sebetulnya spesies yang berbeda dan bukan merupakanrempah pengganti. Terdapat pula kerabat dekat kencur yang biasa ditanam di pekarangan sebagaitanaman obat, temu rapet (K. rotonda Jaeq), namun mudah dibedakan dari daunnya. Etil p-metoksisinamat (EPMS) adalah salah satu senyawa hasil isolasi rimpang kencur (Kaempferia galanga L) yang merupakan bahan dasar senyawa tabir surya yaitu pelindung kulitdari sengatan sinar matahari. EPMS termasuk dalam golongan senyawa ester yang mengandungcincin benzena dan gugus metoksi yang bersifat non-polar sehingga dalam ekstraksinya dapatmenggunakan pelarut – pelarut yang mempunyai variasi kepolaran yaitu etanol, etil asetat,metanol, air dan heksana (Asyharist, 2011).
dijadikan metode pilihan pertama pada pemisahan dengan kromatografi karena prosesnya yang mudah dan cepat.
Biasanya pelat KLT menggunakan bahan indicator fluoresens yang dapat memancarkan warna biru keunguan di bawah lampu UV pada panjang gelombang 254 nm. Senyawa yang akan diuji dan ditotolkan pada pelat KLT, yang menyerap sinar UV pada panjang gelombang tersebut akan memberikan penampakan noda di bawah lampu UV. Cara lain untuk melihat penampakan noda adalah memasukkan pelat KLT ke dalam wadah yang berisi iod padat yang akan menyublim dan mengabsorbsi molekul organik pada fasa gas, sehingga akan terbentuk noda keclokatan.Selain berfungsi sebagai analisis kualitatif, KLT juga menyediakan gambaran kuantitatif kromatografik yang disebut nilai Rf. Nilai Rf adalah ”retardation factor” atau nilai “ratio-to-front” yang diekspresikan sebagai fraksi desimal.
Kencur (Kaempferia galanga L), adalah terna aromatik yang tergolong kedalam famili Zingiberaceae (temutemuan). Adapun klasifikasi terna kencur sebagai berikut:
Kingdom : Plantae Subkingdom : Tracheobionta Superdivisio : Spermatophyta Divisi : Magnoliophyta Kelas : Liliopsida Sub-kelas : Commelinidae Ordo : Zingiberales Familia : Zingiberaceae Genus : Kaempferia
Spesies : Kaempferia galanga L.
Kencur (Kaempfria galanga L) termasuk suku tumbuhan Zingiberaceae dan digolongkansebagai tanaman jenis empon – empon yang mempunyai daging buah paling lunak dan tidakberserat. Kencur merupakan terna kecil yang tumbuh subur di daerah dataran rendah ataupegunungan yang tanahnya gembur dan tidak terlalu banyak air. Rimpang kencur mempunyaiaroma yang spesifik. Daging buah kencur berwarna putih dan kulit luarnya berwarna coklat.Jumlah helaian daun kencur tidak lebih dari 2 sampai 3 lembar dengan susunan berhadapan.Bunganya tersusun setengah duduk dengan mahkota bunga berjumlah antara 4 – 12 buah, bibirbunga berwarna lembayung dengan warna putih lebih dominan. Kencur tumbuh dan berkembangpada musim tertentu, yaitu pada musim penghujan. Kencur dapat ditanam dalam pot atau dikebun yang cukup sinar matahari, tidak terlalu basah dan di tempat terbuka (ipteknet, 2011).
D. Alat dan Bahan 1. Alat
No Nama alat Kategori Gambar Fungsi Alat
1 Pipet Tetes
I
Untuk mengambil dan meneteskan reagen dalam skala kecil.
2 Erlenmeyer
I
Sebagai wadah mereaksikan larutan dan atau menempatkan suatu larutan.
3 Gelas Piala
I
Sebagai wadah untuk melarutkan zat.
4 Corong Bucnher
I
Untuk Menyaring larutan dengan dengan bantuan pompa vakum.
5 Gelas Ukur
I
Untuk mengukur suatu larutan dengan volume tertentu yang diinginkan
6 Termometer
I
Untuk mengukur suhu sampel yang digunakan
7 Kertas Saring
I
8 Kaca Arloji
I
Digunakan untuk tempat zat yang akan ditimbang
9 Neraca analitik
II
Untuk menimbang dan mengukur berat suatu bahan.
10 Penangas air
II
Untukmemanaskan air
11 Labu bundar
I
Untuk memanaskan larutan dan menyimpan larutan
12 Statif dan Klem
I
Sebagai penjepit, misalnya, Untuk menjepit kondensor pada proses
13 KondensorRefluks
I
Digunakan dalam proses refluks
14 Pelat KLT
I Digunakan untuk memisahkan komponen-komponen atas dasar adsorpsi atau partisi oleh fase diam di bawah gerakan pelarut pengembang
No Bahan Kategori Sifat Fisik Sifat kimia
1 HCl encer Khusus Massa jenis : 3,21 gr/cm3.
Titik leleh : -1010C
Energi ionisasi : 1250 kj/mol
Kalor jenis : 0,115 kal/gr
Pada suhu kamar, hidroksida, kloroform, dan eter
Merupakan oksidator kuat
Berafinitas besar sekali terhadap unsur-unsur lainnya
2 H2O (aquades) Umum Merupakan pelarut
universal
Berat jenis 0,998 gr/cm3
tidak berbau
Memiliki gaya adhesi yang kuat
Memilki keelektronegatifan yang lebih kuat daripada elektrolisis menjadi oksigen dan hydrogen
Dibentuk sebagai hasil samping dari pembakaran senyawa yang mengandung hydrogen
3 NaOH Khusus Berwarna putih atau praktis putih
Berbentuk pellet, serpihan
atau batang dan bentuk lain
Keras dan rapuh
Titik didih 13900C
Titik leleh 3180C
NaOH membentuk basa kuat bila dilarutkan dalam air
Bila dibiarkan di udara akan cepat
menyerap karbondioksida da n lem- bab
Kelarutan mudah larut dalam air dan dalam etanol tetapi tidak larut dalam eter
4 n-heksana Khusus Rumus molekul = C6H14
Massa molar= 86.18 g mol−1
Merupakan cairan yang tak berwarna
Densitas = 0.6548 g/mL
Viskositas = 0.294 cP
Kelarutan =13 mg/L at 20°C
Titik leleh: -95°C,178 K
Terdapat pada bensin dan lem sepatu, kulit dan tekstil
5 Etanol Khusus Tidak Berwarna
Mudah menguap
Mudah terbakar
Massa molar 46,07 g/mol
Titik lebur -114,30C
Titik didih 78,4 0C
Rumus molekul C2H5OH
Rumus empiris C2H6O
Merupakan isomer
konstitusional dari dimetil eter
6 Etil p
-metoksisinama t
Khusus Mengandung cincin benzena Bersifat nonpolar
Termasuk golongan senyawa ester
7 Metanol Khusus Rumusmolekul : CH3OH
Massa molar : 32,04 g/mol
Beracun
Densitas : 0,7918 g/cm3
Berbentukcair
Mudah menguap
8 Benzaldehid Khusus Berbentuk cairan tidak berwarna
Densitas 1,0415 g/ml
Titik lebur -26 0C
Titik didih 178,1 0C
Merupakan aldehida aromatic yang paling sederhana
9 Asam Malonat Khusus Berbentuk putih padat
Massa molar 116,1 g/mol
Merupakan isomer cis dari asam butenadioat
Larut dalam air
10 Piridin Khusus Berbentuk cair
Titik lebur -41,6 0C
Titik didih 115,2 0C
Senyawa organic heterosiklik
Memasukkan 15 gram serbuk kencur kedalam labu bundar 250 mL
Menambahkan sekitar 100 mL heksana
Memasang kondensor refluks pada labu bundar
2) Hirolisis Etil-p-Metoksisinamat
Residu Filtrat
Mendestilasi sederhana filtrate dalam labu bundar tersebut dalam penangas air hingga tersisa 10 mL larutan dalam labu.
Mendinginkan labu pada suhu kamar hingga terbentuk Kristal berwarna putih
Mendinginkan labu dalam penangas es sampai Kristal terbentuk sempurna Menyaring padatan putih yang terbentuk dengan corong dan kertas saring
Kristal
Menimbang Kristal dan menghitung rendamannya
Mengkristalisasi dalam n-heksan
Mengukur titik leleh dan membandingkan dengan literatur
Titik leleh = 46oC, 48oC dan 50oC
Etil-p-metoksisinamat
Kristal
Menimbang 2.5 gram etil-p-metoksisinamat Melarutkan dengan 5 ml etanol dalam labu alas bulat 100 mL
Menambahkan 1,25 gram NaOH dan 20mL air Merefluks campuran reaksi selama 30 menit Mendinginkan pada suhu kamar
Menetralkannya dengan HCl encer yang akan menghasilkan Kristal putih
3) Sintesis Asam Sinamat
F. Hasil Pengamatan
Titik leleh
Mencuci Kristal dengan air
Mengkristalisasi dengan pelarut mentanol Mengukur titik lelehnya dan membandingkan dengan referensi
2 gram benzaldehid + 3 gram asam malonat
Kristal
Titik leleh = 129oC, 131oC dan 134oC
Mereaksikan dengan 6 gram piridin dan 4 tetes piperidin
Memanaskan didalam air selama 1 jam Mendidihkan dan menambahkan 40 gram butiran es dan 10 mL larutan HCl 5 M Menyaring hasil reaksi
Mencuci Kristal dengan air
Mengkristalisasi dengan air atau pelarut etanol atau campuran air dan etanol
1 Isolasi etil p-metoksisinamat
Menimbang 15 gr serbuk kencur dan memasukkan kedalam labu bundar. dalam penangas air selama 30 menit.
Menyaring campuran kencur hasil refluks kedalam labu bundar 100 mL.
Melakukan destilasi sampai filtrat termometer dan mencelupkan termometer dalam minyak kelapa
dan terdapat diatas permukaan serbuk kencur.
Kondensor terdapat pada labu
bundar, perlahan serbuk kencur dan n-heksana dalam labu bundar mulai mendidih.
Filtrat berada dalam labu bundar. Filtrat dalam labu tersisa kurang
lebih 10 mL.
Kristal berada dalam pipa kapiler. Perlahan kristal mulai meleleh.
Titik leleh awal = 46˚C
Titik leleh pertengahan = 48˚C Titik leleh akhir = 50˚C
2 Pembuatan asam sinamat
Menimbang 3 gr asam malonat dan
memasukkan kedalam enlenmeyer.
Menambahkan 2 mL benzaldehid, 6
mL piridin dan 4 tetes piperidin kedalam enlenmeyer yang berisi asam malonat.
Memanaskan larutan didalam
penangas air dan menambahkan 40 gr butiran es dan 20 mL HCl 5 M.
Menyaring larutan dan mencuci endapan air es.
Mengkristalisasi kristal yang dihasilkan dengan sedikit metanol.
Memanaskan campuran diatas penangas.
Menyaring kristal yang terbentuk dan menimbang.
Larutan perlahan mulai mendidih.
Terdapat endapan putih dalam
enlenmeyer.
Kristal terpisah dari larutan dan
berada dalam kertas saring.
Kristal larut dalam metanol.
Berat kertas saring = 0,2646 gr
Perhitungan :
Dik : mol benzaldehid = 106,1242grgr
/mol=0,01889mol
mol asam malonat = 104, 023grgr
/mol=0,02883mol
mol piridin = 0,982gr/mol x6mL
79,1gr/mol =0,0744mol
mol asam sinamat = 0,01884 mol gr asam sinamat = 0,01884 x Mr
= 0,1884 mol x 148,1 gr/mol = 2,7915 gr
% rendemen = h asil percobaan
h asil teori x100
= 1,5866gr 2,7915gr x100
= 56,83%
Reaksinya : Asam Benzoat + Asam Malonat piridin
piperidin > Asam Malonat
Awal 0,01884 mol 0,02883 mol
Rx sisa
−¿
0,01884
¿ mol
0,01844 0,01704 mol
G. pembahasan
Percobaan ini bertujuan untuk memperoleh etil parametoksi sinamat dari kencur. Di dalam kencur juga terdapat minyak atsiri. Untuk memperoleh etil-parametoksi sinamat dari kencur, hal pertama yang dilakukan yaitu ditimbang rimpang kencur . Kemudian setelah ditimbang rimpang kencur direndam dengan menggunakan larutan N-Heksan . Pelarut N-Heksan digunakan karena etil p-metoksi sinamat termasuk dalam senyawa ester yang mengandung cincin benzena dan juga gugus metoksi yang bersifat nonpolar serta gugus karbonil yang mengikat etil yang bersifat polar sehingga dalam ekstraksinya dapat menggunakan pelarut polar sebagaimana prinsip dari isolasi yaitu proses pengambilan suatu zat dari bahan alam yang menggunakan pelarut yang sesuai, dalam hal ini dilihat dari tingkat kepolarannya. Selain itu, digunakan N-Heksan juga karenaN-N-Heksanadalah pelarut yang mudah mendidih sehingga mudah menguap serta mudah menarik zat yang terkandung dalam sampel yaitu etil p-metoksi sinamat dari sampel (kencur). Karena mudah menguap sehingga memudahkan pemisahan antara ekstrak dengan pelarutnya dalam hal ini N-Heksan. Larutan n-heksan yang telah di campurkan dengan kencur, kemudian direfluks untuk mengisolasi senyawa etil-p-metoksi sinamat. Senyawa ini merupakan senyawa yang nonpolar, sehingga etil-p-metoksi sinamat dapat larut dalam n-heksan secara baik. Hal ini sesusai dengan proses refluks yang dilakukan selama 1 jam untuk benar-benar melarutkan etil-p-metoksi sinamat dan mengeluarkannya dari kencur. Semakin lama proses refluks, maka akan membuat semakin banyak ekstrak kencur yang akan dihasilkan.
Kemudian setelah direfluks, larutan hasil rendaman disaring yang bertujuan untuk memisahkan ekstrak dengan ampasnya. Setelah disaring, maka filtrat tersebut di destilasi untuk memisahkan antara pelarut dan ekstrat yang mengandung etil-p-metoksinamat. Proses destilasi ini, dilakukan hingga tersisa 10 mL ekstrak kental yang berada dalam labu leher tiga. Proses destilasi, dilakukan jangan sampai pada suhu terlalu tinggi. Karena jika destilasi dilakukan pada suhu yang tinggi maka, senyawa etil-p-metoksisinamat akan rusak sehingga dikhawatirkan tidak akan terbentuk Kristal yang diharapkan.
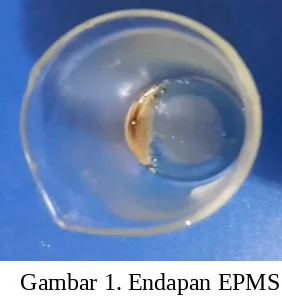
suhu larutan turun, komponen zat yang memiliki titik beku lebih tinggi akan membeku terlebih dahulu, sementara zat lain masih dalam bentuk larutan. Proses ini dilakukan dalam proses yang cukup panjang. Akan tetapi, Kristal tidak terbentuk yang ada hanyalah endapan (Gambar 1). Endapan berwarna kuning kehijauan dan warna larutan yang diperoleh yaitu kuning keruh. Setelah beberapa menit, endapan kemudian disaring dan diperoleh larutan berwarna kuning jernih dan endapan kuing keruh. Endapan tersebut bukan etil parametoksi sinamat melainkan minyak atsirinya bercampur ampas. Penyebab, tidak terbentuknya kristal etil parametoksi sinamat (Epms) dikarenakan adanya beberapa kesalahan pada saat proses pelaksanaan praktikum. Jadi, karena proses isolasi etil parametoksi sinamat tidak menghasilkan kristal maka titik lelehnya pun tidak dapat ditentukan. Akan tetapi, ada juga sumber yang menyatakan bahwa yang terbentuk itu adalah Kristal EPMS dan minyak atsiri. Padatan yang terbentuk dipisahkan dari minyak atsiri, kemudian diHal ini dapat dilihat dari padatan yang diuji titik lelehnya yaitu 46oC, 48oC dan 50 oC, dan berdasarkan literature titik leleh EPMS adalah 48oC, 49oC dan 50 oC
Gambar 1. Endapan EPMS
Hasil pemilihan pelarut dalam penelitian ini terlihat bahwa n-heksan lebih sesuai hal ini ditunjukkan oleh persentase hasil yaogng lebih besar dibandingkan dengan pelarut lain pada suhu kamar. Kenyataan ini menunjukkan bahwa kepolaran etil p-Metoksisinamat lebih mendekati heksan karena dalam etil p-Metoksisinamatada dua gugus yang mendukung sifat nonpolar yaitu gugus eter dan lingkar benzen, sedang gugus yang mendukung ke arah polar hanya satu yaitu adanya karbonil dalam gugus ester.
Hasil optimasi suhu menunjukkan bahwa suhu optimum dalam isolasi menggunakan pelarut terpilih yaitu n-heksan adalah 50oC. Kenyataan ini memberikan gambaran jelas bahwa
isolasi. Pada suhu diatas 50oC terjadi penurunan hasil isolasi disebabkan karena EPMS yang
telah terekstrak sebagian mengalami penguraian struktur karena pemanasan yang berlebihan. Hasil analisa kemurnian dengan penentuan titik leleh menunjukkan angka menurut literature standard yaitu 48-500C., dan hasil titik leleh yang didapatkan mendekat titik leleh
EPMS menurut literatur, sehingga dapat disimpulkan bahwa tidak semua EPMS terurai pada saat destilasi, tetapi terdapat beberapa bagian yang terurai dan juga kemungkinan karena terdapat kesalaahn saat praktikum sehingga, kristalnya tidak terbentuk.
Selanjutnya adalah sintesis senyawa asam p-metoksisinamat. Reaksi dasar dari pembuatan asam sinamat adalah reaksi kondensasi, dimana reaksi sintesis asam sinamat dapat dilihat pada gambar 2. Asam sinamat dapat disintesis dengan reaksi knoevenagel yaitu modifikasi dari kondensasi aldol.
Digunakan asam malonat yang direaksikan dengan benzaldehid, piridin dan piperidin. Benzaldehid disini, berfungsi sebagai senyawa karbonil dan asam malonat sebagai senyawa enol. Reaksi dilangsungkan dalam keadaan panas karena karbonil dan enol membutuhkan tambahan energi untuk melakukan reaksi. Selama pemanasan akan terjadi dekarboksilasi menghasilkan CO2 untuk membentuk asam sinamat. Setelah cukup panas maka ditambahkan butiran-butiran es
Setelah kristal terbentuk (Gambar 3), maka ditimbang berat Kristal yang diperoleh yaitu 1.5866 gram atau sekitar 56,83%. Kemudian mengukur titik lelehnya dengan memasukkan kristal kedalam pipa kapiler dan diikat dengan termometer untuk mengetahui suhu saat terjadi pelelehan dari kristal tersebut. Hasil dari pengujian titik leleh kristal asam p-metoksisinamat adalah 129oC, 131oC dan 134oC.
Gambar 3. Kristal Asam Sinamat
H. kesimpulan
Dari percobaan yang dilakukan, maka dapat disimpulkan bahwa prinsip dasar dari isolasi EPMS ini adalah’ refluks, yaitu penarikan komponen kimia yang dilakukan dengan cairan penyari yang dipanaskan dan uap-uap cairan penyari terkondensasi menjadi molekul-molekul cairan yang akan turun ke labu alas bulat.
Hasil dari isolasi EPMS tidak mendapatkan kristal disebabkan oleh kesalahan saat praktikum. Sedangkan untuk kristal sintesis asam p-metoksisinamat didapati kristal sebanyak 1.5866 g atau sekitar 56,83%.
Daftar Pustaka
Anneahira. 2011. Manfaat Kencur. (http://www.anneahira.com). Diakses pada 21 Januari 2011.
Asyaharst. 2011. Isolasi Etil p Metoksi Sinamat dari Kencur Kaempferia Galanga L dan Sintesis Asam pMetoksi Sinamat Sintesis Turunannya dan Penetapan Struktur.
.Harborne. 1989. Metode Fitokimia. Bandung : ITB Bandung.Iptek net. 2011.
.Sastroharmidjojo, Hardjono. 1995. Sintesis Bahan Alam. Yogyakarta : Gadjah Mada University
Otih Rostiana, Rosita SMD, Mono Rahardjo dan Taryono, 2005, Budidaya Tanaman Kencur, Badan Penelitian dan Pengembangan Pertanian Balai Penelitian Tanaman Obat dan Aromatika : Yogyakarta