3 TINJAUAN PUSTAKA
Ampas Teh
Ampas teh merupakan hasil ikutan atau limbah dari pembuatan minuman teh yang diproses dengan pelayuan, penggulungan, fermentasi, dan pengeringan (Istirahayu, 1993). Menurut Kondo et al. (2007) konsumsi teh dalam kaleng, kemasan, dan botol terjadi penambahan setiap tahunnya di bagian Timur Asia dan negara bagian Selatan Tenggara Asia, sehingga pabrik minuman teh menghasilkan limbah berupa ampas teh yang cukup besar. PT Sosro dapat menghasilkan ampas teh sebanyak 470 ton/tahun ditambah dengan beberapa perusahaan lain yang juga memproduksi minuman teh baik dalam kemasan kotak maupun botol yaitu, Pepsi, Coca Cola, Teh Giju, dan Ultra Jaya, merupakan potensi yang dapat menjamin ketersediaan ampas teh (Khotijah et al., 2004). Tindaon (2009) melaporkan bahwa rendemen teh dari PT. Perkebunan Nusantara IV berkisar antara 20-22% sehingga produksi ampas tehnya antara 78-80%. Proses diperolehnya ampas teh terdapat pada Gambar 1.
Ampas teh berpotensi dimanfaatkan sebagai pakan ternak karena mengandung TDN 66,71%, protein 27,42%, lemak 3,26%, serat kasar 20,39%, BETN 44,20%, abu 4,76% dan 1,4% tanin (Istirahayu, 1993). Faktor yang membatasi penggunaan ampas teh adalah kandungan serat kasar yang cukup tinggi terutama lignin mencapai 29% (Kuntadi, 1992).
Serat yang tertinggal dalam ampas teh lebih dominan berupa serat yang tidak larut yaitu lignin. Lignin sulit didegradasi karena strukturnya yang kompleks dan heterogen yang berikatan dengan selulosa dan hemiselulosa menjadi lignoselulosa dalam jaringan tanaman (Suparjo, 2008). Menurut McDonald et al. (2002) semua karbohidrat mampu dicerna mikroba rumen kecuali lignin yang tidak dapat dicerna sama sekali. Penurunan kecernaan dinding sel ditentukan oleh deposisi lignin. Kandungan lignin yang tinggi memperlambat aktivitas mikroba rumen sehingga pakan menjadi sukar larut dan jumlah pakan yang dicerna menjadi sedikit (Selly, 1994). Struktur lignin disajikan dalam Gambar 2.
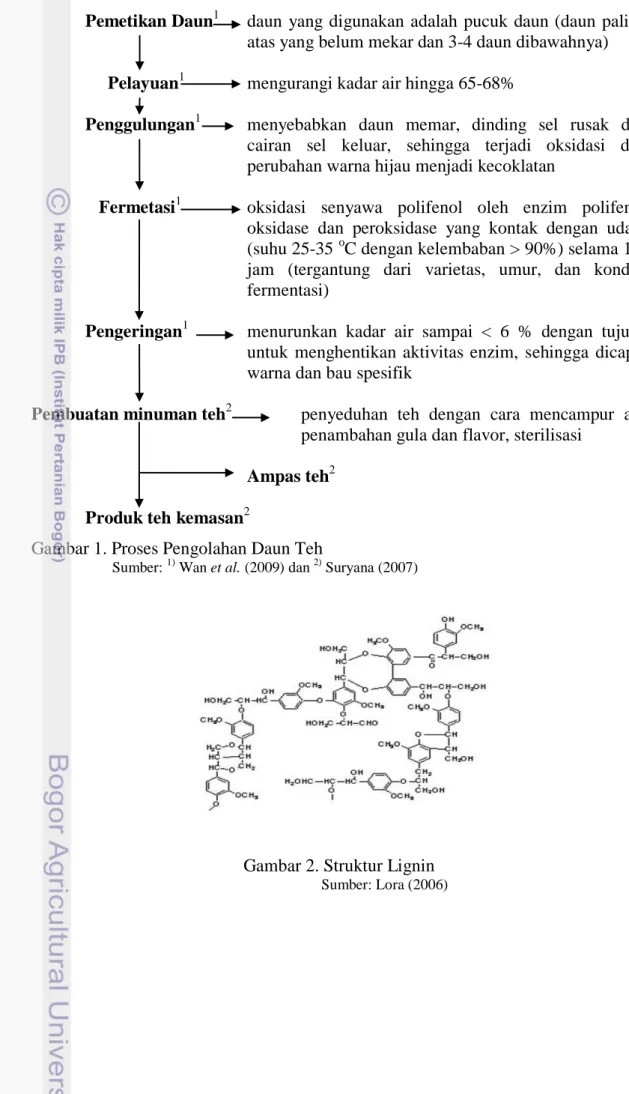
4 Pemetikan Daun1 daun yang digunakan adalah pucuk daun (daun paling
atas yang belum mekar dan 3-4 daun dibawahnya) Pelayuan1 mengurangi kadar air hingga 65-68%
Penggulungan1 menyebabkan daun memar, dinding sel rusak dan cairan sel keluar, sehingga terjadi oksidasi dan perubahan warna hijau menjadi kecoklatan
Fermetasi1 oksidasi senyawa polifenol oleh enzim polifenol oksidase dan peroksidase yang kontak dengan udara (suhu 25-35 oC dengan kelembaban > 90%) selama 1-3 jam (tergantung dari varietas, umur, dan kondisi fermentasi)
Pengeringan1 menurunkan kadar air sampai < 6 % dengan tujuan untuk menghentikan aktivitas enzim, sehingga dicapai warna dan bau spesifik
Pembuatan minuman teh2 penyeduhan teh dengan cara mencampur air, penambahan gula dan flavor, sterilisasi
Ampas teh2
Produk teh kemasan2
Gambar 1. Proses Pengolahan Daun Teh
Sumber: 1) Wan et al. (2009) dan 2) Suryana (2007)
Gambar 2. Struktur Lignin
5 Kembang Sepatu
Kembang Sepatu (Hibiscus rosa sinensis) merupakan tanaman yang banyak tumbuh di daerah tropis dan subtropis. Tanaman ini banyak ditanam orang di halaman sebagai tanaman hias atau sebagai pagar hidup. Penyebaran di Indonesia mulai dari Sumatera, Jawa, Nusa Tenggara, Sulawesi, Maluku dan Irian (Kementerian Lingkungan Hidup, 2010). Klasifikasi kembang sepatu adalah sebagai berikut:
Kingdom : Plantae (Tumbuhan)
Sub kingdom : Tracheobionta (Tumbuhan berpembuluh) Super Divisi : Spermatophyta (Menghasilkan biji) Divisi : Magnoliophyta (Tumbuhan berbunga) Kelas : Magnoliopsida (berkeping dua/dikotil) SubKelas : Dilleniidae
Famili : Malvaceae (suku kapas-kapasan) Genus : Hibiscus
Spesies : Hibiscus rosa sinensis L.
Tanaman kembang sepatu tumbuh di daerah rendah sampai pegunungan, daun tunggal berbentuk bulat telur dengan tepi bergerigi kasar dan tulang daun menjari, ujung meruncing, panjang daun 3,5-9,5 cm dan lebar 2-6 cm dengan daun penumpu berbentuk garis. Daun mempunyai tangkai yang panjangnya 1-3,7 cm. Bunga tunggal, keluar dari ketiak daun, sedikit menggantung, dengan tangkai bunga beruas, warnanya ada yang merah, kuning, putih, orange, dan sebagainya. Tanaman berkembang biak dengan cara stek, pencangkokan, dan penempelan (Wijayakusuma, 2000).
Kandungan nutrien dari daun kembang sepatu (%BK) yaitu abu 13,03%, lemak 7,91%, serat kasar 11,20%, Beta-N 46,65%, dan protein kasar 21,21% (Despal, 1993) dan saponin 23,33% dari hasil ekstraknya (Fitri et al., 2010). Pengujian secara in vitro daun kembang sepatu memiliki nilai kecernaan yang tinggi (> 60%), VFA (43,89 mM) yang sudah cukup untuk menunjang sintesis protein mikroba dan nilai kadar amonia (7,59 mM) yang menandakan bahwa daun kembang sepatu cukup fermentabel dan mampu menyediakan amonia guna menunjang sintesa protein mikroba (Despal, 1993).
6 Sistem Rumen dan Mikroba
Ruminansia merupakan ternak yang memiliki lambung terbagi menjadi empat rongga dan saling berhubungan yaitu rumen, retikulum, omasum dan abomasum. Rumen merupakan bagian lambung terbesar yang menempati lebih kurang 75 % dari rongga perut yang terletak di sebelah kiri rongga perut. Retikulum merupakan bagian kecil lambung yang terletak di bagian depan rumen, memiliki tonjolan-tonjolan (papilla) yang menyerupai rumah tawon (sarang lebah). Omasum (perut berlapis/buku) merupakan bagian ketiga yang terletak di sebelah kanan rumen dan retikulum. Bagian terakhir adalah abomasum (perut sejati) yang terletak di sisi kiri bawah omasum dan meluas ke bagian belakang melewati sisi kanan dari rumen (Campbell et al., 2003).
Pencernaan rumen, retikulum dan omasum bersifat fermentatif karena adanya mikroba rumen, sedangkan perut belakang yaitu abomasum yang sistem pencernaannya bersifat enzimatis karena adanya enzim-enzim induk semang (Campbell et al., 2003). Mikroba rumen dan induk semang (ternak) hidup secara simbiosis. Secara umum terdapat empat jenis mikroorganisme rumen, yaitu bakteri (1010-1011 sel/ml yang mewakili 50 genus), ciliate protozoa (104-106/ml, dari 25 jenis, fungi anaerob (103-105 zoospora/ml, mewakili 5 jenis), dan bakteriofag (108 -109/ml). Bakteri mendegradasi selulosa, hemiselulosa, pati, protein dan sangat sedikit jumlah minyak untuk menghasilkan VFA dan protein mikroba di dalam rumen. Protozoa mencerna karbohidrat dan protein. Fungi memiliki peran dalam fermentasi rumen yaitu sebagai pencerna pakan berserat karena fungi membentuk koloni pada jaringan selulosa pakan. Rizoid fungi tumbuh jauh menembus dinding sel tanaman sehingga pakan lebih terbuka untuk dicerna oleh enzim bakteri rumen (Kamra, 2005).
Protozoa memiliki jumlah yang lebih sedikit dibandingkan dengan bakteri. Ukuran tubuh protozoa lebih besar sehingga total biomassanya hampir sama dengan bakteri (McDonald et al., 2002). Protozoa bersifat fagosit aktif (pemangsa/predator) terhadap bakteri rumen terutama bakteri amilolitik. Bakteri amilolitik menempel granula pati dan sifat makan protozoa yang menelan partikel-partikel pati sehingga bakteri amilolitik ikut termakan bersama granula pati (Subrata et al., 2005). Sebanyak 70% dari total bakteri metanogen bersimbiosis dengan protozoa (Jouany,
7 1991). Produksi H2 dari hasil fermentasi akan dimanfaatkan oleh bakteri metanogen untuk diubah menjadi gas metan (CH4). Hal ini akan merugikan karena pembentukan metan merupakan proses pemborosan yang dapat mengurangi 6-10% gross energi (Jayanegara, 2008) yang seharusnya dapat dikonversi dalam pembentukan produk fermentasi.
Keberadaan protozoa dalam rumen cukup penting namun tidak mutlak dan
cenderung merugikan sehingga perlu adanya proses defaunasi (proses penghilangan protozoa dari dalam rumen). Proses defaunasi berkaitan dengan peningkatan total bakteri terutama amilolitik dan proteksi protein dari degradasi protozoa sehingga memungkinkan meningkatnya penyediaan energi dan protein untuk ternak (Subrata et al., 2005). Defaunasi menyebabkan turunnya mekanisme simbiosis antara metanogen dengan protozoa sehingga hanya sedikit hidrogen yang dapat dikonversikan menjadi metan (Takahashi, 2006).
Fermentasi Rumen
Proses pencernaan pada ruminansia terjadi secara mekanis di dalam mulut, fermentatif oleh mikroba dalam rumen dan hidrolisis oleh enzim pencernaan ternak inang. Proses pencernaan fermentatif zat makanan dirombak oleh mikroba menjadi senyawa lain yang berbeda sifat kimianya sebagai zat intermediate. Produk dari hasil pencernaan fermentatif yaitu asam lemak terbang (VFA) (produk akhir yang utama), NH3, sel mikroba, gas metan, CO2 dan air. Gas metan akan dikeluarkan dengan cara eruktasi dan VFA diserap melalui dinding rumen. Sekitar 75% dari total VFA yang diproduksi akan diserap langsung retikulo-rumen yang masuk ke darah, sekitar 20% diserap di abomasum dan omasum, dan sisanya sekitar 5% diserap usus halus (McDonald et al., 2002).
VFA (Volatile Fatty Acid) merupakan produk akhir fermentasi utama yang berfungsi sebagai sumber energi bagi ternak ruminansia dan merupakan sumber kerangka karbon bagi pembentukan protein mikroba. VFA sangat penting karena sebagai sumber energi yang memenuhi sekitar 50 sampai 70% dari kebutuhan energi ternak ruminansia (Damron, 2006). Peningkatan produksi VFA menunjukkan mudah atau tidaknya pakan tersebut didegradasi oleh mikroba rumen. Produksi VFA yang tinggi merupakan kecukupan energi bagi ternak (Sakinah, 2005).
8 Ransum yang diberikan kepada ternak ruminansia sebagian besar terdiri dari karbohidrat. Degradasi karbohidrat di dalam rumen dilakukan dengan dua tahapan yaitu 1) karbohidrat kompleks (polisakarida: selulosa, pati dan lain-lain) dihidrolisa menjadi gula sederhana (monosakarida: glukosa) oleh enzim-enzim mikroba rumen, 2) monosakarida menjadi piruvat yang selanjutnya akan diubah menjadi produk akhir yaitu VFA (asetat, propionat dan butirat) (McDonald et al. 2002) (Gambar 3).
Gambar 3. Sintesis VFA oleh Mikroorganisme di Rumen
Sumber: Damron (2006)
Kisaran normal VFA cairan rumen adalah 70-150 mM yang setara dengan 5-10 g/l (McDonald et al., 2002) atau 80-160 mM (Sutardi, 1980). Menurut McDonald et al. (2002) proporsi molar dari VFA teridiri dari 65% asetat, 21% propionat dan 14% butirat, hal ini sangat dipengaruhi oleh jenis pakan yang dikonsumsi. Ternak sapi yang mengkonsumsi pakan dengan proporsi hijauan dan konsentrat (40:60) menghasilkan VFA sebanyak 96 mmol/l dengan perbandingan 61% asetat (C2), 18% propionat (C3), 13% butirat (C4) dan 8% lainnya (McDonald et al., 2002). Menurut Damron (2006) asam lemak terbang yang diproduksi di rumen yaitu asetat, propionat, butirat, isobutirat, valerat dan isovalerat.
Fermentasi anaerobik selain menghasilkan VFA juga menghasilkan gas bio yang terdiri dari CH4 (30-50%), CO2 (25-45%), sedikit H2, N2 dan H2S (Soejono et al., 1990). Emisi CH4 ini menggambarkan hilangnya sebagian energi dari ternak
CH4 Selulosa Selobiosa Glukosa Selulase Pati Maltosa Amilase 2 ATP 2 NAD+ 2 NADH Piruvat
Asam Laktat Asetil Co-A
CO2
2 NADH 2 NAD+
4 NADH 4 NAD+
Propionat Asetat Butirat
NADH NAD+
9 sehingga tidak dapat dimanfaatkan untuk proses produksi. Emisi CH4 terbentuk secara alami dari reduksi CO2 oleh H2 yang dikatalisis oleh enzim yang dihasilkan oleh bakteri metanogen. Pembentukan ini bertujuan untuk menjaga tekanan H2 yang sangat rendah (menghindari pembentukan laktat yang tinggi) dan hal ini berpengaruh penting terhadap fermentasi secara keseluruhan (Jayanegara, 2008). Martin et al., (2008) menyatakan bahwa dalam pembentukan propionat dibutuhkan H2, sedangkan pembentukan asetat dan butirat menghasilkan H2 (Gambar 4).
Gambar 4. Pola Fermentasi Mikroba (Metabolisme H2) Sumber: Martin et al. (2008)
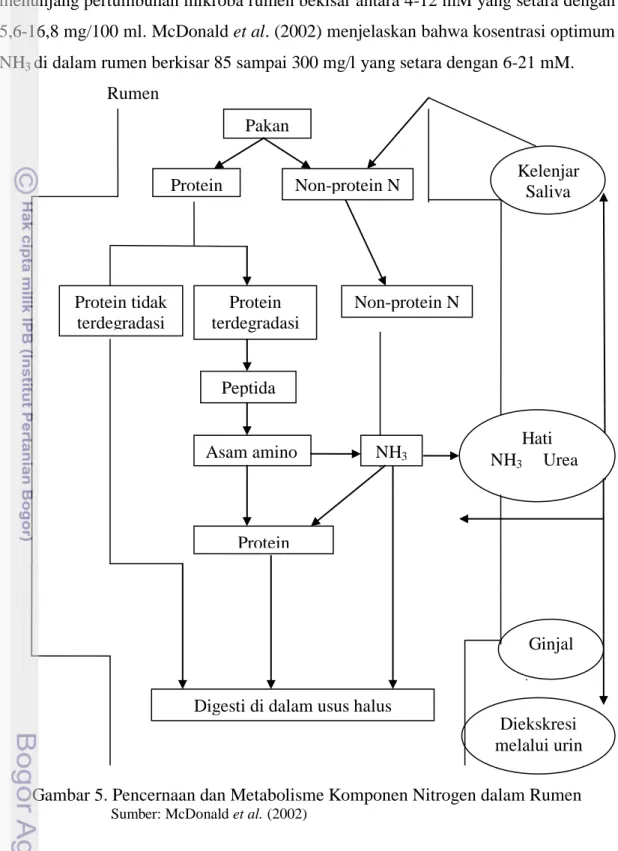
Protein dalam rumen (protein pakan dan non protein nitrogen) mengalami proteolisis seperti halnya karbohidrat. Protein dihidrolisis menjadi peptida dan asam amino oleh mikroba rumen, akan tetapi beberapa asam amino didegradasi kembali menjadi asam organik, amonia, dan karbondioksida. Produksi amonia, asam amino bebas, dan peptida-peptida kecil dimanfaatkan oleh mikroorganisme rumen untuk sintesis protein mikroba (McDonald et al., 2002).
Konsentrasi amonia harus dalam keadaan cukup untuk menunjang sintesis protein mikroba. Kekurangan amonia akan menyebabkan pertumbuhan bakteri yang lambat sehingga degradasi karbohidrat melambat. Kelebihan amonia akan menyebabkan amonia terakumulasi di rumen yang kemudian akan diserap oleh darah dan dibawa ke hati untuk dikonversi menjadi urea. Beberapa urea akan dikembalikan ke saliva dan ada yang langsung dieksresikan melalui urin (McDonald et al., 2002) (Gambar 5). Menurut (Sutardi, 1980) kadar amonia yang dibutuhkan untuk
Karbohidrat (Serat, pati) Pyruvat Asetil-KoA Oxaloasetat Malat Fumarat Suksinat PROPIONAT Akrylat H2 H2 H2 H2 H2 H2 ASETAT BUTIRAT
CH
4 Menggunakan H2 Menghasilkan H210 menunjang pertumbuhan mikroba rumen bekisar antara 4-12 mM yang setara dengan 5,6-16,8 mg/100 ml. McDonald et al. (2002) menjelaskan bahwa kosentrasi optimum NH3 di dalam rumen berkisar 85 sampai 300 mg/l yang setara dengan 6-21 mM.
Rumen
Gambar 5. Pencernaan dan Metabolisme Komponen Nitrogen dalam Rumen
Sumber: McDonald et al. (2002)
Evaluasi Pakan in vitro
Evaluasi ransum secara biologis dapat dilakukan secara laboratorium (in vitro dan in sacco) maupun menggunakan hewan percobaan (in vivo). Metode in vitro menggambarkan model biologis yang menirukan proses pencernaan in vivo dengan tingkat kompleksitas berbeda. Metode in vitro dikembangkan untuk memperkirakan
Diekskresi melalui urin Pakan Non-protein N Protein Protein tidak terdegradasi Protein terdegradasi Peptida Asam amino NH3 Protein mikrobia
Digesti di dalam usus halus
Non-protein N Kelenjar Saliva Hati NH3 Urea Ginjal
11 kecernaan dan tingkat degradasi rumen terhadap pakan serta mempelajari berbagai respon perubahan kondisi rumen. Metode ini biasa digunakan untuk mengevaluasi pakan, meneliti antinutrisi, aditif dan suplemen pakan (Lopez, 2005).
Pada awalnya banyak sistem in vitro yang terdiri dari pencernaan one stage dalam cairan rumen untuk mengukur kecernaan in vitro. Tilley dan Terry (1963) memperkenalkan metode two stage, metode ini paling banyak digunakan untuk mengukur kecernaan in vitro. Tahap pertama adalah inkubasi dalam buffer cairan rumen selama 48 jam dalam kondisi anaerob, kemudian dilanjutkan tahap kedua yaitu pemberian pepsin dan inkubasi selama 48 jam (Tilley dan Terry, 1963). Residu yang dicerna dalam asam pepsin menggambarkan pencernaan dalam abomasum (Lopez, 2005). Tilley dan Terry (1963) menyatakan bahwa korelasi antara kecernaan in vitro dan in vivo adalah tinggi.
Rumen memiliki kisaran suhu 38-42 ºC dan kondisi pH yang tetap dipertahankan 6,3–7 dengan adanya buffer saliva yaitu fosfat dan bikarbonat (Ørskov, 1998). Teknik in vitro proses fermentasinya berlangsung dalam suatu tabung fermentor dan dilakukan peniruan terhadap kondisi rumen. Proses pencernaan oleh mikroba anaerob terjadi pada suhu rumen 39 oC dengan pH netral 6,9–7,0. Protein dalam abomasum dan usus halus dicerna secara hidrolisis oleh enzim proteolitik HCl-Pepsin (Suparjo, 2008).
Kondisi anaerob pada fase fermentatif diusahakan dengan cara mengaliri gas CO2 dan ditutup dengan penutup karet sehingga udara dari luar tidak bisa masuk ke dalam tabung. Sumber inokulum mikroba diperoleh dari cairan rumen. Saliva rumen yang mempunyai sifat buffer diperolah dari larutan McDougall yang dibuat dengan komposisi dan sifat-sifat mirip saliva rumen karena mengandung fosfat dan bikarbonat. Gerakan rumen ditiru dengan menempatkan sistem fermentasi dalam shaker waterbath yang bersuhu konstan 38,5-39 oC (Suparjo, 2008).
Kecernaan Pakan
Kecernaan pakan secara in vitro dapat didefinisikan dengan cara menghitung selisih antara berat awal sampel dengan berat endapan yang tidak larut (Suparjo, 2008). Sisa sampel bahan makanan yang tidak larut setelah proses fermentatif dan hidrolisis (endapan=residu) merupakan bahan makanan yang tidak tercerna. Pada uji in vitro kecernaan bahan terdiri dari kecernaan bahan kering (KCBK) dan bahan
12 organik (KCBO). Kecernaan bahan kering menggambarkan senyawa protein, karbohidrat, lemak, dan mineral yang dapat dicerna oleh ternak. Kecernaan bahan organik menggambarkan daya cerna bahan organik dalam bahan makanan selain mineral (abu). Menurut (Sutardi, 1980) apabila nilai kecernaan bahan pakan (> 60%) dikatakan memiliki nilai kecernaan yang tinggi.
Produksi Gas
Metode pengukuran gas digunakan untuk mengevaluasi nilai nutrisi pakan dan menggambarkan pola fermentasi hijauan dengan cara menghitung produksi gas (Close dan Manke, 1986). Besarnya produksi gas yang dihasilkan pada metode ini berasal dari fermentasi substrat secara langsung (CO2 dan CH4) dan berasal dari produksi gas secara tidak langsung melalui mekanisme buffering VFA yakni berupa gas CO2 dilepaskan dari buffer bikarbonat yang diproduksi selama proses fermentasi (Getachew et al., 1998).
Laju produksi gas in vitro semakin berkurang seiring dengan meningkatnya waktu inkubasi. Meningkatnya waktu inkubasi menyebabkan substrat yang dapat difermentasi semakin berkurang jumlahnya. Berkurangnya jumlah substrat yang dapat difermentasi selama masa inkubasi kemudian berdampak pada laju produksi VFA yang semakin berkurang, sebagai indikasi menurunnya ketersediaan energi bagi ternak (Jayanegara et al., 2006).
Senyawa Metabolit Sekunder Tanaman Tanin
Tanin merupakan salah satu senyawa metabolit sekunder yang terdapat pada tanaman dan disintesis oleh tanaman (Jayanegara dan Sofyan, 2008). Tanin merupakan senyawa yang mempunyai berat molekul 500-3000 dan mengandung sejumlah besar gugus hidroksi fenolik yang memungkinkan membentuk ikatan silang yang efektif dengan protein dan molekul-molekul lain seperti polisakarida, asam amino, asam lemak dan asam nukleat (Fahey & Berger, 1988).
Tanin dibagi menjadi dua kelompok yaitu tanin yang mudah terhidrolisis dan tanin terkondensasi. Tanin yang mudah terhidrolisis merupakan polimer gallic dan ellagic acid yang berikatan ester dengan sebuah molekul gula, sedangkan tanin terkondensasi merupakan polimer senyawa flavonoid dengan ikatan karbon-karbon berupa cathecin dan gallocathecin (Patra dan Saxena, 2010) (Gambar 6). Tanin yang
13 berasal dari hijauan (leguminosa) umumnya membentuk tanin terkondensasi dan mempunyai ikatan kompleks dengan protein yang lebih kuat dibandingkan dengan tanin terhidrolisis (Fahey & Berger, 1988).
Tanin dapat berinteraksi dengan protein dan ada tiga bentuk ikatan yaitu: (1) ikatan hidrogen, (2) ikatan ion, (3) ikatan kovalen. Tanin terhidrolisis dan terkondensasi berikatan dengan protein dengan membentuk paling banyak ikatan hidrogen antara kelompok fenol dari tanin dan kelompok karboksil (aromatik dan alifatik) dari protein. Ikatan kuat antara tanin dan protein akan berpengaruh terhadap kecernaan protein (Mueller, 2006).
Tanin terkondensasi (cathecin dan gallocathecin)
Tanin terhidrolisis (gallic dan ellagic acid) Gambar 6. Struktur Kimia Tanin Terkondensasi dan Terhirolisis
Sumber: Patra dan Saxena (2010)
Kandungan tanin dalam pakan ternak mempunyai pengaruh yang menguntungkan dan merugikan. Makkar et al. (1988) melaporkan bahwa tanin menurunkan beberapa aktivitas enzim rumen seperti urease, carboxymethyl cellulase, protease, glutamine dehydrogenase dan alanine transferase. Sigh et al. (2011) melaporkan bahwa pemberian pakan dengan daun pakar (Ficus infectoria) yang mengandung tanin (8,60 dan 13,84)% pada kambing betina secara signifikan (p<0,05) menurunkan populasi bakteri selulolitik. Penelitian ini menggunakan Real Time PCR yang menunjukkan penurunan 14% pada populasi bakteri R. flavefacien
14 dan tidak ada perubahan terhadap populasi bakteri pendegradasi serat yang lain yaitu F. succinogenes.
Tanin dalam jumlah kecil pada ruminansia dapat bersifat menguntungkan karena tanin dalam pakan dapat mencegah kembung pada ternak sapi dan domba, selain itu tanin terkondensasi melindungi protein dari degradasi mikroba rumen (protein by pass) sehingga dapat langsung diserap oleh usus halus. Komplek tanin protein yang terbentuk oleh ikatan hidrogen stabil pada pH sekitar 4-7 namun selain pH tersebut komplek ini akan terpisah. Protein diikat oleh tanin dalam rumen, lalu setelah keluar dari rumen ikatan ini akan pecah di abomasum (pH 2,5-3,5) dan masuk ke usus halus sehingga protein tersebut dapat dicerna dan diserap (Wiryawan et al., 1999) (Gambar 7).
Mulut Tanin terkondensasi + protein pakan
Kompleks tannin terkondensasi dengan protein pakan Rumen
(pH 5-7)
Perlindungan tannin terhadap protein dari degradasi mikroba
Tanin terkondensai bebas Abomasum
(pH 2,5-3,5) Protein pemisahan dari komplek
Tanin terkondensasi bebas Protein pemisahan dari komplek
Usus
(pH 8-9) Dicerna dan diserap
Gambar 7. Mekanisme Perlindungan Tanin Terkondensasi terhadap Protein pada Ternak Ruminansia
Sumber : D’Mello (1991)
Tanin juga memiliki potensi menurunkan jumlah protozoa dan produksi metan tidak mempengaruhi kondisi normal rumen. Hasil penelitian Daning (2010) melaporkan bahwa penambahan limbah teh hitam (bohea bulu) yang setara dengan kandungan tanin 3, 6, dan 12 mg/g subtrat pada fermentasi rumput raja dan dedak
15 halus secara in vitro secara nyata (P<0,05) menurunkan populasi protozoa, produksi gas total dan metan, kadar NH3, serta tidak nyata (P>0,05) menurunkan pH, sintesis dan efisiensi protein mikroba.
Pengaruh tanin terhadap karakteristik fermentasi (pH, NH3, VFA total dan parsial, kecernaan bahan pakan dan produksi gas) bermacam-macam. Hasil penelitian (Krueger et al., 2010) melaporkan bahwa penambahan mimosa (tanin terkondensasi) dan chesnut (tanin terhidrolisis) yang mengandung tanin setara 0,38 g/kg BB pada pakan yang mengandung 14,9 g/kg BK tidak memberikan efek yang signifikan (P>0,05) terhadap pH, konsentrasi amonia, produksi VFA total dan parsial serta rasio asetat dan propionat. Respon yang berbeda dilaporkan oleh (Jayanegara et al., 2009) bahwa penambahan tanin murni 0,5 mg/ml pada subtrat hay secara nyata (P<0,05) menurunan KCBO sebesar 4,4% hingga 5,9%, secara umum menurunkan produksi asam asetat, propionat, butirat dan valerat (P<0,05), tidak berbeda nyata (P>0,05) antara rasio asetat dan propionat (C2/C3), serta menurunkan produksi total
gas secara nyata (P<0,05) pada waktu inkubasi 24 jam kecuali tanin yang berasal dari tanaman sumach. Perbedaan ini disebabkan tipe dan konsentrasi tanin yang diberikan berbeda.
Kumar (1992) mengemukakan bahwa tanin terkondensasi sebanyak 2-3% di dalam ransum ruminansia memberikan pengaruh yang menguntungkan. Menurut Patra dan Saxena (2010) penambahan tanin lebih dari 5% pada pakan akan menyebabkan penurunan kecernaan baik secara in vitro ataupun in vivo, penurunan palatabilitas pakan, mengganggu penggunaan kecernan nutrien dan produktivitas ternak. Mengurangi kecernaan serat karena berikatan dengan lignoselulosa dan mengganggu degradasi oleh mikroba rumen yang secara langsung menghambat degradasi mikroorganisme selulolitik dan aktivitas enzim fibrolitik atau keduanya. Saponin
Saponin merupakan senyawa sekunder yang ditemukan pada banyak tanaman di bagian akar, kulit, daun, biji, dan buah yang berfungsi sebagai sistem pertahanan. Keberadaan saponin dapat dicirikan dengan adanya rasa pahit, pembentukan busa yang stabil pada larutan cair dan mampu membentuk molekul dengan kolesterol. Secara umum pada tanaman yang sama, tanaman yang belum matang memiliki
16 kandungan saponin yang lebih tinggi dibandingkan yang matang (Francis et al., 2002).
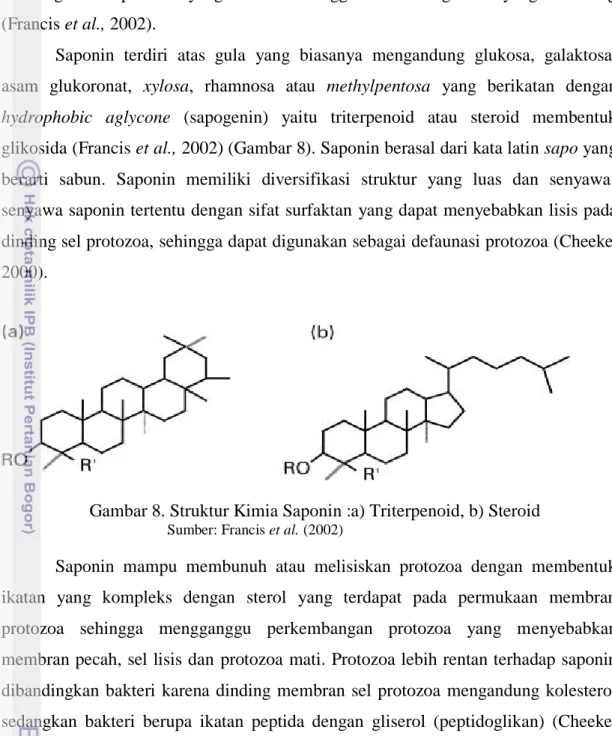
Saponin terdiri atas gula yang biasanya mengandung glukosa, galaktosa, asam glukoronat, xylosa, rhamnosa atau methylpentosa yang berikatan dengan hydrophobic aglycone (sapogenin) yaitu triterpenoid atau steroid membentuk glikosida (Francis et al., 2002) (Gambar 8). Saponin berasal dari kata latin sapo yang berarti sabun. Saponin memiliki diversifikasi struktur yang luas dan senyawa-senyawa saponin tertentu dengan sifat surfaktan yang dapat menyebabkan lisis pada dinding sel protozoa, sehingga dapat digunakan sebagai defaunasi protozoa (Cheeke, 2000).
Gambar 8. Struktur Kimia Saponin :a) Triterpenoid, b) Steroid
Sumber: Francis et al. (2002)
Saponin mampu membunuh atau melisiskan protozoa dengan membentuk ikatan yang kompleks dengan sterol yang terdapat pada permukaan membran protozoa sehingga mengganggu perkembangan protozoa yang menyebabkan membran pecah, sel lisis dan protozoa mati. Protozoa lebih rentan terhadap saponin dibandingkan bakteri karena dinding membran sel protozoa mengandung kolesterol sedangkan bakteri berupa ikatan peptida dengan gliserol (peptidoglikan) (Cheeke, 2000). Menurut Patra dan Saxena (2010) keefektifan saponin dapat berkurang karena saponin mampu didegradasi oleh mikroba rumen sehingga perlu adanya protektif terhadap saponin dari degradasi mikroba rumen agar saponin tetap efektif.
Pengaruh saponin terhadap karakteristik fermentasi (pH, NH3, VFA total dan parsial, kecernaan bahan pakan dan produksi gas) bermacam-macam. Beberapa penelitian menunjukkan penambahan saponin meningkatkan propionat, menurunkan asetat dan butirat, namun penelitian lain menunjukkan tidak ada perbedaan dengan kontrol. Perbedaan ini disebabkan tipe dan konsentrasi saponin yang diberikan
17 berbeda. Banyak penelitian yang melaporkan terjadinya peningkatan propionat ketika pakan banyak mengandung bijian dan berbeda ketika pakan banyak serat ataupun campuran (Hart et al., 2008).
Hasil penelitian Santoso et al. (2007) melaporkan bahwa penambahan Biophytum petersianum Klotzsch pada pakan dengan rasio konsentrat dan hijauan (70:30 BK) dengan kandungan saponin 0, 13; 19,5 dan 26 mg/kg BB secara linier menurunkan konsentrasi NH3 (P<0,01), VFA total, proporsi butirat dan iso acid, serta populasi protozoa (P<0,05) dan meningkatkan pH (P<0,01)antara 6,91 sampai 7,2. Thalib (2004) melaporkan bahwa beberapa tanaman tropis mengandung saponin dalam jumlah tinggi, buah lerak (Sapindus rarak) efektif menekan proses metanogenesis di dalam rumen. Eliminasi protozoa rumen mampu meningkatkan jumlah bakteri amilolitik, sehingga menghasilkan lebih banyak asam propionat dan lebih sedikit gas metan.