ANALISIS SENYAWA ANTIBAKTERI PADA BEBERAPA JENIS KARANG GORGONIAN DAN IDENTIFIKASI BERDASARKAN KARAKTER SPIKULA
Skripsi
Untuk memenuhi sebagian persyaratan guna memperoleh gelar Sarjana Sains
Oleh:
Eni Rohkayati NIM. M0405027
JURUSAN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SEBELAS MARET
BAB I.
PENDAHULUAN
A. Latar Belakang
Di dalam lautan terdapat berbagai sumber plasma nutfah yang bermanfaat. Dimulai
dari produsen primer berupa fitoplankton dan tumbuhan laut, keanekaragaman hewan
dari protozoa, invertebrata dan vertebrata. Keberadaan komunitas bentos, pelagik, dan
nekton, kesemuanya menyusun keragaman sumber daya laut (McConnaughey dan
Zottoli, 1983; Sumich, 1999). Octocoral sangat melimpah pada daerah terumbu karang.
Salah satu koral yang melimpah adalah koral gorgonian (Grajales et al., 2007). Gorgonian memiliki kemelimpahan dan peran ekologis sangat penting. Gorgonian dapat
dijumpai pada perairan dangkal hingga laut dalam. Gorgonian merupakan anggota taksa
octocoral yang jarang dipelajari baik taksonominya maupun subjek lainnya (McFadden et al., 2006).
Laut sebagai sistem yang terbuka memungkinkan terjadinya pertukaran aneka
materi dan energi dengan lingkungan disekitarnya. Selain materi dan energi, terjadi juga
pertukaran bakteri. Beberapa jenis bakteri darat dan air tawar dapat bertahan hidup dalam
larutan garam, dengan konsentrasi sama atau lebih tinggi dari laut untuk beberapa saat
(Sidharta, 2000). Patogenesis merupakan mekanisme invasi patogen ke inang sampai
menghasilkan suatu simptom (gejala penyakit). Patogen sendiri adalah material maupun
organisme yang mampu menyebabkan penyakit. Sebagian besar patogen berupa bakteri
Adanya berbagai patogenesis yang ditimbulkan oleh bakteri menimbulkan
pemikiran tentang pentingnya antibakteri guna menghambat dan atau mematikan bakteri
patogen yang telah menginvasi sel inang. Antibakteri dapat diperoleh dari hasil ekstraksi
dan isolasi senyawa suatu organisme. Organisme hidup beradaptasi dalam
mempertahankan eksistensi terhadap perubahan lingkungan hidupnya. Salah satu
mekanisme adaptasi yang dilakukan adalah membentuk suatu senyawa yang merupakan
hasil metabolisme sekunder. Senyawa hasil metabolisme sekunder dikenal memiliki
berbagai aktifitas biologis diantaranya sebagai antibakteri atau antimicrobial. Beberapa penelitian yang telah dipublikasikan memberikan informasi bahwa karang gorgonian
dapat menghasilkan senyawa metabolisme sekunder yang berfungsi sebagai antibakteri
(Fuganti and Serra, 2000; Kelman et al., 2006). Metabolit sekunder tersebut berupa senyawa-senyawa dari golongan terpenoid, alkaloid, fenolik dan steroid (Pawlik and
Fenical, 1992; Gutie´rrez et al. 2006; Iwamaru et al., 2007).
Pada karang gorgonian, spikula merupakan dasar utama dalam menentukan spesies
Brill and Backhuys, 1983; Lewis and Wallis, 1991; Sanchez et al., 2003). Selain itu analisis senyawa kimia dari organisme juga memberikan kontribusi kemudahan dalam
sistematika (Gerhart, 1983). Adapun analisis senyawa yang berfungsi sebagi antibakteri
memberikan gambaran kemampuan pertahanan diri dari karang gorgonin
B. Rumusan Masalah
Berdasarkan latar belakang maka dirumuskan permasalahan sebagai berikut:
1. Apakah jenis senyawa dari ekstrak metanol dan etil asetat karang gorgonian yang
2. Bagaimana identifikasi spesies dari taksa gorgonian dilihat dari karakter spikula?
C. Tujuan Penelitian
Penelitian yang dilakukan bertujuan untuk:
1. Mengetahui senyawa dari ekstrak metanol dan etil asetat karang gorgonian yang
dapat berfungsi sebagai antibakteri.
2. Mengetahui karakter spikula dari karang gorgonian untuk identifikasi tingkat
genus dan spesies.
D. Manfaat penelitian
Hasil penelitian ini diharapkan dapat bermanfaat untuk:
1. Memperoleh jenis senyawa antibakteri dari ekstrak metanol dan etil asetat karang
gorgonian yang dapat berfungsi sebagai antibakteri.
BAB II. LANDASAN TEORI
BAB II.
LANDASAN TEORI
A. Karang Gorgonian
Gorgonian memiliki kemelimpahan dan peran ekologis yang penting. Hewan ini
dapat dijumpai pada perairan dangkal hingga laut dalam. Gorgonian merupakan anggota
taksa octocoral yang jarak dipelajari baik taksonomi maupun subyek lainnya (McFadden
et al., 2006). Octocoral melimpah pada daerah terumbu karang, di laut Karibia (Atlantik barat) didapatkan lebih dari 60 spesies dalam satu lokasi. Salah satu koral yang melimpah
adalah koral gorgonian (Grajales et al., 2007).
Gorgonian merupakan koral yang mempunyai kerangka berbentuk tanduk dengan
spikula calcarea dan polip kecil berasosiasi dengan sea fans, sea whips, sea feathers dan koral merah. Gorgonian mempunyai rangka aksial dalam yang kuat, fleksibel tersusun
atas material keras yang disebut gorgonin. Gorgonin merupakan material proteinaceous
yang hampir menyerupai tanduk atau dikenal dengan istilah scleroproteinous (Antonius, 2000; Fabricius and Alderslade, 2001).
Rangka tubuh fleksibel yang mendukung pergerakan. Rangka dilapisi oleh sebuah
lapisan tersusun atas jaringan dimana polip tertanam di dalamnya. Jaringan ini terdiri atas
banyak tubula yang berhubungan dengan spikula calcarea. Gorgonian umumnya
berbentuk seperti pohon dengan banyak cabang pendukung. Adapula gorgonian yang
merupakan koral sangat indah dan memiliki banyak warna (Antonius, 2000). Pada
umumnya gorgonian memiliki bentuk padat, aksis sentral memiliki lapisan choenenchym
tipis sebagai tempat tumbuhnya polip. Pada daerah tropis koloni banyak ditemukan dalam
bentuk kipas yang memiliki diameter hingga mencapai 2-3 meter. Bagian tubuh
sederhana terdiri atas medula dan korteks (Fabricius and Alderslade, 2001).
Hewan ini bereproduksi secara seksual dan aseksual. Reproduksi seksual dengan
cara broadcaster, yaitu dengan cara mengeluarkan telur dan sperma dalam jumlah besar ke perairan sehingga terjadi fertilisasi eksternal dan larvanya berenang bebas sebelum
menempel di dasar perairan untuk tumbuh menjadi gorgonian dewasa. Pemijahan dapat
terjadi dengan adanya penyesuaian antara pencahayaan dan suhu air. Reproduksi aseksual
meliputi runner-formation, coloni fragmentation, fission atau budding (Fabricius and Alderslade, 2001).
B. Spikula dan Identifikasi
Spikula disebut juga sklerit merupakan komponen penyusun kerangka aksial
karang gorgonian. (Antonius, 2000; Fabricius and Alderslade, 2001). Berbagai bentuk
spikula tersebar luas pada octocoral. Pemberian nama genus dan familia banyak
berdasarkan pada karakter spikula yang ada (Brill and Backhuys, 1983). Tiap kelompok
gorgonian memiliki spikula yang menjadi penciri khas. Bentuk-bentuk dasar spikula itu
diantaranya double head, spindle, club, scaphoid dan rod. Penentuan bentuk spikula tersebut menganut pada ketentuan taksonomi yang ada (Brill and Backhuys, 1983; Lewis
Pada banyak penelitian tentang taksonomi, spikula merupakan dasar penentuan
spesies disamping kemotaksonomi dan genetik (Lewis and Wallis, 1991; Sanchez et al., 2003). Penggolongan dalam grup atau sub-ordo banyak didasarkan pada karakter spikula.
Gorgonian merupakan anggota Alcyonacea yang terdiri atas grup scleraxonia, sub-ordo
holaxonia dan calcaxonia. Kelompok tertentu memiliki penciri khas tertentu. Seperti
familia Ellisellidae (calcaxonia) memiliki ciri khas bentuk double head atau double cone. Adapun familia Melithaeidae (scleraxonia) memiliki bentuk nodus yang tampak jelas dan
struktur spikula scaphoid (Brill and Backhuys, 1983; Lewis and Wallis, 1991Grasshoff, 1999; Grasshoff, 2000; Fabricius and Alderslade, 2001; Sanchez et al., 2003)
C. Gorgonian dan Aktivitas Senyawa Metabolit Sekundernya
Cnidaria mempunyai fungsi ekologis sebagai antipredator dan antifouling. Koral
mengeluarkan metabolisme sekundernya ke lingkungan pada kondisi krusial dalam
interaksi kompetitif di lingkungan yang terbatas (Marti et al., 2005). Kim et al. (2000) dan Kelman et al. (2006) mengungkapkan bahwa koral mengandung senyawa yang dapat berfungsi sebagai antimikrobial.
Gorgonian dikenal menghasilkan karotenoid seperti peridinin, astaxantin, turunan
7,8-didehidro dan 7,8,7’,8’-tetradehidro, karotenoid asam lemak, glikosida dan
karotenoprotein. Selain adanya karotenoid juga ditemukan sejumlah terpenoid dan sterol.
Terpenoid yang ditemukan berbentuk seskuiterpen seperti (+)-β-Bisabolena, (+)-α
-Kurkumena, (+)-β-Kurkumena, (+)-β-Kurkumena, (-)-Germakrena, (-)-δ-Kardinena,
(+)-α-Muurolena, (+)-β-Gorgonena dan sebagainya. Adapun sterol yang dijumpai adalah
kolesterol, kolestenon, 22-Dehidrokolesterol, Dihidrobrasikasterol, Brasikasterol,
Stigmasterol, Sitosterol, Kalinasterol, 24-Metilenasterol, Gorgostanol, Gorgosterol,
Dimetilgorgosterol dan Fukosterol (Scheuer, 1995).
Gambar 2. Pseudopterogorgia elisabethae mengandung pseudopterosin sebagai anti-allergenic and anti-inflammatory (Fenical, 2006).
Pawlik dan Fenical (1992) menyampaikan bahwa Pseudopterogorgia rigida
hidrokarbon sesquiterpen. Senyawa yang dihasilkan mempunyai aktivitas untuk
pertahanan diri dari serangan predator. Fenical (2006) melaporkan bahwa
Pseudopterogorgia elisabethae, mengandung pseudopterosin yang potensial digunakan sebagai anti-allergenic dan anti-inflammatory. Gutie´rrez et al. (2006) menyatakan bahwa ekstrak metanol dari Muricea austera diperoleh 8 komponen senyawa yang terdiri dari 3 senyawa derivat tyramin, 2 senyawa steroid yang mengandung gugus glikosida dan
tiga senyawa sesquiterpen. Senyawa yang dihasilkan diujikan terhadap Plasmodium falciparum dan bentuk interseluler Trypanosoma cruzi. Hasil pengujian menunjukkan adanya aktifitas antiprotozoal dan antiplasmodial. Eunicea sussicea dalam laporan Iwamaru et al. (2007) menghasilkan eupalmarin asetat yang memiliki aktivitas antikanker karena kestabilan senyawa dan kemampuan sitotoksik yang lebih tinggi. Fuganti dan
Serra (2000) menyebutkan bahwa curcuphenol, curcuquinone dan curcuhydroquinone
yang diisolasi dari gorgonian Pseudopterogorgia rigida menunjukkan kemampuan sebagai antibakteri melawan Staphylococcusaureus dan Vibrio anguillarum.
(S)-(+)-Curcuphenol (S)-(-)-Curcuquinone (S)-(+)-curcuhydroquinone
Gambar 3. Struktur senyawa hasil isolasi Pseudoterogorgia rigida yang memiliki aktifitas antibakteri pada Staphylococcus aureus dan Vibrio anguillarum (Fuganti dan Serra, 2000).
D. Bioprospek Gorgonian
Setiap spesies menghasilkan kandungan yang khas. Ada keterkaitan antara berbagai
disiplin ilmu yang membahas hal ini adalah kemotaksonomi. Kemotaksonomi, genetik
dan analisis hubungan berdasarkan morfologi sangat berkaitan antar beberapa famili.
Produksi, konsentrasi dan komposisi dari senyawa yang dihasilkan dipengaruhi kondisi
lingkungan dan variasi dari tempat. Kegiatan kemotaksonomi berperan untuk
memberikan alternatif bagi teknik taksonomi tradisional (Fabricius and Alderslade,
2001). Kemotaksonomi merupakan suatu bentuk pengklasifikasian yang menggunakan
karakater senyawa kimia (Gerhart, 1983).
Gorgonian merupakan merupakan sesil (hewan yang tumbuh dan hidup menempel).
Kondisi ini sangat memungkinkan adanya predator, kompetitor dan terpapar ultraviolet.
Gorgonian meningkatkan produksi substansi kimianya, yang efektif melawan predator
dan mencegah pertumbuhan hewan sekitarnya maupun hewan penempel. Substansi
tersebut yang dinamakan metabolisme sekunder. Banyak dari produk alam yang berasal
dari gorgonian dimanfaatkan dalam pengujian farmakologi (Fabricius and Alderslade,
2001).
E. Bakteri
1. Morfologi Bakteri
Sekitar 80% bakteri laut yang diketahui berbentuk batang dan Gram negatif
(Zobell, 1946 dalam Sidharta, 2000). Pemeriksaan secara acak terhadap berbagai koloni
dan pengamatan mikroskopis langsung menunjukkan 95% bakteri laut bersifat
gram-negatif. Pleomorfisme umum terjadi pada bakteri laut ketimbang mikrobia sungai, danau,
dan tanah. Sekitar seperlima bakteri batang dari laut berbentuk kumparan (Helicoid),
secara aktif. Diperkirakan kemampuan bergerak ini sebagai hasil adaptasi kehidupan
perairan. Pseudomonas, Vibrio, Flavobacterium, Achromobacter, dan Bacterium
merupakan jenis terbanyak yang dijumpai di laut secara berturut-turut (Sidharta, 2000).
2. Jenis Bakteri-bakteri Patogen
Bacillus subtilis merupakan bakteri mesofilik, bacillus aerobic, memiliki bentuk spora ellipsoidal hingga silindris. Bakteri ini merupakan anggota gram-positif (Purwoko,
2007). Pada peptidoglikan bakteri ini mengandung berbagai variasi peptida (Lamanna,
1973). Hidup pada pH 6.0 dalam acetyl-methylcarbinol, gelatin terhidrolisis.
Menghidrolisis pati dan mereduksi nitrat menjadi nitrit (Burrows et al., 1968). Bacillus subtilis mampu menginfeksi dan terkadang memproduksi septicemia pada hewan immature. Pengamatan di bawah mikroskop didapatkan bakteri berbentuk gulungan kusut
rantai panjang. Bakteri tersebut ditemukan bersamaan dengan air segar yang turun saat
hujan (Burrows et al., 1968).
Staphylococcus aureus merupakan bakteri kokus dan gram-positif. Koloni bakteri umumnya berwarna kuning kemilau pada beberapa media (Salyers dan Whitt, 1944).
Staphylococcus aureus memiliki diameter sel 0.8-1.0 µm dan terkadang terlihat sebagai sel tunggal, berpasangan atau dalam kelompok. Pada media trypticase soy agar atau
blood agar berdiameter antara 1-3 mm, terlihat kuning, jingga atau putih. Memiliki toleransi terhadap garam, tumbuh baik pada media yang mengandung sodium chloride
10% (Benson, 2002). Hampir semua strain bakteri ini merupakan coagulase-positif. Menghasilkan alfa toksin yang menyebabkan terjadinya zona bening luas (beta-tipe),
kematian (Benson, 2002). Secara normal koloni Staphylococcus aureus dapat ditemukan pada hidung manusia dan kulit, dalam jumlah kecil juga dapat ditemukan pada colon dan saluran vagina. Gejala penyakit yang disebabkan oleh bakteri ini seperti mual akut, nyeri
perut dan diare (Salyers dan Whitt, 1994).
Pseudomonas aeruginosa merupakan bakteri berbentuk batang dan memiliki flagela polar. Bakteri ini termasuk anggota gram-negatif aerobik. Memiliki sifat resistan
terhadap antibiotik dan desinfektan. Pseudomonas aeruginosa menghasilkan ekskret ekstraselular berwarna hijau-biru yang dapat berdifusi ke media. Pada kondisi inang
lemah, bakteri ini mampu menginfeksi saluran urinaria, peradangan, dan luka. Bakteri ini
mengakibatkan septicemia, absses, pneumonia dan meningitis. Bakteri ini banyak ditemukan di tanah dan lingkungan yang tidak sehat. Antibiotik dari kelompok
carboxypenicillin, seperti carbenicillin dan ticarcillin memiliki kemampuan melawan infeksi bakteri ini. Adapun Aminoglycosides berjenis Gentamicin dapat mencegah sintesis protein bakteri ini dan bersifat bakterisidal (Tortora et al., 1994).
Vibrio harveyii merupakan bakteri gram-negatif berbentuk batang-koma ( Curve-rod) dengan satu flagela polar. Bakteri ini dapat bertahan di lingkungan laut dan darat serta berkoloni dalam saluran pencernaan, khususnya usus halus (Purwoko, 2007). Vibrio harveyii ini banyak dijumpai dalam darah kura-kura yang terserang tumor dan berasosiasi dengan bakteri gram-positif. Vibrio harveyii merupkan patogen yang signifikan pada crustacea, kuda laut dan finfish (Work et al., 2003). Bakteri ini memiliki autoinducer Nacylated homoserine lactone (OHL) yang merupakan derivat dari
N-(3-hydroxybutanol)-L-homoserine lactone (Hydroxy-BHL). Autoinducer yang dimiliki
Aeromonas hydrophila merupakan bakteri gram-negatif, anaerobik fakultatif, batang motil, lurus, kemo-organotrofik diantara metabolisme oksidatif dan fermentasi,
sitokrom-oksidase, katalase-positif, mereduksi nitrit menjadi nitrat tanpa membentuk gas
dan resistan terhadap vibriostatik. Tumbuh secara optimal selama 24 jam pada suhu 28 oC
dalam mediun TSA, tetapi keseluruhan strain Aeromonas dalapt hidup pada suhu 42 oC setelah 24 – 48 jam (Statner et a.l, 1988; Taylor et al., 1999; Huys et al., 2002). Menghasilkan pigmen terlarut dalam medium TSA. Memiliki protein (19-kDa) yang
dapat berfungsi sebagai Arginin-hydrolase, lysine decarboxylase-, indole- and Voges ±
Proskauer-positif. Dapat hidup dalam subtrat yang mengandung karbon dan sumber
energi seperti: acetate, N-acetyl-d-glucosamine, cis-aconitate. Keseluruhan strain resistan terhadap ampicillin dan penicillin, clendamycin, erythromycin, Spectinomycin,
sulfachloropyridazine, sulfadimethoxine, tiamulin, tilmicosin, tylosin tetapi sensitif
terhadap kanamycin, apramycin, ceftiofur, enrofloxacin, gentamycin dan neomycin.
Selain itu juga mempunyai resistensi terhadap nalidixic acid, streptomycin dan
tetracycline. Memiliki aktifitas β-hemolytic sangat kuat terhadap darah domba.
Memproduksi cytotoxin (Hird et al., 1983; Zemelman et al., 1983; Loewy et al., 1993; Huys et al., 2002; Maueal et al., 2002; Aydin et al., 2004). Cytotoxin enterotoksin
Aeromonas hydrophila memiliki beberapa aktifitas biologis, diantaranya menimbulkan efek peradangan pada inang dan mengakibatkan apoptosis pada makrofag murine,
cytotoxicity, enterotoxycity dan kematian pada mencit. Aeromonas hydrophila merupakan signifikan patogen pada manusia yang diisolasi dari perairan darat, lautan dan berbagai
jenis makanan. Secara umum bakteri ini dapat mengakibatkan penyakit pada saluran
penyebab virulensi berupa cytotoxin enterotoksin berukuran 52-kDa (Zemelman et al.,
1983; Galindo et al., 2004).
F. Kromatografi sebagai Metode Analisis
Kromatografi adalah suatu istilah umum yang digunakan untuk bermacam-macam
teknik pemisahan yang didasarkan atas partisi sampel diantara suatu fasa gerak yang bisa
berupa gas ataupun cair dan fasa diam yang juga bisa berupa cairan ataupun suatu
padatan. Pemisahan dengan teknik ini dijalankan dengan mengadakan manipulasi atas
dasar perbedaan sifat-sifat fisik dari zat-zat warna yang menyusun campuran. Sifat-sifat
fisik tersebut khususnya ialah: (1) adanya tendensi molekul dari suatu zat utuk larut
dalam suatu cairan, (2) adanya tendesi molekul dari suatu zat untuk dapat teradsorbsi
pada butir-butir zat padat yang halus dengan permukaan yang luas, (3) adanya tendesi
molekul dari suatu zat untuk masuk ke fase uap atau menguap (Fulton, 1996; Adnan,
1997).
Dalam kromatografi polaritas mempunyai arti penting. Polarits diartikan sebagai
adanya pemisahan kutub muatan positif dan negatif dari suatu molekul sebagai akibat
terbentuknya konfigurasi dari atom-atom yang menyusunnya. Tingkat pemisahan dari
muatan-muatan tersebut menentukan derajat polaritasnya, begitu juga daya tariknya.
Polaritas digunakan sebagai petunjuk sifat zat pelarut, adsorben, dan senyawa-senyawa
yang dipisahkan (Adnan, 1997).
Proses kromatografi dibedakan dua jenis, partisi dan adsorbsi. Pemilihan proses
kromatografi ditentukan oleh 3 faktor; 1) mudah tidaknya jenis kromatografi tersebut
Kromatografi adsorbsi umumnya lebih mudah dipakai dikarenakan polaritas adsorbennya
tetap (Adnan, 1997).
G. Kerangka Pemikiran
Karakter spikula merupakan dasar penentuan karang gorgonian. Pengamatan
terhadap spikula dapat digunakan untuk menentukan taksa. Analisis terhadap senyawa
metabolit sekunder dapat digunakan sebagai cara untuk mengetahui senyawa yang
berfungsi sebagai pertahanan diri. Senyawa kimia yang diperoleh merupakan metabolit
sekunder gorgonian. Metabolit sekunder mempunyai peran sangat penting bagi
organisme terkait eksistensi dalam lingkungan. Metabolit sekunder berfungsi sebagai alat
pertahanan diri dari predator dan bentuk adaptasi terhadap kondisi lingkungan tertentu.
Senyawa metabolit sekunder salah satunya berperan sebagai antibakteri. Pengkajian
terhadap karakteristik spikula memberikan informasi tentang hubungan kekerabatan dan
analisis senyawa antibakteri memberikan gambaran tentang kemampuan pertahanan diri
gorgonian.
Gambar 4. Diagram alir kerangka pemikiran penelitian
Karang Gorgonian
Spikula Uji antibakteri ekstrak
H. Hipotesis
Dari kegiatan penelitian yang akan dilakukan hipotesis awal adalah sebagai berikut:
1. Senyawa yang diperoleh dan berfungsi sebagai antibakteri termasuk dalam
kelompok terpenoid dan alkaloid.
2. Karakter spikula dari masing-masing spesies berbeda dan dasar untuk kegiatan
BAB III. METODE PENELITIAN
BAB III.
METODE PENELITIAN
A. Waktu dan Tempat Penelitian
Penelitian dilakukan pada bulan Juli–Oktober 2008 dan Maret-Juni 2009. Kegiatan
identifikasi sampel dilakukan di Laboratorium Mikroskop, kegiatan ekstraksi dilakukan
di Laboratorium Organik, kegiatan pengujian antibakteri dilakukan di Laboratorium
Mikrobiologi, Oseanografi-LIPI Ancol Timur Jakarta Utara dan kegiatan analisis
senyawa dilakukan di Laboratorium Kimia Analitik IPB
B. Alat dan Bahan 1. Alat Penelitian
Alat yang digunakan dalam penelitian ini adalah:
a. Identifikasi sampel: Botol sampel, gelas benda dan gelas penutup, mikroskop
kamera lucida (Leica) dan kamera digital (Olympus).
b. Ekstraksi: Penampan, blender, plastik sampel, erlemeyer 250 ml (Iwaki pyrex
), magnetic stirrer (Rexim), spinbar (Scienceware), labu alas bulat (Schot duran),
rotary evaporator (Buchi), vakum (Gast), water cooler (Eyela, Japan), corong pisah, gelas ukur 25 ml (YZ) dan 100 ml (Iwaki pyrex), spatula, botol sampel,
dan neraca analitik (Sartorius).
c. Pengujian Antibakteri: Cawan petri (16 buah), autoklaf (Tomy Sx 500),
ml (Iwaki Pyrex, 16 buah), vortex, lemari pendingin, jarum drigalsky,
mikropipet 100-1000 µl dan 1-20 µl (PipetPAL, 1 buah), tip 20 µl dan 1 ml,
UV-Vis spektrofotometri (Amersham, Biosciences), cuvet, paper disk (80 buah), pinset, falcon 15 ml (Sarstedt, 5 buah), spatula, kaki tiga, hot plate
(IKA RH Basic 2), laminar air flow (Bio Clean Bench, Sanyo), dan waterbath
(Memmert)
d. Analisis senyawa ekstrak gorgonian: Botol jam (4 buah), mikropipet 100-1000
µl dan 1-20 µl (PipetPAL, 1 buah), tip 20 µl dan 1 ml, UV-light box, kamera digital, syringe, chamber, tabung reaksi (Iwaki pyrex), sentrifuse, oven, pipet tetes.
2. Bahan Penelitian
Bahan yang digunakan dalam penelitian ini adalah:
a. Identifikasi sampel: Spikula gorgonian dan klorok.
b. Ekstraksi: Sampel karang gorgonian dalam bentuk serbuk, metanol pro-analysis (Merck), etil asetat pro-analysis (Merck), kertas saring, alumunium foil, dan kertas label.
c. Pengujian Antibakteri: Medium Muller hinton agar (Oxoid England), Biakan
bakteri Bacillus subtillis, Staphylococcus aureus, Pseudomonas aeruginosa, Vibrio harveyii, Aeromonas hydrophila, chloramphenicol, metanol dan etil asetat.
d. Analisis senyawa ekstrak gorgonian: ekstrak metanol dan etil asetat
(Merck), n-heksana (Merck), Silica Gel 60 F254 (Merck 0.20 mm), reagen
wagner, dragendorf, reagen mayer, H2SO4 2M, H2SO4 pekat, eter, asam asetat
anhidrat.
C. Cara Kerja
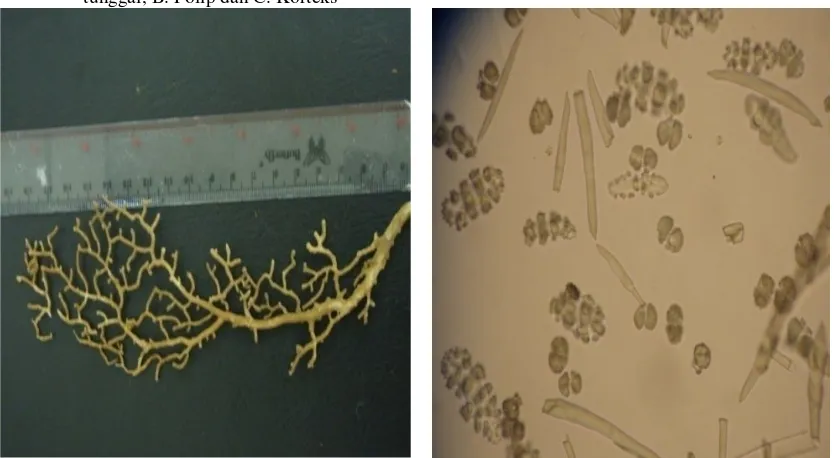
a. Identifikasi sampel
· Identifikasi karang gorgonian dengan metode bleaching (Perendaman dengan klorok).
· Spikula yang diperoleh diamati dibawah mikroskop dan dibuat sediaan
preparat permanen
· Spikula diukur dengan mikrometer
· Hasil yang diperoleh didokumentasikan dalam bentuk gambar.
b. Ekstraksi
· Sampel dikeringanginkan dan disimpan pada suhu rendah (±18 oC)
sebelum dihaluskan.
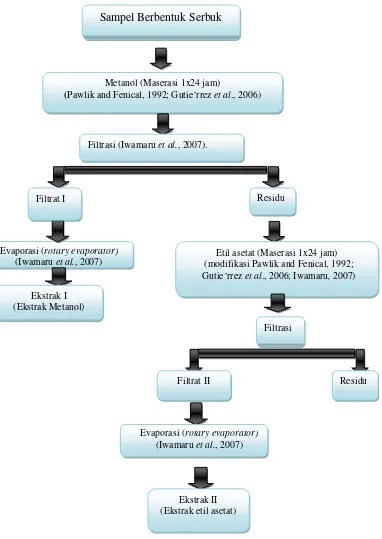
Gambar 5. Diagram alir cara kerja kegiatan ekstraksi pada karang gorgonian Evaporasi (rotary evaporator)
(Iwamaru et al., 2007)
Ekstrak II (Ekstrak etil asetat)
Filtrasi
Filtrat II Residu
Sampel Berbentuk Serbuk
Metanol (Maserasi 1x24 jam)
(Pawlik and Fenical, 1992; Gutie´rrez et al., 2006)
Filtrasi (Iwamaru et al., 2007).
Filtrat I Residu
Etil asetat (Maserasi 1x24 jam) (modifikasi Pawlik and Fenical, 1992; Gutie´rrez et al., 2006; Iwamaru, 2007)
Evaporasi (rotary evaporator)
(Iwamaru et al., 2007) Ekstrak I
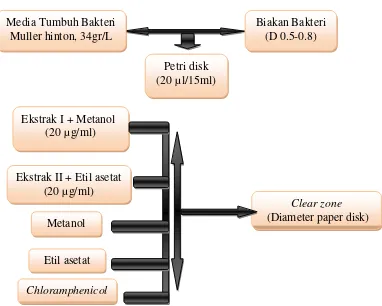
c. ’Pengujian Antibakteri (Modifikasi Adeloye et al., 2007):
Gambar 6. Diagram alir cara kerja uji antibakteri ekstrak kasar gorgogian
d. Analisis senyawa ekstrak gorgonian:
· Membuat reagen wagner: 20 g KI dan 25 g I2 dilarutkan dalam 10 mL
akuades. Larutan diencerkan hingga 200 mL, kemudian disaring dan
disimpan dalam botol coklat.
· Membuat reagen mayer: 1.36 g HgCl2 dilarutkan dalam 25 mL akuades. 5
g KI dilarutkan dalam 10 mL akuades. Kedua larutan dicampur, kemudian
diencerkan hingga 100 mL dan disimpan.
mL asam asetat glasial dan 40 mL akuades. 8 g KI dilarutkan dalam 20
mL akuades. Kedua larutan tersebut dicampurkan
· Fitokimia untuk alkaloid: 10 mg ekstrak kasar ditambahkan kloroform
dan NH3, kemudian divortek. Dilakukan penambahan H2SO4 2M
sebanyak 2 tetes, lalu divortek kembali. Lapisan asam yang terbentuk
diambil dan dibagi menjadi 3 bagian. Masing-masing bagian ditetesi
dengan reagen wagner, meyer, dan dragendorf. Dilakukan pengamatan
perubahan warna yang terjadi dan terbentuknya endapan (untuk reagen
wagner dan dragendorf). Hasil yang diperoleh didokumentasikan.
· Fitokimia untuk steroid terpenoid: 10 mg sampel ditambahkan eter 2 mL.
Selanjutnya ditambahkan 3 tetes asam asetat anhidrat dan 1 tetes H2SO4
2M. Perubahan warna yang terjadi diamati dan didokumentasikan.
Adanya cincin hijau menandai adanya steroid. Perubahan warna menjadi
lembayung dan ungu menandai adanya terpenoid.
· Fitokimia untuk flavonoid: 10 mg sampel dilarutkan pada metanol,
kemudian divortek, dipanaskan. Larutan diambil beberapa tetes kemudian
ditambahkan asam sulfat pekat. Perubahan warna yang terjadi diamati dan
didokumentasikan. Perubahan warna dari kuning, jingga hingga merah
menandai adanya dalam ekstrak.
· KLT analitik ekstrak metanol dilakukan pada plat silika gel F 254. Plat
sepanjang 10 cm, masing-masing digaris dengan pensil berjarak 1 cm dari
ujung. Ekstrak metanol 0.02 g dilarutkan dalam 1 ml metanol. Ekstrak
totolan dikembangkan dengan eluen metanol:kloroform: aquades (9:2:1).
Setelah pengembangan mencapai garis batas pada ujung yang lain,
pengembangan dihentikan. Plat dikeringkan dan secepatnya diamati
dibawah UV dengan panjang gelombang 356 nm. Spot yang ada ditandai
dan dihitung Rf-nya.
· KLT analitik ekstrak etil asetat dilakukan pada plat silika gel F 254. Plat
sepanjang 10 cm, masing-masing digaris dengan pensil berjarak 1 cm dari
ujung. Ekstrak etil asetat 0.02 g dilarutkan dalam 1 mL etil asetat. Ekstrak
ditotolkan pada plat disalah satu sisi yang bergaris. Plat yang telah berisi
totolan dikembangkan dengan eluen etil asetat:n-heksana (95:5). Setelah
pengembangan mencapai garis batas pada ujung yang lain,
pengembangan dihentikan. Plat dikeringkan dan secepatnya diamati
dibawah UV dengan panjang gelombang 254 nm. Spot yang ada ditandai
dan dihitung Rf-nya.
· KLT Preparatif pada ekstrak metanol dari Annella sp.1, Annella sp.2,
Annella sp.3 dan Paraplexaura sp. dikembangkan dengan eluen metanol:chlorofom:akuades (9:2:1). Eluen yang digunakan dijenuhkan
terlebih dahulu. Plat KLT preparatif diaktifkan dengan cara dioven pada
suhu 60 oC selama 45 menit. Plat KLT digaris pada kedua ujung berjarak
masing-masing 1 cm dari tepi. Ekstrak seberat 0.2-0.5 g dilarutkan dalam
metanol (usahakan larutan pekat). Ekstrak ditotolkan pada salah satu garis
Setelah proses pengembangan selesai, plat dikeringkan dan diamati
dibawah UV dengan panjang gelombang 254 nm. Spot yang terlihat
ditandai dan dilakukan pengerokan silika. Silika yang diperoleh
dilarutkan dalam metanol. Larutan disentrifuse dengan kecepatan 800 rpm
selama 10 menit. Supernatan diambil dan ditempatkan pada botol sampel
untuk dikeringkan dengan vakum. Hasil yang diperoleh ditimbang dengan
neraca analitik
· KLT preparatif pada ekstrak etil asetat dari Annella sp.1 dan Annella sp.3 dikembangkan dengan eluen etil asetat:n-heksana (95:5). Eluen yang
digunakan dijenuhkan terlebih dahulu. Plat KLT preparatif diaktifkan
dengan cara dioven pada suhu 60 oC selama 45 menit. Plat KLT digaris
pada kedua ujung berjarak masing-masing 1 cm dari tepi. Ekstrak seberat
0.2-0.5 g dilarutkan dalam metanol (usahakan larutan pekat). Ekstrak
ditotolkan pada salah satu garis dengan syringe. Plat dikembangkan dalam
chamber yang berisi eluen yang telah dijenuhkan hingga mencapai garis pada ujung yang satunya. Setelah proses pengembangan selesai, plat
dikeringkan dan diamati dibawah UV dengan panjang gelombang 254
nm. Spot yang yang terlihat ditandai dan dilakukan pengerokan silika.
Silika yang diperoleh dilarutkan dalam etil asetat. Larutan disentrifuse
dengan kecepatan 800 rpm selama 10 menit. Supernatan diambil dan
ditempatkan pada botol sampel untuk dikeringkan dengan vakum. Hasil
D. Teknik Pengumpulan Data
Data primer penelitian berupa ukuran spikula, bentuk spikula, ukuran zona bening,
dan jenis senyawa. Data ukuran dan bentuk spikula diperoleh dari kegiatan identifikasi
sampel. Data ukuran zona bening diperoleh dari kegiatan uji antibakteri. Data jenis
senyawa diperoleh dari kegiatan fitokimia. Data dikumpulkan secara kolektif. Data
didokumentasikan sebagai hasil penelitian.
Data sekunder diperoleh dari hasil telaah pustaka yang berisi hasil penelitian yang
berhubungan. Data sekunder merupakan pendukung dan pembanding terhadap hasil yang
diperoleh.
E. Analisis Data
Data yang diperoleh pada penelitian ini berupa data kuantitatif dan kualitatif. Data
kuantitatif meliputi ukuran spikula, zona penghambatan dan Rf. Data kualitatif berupa
jenis sampel, bentuk-bentuk spikula dan senyawa kimia dari masing-masing sampel.
BAB IV. HASIL DAN PEMBAHASAN
BAB IV.
HASIL DAN PEMBAHASAN
A. Identifikasi Sampel
Identifikasi merupakan proses menentukan suatu spesies dalam taksa tertentu.
Karakter spikula merupakan kunci yang utama dalam identifikasi secara konvensional.
Hasil identifikasi terhadap sampel diperoleh nama sampel dalam tingkat genus. Hasil
disampaikan dalam Tabel 1 ini:
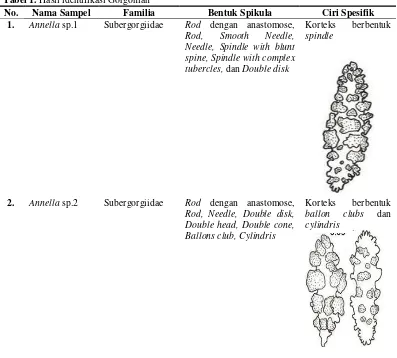
Tabel 1. Hasil identifikasi Gorgonian
No. Nama Sampel Familia Bentuk Spikula Ciri Spesifik
1. Annella sp.1 Subergorgiidae Rod dengan anastomose,
Rod, Smooth Needle, Needle, Spindle with blunt spine, Spindle with complex tubercles, dan Double disk
Korteks berbentuk
spindle
2. Annella sp.2 Subergorgiidae Rod dengan anastomose,
Tabel 1. Hasil identifikasi Gorgonian (lanjutan)
3. Annella sp.3 Subergorgiidae Rod dengan anastomose,
Rod, Needle, Spindle with
4. Annella sp.4 Subergorgiidae Rod dengan anastomose,
Rod, Rod with terminal
5. Verucella sp. Ellisellidae Double head, cylindris Double heads dengan batas yang jelas
6. Anthogorgia sp. Acanthogorgiidae Spindle with complex tubercles, Bent Spindle, Spindle, Scaphoid
Tabel1. Hasil identifikasi Gorgonian (lanjutan)
8. Wrigthella sp Melitheaidae Rod, Branched spindle, Hockeystick spindle, Wart
11. Melithea sp.2 Melitheaidae Rod, Rod with median
Antonius (2000) menyampaikan bahwa spikula merupakan kerangka penyusun
karang gorgonian. Rangka tanduk pada karang gorgonian disebut dengan gorgonin. Sklerit (spikula) merupakan karakter yang sangat penting untuk taksonomi dan klasifikasi
dari octocoral saat ini. Tipe spikula merupakan sumber informasi untuk penelitian
filogenetik dan pengelompokan dalam taksa (Brill and Backhuys, 1983; Lewis and
Wallis, 1991; Sanchez et al., 2003). Proses identifikasi dilakukan dengan cara pengamatan spikula yang dibawah mikroskop.
Spikula merupakan kunci identifikasi octocoral karena masing-masing jenis
memiliki bentuk dan struktur khas (Brill and Backhuys, 1983; Lewis and Wallis, 1991;
Antonius, 2000; Sanchez et al., 2003). Hasil identifikasi terhadap sampel yang ada, struktur dan bentuk dari spikula berupa needle, spindle, clubs, double head, double disk, double cone, scaphoid dan spiny ball (Brill and Backhuys, 1983; Lewis and Wallis, 1991).
Teknik untuk memperoleh bentuk spikula dan susunannya sangatlah sederhana,
dipisahkan dari spikula menggunakan teknik yang dinamakan bleaching, yaitu dengan merendam bahan pada cairan dan akhirnya spikula tertinggal. Larutan yang digunakan
berupa Na(OHCl) (dengan konsentrasi klorin 10-13%) (Fabricius and Alderslaide, 2001).
Hal-hal yang perlu diperhatikan pada saat bleaching adalah lama perendaman dan proses pencucian. Lama perendaman berpengaruh terhadap spikula yang diperoleh. Perendaman
yang terlalu lama akan merusak spikula karena sodium hipoklorit yang bersifat asam
akan mereduksi spikula. Pencucian berperan menghilangkan sisa sodium hipoklorit dan
menjadikan spikula bersih sehingga jelas ketika diamati dibawah mikroskop.
Daya resolusi dan pencahayaan berpengaruh dalam pengamatan spikula dibawah
mikroskop. Daya resolusi berpengaruh terhadap akurasi dari bentuk dan detail spikula
sehingga dapat digunakan sebagai pembeda antar genus dan spesies. Pencahayaan
berpengaruh terhadap kejelasan obyek yang diamati. Kegiatan yang juga berpengaruh
terhadap proses pengamatan adalah saat mounting atau penempelan dengan perekat. Adanya gelembung udara saat penempelan obyek pada gelas benda akan menghalanngi
saat pengamatan. Selain itu terdapat pula alat yang sangat diperlukan pada saat
pengamatan di bawah mikroskop yaitu adanya mikrometer yang berfungsi sebagai alat
ukur untuk menentukan besarnya spikula yang diamati.
Adapun deskripsi masing-masing sampel berdasarkan karakter spikula yang
diperoleh sebagai berikut:
1. Annella sp1 Gray 1858
Polip: monomorfik, retraktil dan tersebar diseluruh sisi cabang (Fabricius and Alderslade, 2001).
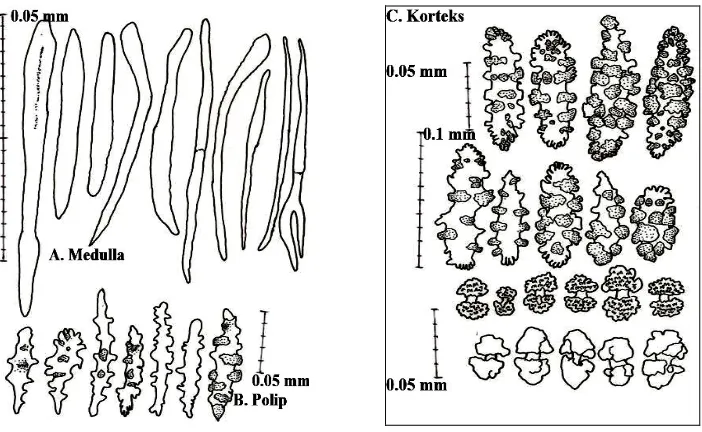
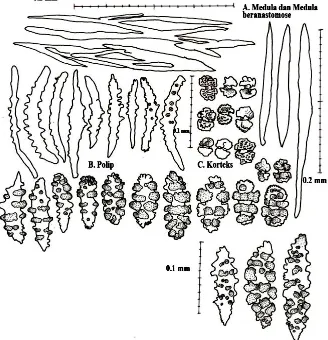
Sklerit: Tidak berwarna. Rod dengan anastomose; sklerit lurus atau berlekuk monoaksial dengan ujung mengecil, merupakan bagian medula yang beranastomose (Gambar 7A).
Rod; sklerit lurus atau berlekuk monoaksial, mengecil pada kedua ujung merupakan bagian medula yang dijumpai tunggal (Gambar 8A). Smooth Needle; sklerit yang panjang, kurus, menyerupai sklerit monoaksial yang halus, dengan ketidakhadiran
tonjolan kecil. Needle; sklerit yang panjang, kurus, menyerupai sklerit monoaksial dengan kehadiran tonjolan kecil, penyusun polip (Gambar 8B). Spindle with blunt spine; monoaksial sklerit berlekuk atau lurus yang mengecil pada kedua ujung dengan duri yang
tumpul pada permukaan sklerit, merupakan penyusun korteks; Spindle with complex tubercles,; monoaksial sklerit berlekuk atau lurus yang mengecil pada kedua ujung dengan tonjolan yang komplek, penyusun korteks (Gambar 8C-atas). Double disk; derivat dari putaran, dengan tonjolan pada kedua ulir yang bergabung pada roda atau piringan,
merupakan penciri khas pada Annella (Gambar 8C-bawah). Medula berukuran 0.1-0.12 mm, polip 0.03-0.07 mm dan korteks 0.03-0.07 mm (gambar 7-8) (Brill and Backhuys,
1983; Lewis and Wallis, 1991; Grasshoff, 1999; Grasshoff, 2000; Fabricius and
Alderslade, 2001).
Warna sesudah pengeringan: coklat
Distribusi: Raja Ampat Papua, Ambon, Samudra Hindia dan Samudra Pasifik bagian barat (Grasshoff, 1999; Grasshoff, 2000; Fabricius and Alderslade, 2001).
Catatan: cabang tersusun retikularis membentuk jala kecil. sklerit korteks dan polip lebih panjang dan lebih ramping dibanding Annella sp2.
Gambar 7. Re-drawing sklerit berupa medula beranastomose (A) dari Annella sp.1 (menggunakan mikroskop kamera lucida)
Gambar 9. Specimen kering dari Annella sp.1 (kiri) dan spikula dibawah mikroskop cahaya (tidak berskala).
2. Annella sp2 Gray 1858
Polip: monomorfik, retraktil dan tersebar diseluruh sisi cabang (Fabricius and Alderslade, 2001).
Aksis: berwarna kuning kecoklatan
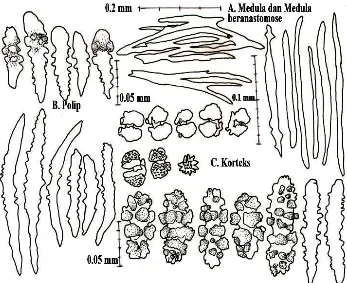
Sklerit: Tidak berwarna. Rod dengan anastomose; sklerit lurus atau berlekuk monoaksial dengan ujung mengecil, merupakan bagian medula yang beranastomose (Gambar 10A).
Rod; sklerit lurus atau berlekuk monoaksial, mengecil pada kedua ujung merupakan bagian medula tunggal (Gambar 11A). Needle; sklerit panjang, kurus, menyerupai sklerit monoaksial dengan kehadiran tonjolan kecil, penyusun polip (Gambar 11B). Double disk; derivat dari putaran, dengan tonjolan pada kedua ulir yang bergabung pada roda atau
piringan, merupakan penciri khas pada Annella. Double head; umumnya bagian terminal dibangun oleh sklerit yang sempit simetris, bagian tengah atau pinggang halus, dan
pegangan, penyusun korteks. Cylindris bagian ujung tumpul, berbentuk sepertii gulungan (Gambar 11C). Medula berukuran 0.1-0.3 mm, polip 0.05-0.08 mm dan korteks
0.03-0.08 mm (Gambar 10-11) (Brill and Backhuys, 1983; Lewis and Wallis, 1991;
Grasshoff, 1999; Grasshoff, 2000; Fabricius and Alderslade, 2001).
Warna sesudah pengeringan: coklat kemerahan
Distribusi: Raja Ampat Papua, Ambon, Samudra Hindia dan Samudra Pasifik bagian barat (Grasshoff, 1999; Grasshoff, 2000; Fabricius and Alderslade, 2001).
Catatan: percabangan retikularis tersusun seperti jala.Bagian ujung sklerit korteks ditemukan bergelombang kecil dan melebar, jarang ditemukan mengecil.
Berikut ini Gambar 10, Gambar 11 dan Gambar 12 yang merupakan specimen Annella
sp.2
Gambar 11. Re-drawing sklerit dari Annella sp.2 (menggunakan mikroskop kamera lucida). A. Medula tunggal, B. Polip dan C. Korteks
3. Annella sp3 Gray 1858
Polip: monomorfik, retraktil dan tersebar diseluruh sisi cabang (Fabricius and Alderslade, 2001).
Aksis: berwarna kuning kecoklatan dan halus
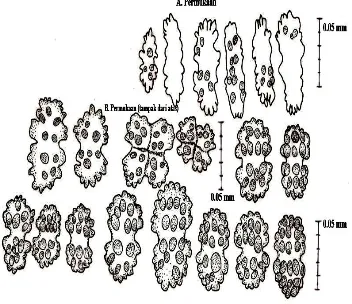
Sklerit: Tidak berwarna. Rod dengan anastomose; sklerit lurus atau berlekuk monoaksial dengan ujung mengecil, merupakan bagian medula yang beranastomose membentuk
jaringan. Rod; sklerit lurus atau berlekuk monoaksial, mengecil pada kedua ujung merupakan bagian medula yang dijumpai tunggal (Gambar 13A). Needle; sklerit panjang, kurus, menyerupai sklerit monoaksial dengan kehadiran tonjolan kecil, penyusun polip.
Spindle with blunt spine; sklerit lurus atau berlekuk mengecil pada kedua ujung, terdapat tonjolan yang tumpul. Crown spine; jarum berbentuk siklik, bagian distal termodifikasi menjadi panjang, hampir menyerupai jarum yang halus (Gambar 13B). Double disk; derivat dari putaran, dengan tonjolan pada kedua ulir yang bergabung pada roda atau
piringan, merupakan penciri khas pada Annella. Double head; umumnya bagian terminal dibangun oleh sklerit yang sempit simetris, bagian tengah atau pinggang halus, dan
tandan bagian ujung penuh tersusun melalui proses yang tidak radial. Double cone; jarum pendek dengan pinggang, menyerupai bentuk conus dari pakis pada kedua sisi (Gambar 13C-atas). Ballons club; tongkat halus, memiliki kepala seperti bola atau buah apel, kadang tersusun oleh kutil kecil atau 2-3 ulir jarum pada bagian tengah pegangan,
0.1-0.15 mm dan korteks 0.03-0.1 mm (Gambar 13) (Brill and Backhuys, 1983; Lewis
and Wallis, 1991; Grasshoff, 1999; Grasshoff, 2000; Fabricius and Alderslade, 2001).
Warna sesudah pengeringan: kehitaman.
Distribusi: Raja Ampat Papua, Ambon, Samudra Hindia dan Samudra Pasifik bagian barat (Grasshoff, 1999; Grasshoff, 2000; Fabricius and Alderslade, 2001).
Catatan: polip ramping, tonjolan-tonjolan pada sklerit berukuran besar. Perbedaan terlihat pada bentuk korteks.
Berikut ini Gambar 13 dan Gambar 14 merupakan gambar spesimen Annella sp.3.
Gambar 14. Spesimen kering Annella sp.3 (kiri) dan spikula (kanan) dibawah mikroskop electron (tanpa skala)
4. Annella sp4 Gray 1858
Polip: monomorfik, retraktil dan tersebar diseluruh sisi cabang (Fabricius and Alderslade, 2001).
Aksis: berwarna coklat muda
Sklerit: Tidak berwarna. Rod dengan anastomose; sklerit lurus atau berlekuk monoaksial dengan ujung mengecil, merupakan bagian medula yang beranastomose. Rod; sklerit lurus atau berlekuk monoaksial, mengecil pada kedua ujung merupakan bagian medula
yang dijumpai tunggal. Rod with terminal whorl; sklerit lurus atau berlekuk monoaksial, dengan ujung mengecil dan terdapat ulir (Gambar 15A). Needle; sklerit panjang, kurus, menyerupai sklerit monoaksial dengan kehadiran tonjolan kecil, penyusun polip. Ballons club; tongkat halus, memiliki kepala seperti bola atau buah apel, kadang tersusun oleh kutil kecil, atau 2-3 ulir jarum pada bagian tengah pegangan, penyusun polip (Gambar
merupakan double disk yang mempunyai bentuk tambahan seperti mulut. Cylindris; bagian ujung tumpul, berbentuk seperti gulungan. Spiny ball; bentukan yang tersusun bentuk menyerupai jarum (Gambar 15C). Medula berukuran 0.2-0.3 mm polip 0.05-0.08
mm dan korteks 0.03-0.1 mm (Brill and Backhuys, 1983; Lewis and Wallis, 1991;
Grasshoff, 1999; Grasshoff, 2000; Fabricius and Alderslade, 2001).
Warna sesudah pengeringan: coklat kehitaman
Distribusi: Raja Ampat Papua, Ambon, Samudra Hindia dan Samudra Pasifik bagian barat (Grasshoff, 1999; Grasshoff, 2000; Fabricius and Alderslade, 2001).
Catatan: cabang tersusun retukularis membentuk jala memanjang. Pada double disk
memiliki ulir yang halus dan kasar.
Berikut ini Gambar 15 dan Gambar 16 merupakan spesimen Annella sp.4.
Gambar 16. Spesimen kering Annella sp.4 (kiri) dan spikula (kanan) dibawah mikroskop elektron (tanpa skala)
5. Verucella sp Milne Edwards & Haime 1857
Polip: monomorfik, sangat kontraktil tapi tidak retraktil. Kontraksi polip umumnya berbentuk gundukan pada permukaan cabang (Fabricius and Alderslade, 2001).
Aksis: berwarna putih
Sklerit: Berwarna jingga. Double head; umumnya bagian terminal dibangun oleh sklerit yang sempit simetris, bagian tengah atau pinggang halus, dan tandan bagian ujung penuh
tersusun melalui proses yang tidak radial (Gambar 17A-bawah). Cylindris; bagian ujung tumpul, berbentuk seperti gulungan (Gambar 17A-atas). Pada pengamatan dibawah
mikroskop sklerit bias tampak secara horizontal maupun vertical. Spikula permukaan
berukuran 0.05-0.07 mm (Brill and Backhuys, 1983; Lewis and Wallis, 1991; Grasshoff,
1999; Grasshoff, 2000; Fabricius and Alderslade, 2001).
Warna sesudah pengeringan: jingga
Catatan: cabang berukuran kecil dengan tonjolan halus pada permukaan. Batas antara
double heads terlihat jelas.
Berikut ini Gambar 17 dan Gambar 18 merupakan spesimen Verrucella sp. -
Gambar 18. Spesimen kering Verucella sp (kiri) dan spikula (kanan) dibawah mikroskop electron (tanpa skala)
6. Anthogorgia sp Verrill 1868
Polip: monomorfik, retraktil, silindris atau berbentuk kubah (Fabricius and Alderslade, 2001).
Aksis: berwarna coklat kekuningan
Sklerit: Tidak berwarna. Spindle with complex tubercles; sklerit lurus atau berlekuk mengecil pada kedua ujung, terdapat tonjolan sangat komplek. Bent Spindle; sklerit lurus atau berlekuk, mengecil pada kedua ujung dengan tonjolan yang letaknya menyebar.
Spindle; sklerit yang lurus atau berlekuk yang mengecil pada kedua ujung, umumnya sklerit berbentuk spindle pada Anthogorgia berukuran besar (Gambar 19-20B). Scaphoid; jarum dengan sedikit atau banyak lekukan (Gambar 20A). Polip berukuran 1-1.5 mm dan
tentakel 0.5-0.7 mm (Brill and Backhuys, 1983; Lewis and Wallis, 1991; Grasshoff,
1999; Grasshoff, 2000; Fabricius and Alderslade, 2001).
Distribusi: di kepulauan Raja Ampat Papua
Catatan: sklerit hampir menyerupai Astrogorgia pada plexauridae, untuk membedakan dengan cara melihat ada tidaknya sklerit berbentuk bent spindle.
Berikut ini Gambar 19, Gambar 20 dan Gambar 21 merupakan spesimen Anthogorgia sp.
Gambar 20. Re-drawing sklerit bagian polip dan permukaan Anthogorgia sp.
Gambar 21. Specimen kering Anthogorgia sp. (kiri) dan spikula penciri familia Achantogorgiidae (kanan) dibawah mikroskop elektron (tanpa skala)
7. Viminella sp Gray 1870
Polip: monomorfik, sangat kontraktil tetapi tidak retraktil, tersusun melingkari atau sedikit menyelubungi saluran longitudinal. Umumnya selalu berkontraksi (Fabricius and
Alderslade, 2001).
Aksis: berwarna putih
Sklerit: Berwarna jingga. Double head; umumnya bagian terminal dibangun oleh sklerit yang sempit simetris, bagian tengah atau pinggang halus, dan tandan bagian ujung penuh
tersusun melalui proses yang tiidak radial. Double cone; jarum pendek dengan pinggang (Gambar 22 tengah-bawah). Cylindris bagian ujung tumpul, berbentuk seperti gulungan (Gambar 22-atas). Sklerit permukaan berukuran 0.05-0.1 mm (Brill and Backhuys, 1983;
Lewis and Wallis, 1991; Grasshoff, 1999; Grasshoff, 2000; Fabricius and Alderslade,
2001).
Warna sesudah pengeringan: putih pada bagian ujung dan jingga pada bagian pangkal
(Grasshoff, 1999; Grasshoff, 2000; Fabricius and Alderslade, 2001). Ditemukan pada
perairan di kepulauan Raja Ampat Papua.
Catatan: permukaan cabang tersusun atas tonjolan yang besar. Untuk membedakan
Ellisella dan Viminella perlu memperhatikan morfologi luar dan susunan tonjolan pada
double head.
Berikut ini Gambar 22 dan Gambar 23 merupakan spesimen Viminella sp.
Gambar 23. Spesimen kering Viminella sp. (kiri) dan spikula double head (kanan) dibawah mikroskop elektron (tanpa skala)
8. Wrigthella sp. Gray 1870
Polip: monomorfik, kecil, dan retraktil (Fabricius and Alderslade, 2001).
Aksis: berwarna merah dan berbentuk gelondong
Sklerit: Berwarna merah hingga jingga. Rod; sklerit lurus atau berlekuk monoaksial, mengecil pada kedua ujung merupakan bagian medula yang dijumpai tunggal. Branched spindle; sklerit lurus atau berlekuk yang mengecil pada kedua ujung dengan tonjolan tegas dan jelas. Hockeystick spindle; sklerit lurus atau berlekuk yang mengecil pada kedua ujung, berbentuk seperti tongkat pemukul hoki. Wart club; merupakan club dengan kepala yang berbentuk tonjolan atau menyerupai kutil. Ballons club; tongkat halus, memiliki kepala seperti bola atau buah apel, kadang tersusun oleh kutil kecil, atau 2-3 ulir
jarum pada bagian tengah pegangan, penyusun polip (Gambar 24C). Double disk derivat dari putaran, dengan tonjolan pada kedua ulir yang bergabung pada roda atau piringan.
Unilaterally foliate spheroid; kumpulan bentuk daun yang menyatu, hampir membentuk bola (Gambar 24BCD). Scaphoid with transverse crest; jarum dengan sedikit atau banyak lekukan, berbentuk seperti huruf “S” dengan tonjolan pada sisi cembung terlihat jelas
(Gambar 24E). Nodus berukuran 0.04-0.06 mm, polip 0.1-0.2 mm, korteks 0.05-0.08
mm, kaliks 0.05-0.08 mm dan tentakel 0.08-0.1mm (Brill and Backhuys, 1983; Lewis
and Wallis, 1991; Fabricius and Alderslade, 2001).
Warna sesudah pengeringan: merah
Distribusi: laut Jawa di perairan Pangkal Pinang.
Gambar 24. Re-drawing sklerit Wrightella sp. terdiri atas nodus (A), korteks (B), polip (C), kaliks (D), dan tentakel (E).
9. Paraplexaura sp. Kükenthal 1909
Polip: monomorfik dan semuanya retraktil. Calyces terlihat sangat rendah (Fabricius and Alderslade, 2001).
Aksis: berwarna hitam
Sklerit: Berwarna jingga. Rod; sklerit lurus atau berlekuk monoaksial, mengecil pada kedua ujung merupakan bagian medula yang dijumpai tunggal. Needle; sklerit yang panjang, kurus, menyerupai sklerit monoaksial dengan kehadiran tonjolan kecil,
penyusun polip (gambar 26A). Leaf spindle, sklerit yang lurus atau berlekuk yang mengecil pada kedua ujung dengan tonjolan yang tegas dan jelas (Gambar 26BC).
Ballons club; tongkat halus, memiliki kepala seperti bola atau buah apel, kadang tersusun oleh kutil kecil, atau 2-3 ulir jarum pada bagian tengah pegangan, penyusun polip. Wart club, merupakan club dengan kepala yang berbentuk tonjolan atau menyerupai kutil. Six-radiate, sklerit lurus atau berlekuk monoaksial, mengecil pada kedua ujung dengan tiga tonjolan pada kedua ulir di ujung. Spheroid; kumpulan menyatu tersusun atas bentuk tonjolan-tonjolan (Gambar 26D). Nodus berukuran 0.15-0.2 mm, kaliks 0.1-0.2 mm, dan
sub permukaan berukuran 0.05-0.2 mm (Brill and Backhuys, 1983; Lewis and Wallis,
1991; Fabricius and Alderslade, 2001).
Warna sesudah pengeringan: merah kehitaman. Aksis berwarna hitam
Distribusi: New Caledonia, perairan Indonesia, laut tropis dan sub-tropis Australia, pulau Andaman, Jepang dan Laut Merah (Fabricius and Alderslade, 2001). Ditemukan
diperairan Pangkal pinang dan Ambon.
Catatan: percabangan dikotom.
Gambar 26. Re-drawing sklerit Paraplexaura sp. terdiri atas nodus (A), kaliks (B), sub-permukaan (C) dan permukaan (D)
10.Melithaea sp1 Milne Edwards & Haime 1857
Polip: monomorfik, kecil, dan retraktil (Fabricius and Alderslade, 2001).
Aksis: berwarna putih keabuan
Sklerit: Berwarna kuning hingga jingga. Rod, sklerit lurus atau berlekuk monoaksial, mengecil pada kedua ujung merupakan bagian medula yang dijumpai tunggal. Rod with median whorl, sklerit lurus atau berlekuk monoaksial , mengecil pada kedua ujung dengan bagian tengah terdapat ulir (Gambar 28 AB). Needle, sklerit yang panjang, kurus, menyerupai sklerit monoaksial dengan kehadiran tonjolan kecil, penyusun polip (Gambar
28C-bawah). Spindle; sklerit lurus atau berlekuk mengecil pada kedua ujung. Bent Spindle;sklerit lurus atau berlekuk, mengecil pada kedua ujung dengan tonjolan letaknya menyebar. Branched spindle, Ballons club; tongkat halus, memiliki kepala seperti bola atau buah apel, kadang tersusun oleh kutil kecil atau 2-3 ulir jarum pada bagian tengah
pegangan, penyusun polip (Gambar 28D). Double disk, derivat dari putaran, dengan tonjolan pada kedua ulir yang bergabung pada roda atau piringan (Gambar 28C-atas).
Scaphoid with transverse crest; jarum dengan sedikit atau banyak lekukan, berbentuk seperti huruf “S” dengan tonjolan pada sisi cembung terlihat jelas. Ukuran nodus
0.03-0.08 mm, internodus 0.03-0.05 mm, tentakel 0.1-0.15 mm, korteks 0.05-0.1 mm dan
polip 0.1-0.2 mm (Brill and Backhuys, 1983; Lewis and Wallis, 1991; Grasshoff, 1999;
Grasshoff, 2000, Fabricius and Alderslade, 2000).
Warna sesudah pengeringan: merah
Distribusi: tersebar luas pada Samudra Hindia dan Samudra Pasifik (Grasshoff, 1999; Grasshoff, 2000; Fabricius and Alderslade, 2001). Ditemukan pada perairan selat Nasik
Catatan: memiliki nodus yang terlihat jelas, percabangan dikotom dan multiplanar. Berikut ini Gambar 28 dan Gambar 29 merupakan spesimen Melithaea sp.1.
Gambar 28. Re-drawing sklerit Melithaea sp.1 terdiri atas nodus (A), internodus (B), korteks (C), tentakel (D), dan polip (E) menggunakan mikroskop kamera lucida.
Gambar 29. Spesimen kering (kiri) dan spikula Melitahea sp.1 dibawah mikroskop elektron (tanpa skala).
Polip: monomorfik, kecil, dan retraktil (Fabricius and Alderslade, 2001).
Aksis: berwarna putih keabuan
Sklerit: Berwarna jingga. Rod; sklerit lurus atau berlekuk monoaksial, mengecil pada kedua ujung merupakan bagian medula yang dijumpai tunggal. Rod with median whorl,
sklerit lurus atau berlekuk monoaksial (Gambar 30DE). Needle; sklerit yang panjang, kurus, menyerupai sklerit monoaksial dengan kehadiran tonjolan kecil, penyusun polip.
Leafy spindle; jarum dengan satu bagian yang memiliki bentuk menyerupai daun. Ballons club; tongkat halus, memiliki kepala seperti bola atau buah apel, kadang tersusun oleh kutil kecil, atau 2-3 ulir jarum pada bagian tengah pegangan, penyusun polip. Wart club; merupakan club dengan kepala yang berbentuk tonjolan atau menyerupai kutil (Gambar 30AC). Double head; umumnya bagian terminal dibangun oleh sklerit yang sempit
Grasshoff, 1999; Grasshoff, 2000, Fabricius and Alderslade, 2000).
Warna sesudah pengeringan: merah jingga
Distribusi: tersebar luas pada Samudra Hindia dan Samudra Pasifik (Grasshoff, 1999; Grasshoff, 2000; Fabricius and Alderslade, 2001). Ditemukan di perairan selat Klatik
Natuna
Gambar 30. Re-drawing sklerit Melithaea sp.2 terdiri atas polip (A), korteks (B), tentakel (C), nodus D) dan internodus (E)
Gambar 31. Spesimen kering Melithaea sp.2 (kiri) dan spikula (kanan) dibawah mikroskop elektron
Dari deskripsi masing-masing spesies diatas dapat diperoleh informasi tentang
pada familia tertentu. Terdapat 5 familia pada sampel gorgonian yang digunakan (Tabel
1). Informasi biologis merupakan hal yang penting untuk mengetahui nama spesies,
hubungan kekerabatan dan gambaran kehidupan dari gorgonian tersebut.
B. Karakter Spikula Sebagai Dasar Identifikasi
Gorgonian dibedakan dengan Alcyonian dikarenakan adanya aksis semi-rigid
scleroproteinous. Gorgonacea merupakan nama ordo gorgonian yang hanya berada pada GenBank-taxonomy NCBI dan UNEP-WCMC database untuk hewan. Ordo ini
dihapuskan oleh Bayer (1961), kemudian dimasukkan pada ordo Alcyonacea (Fabricius
and Alderslade, 2001; Sanchez et al., 2003). Ordo Alcyonacea terdiri atas satu grup yaitu
Scleraxonia, dan 2 ordo yaitu Holaxonia dan Calcaxonia. Scleraxonia merupakan grup gorgonian yang memiliki aksial dalam seperti lapisan dan aksial luar yang terbentuk dari
sklerit. Holaxonia merupakan kelompok yang memiliki ciri aksial bulat, tidak memiliki
sklerit aksis tanpa spikula aksial dan saluran melintang berlekuk pada inti tengah.
Calcaxonia merupakan kelompok yang memiliki aksis gorgonin sleroproteinous dengan sejumlah non-skleritik CaCO3, internodus terbenam dalam gorgonin, aksis tanpa saluran
melintang berlekuk pada inti tengah (Grasshoff, 1999; Grasshoff, 2000; Fabricius and
Alderslade, 2001; Sánchez et al., 2003; McFadden et al., 2006).
Bentuk sklerit seringkali digunakan untuk menentukan spesimen pada tingkat
tertentu (Brill and Backhuys, 1983; Gerhart, 1983; Lewis and Wallis, 1991; Grasshoff,
Alcyonacea. Nama scleraxonia bukan merupakan ordo karena pada kelompok ini terdiri
atas alcyonian dan gorgonian. Alcyonian dan gorgonian memiliki kesamaan yaitu bagian
luar dan dalam aksis tersusun atas sklerit. Oleh karena alcyonian dan gorgonian yang
termasuk pada grup ini memiliki kesamaan komplek, maka scleraxonia bukan merupakan
ordo.
Hasil identifikasi berdasarkan karakter spikula memasukkan familia
Subergorgiidae dan Melitaheidae dalam grup scleraxonia. Subergorgiidae merupakan
anggota scleraxonia dengan aksis yang tidak tergabung (terdiri atas medulla dan korteks).
Melitaheidae merupakan scleraxonia yang aksisnya tergabung (Grasshoff, 1999;
Grasshoff, 2000; Fabricius and Alderslade, 2001; Sánchez et al., 2003; McFadden et al., 2006). Hasil identifikasi menempatkan Annella sp.1-4 sebagai anggota Subergorgiidae. Adapun Melithaeidae terdiri atas Wrightella sp. dan Melithae sp.1-2.
Ordo Holaxonia terdiri atas dua familia, Plexauridae dan Achanthogorgiidae.
Plexauridae ditandai adanya Paraplexaura sp. Adapun Achanthogorgiidae ditandai adanya Anthogorgia sp. (Grasshoff, 1999; Grasshoff, 2000; Fabricius and Alderslade, 2001; Sánchez et al., 2003; McFadden et al., 2006). Ordo Calcaxonia terdiri atas familia Ellisellidae, yang ditandai dengan adanya Verucella sp. dan Viminella sp. (Grasshoff, 1999; Grasshoff, 2000; Fabricius and Alderslade, 2001; Sánchez et al., 2003). Pemberian nama spesies pada penelitian ini belum terlalu spesifik karena terkendala ketersediaan
halotipe, proses pemberian nama spesies yang sangat rumit dan spesimen yang terbatas.
Hasil identifikasi memperlihatkan hal yang menarik. Pada familia Subergorgiidae
medulla, kortek dan polip. Namun terdapat perbedaan antara keempat Annella tersebut.
Annella sp.1, Annella sp.2 dan Annella sp.4 mempunyai perbedaan pada bentuk sklerit bagian korteks. Annella sp.1 mempunyai bentuk sklerit spindle. Annella sp.2 mempunyai bentuk sklerit ballons clubs dan cylindris. Annella sp.4 mempunyai sklerit berbentuk
double disk yang memiliki ulir halus dan kasar. Perbedaan ini yang mendasari pembagian
Annella kedalam 4 jenis yang berbeda. Hasil ini menarik karena keempat jenis Annella
tersebut ditemukan dalam satu tempat yaitu perairan Raja Ampat Papua. Hal ini
memberikan informasi adanya keragaman dalam satu komunitas yang ada.
Adapun Melithaea dibedakan dibedakan dalam Melithaea sp.1 dan Melithaea
sp.2. Penentuan jenis tersebut didasarkan pada perbedaan yang terdapat pada korteks.
Melithaea sp.1 mempunyai korteks yang berbentuk ballon clubs, sedangkan Melithaea
sp.2 mempunyai korteks yang berbentuk double disk. Adapun anggota satu familia dengan Melithaea yaitu Wrightella sp. dibedakan dengan Melithaea karena memiliki kaliks yang berbentuk Unilateraly foliate spheroid.
Jenis yang lain seperti Viminella sp., Verrucella sp., Anthogorgia sp. dan
Paraplexaura sp. dengan mudah dibedakan dari jenis lain karena mempunyai ciri-ciri yang nyata berbeda. Hasil identifikasi ini memperlihatkan bahwa dalam genus yang sama
mempunyai banyak persamaan dalam bentuk sklerit. Hal ini menunjukkan bahwa
karakter sklerit merupakan kunci dalam melakukan identifikasi.
Hasil identifikasi memberikan wawasan tentang aspek biologi dari gorgonian.
Gorgonian merupakan anggota karang yang sangat indah, namun belum banyak yang
spesifik perbedaan antar spesies yang ada dapat ditunjang dengan data-data kimiawi dan
molekuler. Pendalaman tentang aspek biologis gorgonian ini, merupakan peletak dasar
dalam mempelajari aspek yang lainya.
C. Ekstraksi
Kegiatan ekstraksi yang dilakukan memperoleh hasil berupa ekstrak metanol dan
etil asetat dari karang gorgonian. Kuantitas sampel dan ekstrak yang diperoleh terdapat
dalam lampiran 1. Karakteristik fisik dari ekstrak cair disampaikan dalam Tabel 2
berikut ini:
Tabel 2. Hasil maserasi dengan metanol dan etil asetat
No. Nama Spesies Warna ekstrak
metanol
Warna ekstrak etil asetat 1. Annella sp1. Jingga tua Jingga tua
2. Annella sp2. Jingga tua Jingga tua
3. Annella sp3. Hijau lumut Hijau kekuningan
4. Annella sp4. Jingga Jingga
5. Verucella sp. Kehijauan Kehijauan
6. Anthogorgia sp. Jingga Jingga
7. Viminella sp. Kekuningan Kekuningan
8. Wrightella sp. Hijau kecoklatan Hijau lumut
9. Paraplexaura sp. Keemasan Kekuningan
10. Melithea sp1. Kuning Kekuningan
11. Melithea sp2. Kuning Kekuningan
Ekstraksi merupakan metode untuk memperoleh suatu senyawa dari organisme
dengan pelarut tertentu (Markham, 1988). Ekstrasi merupakan metode pemisahan
campuran senyawa organik sehingga diperoleh komponen kimia tertentu. Maserasi
merupakan salah satu metode ekstraksi klasik. Maserasi merupakan pelarutan zat terlarut
dalam suatu massa dengan pelarut disertai pengadukan (Rydberg et al., 2004; Waksmundzka-Hajnos et al., 2008; Meireles, 2009).
yang ingin diperoleh, waktu, volume pelarut, pelarut yang terbuang dari ekstrak, daur
ulang pelarut dan biaya (Meireles, 2009). Keuntungan proses ekstraksi dengan cara
maserasi sebagai berikut; 1) baik untuk analisis kualitatif, 2) prosesnya cepat, dan 3)
efektik untuk jumlah sampel yang kecil (Waksmundzka-Hajnos et al., 2008).
Kegiatan ekstraksi terhadap gorgonian digunakan metode maserasi. Pemilihan
metode mempertimbangkan efektifitas kegiatan dan jumlah sampel yang ada. Metode ini
sesuai untuk analisis kualitatif dengan jumlah sampel yang sedikit seperti yang terungkap
dalam Waksmundzka-Hajnos et al. (2008) dan Meireles (2009). Pelarut yang digunakan berupa metanol dan etil asetat. Pemilihan pelarut didasarkan pada sifat selektifitas.
Metanol merupakan pelarut polar dan etil asetat merupakan pelarut semi-polar. Hasil
ekstraksi diharapkan memperoleh senyawa bersifat polar dan semi-polar (Adnan, 1997;
Rydberg et al., 2004). Oleh karena itu sesuai dengan tujuan penelitian diharapkan diperoleh senyawa golongan terpenoid, alkaloid dan flavonoid.
Lama waktu ekstraksi selama 24 jam. Bahan yang akan diekstrak terlebih dahulu
diserbukan. Menurut Sembiring dkk (2006) disampaikan bahwa lama waktu ekstraksi dan kehalusan bahan berpengaruh terhadap hasil rendemen yang dihasilkan. Semakin lama
waktu ekstraksi semakin tinggi rendemen yang dihasilkan. Kehalusan bahan berpengaruh
terhadap rendemen yang diperoleh. Hal ini dimungkinkan karena luas permukaan bahan
yang semakin luas sehingga memperbesar kontak antara bahan dengan pelarut yang
digunakan. Pembuatan sampel dalam bentuk serbuk karena sampel merupakan hewan
yang strukturnya keras. Pembuatan serbuk memberikan kemudahan proses ekstraksi.
Bentuk serbuk meningkatkan interaksi antara pelarut dengan bahan sehingga ekstraksi
Hasil maserasi diperoleh rendemen yang berupa cairan dengan ciri-ciri fisik
berupa warna yang terdapat pada Tabel 2. Rendemen yang berupa cairan difiltrasi dengan
kertas whatman guna memisahkan padatan dengan cairan. Filtrat dievaporasi dengan
metode rotary evaporator. Metode ini memiliki beberapa keuntungan yaitu 1) suhu dapat diatur dan dikendalikan, 2) senyawa tidak mengalami kerusakan, 3) proses evaporasi
relatif lebih cepat dan 4) pelarut yang menguap dapat ditampung dan dimurnikan
kembali. (Tringali, 2001; Iwamaru et al., 2007). Tujuan evaporasi adalah menguapkan pelarut yang digunakan. Suhu dan kondisi vakum sangat berpengaruh pada kecepatan
proses evaporasi dengan metode rotary evaporator. Hasil kegiatan evaporasi berupa ekstrak kering yang siap digunakan untuk pengujian dan analisis pada tahap berikutnya.
Besarnya jumlah ekstrak kering yang diperoleh tercantum dalam Lampiran 1.
D. Pengujian Antibakteri Ekstrak Gorgonian
Pengujian awal ekstrak yang diperoleh terhadap bakteri uji memperlihatkan yang
baik. Sembilan sampel terindikasi mampu berperan sebagai antibakteri dengan
menunjukkan adanya zona bening. Hasil kegiatan pengujian awal ekstrak terhadap
bakteri disampaikan dalam Tabel 3, Tabel 4, Tabel 5 dan Tabel 6 berikut ini:
9. Paraplexaura sp. - 9 - 10 -
10. Melithea sp1. - - - - -
11. Melithea sp2. - - - - -
12. Methanol - - - - -
13. Chlorampenicol 23 33 28 32 22
Tabel 4. Hasil uji Antibakteri ekstrak metanol dengan konsentrasi ekstrak 20mg/ml (Hasil pengamatan 18 jam)
Tabel 5. Hasil uji Antibakteri ekstrak etill asetat derngan konsentrasi ekstrak 20mg/ml (Hasil pengamatan 15 jam)