BAB II
TINJAUAN PUSTAKA
2.1 Minyak
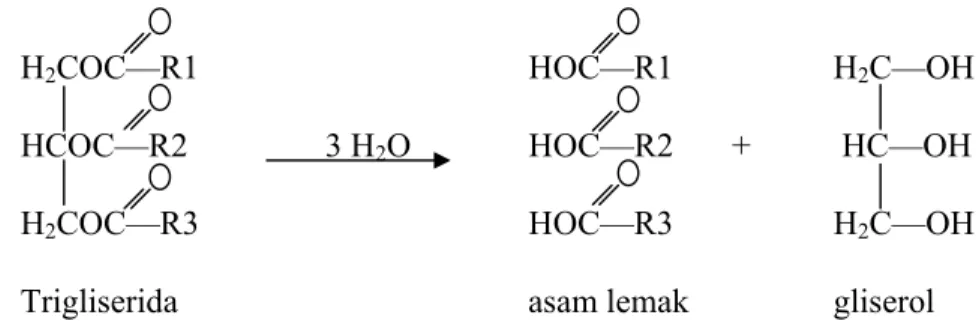
Minyak atau lemak adalah senyawa yang tertentuk dari trigliserida sebagai komponen pembentuk utama. Trigliserida adalah triester yang terbentuk dari satu molekul gliserol dan tiga molekul asam lemak, sehingga disebut juga triasilgliserol (TAG) (Silalahi dan Tampubolon, 2002; Mc. Murry, 2008). Reaksi pembentukan TAG dapat dilihat pada Gambar 2.1.
H2COH HOC—R1 H2C—OC—R1
HCOH + HOC—R2 Æ HC—OC—R2 + 3H2O
H2COH HOC—R3 H2C—OC—R3
Gliserol Asam Lemak Trigliserida Gambar 2.1 Reaksi pembentukan trigliserida
(Sumber: Mc. Murry, 2008)
Gliserol adalah senyawa yang memiliki tiga gugus hidroksil, atau –OH, yang dapat bergabung dengan sampai tiga asam lemak sehingga membentuk TAG.Setiap TAG dapat mengandung suatu campuran dari tiga asam lemak yang sama (simple triglyceride) atau berbeda (complex triglyceride). Asam lemak yang sama atau yang berbeda dapat bergabung dengan ketiga gugus hidroksil sehingga menghasilkan berbagai senyawa trigliserida (Silalahi, 2000).
Distribusi atau posisi asam lemak dalam molekul lemak dapat dibedakan berdasarkan stereospecific numbering system (sn) menjadi sn-1, sn-2, sn-3.
O
Nomenklatur molekul TAG diberikan berdasarkan posisi residu asam lemak (asil) yang membentuk TAG. Contohnya dapat dilihat pada Gambar 2.2 berikut ini.
(α ) miristat atau posisi sn-1 (β ) palmitat atau posisi sn-2 (α’) miristat atau posisi sn-3
1,3-dimiristoil, 2-palmitoil gliserol Gambar 2.2 Struktur kimia lemak (triasilgliserol)
(Sumber: Boyer, 1986; Silalahi dan Tampubolon, 2002)
Keterangan: R – C – disebut dengan gugus asil, yang mengikat molekul gliserol dengan 3 asam lemak. Contoh: miristat, palmitat, miristat maka struktur kimia tersebut dinamakan 1,3-dimiristoil, 2-palmitoil gliserol.
sn : stereospesific numbering
Trigliserida bersifat hidrofobik, tidak larut dan tidak tersatukan dengan air, memiliki berat jenis lebih rendah dibandingkan air. Pada suhu kamar normal dapat berada dalam bentuk padat atau cair. Apabila padat disebut lemak, sedangkan apabila cair disebut minyak. Biasanya lemak nabati adalah lemak tak jenuh dan cair pada suhu kamar sehingga disebut minyak kecuali minyak kelapa dan minyak inti sawit karena banyak mengandung asam lemak jenuh rantai sedang (Darmoyuwono, 2006)
Trigliserida yang terbentuk dari asam lemak rantai pendek disebut Short Chain Triglyceride, yang terbentuk dari asam lemak rantai sedang disebut Medium Chain Triglyceride, sedangkan yang terbentuk dari asam lemak rantai panjang disebut Long Chain Triglyceride (McKee dan McKee, 2003). Senyawa
C C C O O O H H H H H C C C (CH2)12 (CH2)14 (CH2)12 O O O CH3 CH3 CH3 α β α’
yang memiliki dua gugus asam lemak dan satu gugus hidroksil disebut sebagai digliserida, sedangkan senyawa yang memiliki satu gugus asam lemak dan dua gugus hiroksil disebut sebagai monogliserida. Monogliserida, digliserida dan trigliserida digolongkan sebagai senyawa ester yaitu senyawa yang terbentuk dari reaksi antara asam dan alkohol yang melepaskan air (H2O) (Silalahi dan Tampubolon, 2002).
Asam lemak digolongkan menjadi tiga yaitu berdasarkan panjang rantai asam lemak, tingkat kejenuhan, dan bentuk isomer geometrisnya (Silalahi, 2000). Berdasarkan panjang rantai asam lemak dibagi atas; asam lemak rantai pendek (short chain fatty acids, SCFA) mempunyai atom karbon lebih rendah dari 8, asam lemak rantai sedang mempunyai atom karbon 8 sampai 12 (medium chain fatty acids, MCFA) dan asam lemak rantai panjang mempunyai atom karbon 14 atau lebih (long chain fatty acids, LCFA). Semakin panjang rantai C yang dimiliki asam lemak, maka titik lelehnya akan semakin tinggi (Silalahi, 2000; Silalahi dan Tampubolon, 2002).
Berdasarkan tingkat kejenuhan asam lemak dibagi atas; asam lemak jenuh (SFA) karena tidak mempunyai ikatan rangkap, asam lemak tak jenuh tunggal (MUFA) hanya memiliki satu ikatan rangkap dan asam lemak tak jenuh jamak (PUFA) memiliki lebih dari satu ikatan rangkap.Semakin banyak ikatan rangkap yang dimiliki asam lemak, semakin rendah titik lelehnya (Silalahi, 2000; Silalahi dan Tampubolon, 2002).
Berdasarkan bentuk isomer geometrisnya asam lemak dibagi atas asam lemak tak jenuh bentuk cis dan trans. Pada isomer geometris, bagian rantai karbon akan saling mendekat atau saling menjauh. Jika saling mendekat disebut isomer
cis (berarti berdampingan), dan apabila saling menjauh disebut trans (berarti berseberangan). Asam lemak alami biasanya dalam bentuk cis. Isomer trans biasanya terbentuk selama reaksi kimia seperti hidrogenasi atau oksidasi. Titik leleh dari asam lemak tak jenuh bentuk trans lebih tinggi dibanding asam lemak tak jenuh bentuk cis karena orientasi antar molekul dengan bentuk cis yang membengkok tidak sempurna sedangkan asam lemak tak jenuh trans lurus sama seperti bentuk asam lemak jenuh (Silalahi, 2000; Silalahi dan Tampubolon, 2002).
Asam lemak trans berdampak buruk bagi kesehatan. Apabila mengkonsumsi asam lemak trans, maka asam lemak ini akan masuk kedalam sel-sel tubuh, yang mengakibatkan membran sel-sel dan struktur sel-seluler lainnya menjadi rusak bentuknya dan tidak dapat berfungsi dengan mestinya. Asam lemak trans juga meningkatkan LDL (low density lipoprotein) dan menurunkan HDL (high density lipoprotein). LDL merupakan lemak yang meningkatkan resiko penyakit jantung koroner dan stroke karena mudah menempel dan menyebabkan penyumbatan pada dinding pembuluh darah sedangkan HDL berfungsi untuk membersihkan kelebihan kolesterol dari dinding pembuluh darah (Silalahi dan Tampubolon, 2002; Darmoyuwono, 2006).
2.2 Hidrolisis Minyak
Hidrolisis dari minyak atau trigliserida akan menghasilkan asam lemak bebas dan gliserol. Reaksi hidrolisis dapat terjadi dengan bantuan enzim lipase atau dengan mereaksikannya secara kimia dengan KOH atau NaOH. Reaksi hidrolisis yang dilakukan dengan penggunaan zat kimia maka akan menghasilkan produk lemak dengan distribusi asam lemak yang acak yaitu akan menghidrolisis pada semua posisi sn dalam produk lemak. (lebih dikenal dengan proses
penyabunan). Proses penyabunan ini banyak digunakan dalam industri untuk menghasilkan gliserol. Reaksi hidrolisis dengan menggunakan enzim lipase lebih efisien dan mudah dikontrol karena dan enzim lipase spesifik pada posisi tertentu sehingga dapat mengubah produk lemak dan distribusi asam lemak sesuai dengan yang diinginkan (Aehle, 2004). Adapun persamaan reaksi untuk hidrolisis trigliserida dapat dilihat pada Gambar 2.3.
H2COC—R1 HOC—R1 H2C—OH
HCOC—R2 3 H2O HOC—R2 + HC—OH
H2COC—R3 HOC—R3 H2C—OH
Trigliserida asam lemak gliserol
Gambar 2.3 Reaksi hidrolisis trigliserida (Sumber: Boyer, 1986)
Prinsip proses hidrolisis enzimatik bertujuan untuk menghasilkan produk monogliserida, digliserida atau gliserol dan asam lemak bebas dari posisi sn yang diinginkan dengan penambahan enzim lipase dengan spesifikasi tertentu pada minyak dan lemak dengan adanya air (Aehle, 2004). Proses penyabunan akan menghidrolisis trigliserida pada semua posisi sn secara acak. Sedangkan hidrolisis trigliserida secara enzimatik lebih spesifik pada posisi sn tertentu sesuai dengan jenis enzimnya. Berdasarkan reaksi hidrolisis pada Gambar 2.3, hidrolisis triasilgliserol secara enzimatik dengan enzim lipase yang spesifik pada posisi sn-1,3 adalah dengan menghidrolisis triasilgliserol pada posisi sn-sn-1,3 sehingga akan menghasilkan produk 2-MAG dan asam lemak bebas dari asam lemak pada posisi sn-1,3. Berbagai macam enzim lipase yang bekerja berdasarkan spesifikasinya, dapat dilihat pada Tabel 2.1.
Tabel 2.1 Klasifikasi enzim lipase berdasarkan spesifikasinya Klasifikasi
enzim lipase Spesifikasi Sumber Lipase Komersil
Spesifik pada substrat
Monoasilgliserol Jaringan lemak pada tikus Mono- dan
Diasilgliserol Penicillium camembertii Triasilgliserol Penicillium sp.
Regiospesifik Posisi sn-1,3
Pankreas babi Mucor miehei
Aspergillus niger Lipase AP6® Thermomyces lanuginose Lipozym TL IM® Rhizomucor meihei Palatase M® Posisi sn-2 Candida antartica A Novozym 435® Nonspesifik - Penicillium expansum Aspergillus sp. Pseudomonas cepacia Asilspesifik pada lemak
Asam lemak rantai pendek
Penicillium roqueforti Lambung bayi Getah Carica papaya asam lemak jenuh
cis-9 Geotrichum candidum Asam lemak jenuh
rantai panjang Botrystis cinerea
Stereospesifik
Posisi sn-1 Humicola lanugunose Pseudomonas aeruginose Posisi sn-3 Fusarium solani cutinase
Lambung kelinci Sumber : Aehle (2004); Villeneuve dan Foglia (1997)
Ada beberapa metode yang dapat digunakan untuk menghidrolisis trigliserida secara enzimatik. Sejumlah tertentu trigliserida ditambahkan dengan air dan larutan kalium klorida, lalu direaksikan dengan Lipozym TM IL dengan bantuan buffer TrisHCl. Kemudian campuran dikocok diatas mesin pengocok pada suhu 55oC, 200 rpm, selama 12 jam. Produk hidrolisis dipisahkan dari air menggunakan corong pemisah, selanjutnya ditambahkan larutan basa dalam etanol 50% untuk menetralkan asam lemak bebas yang terjadi. Hidrolisat yang telah dibebaskan asam lemak dan monogliseridnya dilewatkan pada saringan yang
berisi Na2SO4 anhidrous untuk menghilangkan sisa air yang tertinggal (Satiawiharja, 2001).
Metode lainnya yaitu dengan melarutkan sejumlah tertentu trigliserida dalam heksan, kemudian ditambahkan larutan kalium klorida dan enzim lipase yang dilarutkan dalam larutan 1 M buffer Tris pH 8.0. Campuran dikocok kuat selama 5 detik, kemudian ditempatkan dengan suhu 37oC, sambil dikocok setiap beberapa menit. Campuran ini diinkubasi selama kurang lebih 2 jam. Hasil reaksi kemudian dinetralkan dengan penambahan asam dalam methanol. Titik akhir dapat diamati dengan kromatografi lapis tipis berupa hilangnya noda trigliserida pada pelat atau dengan melihat terjadinya kekeruhan akibat pengendapan garam kalsium dari asam lemak yang dilepaskan. Hidrolisat dipisahkan dengan cara ekstraksi menggunakan larutan non polar, misalnya n-heksan, untuk menarik asam lemak bebas dan monogliseridanya. Pada lapisan heksan terdapat asam lemak dan monogliserid. Keringkan dengan penambahan MgSO4 anhidrat selama penyaringan, heksan diuapkan dengan penangas air. Setelah terpisah asam lemak bebas yang berasal dari posisi sn-1,3 dapat ditentukan dengan alat kromatografi gas (Boyer, 1986).
Penentuan asam lemak pada posisi 2-gliserida dilakukan dengan mengisolasi 2-gliserida dengan mengekstraksi 3 kali dengan etil eter. Lapisan eter dikeringkan dengan MgSO4 dan dipekatkan melalui penangas air. Kemudian ditambahkan NaOH dalam metanol untuk melepaskan asam lemak yang berasal dari monogliseridnya. Komposisi asam lemak yang berasal dari 2-trigliserida dapat dianalisis dengan alat kromatografi gas (Boyer, 1986; Satiawihardja, 2001; Silalahi dan Tampubolon, 2002).
Banyaknya asam lemak bebas yang dihasilkan dari proses hidrolisis dapat ditentukan dengan menghitung bilangan asam. Prinsip kerja penentuan asam lemak bebas adalah pelarutan contoh minyak/lemak dalam pelarut organik tertentu (alkohol 96% netral) dilanjutkan dengan titrasi menggunakan basa NaOH atau KOH. Bilangan asam termasuk ke dalam persyaratan SNI untuk menentukan kualitas minyak. Bilangan asam dinyatakan sebagai jumlah miligram KOH yang digunakan untuk menetralkan asam lemak bebas yang terdapat dalam 1 gram minyak atau lemak, dihitung dengan rumus sebagai berikut:
Bilangan Asam (acid value) =
Keterangan:
A = jumlah ml KOH untuk titrasi N = normalitas larutan KOH G = bobot minyak (gram) BM KOH = 56,1
2.3 Virgin Coconut Oil dan Palm Kernel Oil
Minyak kelapa murni (Virgin Coconut Oil, VCO) merupakan produk yang diperoleh dari pengolahan daging buah kepala (Cocos nucifera) yang tua dan segar. Proses pembuatan VCO dapat dilakukan melalui beberapa cara, yaitu: (i) metode kering, dibedakan lagi menjadi tiga, wet milling route, desiccated route, dan grated coconut route, (ii) metode tekanan rendah, (iii) metode tradisional, yaitu ekstraksi langsung dari santan kelapa, (iv) metode fermentasi, dan (v) metode sentrifugasi (Bawalan dan Chapman, 2006).
VCO yang dibuat dari kelapa segar berwarna putih murni ketika minyaknya dipadatkan dan jernih seperti air ketika dicairkan. Sifat-sifat kimia dan fisika dari VCO antara lain tidak berwarna, kristal seperti jarum, sedikit berbau
asam ditambah aroma karamel. Tidak larut dalam air, tetapi larut dalam alkohol (1:1). Berat jenis 0,8883 pada suhu 20oC, titik cair 20-25oC dan tiitik didihnya 225oC. Kandungan trigliserida yaitu LaLaLa, LaLaM, CLaLa, LaMM, dan CCLa (La, laurat; C, kaprat; M, miristat). Bilangan penyabunan berkisar antara 250,07-260,67 mgKOH/g minyak, bilangan peroksida 0,21-0,57 mequiv oksigen/kg, sedangkan bilangan iod 4,47-8,55. Kandungan asam lemak bebas yaitu berkisar antara 0,15-0,25% (Darmoyuwono, 2006; Marina, et al., 2009).
Minyak inti sawit (Palm Kernel Oil, PKO) diperoleh dari pengolahan biji atau inti (kernel) dari buah pohon kelapa sawit (Elaies guineensis). VCO dan PKO mengandung asam lemak rantai sedang (medium chain fatty acid, MCFA) terutama asam laurat. Kandungan MCFA dan kadar asam laurat dipengaruhi oleh varietas kelapa, tinggi tempat tumbuh, dan teknologi proses pembuatannya (Banigo dan Ogunlesi, 1977).
PKO diperoleh melalui 3 cara, yaitu melalui cara tradisional dengan pemanasan langsung terhadap inti sawit, melalui cara ekstraksi secara mekanik terhadap biji sawit dan melalui cara ekstraksi menggunakan pelarut (Mrema, 2005). Biji sawit terdapat dalam buah sawit terbungkus dengan rangka yang keras sehingga mudah dipisahkan dari daging buah. Proses produksi yang tidak menggunakan pemanasan yang tinggi akan menghasilkan MCFA yang tinggi dan dapat mempertahankan keberadaan vitamin E dan enzim-enzim yang terkandung dalan daging buah kelapa (Syah, 2005).
Sifat fisika PKO antara lain; bobot jenis PKO 0,900-0,913, indeks bias pada 40oC 1,495-1,415, bilangan iod 14-20, bilangan penyabunan 244-254. PKO memiliki komposisi asam lemak yang hampir sama dengan VCO. Asam lemak
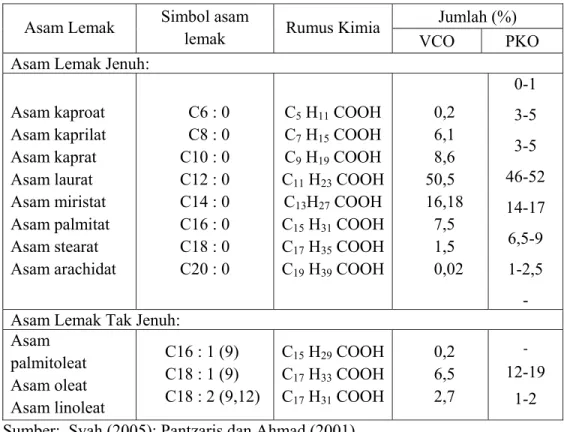
utama dalam minyak inti sawit adalah asam laurat (C12, 48%), asam miristat (C14, 16%) dan asam oleat (C18, 15%) (Pantzaris dan Ahmad, 2001). Rumus kimia dan komposisi asam lemak yang terdapat dalam VCO dan PKO dapat dilihat pada Tabel 2.2.
Tabel 2.2 Komposisi asam lemak minyak kelapa murni (VCO) dan minyak inti sawit (PKO)
Asam Lemak Simbol asam
lemak Rumus Kimia
Jumlah (%)
VCO PKO Asam Lemak Jenuh:
Asam kaproat Asam kaprilat Asam kaprat Asam laurat Asam miristat Asam palmitat Asam stearat Asam arachidat C6 : 0 C8 : 0 C10 : 0 C12 : 0 C14 : 0 C16 : 0 C18 : 0 C20 : 0 C5 H11 COOH C7 H15 COOH C9 H19 COOH C11 H23 COOH C13H27 COOH C15 H31 COOH C17 H35 COOH C19 H39 COOH 0,2 6,1 8,6 50,5 16,18 7,5 1,5 0,02 0-1 3-5 3-5 46-52 14-17 6,5-9 1-2,5 - Asam Lemak Tak Jenuh:
Asam palmitoleat Asam oleat Asam linoleat C16 : 1 (9) C18 : 1 (9) C18 : 2 (9,12) C15 H29 COOH C17 H33 COOH C17 H31 COOH 0,2 6,5 2,7 ‐ 12-19 1-2 Sumber: Syah (2005); Pantzaris dan Ahmad (2001)
Dari table tersebut dapat dilihat bahwa hampir seluruh komposisi asam lemak VCO dan PKO adalah sama, dengan komposisi asam lemak yang utama yaitu asam laurat. Hanya terdapat 2 jenis asam lemak yang tidak terdapat dalam PKO, yaitu asam arachidat dari asam lemak jenuh, dan asam palmitoleat dari asam lemak tak jenuh.Kedua asam lemak yang terdapat dalam VCO tapi tidak terdapat dalam PKO adalah asam lemak rantai panjang.
Metabolisme lemak atau trigliserida ditentukan oleh komposisi dan distribusi asam lemak pembentuknya. Semakin pendek rantai asam lemak, semakin meningkat kelarutannya sehingga lebih mudah diserap dalam saluran pencernaan. Hidrolisis yang terjadi tergantung pada posisi dan panjang rantai spesifik lemak (Syah, 2005). Sehingga SCFA cenderung lebih mudah dicerna dan dimetabolisme menjadi energi. Selain itu SCFA tertentu dapat melindungi usus dan mengurangi faktor resiko gangguan pencernaan, kanker dan penyakit kardiovaskular (Hijova dan Chmelarova, 2007; Comalada et al., 2006) serta sebagai pengatur sistem imunitas (Meijer et al., 2010) dan pengatur berbagai fungsi pencernaan (Vinolo et al., 2011).
Sebagian besar asam lemak yang ditemukan dalam makanan terdiri dari asam lemak rantai panjang, yang merupakan molekul yang mengandung 12 atau lebih atom karbon. Sebaliknya, asam lemak rantai menengah yang terdiri dari 8-12 atom karbon, paling banyak ditemukan dalam minyak kelapa murni dan minyak inti sawit diantara berbagai jenis makanan lain. MCFA diserap langsung ke dalam vena portal, diangkut dengan cepat ke hati untuk beta-oksidasi, dan dengan demikian meningkatkan diet-induced thermogenesis. MCFA memberikan efek pengurangan pada akumulasi lemak ditubuh manusia (Hiroyuki et al., 2008). Kekuatan antibakteri MCFA dimanfaatkan secara alami oleh tubuh kita sendiri yaitu ditemukan dalam air susu ibu untuk melindungi dan memberi nutrisi pada bayinya (Enig, 1996). Sebaliknya, LCFA diserap melalui saluran limfatik dan diangkut oleh kilomikron ke dalam sirkulasi sistemik. Sehingga LCFA diserap dan dimetabolisme lebih lambat dibandingkan MCFA dan SCFA (Syah, 2005).
Asam lemak rantai sedang (Medium Chain Fatty Acid - MCFA) yang merupakan kandungan asam lemak utama dari VCO dapat langsung dikonversi menjadi energi dalam hati, yang juga meningkatkan laju metabolisme yang menghasilkan konversi yang lebih baik dari makanan menjadi energi dan termogenesis yang merangsang pemecahan lemak yang tersimpan menjadi energi, yang berujung pada penurunan berat badan (Syah, 2005).
Komposisi VCO dan PKO terdiri dari asam lemak rantai pendek (C:4 s/d C:8) dan asam lemak rantai sedang yang jenuh (C:10 dan C:12), sehingga disebut Medium Chain Triglycerides (MCT), karena sebagian besar komposisinya adalah asam laurat (C:12). Sedangkan minyak yang komposisi utamanya asam lemak rantai panjang disebut Long Chain Triglyceride (LCT). Enzim yang berperan dalam metabolisme lemak adalah lipase.Enzim ini berasal dari mulut, lambung dan saluran pankreas. Dalam proses pencernaan di rongga mulut dan di lambung, VCO dan PKO akan diuraikan oleh enzim lipase menjadi asam lemak bebas rantai pendek, sedang dan 2-monoasilgliserida (2-MAG). Komposisi asam lemak terbesar dari VCO dan PKO adalah asam laurat maka hasil penguraiannya sebagian besar berupa asam laurat dan monolaurin (Silalahi dan Nurbaya, 2011; Willis, et al., 1998).
Lipase air liur cenderung menghidrolisis asam lemak rantai pendek dan sedang pada posisi sn-3. Lipase lambung lebih spesifik menghidrolisis asam lemak rantai sedang pada posisi sn-1,3. Hasil penguraian ini, asam lemak rantai pendek dan sedang, lebih mudah larut dalam media berair sehingga dengan cepat diserap lambung dan melalui vena porta segera sampai ke hati tempat asam dioksidasi sehingga menghasilkan energi dalam waktu singkat. Minyak yang
mengandung asam lemak rantai panjang (Long Chain Triglyceride, LCT) atau lemak pada umumnya mengalami proses yang lebih rumit (Silalahi dan Nurbaya, 2011; Willis, et al., 1998).
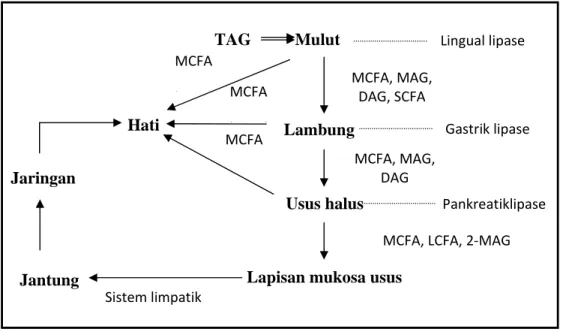
LCT tidak diuraikan di dalam lambung, tetapi akan diproses sesudah sampai di usus halus seperti terlihat pada Gambar 2.4. Lipase pankreatik akan bercampur dengan asam empedu dalam saluran empedu kemudian sampai di usus halus dan bertemu dengan LCT. LCT bersifat hidrofobik sehingga memerlukan media yang akan membawanya dalam saluran pencernaan, yaitu melalui emulsifikasi dengan asam empedu membentuk misel (Syah, 2005).
Gambar 2.4 Metabolisme dan transportasi triasilgliserol pada manusia (Sumber: Willis, et al., 1998)
Keterangan: TAG: Triasilgliserol; DAG: Diasilgliserol; MAG: Monoasilgliserol; MCFA: Medium chain fatty acid (asam lemak rantai sedang); LCFA: Long chain fatty acid (asam lemak rantai panjang); FFA: Free fatty acid (asam lemak bebas)
Lipase pankreatik lebih spesifik menghidrolisis asam lemak pada posisi Lingual lipase Gastrik lipase MCFA, LCFA, 2‐MAG Pankreatiklipase MCFA, MAG, DAG, SCFA Hati Jantung MCFA ( ) Lambung TAG Usus halus Jaringan
Lapisan mukosa usus MCFA Sistem limpatik Mulut MCFA, MAG, DAG MCFA ( )
menghidrolisis asam lemak rantai panjang. Sesudah hidrolisis, asam lemak dan 2-MAG membentuk misel dan diabsorbsi lapisan mukosa usus. Pada dinding sel usus dibentuk kembali menjadi TAG dan selanjutnya diangkut dalam bentuk kilomikron ke aliran darah (Silalahi, 2011; Willis, et al., 1998).
VCO dan PKO merupakan lemak jenuh, bahkan termasuk minyak yang paling jenuh, tetapi terdiri dari asam lemak jenuh rantai sedang lebih dari 80%; asam lemak rantai pendek sekitar 10%, dan hanya sedikit asam lemak jenuh rantai panjang seperti asam palmitat (7,5%). Namun VCO dan PKO sebagai MCT, mudah dihidrolisis oleh lingual lipase di dalam mulut dan oleh gastrik lipase di lambung menjadi asam lemak bebas rantai pendek dan sedang, tidak bersifat aterogenik, karena dengan cepat dicerna dan diserap melalui vena porta ke hati kemudian segera dioksidasi menjadi energi (Silalahi dan Nurbaya, 2011).
2.5 Aktivitas Antibakteri VCO dan PKO
VCO bersifat antimikroba dari kandungan asam lauratnya (C-12, 48-52%) dan MCFA lain yang membunuh bakteri patogen, jamur, virus, protozoa dan parasit. VCO juga mengandung antioksidan dalam bentuk vitamin E (Lieberman et al., 2006). VCO mengandung tiga jenis MCFA, yaitu asam laurat (C-12, 48-53%), asam kaprat (C-10, 7%), dan asam kaprilat (C-8, 8%). Di dalam tubuh, diubah menjadi monogliserida, yaitu monolaurin, monocaprin, dan monocaprilin yang mampu membunuh mikroorganisme patogen termasuk bakteri, jamur dan ragi, virus dan protozoa. Monogliserida ini juga memberikan kekebalan terhadap tubuh. Asam laurat berada dalam air susu ibu untuk memberikan kekebalan terhadap bayi selama enam bulan pertama kehidupan ketika imunitas belum dikembangkan (Enig, 1996).
Kebanyakan bakteri dan virus terbungkus dalam lapisan lipid (lemak). Asam lemak yang membentuk membran luar atau kulit bersama dengan DNA organisme dan bahan lainnya. Asam-asam lemak yang membentuk membran ini hampir berbentuk cairan sehingga memberikan tingkat mobilitas dan fleksibilitas membran. Pertumbuhan virus dan bakteri berlapis lipid mudah dihentikan oleh MCFA, yang terutama merusak organisme dengan cara mengganggu membran lipid mereka. Asam lemak rantai sedang, serupa dengan membran mikroorganisme, bahkan molekul MCFA jauh lebih kecil karena itu mampu melemahkan membran. Membran ini kemudian menjadi hancur dan terbuka, menumpahkan isi dan membunuh organisme. Kemudian sel darah putih dengan cepat membersihkan dan membuang puing-puing sel organisme yang rusak dan mati tersebut. MCFA membunuh organisme penyerang tanpa menimbulkan bahaya pada jaringan tubuh (Enig, 1996).
Tubuh manusia memiliki banyak cara untuk melindungi diri dari mikroorganisme yang membahayakan. Baris pertama pertahanan tubuh terhadap organisme berbahaya adalah lapisan kulit. Untuk dapat menginfeksi, mikroorganisme pertama harus menembus penghalang pelindung kulit. Kulit memiliki permiabilitas tertentu, juga dilengkapi dengan zat kimia untuk membantu mencegah masuknya mikroorganisme yang berbahaya. Salah satunya adalah minyak disekresikan oleh kelenjar sebaceous. Kelenjar sebaceous ditemukan dekat akar rambut. Minyak disekresikan di sepanjang batang rambut untuk melumasi rambut dan kulit. Minyak ini adalah sebagai krim kulit alami atau pelembab alami karena berfungsi untuk mencegah pengeringan kulit. Minyak yang mengandung asam lemak rantai sedang ini juga memiliki fungsi lain yang
sangat penting, yaitu untuk melawan serangan mikroorganisme. Lapisan tipis minyak di kulit membantu melindungi kita dari banyak kuman berbahaya yang terpapar pada kulit setiap hari. Karena itu pemakaian VCO sebagai pelembab kulit mampu meningkatkan kelembaban kulit sekaligus juga memberikan perlindungan terhadap mikrooganisme berbahaya (Enig, 1996).
VCO telah dibuktikan dapat menghambat pertumbuhan berbagai bakteri patogen diantaranya Listeria monocytogene, Staphylococcus sp maupun Helicobacter sp. Aktivitas antibakteri MCFA terbaik adalah dalam bentuk bebas dan monogliserida. Untuk memperoleh monogliserida dari trigliserida yang terkandung dalam VCO adalah dengan melakukan hidrolisis menggunakan enzim yang spesifik bekerja hanya untuk menghidrolisis secara parsial yaitu menghidrolisis trigliserida pada posisi sn-1 dan 3. Enzim yang spesifik bekerja pada posisi sn-1 dan 3 adalah enzim lipase yang berasal dari pankreas, Aspergillus niger dan Mucor meihei (Silalahi dan Tampubolon, 2002). Dari semua asam lemak jenuh, asam laurat memiliki aktivitas antimikroba lebih baik dibandingkan dengan asam kaprilat (C8:0), asam kaprat (C10:0), dan asam miristat (C14:0) (Kabara, et al., 1972; Enig, 1996).
PKO memiliki komposisi asam lemak yang serupa dengan VCO, yaitu sebagian besar terdiri dari asam lemak jenuh rantai pendek dan sedang. Komposisinya utamanya yaitu asam laurat dan monogliseridanya, monolaurin yang dikenal memiliki aktivitas antibakteri sehingga PKO dapat memberikan efek anti bakteri.Kemampuan antibakteri dari PKO telah diuji dan hasil penelitian menunjukan bahwa PKO memberikan hasil hambatan yang minimal terhadap Escherichia coli (Ekwenye dan Ijeomah, 2005). Penelitian lain juga menunjukkan
kemampuan penghambatan PKO terhadap S. aureus dan Streptococcus sp. (Ugbogu et al., 2006).
2.6 Aktivitas Antibakteri Asam Laurat dan Monolaurin
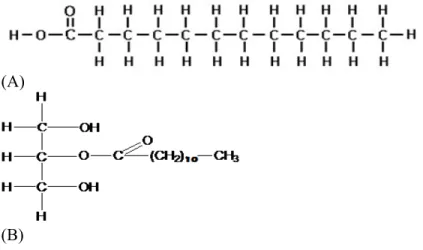
Asam laurat dan monolaurin menghasilkan efek membunuh atau menonaktifkan bakteri dengan cara melisiskan atau merusak lapisan membran plasma lipid. Aktivitas antibakteri terkait dengan monolaurin yang dapat melarutkan lipid dan fosfolipid sehingga menyebabkan disintegrasi membran bakteri. Monolaurin juga dapat mengganggu proses tranduksi sinyal bakteri dan gangguan proses perakitan virus dan pematangan virus (Lieberman, et al., 2006). Struktur kimia dari asam laurat dan monolaurin dapat dilihat pada Gambar 2.5.
(A)
(B)
Gambar 2.5 Rumus Struktur Asam Laurat (A) dan Monolaurin (B) (Sumber: Widiyarti dan Hanafi, 2008)
Bakteri penyebab penyakit pada umumnya memiliki dinding sel yang terbuat dari lipid. Membran sel bakteri gram negatif merupakan lipopolisakarida yang terdiri dari lipid, polisakarida dan protein, sedangkan untuk bakteri gram positif terdiri dari lapisan peptidoglikan yang lebih banyak dari bakteri gram negatif. Penelitian juga menunjukkan efek antivirus monolaurin yaitu dengan menyelimuti RNA dan DNA virus. Penelitian dilakukan dengan prototipe virus
yang dipilih atau diakui strain wakil dari virus manusia. Virus ini memiliki amplop atau selubung yang terbuat dari membran lipid, adanya membran lipid ini membuat mereka sangat rentan terhadap asam laurat monolaurin dan turunannya. Penelitian juga telah menunjukkan bahwa virus tidak aktif terhadap air susu ibu dan susu sapi oleh karena adanya asam lemak dan monogliserida (Enig, 2010).
Asam lemak dan turunannya yang bersifat antibakteri dan tidak berbahaya untuk manusia, misalnya asam laurat, bahkan diproduksi secara in vivo dalam tubuh ketika terdapat diet yang mengandung kadar MCFA yang memadai. Menurut penelitian, asam laurat adalah salah satu asam lemak yang terbaik, dan monogliseridanya bahkan lebih efektif dibandingkan dengan asam lemaknya (Kabara et al., 1972; Kabara, 1984).
Untuk dapat hidup maka membran lipid virus atau bakteri bergantung pada lipid inang (host) untuk membentuk konstituen lipid mereka. Keragaman asam lemak dalam makanan individu serta variabilitasnya menyebabkan variabilitas asam lemak dalam membran lipid virus/bakteri dan juga menjelaskan variabilitas ekspresi glikoprotein (Enig, 2006).
Monolaurin mampu menghambat pertumbuhan bakteri patogen baik yang berasal dari organisme gram positif dan beberapa gram negatif (Kabara, 1984). Monolaurin tidak memiliki efek buruk pada bakteri normal usus, melainkan hanya potensial terhadap mikroorganisme patogen, yaitu menghambat Hemophilus influenzae, Staphylococcus epidermidis dan Streptococcus grup B gram positif. Asam laurat dan monolaurin juga efektif terhadap bakteri gram positif seperti Staphylococcus aureus dan Lysteria monocytogene, dan bakteri gram negatif
seperti Pseudomonas aeruginosa dan Helycobacter pylori (Kabara, 1984). Mikroorganisme yang dihambat oleh asam laurat dapat dilihat pada Tabel 2.3.
Tabel 2.3 Mikroorganisme yang dihambat oleh asam laurat Mikroorganisme yang dihambat oleh asam laurat
Virus Bakteri Visna virus Cytomegalovirus Epstein-barr virus Influenza virus Leukemia virus Pneumono virus Hepatitis C virus Listeria monocytogenes Helicobacter pylori Hemophilus influenzae Staphylococcus aureus Streptococcus agalactiae
Groups A, B, F, & G streptococci Organisme gram-positif
Organisme gram-negatif Sumber: Kabara, 1984
Jamur dan protozoa juga dihambat pertumbuhannya oleh asam laurat dan monolaurin, yaitu dapat menghambat pertumbuhan Candida albicans dan Giardia lamblia. Penelitian juga dilakukan terhadap virus SARS (Sevire Acute Respiratory Syndrome), yang menunjukkan bahwa Filipina yang sebagian besar penduduknya mengkonsumsi minyak kelapa relatif tidak terpengaruh oleh wabah SARS seperti di negara-negara kawasan Asia lainnya. Hampir tidak ada bakteri atau organisme patogen yang resisten terhadap asam laurat dan monolaurin (Enig, 1996).
2.7 Penentuan Aktivitas Antibakteri VCO dan PKO
Aktivitas antibakteri ditunjukkan dengan adanya efek daya hambat terhadap pertumbuhan bakteri. Ada dua metode umum yang dapat digunakan menentukan aktivitas antibakteri yaitu penetapan dengan lempeng silinder atau lempeng difusi dan penetapan dengan cara tabung atau turbidimetri. Metode pertama berdasarkan difusi antibiotik atau zat antibakteri dari silinder yang dipasang tegak lurus pada lapisan agar padat dalam cawan petri, sehingga bakteri
yang ditambahkan dihambat pertumbuhannya pada daerah berupa lingkaran atau zona disekeliling silinder yang berisi larutan uji (zat antibiotik atau antibakteri). Metode kedua berdasarkan kekeruhan atau turbidimetri, yaitu dengan mengukur kekeruhan berdasarkan atas hambatan pertumbuhan biakan mikroba dalam larutan serba sama zat antibiotik atau antibakteri dalam media cair yang dapat menumbuhkan mikroba dengan cepat bila tidak terdapat antibiotik atau antibakteri (Ditjen POM, 1995).
Sulistiyaningsih, dkk., (2007), melakukan pengujian sifat antibakteri VCO terhadap Pseudomonas aeruginosa, Staphylococcus aureus dan Candida albicans menggunakan metode difusi agar cara perforasi, yaitu dengan membuat lubang pada media yang telah memadat, kemudian pada lubang tersebut diteteskan bahan uji. Pengujian menunjukkan bahwa VCO pada konsentrasi 55% (550000 ppm) aktivitasnya terhadap Staphylococcus aureus dan Pseudomonas aeruginosa masing-masing sebanding dengan 16,788 ppm dan 152,405 ppm baku tetrasiklin (Sulistiyaningsih et al., 2007).
Penggunaan pencadang gelas dilakukan oleh Ginting (2008), untuk pengujian VCO dan krim VCO. Sedangkan Ugbogu, et al., (2006), menggunakan pencadang kertas dengan diameter 5 mm untuk pengujian palm kernel oil. Berbeda dengan Nurliana (2009), dalam pengujian minyak pliek u (minyak kelapa terfermentasi) menggunakan pencadang kertas dengan diameter 13 mm. Menurut Ginting (2008), hasil pengujian aktivitas antibakteri VCO sangat besar yaitu pada konsentrasi 2% memberikan daya hambat 40,48 mm terhadap Staphylococcus aureus dan 35,63 mm terhadap Pseudomonas aeruginosa, dengan gliserin sebagai
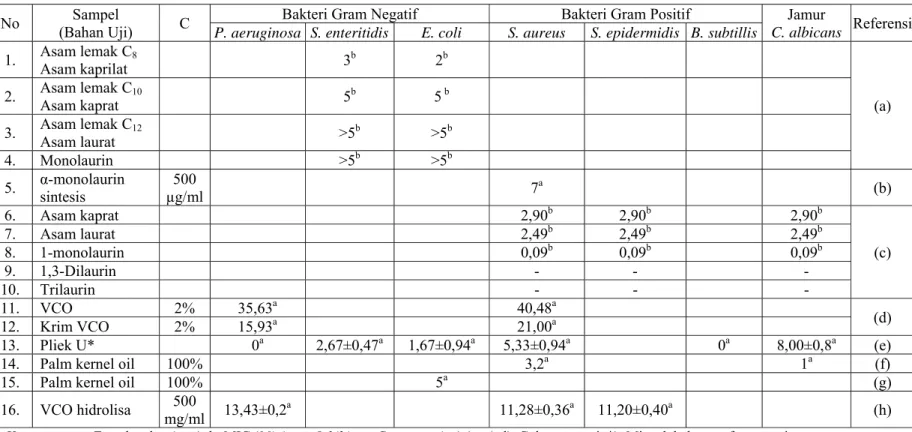
pelarut. Hasil penelitian mengenai sifat antimikrobial dari asam laurat, monolaurin, VCO dan PKO dapat dilihat pada Tabel 2.4
Tabel 2.4 Hasil penelitian mengenai sifat antimikrobial asam lemak, monolaurin, dilaurin, trilaurin, minyak kelapa murni dan minyak
inti sawit
No (Bahan Uji) Sampel C Bakteri Gram Negatif Bakteri Gram Positif Jamur
C. albicans Referensi P. aeruginosa S. enteritidis E. coli S. aureus S. epidermidis B. subtillis
1. Asam lemak C8 Asam kaprilat 3b 2b (a) 2. Asam lemak C10 Asam kaprat 5b 5 b 3. Asam lemak C12 Asam laurat >5b >5b 4. Monolaurin >5b >5b 5. α-monolaurin sintesis µg/ml 500 7a (b) 6. Asam kaprat 2,90b 2,90b 2,90b (c) 7. Asam laurat 2,49b 2,49b 2,49b 8. 1-monolaurin 0,09b 0,09b 0,09b 9. 1,3-Dilaurin - - - 10. Trilaurin - - - 11. VCO 2% 35,63a 40,48a (d) 12. Krim VCO 2% 15,93a 21,00a 13. Pliek U* 0a 2,67±0,47a 1,67±0,94a 5,33±0,94a 0a 8,00±0,8a (e)
14. Palm kernel oil 100% 3,2a 1a (f)
15. Palm kernel oil 100% 5a (g)
16. VCO hidrolisa mg/ml 500 13,43±0,2a 11,28±0,36a 11,20±0,40a (h)
Keterangan: a: Zona hambat (mm), b: MIC (Minimum Inhibitory Concentration) (mg/ml), C: konsentrasi, *): Minyak kelapa terfermentasi
(a): Skrivanova et al., 2006, (b): Widiyarti et al., 2009, (c): Kabara et al., 1972, (d): Ginting, 2008, (e): Nurliana et al., 2009, (f): Ugbogu et al., 2006, (g): Ekwenye dan Ijeomah, 2005, (h): Permata, 2012.
Skrivanova (2006), meneliti mengenai konsentrasi hambat minimum (Minimum Inhibitory Concentration, MIC) asam lemak C2-C18, hasilnya menunjukkan bahwa asam lemak rantai sedang C8- C12 (MIC < 5 mg/ml) lebih aktif sebagai antibakteri jika dibandingkan dengan asam lemak rantai pendek C2- C6 (MIC > 5 mg/ml) dan asam lemak rantai panjang C14- C18 (MIC > 5 mg/ml). Pengujian aktivitas antibakteri monolaurin hasil sintesis yang dilakukan oleh Widiyarti, dkk., (2009), menunjukkan bahwa senyawa α-monolaurin hasil sintesis dengan konsentrasi 500 µg/ml sama aktif dengan α-monolaurin standar pada konsentrasi yang sama, sedangkan dilaurin yang tidak memberikan aktivitas antibakteri.
Hasil penelitian menunjukkan bahwa PKO memiliki aktivitas antibakteri dengan memberikan hasil hambatan yang minimal terhadap pertumbuhan Escherichia coli. Sebanyak 0,04 ml PKO dimasukan dalam cakram, lalu dibiarkan sampai 24 jam dalam inkubator suhu 37oC, kemudian disimpan pada suhu 4oC. Percobaan aktivitas antibakteri pada Staphylococcus aureus, Pseudomonas aeruginosa, Candida albicans dan Escherichia coli dilakukan pada pelat agar nutrien sedangkan yang pada Aspergillus niger dilakukan pada pelat SDA (sabouraud dextrose agar). Pengujian dilakukan terhadap bakteri yang sudah dibiakkan pada media miring yang disimpan pada suhu 4oC, kemudian agar miring dibiarkan selama 15 menit agar mencapai suhu kamar, kemudian dilakukan pembuatan inokulum untuk dihomogenkan dengan media pertumbuhan. Forseps steril digunakan untuk meletakkan cakram ke piring diinokulasi. Lempeng kemudian diinkubasi pada suhu 37oC selama 24 jam untuk bakteri dan 72 jam untuk jamur. Zona inhibisi dinilai setelah periode inkubasi (Ekwenye dan Ijeomah,
2005). Penelitian lain juga menunjukan kemampuan penghambatan PKO terhadap Staphylococcus aureus dan Streptococcus sp. Aktivitas antimikroba diuji menggunakan teknik difusi Cakram. Kertas cakram steril (kertas filter Whatman No 1) diameter 5 mm diresapi dengan minyak inti sawit dan dikeringkan dalam oven pada 60°C selama 15 menit. Pelat agar yang mengandung 0,1 ml biakan organisme yang hendak uji dan cakram yang telah disiapkan ditempatkan dalam pelat. Kemudian diinkubasi pada suhu 37°C selama 18 - 24 jam dan diamati zona hambatannya (Ugbogu et al., 2006). Penelitian mengenai hasil hidrolisis VCO, menunjukkan peningkatan sifat antibakteri yang sejalan dengan peningkatan tingkat hidrolisis. Penelitian dilakukan dengan menghitung zona hambatan pada cawan biakan bakteri. Hasilnya menunjukkan bahwa sifat antibakteri dari hasil hidrolisis VCO yang dilakukan secara enzimatik lebih tinggi dari hasil hidrolisis VCO secara penyabunan (Permata, 2012).