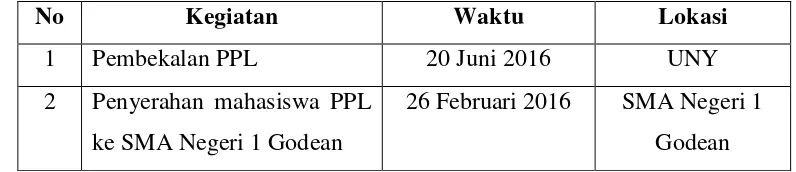
No. Dokumen : F/751/WKS1/P/5
No. Revisi : 1
Tanggal Berlaku : 1 Juli 2016
RENCANA PELAKSANAAN PEMBELAJARAN
(RPP)
Satuan Pendidikan : SMA Negeri 1 Godean Mata Pelajaran : KimiaKelas/Semester :XI/MIPA Materi Pokok : Hidrokarbon Alokasi Waktu : 2 x 45 Menit
A. Tujuan Pembelajaran
Setelah mengikuti proses pembelajaran peserta didik dapat: 1. Menjelaskan pengertian senyawa hidrokarbon.
2. Mengidentifikasi unsur C, H, dan O dalam senyawa karbon. 3. Mendeskripsikan kekhasan atom karbon dalam senyawa karbon 4. Membedakan atom karbon primer, sekunder, tertier, dan kuartener. 5. Mengelompokkan senyawa hidrokarbon berdasarkan kejenuhan ikatan B. Kompetensi Dasar dan Indikator Pencapaian Kompetensi
KD :
3.1.Menganalisis struktur dan sifat senyawa hidrokarbon berdasarkan pemahaman kekhasan atom karbon dan penggolongan senyawanya
4.1.Menemukan berbagai struktur molekul hidrokarbon dari rumus molekul yang sama dan memvisualisasikannya
IPK:
3.1.1. Menjelaskan pengertian senyawa hidrokarbon.
3.1.2. Mengidentifikasi unsur C, H, dan O dalam senyawa karbon. 3.1.3. Mendeskripsikan kekhasan atom karbon dalam senyawa karbon 3.1.4. Membedakan atom karbon primer, sekunder, tertier, dan kuartener. 3.1.5. Mengelompokkan senyawa hidrokarbon berdasarkan kejenuhan ikatan Materi Pembelajaran
1. Senyawa Organik dan Senyawa Anorganik 2. Identifikasi atom C,H dan O
3. Kekhasan atom karbon C. Metode Pembelajaran
1. Pendekatan : Saintifik (melakukan/menerapkan langkah-langkah mengamati, menanya, mengumpulkan informasi, mengolah informasi dan menyajikan informasi).
D. Media Pembelajaran 1. Media:
a. Bahan presentasi (Power Point)
2. Alat/Bahan:
a. LCD Proyektor b. Spidol
c. Papan tulis d. Lembar Kerja e. Laptop f. LKS/ buku E. Sumber Belajar
1. Michael Purba. 2007. Kimia untuk SMA Kelas X. Jakarta: Erlangga. 2. Das Salirawati, dkk. 2007. Belajar Kimia SecaraMenarikuntuk
SMA/MA kelas X. Jakarta: Grasindo.
3. Unggul Sudarmo. 2014. Kimia untuk SMA/MA Kelas XI Kelompok Peminatan Matematika dan Ilmu Alam. Jakarta:Erlangga.
4. LKS kimia SMA kelas XI semester 1 : Kreativ, TIM Penyusun MIPA
F. Langkah-langkah Pembelajaran 1. PertemuanPertama (2 JP)
KEGIATAN LANGKAH KEGIATAN PEMBELAJARAN ALOKASI WAKTU
Pendahuluan
a. Komunikasi
1. Pendidik memberi salam
2. Pendidik mempersilahkan peserta didik duduk dan tenang untuk bersiap mengikuti pembelajaran
3. Pendidik mengajak peserta didik berdoa sebelum memulai pelajaran 4. Pendidik menanyakan kabar dan
mengecek kehadiran peserta didik
5 menit
b. Motivasi
kimia. Padahal banyak sekali semua kejadian yang kita alami maupun kita lakukan itu berkaitan dengan kimia. Jadi, kalau diantara kalian ada yang mengaitkan semua kejadian dengan kimia berarti selama liburan kalian telah belajar kimia. Mengasyikkan bukan? Ada yang bisa memberi contoh?
c. Apresepsi
Pernahkah anda membakar sate, apa yang terjadi jika daging sate tersebut terlalu lama dibakar? Ternyata sate tersebut menjadi gosong dan berwarna hitam. Taukah anda mengapa jika kayu terbakar juga menjadi berwarna hitam? Apakah yang menyebabkan warna hitam tersebut? apakah daging binatang juga tersusun atas atom-atom yang sama dengan atom-atom penyusun kayu? Salah satu atom penyusun kayu dan tubuh bnatang dan manusia adalah atom C. Atom C merupakan paling banyak yang menyusun tubuh makhluk hidup dan dialam semesta ini, senyawa dari atom C menduduki jumlah terbanyak.
Kegiatan Inti 1. Mengamati
Peserta didik diminta untuk mengamati berbagai gambar di layar LCD (mengenai gambar sate dan kayu bakar).
2. Menanya
Dengan melihat gambar pada layar tersebut akan muncul pertanyaan dari peserta didik. Dari pertanyaan yang diajukan peserta didik
lain guru memberikan kesempatan pada peserta didik lain untuk menjawab pertanyaan yang diajukan temannya.
Bila tidak ada pertanyaan pendidik berusaha untuk mengarahkan agar timbul pertanyaan dari peserta didik.
3. Mengumpulkan informasi
Peserta didik dapat memanfaatkan segala sumber belajar untuk menyelesaikan permasalahan yang diberikan pendidik mengenai sesuatu benda yang mengandung atom C.
4. Mengasosiasi
Peserta didik mendiskusikan kekhasan atom karbon dalam senyawa karbon, atom karbon primer, sekunder, tertier, dan kuartener, rantaikarbon atom karbon, rumus struktur, rumus molekul, dan rumus bangun.
Data tersebut kemudian dikelompokkan menjadi kekhasan atom karbon dalam senyawa karbon, atom karbon primer, sekunder, tersier, dan kuartener, rantai karbon atom karbon, rumus struktur, rumus molekul, dan rumus bangun.
5. Mengkomunikasikan
Pendidik meminta salah satu peserta didik untuk mempresentasikan hasil pengamatannya mengenai kekhasan atom karbon dalam senyawa karbon, atom karbon primer, sekunder, tertier, dan kuartener, rantai karbon atom karbon, rumus struktur, rumus molekul, dan rumus bangun yang telah dianalisis kaitannya dengan hipotesa yang telah dirumuskan terdahulu.
Berdasarkan undian, maka secara bergiliran setiap kelompok mempresentasikan hasilnya. Kelompok lain dapat member penilaian,
pertanyaan maupun tanggapan ataupun berupa saran.
Penutup a. Simpulan
Pendidik bersama-sama dengan peserta didik menyebutkan pengertian hidrokarbon
Peserta didik mendeskripsikan kekhasan atom karbon dalam senyawa karbon
karbon primer, sekunder, tertier, dan kuartener. Bersama dengan pendidik, peserta didik dapat
membandingkan senyawa hidrokarbon berdasarkan kejenuhan ikatan
5 menit
b. Evaluasi
Pendidik meminta peserta didik untuk mempelajari materi berikutnya dan meminta peserta didik untuk mengerjakan tugas.
c. Refleksi
Meminta umpan balik kepada peserta didik tentang kegiatan belajar yang telah berlangsung pada hari ini.
d. Penutup
Pendidik mengakhiri kegiatan pembelajaran dengan berdoa dan salam untuk menutup kegiatan pembelajaran.
G. Penilaian Hasil Pembelajaran
1. Penilaian pengetahuan (terlampir) 2. Penilaian keterampilan (terlampir)
Godean, Juli 2016 Mengetahui,
Guru Mata Pelajaran
Siti Martiningsih, S.Pd. NIP 19700223 200604 2 003
Mahasiswa PPL
Fatma Septiyani
Lampiran 1
A. Materi Pembelajaran
Identifikasi Senyawa C, H, dan O
Hidrokarbon merupakan senyawa karbon yang paling sederhana. Namun demikian, hidrokarbon merupakan sumber utama untuk membentuk senyawa karbon yang lebih besar dan kompleks.
Senyawa hidrokarbon terdiri dari atom karbon dan atom hidrogen. Untuk mengetahui adanya unsur karbon dan hidrogen dalam senyawa karbon dapat dilakukan suatu percobaan sederhana. Misalnya, pada pembakaran kayu, kertas, ikan, atau gula diperoleh zat yang berwama hitam. Zat yang berwarna hitam tersebut adalah karbon atau arang. Untuk membuktikan adanya hidrogen dalam senyawa karbon yaitu dengan memanaskan gula dalam tabung reaksi. Bintik air yang terbentuk pada dinding tabung sebelah dalam membuktikan adanya hidrogen.
Secara kimiawi, kehadiran karbon dan oksigen dapat dilihat pada rumus atom pembentuk senyawa/molekul itu. Misalnya, metana. Molekul ini memiliki rumus CH4. Molekul ini terdiri atas atom C dan H.
Karbon adalah unsur yang dalam kehidupan sehari-hari dikenal dalam bentuk arang, grafit dan intan. Intan adalah zat padat yang bening berkilauan dan merupakan zat yang paling keras. Penggunaan intan sesuai dengan sifatnya yang keras dan mengkilap sebagian besar digunakan untuk perhiasan. Intan alam yang tidak cukup baik untuk perhiasan dan intan buatan digunakan untuk membuat alat pemotong. Intan bubuk digunakan untuk membuat ampelas. Grafit merupakan karbon yang bersifat licin dan dapat menghantarkan listrik. Grafit digunakan baik sebagai elektroda, bahan pelumas, bahan pembuat pinsil ataupun bahan pembuat komposit. Arang merupakan karbon yang dibuat dari kayu yang terbakar. Arang digunakan sebagai bahan pengadsorpsi zat warna ataupun sebagai obat sakit perut.
Hidrogen merupakan unsur teringan dan dalam keadaan bebas berupa molekul dwiatom yang berwujud gas. Hidrogen umumnya terdapat sebagai air atau zat-zat organik. Gas hidrogen merupakan gas yang tak berwarna, tak berbau dan tak berasa, sedikit larut dalam air. Senyawa hidrogen umumnya merupakan senyawa kovalen. Dalam kehidupan sehari-hari hidrogen digunakan sebagai bahan untuk membuat macam-macam persenyawaan organik, untuk mengeraskan minyak, bahan bakar dan pengisi balon udara.
organik juga dapat dibuat oleh manusia maka senyawa organik berubah menjadi senyawa karbon. Selain senyawa organik dikenal juga senyawa anorganik, yaitu senyawa yang bukan berasal dari makhluk hidup. Senyawa organik dan anorganik mempunyai perbedaan dalam hal kereaktifan, titik cair, dan titik didih serta kelarutan. Perbedaannya yaitu senyawa organik mempunyai kereaktifan, titik cair, dan titik didih yang lebih rendah dibanding senyawa anorganik. Dalam hal kelarutan, senyawa organik lebih mudah larut dalam pelarut nonpolar seperti alkohol daripada dalam pelarut polar seperti air.
Senyawa karbon didefinisikan sebagai semua senyawa yang mengandung atom karbon (C), dengan pengecualian senyawa karbon seperti oksida karbon, karbonat, dan sianida. Senyawa karbon yang paling sederhana dikenal dengan hidrokarbon, yang hanya terdiri dari atom karbon (C) dan hidrogen (H). Dalam senyawa karbon, selain unsur karbon dan hidrogen terdapat unsur lain seperti oksigen, nitrogen, sulfur atau posfor.
Untuk mengetahui keberadaan unsur karbon, hidrogen dalam senyawa karbon dapat dilakukan dengan percobaan sederhana, misalnya dengan pembakaran. Salah satu contoh dari senyawa karbon adalah gula (C11H22O11). Adanya unsur karbon dan hidrogen pada gula pasir dapat ditunjukkan melalui reaksi pembakaran. Apabila senyawa gula pasir dibakar atau dioksidasi sempurna maka karbon akan berubah menjadi CO2 dan hidrogen akan berubah menjadi H2O, melalui reaksi:
aC11H22O11(s) + bO2(g)cCO2(g) + dH2O (g)
Adanya H2O dapat ditunjukkan dengan terbentuknya embun pada dinding pipa penghubung. Terkadang kurangnya oksigen menyebabkan terjadinya reaksi pembakaran yang tidak sempurna. Menanggapi hal ini, digunakan oksidator untuk menyebabkan terjadinya reaksi pembakaran sempurna. Dalam kasus pembakaran gula pasir ini, dapat digunakan CuO sebagai oksidator dan uap gula pasir yang akan mengalami reaksi oksidasi, sebagaimana persamaan reaksi:
2 C11H22O11(s) + 4 CuO(s) + 21O2(g) 22CO2(g) + 22H2O(g) + 2 Cu2O(s) Terjadinya reaksi oksidasi sempurnya ditunjukkan dengan terbentuknya zat berwarna merah yaitu Cu2O.
Kekhasan Atom Karbon
Banyaknya jenis dan jumlah senyawa karbon tidak terlepas dari sifat khas atom karbon yang dapat membentuk senyawa dengan berbagai unsur, dengan struktur yang bervariasi. Beberapa sifat khas atom karbon, antara lain:
dengan atom lain membentuk ikatan kovalen. Keempat elektron valensi ini dapat digambarkan sebagai tangan ikatan.
2. Atom karbon dengan keempat tangan itu dapat membentuk rantai atom karbon dengan berbagai bentuk dan kemungkinan. Setiap kemungkinan menghasilkan satu jenis senyawa. Semakin banyak kemungkinan, semakin banyak jenis senyawa yang bisa dibentuk oleh atom karbon. Beberapa kemungkinan rantai karbon yang dibentuk dapat dikelompokkan berdasarkan:
a. Jumlah ikatan
Ikatan tunggal, yaitu ikatan antar atom-atom karbon dengan satu tangan ikatan (sepasang elektron ikatan).
Ikatan rangkap dua, yaitu terdapat ikatan antara atom-atom karbon dengan dua tangan ikatan (dua pasang elektron ikatan).
Ikatan rangkap tiga, yaitu ikatan antara atom-atom karbon dengan tiga tangan ikatan (tiga pasang elektron ikatan).
b. Bentuk rantai
Rantai terbuka (alifatis), yaitu rantai yang antar ujung-ujung atom karbonnya tidak saling berhubungan. Rantai jenis ini ada yang bercabang dan ada yang tidak bercabang.
Rantai tertutup (alisiklis), yaitu rantai yang terdapat pertemuan antara ujung-ujung rantai karbonnya. Terdapat dua macam rantai siklis, yaitu rantai siklis dan aromatis.
3. Posisi atom karbon di dalam rantai karbon
Berdasarkan jumlah atom karbon lain yang diikat, terdapat empat posisi atom karbon, yaitu:
a. Atom karbon primer, yaitu atom karbon yang hanya mengikat secara langsung satu atom karbon yang lain.
b. Atom karbon sekunder, yaitu atom karbon yang hanya mengikat secara langsung dua atom karbon yang lain.
c. Atom karbon tersier, yaitu atom karbon yang hanya mengikat secara langsung tiga atom karbon yang lain.
Lampiran 2
RUBRIK PENILAIAN KOMPETENSI PENGETAHUAN
Petunjuk penilaian :
Lembar ini diisi oleh guru untuk menilai tugas kelompok. Berilah tanda check list(√) pada kolom skor sesuai deskripsi yang ditentukan.
INSTRUMEN PENILAIAN KOMPETENSI PENGETAHUAN (DISKUSI KELOMPOK)
1. Zat yang berwarna hitam hasil pembakaran adalah ….
2. Karbon adalah unsur yang dalam kehidupan sehari-hari dikenal dalam bentuk … , … dan ...
3. Intan bubuk digunakan untuk membuat .... 4. Arang digunakan sebagai … ataupun sebagai ….
5. Hidrogen merupakan unsur teringan dan dalam keadaan bebas berupa molekul dwiatom yang berwujud ....
6. Senyawa organik dan anorganik mempunyai perbedaan dalam hal…, …, dan … serta ….
7. Kereaktifan senyawa organik lebih ... dibanding senyawa anorganik.
8. Dalam hal kelarutan, senyawa organik lebih …disbanding senyawa anorganik.
9. Dalam senyawa karbon, selain unsur karbon dan hidrogen terdapat unsur lain seperti ..., ..., ... atau ....
10.Sebutkan hasil reaksi pembakaran sempurna senyawa hidrokarbon!
11.Sebutkan beberapa macam ikatan yang dapat dibentuk oleh atom-atom karbon!
12.Sebutkan beberapa posisi atom karbon yang diikat oleh atom karbon lain!
d. PenilaianKeterampilan (KI 4)
Diskusikanlah pertanyaan-pertanyaan dibawah ini bersama teman satu kelompokmu !
1. Bagaimana proses terjadinya reaksi pembakaran sempurna pada gula pasir (C11H22O11)?
2. Sebutkan hasil reaksi pembakaran sempurna senyawa hidrokarbon!
3. Sebutkan beberapa macam ikatan yang dapat dibentuk oleh atom-atom karbon!
4. Sebutkan beberapa posisi atom karbon yang diikat oleh atom karbon lain! 5. Mengapa atom karbon dapat mengikat 4 atom lain?
KUNCI JAWABAN PenilaianPengetahuan (KI 3)
1. Zat yang berwarna hitam hasil pembakaran adalah arang atau karbon (skor 1)
2. Karbon adalah unsur yang dalam kehidupan sehari-hari dikenal dalam bentuk arang, grafit, dan intan. (skor 1)
3. Intan bubuk digunakan untuk membuat amplas. (skor 1)
4. Arang digunakan sebagai penyerap warna ataupun sebagai obat sakit perut. (skor 2)
5. Hidrogen merupakan unsur teringan dan dalam keadaan bebas berupa molekul dwiatom yang berwujud gas. (skor 1)
6. Senyawa organik dan anorganik mempunyai perbedaan dalam hal kereaktifan, kelarutan, dan titik leleh serta titik didih. (skor 4)
7. Kereaktifan senyawa organik lebih kecil dibanding senyawa anorganik. (skor 1)
8. Dalam kelarutan, senyawa organik lebih besar disbanding senyawa anorganik. (skor 1)
9. Dalam senyawa karbon, selain unsur karbon dan hidrogen terdapat unsur lain seperti oksigen, nitrogen, sulfur dan fosfor. (skor 4)
10.Hasil reaksi pembakaran sempurna senyawa hidrokarbon adalah CO2dan O2. (skor 2)
11.Macam ikatan yang dapat dibentuk oleh atom-atom karbon adalah tunggal, rangkap dua, rangkap tiga. (skor 3)
12.Posisi atom karbon yang diikat oleh atom karbon lain adalah primer, sekunder, tersier, kuartener. (skor 4)
Nilai = jumlah skor x 5
6
d. Penilaian Keterampilan (KI 4)
1. Adanya unsur karbon dan hidrogen pada gula pasir (C11H22O11) dapat ditunjukkan melalui reaksi pembakaran. Apabila senyawa gula pasir dibakar atau dioksidasi sempurna maka karbon akan berubah menjadi CO2 dan hidrogen akan berubah menjadi H2O, melalui reaksi:
aC11H22O11 (s) + b O2 (g) c CO2 (g) + d H2O (g).
reaksi pembakaran yang tidak sempurna. Menanggapi hal ini, digunakan oksidator untuk menyebabkan terjadinya reaksi pembakaran sempurna. Dalam kasus pembakaran gula pasir ini, dapat digunakan CuO sebagai oksidator dan uap gula pasir yang akan mengalami reaksi oksidasi, sebagaimana persamaan reaksi:
2 C11H22O11(s) + 4 CuO(s) + 21 O2(g) 22 CO2(g) + 22 H2O(g) + 2 Cu2O(s) Terjadinya reaksi oksidasi sempurnya ditunjukkan dengan terbentuknya zat berwarna merah yaitu Cu2O. (skor 6)
2. Hasil reaksi pembakaran sempurna senyawa hidrokarbon adalah CO2 dan H2O. (skor 1)
3. Ikatan yang dapat dibentuk oleh atom-atom karbon adalah ikatan tunggal, ikatan rangkap dua, dan ikatan rangkap tiga. (skor 2)
4. Posisi atom karbon yang diikat oleh atom karbon lain ada empat, yaitu atom karbon primer, atom karbon sekunder, atom karbon tersier, dan atom karbon kuartener. (skor 2)
5. Atom karbon dapat mengikat 4 atom lain karena atom karbon memiliki empat elektron valensi. (skor 2)
6. Bentuk rantai atom karbon yaitu rantai terbuka (alifatik) dan rantai tertutup (alisiklik) rantai tertutup terdapat dua macam yaitu siklik dan aromatik. (skor 2)
RUBRIK PENILAIAN KOMPETENSI KETRAMPILAN
Petunjuk penilaian :
Lembar ini diisi oleh guru untuk menilai kompetensi keterampilan peserta didik. PERTEMUAN 1
No. Nama Siswa
Skor Aspek yang Dinilai
Ju
Keterangan Nilai
Rentang Skor = 1 – 4 Skor minimal = 4
No. Tujuan Pembelajaran Kriteria Deskripsi
1. Menjelaskan
pengertian senyawa hidrokarbon.
4 (sangat baik) Jika peserta didik dapat
menjelaskan pengertian
hidrokarbon dengan tepat, lancar dalam mempresentasikan dan aktif selama diskusi.
menjelaskan pengertian hidrokarbon dengan tepat, namun
kurang lancar dalam
mempresentasikan tetapi aktif selama diskusi.
2 (cukup baik) Jika peserta didik dapat
menjelaskan pengertian
hidrokarbon dengan tepat, namun
kurang lancar dalam
mempresentasikan dan tidak aktif selama diskusi.
1 (kurang baik)
Jika peserta tidak didik dapat
menjelaskan pengertian
hidrokarbon dengan tepat, namun
kurang lancar dalam
mempresentasikan dan tidak aktif selama diskusi.
2. Mengidentifikasi unsur C, H, dan O dalam senyawa karbon.
4 (sangat baik) Jika peserta didik dapat mengidentifikasi unsur C, H, dan O dalam senyawa karbon dengan
tepat, lancar dalam
mempresentasikan dan aktif selama diskusi.
3 (baik) Jika peserta didik dapat
mengidentifikasi unsur C, H, dan O dalam senyawa karbon dengan tepat, namun kurang lancar dalam mempresentasikan tetapi aktif selama diskusi.
2 (cukup baik) Jika peserta didik dapat mengidentifikasi unsur C, H, dan O dalam senyawa karbon dengan tepat, namun kurang lancar dalam mempresentasikan dan tidak aktif selama diskusi.
baik) mengidentifikasi unsur C, H, dan O dalam senyawa karbon dengan tepat, namun kurang lancar dalam mempresentasikan dan tidak aktif selama diskusi.
3. Mendeskripsikan kekhasan atom karbon dalam senyawa karbon
4 (sangat baik) Jika peserta didik dapat mendeskripsikan kekhasan atom karbon dalam senyawa karbon dengan tepat, lancar dalam mempresentasikan dan aktif selama diskusi.
3 (baik) Jika peserta didik dapat
mendeskripsikan kekhasan atom karbon dalam senyawa karbon dengan tepat, namun kurang lancar dalam mempresentasikan tetapi aktif selama diskusi.
2 (cukup baik) Jika peserta didik dapat mendeskripsikan kekhasan atom karbon dalam senyawa karbon dengan tepat, namun kurang lancar dalam mempresentasikan dan tidak aktif selama diskusi.
1 (kurang baik)
Jika peserta tidak didik dapat mendeskripsikan kekhasan atom karbon dalam senyawa karbon dengan tepat, namun kurang lancar dalam mempresentasikan dan tidak aktif selama diskusi.
4. Membedakan atom
karbon primer,
sekunder, tersier , dan kuartener.
4 (sangat baik) Jika peserta didik dapat membedakan atom karbon primer, sekunder, tersier , dan kuartener dengan tepat, lancar dalam mempresentasikan dan aktif selama diskusi.
membedakan atom karbon primer, sekunder, tersier , dan kuartener dengan tepat, namun kurang lancar dalam mempresentasikan tetapi aktif selama diskusi.
2 (cukup baik) Jika peserta didik dapat membedakan atom karbon primer, sekunder, tersier , dan kuartener dengan tepat, namun kurang lancar dalam mempresentasikan dan tidak aktif selama diskusi.
1 (kurang baik)
Jika peserta didik dapat membedakan atom karbon primer, sekunder, tersier , dan kuartener dengan tepat, namun kurang lancar dalam mempresentasikan dan tidak aktif selama diskusi.
5. Mengelompokkan senyawa hidrokarbon berdasarkan kejenuhan ikatan
4 (sangat baik) Jika peserta didik dapat
mengelompokkan senyawa
hidrokarbon berdasarkan kejenuhan ikatan dengan tepat, lancar dalam mempresentasikan dan aktif selama diskusi.
3 (baik) Jika peserta didik dapat
mengelompokkan senyawa
hidrokarbon berdasarkan kejenuhan ikatan dengan tepat, namun kurang lancar dalam mempresentasikan tetapi aktif selama diskusi.
2 (cukup baik) Jika peserta didik dapat
mengelompokkan senyawa
hidrokarbon berdasarkan kejenuhan ikatan dengan tepat, namun kurang lancar dalam mempresentasikan dan tidak aktif selama diskusi.
No. Dokumen : F/751/WKS1/P/5
No. Revisi : 1
Tanggal Berlaku : 1 Juli 2016
RENCANA PELAKSANAAN PEMBELAJARAN
(RPP)
Satuan Pendidikan : SMA Negeri 1 Godean Mata Pelajaran : KimiaKelas/Semester : XI/ Gasal Materi Pokok : Hidrokarbon
Materi Pembelajaran: Struktur dan tata nama alkana Alokasi Waktu : 2 x 45 Menit
A. Tujuan Pembelajaran
1. Mengelompokkan senyawa hidrokarbon berdasarkan jenis ikatan yang terdapat pada rantai karbonnya.
2. Menuliskan rumus umum alkana berdasarkan analisis rumus struktur dan rumus molekul.
3. Menjelaskan sifat-sifat deret homolog pada alkana.
4. Menentukan nama senyawa alkana sesuai dengan aturan IUPAC. 5. Menuliskan jumlah isomer senyawa alkana.
6. Menjelaskan sifat dan kegunaan alkana.
7. Mempresentasikan hasil diskusi mengenai kekhasan atom C. B. Kompetensi Dasar dan Indikator Pencapaian Kompetensi
3.1. Menganalisis struktur dan sifat senyawa hidrokarbon berdasarkan pemahaman kekkhasan atom karbon dan penggolongan senyawanya.
3.1.1. Mengelompokkan senyawa hidrokarbon berdasarkan jenis ikatan yang terdapat pada rantai karbonnya.
3.1.2. Menuliskan rumus umum alkana berdasarkan analisis rumus struktur dan rumus molekul.
3.1.3. Menjelaskan sifat-sifat deret homolog pada alkana.
3.1.4. Menentukan nama senyawa alkana sesuai dengan aturan IUPAC. 3.1.5. Menuliskan jumlah isomer senyawa alkana.
3.1.6. Menjelaskan sifat dan kegunaan alkana.
4.1Menemukan berbagai struktur molekul hidrokarbon dari rumus molekul yang
sama dan memvisualisasikannya
4.1.1. Mempresentasikan hasil diskusi mengenai kekhasan atom C.
C. Materi Pembelajaran
2. Alkana
a. Deret homolog alkana b. Tata nama alkana c. Isomeri alkana
d. Sifat dan kegunaan alkana *Materi selengkapnya terlampir
D. Metode Pembelajaran
Metode pembelajaran :ceramah, diskusi, tanya jawab, dan penugasan
E. Media Pembelajaran
1. Media pembelajaran : Buku
2. Alat pembelajaran : Laptop, LCD, white board, dan spidol 3. Bahan pembelajaran : Bahan ajar, LKS
F. Sumber Belajar
1. Sudarmo, Unggul. 2013. Kimia untuk SMA/MA Kelas XI. Jakarta: Erlangga 2. Salirawati, Das, Fitria Meilina, Jamil Suprihatiningrum. 2007. Belajar Kimia
secara Menarik untuk SMA/MA Kelas X. Jakarta: Gramedia Widiasarana Indonesia
3. LKS kimia SMA kelas XI semester 1 : Kreativ, TIM Penyusun MIPA
G. Langkah-langkah Pembelajaran
Kegiatan Langkah Kegiatan Pembelajaran Alokasi Waktu
Pendahuluan
a. Komunikasi
1. Pendidik memberi salam
2. Pendidik mempersilahkan peserta didik duduk dan tenang untuk bersiap mengikuti pembelajaran
3. Pendidik mengajak peserta didik berdoa sebelum memulai pelajaran 4. Pendidik menanyakan kabar dan
mengecek kehadiran peserta didik
5 menit
b. Motivasi
yang terdapat pada rantai karbonnya, membahas rumus umum alkana berdasarkan analisis rumus struktur dan rumus molekul, menjelaskan sifat-sifat deret homolog pada alkana, menentukan nama senyawa alkana sesuai dengan aturan IUPAC, menuliskan jumlah isomer senyawa alkana, dan m.enjelaskan sifat dan kegunaan alkana
Apresepsi
Guru memberikan apersepsi dengan mengaitkan materi yang sudah disampaikan sebelummnya mengenai penulisan rantai atom karbon.
Kegiatan Inti 1. Mengamati
Siswa menyimak dan mendengarkan materi yang disampaikan guru mengenai pengolongan senyawa hidrokarbon berdasarkan jenis ikatan dan alkana yang meliputi deret homolog, tata nama, isomeri, sifat dan kegunaan alkana. Guru menjelaskan materi pengolongan senyawa hidrokarbon berdasarkan jenis ikatan dan alkana yang meliputi deret homolog, tata nama, isomeri, sifat dan kegunaan alkana.
80 menit
2. Menanya
Siswa bertanya tentang penjelasan materi yang belum dipahami atau informasi tambahan yang ingin diketahui.
3. Mengumpulkan informasi
Siswa menganalisis dari berbagai sumber terkait pengolongan senyawa hidrokarbon berdasarkan jenis ikatan dan alkana yang meliputi deret homolog, tata nama, isomeri, sifat dan kegunaan alkana.
(siswa membaca buku panduan)
4. Mengasosiasi
Siswa bekerjasama dengan teman sebangku untuk menghafal deret homolog alkana sampai pada dekana. Siswa berlatih mengerjakan soal yang
diberikan oleh guru.
5. Mengkomunikasikan
Siswa menuliskan tata nama senyawa alkana di papan tulis.
Siswa dan guru berdiskusi mengenai jawaban pada soal yang di berikan oleh guru.
Guru memberikan penilaian atas keaktifan siswa dalam mengerjakan tugas..
Penutup a. Simpulan
Siswa dengan dibimbing guru bersama-sama membuat kesimpulan mengenai pengolongan senyawa hidrokarbon berdasarkan jenis ikatan dan alkana yang meliputi deret homolog, tata
nama, isomeri, sifat dan kegunaan alkana. 5 menit
b. Evaluasi
Guru memberikan tugas kepada siswa mengenai tata nama senyawa alkana.
Siswa diminta untuk mempelajari materi selanjutnya yaitu alkena.
c. Refleksi
Meminta umpan balik kepada peserta didik tentang kegiatan belajar yang telah berlangsung pada hari ini.
d. Penutup
Pendidik mengakhiri kegiatan pembelajaran dengan berdoa dan salam untuk menutup kegiatan pembelajaran.
H. Penilaian Hasil Pembelajaran
Aspek Prosedur Instrument Keterangan
Pengetahuan -Tes tertulis -Diskusi
-Soal evaluasi Terlampir
Godean, Juli 2016 Mengetahui,
Guru Mata Pelajaran
Siti Martiningsih, S.Pd. NIP 19700223 200604 2 003
Mahasiswa PPL
Fatma Septiyani
Lampiran 1
Materi Pembelajaran
A. Penggolongan senyawa hidrokarbon berdasarkan jenis ikatan
Kelompok senyawa karbon yang paling sederhana adalah hidrokarbon, yaitu senyawa karbon yang tersusun dari atom karbon dan hidrogen. Hidrokarbon yang paling sederhana adalah metana, yang terdiri dari satu atom karbon dengan empat atom hidrogen (CH4). Metana merupakan molekul yang mempunyai struktur ruang tetrahedron dengan atom karbon sebagai pusatnya, dan atom hidrogen yang terdapat pada keempat sudutnya.
Berdasarkan ikatan yang pada rantai karbonnya, hidrokarbon dibedakan menjadi:
a. Hidrokarbon jenuh, yaitu hidrokarbon yang pada rantai karbonnya semua berikatan tunggal. Hidrokarbon ini disebut juga sebagai alkana. b. Hidrokarbon tak jenuh, yaitu hidrokarbon yang pada rantai karbonnya
terdapat ikatan rangkap dua atau tiga. Hidrokarbon yang mengandung ikatan rangkap dua disebut dengan dengan alkena dan hidrokarbon yang mengandung ikatan rangkap tiga disebut alkuna.
B. Alkana
Setiap atom karbon mempunyai empat elektron valensi yang digunakan untuk membentuk ikatan kovalen dengan atom lainnya., yang digambarkan sebagai tangan ikatan. Jadi, atom karbon pada senyawa karbon mempunyai empat tangan ikatan. Pada alkana, keempat tangan tersebut bila tidak digunakan untuk mengikat atom karbon yang lain akan digunakan untuk mengikat atom hidrogen.
Penggantian (substitusi) sebuah atom H yang manapun pada gambar model molekul di atas dengan atom klorin, akan menghasilkan senyawa lain. Hal ini menunjukkan bahwa semua atom H di dalam senyawa CH4 mempunyai kedudukan yang identik. Jika dua model molekul metana digabungkan, akan didapat molekul hidrokarbon dengan dua atom karbon di dalamnya
Hal tersebut menunjukkan bahwa alkana yang terbentuk dari dua atom karbon akan mengikat enam atom hidrogen sehingga mempnyai rumus molekul C2H6. Jika penggantian atom hidrogen dengan atom karbon dilakukan terus-menerus.
1. Deret homolog alkana
Deretan rumus molekul alkana menunjukkan bahwa pada setiap anggota yang satu ke anggota berikutnya bertambah sebanyak CH2. Deret senyawa karbon yang demikian ini disebut deret homolog. Deret homolog pada alkana mempunyai sifat-sifat sebagai berikut:
a) Mempunyai rumus umum, untuk deret homolog alkana adalah CnH2n+2.
b) Antara satu anggota ke anggota berikutnya mempunyai pembeda CH2.
c) Selisish massa rumus antara satu anggota ke anggota berikutnya adalah 14.
d) Semakin panjang rantai atom karbonnya, semakin tinggi titik didihnya.
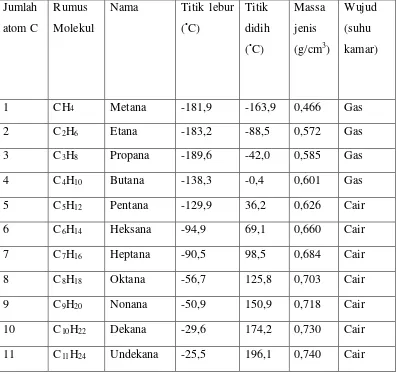
Tabel 1.1 menunjukkan sebagian anggota deret homolog alkana dengan beberapa sifat-sifatnya.
Tabel 1.1 Deret homolog alkana
12 C12H26 Dodekana -14,5 216,4 0,749 Cair
14 C14H30 Tetradekana 5,9 253,5 0,763 Cair
18 C18H38 Oktadekana 28 313,9 0,789 Padat
20 C20H24 Eikosana 36,9 343,9 0,789 Padat
2. Tata nama alkana
Senyawa karbon merupakan senyawa yang jumlah dan jenisnya sangat banyak. Oleh karena itu, diperlukan cara penamaan senyawa karbon yang sistematis. Nama senyawa karbon dapat memberi informasi tentang rumus molekul dan strukturnya. Pemberian nama senyawa karbon didasarkan pada aturan IUPAC (International Union and Pure Applied Chemistry) sebagai berikut.
a. Nama alkana diambil berdasarkan jumlah atom karbon yang menyusunnya dan diakhiri dengan akhiran “ana”.
b. Jika strukturnya telah diketahui dan merupakan rantai karbon tak bercabang, di depan nama huruf tersebut diberi huruf n (dari kata normal).
c. Jika rantai karbonnya bercabang, ditentukan dahulu ratai utamanya (rantai induk), yakni rantai atom karbon terpanjang dan diberi nomor urut dari ujung yang paling dekat dengan letak cabang.
d. Menetapkan gugus cabang yang terikat pada rantai utama. Gugus cabang pada alkana umumnya merupakan alkil. Gugus alkil merupakan gugus hidrokarbon (alkana) yang kehilangan sebuah atom hidrogen. Rumus umum alkil adalah CnH2n+1. Nama gugus alkil disesuaikan dengan nama alkananya dengan mengganti akhiran –ana dengan akhiran –il.
Rumus Gugus alkil Nama IUPAC
CH3‒ Metil
C2H5‒ Etil
C3H7‒ Propil
C4H9‒ Butil
C5H11‒ Pentil
C6H13‒ Heksil
f. Urutan penamaan alkana: nomor cabang-nama cabang-nama rantai utama
g. Jika terdapat lebih dari satu cabang yang sama, nama cabang disebut sekali, tetapi diawali dengan angka latin yang menunjukkan jumlahnya.
3. Isomeri alkana
Isomeri adalah peristiwa dimana suatu senyawa karbon mempunyai rumus molekul sama tetapi mempunyai struktur berbeda.
Perbedaan antara senyawa n-butana dengan metil propana adalah pada kerangka rantai atom karbonnya. Rantai n-butana tidak bercabang, sedangkan metilpropana rantainya bercabang pada atom C-2. Perbedaan struktur kedua senyaa tersebut mengakibatkan perbedaan sifat, dimana titik didih n-butana adalah -0,4°C sedangkan titik didih metilpropana adalah -11,6°C. Semakin banyak jumlah atom karbon penyususn alkana, semakin banyak jumlah isomernya.
4. Sifat dan kegunaan alkana a. Sifat fisis alkana
Alkana merupakan senyawa kovalen yang mempunyai titik didih dan titik lebur relatif rendah. Titik didih dan titik lebur alkana ditentukan oleh banyaknya atom karbon dan struktur rantai atom karbonnya. Secara umum titik didih dan titik lebur alkana mempunyai pola sebagai berikut.
1) Semakin banyak atom karbon atau semakin panjang rantai karbon alkana, semakin tinggi titik didih dan titik leburnya. 2) Untuk jumlah atom karbon yang sama, isomer dengan rantai karbon tidak bercabang mempunyai titikdidih dan titik lebur yang lebih tinggi daripada isomer dengan rantai karbon bercabang.
3) Semakin banyak cabang pada rantai karbonnya, semakin rendah titik didih dan titik leburnya.
b. Sifat kimia alkana
rendah. Semakin panjang rantai karbon semakin berkurang kereaktifannya. Reaksi pada alkana biasanya merupakan reaksi substitusi, yaitu reaksi penggantian gugus atom hidrogen pada suatu alkana.
c. Kegunaan alkana
1) Alkana digunakan sebagai bahan bakar. Manfaat utama alkana diantaranya:
Metana merupakan senyawa utama yang terkandung dalam gas alam cair atau LNG (Liquefied Natural Gas). Gas alam banyak digunakan sebagai bahan bakar di industri dan rumah tangga.
Alkana dengan jumlah atom karbon 2 (etana) sampai 5 (pentana) terkandung dalam LPG (Liquefied Protoleum Gas) atau lebih dikenal dengan LPG. Elpigi digunakan sebagai bahan bakar untuk rumah tangga.
Butana digunakan sebagai pengisi korek api.
Oktana merupakan senyawa utama yang terkandung di dalam bensin. Bensin digunakan sebagai bahan bakar kendaraan bermotor.
2) Selain digunakan sebagai bahan bakar, alkana juga digunakan sebagai pelarut non-polar yang dapat melarutkan senyawa-senyawa non-polar.
Lampiran 2
RUBRIK TES PENGETAHUAN
N o
Tujuan Pembelajaran
Butir Soal Sko
r 1. Mengelompokka
n senyawa
hidrokarbon berdasarkan jenis ikatan yang terdapat pada rantai karbonnya.
Jelaskan pengertian senyawa hidrokarbon dan dibagi menjadi berapa kelompok senyawa hidrokarbon tersebut berdasarkan jenis ikatan pada rantai karbonnnya? analisis rumus struktur dan rumus molekul.
Apa rumus umum alkana dan bagaimana bisa didapatkan rumus umum tersebut?
10
3. Menjelaskan sifat-sifat deret homolog pada alkana.
Jelaskan apa yang dimaksud deret homolog dan sebutkan sifat-sifat deret homolog alkana!
10
4. Menentukan nama senyawa alkana sesuai dengan aturan IUPAC
Tuliskan nama senyawa alkana sesuai dengan aturan IUPAC yag mempunyai rumus struktur berikut:
a.
b.
20
5. Menuliskan jumlah isomer senyawa alkana.
Nilai = � �ℎ �
8
6. Menjelaskan sifat dan kegunaan alkana.
Sebutkan sifat fisik, sifat kimia, dan kegunaan alkana!
Lampiran 3
Kunci Jawaban
1. Senyawa hidrokarbon adalah senyawa karbon yang tersusun dari atom karbon dan hydrogen. Berdasarkan ikatan yang pada rantai karbonnya, hidrokarbon dibedakan menjadi:
a. Hidrokarbon jenuh, yaitu hidrokarbon yang pada rantai karbonnya semua berikatan tunggal. Hidrokarbon ini disebut juga sebagai alkana. b. Hidrokarbon tak jenuh, yaitu hidrokarbon yang pada rantai karbonnya
terdapat ikatan rangkap dua atau tiga. Hidrokarbon yang mengandung ikatan rangkap dua disebut dengan dengan alkena dan hidrokarbon yang mengandung ikatan rangkap tiga disebut alkuna.
2. Rumus umum molekul alkana adalah CnH2n+2. Rumus tersebut didapat dengan mengamati deret homolog alkana yaitu deretan rumus molekul alkana menunjukkan bahwa pada setiap anggota yang satu ke anggota berikutnya bertambah sebanyak CH2. Jadi dengan melihat selisih antara anggota satu ke anggota berikutnya pada deret homolog alkana tersebut, maka dapat dituliskan rumus umum molekul alkana yaitu CnH2n+2.
3. Deret homolog alkana adalah deretan rumus molekul alkana menunjukkan bahwa pada setiap anggota yang satu ke anggota berikutnya bertambah sebanyak CH2. Sifat-sifatnya antara lain:
a. Mempunyai rumus umum, untuk deret homolog alkana adalah CnH2n+2. b. Antara satu anggota ke anggota berikutnya mempunyai pembeda CH2. c. Selisish massa rumus antara satu anggota ke anggota berikutnya adalah
14.
d. Semakin panjang rantai atom karbonnya, semakin tinggi titik didihnya. 4. a.
2,4-dimetilpentana b.
6. Sifat dan kegunaan alkana adalah sebagai berikut. a. Sifat fisis alkana
Alkana merupakan senyawa kovalen yang mempunyai titik didih dan titik lebur relatif rendah. Titik didih dan titik lebur alkana ditentukan oleh banyaknya atom karbon dan struktur rantai atom karbonnya.
b. Sifat kimia alkana
Alkana merupakan hidrokarbon jenuh dan semua ikatan yang ada merupakan ikatan kovalen yang sempurna. Akibatnya, hidrokarbon merupakan senyawa yang kurang reaktif sehingga disebut “parafin” yang berarti daya gabung atau daya reaksinya rendah. Semakin panjang rantai karbon semakin berkurang kereaktifannya. Reaksi pada alkana biasanya merupakan reaksi substitusi, yaitu reaksi penggantian gugus atom hidrogen pada suatu alkana.
c. Kegunaan alkana
1) Alkana digunakan sebagai bahan bakar. Manfaat utama alkana diantaranya:
Metana merupakan senyawa utama yang terkandung dalam gas alam cair atau LNG (Liquefied Natural Gas). Gas alam banyak digunakan sebagai bahan bakar di industri dan rumah tangga.
Alkana dengan jumlah atom karbon 2 (etana) sampai 5 (pentana) terkandung dalam LPG (Liquefied Protoleum Gas) atau lebih dikenal dengan LPG. Elpigi digunakan sebagai bahan bakar untuk rumah tangga.
Butana digunakan sebagai pengisi korek api.
Oktana merupakan senyawa utama yang terkandung di dalam bensin. Bensin digunakan sebagai bahan bakar kendaraan bermotor.
2) Selain digunakan sebagai bahan bakar, alkana juga digunakan sebagai pelarut non-polar yang dapat melarutkan senyawa-senyawa non-polar.
Lembar Pengamatan Keterampilan
No Aspek yang dinilai Skor Keterangan
1 2 3
1 Rasa ingin tahu
2 Ketekunan/ keuletan dalam belajar baik secara kelompok maupun individu dalam
menyelesaikan masalah yang ada. 3 Keberanian dalam menyampaikan
hasil diskusi di depan kelas
Rubrik
No Aspek yang dinilai Rubrik
1 Menunjukan rasa ingin tahu 3 = menunjukkan rasa ingin tahu yang kelompok ketika disuruh atau kurang antusias dalam menyelesaikan masalah secara individu.
1 = tidak menunjukkan antusias dalam pengamatan, sulit terlibat aktif dalam kegiatan kelompok atau individu walaupun telah didorong untuk terlibat. 2 Ketekunan/ keuletan dalam
belajar baik secara
kelompok maupun individu dalam menyelesaikan
masalah yang ada.
3 = tekun/ulet dalam menyelesaikan tugas dengan hasil terbaik yang bisa dilakukan, berupaya tepat waktu.
2= berupaya tepat waktu dalam menyelesaikan tugas, namun belum menunjukkan upaya terbaiknya.
1= tidak berupaya sungguh-sungguh dalam menyelesaikan tugas, dan tugasnya tidak selesai.
3 Keberanian dalam
menyampaikan hasil diskusi di depan kelas
3= berani menyampaikan hasil diskusinya disertai dengan rasa percaya diri
2= berani menyampaikan hasil diskusinya namun kurang percaya diri
1= tidak berani menyampaikan hasil diskusinya dan tidak percaya diri
Pedoman penilaian :
No. Dokumen : F/751/WKS1/P/5
No. Revisi : 1
Tanggal Berlaku : 1 Juli 2016
RENCANA PELAKSANAAN PEMBELAJARAN
(RPP)
Satuan Pendidikan : SMA Negeri 1 Godean Mata Pelajaran : KimiaKelas/Semester : XI/ Gasal Materi Pokok : Hidrokarbon
Materi Pembelajaran: Struktur dan tata nama alkena Alokasi Waktu : 2 x 45 Menit
A. Tujuan Pembelajaran
1. Mengelompokkan senyawa hidrokarbon berdasarkan jenis ikatan yang terdapat pada rantai karbonnya.
2. Menuliskan rumus umum alkena berdasarkan analisis rumus struktur dan rumus molekul.
3. Menentukan nama senyawa alkena sesuai dengan aturan IUPAC.
4. Menjelaskan konsep isomer struktur (kerangka, posisi, fungsi) atau isomer geometri (cis, trans) dan penerapannya pada sifat senyawa alkena.
5. Menjelaskan sifat fisis dan kimia pada alkena. 6. Menuliskan reaksi sederhana senyawa alkena. 7. Menjelaskan kegunaan senyawa alkena.
8. Mempresentasikan hasil diskusinya mengenai penulisan isomer alkena. B. Kompetensi Dasar dan Indikator Pencapaian Kompetensi
3.1. Menganalisis struktur dan sifat senyawa hidrokarbon berdasarkan pemahaman kekkhasan atom karbon dan penggolongan senyawanya.
3.1.1. Mengelompokkan senyawa hidrokarbon berdasarkan jenis ikatan yang terdapat pada rantai karbonnya.
3.1.2. Menuliskan rumus umum alkena berdasarkan analisis rumus struktur dan rumus molekul.
3.1.3. Menentukan nama senyawa alkena sesuai dengan aturan IUPAC.
3.1.4. Menjelaskan konsep isomer struktur (kerangka, posisi, fungsi) atau isomer geometri (cis, trans)dan penerapannya pada sifat senyawa alkena. 3.1.5.Menjelaskan sifat fisis dan kimia pada alkena.
4.1Menemukan berbagai struktur molekul hidrokarbon dari rumus molekul yang
sama dan memvisualisasikannya
4.1.1. Mempresentasikan hasil diskusi mengenai isomer dari alkena.
C. Materi Pembelajaran
1. Penggolongan senyawa hidrokarbon berdasarkan jenis ikatan. 2. Alkena
a. Deret homolog alkena b. Tata nama alkena c. Isomer alkena
d. Sifat dan kegunaan alkena *Materi selengkapnya terlampir D. Metode Pembelajaran
Metode pembelajaran : ceramah, diskusi, tanya jawab, dan penugasan
E. Media Pembelajaran
1. Media pembelajaran : Buku
2. Alat pembelajaran : Laptop, LCD, white board, dan spidol 3. Bahan pembelajaran : Bahan ajar, LKS
F. Sumber Belajar
1. Sudarmo, Unggul. 2013. Kimia untuk SMA/MA Kelas XI. Jakarta: Erlangga 2. Salirawati, Das, Fitria Meilina, Jamil Suprihatiningrum. 2007. Belajar Kimia
secara Menarik untuk SMA/MA Kelas X. Jakarta: Gramedia Widiasarana Indonesia
3. LKS kimia SMA kelas XI semester 1 : Kreativ, TIM Penyusun MIPA G. Langkah-langkah Pembelajaran
1. Pertemuan 1 (2JP)
Kegiatan Langkah Kegiatan Pembelajaran Alokasi Waktu
Pendahuluan
a. Komunikasi
1. Pendidik memberi salam
2. Pendidik mempersilahkan peserta didik duduk dan tenang untuk bersiap mengikuti pembelajaran
3. Pendidik mengajak peserta didik berdoa sebelum memulai pelajaran 4. Pendidik menanyakan kabar dan
mengecek kehadiran peserta didik
b. Motivasi
“Anak-anak kemarin kita sudah belajar apa ya? Ada yang masih ingat dengan pembagian atom C berdasarkan jenis ikatan? Kemarin kita sudah belajar hidrokarbon dengan rantai tunggal yang kita kenal dengan nama alkana. Untuk alkana kita kemarin sudah belajar mengenai tata nama, sifat fisika dan kimia, isomer dan kegunaannya. Nah untuk senyawa hidrokarbon dengan ikatan rangkap 2 biasanya dikenal dengan sebutan apa ya anak-anak? Apakah untuk hidrokarbon dengan rangkap 2 ini semua sifatnya sama dengan alkana? Untuk itu pada hari ini kita akan belajar mengenai alkena baik tata nama, sifat fisika dan kimia, isomer dan kegunaannya”.
c. Apresepsi
Guru memberikan apersepsi dengan mengaitkan materi yang sudah disampaikan sebelummnya mengenai penulisan rantai atom karbon.
Kegiatan Inti 1. Mengamati
Siswa mengamati dan mendengarkan materi yang disampaikan guru mengenai senyawa alkena yang meliputi deret homolog, tata nama, isomeri, sifat fisika dan kimia, dan kegunaan alkena.
Siswa mengamati bentuk struktur alkena yang ditampilkan dilayar.
Guru menjelaskan materi pengolongan senyawa hidrokarbon berdasarkan jenis ikatan dan alkena yang meliputi deret homolog, tata nama, isomeri, sifat fisika dan kimia, dan kegunaan alkena.
80 menit
Siswa bertanya tentang penjelasan materi yang belum dipahami atau informasi tambahan yang ingin diketahui.
Guru memberikan kesempatan kepada siswa lain untuk menjawab pertanyaaan yang diajukan oleh temannya. Apabila tidak ada pertanyaan guru dapat mengarahkan agar timbul pertanyaan dari siswa.
3. Mengumpulkan Informasi
Siswa menganalisis dari berbagai sumber terkait pengolongan senyawa hidrokarbon berdasarkan jenis ikatan dan alkena yang meliputi deret homolog, tata nama, isomeri, sifat fisika dan kimia, dan kegunaan alkena.
Siswa megumpulkan informasi untuk menyelesaikan soal yang diberikan oleh guru.
(siswa membaca buku panduan)
4. Mengasosiasi
Siswa bekerjasama dengan teman sebangku untuk menghafal deret homolog alkena sampai pada dekana. Siswa berlatih mengerjakan soal yang
5. Mengkomunikasikan
Siswa menuliskan tata nama senyawa alkena di papan tulis.
Siswa dan guru berdiskusi mengenai jawaban soal yang diberikan oleh guru. Siswa mempresentasikan hasil
diskusinya mengenai penamaan dan isomerisasi pada alkena.
Guru memberikan penilaian atas keaktifan siswa dalam mengerjakan tugas..
Penutup a. Simpulan
Siswa dengan dibimbing guru bersama-sama membuat kesimpulan mengenai penggolongan senyawa hidrokarbon berdasarkan jenis ikatan dan alkena yang meliputi deret homolog, tata
nama, isomeri, sifat dan kegunaan alkena. 5 menit
b. Evaluasi
Guru memberikan tugas kepada siswa mengenai tata nama dan isomerisasi senyawa alkena. Siswa diminta untuk mempelajari materi
selanjutnya yaitu alkuna.
c. Refleksi
Meminta umpan balik kepada peserta didik tentang kegiatan belajar yang telah berlangsung pada hari ini.
d. Penutup
H. Penilaian Hasil Pembelajaran
Aspek Prosedur Instrument Keterangan
Pengetahuan -Tes tertulis -Diskusi
-Soal evaluasi Terlampir
Godean, Agustus 2016 Mengetahui,
Guru Mata Pelajaran
Siti Martiningsih, S.Pd.
NIP 19700223 200604 2 003
Mahasiswa PPL
Fatma Septiyani
Lampiran 1
Materi Pembelajaran
A. Penggolongan senyawa hidrokarbon berdasarkan jenis ikatan
Kelompok senyawa karbon yang paling sederhana adalah hidrokarbon, yaitu senyawa karbon yang tersusun dari atom karbon dan hidrogen. Hidrokarbon yang paling sederhana adalah metana, yang terdiri dari satu atom karbon dengan empat atom hidrogen (CH4). Metana merupakan molekul yang mempunyai struktur ruang tetrahedron dengan atom karbon sebagai pusatnya, dan atom hidrogen yang terdapat pada keempat sudutnya.
Berdasarkan ikatan yang pada rantai karbonnya, hidrokarbon dibedakan menjadi:
a. Hidrokarbon jenuh, yaitu hidrokarbon yang pada rantai karbonnya semua berikatan tunggal. Hidrokarbon ini disebut juga sebagai alkana.
b. Hidrokarbon tak jenuh, yaitu hidrokarbon yang pada rantai karbonnya terdapat ikatan rangkap dua atau tiga. Hidrokarbon yang mengandung ikatan rangkap dua disebut dengan dengan alkena dan hidrokarbon yang mengandung ikatan rangkap tiga disebut alkuna.
B. Alkena
Alkena merupakan senyawa hidrokarbon tidak jenuh dengan ikatan rangkap dua (-C=C–). Alkena paling sederhana yaitu etena, C2H4. Rumus umum alkena C2H2n. Tabel berikut menyajikan deret homolog alkena.
a. Tata nama alkena 1) Alkena rantai lurus
Atom karbon yang berikatan rangkap ( - C = C -) diberi nomor yang menunjukkan ikatan rangkap tersebut. Penomoran dimulai dari ujung rantai yang paling dekat dengan ikatan rangkap.
1.Rantai utama yaitu rantai yang terpanjang dan mengandung ikatan rangkap.
2.Penomoran rantai utama diawali dari yang paling dekat dengan ikatan rangkap, bukan cabang yang terdekat.
3. Urutan penulisan nama: nomor cabang, nama cabang, nomor ikatan rangkap, nama alkena.
3) Alkena dengan lebih dari satu ikatan rangkap
Jika alkena memiliki lebih dari satu ikatan rangkap, namanya diberi tambahan diena (untuk dua ikatan rangkap) atau triena (untuk tiga ikatan rangkap).
Contoh :
menpunyai rantai utama.
Penghitungan atom C pada rantai utama dimulai dari ikatan rangkap sebelah kiri ikatan rangkap hanya ada satu pilihan sedangkan sebelah kanan ikatan rangkap ada dua pilihan yaitu lurus dan belokan pertama ke bawah, kedua-duanya sama-sama menambah 4 atom C namun bila belokan pertama kebawah hanya menghasilkan satu cabang sedangkan bila lurus menimbulkan dua cabang.
Jadi namanya : 3 etil 4 metil 1 pentena
1 pentena dapat diganti dengan n-pentena atau khusus ikatan rangkap di nomor satu boleh tidak ditulis sehingga namanya cukup : pentena. Nomor cabang diurutkan sama dengan urutan nomor ikatan rangkapnya. Pada soal di atas dari ujung sebelah kanan.
b. Isomer alkena
Alkena paling rendah yang memiliki isomer yaitu butena (C4H8). Alkena memiliki dua jenis isomer sebagai berikut.
Isomer posisi adalah senyawa-senyawa dengan rumus molekul sama, namun memiliki penataan atom yang berbeda. Alkana hanya memiliki satu jenis isomer posisi, namun alkena memiliki dua jenis perubahan penataan atom, yaitu:
1. isomer posisi di mana perubahan posisi dialami oleh ikatan rangkap, 2. isomer posisi di mana perubahan posisi dialami oleh rantai cabang. 2) Isomer geometri
Isomer geometri menjadikan ikatan rangkap sebagai sumbu. Syarat isomer geometri yaitu atom C yang berikatan rangkap harus mengikat dua gugus atom yang berlainan.
c. Sifat alkena
Sifat-sifat Umum Alkena
Hidrokarbon tak jenuh ikatan rangkap dua Alkena disebut juga olefin (pembentuk minyak)
Sifat fisiologis lebih aktif (sbg obat tidur –> 2-metil-2-butena) Sifat sama dengan Alkana, tapi lebih reaktif
Sifat-sifat : gas tak berwarna, dapat dibakar, bau yang khas, eksplosif dalam udara (pada konsentrasi 3 – 34 %)
Terdapat dalam gas batu bara biasa pada proses “cracking” 1) Sifat fisika
2) Sifat Kimia
Ikatan rangkap yang dimiliki alkena merupakan ciri khas dari alkena yang disebut gugus fungsi. Reaksi terjadi pada alkena dapat terjadi pada ikatan rangkap dapat pula terjadi diluar ikatan rangkap.
a) Oksidasi
Sebagaimana hidrokarbon pada umumnya, pembakaran/ oksidasi alkena juga akan menghasilkan CO2 dan H2O.
b) Adisi H2
Reaksi yang terjadi pada ikatan rangkap disebut reaksi adisi yang ditandai dengan putusnya ikatan rangkap (ikatan π) membentuk ikatan tunggal (ikatan α) dengan atom atau gugus tertentu.
c) Adisi halogen (F2 , Br2 , I2)
Reaksi adisi oleh halogen akan memutus rantai rangkap alkena membentuk alkana. Selanjutnya halogen tersebut akan menjadi cabang/substituen dari alkana yang terbentuk
d) Adisi asam halida
Adisi dengan asam halida akan memutus ikatan rangkap pada alkena menjadi alkana dengan mengikuti aturan Markovnikof. Atom H dari asam halida akan terikat pada atom karbon dari alkena tidak simetris yang memiliki atom H paling banyak. Jika atom C yang berikatan rangkap memiliki jumlah H yang sama, halida akan terikat pada atom C yang paling panjang. CH3 CH = CHCH3→ ikatan rangkap membagi sama banyak atom C dan atom H → simetris CH3CH 2CH = CH2→ ikatan rangkap tidak membagi sama banyak atom C dan H → tidak simetris
d. Kegunaan Alkena:
Lampiran 2
RUBRIK TES PENGETAHUAN
No Tujuan Pembelajaran
Butir Soal Skor
1. Mengelompokkan senyawa
hidrokarbon
berdasarkan jenis ikatan yang terdapat
pada rantai
karbonnya.
Jelaskan pengertian senyawa hidrokarbon dan dibagi menjadi berapa kelompok senyawa hidrokarbon tersebut berdasarkan jenis ikatan pada rantai karbonnnya?
10
2. Menuliskan rumus
umum alkena
berdasarkan analisis rumus struktur dan rumus molekul.
Apa rumus umum alkena dan bagaimana bisa didapatkan rumus umum tersebut?
10
3. Menentukan nama senyawa alkena sesuai dengan aturan IUPAC
Tuliskan nama senyawa alkana sesuai dengan aturan IUPAC yag mempunyai rumus struktur berikut:
a.
10
4. Menuliskan jumlah isomer senyawa alkena.
Tuliskan isomer rantai, posisi dan geometri dari C4H8!
30
5. Menjelaskan sifat fisis dan kimia pada alkena.
Sebut dan jelaskan sifat-sifat fisika dan kimia pada alkena
Nilai = � �ℎ �
9
Lampiran 3
Kunci Jawaban
1. Senyawa hidrokarbon adalah senyawa karbon yang tersusun dari atom karbon dan hydrogen. Berdasarkan ikatan yang pada rantai karbonnya, hidrokarbon dibedakan menjadi:
a. Hidrokarbon jenuh, yaitu hidrokarbon yang pada rantai karbonnya semua berikatan tunggal. Hidrokarbon ini disebut juga sebagai alkana.
b. Hidrokarbon tak jenuh, yaitu hidrokarbon yang pada rantai karbonnya terdapat ikatan rangkap dua atau tiga. Hidrokarbon yang mengandung ikatan rangkap dua disebut dengan dengan alkena dan hidrokarbon yang mengandung ikatan rangkap tiga disebut alkuna.
2. Rumus umum molekul alkane adalah CnH2n. Rumus tersebut didapat dengan mengamati deret homolog alkena yaitu deretan rumus molekul alkena menunjukkan bahwa pada setiap anggota yang satu ke anggota berikutnya bertambah sebanyak CH2. Jadi dengan melihat selisih antara anggota satu ke anggota berikutnya pada deret homolog alkena tersebut, maka dapat dituliskan rumus umum molekul alkena yaitu CnH2n.
3. a.
3-etil-4-metil-1-pentena 4. Isomer dari C4H8
a. Isomer rantai
CH2=CH-CH2-CH3 (1-butena) dan CH2=C-CH3 (2-metil-1-propena) 6. Menuliskan reaksi
kimia sederhana pada alkena
Tuliskan reaksi adisi yang terjadi pada alkena 10
7. Menjelskan
kegunaan dari senyawa alkena
CH3 b. Isomer posisi
CH2=CH-CH2-CH3 (1-butena) dan CH3-CH=CH-CH3 (2-butena) c. Isomer geometri
a. Cis-2-butena b. trans-2-butena 6. Sifat fisika dan kimia alkena adalah
a. Sifat fisika
Alkena memiliki sifat fisika yang sama dengan alkana. Perbedaannya yaitu, alkena sedikit larut dalam air. Hal ini disebabkan oleh adanya ikatan rangkap yang membentuk ikatan S. Ikatan S tersebut akan ditarik oleh hidrogen dari air yang bermuatan positif sebagian. Pada temperatur kamar alkena yang memiliki dua, tiga dan empat atom karbon berwujud gas. Sedangkan Alkena dengan dengan berat molekul lebih tinggi dapat berupa cair dan padatan pada suhu kamar.
b. Sifat kimia alkena
Ikatan rangkap yang dimiliki alkena merupakan ciri khas dari alkena yang disebut gugus fungsi. Reaksi terjadi pada alkena dapat terjadi pada ikatan rangkap dapat pula terjadi diluar ikatan rangkap.
a) Oksidasi
Sebagaimana hidrokarbon pada umumnya, pembakaran/ oksidasi alkena juga akan menghasilkan CO2 dan H2O.
b) Adisi H2
Reaksi yang terjadi pada ikatan rangkap disebut reaksi adisi yang ditandai dengan putusnya ikatan rangkap (ikatan π) membentuk ikatan tunggal (ikatan α) dengan atom atau gugus tertentu.
c) Adisi halogen (F2 , Br2 , I2)
Reaksi adisi oleh halogen akan memutus rantai rangkap alkena membentuk alkana. Selanjutnya halogen tersebut akan menjadi cabang/substituen dari alkana yang terbentuk
d) Adisi asam halida
panjang. CH3 CH = CHCH3→ ikatan rangkap membagi sama banyak atom C dan atom H → simetris CH3CH 2CH = CH2→ ikatan rangkap tidak membagi sama banyak atom C dan H → tidak simetris
7. Kegunaan Alkena:
Dapat digunakan sebagai obat bius (dicampur dengan O2) Untuk memasakkan buah-buahan
Lampiran 4
Lembar Pengamatan Keterampilan
No Aspek yang dinilai Skor Keterangan
1 2 3
1 Rasa ingin tahu
2 Ketekunan/ keuletan dalam belajar baik secara kelompok maupun individu dalam
menyelesaikan masalah yang ada. 3 Keberanian dalam menyampaikan
hasil diskusi di depan kelas
Rubrik
No Aspek yang dinilai Rubrik
1 Menunjukan rasa ingin tahu 3 = menunjukkan rasa ingin tahu yang aktif dalam kegiatan kelompok ketika disuruh atau kurang antusias dalam menyelesaikan masalah secara individu. 1 = tidak menunjukkan antusias dalam pengamatan, sulit terlibat aktif dalam kegiatan kelompok atau individu walaupun telah didorong untuk terlibat. 2 Ketekunan/ keuletan dalam
belajar baik secara
kelompok maupun individu dalam menyelesaikan
masalah yang ada.
3 = tekun/ulet dalam menyelesaikan tugas dengan hasil terbaik yang bisa dilakukan, berupaya tepat waktu.
2= berupaya tepat waktu dalam menyelesaikan tugas, namun belum menunjukkan upaya terbaiknya.
1= tidak berupaya sungguh-sungguh dalam menyelesaikan tugas, dan tugasnya tidak selesai.
3 Keberanian dalam
menyampaikan hasil diskusi di depan kelas
3= berani menyampaikan hasil diskusinya disertai dengan rasa percaya diri
2= berani menyampaikan hasil diskusinya namun kurang percaya diri
1= tidak berani menyampaikan hasil diskusinya dan tidak percaya diri
Pedoman penilaian :
No. Dokumen : F/751/WKS1/P/5
No. Revisi : 1
Tanggal Berlaku : 1 Juli 2016
RENCANA PELAKSANAAN PEMBELAJARAN
(RPP)
Satuan Pendidikan : SMA Negeri 1 Godean Mata Pelajaran : KimiaKelas/Semester : XI/ Gasal Materi Pokok : Hidrokarbon
Materi Pembelajaran: Struktur dan tata nama alkuna Alokasi Waktu : 2 x 45 Menit
A. Tujuan Pembelajaran
1. Mengelompokkan senyawa hidrokarbon berdasarkan jenis ikatan yang terdapat pada rantai karbonnya.
2. Menuliskan rumus umum alkuna berdasarkan analisis rumus struktur dan rumus molekul.
3. Menjelaskan konsep isomer struktur (kerangka, posisi, fungsi) dan penerapannya pada sifat senyawa alkuna.
4. Menjelaskan sifat fisis dan kimia pada alkuna. 5. Menuliskan reaksi sederhana senyawa alkuna. 6. Menjelaskan kegunaan senyawa alkuna.
7. Mempresentasikan hasil diskusinya mengenai penulisan isomer alkuna. B. Kompetensi Dasar dan Indikator Pencapaian Kompetensi
3.1. Menganalisis struktur dan sifat senyawa hidrokarbon berdasarkan pemahaman kekkhasan atom karbon dan penggolongan senyawanya.
3.1.1. Mengelompokkan senyawa hidrokarbon berdasarkan jenis ikatan yang terdapat pada rantai karbonnya.
3.1.2. Menuliskan rumus umum alkuna berdasarkan analisis rumus struktur dan rumus molekul.
3.1.3.Menentukan nama senyawa alkuna sesuai dengan aturan IUPAC.
3.1.4. Menjelaskan konsep isomer struktur (kerangka, posisi, fungsi) dan penerapannya pada sifat senyawa alkuna.
4.1Menemukan berbagai struktur molekul hidrokarbon dari rumus molekul yang sama dan memvisualisasikannya
4.1.1. Mempresentasikan hasil diskusi mengenai isomer dari alkuna. C. Materi Pembelajaran
1. Penggolongan senyawa hidrokarbon berdasarkan jenis ikatan. 2. Alkuna
a. Deret homolog alkuna b. Tata nama alkuna c. Isomer alkuna
d. Sifat dan kegunaan alkuna *Materi selengkapnya terlampir
D. Metode Pembelajaran
Metode pembelajaran : ceramah, diskusi, tanya jawab, dan penugasan
E. Media Pembelajaran
1. Media pembelajaran : Buku
2. Alat pembelajaran : Laptop, LCD, white board, dan spidol 3. Bahan pembelajaran : Bahan ajar, LKS
F. Sumber Belajar
1. Sudarmo, Unggul. 2013. Kimia untuk SMA/MA Kelas XI. Jakarta: Erlangga 2. Salirawati, Das, Fitria Meilina, Jamil Suprihatiningrum. 2007. Belajar Kimia
secara Menarik untuk SMA/MA Kelas X. Jakarta: Gramedia Widiasarana Indonesia
3. LKS kimia SMA kelas XI semester 1 : Kreativ, TIM Penyusun MIPA
G. Langkah-langkah Pembelajaran
Kegiatan Langkah Kegiatan Pembelajaran Alokasi Waktu
Pendahuluan
a. Komunikasi
1. Pendidik memberi salam
2. Pendidik mempersilahkan peserta didik duduk dan tenang untuk bersiap mengikuti pembelajaran
3. Pendidik mengajak peserta didik berdoa sebelum memulai pelajaran
4. Pendidik menanyakan kabar dan mengecek kehadiran peserta didik
b. Motivasi
“Anak-anak kemarin kita sudah belajar apa ya? Ada yang masih ingat dengan pembagian atom C berdasarkan jenis ikatan? Kemarin kita sudah belajar hidrokarbon dengan rantai rangkap 2 yang kita kenal dengan nama alkena. Untuk alkena kita kemarin sudah belajar mengenai tata nama, sifat fisika dan kimia, isomer dan kegunaannya. Nah untuk senyawa hidrokarbon dengan ikatan rangkap 3 biasanya dikenal dengan sebutan apa ya anak-anak? Apakah untuk hidrokarbon dengan rangkap 3 ini semua sifatnya sama dengan alkane dan alkena? Untuk itu pada hari ini kita akan belajar mengenai alkuna baik tata nama, sifat fisika dan kimia, isomer dan kegunaannya”.
c. Apresepsi
Guru memberikan apersepsi dengan mengaitkan materi yang sudah disampaikan sebelummnya mengenai penulisan rantai atom karbon.
Kegiatan Inti 1. Mengamati
Siswa mengamati dan mendengarkan materi yang disampaikan guru mengenai senyawa alkuna yang meliputi deret homolog, tata nama, isomeri, sifat fisika dan kimia, dan kegunaan alkuna.
Siswa mengamati bentuk struktur alkuna yang ditampilkan dilayar.
Guru menjelaskan materi pengolongan senyawa hidrokarbon berdasarkan jenis ikatan dan alkena
yang meliputi deret homolog, tata nama, isomeri, sifat fisika dan kimia, dan kegunaan alkena.
2. Menanya
Siswa bertanya tentang penjelasan materi yang belum dipahami atau informasi tambahan yang ingin diketahui.
Guru memberikan kesempatan kepada siswa lain untuk menjawab pertanyaaan yang diajukan oleh temannya. Apabila tidak ada pertanyaan guru dapat mengarahkan agar timbul pertanyaan dari siswa.
3. Mengumpulkan Informasi
Siswa menganalisis dari berbagai sumber terkait pengolongan senyawa hidrokarbon berdasarkan jenis ikatan dan alkuna yang meliputi deret homolog, tata nama, isomeri, sifat fisika dan kimia, dan kegunaan alkuna.
Siswa megumpulkan informasi untuk menyelesaikan soal yang diberikan oleh guru.
(siswa membaca buku panduan)
4. Mengasosiasi
Siswa bekerjasama dengan teman sebangku untuk menghafal deret homolog alkuna sampai pada dekana. Siswa berlatih mengerjakan soal yang
5. Mengkomunikasikan
Siswa menuliskan tata nama senyawa alkuna di papan tulis.
Siswa dan guru berdiskusi mengenai jawaban soal yang diberikan oleh guru. Siswa mempresentasikan hasil
diskusinya mengenai penamaan dan isomerisasi pada alkuna.
Guru memberikan penilaian atas keaktifan siswa dalam mengerjakan tugas..
Penutup a. Simpulan
Siswa dengan dibimbing guru bersama-sama membuat kesimpulan mengenai penggolongan senyawa hidrokarbon berdasarkan jenis ikatan dan alkuna yang meliputi deret homolog, tata
nama, isomeri, sifat dan kegunaan alkuna. 5 menit
b. Evaluasi
Guru memberikan tugas kepada siswa mengenai tata nama dan isomerisasi senyawa alkuna. Siswa diminta untuk mempelajari semua materi
karena pada pertemuan berikutnya akan diadakan ulangan harian.
Meminta umpan balik kepada peserta didik tentang kegiatan belajar yang telah berlangsung pada hari ini.
d. Penutup
Pendidik mengakhiri kegiatan pembelajaran dengan berdoa dan salam untuk menutup kegiatan pembelajaran.
H. Penilaian Hasil Pembelajaran
Aspek Prosedur Instrument Keterangan
Pengetahuan -Tes tertulis -Diskusi
-Soal evaluasi Terlampir
Godean, Agustus 2016 Mengetahui,
Guru Mata Pelajaran
Siti Martiningsih, S.Pd.
NIP 19700223 200604 2 003
Mahasiswa PPL
Fatma Septiyani
Lampiran 1
Materi Pembelajaran
A. Penggolongan senyawa hidrokarbon berdasarkan jenis ikatan
Kelompok senyawa karbon yang paling sederhana adalah hidrokarbon, yaitu senyawa karbon yang tersusun dari atom karbon dan hidrogen. Hidrokarbon yang paling sederhana adalah metana, yang terdiri dari satu atom karbon dengan empat atom hidrogen (CH4). Metana merupakan molekul yang mempunyai struktur ruang tetrahedron dengan atom karbon sebagai pusatnya, dan atom hidrogen yang terdapat pada keempat sudutnya.
Berdasarkan ikatan yang pada rantai karbonnya, hidrokarbon dibedakan menjadi:
a. Hidrokarbon jenuh, yaitu hidrokarbon yang pada rantai karbonnya semua berikatan tunggal. Hidrokarbon ini disebut juga sebagai alkana.
b. Hidrokarbon tak jenuh, yaitu hidrokarbon yang pada rantai karbonnya terdapat ikatan rangkap dua atau tiga. Hidrokarbon yang mengandung ikatan rangkap dua disebut dengan dengan alkena dan hidrokarbon yang mengandung ikatan rangkap tiga disebut alkuna.
B. Alkuna
Alkuna merupakan hidrokarbon tidak jenuh yang memiliki ikatan rangkap tiga (– C ≡ C –). Alkuna mempunyai rumus umum CnH2n-2. Alkuna paling sederhana yaitu etuna, C2H2. Deret homolog alkuna sebagai berikut.
a. Tata nama alkuna
a. Rantai utama harus terpanjang dan mengandung ikatan rangkap. b. Nomor ikatan rangkap sekecil-kecilnya
c. Rantai utama diberi nama dengan akhiran una