NINA FENTIANA
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
2009
NURHAYATI dan ELLA SALAMAH.
Salah satu penyebab kemunduran mutu ikan segar adalah proses perombakan oleh aktivitas enzim terutama enzim proteolitik yang terdapat secara alami pada ikan. Katepsin dan kolagenase merupakan enzim proteolitik yang terdapat pada jeroan ikan dan memiliki peranan penting dalam penguraian protein selama proses kemunduran mutu.
Penelitian ini terbagi empat tahap yaitu penelitian tahap 1 untuk menentukan fase post mortem ikan secara organoleptik, tahap 2 untuk mempelajari pola kemunduran mutu ikan, tahap 3 untuk mengekstraksi enzim katepsin dan tahap 4 proses ekstraksi enzim kolagenase. Pengamatan dilakukan terhadap empat kelompok ikan yaitu ikan bandeng yang dipuasakan sebelum dipanen dan disimpan pada suhu ruang (sampel A), ikan bandeng yang tidak dipuasakan dan disimpan pada suhu ruang (sampel B), ikan bandeng yang dipuasakan sebelum dipanen dan disimpan pada suhu chilling (sampel C) dan ikan bandeng yang tidak dipuasakan pada penyimpanan suhu chilling (sampel D).
Penelitian tahap 1 bertujuan untuk mengetahui waktu terjadinya fase post mortem. Penelitian tahap 2 dilakukan untuk mengetahui tingkat kesegaran ikan bandeng dengan menggunakan uji subjektif (organoleptik) dan objektif (TVB, TPC, pH), sedangkan penelitian tahap 3 dan 4 berturut-turut bertujuan untuk menentukan aktivitas enzim katepsin dan kolagenase. Uji organoleptik dilakukan setiap satu jam selama 19 jam penyimpanan suhu ruang dan setiap 12 jam selama 41 hari (971 jam) penyimpanan suhu chiling. Uji TVB, TPC, pH, assay aktivitas enzim katepsin dan kolagenase dan konsentrasi protein enzim dilakukan pada fase pre rigor, rigor, post rigor dan busuk serta sangat busuk (hanya penyimpanan suhu chilling).
Sampel A dan B mencapai fase pre rigor, rigor mortis, post rigor, dan busuk secara berturut-turut pada jam penyimpanan ke-0, 10, 15 dan 19. Sampel C dan D mencapai fase pre rigor, rigor mortis, post rigor, busuk, dan sangat busuk secara berturut-turut pada jam penyimpanan ke-0, 84, 300, 540 dan 971. Aktivitas katepsin jeroan tertinggi ditemukan pada sampel D saat fase post rigor yaitu sebesar 1,1071 U/ml, sedangkan aktivitas kolagenase jeroan tertinggi pada sampel A saat fase post rigor yaitu sebesar 0,0792 U/ml.
Hasil uji ragam (ANOVA) menunjukkan bahwa pada tingkat kepercayaan 95 % perlakuan kombinasi kondisi ikan sebelum dipanen dan suhu penyimpanan serta fase kemunduran mutu ikan (pre rigor, rigor mortis, post rigor, busuk dan sangat busuk) dari masing-masing sampel A, B, C dan D memberikan pengaruh yang berbeda nyata terhadap aktivitas katepsin dan kolagenase. Analisis korelasi linier sederhana menunjukkan bahwa aktivitas enzim (katepsin dan kolagenase) dan parameter kesegaran ikan (nilai organoleptik, pH, TVB dan TPC) memiliki hubungan yang sangat erat (r=>0,7) secara linier dalam proses kemunduran mutu dari fase pre rigor hingga post rigor dan tidak erat (r=<0,7) pada fase busuk dan sangat busuk.
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
Oleh :
Nina Fentiana
C34050150
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
2009
Nama Mahasiswa : Nina Fentiana
Nomor Pokok : C34050150
Disetujui, Komisi Pembimbing
Pembimbing I Pembimbing II
Dr. Tati Nurhayati, S.Pi, M.Si. Dra. Ella Salamah, M.Si. NIP. 132 149 436 NIP. 131 788 597
Diketahui,
Dekan Fakultas Perikanan dan Ilmu Kelautan
Dr. Ir. Indra Jaya, M.Sc NIP. 131 578 799
Dengan ini saya menyatakan bahwa skripsi saya yang berjudul “ Peranan Enzim Protease Jeroan Ikan Bandeng (Chanos chanos) Dalam Proses
Kemunduran Mutu” adalah hasil karya saya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau kutipan dari karya yang diterbitkan maupun yang tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi.
Bogor, Maret 2009 Nina Fentiana
Penulis bernama lengkap Nina Fentiana. Dilahirkan di Tembilahan pada tanggal 21 November 1987 dari pasangan Bapak Amat Daud dan Ibu Elly Sulistiawaty. Penulis adalah anak kedua dari tiga bersaudara, memiliki kakak yang bernama Yayuk Amatasari dan adik yang bernama Joehandra. Penulis mengawali pendidikan formal di SD Negeri 001 Bagansiapiapi tahun 1993 dan menyelesaikan pendidikan pada tahun 1999. Pada tahun yang sama penulis diterima di SLTPN 1 Bagansiapiapi dan menyelesaikan pendidikannya pada tahun 2002. Penulis melanjutkan pendidikan ke SMUN 1 Bangko, Bagansiapiapi dan menyelesaikannya pada tahun 2005. Pada tahun yang sama, penulis diterima menjadi mahasiswa Institut Pertanian Bogor melalui Program Beasiswa Utusan Daerah (BUD) Propinsi Riau di Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan.
Selama masa perkuliahan penulis aktif menjadi asisten Iktiologi (2007/2008), asisten Fisiologi, Formasi dan Degradasi Metabolit Sekunder Hasil Perairan (2008/2009), anggota paduan suara FPIK (2006/2009) serta menjadi pengurus dan anggota Organisasi Mahasiswa Daerah (OMDA) Riau 2005 hingga sekarang. Penulis tercatat sebagai anggota Mahasiswa Dharmasiswa Caltex (Chevron) Riau tahun 2005 hingga sekarang. Pada bulan Juli 2008 penulis melaksanakan praktek lapang di PT Lautan Niaga Jaya, Muara Baru, Jakarta Utara.
Penulis melakukan penelitian dan menyusun skripsi sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan, dengan judul “Peranan Enzim Protease Jeroan Ikan Bandeng (Chanos chanos) Dalam Proses Kemunduran Mutu”, dibawah bimbingan Ibu Dr. Tati Nurhayati, S.Pi, M.Si dan Dra. Ella Salamah M.Si.
Puji syukur penulis panjatkan kehadirat Allah SWT, karena berkat rahmat serta hidayah-Nya, penulis dapat menyelesaikan penulisan skripsi dengan judul ” Peranan Enzim Protease Jeroan Ikan Bandeng (Chanos chanos) Dalam Proses Kemunduran Mutu”. Penelitian ini berjalan atas pembiayaan dari program Hibah Bersaing 2008 atas nama Dr. Tati Nurhayati, S.Pi, M.Si. Penyusunan skripsi ini adalah sebagai syarat untuk memperoleh gelar Sarjana di Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Pada kesempatan ini penulis mengucapkan terima kasih yang sebesar-besarnya kepada semua pihak yang telah membantu dalam penulisan skripsi ini, terutama kepada:
1. Ibu Dr. Tati Nurhayati, S.Pi, M.Si dan ibu Dra, Ella Salamah, M.Si selaku komisi pembimbing, atas segala bimbingan dan pengarahan yang diberikan kepada penulis.
2. Ayah dan ibu tercinta (Bapak Amat Daud dan Ibu Elly Sulistiawaty), Kakakku Yayuk Amatasari, SE dan adikku Joehandra atas semua dukungan dan kasih sayang yang diberikan.
3. Seluruh staf dosen dan TU THP (Mas Mail, Pak Ade, Pak Jamhuri, Pak Tatang, Mba Heni, dan Umi), terima kasih atas dukungan dan bantuannya.
4. Ibu Ema (Laboran THP), Mbak Martini dan Pak Arya (Biokimia) serta Pak Wahyu (FKH) yang telah memberikan banyak sekali pembelajaran kepada penulis.
5. Pemerintah Propinsi Riau, Bupati (H. Annas Makmun) dan Wakil Bupati (H. Suyatno) Kabupaten Rokan Hilir, Pak Surya Arfan dan seluruh staf Dinas Pendidikan dan Kebudayaan Kabupaten Rokan Hilir. Trimakasih atas dukungannya hingga penulis dapat menyelesaikan pendidikan.
6. Chevron Indonesia (Darmasiswa Caltex Riau). Trimakasih atas bantuannya selama penulis menjalankan pendidikan.
melakukan penelitian.
8. Sahabat-sahabatku: Maisyah Ahmad, Hermi Apriani, Mbak Tati Yuniarti, Debi, Dewi Mariana Manurung, Stefanus Senoadi, Erdita Hasian Sianipar, Junide Mastuty, Ari Aprilan, Purwaty, Evi, teman-teman di Asrama Riau “Dang Merdu” dan THPers 42. Teman satu bimbinganku: Tyas dan Jamal. Terima kasih atas kebersamaan, bantuan, semangat dan doa nya.
9. Kakak-kakak kelasku (THP 40 dan THP 41) dan adik-adik kelasku (THP 43 dan THP 44) dan semua pihak yang telah membantu penulis selama penelitian dan penyusunan skripsi, yang tidak dapat penulis sebutkan satu persatu.
Penulis menyadari bahwa dalam penulisan skripsi ini masih banyak kekurangannya karena keterbatasan ilmu dan pengalaman penulis. Oleh karena itu penulis mengharapkan saran dan kritik yang bersifat membangun dari semua pihak demi penyempurnaan skripsi ini. Semoga skripsi ini dapat bermanfaat bagi semua pihak yang memerlukannya.
Bogor, Maret 2009 Nina Fentiana
Hal DAFTAR TABEL ... ix DAFTAR GAMBAR ... x DAFTAR LAMPIRAN ... xi 1. PENDAHULUAN ... 1 1.1 Latar Belakang ... 1 1.2 Tujuan Penelitian ... 2 2. TINJAUAN PUSTAKA ... 3
2.1 Identifikasi dan Deskripsi Ikan Bandeng (Chanos chanos) ... 3
2.2 Jeroan Ikan ... 4
2.3 Kemunduran Mutu Ikan ... 5
2.3.1 Tahapan post mortem ikan ... 5
2.3.2 Proses perubahan enzimatis (autolisis) ... 7
2.3.3 Proses perubahan karena aktivitas mikroba... 8
2.3.4 Proses perubahan karena oksidasi ... 9
2.4 Proses Penguraian Protein secara Enzimatis oleh Enzim Proteolitik.. 10
2.5 Enzim ... 13
2.5.1 Enzim katepsin ... 14
2.5.2 Enzim kolagenase ... 15
2.6 Peranan Katepsin dan Kolagenase dalam Kemunduran Mutu Ikan .... 16
3. METODOLOGI ... 18
3.1 Waktu dan Tempat Penelitian ... 18
3.2 Bahan dan Alat Penelitian ... 18
3.3 Tahapan Penelitian ... 19
3.3.1 Penentuan fase post mortem ikan secara organoleptik (BSN 2006) ... 19
3.3.2 Penentuan pola kemunduran mutu ikan ... 19
3.3.3 Ekstraksi enzim katepsin (Dinu et al. 2002) ... 20
3.3.4 Ekstraksi enzim kolagenase (Moore dan Stein 1954 diacu dalam Kim et al. 2002)... 20
3.4.4 Uji total volatile base (TVB) (Apriyantono et al. 1989) ... 23
3.4.5 Assay aktivitas katepsin (Dinu et al. 2002) ... 23
3.4.6 Assay aktivitas kolagenase (Moore dan Stein 1954 diacu dalam Park et al. 2002) ... 24
3.4.7 Pengukuran konsentrasi protein enzim (Breadford 1976) ... 25
3.5 Analisis Data ... 26
4. HASIL DAN PEMBAHASAN ... 28
4.1 Penentuan Fase Post Mortem Ikan ... 28
4.2 Pola Kemunduran Mutu Ikan ... 29
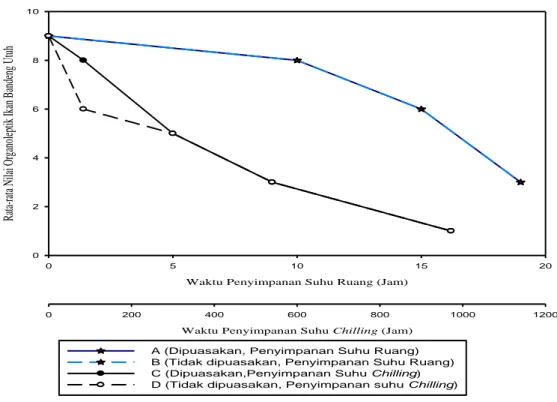
4.2.1 Penilaian organoleptik ... 30
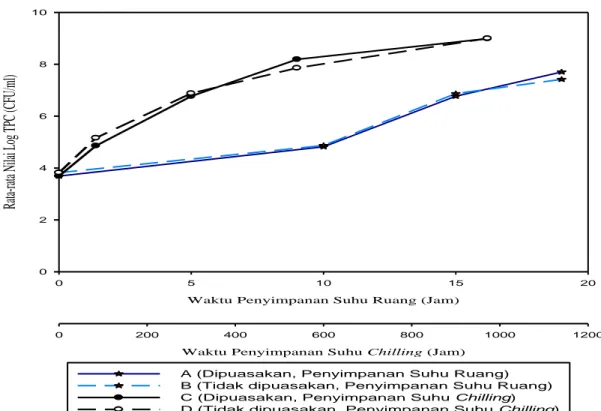
4.2.2 Nilai TPC (Total Plate Count) ... 35
4.2.3 Nilai pH ... 38
4.2.4 Nilai TVB ... 40
4.3 Aktivitas Katepsin ... 42
4.4 Aktivitas Kolagenase ... 46
4.5 Hubungan Antara Aktivitas Enzim dan Parameter Kesegaran Ikan ... 49
5. KESIMPULAN DAN SARAN ... 63
5.1 Kesimpulan ... 63
5.2 Saran ... 64
DAFTAR PUSTAKA ... 65
No Teks Hal
1. Komposisi kimia ikan bandeng (Chanos cahos) ... 4
2. Spesifikasi persyaratan mutu ikan basah... 5
3. Pengelompokan mikroorganisme berdasarkan suhu pertumbuhannya ... 9
4. Enzim proteolitik yang berhubungan dengan lisosom ikan ... 14
5. Pembuatan larutan standar BSA konsentrasi 0,1-1,0 mg/ml... 26
6. Kondisi isi perut (jeroan) ikan bandeng selama proses kemunduran mutu 33
7. Koefisien korelasi linier sederhana aktivitas enzim dan parameter kesegaran ikan pada fase pre rigor hingga busuk... 61
No Teks Hal
1. Morfologi ikan bandeng (Chanos cahos) ... 3
2. Isi perut ikan setelah dibedah ... 4
3. Rata-rata nilai organoleptik sampel A, B, C, dan D ... 30
4. Rata-rata nilai organoleptik jeroan sampel A, B, C, dan D... 32
5. Rata-rata nilai log TPC jeroan sampel A, B, C, dan D ... 36
6. Rata-rata nilai pH jeroan sampel A, B, C, dan D ... 38
7. Rata-rata nilai TVB jeroan sampel ikan A, B, C, dan D ... 41
8. Rata-rata nilai aktivitas enzim katepsin jeroan sampel A, B, C, dan D .... 43
9. Rata-rata nilai konsentrasi protein enzim katepsin jeroan sampel A, B, C, dan D ... 45
10. Rata-rata nilai aktivitas enzim kolagenase jeroan sampel A, B, C, dan D ... 46
11. Rata-rata nilai konsentrasi protein enzim kolagenase jeroan sampel A, B, C, dan D ... 48
12. Hubungan antara aktivitas enzim dan parameter kesegaran sampel A ... 50
13. Hubungan antara aktivitas enzim dan parameter kesegaran sampel B ... 51
14. Hubungan antara aktivitas enzim dan parameter kesegaran sampel C ... 52
15. Hubungan antara aktivitas enzim dan parameter kesegaran sampel D ... 53
16. Koefisien korelasi aktivitas enzim dan parameter kesegaran ikan fase pre rigor hingga post rigor sampel A ... 54
17. Koefisien korelasi aktivitas enzim dan parameter kesegaran ikan fase pre rigor hingga post rigor sampel B ... 55
18. Koefisien korelasi aktivitas enzim dan parameter kesegaran ikan fase pre rigor hingga post rigor sampel C ... 56
19. Koefisien korelasi aktivitas enzim dan parameter kesegaran ikan fase pre rigor hingga post rigor sampel D ... 57
No Hal
1a. Format uji organoleptik ikan segar (SNI 01-2346-2006) ... 71
1b. Format uji organoleptik dinding perut dan isinya (Intestine)... 73
2a. Bahan-bahan untuk ekstraksi enzim katepsin (Dinu et al. 2002) ... 74
2b. Bahan-bahan untuk ekstraksi enzim kolagenase (Moore dan Stein 1954 diacu dalam Park et al. 2002) ... 74
2c. Bahan-bahan untuk pengukuran aktivitas enzim katepsin (Dinu et al. 2002) ... 74
2d. Bahan-bahan untuk pengukuran aktivitas enzim kolagenase (Moore dan Stein 1954 diacu dalam Park et al. 2002) ... 75
3. Hasil pengujian tingkat kesegaran ikan bandeng pada penentuan pola kemunduran mutu ... 76
4. Hasil pengujian aktivitas enzim selama kemunduran mutu ... 77
5. Kurva standar penentuan konsentrasi protein ... 78
6. Dokumentasi kondisi jeroan ikan bandeng ... 80
1. PENDAHULUAN
1.1 Latar Belakang
Produksi perikanan tangkap dari penangkapan ikan di laut dan di perairan umum pada tahun 2006 masing-masing sekitar 4.468.010 ton dan 301.150 ton (Ditjen Perikanan Tangkap 2007). Produksi perikanan budidaya pada tahun 2006 mencapai 2.625.800 ton yang didominasi oleh udang 327.260 ton, rumput laut 1.079.850 ton, ikan mas 285.250 ton, bandeng 269.530 ton, nila 227.000 ton, ikan lele 94.160 ton, gurami 35.570 ton dan kerapu 8.430 ton (Ditjen Perikanan Budidaya 2007).
Ikan bandeng merupakan komoditas budidaya yang digunakan dalam beberapa jenis pemanfaatan dengan jumlah permintaan yang cukup tinggi. Data warta penelitian perikanan budidaya tahun 2005 menunjukkan kebutuhan ikan bandeng untuk konsumsi (300-500 g/ekor) sekitar 6 juta ton per tahun, sedangkan untuk keperluan umpan (80-150 g/ekor) dan induk (>4000 g/ekor) berturut-turut adalah 200 juta ekor per tahun dan 13.200 ekor per tahun.
Hasil penelitian Atjo dan Syahrun (2005) melaporkan bahwa kebutuhan ikan bandeng untuk pasar spesifik berupa rumah makan seafood, hotel, dan pasar swalayan khususnya di kota Madya Makasar diperkirakan mencapai 6 ton per hari dan saat ini baru terpenuhi 25 %. Selanjutnya, dikatakan bahwa salah satu masalah yang dihadapi adalah konsistensi mutu. Hal ini disebabkan karena ikan merupakan komoditas yang mudah busuk (highly perishable) sehingga cepat mengalami kemunduran mutu.
Salah satu penyebab kemunduran mutu ikan adalah proses perombakan oleh aktivitas enzim yang terdapat secara alami pada ikan. Enzim proteolitik merupakan salah satu enzim yang berperan penting dalam kemunduran mutu ikan yang mampu menguraikan protein menjadi pepton, polipeptida, dan asam-asam amino (Kreuzer 1965). Katepsin dan kolagenase merupakan enzim proteolitik yang terdapat pada jeroan ikan dan memiliki peranan penting dalam penguraian protein selama proses kemunduran mutu.
Pada ikan budidaya yang biasa disimpan dalam keadaan utuh, enzim-enzim dalam organ pencernaannya dapat menyerang jaringan daging yang menyebabkan pembusukan. Adanya makanan dalam perut ikan saat dipanen
menyebabkan tingginya aktivitas enzim pada saluran pencernaan yang akhirnya mendegradasi jaringan di daerah sekitar perut dan menyerang bagian tubuh ikan lainnya sehingga memperpendek umur simpan. Aktivitas proteolitik pada jeroan ikan berlangsung lebih lambat bila ikan disimpan pada suhu 0 0C atau lebih rendah. Penyimpanan ikan pada suhu rendah merupakan salah satu usaha untuk menghambat aktivitas proteolitik pada jeroan sehingga proses pembusukan menjadi terhambat dan ikan dapat disimpan lebih lama (Bihan et al. 2006).
Hidrolisis protein oleh aktivitas katepsin menyebabkan timbulnya akumulasi metabolit, perubahan citra rasa, komponen volatil serta peningkatan jumlah bakteri yang pada akhirnya menimbulkan kebusukan pada ikan (Lawrie 1985). Aktivitas kolagenase dari hepatopankreas ikan mempengaruhi tekstur setelah ikan mati sehingga jaringan daging melunak (Simpson 2000). Hal ini dapat merugikan industri pengolahan ikan karena mengakibatkan menurunnya harga ikan dan ikan menjadi tidak sehat untuk dikonsumsi. Oleh karena itu, perlu diketahui peranan aktivitas enzim dalam proses kemunduran mutu sebagai landasan dalam pengambil tindakan yang tepat pada penanganan maupun pengolahan ikan.
1.2 Tujuan Penelitian
Tujuan penelitian ini adalah :
(1) menentukan fase post mortem ikan selama penyimpanan suhu ruang dan suhu chilling;
(2) mempelajari pola kemunduran mutu ikan bandeng selama penyimpanan suhu ruang dan suhu chilling berdasarkan analisis tingkat kesegaran ikan (organoleptik, pH, TVB, TPC);
(3) menentukan aktivitas enzim katepsin dan enzim kolagenase dalam proses kemunduran mutu ikan bandeng;
(4) mengetahui korelasi aktivitas enzim terhadap parameter kesegaran ikan.
2. TINJAUAN PUSTAKA 2.1 Identifikasi dan Deskripsi Ikan Bandeng (Chanos chanos)
Klasifikasi ikan bandeng, menurut Saanin (1984) adalah sebagai berikut : Filum : Chordata
Sub filum : Vertebrata Kelas : Pisces Sub kelas : Teleostei Ordo : Malacopterigii Family : Chanidae Genus : Chanos
Spesies : Chanos chanos
Ikan bandeng termasuk ikan pemakan tumbuhan (herbivora), dapat hidup di air tawar, air payau dan air laut (Ratna 2001). Ikan bandeng mempunyai bentuk tubuh langsing dan mirip torpedo, moncong yang agak runcing, ekor bercagak, dan sisik yang halus menyebabkan ikan ini dapat bergerak dengan cepat (Mudjiman 1983). Secara lengkap morfologi ikan bandeng disajikan pada Gambar 1.
Gambar 1. Morfologi ikan bandeng (Chanos chanos) Sumber : www.google-image.com
Salah satu sifat yang mencolok dari ikan ini adalah sifat euryhalien
(tahan tehadap perubahan salinitas air), yang memungkinkannya untuk dipelihara di air payau. Ikan bandeng juga dapat dipelihara di air tawar karena sifat
euryhalinnya mampu hidup pada kisaran salinitas yang luas meskipun untuk memijah induk dan larva masih membutuhkan air asin. Bahkan pada salinitas nol per mil, ikan bandeng mampu hidup dan tumbuh besar (Susanto 2006). Ikan
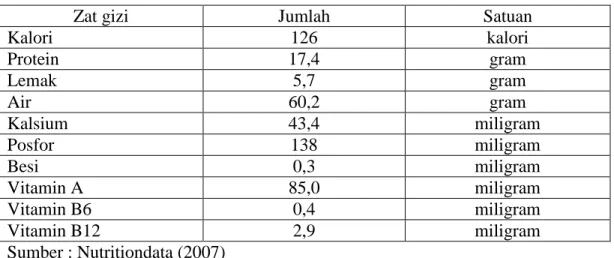
bandeng mempunyai komposisi zat gizi bernilai cukup tinggi. Kandungan masing-masing zat gizi ikan bandeng disajikan pada Tabel 1.
Tabel 1. Komposisi kimia ikan bandeng (Chanos chanos)
Zat gizi Jumlah Satuan
Kalori 126 kalori Protein 17,4 gram Lemak 5,7 gram Air 60,2 gram Kalsium 43,4 miligram Posfor 138 miligram Besi 0,3 miligram Vitamin A 85,0 miligram Vitamin B6 0,4 miligram Vitamin B12 2,9 miligram Sumber : Nutritiondata (2007) 2.2 Jeroan Ikan
Jeroan adalah bagian-bagian yang terdapat di dalam tubuh hewan yang telah dimatikan. Biasanya jeroan terdiri dari berbagai jenis organ yang terdapat di dalam rongga perut ikan yang disiangi. Menurut Hadiwiyoto (1993) organ-organ yang terlihat saat ikan disiangi adalah bladder (kandung kemih), ginjal, perut besar, usus buntu, empedu, dan instestine (usus halus). Secara lengkap letak organ-organ tersebut disajikan pada Gambar 2.
Gambar 2. Isi perut ikan setelah dibedah
Sumber : A. Aitken et al. (1992) diacu dalam Hadiwiyoto (1993)
Jeroan ikan merupakan sumber enzim protease yang tinggi terutama pada bagian pilorik kaeka dan pankreas. Enzim protease yang ditemukan adalah
trypsin, chymotrypsin, kolagenase, elastase, karboksipeptidase dan karboksil esterase (Simpson 2000).
Pada umumnya jeroan ikan dimanfaatkan sebagai makanan ternak yaitu di buat silase (Bihan et al. 2006). Pemanfaatan jeroan ikan sebagai bahan pangan di Indonesia umumnya masih sangat terbatas. Salah satu produk yang dihasilkan dikenal sebagai bekasang (Ibrahim dan Salamah 1991). Di Jepang dikenal produk fermentasi jeroan ikan yang disebut Shiokara atau Katsuono shiokara. Jeroan tersebut ditempatkan dalam tong dan ditambahkan garam sebanyak 20-30 % (Anonim 2006).
2.3 Kemunduran Mutu Ikan
Berbagai proses perubahan fisik dan biokimia terjadi dengan cepat setelah ikan mengalami kematian. Semua proses perubahan ini akhirnya mengarah pada pembusukan (Eskin 1990). Proses penurunan mutu ikan segar terutama diawali dengan proses perombakan oleh aktivitas enzim yang secara alami terdapat di dalam ikan. Proses ini disebut proses kemunduran mutu kesegaran ikan yang berlangsung hingga tahap tertentu dan disusul dengan makin berkembangnya aktivitas mikroba pembusuk yang dikenal dengan proses pembusukan (Ilyas 1983).
2.3.1 Tahapan post mortem ikan
Pada ikan segar atau produk perikanan lainnya, mutu identik dengan kesegaran. Ikan yang baru ditangkap memiliki tingkat kesegaran tinggi dan akan mengalami penurunan mutu seiring lamanya waktu penyimpanan (Ilyas 1983). Spesifikasi persyaratan mutu ikan segar dapat dilihat pada Tabel 2.
Tabel 2. Spesifikasi persyaratan mutu ikan basah (SNI 01-2729-2006)
Jenis Uji Satuan Persyaratan Mutu
a). Organoleptik Nilai min. 7 b). Cemaran mikroba 1). ALT/gr, maks 2). Escherichia coli 3). Vibrio cholerae *) koloni/gr APM/gr Per 25 gram 5 x 105 <3 Negatif
Segera setelah ikan mati, terjadi perubahan-perubahan yang dapat mengakibatkan penurunan mutu ikan. Penurunan tingkat kesegaran ikan ini terlihat dengan adanya perubahan fisik, kimia dan organoleptik pada ikan yang disebabkan oleh aktivitas enzim, mikroorganisme, fisik, dan kimiawi. Urutan proses perubahan yang terjadi setelah ikan mati, meliputi perubahan pre rigor,
rigor mortis, dan post rigor (Eskin 1990).
Fase pre rigor merupakan perubahan pertama yang terjadi ketika ikan mati. Fase ini ditandai dengan melemasnya otot-otot ikan sesaat setelah ikan mati sehingga ikan mudah dilenturkan. Pada fase ini terjadi peristiwa terlepasnya lendir dibawah kelenjar permukaan kulit yang sebagian besar terdiri dari glukoprotein dan musin yang merupakan media ideal bagi pertumbuhan bakteri. Secara biokimia ditandai dengan menurunya kadar adenosine triposfat (ATP) dan keratin fosfat (seperti pada reaksi glikolisis) (Eskin 1990).
Adenosine triposfat merupakan sumber energi tertinggi bagi aktivitas ikan. Setelah ikan mati, ATP diperoleh dari penguraian kreatin fosfat. Kemudian ATP mulai mengalami penguraian ketika kandungan kreatin fosfat dan ATP mencapai titik yang sama. Hidrolisis ATP menjadi ADP dengan bantuan enzim ATPase akan menghilangkan energi (Eskin 1990).
Energi pada jaringan otot ikan setelah ikan mati diperoleh secara anerobik dari pemecahan glikogen melalui proses glikolisis menghasilkan ATP dan asam laktat. Akumulasi asam laktat selain menurunkan pH otot, juga diikuti oleh peristiwa rigor mortis (Eskin 1990). Segera setelah ikan mati, suplai oksigen dalam jaringan berkurang sehingga terjadi perubahan glikogen menjadi asam laktat. Hal ini mengakibatkan pH tubuh ikan menurun, diikuti pula dengan penurunan jumlah adenosine triposfat (ATP) (Gopakumar 2000).
Penurunan kelenturan otot terus berlangsung seiring dengan semakin sedikitnya jumlah ATP. Hilangnya kelenturan otot ikan ini akibat ion Ca2+ yang berikatan dengan protein troponin, sehingga menyebabkan terjadinya ikatan elektrostatik antara filamen aktin dan miosin (aktomiosin) yang ditandai dengan terjadinya pengkerutan atau kontraksi serabut otot yang tidak dapat balik (irreversible). Saat konsentrasi ATP 0,1 mikro mol/gram akan terjadi rigor mortis
rigor mortis tergantung pada spesies, kondisi fisik ikan, derajat perjuangan ikan sebelum mati, ukuran, cara penangkapan, dan suhu selama penyimpanan (Eskin 1990).
Nilai pH ikan yang baru mati mendekati netral. Pada fase rigor mortis pH tubuh ikan menurun hingga sekitar 6,2-6,5. Nilai pH ikan dipengaruhi jumlah glikogen yang ada. Ikan yang mati meronta-ronta mengalami penurunan jumlah glikogen lebih cepat dan pH dapat turun hingga 5,5. Pada saat pH turun enzim katepsin menjadi aktif. Enzim ini mendegradasi garis gelap Z pada miofilamen, menghilangkan daya adhesi antara serabut-serabut otot, dan bersifat proteolitik yang melonggarkan struktur protein serat daging (Eskin 1990).
Fase terakhir post mortem ikan adalah fase post rigor. Tahap ini ditandai dengan mulai melunaknya kembali otot ikan secara bertahap (Wang et al. 1998). Proses pembusukan ikan ditandai dengan terbentuknya senyawa-senyawa basa volatil. Komponen utama total volatile base (TVB) adalah amoniak (NH3), trimetil amin (TMA), dan dimetil amin (DMA). Nukleotida utama yang berperan dalam mentransfer energi, yaitu ATP juga berperan dalam penambahan jumlah ammonia pada volatil amin setelah kematian ikan. Nukleotida ATP adalah senyawa utama pembawa energi kimia dalam sel. Kondisi anaerob setelah ikan mati akan menyebabkan ATP terurai dengan melepaskan energi (Gill 2000). ATP berubah menjadi ADP oleh enzim ATPase, kemudian diubah menjadi AMP oleh miokinase. Selanjutnya AMP diubah oleh enzim deaminase menjadi IMP dan IMP diubah menjadi inosin oleh enzim fosfatase. Kemudian inosin dengan cepat berubah menjadi hipoksantin. Deaminase AMP menjadi IMP telah melepaskan molekul ammonia (NH3) dari gugusan basa purin adenine (Eskin 1990).
2.3.2 Proses perubahan enzimatis (autolisis)
Autolisis (auto = sendiri; dan lysis = penguraian) adalah proses penguraian organ-organ tubuh ikan oleh enzim-enzim (protease dan lipase) yang terdapat di dalam tubuh ikan sendiri. Proses ini biasanya terjadi setelah ikan yang mati melewati fase rigor mortis (FAO 1995).
Autolisis dimulai dengan menurunya pH. Mula-mula protein dipecah menjadi molekul-molekul makro yang menyebabkan peningkatan dehidrasi
protein dan molekul-molekulnya pecah menjadi proteose, lalu pecah menjadi pepton, peptida dan akhirnya menjadi asam amino. Disamping asam amino, autolisis menghasilkan pula sejumlah kecil purin dan pirimidin basa yang dibebaskan pada waktu asam nukleat pecah. Bersamaan dengan itu hidrolisis lemak menghasilkan asam lemak dan gliserol (Hames dan Hooper 2005).
Bila protein dihidrolisis dengan asam, alkali atau enzim maka akan dihasilkan campuran asam-asam amino yang terdiri dari sebuah gugus amino, sebuah gugus karboksil, sebuah atom hidrogen dan gugus R yang terikat pada sebuah atom C yang dikenal sebagai karbon α, serta gugus R merupakan rantai cabang (Hames dan Hooper 2005).
2.3.3 Proses perubahan karena aktivitas mikroba
Selama ikan hidup, bakteri yang terdapat dalam saluran pencernaan, insang, saluran darah, dan permukaan kulit tidak dapat merusak dan menyerang bagian-bagian tubuh ikan. Hal ini disebabkan karena bagian-bagian tubuh ikan tersebut mempunyai batas pencegah (barrier) terhadap penyerangan bakteri. Setelah ikan mati, kemampuan barrier hilang sehingga bakteri segera masuk ke dalam daging ikan (Eskin 1990).
Akibat serangan bakteri, ikan mengalami berbagai perubahan, yaitu lendir menjadi pekat, bergetah, amis, mata terbenam, dan pudar sinarnya, serta insang berubah warna dengan susunan tidak teratur dan bau menusuk. Bakteri-bakteri tersebut menyerang tubuh ikan mulai dari insang atau luka yang terdapat pada kulit menuju jaringan daging ikan dan dari permukaan kulit menuju ke jaringan tubuh bagian dalam (Ilyas 1983).
Suhu lingkungan yang sesuai merupakan syarat utama bagi bakteri untuk hidup. Selama ikan masih hidup, suhu tubuhnya masih cukup rendah untuk menunjang pertumbuhan bakteri secara optimal. Setelah ikan mati dan proses autolisis berlangsung, suhu tubuh ikan berangsur-angsur meningkat sehingga akhirnya akan tercipta suatu kondisi yang cocok untuk pertumbuhan bakteri. Jenis bakteri yang umum ditemukan pada tubuh ikan adalah Acromobacter, Vibrio,
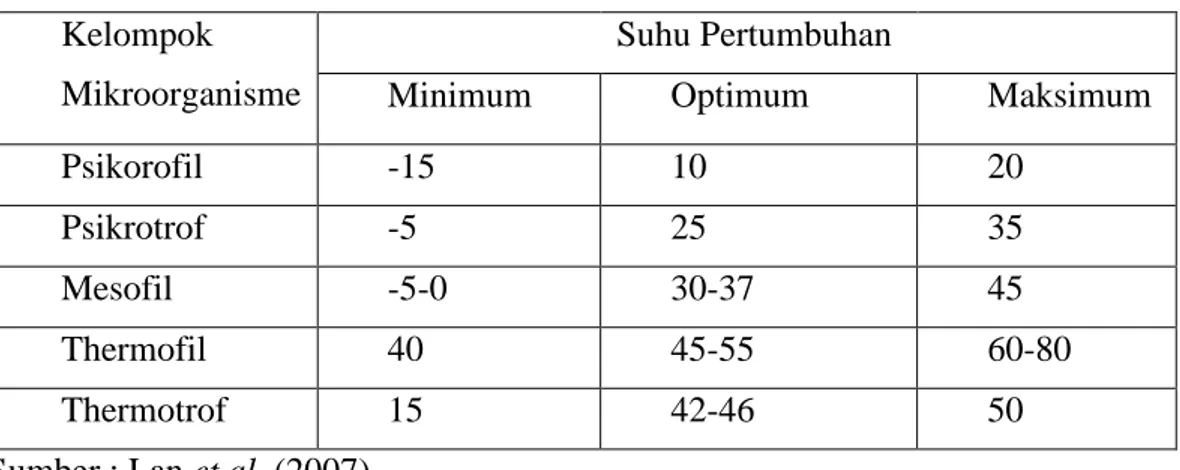
Pseudomonas, flavobacter, dan Micrococcus (Eskin 1990). Pengelompokan mikroorganisme berdasarkan suhu pertumbuhannya dapat dilihat pada Tabel 3.
Tabel 3. Pengelompokan mikroorganisme berdasarkan suhu pertumbuhannya Kelompok
Mikroorganisme
Suhu Pertumbuhan
Minimum Optimum Maksimum
Psikorofil -15 10 20
Psikrotrof -5 25 35
Mesofil -5-0 30-37 45
Thermofil 40 45-55 60-80
Thermotrof 15 42-46 50
Sumber : Lan et al. (2007)
2.3.4 Proses perubahan karena oksidasi
Proses perubahan pada ikan dapat juga terjadi karena proses oksidasi lemak sehingga timbul aroma tengik yang tidak diinginkan dan perubahan rupa serta warna daging kearah coklat kusam. Perubahan warna daging ini disebabkan oleh kandungan asam lemak tidak jenuh berantai panjang PUFA (polyunsaturated fatty acids) yang tinggi dalam tubuh (FAO 1995).
Autooksidasi dimulai dengan pembentukan radikal-radikal bebas yang disebabkan oleh faktor-faktor yang dapat mempercepat reaksi seperti cahaya, panas, peroksida lemak, adanya logam (Cu, Fe, Co, Mn) (FAO 1995). Bau tengik yang tidak sedap tersebut disebabkan oleh pembentukan senyawa-senyawa hasil pemecahan hidroperoksida. Selain itu dengan adanya air, lipida dapat terhidrolisis menjadi gliserol dan asam lemak bebas yang terbentuk. Hidrolisis dapat memacu oksidasi dan asam lemak bebas yang terbentuk dapat menyebabkan soapy flavor, yaitu bau yang menyerupai sabun (FAO 1995).
Proses oksidasi lemak menghasilkan sejumlah substansi yang dapat menyebabkan timbulnya bau dan rasa tengik yang disebut proses ketengikan. Proses ini dipercepat dengan adanya logam-logam berat, enzim-enzim lipooksidase, cahaya, dan panas. Senyawa hasil pemecahan hidroperoksida merupakan produk sekunder yang sebagian besar berupa aldehid, keton, alkohol, asam karboksilat, dan alkana yang menyebabkan timbulnya diskolorisasi atau bau tengik pada ikan (FAO 1995).
2.4 Proses Penguraian Protein secara Enzimatis oleh Enzim Proteolitik
Setelah ikan mati, banyak perubahan yang terjadi pada daging ikan, baik secara fisikawi maupun biokimiawi. Kerusakan biokimiawi disebabkan oleh adanya enzim-enzim dan reaksi-reaksi biokimiawi yang masih berlangsung pada tubuh ikan segar (FAO 1995). Pada mulanya, enzim-enzim tersebut hanya membongkar beberapa senyawa untuk menutupi kekurangan-kekurangan di dalam metabolisme. Tetapi lama-lama hal tersebut tidak dapat berlangsung terus-menerus, sehingga makin lama aktivitas enzim makin tidak terkendali lagi, enzim-enzim akan dapat membongkar senyawa apa saja yang ada. Senyawa-senyawa makromolekul akan diuraikan menjadi senyawa-senyawa yang lebih kecil sampai pada akhirnya terjadi berbagai senyawa yang mudah menguap yang baunya tidak sedap lagi (Eskin 1990).
Enzim-enzim yang berperan dalam proses enzimatis terutama adalah enzim proteolitik. Hal ini berhubungan dengan kadar protein ikan yang relatif tinggi (Dinu et al. 2002). Pada ikan air tawar yang biasa disimpan dalam keadaan utuh, enzim-enzim dalam organ pencernaannya dapat menyerang jaringan daging yang menyebabkan pembusukan. Selain itu enzim-enzim yang terdapat dalam daging dapat menimbulkan keadaan yang cocok bagi bakteri untuk berkembang biak secara optimal (Bramstedt dan Auerbach 1961). Beberapa enzim yang berperan dalam proses ini antara lain katepsin (dalam daging dan organ pencernaan), tripsin, kemotripsin, kimosin dan pepsin (dalam organ pencernaan),
serta enzim dari mikroorganisme yang terdapat dalam tubuh ikan (Bihan et al. 2006).
Proses enzimatis ikan lebih banyak dihubungkan dengan proses penguraian (hidrolisis) protein menjadi senyawa-senyawa yang lebih sederhana. Pada proses enzimatis, protein akan diuraikan menjadi pepton, polipeptida, dan asam-asam amino. Disamping itu, hidrolisis protein membentuk sedikit basa purin dan pirimidin (Kreuzer 1965). Enzim-enzim yang terlibat dalam proses penguraian protein, antara lain : katepsin, peptidase, transaminase, amidase, asam amino dekarboksilase, dan glutamat dehidrogenase. Proses penguraian protein terjadi akibat adanya penurunan pH jaringan otot karena terbentuknya asam laktat. Nilai pH yang rendah dengan bantuan ATP akan menyebabkan aktin dan miosin
bergabung membentuk aktomiosin yang relatif mudah mengalami penguraian. Hal ini menyebabkan terjadinya peristiwa rigor mortis (kekakuan) (FAO 1995).
Pembebasan dan pengaktifan katepsin selanjutnya akan menyebabkan terjadinya penguraian protein menjadi senyawa-senyawa yang lebih sederhana. Hal ini menimbulkan terjadinya akumulasi metabolit dan pembentukan senyawa- senyawa basa volatil yang berakibat terhadap kenaikan pH dan peningkatan jumlah bakteri karena senyawa-senyawa basa tersebut merupakan media yang sangat cocok bagi pertumbuhan bakteri terutama golongan bakteri pembusuk (Lawrie 1985).
Menurut Ladrat et al. (2004) pada akhir fase rigor mortis, saat hasil penguraian jaringan makin banyak, kegiatan bakteri pembusuk dengan enzimnya makin meningkat dan setelah melewati fase rigor (badan ikan mulai menjadi lembek) kecepatan pembusukan atau kemunduran mutu makin meningkat.
Dalam berbagai kajian proses pembusukan ikan, penguraian protein baru akan terjadi pada tingkat lanjut sedangkan pada tahap-tahap permulaan boleh dikatakan hampir tidak terjadi penguraian protein. Pembentukan senyawa-senyawa volatil seperti trimetilamin (TMA) pada tahap awal bukan terjadi dari protein tetapi dari senyawa lain yang bukan protein, antara lain karena penggabungan asam laktat dengan TMAO (TMA-Oksida). Dengan kata lain kecepatan penguraian senyawa makro molekul pada tahap awal masih rendah. Demikian pula senyawa-senyawa makro molekul lainnya yang mempunyai berat molekul lebih besar dari pada 5000 tidak mengalami penguraian selama tahap permulaan proses pembusukan daging ikan (Hadiwiyoto 1993).
Salah satu perubahan yang terjadi pada ikan pelagis akibat degradasi jaringan oleh aktivitas enzim adalah terjadi peristiwa belly bursting. Belly bursting merupakan hasil kecepatan degradasi jaringan yang didahului oleh
post mortem yang berlangsung pada dinding perut (abdominal) ikan pada beberapa spesies ikan pelagis (Martinez 2006).
Peristiwa belly bursting terjadi selama ikan berada pada musim makan yang tinggi, dan kadangkala degradasi jaringan yang mengakibat belly bursting
juga dapat terjadi dengan cepat beberapa jam setelah penangkapan, yaitu pada kondisi makanan cukup bagi kebutuhan ikan. Banyaknya keberadaan makanan
dalam perut ikan atau dalam usus (saluran pencernaan) ikan saat dipanen atau ditangkap menyebabkan tingginya aktivitas enzim pada saluran pencernaan ikan yang akhirnya mendegradasi jaringan disekitar perut ikan. Proses pendegradasian jaringan ini akan berlangsung cepat setelah ikan memasuki fase post mortem dan terus meningkat dengan semakin lamanya penyimpanan. Ketika ikan menuju proses pembusukan peristiwa ini terus berlangsung dengan lebih cepat (Martinez 2006).
Intensitas makan pada ikan mempengaruhi siklus biologi ikan tersebut. Ikan menggunakan energi yang diperoleh dari makanan untuk pembentukan jaringan otot dan pematangan gonad. Adanya makanan pada saluran pencernaan setelah ikan mati menyebabkan autolisis disekitar daerah perut (belly burst) yang biasanya terjadi pada ikan berukuran kecil seperti Anchovy. Peristiwa ini juga dipengaruhi oleh aktivitas enzim protease yang terdapat pada pencernaan ikan. Enzim protease yang terdapat pada perut, intestine (usus), maupun yang berasal dari bakteri akan melakukan aktivitas proteolitik pada pH asam. Pada pH diatas 6,5 degdradasi jaringan sekitar perut masih terjadi akan tetapi lebih banyak disebabkan oleh aktivitas tripsin yang berasal dari pankreas. Aktivitas protease lainnya yang berhubungan dengan belly burst pada sejumlah ikan teleostei adalah aktivitas kolagenase. Aktivitas enzim ini dipengaruhi oleh suhu. Penyimpanan ikan pada suhu rendah hingga 0 0C mampu mengurangi kecepatan degradasi jaringan sekitar perut (Sikorski dan Kolakowski 2000).
Komposisi makanan ikan mempengaruhi aktivitas proteolitik pada pencernaannya. Aktivitas proteolitik pada ikan predator lebih tinggi dari pada ikan omnivora. Aktivitas enzim protease ini dapat ditekan bila ikan mengkonsumsi detritus dalam jumlah banyak (Sikorski dan Kolakowski 2000).
Ikan dengan keadaan perut yang penuh dengan makanan sebelum ditangkap memiliki hubungan jaringan yang lemah pada otot-otot perutnya dibandingkan dengan ikan dalam kondisi lapar atau dipuasakan terlebih dahulu sebelum ditangkap. Hubungan jaringan yang lemah ini terjadi pada post mortem
dimana pH daging ikan rendah. Saat post mortem berlangsung, pH ikan akan rendah ketika ikan ditangkap dalam keadaan kenyang. Degradasi jaringan yang lebih cepat terjadi pada pH asam (Gildberg 1978).
Peristiwa belly bursting secara visual dapat diamati dengan terbentuk lubang pada daerah sekitar insang dan lubang anal. Lubang ini akan terus membesar dengan meningkatnya waktu penyimpanan dan saat ikan menuju tahap pembusukan. Semakin besar lubang yang terbentuk mengindikasikan bahwa belly bursting sudah sangat kompleks terjadi. Peristiwa ini juga merupakan satu indikator bahwa ikan sudah dalam keadaan tidak baik (busuk) (Martinez 2006). 2.5 Enzim
Enzim merupakan unit fungsional dari metabolisme sel yang bekerja dengan urutan-urutan yang teratur. Enzim mengkatalisis ratusan reaksi bertahap yang menguraikan molekul nutrein, reaksi yang menyimpan dan mengubah energi kimiawi, dan yang membuat makromolekul sel dari prekursor sederhana (Lehninger 1993).
Enzim pada saluran pencernaan ikan banyak terdapat pada hati, pankreas, perut besar, usus halus, dan ginjal. Enzim-enzim ini dapat digolongkan berdasarkan sensitivitas pH, yaitu (Simpson 2000):
(1) Proteinase asam (aspartil) yang termasuk dalam golongan enzim endoproteinase dan memiliki aktivitas tertinggi pada pH asam. Proteinase asam yang berhasil diisolasi dari perut ikan adalah pepsin, kimosin, dan gastriksin.
(2) Proteinase serin yang membutuhkan kelompok imidazol, aspartyl carboxyl, dan residu serin untuk kegiatan katalisisnya. Protease serin yang berhasil dimurnikan dari saluran pencernaan ikan adalah tripsin, kemotripsin, kolagenase dan elastase.
(3) Protease thiol (cysteine) yang membutuhkan kelompok thiol untuk kegiatan katalisisnya. Protease thiol yang terdapat pada saluran pencernaan ikan adalah katepsin B.
(4) Metalloproteinase yang merupakan enzim hidrolitik dan aktivitasnya tergantung pada ikan kation divalent dan termasuk dalam golongan enzim eksopeptidase. Metalloproteinase tidak ditemukan pada saluran pencernaan ikan tetapi terdapat pada daging.
2.5.1 Enzim katepsin
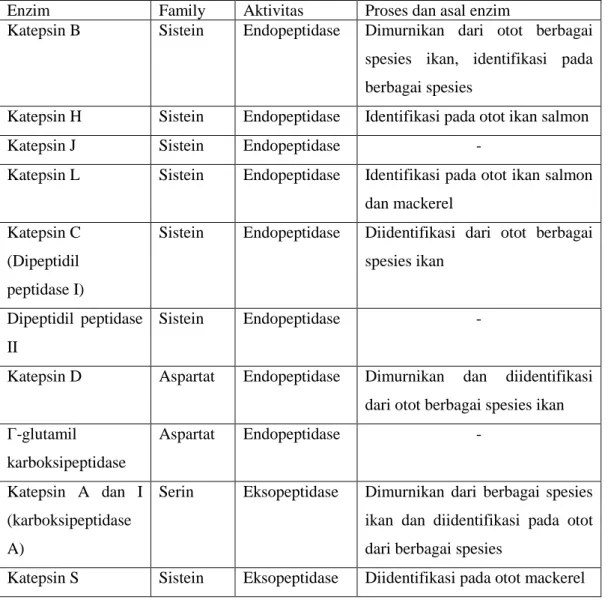
Katepsin merupakan salah satu enzim proteolitik yang ditemukan pada jaringan hewan termasuk ikan yang dapat menghidrolisis protein menjadi polipeptida. Pada jaringan otot ikan, katepsin dan enzim penghidrolisis lainnya ditempatkan dalam organel subseluler atau disebut lisosom dan dibagi dalam dua
tempat, yakni pada serabut otot dan matriks ekstraseluler (Shahidi dan Botta 1994). Berbagai jenis katepsin yang terdapat pada lisosom
disajikan pada Tabel 4.
Tabel 4. Enzim proteolitik yang berhubungan dengan lisosom ikan
Enzim Family Aktivitas Proses dan asal enzim
Katepsin B Sistein Endopeptidase Dimurnikan dari otot berbagai
spesies ikan, identifikasi pada berbagai spesies
Katepsin H Sistein Endopeptidase Identifikasi pada otot ikan salmon
Katepsin J Sistein Endopeptidase -
Katepsin L Sistein Endopeptidase Identifikasi pada otot ikan salmon
dan mackerel Katepsin C
(Dipeptidil peptidase I)
Sistein Endopeptidase Diidentifikasi dari otot berbagai
spesies ikan
Dipeptidil peptidase II
Sistein Endopeptidase -
Katepsin D Aspartat Endopeptidase Dimurnikan dan diidentifikasi
dari otot berbagai spesies ikan Γ-glutamil karboksipeptidase Aspartat Endopeptidase - Katepsin A dan I (karboksipeptidase A)
Serin Eksopeptidase Dimurnikan dari berbagai spesies
ikan dan diidentifikasi pada otot dari berbagai spesies
Katepsin S Sistein Eksopeptidase Diidentifikasi pada otot mackerel
Sumber : Goll et al. (1989) diacu dalam Shahidi dan Botta (1994)
Katepsin A dan termasuk jenis eksopeptidase dan memiliki pH optimum 5-6 serta inaktif oleh panas dan alkali (Shahidi dan Botta 1994). Katepsin B yang
memiliki ikatan polipeptida tunggal dengan berat molekul 13,6-25 kDa ditemukan pada saluran pencernaan ikan. Enzim ini memiliki aktivitas maksimum pada pH 3,5-8,0 (Simpson 2000).
Katepsin C memiliki aktivitas eksopeptidase dan mutlak memerlukan ion Cl- untuk aktivitasnya dan secara relatif spesifik untuk memisahkan residu dipeptidil dari amino terminal rantai polipeptida. Katepsin D adalah enzim peptidase yang memiliki substrat protein seperti pepsin, tetapi berbeda aktivitasnya pada substrat dengan berat molekul rendah. Katepsin D adalah glikoprotein yang memiliki aktivitas optimal pada pH 3,5. Katepsin D mendegradasi aktin dan miosin pada pH asam (Okitani et al. 1981 diacu dalam Shahidi dan Botta 1994).
Penelitian menunjukkan bahwa katepsin D ikan dapat menghidrolisis protein miofibril pada kondisi asam tetapi tidak terhidrolisis pada pH netral. Studi lainnya melaporkan bahwa adanya kontribusi katepsin D pada autolisis otot ikan. Katepsin H aktif pada pH netral, stabil terhadap panas dan menunjukkan aktivitas molekuler dengan substrat miosin. Katepsin L merupakan jenis endoprotease yang sangat aktif dalam mendegradasi protein miofibril. Katepsin L yang berhasil ditemukan pada hati ikan memiliki berat molekul 30 kDa (Simpson 2000).
Aktivitas molekular dari katepsin L dengan substrat miosin adalah 10 kali lebih besar dari pada katepsin B. Katepsin L dapat mendegradasi miofibril termasuk aktin, miosin, dan tropomiosin pada pH 6,5 dan secara khusus aktif untuk troponin serta berperan dalam pemindahan Ca2+ dari ATPase miofibril pada pH netral. Enzim proteinase ini memiliki aktivitas optimum pada suhu 40-50 0C dan pada suhu 65-70 0C enzim ini akan kehilangan aktivitasnya proteolitiknya (Shahidi dan Botta 1994).
2.5.2 Enzim kolagenase
Umumya enzim protease terdapat didalam organ dalam (isi perut) ikan terutama pada bagian organ yang berhubungan dengan pencernaan makanan. Organ tersebut misalnya lambung, usus, pyloric caeca dan kelenjer pankreas. Salah satu enzim protease yang terdapat di dalam isi perut ikan adalah enzim kolagenase (Affandi et al. 2005).
Secara umum kolagenase didefinisikan sebagai enzim yang mampu mendegradasi ikatan polipeptida. Enzim ini dibagi menjadi dua tipe yang berbeda berdasarkan fungsi fisiologinya. Serin kolagenase terlibat dalam produksi hormon dan farmakologi-peptida aktif, sebagai fungsi seluler. Fungsi tersebut meliputi pencernaan protein, penggumpalan darah, fibrinolisis, aktivasi kompleks, dan fertilisasi (Neurath 1984; Bond and van Wart diacu dalam Park et al. 2002). Enzim jenis ini secara luas digunakan dalam industri kimia, industri obat, makanan dan eksperimen biologi molekular.
Tipe kedua adalah metallokolagenase terdiri dari zinc yang mengandung enzim yang membutuhkan kalsium untuk kestabilan (Stricklin et al. 1977 diacu dalam Park et al. 2002). Metallokolagenase termasuk dalam enzim ekstraseluler yang terlibat dalam pembentukan kembali matriks ekstraseluler dengan berat molekul yang bervariasi dari 30 hingga 150 kDa (Park et al. 2002). Kolagenase aktif pada pH 6,6 hingga 8,0 dan inaktif pada pH dibawah 5,0. Kolagenase memiliki berat molekul sebesar 25.000 Da dan mampu dihambat aktivitasnya oleh DFP (Diisopropyhfluorophosphate), TLCK (N-P-toluenesulfonyl-L-lysine chloromethyl keton), dan PMSF (Penil Metil Sufonil Floride) (Simpson 2000). 2.6 Peranan Katepsin dan Kolagenase dalam Kemunduran Mutu
Ketika ikan mati (fase pre rigor) maka kondisi menjadi anaerob dan ATP terurai oleh enzim yang terdapat di dalam tubuh ikan dengan melepaskan energi. Proses ini kemudian diikuti dengan peristiwa glikolisis yang akan menguraikan glikogen menjadi asam laktat. Pembentukan asam laktat akan menyebabkan terjadinya penurunan pH, dan jaringan otot tidak mampu mempertahankan fleksibilitasnya. Kondisi inilah yang dikenal dengan istilah rigor mortis (FAO 1995). Nilai pH yang semakin menurun mengakibatkan katepsin yang terdapat dalam jaringan otot menjadi aktif (Simpson 2000).
Pengaktifan enzim katepsin selanjutnya akan menyebabkan terjadinya penguraian protein menjadi senyawa-senyawa yang lebih sederhana. Hal ini menimbulkan terjadinya akumulasi metabolit dan pembentukan senyawa-senyawa basa volatil yang berakibat terhadap kenaikan pH dan peningkatan jumlah bakteri karena senyawa-senyawa basa tersebut merupakan media yang sangat cocok bagi pertumbuhan bakteri terutama golongan bakteri pembusuk (Lawrie 1985).
Aktivitas katepsin akan memberikan pengaruh pada tekstur daging ikan karena katepsin dapat menurunkan fleksibilitas (kekenyalan) sehingga daging ikan menjadi tidak elastis dan jaringan daging ikan melunak (lembek). Daging yang melunak ini merupakan salah satu sumber masalah pada industri surimi karena katepsin dapat menurunkan kemampuan pembentukan gel dalam proses pembuatan surimi dari daging ikan akibat degradasi protein miofibril yang dapat mengurangi elastisitas dan kekuatan gel surimi (Jiang 2000).
Kolagen adalah polimer asam amino yang mempunyai residu non polar dan sebagian besar mengandung prolin dan hidroksi prolin. Matriks Metalloproteinases (MMPs) merupakan salah satu tipe enzim yang berperan dalam pendegradasian kolagen. Famili Metalloproteinases terbagi dalam empat subfamili yaitu kolagenase, gelatinase, stromelysin, dan membrane MMP. Kolagenase dan beberapa subfamili metalloproteinase mampu memecah triple helical dari kolagen yang akhirnya mendegradasi kolagen yang menghasilkan hidrolisis asam amino glysin dan leusin dari rantai α molekul kolagen. Serin kolagenase dan cistein akan mendegradasi bagian lain dari kolagen yang tidak memiliki struktur helic (Saito et al. 2000). Aktivitas kolagenase pada hati ikan mempengaruhi tekstur ikan setelah mati sehingga jaringan daging melunak (Simpson 2000).
3. METODOLOGI 3.1 Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada Bulan April sampai Bulan Juli 2008 di Laboratorium Karakteristik Bahan Baku Hasil Perairan, Laboratorium Biokimia, Laboratorium Mikrobiologi, Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Laboratorium Penelitian I, Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Laboratorium Terpadu, Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
3.2 Bahan dan Alat Penelitian
Bahan-bahan yang digunakan pada penelitian ini terdiri dari bahan utama berupa jeroan ikan bandeng (Chanos chanos) dengan ukuran 200-250 gr/ekor. Ikan bandeng yang digunakan diberi empat perlakuan yaitu ikan bandeng yang dipuasakan sebelum dipanen dan disimpan pada suhu ruang (sampel A), ikan bandeng yang tidak dipuasakan dan disimpan pada suhu ruang (sampel B), ikan bandeng yang dipuasakan sebelum dipanen dan disimpan pada suhu chilling
(sampel C) dan ikan bandeng yang tidak dipuasakan pada penyimpanan suhu chilling (sampel D). Bahan-bahan untuk analisis pH (larutan buffer standar pH 7, akuades), analisis TPC (larutan garam 0,85 % steril, nutrient agar), analisis TVB (H3BO3, K2CO3, trichloroacetic acid (TCA) 7 %, HCl 0,01 N).
Bahan-bahan untuk ekstraksi enzim katepsin adalah buffer tris HCl (pH 7,4), assay aktivitas enzim katepsin (hemoglobin HCl 1N, TCA 5 %, pereaksi folin, tirosin), pembuatan kolagen (kulit ikan bandeng dan asam asetat), ekstraksi enzim kolagenase (buffer tris-HCl (pH 8,0) yang terdiri dari 0,25 % Triton-X 100 dan 10 mM CaCl2), assay aktivitas enzim kolagenase (tris-HCl (pH 7,5) yang mengandung 5 mM CaCl2, TCA 50 % ninhydrin, 50 % 1-propanol), dan pengukuran konsentrasi protein enzim (bovine serum albumin (BSA), coomassie brilian blue G-250, etanol 95 % (v/v), asam fosfat 85 % (w/v), dan akuades.
Alat-alat yang digunakan yaitu refrigerator, inkubator (Termolina), oven (Yammato), sentifuse suhu dingin (Bed Man), spektrofotometer (Yamato), mikropipet (Pipetman), tip, timbangan analitik, homogenizer, magnetic stirrer, hot plate, pipet volumetrik, bulb, pipet tetes, tabung reaksi, cawan petri,
erlenmeyer, pH meter, kapas, tisu, aluminium foil, bunsen, beaker glass dan peralatan gelas lainnya serta peralatan uji organoleptik.
3.3 Tahapan Penelitian
Penelitian ini dilakukan dalam empat tahap, meliputi penelitian tahap 1 untuk menentukan fase post mortem ikan secara organoleptik, tahap 2 untuk mempelajari pola kemunduran mutu ikan, tahap 3 untuk mengekstraksi enzim katepsin dan tahap 4 proses ekstraksi enzim kolagenase.
3.3.1 Penentuan fase post mortem ikan secara organoleptik (BSN 2006)
Penelitian tahap ini bertujuan untuk mengetahui waktu terjadinya fase
post mortem ikan, meliputi pre rigor, rigor mortis, post rigor, dan waktu ketika pembusukan berlangsung cepat serta fase sangat busuk dimana terjadi pemecahan perut ikan atau belly bursting (pada penyimpanan suhu chilling). Pada tahap ini dilakukan penyimpanan pada suhu ruang (26-30 0C) dan suhu chiling ((-1)-5 0C). Penyimpanan pada suhu ruang dilakukan selama 19 jam dengan interval waktu pengamatan satu jam, sedangkan pada suhu chilling penyimpanan dilakukan selama 971 jam (41 hari) dengan interval waktu pengamatan 12 jam hingga ditemukannya proses pemecahan perut (belly bursting). Pengamatan dilakukan secara organoleptik menggunakan scoresheet berdasarkan SNI 01-2346-2006 (Lampiran 1a) dan scoresheet organoleptik dinding perut dan isinya (intestine) ikan segar (Laporan Penelitian Lembaga Teknologi Perikanan, No.2 1973 diacu dalam Ilyas 1983) (Lampiran 1b).
3.3.2 Penentuan pola kemunduran mutu ikan
Penentuan pola kemunduran mutu ikan bertujuan untuk mengetahui pola dan perbedaan pola kemunduruan mutu antara sampel A, B, C dan D berdasarkan analisis tingkat kesegaran ikan pada setiap tahap post mortem. Pada tahap ini dilakukan pengamatan terhadap sampel ikan berdasarkan waktu yang didapat dari hasil penentuan fase post mortem pada penelitian tahap 1. Analisis yang dilakukan pada setiap pengamatan scorsheet berdasarkan SNI 01-2346-2006 (BSN 2006),
scoresheet organoleptik dinding perut dan isinya (intestine) ikan segar (Laporan Penelitian Lembaga Teknologi Perikanan, No.2 1973 diacu dalam Ilyas 1983), uji
nilai pH (Apriyanto et al. 1989), uji total plate count (Fardiaz 1987), uji total volatil base (Apriyanto et al. 1989).
3.3.3 Ekstraksi enzim katepsin (Dinu et al. 2002)
Penelitian tahap ini bertujuan untuk memperoleh ekstrak kasar enzim katepsin yang siap digunakan dalam pengujian selanjutnya. Ekstraksi katepsin dilakukan pada sampel A, B, C dan D pada setiap tahap kemunduran mutu. Proses ektraksi katepsin dilakukan dengan metode analisis yang mengacu pada Dinu et al. 2002.
Tahap pertama dilakukan preparasi sampel untuk memperoleh ekstrak kasar protease dengan cara ikan dimatikan, kemudian perut ikan dibedah dan jeroan ikan diambil dengan cepat. Jeroan ikan disuspensikan dalam akuades dengan perbandingan jeroan ikan dan akuades sebesar 1:5, lalu dihomogenisasikan pada suhu 0-4 0C. Ekstrak daging hasil homogenisasi ini disentrifuse pada 1.000 rpm selama 10 menit dan supernatan yang diperoleh kemudian disentrifuse lagi pada 10.000 rpm selama 10 menit. Pelet yang
dihasilkan dari sentrifugasi ini kemudian dilarutkan dalam 0,1 M buffer tris HCl 7,4 (Lampiran 2a) dengan jumlah yang sama seperti jumlah akuades tadi
dan disentrifuse pada 4.000 rpm selama 10 menit. Supernatan (ekstrak kasar enzim) yang diperoleh merupakan protein utama dari mitokondria dan lisosom yang siap untuk diteliti aktivitasnya lebih lanjut.
3.3.4 Ekstraksi enzim kolagenase (Moore dan Stein 1954 diacu dalam Kim et al.
2002)
Penelitian tahap ini bertujuan untuk memperoleh ekstrak kasar enzim kolagenase yang siap digunakan dalam pengujian selanjutnya. Ekstraksi kolagenase dilakukan pada sampel A, B, C dan D pada setiap tahap kemunduran mutu.
Proses ekstraksi dilakukan dengan cara mencuci jeroan ikan bandeng dengan air dingin, dan ditambahkan dengan 100 mM buffer Tris-HCl (pH 8,0) (Lampiran 2b), dengan perbandingan bahan baku : larutan buffer adalah 1:5, kemudian dihomogenkan dengan homogenezer. Selanjutnya jeroan yang telah homogen tersebut, disentrifugasi dengan kecepatan 7.000 rpm selama 20 menit.
Setelah itu, pelet yang telah dihasilkan disentrifugasi kembali dengan kecepatan 7.000 rpm selama 20 menit menggunakan larutan buffer yang sama. Perbandingan antara bahan baku:larutan buffer sebesar 1:3. Selanjutnya supernatan yang dihasilkan ditambahkan dengan 20 mM Tris-HCl (pH 8,0) yang terdiri dari 0,36 mM CaCl2, dan didiamkan pada suhu rendah (± 4 0C) selama 48 jam. Larutan yang dihasilkan merupakan ekstrak kasar kolagenase yang akan digunakan untuk pengujian selanjutnya.
3.4 Prosedur Analisis
Sampel ikan pada setiap waktu tahap post mortem akan dilakukan analisis, meliputi analisis tingkat kesegaran ikan (penilaian organoleptik, penentuan nilai pH, perhitungan total bakteri dengan menggunakan metode TPC, perhitungan TVB), uji aktivitas katepsin, uji aktivitas kolagenase, dan pengukuran konsentrasi protein enzim.
3.4.1 Uji organoleptik (BSN 2006)
Metode yang digunakan untuk uji organoleptik adalah dengan scoresheet
berdasarkan SNI 01-2346-2006 (BSN 2006) dan scoresheet organoleptik dinding perut dan isinya (intestine) ikan segar (Laporan Penelitian Lembaga Teknologi Perikanan, No.2 1973 diacu dalam Ilyas 1983). Pengujian organoleptik merupakan cara pengujian yang bersifat subjektif menggunakan indera yang ditujukan pada mata, insang, lendir permukaan badan, daging, bau, tekstur dan isi perut (jeroan) sampel ikan. Pada uji organoleptik ini ada beberapa syarat yang harus dipenuhi oleh panelis (SNI 01-2346-2006), antara lain : tertarik dan mau berpartisipasi dalam uji organoleptik, terampil dan konsisten dalam mengambil keputusan, siap sedia pada saat dibutuhkan dalam pengujian, tidak menolak contoh yang akan diuji, berbadan sehat, bebas dari penyakit THT dan tidak buta warna (psikologis), tidak sedang merokok, serta jumlah panelis minimum untuk satu kali pengujian adalah 15 orang (panelis semi terlatih). Dari data yang diperoleh, kemudian dilakukan analisis kesegaran ikan dengan kriteria:
Segar : nilai organoleptik berkisar antara 7-9 Agak segar : nilai organoleptik berkisar antara 5-6 Tidak segar : nilai organoleptik berkisar antara 1-3
3.4.2 Nilai pH (Apriyantono et al. 1989)
Analisis derajat keasaman (pH) ditentukan menggunakan alat pH meter yang sebelumnya telah dikalibrasi terlebih dahulu. Alat pH meter dinyalakan dan dibiarkan stabil selama 15-20 menit, kemudian elektroda dibilas dengan larutan buffer atau akuades. Bila menggunakan akuades, elektroda dikeringkan dengan kertas tisu. Elektroda dicelupkan ke dalam larutan buffer dan didiamkan beberapa saat hingga diperoleh pembacaan yang stabil. Angka pH meter disesuaikan dengan pH buffer, yaitu buffer pH 4 dan buffer pH 7. Sampel sebanyak 10 gram yang diambil dari bagian dinding perut ikan dihancurkan dan dihomogenkan dengan 90 ml air destilata, lalu dibiarkan ±15 menit untuk diukur pH-nya.
3.4.3 Uji total plate count (TPC) (Fardiaz 1987)
Prinsip kerja analisis TPC adalah perhitungan jumlah bakteri yang ada di dalam sampel (jeroan ikan) dengan pengenceran sesuai keperluan dan dilakukan secara duplo. Pembuatan larutan contoh dilakukan dengan mencampurkan 10 g sampel yang telah dihancurkan yang diambil dari bagian jeroan ikan, lalu dimasukkan kedalam botol yang berisi 90 ml larutan garam 0,85 % steril, kemudian dikocok sampai larutan homogen. Campuran larutan contoh tersebut
diambil 1 ml dan dimasukkan kedalam botol berisi 9 ml larutan garam 0,85 % steril sehingga diperoleh contoh dengan pengenceran 10-2, setelah itu
dikocok agar homogen. Banyaknya pengenceran dilakukan sesuai dengan keperluan penelitian, biasanya sampai pengenceran 10-5. Pemipetan dilakukan dari masing-masing tabung pengenceran sebanyak 1 ml larutan contoh dan dipindahkan ke dalam cawan petri steril secara duplo menggunakan pipet steril. Media agar dimasukkan ke dalam cawan petri sebanyak 10 ml dan digoyangkan sampai permukaan agar merata (metode tuang), kemudian didiamkan beberapa saat hingga dingin dan mengeras. Cawan petri yang telah berisi agar dan larutan contoh dimasukkan kedalam inkubator pada suhu 30 0C selama 48 jam dengan posisi cawan petri yang dibalik. Selanjutnya dilakukan pengamatan dengan menghitung jumlah koloni yang ada di dalam cawan petri tersebut. Jumlah koloni bakteri yang dihitung adalah cawan petri yang mempunyai koloni bakteri 30-300 koloni.
3.4.4 Uji total volatile base (TVB) (Apriyantono et al. 1989)
Penetapan ini bertujuan untuk menentukan jumlah kandungan senyawa-senyawa basa volatil yang terbentuk akibat degradasi protein. Prinsip dari analisis TVB adalah menguapkan senyawa-senyawa basa volatil (amin, mono-, di-, dan trimetilamin). Senyawa tersebut kemudian diikat oleh asam borat dan kemudian dititrasi dengan larutan HCl.
Preparasi sampel dilakukan dengan cara menimbang 15 g sampel yang diambil dari jeroan ikan, kemudian ditambahkan 45 ml TCA 7 % dan dihomogenkan selama 1 menit. Hasil homogenisasi kemudian disaring sehingga diperoleh filtrat yang berwarna jernih. Setelah penyiapan sampel maka dilakukan uji TVB dengan cara memasukkan 1 ml H3BO3 ke dalam inner chamber cawan conway dan tutup cawan diletakkan dengan posisi hampir menutupi cawan. Filtrat
dimasukkan ke dalam outer chamber disebelah kiri. Kemudian 1 ml larutan K2CO3 jenuh ditambahkan ke dalam outer chamber sebelah kanan
sehingga filtrat dan K2CO3 tidak tercampur. Sebelum cawan ditutup pinggir cawan diolesi vaselin agar proses penutupan sempurna, lalu digerakkan memutar sehingga kedua cairan di outer chamber tercampur. Disamping itu dikerjakan blanko dengan prosedur yang sama tetapi filtrat diganti dengan TCA 7 %. Kedua cawan Conway tersebut diinkubasi selama 24 jam pada suhu 37 0C. Setelah diinkubasi, larutan asam borat dalam inner chamber cawan conway yang berisi blanko dititrasi dengan larutan HCl 0,01 N dan cawan digoyang-goyang sampai larutan asam borat berubah warna menjadi merah muda. Selanjutnya cawan
conway yang berisi sampel juga dititrasi dengan larutan yang sama dengan blanko. Kadar TVB dapat dihitung dengan menggunakan rumus ;
%N (mg N/100g) = (j – i) x N HCl x 100 x fp x 14 mg N/100 g g contoh 1
Keterangan :
J : ml titrasi sampel fp : factor pengenceran I : ml titrasi blanko N : normalitas HCl 3.4.5 Assay aktivitas katepsin (Dinu et al. 2002)
Aktivitas proteolitik dari katepsin diuji menggunakan hemoglobin terdenaturasi asam sebagai substratnya. Sebanyak 8 % hemoglobin dilarutkan
dalam akuades dengan perbandingan 1:3. Kemudian pH dibuat menjadi 2,0 dengan HCl 1 N dan konsentrasi akhir hemoglobin dibuat sebesar 2 % dengan akuades. Selanjutnya 1 ml dari larutan substrat diinkubasi dengan 0,2 ml larutan enzim pada 37 0C selama 10 menit. Reaksi dihentikan dengan penambahan 2 ml TCA 5 % (Lampiran 2c). Setelah 15 menit pada suhu ruang campuran disaring. Supernatan (1 ml) ditambahkan dengan 1 ml pereaksi folin dan diinkubasi pada suhu ruang selama 15 menit serta diukur absorbansinya pada 750 nm. Selain itu dilakukan pula pengukuran untuk larutan blanko dan larutan standar dengan prosedur yang sama seperti larutan sampel hanya untuk larutan blanko dan larutan standar enzimnya digantikan dengan akuades dan tirosin. Aktivitas enzim protease dapat dihitung dengan rumus berikut :
UA = Absorbansi sampel – absorbansi blanko x P x 1 Absorbansi standar – absorbansi blanko T
Keterangan : P = faktor pengenceran (5); T = waktu inkubasi (10 menit) 3.4.6 Assay aktivitas kolagenase (Moore dan Stein (1954) diacu dalam Park et al.
2002)
Aktivitas kolagenolitik dapat diukur dengan metode Moore dan Stein (1954) yang telah dimodifikasi. Sebelum dilakukan pengukuran aktivitas kolagenase terlebih dahulu dilakukan proses pembuatan kolagen sebagai substrat dengan menggunakan metode modifikasi Lestari (2005). Tahap pembuatan kolagen dari kulit ikan bandeng meliputi pembersihan dan preparasi, perendaman dalam larutan asam dan ekstraksi. Pada tahap pembersihan dan preparasi, sisa daging, lemak, dan kotoran lainnya dibersihkan kemudian dipotong dengan ukuran 8x5 cm untuk memudahkan homogenisasi saat perendaman dan ekstraksi. Kulit yang telah dipotong direndam dalam larutan asam asetat 1,5 % selama 24 jam dengan perbandingan kulit : asam asetat 1:2. Selanjutnya kulit dicuci hingga keasamannya hilang. Kulit yang telah mengembang tersebut diekstrak dalam air dengan perbandingan kulit : air sebesar 2:1. Ekstraksi dilakukan selama 3 jam pada suhu 40-50 0C. Cairan hasil ekstraksi disaring menjadi larutan kolagen.
Aktivitas kolagenolitik selanjutnya diukur dengan mereaksikan 5 ml kolagen dengan 1ml 0,05 M Tris-HCl (pH 7,5) yang mengandung 5 mM CaCl2
(Lampiran 2d) dan 0,1 ml larutan enzim diinkubasi pada suhu 37 0C selama 1 jam. Reaksi dihentikan dengan penambahan 0,2 ml 50 % TCA. Setelah 10 menit pada suhu ruang disaring dengan menggunakan kertas saring. Supernatan (0,2 ml) dicampur dengan 1,0 ml larutan ninhydrin yang diencerkan, diinkubasi pada suhu 100 0C selama 20 menit, kemudian didinginkan pada suhu kamar. Campuran tersebut diencerkan dengan 5 ml 50 % 1-propanol untuk pengukuran absorbansi dengan panjang gelombang 570 nm. Larutan buffer (50 mM Tris-HCl pH 7,5) yang mengandung 5 mM CaCl2 digunakan sebagai pengganti larutan enzim sebagai kontrol, dan larutan tirosin digunakan sebagai larutan standar enzim kolagenase. Aktivitas kolagenase dapat dihitung dengan menggunakan rumus :
UA = Absorbansi sampel – absorbansi blanko x P x 1 Absorbansi standar – absorbansi blanko T
Keterangan : P = faktor pengenceran (5); T = waktu inkubasi (60 menit)
3.4.7 Pengukuran konsentrasi protein enzim (Bradford 1976)
Konsentrasi protein ditentukan dengan menggunakan metode Bradfort dengan bovine serum albumin sebagai standar. Persiapan pereaksi Bradford dilakukan dengan cara melarutkan 25 mg coomasie brilliant blue G-250 dalam 12,5 ml etanol 95 %, lalu ditambahkan dengan 25 ml asam fosfat 85 % (w/v). Jika telah larut dengan sempurna, maka ditambahkan akuades hingga 0,5 liter dan disaring dengan kertas saring Whatman no.1 dan diencerkan lima kali sesaat sebelum digunakan.
Konsentrasi protein ditentukan menggunakan metode Bradford dengan cara 0,1 ml enzim dimasukkan kedalam tabung reaksi. Kemudian ditambahkan sebanyak 5 ml pereaksi Bradford, diinkubasi selama lima menit dan diukur dengan spektrofotometer pada panjang gelombang 595 nm. Demikian pula untuk larutan standar dilakukan sama dengan larutan sampel dengan konsentrasi antara 0,1-1,0 mg/ml. Nilai absorbansi yang didapat kemudian dimasukkan kedalam kurva standar Bradfort untuk menentukan konsentrasi protein yang terkandung dalam sampel enzim.
Larutan standar dibuat dengan cara melarutkan 100 mg protein BSA kedalam 50 ml akuades, sebagai larutan stok dengan konsentrasi 2 mg/ml. Larutan
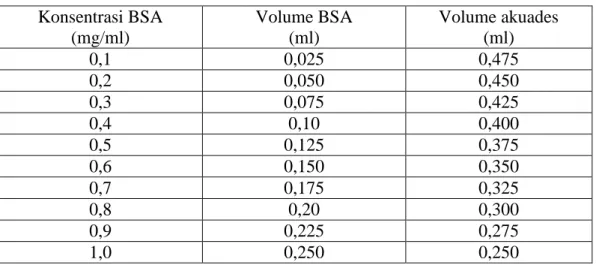
stok diencerkan menjadi beberapa larutan dengan konsentrasi yang lebih rendah yaitu 0,1-1,0 mg/ml. Tabel komposisi volume larutan dalam pembuatan larutan standar konsentrasi 0,1-1,0 mg/ml dari larutan stok BSA konsentrasi 2 mg/ml disajikan pada Tabel 5.
Tabel 5. Pembuatan larutan standar BSA konsentrasi 0,1-1,0 mg/ml Konsentrasi BSA (mg/ml) Volume BSA (ml) Volume akuades (ml) 0,1 0,025 0,475 0,2 0,050 0,450 0,3 0,075 0,425 0,4 0,10 0,400 0,5 0,125 0,375 0,6 0,150 0,350 0,7 0,175 0,325 0,8 0,20 0,300 0,9 0,225 0,275 1,0 0,250 0,250 3.5 Analisis Data
Hasil yang diperoleh dari pengamatan serta pengukuran terhadap nilai organoleptik, pH, TPC, TVB, aktivitas enzim katepsin dan kolagenase, serta konsentrasi protein enzim dicari nilai rata-ratanya. Nilai rata-rata tersebut dihitung menggunakan rumus berikut (Steel dan Torrie 1989) :
Keterangan :
X = Nilai rata-rata
N = Jumlah data
Xi = Nilai X ke-i
Analisis terhadap hubungan tingkat kesegaran ikan (TPC, TVB, dan nilai pH), nilai aktivitas enzim dan konsentrasi protein enzim dilakukan melalui uji ragam (ANOVA) berupa rancangan acak kelompok dengan 4 perlakuan (sampel A, B, C dan D) dan 5 kelompok (pre rigor, rigor mortis, post rigor, busuk dan sangat busuk). Persamaan umum model rancangan tersebut sebagai berikut:
Yij = µ + τi + βj + εij Keterangan:
Yij = nilai pengamatan pada perlakuan ke-i kelompok ke-j µ = nilai tengah populasi
n
Xi
X
n
τi = pengaruh perlakuan τ taraf ke-i βj = pengaruh kelompok β taraf ke-j
εij = galat percobaan pada perlakuan ke-i kelompok ke-j Hipotesis yang digunakan adalah :
1. Hipotesis perlakuan
a. H0 : pengaruh perlakuan tidak berbeda nyata
b. H1 : minimal ada 1 perlakuan yang memberikan pengaruh berbeda nyata 2. Hipotesis kelompok
a. H0 : pengaruh kelompok tidak berbeda nyata
b. H1 : minimal ada 1 kelompok yang memberikan pengaruh berbeda nyata Apabila pengaruh perlakuan dan kelompok berbeda nyata dengan selang
kepercayaan 95 % (P<0.05), maka diadakan uji lanjut Duncan
(Steel dan Torrie 1989).
Derajat hubungan linier antara aktivitas enzim (katepsin dan kolagenase) terhadap parameter kesegaran mutu (nilai organoleptik, pH, TVB, TPC) dilihat menggunakan koefisien korelasi linier sederhana dengan rumus (Snedecor dan Cochran 1967):
Keterangan:
x = simpangan dari rataan peubah pertama (yang mempengaruhi) y = simpangan dari rataan peubah kedua (yang dipengaruhi)
Nilai derajat korelasinya adalah: r ≥0,7 : hubungan sangat erat 0,5<r <0,7 : hubungan erat
r ≤0,5 : hubungan tidak erat
n Xi X n i1 2 2 y x xy r