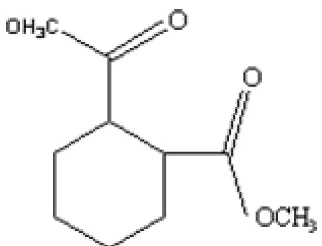
PEMBUATAN DAN KARAKTERISASI BIOPLASTIK DARI POLY-3-HIDROKSIALKANOAT (PHA) YANG DIHASILKANRalstonia
EutrophaPADA HIDROLISAT PATI SAGU DENGAN PENAMBAHAN DIMETIL FTALAT (DMF)
Oleh JUARI F34102051
2006
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
PEMBUATAN DAN KARAKTERISASI BIOPLASTIK DARI POLY-3-HIDROKSIALKANOAT (PHA) YANG DIHASILKANRalstonia
EutrophaPADA HIDROLISAT PATI SAGU DENGAN PENAMBAHAN DIMETIL FTALAT (DMF)
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN Pada Departemen Teknologi Industri Pertanian
Fakultas Teknologi Pertanian Institut Pertanian Bogor
Oleh JUARI F34102051
2006
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
INSTITUT PERTANIAN BOGOR FAKULTAS TEKNOLOGI PERTANIAN
PEMBUATAN DAN KARAKTERISASI BIOPLASTIK DARI POLY-3-HIDROKSIALKANOAT (PHA) YANG DIHASILKANRalstonia
EutrophaPADA HIDROLISAT PATI SAGU DENGAN PENAMBAHAN DIMETIL FTALAT (DMF)
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN Pada Departemen Teknologi Industri Pertanian
Fakultas Teknologi Pertanian Institut Pertanian Bogor
Oleh JUARI F34102051
Dilahirkan pada tanggal 15 Januari 1985 di Karanganyar, Jawa Tengah Tanggal lulus, 13 Oktober 2006
Disetujui
Bogor, 17 Oktober 2006
JUARI. F34102051. Pembuatan dan Karakterisasi Bioplastik dari Poly-3-Hidroksialkanoat (PHA) yang DihasilkanRalstonia eutrophapada Hidrolisat Pati Sagu dengan Penambahan Dimetil Ftalat (DMF). Dibawah bimbingan Dr. Ir. Khaswar Syamsu, MSc. 2006
Ringkasan
Sampah plastik merupakan salah satu faktor penyebab kerusakan lingkungan. Sampah plastik menjadi masalah lingkungan karena kebanyakan plastik merupakan plastik sintetis yang berasal dari minyak bumi. Plastik berbasis minyak bumi sulit diurai oleh alam baik oleh curah hujan dan panas matahari maupun oleh mikroba tanah. Selain itu minyak bumi yang dijadikan sebagai bahan baku, sifatnya tidak terbaharukan. Adanya plastik berbahan baku sumber daya terbaharukan dan bersifat biodegradable diperlukan untuk mengatasi masalah yang timbul dari penggunaan plastik berbasis minyak bumi.
Polihidroksialkanoat (PHA) merupakan poliester alami yang disintesa oleh sejumlah bakteri sebagai komponen simpanan energi dan karbon intraseluler, diakumulasi sebagai granula dalam sitoplasma sel. Polihidroksibutirat (PHB) merupakan salah satu jenis PHA yang banyak diteliti karena karakteristiknya mirip dengan polipropilen (PP). PHB dapat dihasilkan melalui proses kultivasi menggunakan bakteriRalstonia eutropha dengan glukosa sebagai sumber karbon. Penggunaan PHB sebagai bahan baku pembuatan bioplastik diharapkan dapat mengatasi masalah lingkungan yang timbul akibat penggunaan plastik berbasis minyak bumi. Bioplastik merupakan salah satu bentuk plastik yang berasal dari sumber daya hayati dan bersifat biodegradable. Bioplastik yang dibuat dari PHB mempunyai sifat lebih kaku dan rapuh. Penggunaan bahan tambahan pada proses pembuatan bioplastik dari PHB diharapkan dapat memperbaiki kekurangan tersebut.
Pemlastis adalah cairan aditif yang digunakan untuk melembutkan polimer plastik sehingga dapat merubah sifat kaku menjadi lebih fleksibel. Salah satu jenis pemlastis yang biasa digunakan adalah dimetil ftalat (DMF). Pada penelitian ini dilakukan pembuatan bioplastik dari PHA pati sagu dengan penambahan DMF sebagai pemlastis. Konsentrasi DMF yang digunakan adalah 0% (kontrol), 12,5%, 25%, 37,5%, dan 50% (b/b) dari bobot PHA. Untuk melihat pengaruh penambahan DMF maka dilakukan karakterisasi sifat mekanis, gugus fungsi, sifat termal, dan derajat kristalinitas dari bioplastik yang dihasilkan.
PHA dari hidrolisat pati sagu dapat dibuat bioplastik dengan tekniksolution casting menggunakan pelarut kloroform. Bioplastik yang dibuat dengan konsentrasi DMF 0%, 12,5%, 25%, dan 37,5% dapat terbentuk dengan baik. Sedangkan bioplastik yang dibuat dengan konsentrasi DMF 50% tidak dapat terbentuk. Bioplastik yang dihasilkan termasuk jenis film plastik dengan ketebalan sekitar 0,03 mm.
Peningkatan konsentrasi DMF menyebabkan kuat tarik bioplastik semakin menurun. Bioplastik dengan konsentrasi DMF 0%, 12,5%, 25%, dan 37,5% mempunyai kuat tarik sebesar 3,571±2,269 MPa, 3,592±2,104 MPa 3,382±2,656 MPa, dan 3,044±2,160 MPa. Peningkatan konsentrasi DMF sampai 25% menyebabkan perpanjangan putus bioplastik semakin meningkat. Namun
perpanjangan putus bioplastik menurun setelah konsentrasi DMF dinaikkan lagi menjadi 37,5%. Bioplastik dengan konsentrasi DMF 0%, 12,5%, 25%, dan 37,5% mempunyai perpanjangan putus sebesar 7,000±3,430%, 12,660±5,775%, 23,880±4,252%, dan 22,910±9,398%. Berdasarkan karakteristik mekanik tersebut dinyatakan bahwa bioplastik yang dibuat dengan konsentrasi DMF 25% adalah yang terbaik.
Bioplastik yang dibuat tanpa pemlastis (0% DMF) memiliki gugus fungsi karbonil ester (C=O), ikatan polimerik C-O-C, OH, CH, CH2, dan CH3 yang merupakan gugus fungsi dominan pada PHA jenis PHB. Penggunaan konsentrasi DMF sebesar 25% menyebabkan intensitas gugus fungsi OH pada PHA semakin melemah akibat pembentukan ikatan hidrogen antara PHA dan DMF.
Suhu pelelehan bioplastik yang dibuat tanpa pemlastis lebih tinggi dari pada bioplastik yang dibuat dengan konsentrasi DMF 25%, yaitu 168,72oC untuk bioplastik tanpa pemlastis dan 166,71oC untuk bioplastik dengan konsentrasi DMF 25%. Demikian halnya dengan derajat kristalinitas, bioplastik tanpa pemlastis mempunyai derajat kristalinitas yang lebih tinggi dari pada bioplastik dengan konsentrasi DMF 25%.
JUARI. F34102051. Production and Characterization of Bioplastic from Poly-3-Hydroxyalkanoate (PHA) Produced by Ralstonia eutropha on Hydrolyzed Sago Starch with The Addition of Dimethyl Phthalate (DMP). Supervised by Dr. Ir. Khaswar Syamsu, MSc. 2006
SUMMARY
Plastic waste is one of the factors that cause environmental damage. Plastic waste becomes an environmental issue because it is produced majority from petroleum source. Petroleum based plastics are hardly decomposed naturally by rainfall, sunlight or even by microorganisms. Besides that, petroleum is a non renewable source. Plastics from renewable sources with biodegradable characteristic are needed to solve petroleum based plastics problems.
PHA is natural polyester which is synthesized by groups of bacteria as a carbon intercellular material and it is accumulated as granules in the cell cytoplasm. PHB is a kind of PHA which has big interest of being researched because its similar characteristics with PP. PHB can be produced by cultivation process of RE bacteria using glucose as carbon source. PHB as a bioplastic source can hopely solve environmental issue caused by petroleum based plastics. Bioplastic is a plastic produced from natural source which has biodegradable characteristics. Bioplastic from PHB source has a stiff and brittle characteristic. The usage of additives can hopefully reduce the limitations of this kind of bioplastic.
Plasticizer is a liquid additive which is used to soften a polymer and can change its characteristic into a more flexible shape. One kind of plasticizer which is often be used is DMP. This research produces bioplastics from sago starch PHA with DMP as plasticizer. The DMP concentrations used in this research were 0% (control), 12.5%, 25%, 37.5%, and 50% (w/w). Mechanic, functional group, thermal and crystalline analyses were used to observe the effects of DMP addition.
PHA from hydrolyzed sago starch can be produced by solution casting technique using chloroform solvent. Bioplastic with additions of 0%, 12.5%, 25%, and 37.5% DMP can be formed well. But, with the addition of 50% DMP, plastic can not be formed. Bioplastic that is produced has 0.03 mm thickness.
The increasing of DMP concentration tend to decrease the bioplastics tensile strength. The tensile strength of bioplastics with 0%, 12.5%, 25%, and 37.5% DMP concentration were 3.571±2.269 MPa, 3.592±2.104 MPa 3.382±2.656 MPa, and 3.044±2.160 MPa. The increasing of DMP concentration until 25% causes the increasing of elongation break. But the elongation break decrease after the addition of 37.5% DMP. The elongation break of bioplastics with 0%, 12.5%, 25%, and 37.5% DMP concentration were 7.000±3.430%, 12.660±5.775%, 23.880±4.252%, and 22.910±9.398% respectively. Based on the mechanical properties, it is concluded that bioplastic with addition of 25% DMP is the best bioplastic.
Bioplastic without plasticizer addition (0% DMP), has carbonyl ester (C=O) functional group, C-O-C, OH, CH, CH2, and CH3 polymeric bonding which is the dominant functional group in PHB. The addition of 25% DMP causes the
decrease of OH functional group intensity which is caused by the hydrogen bonding between PHA and DMP.
The melting point temperature of bioplastic without plasticizer is higher than that of bioplastic with 25% DMP concentration, which is 168.72oC for bioplastic without plasticizer and 166.71oC for bioplastic with 25% DMP concentration. Crystalline degree for bioplastic without plasticizer is also higher than that for bioplastic with 25% DMP concentration.
KATA PENGANTAR
Alhamdulillahirobbil¶aalamin penulis panjatkan ke hadirat Allah SWT. Berkat ijin dan petunjuknya, penulis akhirnya mampu menyelesaikan penelitian dan berhasil menulis skripsi dengan judul “Pembuatan dan Karakterisasi Bioplastik dari Poly-3-Hidroksialkanoat (PHA) yang Dihasilkan Ralstonia eutropha pada Hidrolisat Pati Sagu dengan Penambahan Dimetil Ftalat (DMF)”. Pada kesempatan ini penulis juga mengucapkan terimakasih kepada :
1. Bapak Dr. Ir. Khaswar Syamsu, MSc atas segala bantuan, perhatian dan bimbingan yang telah diberikan selama penelitian dan penyusunan skripsi ini. 2. Bapak Dr. Ir. Ono Suparno, MT dan Ibu Dr. Ir. Endang Warsiki, MS yang
telah memberi masukkan dan koreksi pada tulisan ini.
3. Semua keluarga di kota Karanganyar tercinta (Ibu, Bapak, Mas Min, Mas Pardi, Mbak Sri, Mbak ku yang berada nun jauh disana “Mbak Harni” serta keluarga lain yang tidak dapat disebutkan satu persatu) atas investasi, semangat, perhatian, kasih sayang, doa dan wejangan selama menjalani hidup di kampus IPB Bogor.
4. Keponakanku satu-satunya “Afrand” atas kegembiraan yang muncul dari wajah imut dan cerianya.
5. Mbak Pepi, Mbak Emi, Pak Mulya, Pak Fairi serta Bapak, Ibu, Mas dan Mbak yang ada di Laboratorium Biorin, Genetika, Kultur Jaringan, dan Mikrobiologi PAU-IPB atas semua bantuan yang telah diberikan.
6. Pak Gun, Bu Ega, Pak Edi, Bu Rini, Pak Sugi, dan Bu Sri atas bantuan yang telah diberikan selama kerja di laboratorium TIN-IPB.
7. Rekan- rekan “Bioplasticers” : Dede, Vico, Dossi, Eva, Bana, Evi, MU, dan Iwal atas kebersamaan dalam menjalani pahit manis penelitian ini.
8. “Al Farabi¶s Crew” : Topan, Setyo, dan Fadiel serta teman sekamarku, Dehixs.
9. Teman-temanku : Oci, Rheni, dan Annisa.
10. “The Java¶s Community” : Hendro, Lani, Makki Bao, Farikhin, Wahyu, Ipul, Lenk Parmadi.
12. Terima kasih juga penulis sampaikan kepada semua pihak yang tidak bisa disebutkan satu per satu atas semua bantuan dan doa selama penelitian dan penyusunan skripsi ini.
Penulis menyadari bahwa tulisan ini jauh dari sebuah kesempurnaan, semoga tulisa ini bermanfaat bagi semua pihak yang membacanya.
Bogor, Oktober 2006
DAFTAR ISI
Halaman
KATA PENGANTAR...i
DAFTAR ISI...iii
DAFTAR GAMBAR...vi
DAFTAR TABEL...vii
DAFTAR LAMPIRAN...viii
I. PENDAHULUAN...1
A. LATAR BELAKANG ...1
B. TUJUAN ...2
II. TINJAUAN PUSTAKA...3
A. HIDROLISAT PATI SAGU ...3
B. POLY-3-HIDROKSIALKANOAT (PHA)...4
1. Definisi dan Klasifikasi...4
2. Ralstonia eutropha dan Biosintesis PHB ...5
3. Kultivasi PHA ...7
4. Proses Hilir PHA ...9
5. Karakteristik PHA...11
6. Aplikasi PHA...12
C. PLASTIK BIODEGRADABLE...13
1. Definisi...13
2. Proses Pembuatan PlastikBiodegradable...14
D. KARAKTERISASI PLASTIKBIODEGRADABLE...15
1. Karakterisasi Sifat Mekanik ...15
2. Karakterisasi Gugus Fungsi...16
3. Karakterisasi Sifat Termal...17
4. Karakterisasi Derajat Kristalinitas ...17
E. PEMLASTIS ...18
1. Definisi dan Karakteristik ...18
III. METODOLOGI PENELITIAN...20
A. BAHAN DAN ALAT ...20
B. METODE PENELITIAN...21
1. Persiapan Bahan Baku ...21
a. Persiapan substrat ...21
b. Kultivasi PHA secarafed-batch...23
c. Proses hilir PHA ...23
2. Pembuatan Bioplastik ...24
a. Formulasi bioplastik...24
b. Karakterisasi bioplastik ...25
c. Analisa data ...27
C. TEMPAT DAN WAKTU PENELITIAN ...27
IV. HASIL DAN PEMBAHASAN...28
A. PERSIAPAN BAHAN BAKU...28
1. Pembuatan Sirup Glukosa ...28
2. Kultivasi PHA ...29
3. Proses Hilir PHA ...31
B. PEMBUATAN BIOPASTIK ...35
1. Formulasi Bioplastik ...35
a. Teknik pembuatan bioplastik ...35
b. Penentuan ukuran bioplastik ...37
c. Penentuan jumlah kloroform ...37
d. Penentuan jumlah PHA ...38
e. Penentuan jumlah pemlastis dimetil ftalat (DMF)...40
2. Karakterisasi Bioplastik ...41
a. Kuat tarik dan perpanjangan putus ...44
b. Gugus fungsi...50
c. Sifat termal ...53
d. Derajat kristalinitas ...58
V. KESIMPULAN DAN SARAN...60
A. KESIMPULAN ...60
DAFTAR PUSTAKA...62 LAMPIRAN...67
DAFTAR GAMBAR
1. Struktur umum molekul PHA... 5
2. Struktur molekul PHB... 6
3. Lintasan umum biosintesis dan degradasi PHB oleh mikroba (Ralstonia eutropha,Azotobacter beijerinckii) ... 8
4. Kurva tegangan-regangan suatu bahan termoplastik ... 16
5. Struktur kimia dimetil ftalat ... 19
6. PHA kering hasil ekstraksi dengan NaOH atau NaOCl... 34
7. PHA hasil ekstraksi kloroform ... 35
8. Bioplastik dari PHA pati sagu ... 41
9. Proses pembentukan ikatan hidrogen antara PHA dan dimetil ftalat (DMF)... 43
10. Kurva hubungan antara konsentrasi DMF dengan kuat tarik dan perpanjangan putus bioplastik PHA pati sagu ... 45
11. Bioplastik dari PHB murni ... 48
12. Spektra FTIR bioplastik PHA pati sagu ... 51
13. Perbedaan transisi antara polimer amorf dan kristalin ... 54
DAFTAR TABEL
1. Perbandingan karakteristik fisik antara PHB dengan polipropilen... 11
2. Kelarutan PHB pada berbagai pelarut... 12
3. Aplikasi praktis PHA ... 13
4. Karakteristik hidrolisat pati sagu ... 30
5. Formulasi bioplastik pada berbagai konsentrasi pemlastis ... 40
6. Perbandingan kuat tarik dan perpanjangan putus bioplastik PHA pati sagu dan bioplastik PHB murni... 49
7. Nilai kuat tarik dan perpanjangan putus PHB dan PP ... 49
DAFTAR LAMPIRAN
1. Diagram alir pembuatan hidrolisat pati sagu ... 67
2. Prosedur analisis hidrolisat pati sagu ... 68
a. Total gula dengan metode Fenol-Sulfat ... 68
b. Total nitrogen dengan metode Kjeldahl ... 68
3. Diagram alir pembuatan bioplastik ... 70
4. Perhitungan formulasi bioplastik ... 71
5. Hasil pengukuran kuat tarik dan perpanjangan putus bioplastik dari PHA pati sagu ... 72
a. Konsentrasi DMF 0% ... 72
b. Konsentrasi DMF 12,5% ... 73
c. Konsentrasi DMF 25% ... 74
d. Konsentrasi DMF 37,5%%... 75
6. Hasil pengukuran kuat tarik dan perpanjangan putus bioplastik dari PHB murni... 76
a. Konsentrasi DMF 0% ... 76
I. PENDAHULUAN
A. Latar Belakang
Salah satu masalah lingkungan timbul ketika manusia dalam kehidupan sehari-harinya banyak menggunakan bahan plastik. Plastik yang biasa digunakan merupakan polimer sintetis dengan minyak bumi sebagai bahan dasar, ditambah bahan-bahan tambahan yang umumnya merupakan logam berat (kadmium, timbal, nikel) atau bahan beracun lainnya seperti klor. Racun dari plastik ini dapat terlepas pada saat terurai atau terbakar (Sutasurya, 2006). Minyak bumi sebagai bahan dasar plastik sintetis merupakan sumber daya tak terbaharukan. Selain itu, plastik sintetis tidak ramah lingkungan karena tidak mudah diurai oleh alam baik oleh curah hujan dan panas matahari maupun oleh mikroba tanah (Anonim, 2002). Penggunaan plastik berbahan baku sumber daya terbaharukan dan bersifat biodegradable diperlukan untuk mengatasi masalah lingkungan yang timbul dari penggunaan plastik sintetis.
Poli-3-hidroksialkanoat (PHA) merupakan salah satu alternatif bahan baku alami yang dapat digunakan untuk membuat bioplastik yang ramah lingkungan. PHA merupakan poliester yang disintesa oleh berbagai jenis bakteri dan diakumulasi sebagai cadangan energi dan karbon dalam bentuk granula di dalam sitoplasma (Lee et al., 1999). Salah satu jenis PHA adalah poli-3-hidroksibutirat (PHB). PHB merupakan bahan termoplastik dengan banyak karakteristik menarik, salah satunya adalah kemiripannya dengan polipropilen. Permintaan pasar akan bahan termoplastik yang bersifat biodegradable ini juga sangat besar (Laffertyet al., 1988).
Bioplastik adalah suatu bentuk plastik yang berasal dari sumber daya hayati yang bersifat biodegradable (Anonim, 2006). PHB merupakan salah satu jenis biopolimer yang dapat digunakan untuk membuat bioplastik. Pemanfaatan PHB sebagai bahan bioplastik dapat mengurangi masalah lingkungan yang disebabkan oleh limbah plastik sintetis. Bioplastik dari PHB lebih mudah didegradasi oleh mikroorganisme (biodegradable) dan sumber daya untuk memproduksi PHB bersifat terbaharukan. Kekurangan PHB sebagai bioplastik adalah bersifat rapuh dan kaku (Kim et al, 1994).
Penggunaan bahan tambahan seperti pemlastis pada proses pembuatan bioplastik dari PHB diharapkan dapat memperbaiki kekurangan tersebut.
Pemlastis adalah cairan aditif yang digunakan untuk melembutkan polimer plastik sehingga dapat merubah sifat kaku menjadi fleksibel (Allcock dan Lampe, 1981). Ester ftalat merupakan kelompok pemlastis yang biasa digunakan untuk menghasilkan film plastik yang fleksibel, salah satu jenisnya adalah dimetil ftalat. Dimetil ftalat merupakan pemlastis yang bersifat larut dalam alkohol, eter dan kloroform. Titik didih dimetil ftalat antara 134-138oC. Penampakan dimetil ftalat adalah cairan tidak berwarna dan tidak berbau (Merck, 1999). Penambahan dimetil ftalat pada proses pembuatan bioplastik dari PHB diharapkan dapat menghasilkan bioplastik yang lebih fleksibel.
B. Tujuan
1. Mendapatkan formulasi yang tepat untuk menghasilkan bioplastik dari PHA dengan penambahan dimetil ftalat sebagai pemlastis.
2. Menganalisa pengaruh konsentrasi dimetil ftalat dengan melakukan karakterisasi terhadap bioplastik yang dihasilkan.
II. TINJAUAN PUSTAKA
A. Hidrolisat Pati Sagu
Indonesia merupakan pemilik areal sagu terbesar di dunia. Luas areal sagu di Indonesia sekitar 1,128 juta ha atau 51,3% dari 2,201 juta ha areal sagu dunia disusul Papua New Guinea 43,3% (Abner dan Miftahorrahman, 2002). Produktivitas pati sagu kering mencapai 25 ton/ha/tahun, lebih banyak dibanding ubi kayu yang hanya 1,5 ton/ha/tahun, kentang sebesar 2,5 ton/ha/tahun maupun jagung sebesar 5,5 ton/ha/tahun (Haryadi, 2004). Sentra penanaman sagu di Indonesia adalah Papua, Maluku, Riau, Sulawesi Tengah dan Kalimantan. Papua merupakan daerah yang mempunyai areal sagu paling besar, yaitu 90% dari luas areal sagu di Indonesia. Pemanfaatan sagu di Indonesia hanya 10% dari potensi yang ada (Abner dan Miftahorrahman, 2002).
Bagian terpenting dari sagu adalah batang. Batang sagu merupakan tempat penyimpanan cadangan makanan (karbohidrat) yang dapat menghasilkan pati. Sagu dapat dipanen untuk diambil patinya pada umur 11 tahun. Pati sagu dapat diperoleh dengan cara melakukan ekstraksi terhadap batang sagu (Haryanto dan Pangloli, 2002).
Pati merupakan homopolimer glukosa dengan ikatan Į-glikosidik. Pati terdiri dari dua fraksi yang dapat dipisahkan dengan air panas, fraksi yang terlarut disebut amilosa sedangkan yang tidak larut disebut amilopektin. Amilosa mempunyai struktur rantai lurus dengan ikatan Į-(1,4)-D-glukosa sedangkan amilopektin selain mempunyai rantai lurus juga mempunyai cabang dengan ikatan Į-(1,6)-D-glukosa sebanyak 4-5% dari berat total (Winarno, 1989).
Sirup glukosa adalah cairan jernih dan kental dengan komponen utama glukosa dan diperoleh dari proses hidrolisis pati dengan cara kimia atau enzimatik (SNI 01-2978-1992). Hidrolisis pati secara kimiawi dengan menggunakan asam lebih mudah dilakukan dibandingkan secara enzimatis. Peralatan yang diperlukan juga tidak terlalu rumit. Namun timbul beberapa masalah, seperti peralatan yang digunakan harus tahan korosi dan DE
(dextrose equivalent) yang dihasilkan lebih rendah dibanding hidrolisis secara enzimatis (Berghmans, 1981).
Hidrolisis pati secara enzimatis terdiri dari dua tahap, yaitu likuifikasi dan sakarifikasi. Likuifikasi terjadi setelah gelatinisasi dengan adanya aktifitas enzim Į-amilase yang memecah ikatan Į-(1,4)-glikosidik di bagian dalam rantai polisakarida secara acak menghasilkan oligosakarida yang mengandung 6-7 maltosa. Sakarifikasi dengan enzim amiloglukosidase (AMG) selanjutnya akan memutuskan rantai molekul maltosa menjadi glukosa bebas. Tidak seperti likuifikasi yang hanya memakan waktu sekitar 60 menit, sakarifikasi biasanya memakan waktu yang lebih lama yaitu 24-96 jam (Fullbrook di dalam Dzieldzic dan Kearsley, 1984).
Berdasarkan penelitian Akyuni (2004) tentang produksi sirup glukosa melalui hidrolisis pati sagu secara enzimatis, nilai DE tertinggi (50,83) pada tahap likuifikasi diperoleh pada konsentrasi Į-amilase 1,75 U/g pati dan waktu likuifikasi 210 menit. Sedangkan pada tahap sakarifikasi, nilai DE tertinggi (98,99) diperoleh pada konsentrasi amiloglukosidase 0,3 U/g pati dan waktu sakarifikasi 48 jam.
B. Poly-3-Hidroksialkanoat (PHA)
1. Definisi dan Klasifikasi
Poli-3-hidroksialkanoat (PHA) merupakan poliester hidroksialkanoat yang disintesa oleh sejumlah bakteri sebagai komponen simpanan energi dan karbon intraseluler, diakumulasi sebagai granula dalam sitoplasma sel (Lee, 1996). PHA secara umum dibagi menjadi 2 kelas utama, yaitu PHA rantai pendek atau short-chain-length PHA (SCL-PHA) dan PHA rantai menengah atau medium-chain-length PHA (MCL-PHA). PHA rantai pendek monomernya mengandung asam 3-hidroksi dari 3 sampai 5 atom karbon pada rantainya. Sedangkan PHA rantai menengah monomernya mengandung asam 3-hidroksi dari 6 sampai 16 atom carbon pada rantainya (Anderson dan Dawes, 1990). PHA rantai pendek dengan karakteristik paling baik adalah polihidroksibutirat (PHB) yang merupakan homopolimer asam 3-hidroksibutirat. Contoh PHA rantai pendek yang lain adalah
polihidroksivalerat (PHV) dengan 5 atom karbon. Ralstonia eutropha merupakan bakteri yang dapat mensintesis PHB. Sedangkan PHA rantai menengah biasa disintesis oleh kelompokPseudomonas, sepertiPseudomonas oleovorans dan Pseudomonas aeruginosa (Poirier et al., 2001). Struktur umum PHA dapat dilihat pada Gambar 1.
Penamaan PHA ditentukan berdasarkan gugus alkil R pada unit monomer penyusunnya. Disebut PHB (poli-3-hidroksibutirat) jika R adalah CH3 (metil), PHV (poli-3-hidroksivalerat) jika R adalah CH2CH3 (etil), PHC hidroksikaproat) jika R adalah n-propil, PHH (poli-3-hidroksiheptanoat) jika R = butil, PHO (poli-3-hidroksioktanoat) jika R = n-pentil, PHN hidroksinanoat) jika R=n-heksil, PHD (poli-3-hidroksidekanoat) jika R = n-heptil, PHUD (poli-3-hidroksi undekanoat) jika R = n-oktil dan PHDD (poli-3-hidroksidodekanoat) jika R = n-nonil (Atkinson dan Mavituna, 1991; Brandlet al., 1990).
2. Ralstonia eutropha dan Biosintesis PHB
Terdapat lebih dari 300 jenis mikroorganisme yang dapat mensintesis PHA (30-80% dari berat kering selnya) namun hanya sejumlah bakteri termasuk Alcaligenes eutrophus, Alcaligenes latus, Azotobacter venelandii, Chromobacterium violaceum, metilotrof, pseudomonas, dan rekombinan E. coli yang prospektif digunakan dalam komersialisasi produksi PHA karena produktifitasnya lebih besar dari 2 g/L/jam (Lee, 1996; Lee dan Choi, 2001).
Berdasarkan kajian sekuens dan hibridisasi 16S RNA, Alcaligenes eutrophus sekarang dikelompokkan ke dalam genus Ralstonia dengan nama baru Ralstonia eutropha (Klem, 1999 di dalam Robinson et al., 2000). R. eutropha termasuk bakteri gram negatif, aerob obligat, motil, suhu optimum
O
R O
O n
PHA rantai pendek R = H, CH3, CH2CH3 PHA rantai menengah R = (CH2)2CH3–(CH2)8CH3
20-37oC, koloni pada NA (Nutrient Agar) tidak berwarna, termasuk oksidase positif dan katalase positif, tidak memproduksi indol, kemoorganotrofik atau dapat menggunakan berbagai macam asam organik dan asam amino sebagai sumber karbon, dapat mereduksi NO3-menjadi NO2- dan dapat tumbuh secara anaerobik dengan adanya NO3-. Habitat alaminya adalah tanah dan air tapi juga dapat ditemukan pada usus vertebrata (John et al., 1994).
Menurut Ayorindeet al. (1998), galur bakteri dan sumber karbon yang digunakan sangat berpengaruh terhadap PHA yang dihasilkan. Ralstonia eutropha dapat memproduksi PHB (poli-ȕ-hidroksibutirat) menggunakan glukosa dan PHV (poli-ȕ-hidroksivalerat) menggunakan glukosa dan asam propionat.
PHB dapat disintesa oleh Ralstonia eutropha jika salah satu elemen nutrisi seperti N, P, S, O atau Mg ada dalam jumlah terbatas namun sumber karbon ada dalam jumlah berlebih (Lee dan Choi, 2001). Sumber karbon yang dapat digunakan untuk pertumbuhannya adalah glukosa (mutan), D-fruktosa, D-glukonat, asetat, adipat, itakonat (John et al., 1994). Bailey dan Ollis (1991) menyatakan bahwa PHB merupakan polimer cadangan makanan bagi bakteri. Polimer ini terbentuk sebagai granula-granula di dalam sel. Saat pasokan nutrisi tidak memadahi, sel-sel akan memecah cadangan makanan ini sehingga menghasilkan asam ȕ-hidroksibutirat yang bersifat dapat larut dan mudah dicerna. Struktur molekul PHB dapat dilihat pada Gambar 2.
Pada R. eutropha terdapat operon tunggal yang mengandung 3 jenis gen yang diperlukan untuk sintesis PHB, yaitu phbA, phbB dan phbC. PhbA (suatu ketothiolase) bergabung dengan dua molekul asetil-KoA untuk menghasilkan asetoasetil-KoA yang kemudian direduksi menjadi R-ȕ
-O O n CH3 | CH CH2 O || C
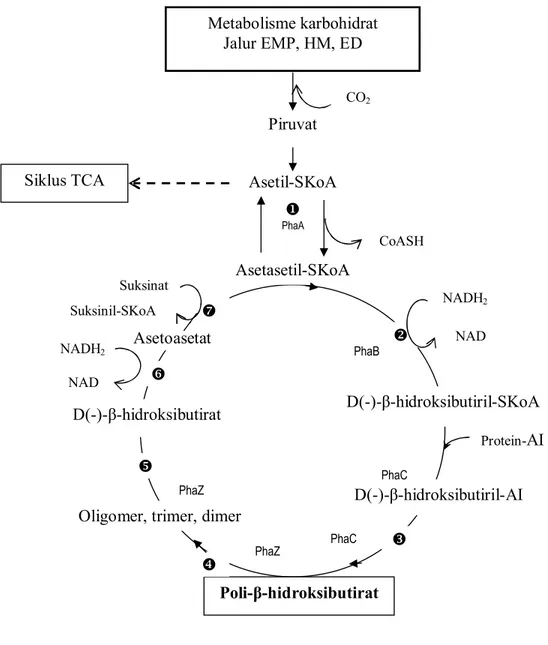
hidroksibutiril-KoA oleh phbB (yaitu suatu reduktase asetosetil-CoA yang membutuhkan NADPH). Molekul R-ȕ-hidroksibutiril-KoA membentuk unit monomer PHB, kemudian dipolimerisasi melalui ikatan ester oleh phbC (suatu PHB sintase). Pada lingkungan yang kaya, PHB secara enzimatis didegradasi menjadi asetil-KoA yang masuk ke jalur primer metabolisme dan dimineralisasi menjadi CO2. Degradasi dimulai oleh depolimerase yang dikode sebagai gen phbZ (Klem, 1999). Jalur metabolisme dan degradasi PHB olehRalstonia eutropha dari karbohidrat dapat dilihat pada Gambar 3.
3. Kultivasi PHA
Kultivasi PHA merupakan suatu proses pertumbuhan biomassa sel dan akumulasi biopolimer PHA. Menurut Kessler et al. di dalamScheper (2001), proses kultivasi PHA terdiri dari 2 tahap, yaitu produksi biomassa dan akumulasi polimer PHA. Tahap produksi biomassa merupakan tahap perkembangbiakan sel pada kondisi pertumbuhan seimbang. Sedangkan tahap akumulasi polimer PHA merupakan tahap akumulasi polimer cadangan pada kondisi nutrisi terbatas.
Kultivasi PHA dengan produktivitas danyield yang tinggi harus dapat dilakukan dengan biaya yang murah. Salah satu metode yang dapat dilakukan adalah dengan menentukan jenis kultivasi yang akan dilakukan. Kultivasi dapat dilakukan dengan sistem batch (curah), fed-batch (terumpani) atau continuous(sinambung).
Sistem fed-batch banyak diterapkan terutama untuk memicu peningkatan akumulasi PHA di dalam sel. Pada saat pergantian operasi dari batch ke fed-batch, densitas biomassa telah mencapai level yang tinggi dan konsentrasi substrat kunci menurun dan hampir habis. Level substrat pembatas yang rendah tersebut dipertahankan dengan pengumpanan perlahan substrat berkonsentrasi tinggi secara konstan (Nielsen dan Villadsen 1993). Terkait dengan penggunaan glukosa sebagai sumber karbon bagi Ralstonia eutropha, beberapa strategi pengumpanan substrat telah dikembangkan selama kultivasi fed-batch untuk menjaga konsentrasi glukosa agar tetap berada dalam rentang yang optimal bagi akumulasi PHB (Lee dan Choi 2001).
Keterangan :
ȕ-ketothiolase (ȕ-ketoasilthiolase, asetoasetil-KoA, asetasetil-KoA thiolase) Asetasetil-KoA reduktase
PHB polimerase (PHB sintetase) PHB hidrolase
Dimer hidrolase
ȕ-hidroksibutirat dehidrogenase
Thiophorase (asetasetil-SKoA thiokinase; Asetoasetat-suksinil-KoA transferase) EMP : jalur glikolisis Embden-Meyerhof-Parnas
HM : jalur Heksosa Monofosfat ED : jalur Entner-Doudoroff
Gambar 3. Lintasan umum biosintesis dan degradasi PHB oleh mikroba (Ralstonia eutropha,Azotobacter beijerinckii) (Laffertyet al., 1988).
Metabolisme karbohidrat Jalur EMP, HM, ED Asetil-SKoA Asetasetil-SKoA Poli-ȕ-hidroksibutirat D(-)-ȕ-hidroksibutirat Asetoasetat Piruvat CO2 PhaA CoASH D(-)-ȕ-hidroksibutiril-SKoA D(-)-ȕ-hidroksibutiril-AI Oligomer, trimer, dimer
NADH2 NAD Protein-AI NADH2 NAD Suksinat Suksinil-SKoA Siklus TCA PhaB PhaC PhaC PhaZ PhaZ
Atifah (2006) telah melakukan penelitian untuk memproduksi PHA melalui kultivasibatch danfed-batchdengan bakteriRalstonia eutropha. Pada penelitian tersebut digunakan sumber karbon dari hidrolisat pati sagu dengan nitrogen sebagai substrat pembatas. Ralstonia eutropha tumbuh paling baik pada konsentrasi gula awal 30 g/L dengan laju pertumbuhan spesifik maksimal 0,108/jam dan rendemen molekuler (Yx/s) sebesar 0,227 g sel/g gula. Masih menurut Atifah (2006), kultivasi fed-batch dengan jenis umpan hidrolisat pati sagu paling efektif diterapkan untuk meningkatkan konsentrasi PHA dan rendemen PHA di dalam sel meskipun tidak efektif untuk meningkatkan konsentrasi sel. Konsentrasi PHA dan rendemen PHA di dalam sel dapat meningkat lebih dari dua kali lipat (3,72 g/L atau 76,54% dari bobot kering sel) dibandingkan dengan hasil kultivasibatch (1,44 g/L atau 32,65% dari bobot kering sel) pada kondisi karbon berlebih dengan indikasi nutrisi pembatas berupa magnesium, sulfat, nitrogen dan fosfat.
4. Proses Hilir PHA
Proses hilir merupakan tahapan proses yang dilakukan setelah proses kultivasi PHA. Berbagai metode proses hilir telah dikembangkan dalam upaya menurunkan biaya produksi PHA. Metode tersebut meliputi ekstraksi dengan pelarut dan pemecahan (digestion) dengan sodium hipoklorit (Doi, 1990; Lee, 1996).
Menurut Punrattanasin (2001), metode proses hilir PHA melalui ekstraksi dengan pelarut merupakan metode yang biasa digunakan pada skala laboratorium dan sama baiknya apabila digunakan untuk skala besar pada produksi komersial. Metode ini banyak digunakan karena dapat diterapkan untuk berbagai jenis PHA yang dihasilkan oleh mikroorganisme yang berbeda. Namun dibutuhkan pelarut dalam jumlah banyak karena larutan PHA sangatlah viskous. Menurut Lee (1996), dibutuhkan 20 bagian pelarut untuk mengekstrak satu bagian PHA. Oleh karena itu metode ini memerlukan biaya yang besar. Beberapa jenis pelarut yang biasa digunakan adalah kloroform, metilen klorida, dan 1-2 dikloroetana.
Pada proses ekstraksi PHA dengan pelarut kloroform, biomassa hasil kultivasi dicuci dengan metanol kemudian disentrifugasi. Hasil sentrifugasi dikeringkan pada tekanan rendah sehingga diperoleh biomassa kering. Pada biomassa kering ditambahkan kloroform dan diaduk pada suhu 50oC selama 24 jam untuk mengekstrak PHA. Proses penguapan kloroform pada evaporator dilakukan untuk memekatkan larutan PHA. PHA yang terlarut dalam kloroform dipisahkan dengan cara presipitasi dengan menambahkan metanol, kemudian PHA dikeringkan pada tekanan rendah. Pada akhirnya diperoleh PHA sebanyak 45% dari bobot biomassa keringnya (Imamuraet al., 2001).
Penggunaan sodium hipoklorit pada proses ektraksi PHA akan melarutkan komponen non-PHA. PHA dapat dipisahkan dari larutan sodium hipoklorit dengan cara sentrifugasi. Penggunaan sodium hipoklorit dapat menyebabkan terjadinya degradasi bobot molekul PHA. Lee (1996) menyatakan bahwa penggunaan sodium hipoklorit pada proses ekstraksi PHA dapat menyebabkan penurunan bobot molekul PHA sebanyak 50% karena sodium hipoklorit merupakan oksidan kuat.
Choi dan Lee (1999) telah meneliti kemampuan berbagai jenis bahan kimia untuk memecah bahan sel selain PHB, meliputi asam (HCl, H2SO4), alkali (NaOH, KOH, NH4OH) dan surfaktan (garam sodium dioktilsulfosuksinat / AOT, heksadeciltrimetilamonium bromida / CTAB, sodium dodesil sulfat / SDS, polioksietilen-p-tert-oktil fenol / Triton X-100 dan polioksietilen (20) sorbitan monolaurat / Tween 20). SDS merupakan bahan kimia yang efisien untuk isolasi PHB dari rekombinan E. coli namun harganya mahal dan limbahnya menimbulkan masalah baru.
Sodium hidroksida (NaOH) dapat digunakan sebagai pengganti sodium hipoklorit pada proses ektraksi PHA. Lee et al (1999) melakukan pemecahan sel rekombinan E. coli yang mengandung 69% PHB dengan NaOH 0,2 N selama 1 jam pada suhu 30oC dan PHB yang diperoleh menunjukkan kemurnian 97%. Jika waktu pemecahan (digestion) diperpanjang hingga 5 jam maka kemurnian PHB meningkat menjadi 98%, begitu juga jika konsentrasi NaOH ditingkatkan menjadi 2 N. Pemecahan
bahan-bahan sel non-PHA dengan NaOH (NaOH digestion) memiliki beberapa kelebihan, yaitu murah dan ramah lingkungan, PHB yang diperoleh memiliki kemurnian tinggi (>98%) dan selama proses ekstraksi tidak terjadi degradasi PHB.
5. Karakteristik PHA
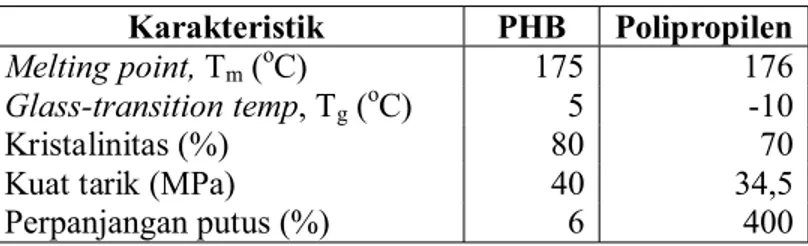
Menurut Kim et al. (1994), PHB merupakan jenis PHA yang pertama ditemukan dan paling banyak diteliti. PHB merupakan alifatik homopolimer yang memiliki sifat termoplastik dengan sifat mekanis bagus, mirip dengan polipropilen (PP). Perbandingan karakteristik fisik antara PHB dengan polipropilen dapat dilihat pada Tabel 1.
Tabel 1. Perbandingan karakteristik fisik antara PHB dengan polipropilen (Lee, 1996; Poirieret al., 1995)
Karakteristik PHB Polipropilen Melting point,Tm (oC) 175 176 Glass-transition temp, Tg (oC) 5 -10
Kristalinitas (%) 80 70
Kuat tarik (MPa) 40 34,5
Perpanjangan putus (%) 6 400
PHB merupakan produk intraseluler yang pada saat masih berada di dalam sel bersifat amorf. Namun setelah melalui proses ekstraksi dengan menggunakan pelarut organik, PHA akan berubah sifat menjadi sangat kristalin. Tingginya kristalinitas menyebabkan PHB menjadi material yang kaku tetapi rapuh. Kerapuhan tersebut menyebabkan PHB tidak tahan terhadap tekanan. Suhu pelelehan PHB (175oC) mendekati suhu degradasi termalnya (200oC) menyebabkan adanya keterbatasan dalam proses pengolahannya (Madison dan Huisman, 1999). Menurut Kim et al. (1994), kelemahan ini dapat diperbaiki dengan kopolimerisasi poli-ȕ-hidroksibutirat (PHB) dan poli-ȕ-hidroksivalerat (PHV) menjadi kopolimer poli-ȕ -hidroksibutirat-co-poli-ȕ-hidroksivalerat (PHB-co-HV) yang lebih fleksibel dan rendah suhu prosesnya.
Karakteristik PHB seperti kristalinitas dan kuat tarik, tergantung pada bobot molekul polimernya. Besarnya bobot molekul ini dipengaruhi oleh strain mikroorganisme yang digunakan, kondisi kultivasi, dan kemurnian PHB
(Punrattanasin, 2001). Lee (1996) menambahkan bahwa bobot molekul PHA berada pada kisaran 2*105 sampai dengan 3*106. Bourque et al. (1995) menyatakan bahwa bobot melekul PHB dapat berkurang selama proses pengerjaan polimer. Laffertyet al. (1988) menambahkan bahwa pengurangan bobot molekul PHB dapat terjadi sepanjang proses ekstraksi dari biomassa.
Menurut Hrabak (1992), PHB mempunyai karakteristik mirip polipropilen dengan 3 keunikan, yaitu termoplastik, 100% tahan air, dan 100% biodegradable. Lindsay (1992) dan Holmes (1988) menambahkan bahwa PHB mempunyai beberapa karakteristik yang banyak diinginkan seperti ketahanan terhadap uap air dan tidak larut di air. Karakter inilah yang membedakan PHB dengan biodegradable plastik yang lain. PHB juga mempunyai impermeabilitas yang baik terhadap oksigen.
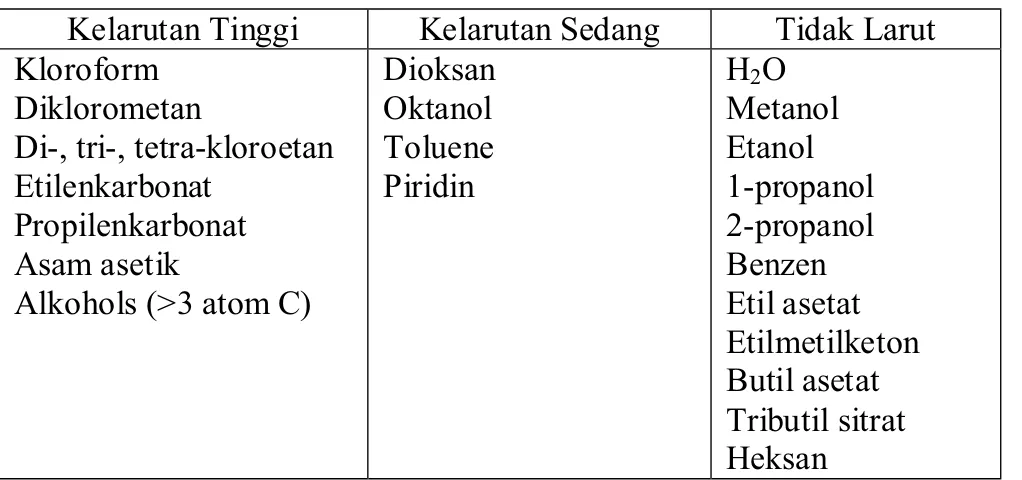
Poli-ȕ-hidroksialkanoat (PHA) dapat larut pada berbagai pelarut seperti kloroform, metilen klorida, etilen klorida, piridin atau campuran diklorometan/etanol (Atkinson dan Mavituna, 1991). Kelarutan PHB dalam beberapa pelarut dapat dilihat pada Tabel 2.
Tabel 2. Kelarutan PHB pada berbagai pelarut (Lafertyet al.,1988) Kelarutan Tinggi Kelarutan Sedang Tidak Larut Kloroform
Diklorometan
Di-, tri-, tetra-kloroetan Etilenkarbonat Propilenkarbonat Asam asetik Alkohols (>3 atom C) Dioksan Oktanol Toluene Piridin H2O Metanol Etanol 1-propanol 2-propanol Benzen Etil asetat Etilmetilketon Butil asetat Tributil sitrat Heksan 6. Aplikasi PHA
Kemampuan PHA untuk diaplikasikan menjadi suatu produk dikarenakan sifat PHA itu sendiri. Sifat tersebut meliputi kemampuan didegradasi secara biologis, karakter termoplastik, sifat piezoelektrik, dan kemampuan depolimerisasi PHB menjadi monomer asam D(-)-3-hidroksibutirat (Lafferty et al., 1988). Secara umum aplikasi PHA terbagi
menjadi 3 lingkup area, yaitu bidang medis dan farmasi, pertanian, dan kemasan (Laffertyet al., 1988; Lee, 1996). Beberapa contoh aplikasi praktis PHA dapat dilihat pada Tabel 3.
Tabel 3. Aplikasi praktis PHA (Brandlet al., 2001; Punrattanasin, 2001) Medis dan farmasi
- Keperluan operasi bedah: benang jahit, pin, penyeka - Pembalut luka
- Pemasangan pembuluh darah dan jaringan tubuh (karena kemampuan depolimerisasi PHB menjadi monomer asam D(-)-3-hidroksibutirat - Pemasangan tulang dan lempeng tulang
- Stimulasi pertumbuhan tulang (karena PHA mempunyai sifat piezoelektrik)
- Pembawa (biodegradable carrier) bahan aktif pada obat-obatan Pertanian
- Pembawa (biodegradable carrier) bahan aktif pada herbisida,
- fungisida, insektisida atau pupuk (karena kemampuan degradasi di
- dalam tanah)
- Kontainer semaian bibit
- Matrik (biodegradable matrix) untuk obat pada bidang veteriner Kemasan dan komoditas lain
- Kemasan kontainer, botol, pembungkus, kantong, dan film
- Bahan-bahan sekali pakai seperti popok bayi dan pembalut wanita
C. Plastik Biodegradable
1. Definisi
Biodegradabilitas plastik tergantung pada struktur kimia materialnya dan konstitusi dari produk akhirnya, bukan hanya bahan baku untuk pembuatannya. Oleh karena itu plastik biodegradable dapat berbasis bahan alami maupun resin sintetis. Plastikbiodegradable alami terutama berasal dari sumber daya terbaharukan (misalnya pati). Plastik biodegradable sintetis berasal dari sumber daya tak terbaharukan, yaitu minyak bumi (NIIR, 2006).
Bioplastik adalah suatu bentukan plastik yang berasal atau bersumber dari tumbuhan, misalnya berasal dari minyak rami, minyak kacang kedelai atau pati. Bioplastik ini mempunyai sifat biodegradable (Anonim, 2006). Menurut ASTM D-5488-84d, biodegradable berarti mampu diurai menjadi gas karbon dioksida, metana, air, inorganic compounds atau biomassa dimana
mekanisme yang utama adalah karena aktivitas enzim yang dihasilkan suatu mikroorganisme.
2. Proses Pembuatan PlastikBiodegradable
Istilah plastik meliputi produk hasil proses polimerisasi baik yang sintetis maupun semisintetis. Plastik dapat dibentuk menjadi suatu objek, film ataupun serat (Anonim, 2006). Menurut Allcock dan Lampe (1981), film plastik dapat dibuat melalui dua teknik dasar yang berbeda, yaitu solution casting atau molten polymer. Pada penelitian ini digunakan teknik solution casting untuk membuat film bioplastik dari polihidroksialkanoat (PHA).
Pada pembuatan film plastik dengan teknik solution casting, bahan polimer dilarutkan ke dalam pelarut yang cocok untuk menghasilkan larutan yang viskous. Larutan yang dihasilkan dituang pada suatu permukaan yang rata (cetakan) yang bersifat non-adesif dan pelarut dibiarkan menguap sampai habis. Film plastik yang sudah kering kemudian diangkat dari cetakannya Teknik molten polymer dilakukan dengan cara pemanasan polimer sampai di atas titik lelehnya (Allcock dan Lampe, 1981).
Masih menurut Allcock dan Lampe (1981), teknik solution casting menjadi pilihan yang cepat dan mudah untuk dilakukan pada skala laboratorium. Pemilihan jenis pelarut yang cocok dengan bahan polimer menjadi faktor penting yang perlu diperhatikan. Menurut Waddington (2000), polihidroksialkanoat (PHA) merupakan material biodegradable yang dapat dibuat film plastik dengan teknik solution casting. Pelarut yang cocok untuk digunakan adalah pelarut yang mengandung unsur klorin, misalnya kloroform.
Teknik solution casting dilakukan dengan membuat larutan polimer 20% (b/v) untuk menghasilkan larutan dengan viskositas yang sesuai. Pengadukan diperlukan untuk mempercepat kelarutan, misalnya pengadukan dengan strirrer (Allcock dan Lampe, 1981). Allcock dan Lampe (1981) menambahkan bahwa apabila larutan polimer perlu disaring sebelum proses casting, maka dapat dilakukan penyaringan vakum karena larutan terlalu viskous. Pada skala laboratoium, proses casting dapat dilakukan pada plat kaca atau cawan gelas. Untuk larutan polimer 20% (b/v), diperlukan plat kaca
yang dapat membentuk ketebalan larutan sebesar kira-kira lima kali ketebalan film plastik yang akan dihasilkan.
D. Karakterisasi PlastikBiodegradable
Kualitas plastik biodegradable yang dihasilkan dapat ditentukan dengan melakukan karakterisasi. Beberapa karakterisasi yang dapat menentukan kualitas plastikbiodegradable adalah karakterisasi sifat mekanik meliputi kuat tarik dan perpanjangan putus, karakterisasi gugus fungsi dengan FTIR, karakterisasi sifat termal meliputi titik leleh dan titik transisi kaca dengan DSC serta karakterisasi derajat kristalinitas.
1. Karakterisasi Sifat Mekanik
Sifat mekanik suatu bahan berhubungan erat dengan struktur kimianya, terutama struktur molekulnya. Struktur molekul yang mempengaruhi sifat mekanik suatu bahan meliputi bentuk molekul, kekompakan molekul, kristalinitas, kekuatan ikatan molekul, dan gaya antarmolekul (Allcock dan Lampe, 1981).
Menurut Surdia dan Saito (1995), kuat tarik adalah tegangan regangan maksimum yang dapat diterima sampel. Datsko (1996) menyatakan bahwa perpanjangan putus adalah perubahan panjang maksimum yang dialami plastik pada saat pengujian kuat tarik. Menurut Stevens (2001), tegangan tarik
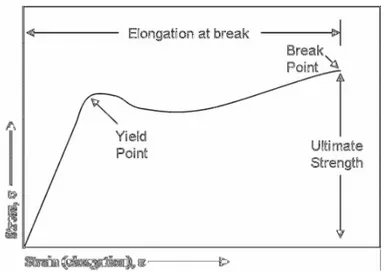
ı) adalah gaya yang diaplikasikan (F) dibagi dengan luas penampang (A). Pengujian kuat tarik akan menghasilkan kurva tegangan-regangan (stress-strain). Informasi yang diperoleh dari kurva tegangan-regangan untuk polimer adalah kekuatan tarik saat putus (ultimate strength) dan perpanjangan saat putus (elongation at break,İ) dari bahan (Billmayer, 1971).
Suatu kurva tegangan-regangan yang umum untuk bahan termoplastik memperlihatkan tegangan tarik dan perpanjangan putus, yaitu pada mulanya tinggi sampai mencapai suatu titik hingga plastik tersebut terdeformasi. Sebelum titik deformasi tersebut perpanjangan masih dapat balik dan setelah sampai pada titik yield, perpanjangan tidak dapat balik yang selanjutnya sampel tersebut patah pada titik break. Kurva tegangan-regangan suatu bahan termoplastik dapat dilihat pada Gambar 4.
Gambar 4. Kurva tegangan-regangan suatu bahan termoplastik (Allcock dan Lampe, 1981).
2. Karakterisasi Gugus Fungsi
Adanya gugus fungsional pada suatu bahan dapat dianalisa dengan menggunakan FTIR (Fourier Transform Infra-Red Spectroscopy). Menurut Sutiani (1997), spektroskopi inframerah merupakan salah satu teknik identifikasi struktur baik untuk senyawa organik maupun senyawa anorganik. Analisa ini merupakan metode semi empirik dimana kombinasi pita serapan yang khas dapat diperoleh untuk menentukan struktur senyawa yang terdapat pada suatu bahan. Menurut Mohsenin (1984), infra merah merupakan gelombang elektromagnetik dengan panjang gelombang diatas daerah sinar tampak yaitu pada 700-3000ȝm.
Energi dari kebanyakan vibrasi molekul berhubungan dengan daerah inframerah. Vibrasi inframerah dapat dideteksi dan diukur pada spektrum inframerah bila vibrasinya menghasilkan perubahan momen dipol. Daerah inframerah dibagi dalam daerah dekat (12800-4000 cm-1), daerah sedang (4000-200 cm-1), dan daerah jauh (200-10 cm-1). Radiasi inframerah yang penting dalam penentuan struktur atau analisa gugus fungsi dan paling banyak digunakan untuk keperluan praktis adalah daerah inframerah sedang yaitu dengan bilangan gelombang antara 4000-650 cm-1 (Khopkar, 2002). Stevens (2001) menyatakan bahwa spektrum-spektrum dari sebagian besar polimer
komersial telah dicatat, karena itu indentifikasi kualitatif zat-zat yang belum diketahui seringkali bisa diselesaikan melalui perbandingan.
3. Karakterisasi Sifat Termal
Menurut Jandali dan Widmann (1995), analisa sifat termal merupakan suatu teknik untuk megetahui karakteristik suatu bahan berdasarkan fungsi suhu dan waktu. Pada teknik ini, sampel dipanaskan atau didinginkan pada laju konstan. Salah satu teknik analisis sifat termal adalah DSC (Diffrential Scanning Calorimetry).
DSC mengukur sejumlah energi (panas) yang diserap atau dilepaskan oleh suatu sampel ketika dipanaskan, didinginkan atau didiamkan pada suhu konstan. DSC juga mengukur suhu sampel pada kondisi tersebut. Prinsip kerja menggunakan metode ini adalah pengukuran aliran panas berdasarkan kompensasi tenaga (Rabek 1983).
Jandali dan Widmann (1995) menambahkan bahwa pada saat energi ditransmisikan akan terjadi perubahan entalpi pada sampel. Ketika sampel menyerap energi maka entalpi akan berubah dan prosesnya disebut endoterm, sedangkan ketika sampel melepas energi prosesnya disebut eksoterm. Perubahan entalpi maupun suhu yang terjadi pada sampel selalu dimonitor oleh sensor yang terpasang pada DSC sehingga dapat memberikan informasi tentang suhu transisi kaca (transition glass temperature, Tg) dan suhu pelelehan (melting temperature, Tm).
4. Karakterisasi Derajat Kristalinitas
Knapczyk dan Simon di dalam Kent (1992) menyatakan bahwa struktur molekul yang susunan keteraturannya tinggi disebut kristalin. Sedangkan struktur molekul yang susunannya tidak teratur disebut amorf. Polimer termoplastik yang kristalinitasnya tinggi, lebih resisten terhadap pelarut dan meleleh lebih tajam pada suhu tinggi dari pada polimer amorf. Polimer dengan kristalinitas tinggi mempunyai kekakuan yang tinggi, lebih rapuh atau ketahanan guncang yang rendah daripada polimer amorf. Oleh karena itu Cullity dan Stock (2001) menyatakan bahwa derajat kristalinitas menetukan aplikasi dari bahan polimer tersebut.
Pengukuran derajat kritalinitas dapat dilakukan dengan menggunakan Difraktometer sinar-X (X-Ray Diffractometer, XRD). Menurut Sutiani (1997), difraktometer sinar-X merupakan suatu alat yang dapat mentukan derajat kristalinitas suatu polimer. Bagian kristalin dan amorf suatu polimer dapat berinteraksi dengan sinar-X dan menunjukkan aktifitas difraksi yang spesifik. Derajat kristalinitas dapat ditentukan bila difraksi kristalin dapat dipisahkan dari difraksi amorf. Derajat kristalinitas diketahui dengan cara menghitung perbandingan luas difraksi kristalin terhadap luas total difraksi
E. Pemlastis
1. Definisi dan Karakteristik
Menurut Hammer (1978), pemlastis adalah bahan kimia yang dapat digunakan untuk mengurangi kekakuan resin termoplastik. Prinsip kerja pemlastis adalah dengan membentuk interaksi molekuler rantai polimer untuk meningkatkan kecepatan respon viskoelastis pada polimer. Hal ini akan meningkatkan mobilitas molekuler rantai polimer dan akibatnya dapat menurunkan suhu transisi kaca (Tg).
Billmeyer (1994) menambahkan bahwa jika suatu polimer semikristalin mendapat tambahan pemlastis maka akan terjadi penurunan suhu pelelehan (Tm) dan derajat kristalinitas. Pemlastis akan lebih banyak berinteraksi dengan fase amorf dan sangat sedikit yang berinteraksi dengan fase kristalin. Efektivitas penambahan pemlastis dapat dilihat melalui beberapa parameter semi empiris, seperti penurunan suhu transisi kaca dan titik leleh, karakteristik mekanik serta kondisi molekuler.
Menurut Hammer (1978), beberapa kondisi yang harus dimiliki pemlastis adalah (1) mampu berinteraksi secara molekuler dengan polimer; (2) mempunyai Tg yang cukup rendah untuk menurunkan Tg polimer; (3) mempunyai bobot molekul yang cukup tinggi untuk tetap menjaga agar bobot molekul polimer tetap tinggi.
Berdasarkan hasil penelitian Kalnins et al. (1999), penambahan pemlastis dan peningkatan konsentrasi pemlastis dapat menyebabkan penurunan suhu transisi kaca (T ) film plastik berbasis PHB. Penurunan T ini
diakibatkan oleh peningkatkan mobilitas makromolekul PHB. Selain itu juga dapat menyebabkan penurunan suhu pelelehan (Tm) sehingga dapat meningkatkan kemampuan proses dari film plastik tersebut.
2. Dimetil Ftalat
Menurut Allcock dan Lampe (1981), untuk meningkatkan fleksibilitas film plastik dapat ditambahkan bahan pemlastis berupa ester ftalat. Penambahan ester ftalat pada umumnya dilakukan untuk mengurangi kekakuan material termoplastik yang berbasis polivinilklorida (PVC). Salah satu jenis pemlastis yang termasuk dalam golongan ester ftalat adalah dimetil ftalat.
Dimetil ftalat merupakan pemlastis yang bersifat dapat larut dalam alkohol, eter, dan kloroform. Titik didih dimetil ftalat adalah 134-138oC. Penampakan dimetil ftalat adalah tidak berwarna dan tidak berbau. Struktur kimia dimetil ftalat dapat dilihat pada Gambar 5.
Gambar 5. Struktur kimia dimetil ftalat (Merck, 1999)
Menurut Akmaliah (2003), pada pembuatan lembaran bioplastik dari poli-ȕ-hidroksialkanoat (PHA) dengan pemlastis dimetil ftalat, lembaran plastik terbentuk pada penambahan pemlastis dengan konsentrasi 10% dan 12,5%, sedangkan pada konsentrasi 5% tidak terbentuk lembaran bioplastik. Lembaran bioplastik dengan karakteristik terbaik diperoleh pada penambahan pemlastis dimetil ftalat dengan konsentrasi 12,5%.
III. METODOLOGI PENELITIAN
A. Bahan dan Alat
1. Bahan
Bahan baku yang digunakan untuk pembuatan film bioplastik adalah poli-3-hidroksialkanoat (PHA) hasil kultivasi secara fed-batch. Proses kultivasi tersebut menggunakan strain bakteriRalstonia eutropha IAM 12368 yang diperoleh dari IAM Culture Collection, Institute of Molecular and Celular Bioscience, The University of Tokyo. Sumber karbon yang digunakan dalam substrat kultivasi adalah hidrolisat pati sagu (Metroxylon sp) yang dipersiapkan melalui hidrolisis enzimatis pati sagu dengan enzim Į-amilase dan amiloglukosidase.
Bahan-bahan untuk kultivasi bakteri dan isolasi PHA adalah nutrient broth, (NH4)2HPO4, K2HPO4, KH2PO4, MgSO4 0,1 M, FeSO4.7H2O, MnCl2.4H2O, CoSO4.7H20, CaCl2.7H2O, CuCl2.2H2O, ZnSO4.7H2O, buffer tris-hidroklorida, NaOH, NaOCl dan NH4OH. Pembuatan film bioplastik dilakukan dengan menggunakan pelarut kloroform untuk melarutkan PHA dan menggunakan dimetil ftalat sebagai pemlastis.
2. Alat
Alat-alat utama yang digunakan untuk kultivasi PHA adalah bioreaktor skala 13 liter dengan volume kerja 10 liter, alat-alat gelas, penyaring vakum, oven, shaking waterbath, termometer, neraca analitik, rotary shaking inkubator, autoklaf, pH meter, sentrifuse kecepatan tinggi, homogenizer, refrigator, freezer, desikator, clean bench, dan pipet mikro. Plat kaca untuk casting bioplastik dan penguapan pelarut dilakukan di dalam lemari asap.
Peralatan yang digunakan untuk karakterisasi film bioplastik adalah UTM (Universal Testing Machine) untuk mengukur kuat tarik dan perpanjangan putus, FTIR (Fourier Transform Infra-Red Spectroscopy) untuk analisis gugus fungsi, DSC (Differential Scanning Calorimetry) untuk analisis Tm (melting point) dan Tg (glass transition temperature).
B. Metode Penelitian
Penelitian ini terdiri dari dua tahap, yaitu tahap persiapan bahan baku pembuatan bioplastik dan tahap penelitian utama. Penelitian utama terdiri dari pembuatan dan karakterisasi bioplastik.
1. Persiapan Bahan Baku
Persiapan bahan baku bertujuan untuk memperoleh PHA sebagai bahan utama pembuatan bioplastik. Persiapan bahan baku terdiri dari tiga tahap, yaitu persiapan substrat, kultivasi PHA, dan proses hilir PHA. a. Persiapan substrat
Tahap pesiapan substrat meliputi proses pembuatan hidrolisat pati sagu secara enzimatis serta persiapan kultur dan media fermentasi. i. Pembuatan hidrolisat pati sagu (Akyuni, 2004)
Suspensi pati sagu dalam air 30% (b/v) diatur pH-nya 6-6,5 dengan penambahan CaCO3 kemudian digelatinisasi sempurna dengan cara pemanasan (70-80oC) dan mengaduknya hingga kental dan bening. Likuifikasi dilakukan dengan menambahkan Į -amilase sebanyak 1,75 U/g pati ke dalam suspensi pati yang telah tergelatinisasi kemudian dipanaskan dan diaduk pada suhu 90-95oC selama 210 menit. Hasil likuifikasi selanjutnya disakarifikasi pada suhu 60oC, pH 4-4,5 selama 48 jam pada inkubator goyang 150 rpm dengan menambahkan amiloglukosidase (AMG) sebanyak 0,3 U/g pati.
Hidrolisat pati sagu hasil sakarifikasi dipanaskan pada suhu 105oC selama 5 menit untuk menginaktifkan enzim. Untuk menjernihkan warna, hidrolisat ditambah arang aktif (1-2 % bobot pati), dipanaskan 80oC selama satu jam lalu disaring vakum. Hidrolisat pati sagu tersebut telah siap digunakan sebagai sumber karbon kultivasi PHA dan sebelumnya dilakukan analisis total gula (metode Fenol Sulfat), total nitrogen (Kjeldahl), kadar mineral (AAS/Spektofotometri Absorpsi Atom) (Apriyantonoet al., 1989) dan profil gula (High Performance Liquid Chromatography atau
HPLC). Diagram alir pembuatan hidrolisat pati sagu dapat dilihat pada Lampiran 1. Prosedur analisis total gula dan nitrogen secara lengkap dapat dilihat pada Lampiran 2a dan 2b.
ii. Persiapan kultur dan media fermentasi (Atifah, 2006)
Kultur R. eutropha dipelihara dalam bentuk kering-beku. Kultur disegarkan setiap dua minggu dengan menumbuhkannya pada media cairNutrient Broth(inkubasi 34oC selama 24 jam).
Formulasi media kultivasi per liter adalah X ml hidrolisat pati sagu dan Y gram (NH4)2HPO4 sedemikian sehingga rasio C/N awal 10:1 dengan asumsi bahwa konsentrasi karbon pada hidrolisat pati sagu adalah 40% dari total gula dan konsentrasi N pada (NH4)2HPO4 adalah 21,21%; 5,8 gram K2HPO4; 3,7 gram KH2PO4; 10 ml MgSO4 0,1 M; dan 1 ml larutan mikroelemen. Larutan mikroelemen terdiri dari 2,78 g FeSO4.7H2O; 1,98 g MnCl2.4H2O; 2,81 g CoSO4.7H2O; 1,67 g CaCl2.2H2O; 0,17 g CuCl2.2H2O dan 0,29 g ZnSO4.7H2O yang dilarutkan dalam 1 liter HCl 1 N.
Sebelum digunakan, media terlebih dahulu disterilisasi pada suhu 121oC selama 15 menit (sumber karbon dan sumber nitrogen disterilisasi dalam wadah yang terpisah untuk menghindari reaksi pencoklatan). Media didiamkan beberapa saat setelah disterilisasi sehingga suhunya mencapai 25-30oC dan siap diinokulasi.
Untuk keperluan kultivasi, terlebih dahulu dilakukan propagasi kultur dengan menumbuhkan kultur segar R. eutropha ke dalam media steril (10% v/v) pada inkubator goyang 150 rpm, suhu 34oC selama 24 jam. Komposisi media propagasi disesuaikan dengan media yang akan digunakan pada kultivasi, volume kultur propagasi 10% dari volume media kultivasi. Kultur hasil propagasi selanjutnya diinokulasikan ke dalam media kultivasi.
b. Kultivasi PHA secarafed-batch (Atifah, 2006)
Kultivasi fed-batch dilakukan pada bioreaktor skala 13 liter, volume kerja 10 L, pH 6,9, agitasi 150 rpm, suhu 34oC dan aerasi 0,2 vvm. Kultivasi dilakukan selama 96 jam. Metode pengumpanan dilakukan pada saat mikroba diperkirakan memasuki fase pertumbuhan stasioner yaitu pada jam ke-48. Umpan berupa hidrolisat pati sagu yang setara dengan 20 g gula per liter kultur atau sekitar 640,5 mL dengan kecepatan pengumpanan konstan 1,7 ml/menit.
c. Proses hilir PHA (Atifah, 2006; Imamura et al., 2001 dan Lee, 1996)
Tahap 1
Setelah proses kultivasi selesai, cairan kultivasi disentrifugasi sebanyak empat tahap pada kecepatan 13000 rpm selama sepuluh menit. Sentrifugasi tahap pertama bertujuan untuk memisahkan biomassa dengan fase cair. Endapan yang diperoleh pada sentrifugasi pertama dibilas dengan aquades untuk pembersihan, kemudian dilakukan sentrifugasi tahap kedua. Endapan hasil bilasan ditambah NaOH 0,2 N atau NaOCl 0,2 %, kemudian dilakukan proses digest selama satu jam untuk mengeluarkan PHA dari biomassa sel. Proses sentrifugasi ketiga dilakukan untuk memisahkan hasil digest dengan cairannya (NaOH atau NaOCl). Endapan hasil sentrifugasi ketiga dibilas dengan aquades, kemudian dilakukan sentrifugasi tahap keempat. Endapan hasil sentrifugasi keempat diambil dan dimasukkan ke cawan petri, kemudian dioven pada suhu 40OC sampai kering. Tahap 2
PHA kering hasil hasil tahap 1 dilarutkan pada kloroform. Setiap 1 gram PHA kering dilarutkan ke dalam 50 ml kloroform. Kemudian larutan PHA dipanaskan dan diaduk selama 24 jam. Pemanasan dan pengadukan dilakukan dengan pemasangan pendingin tegak pada wadah gelas untuk mencegah penguapan. Diakhir proses pemanasan, larutan diangkat dan disaring menggunakan kertas saring wathman 42 dengan sistem penyaringan vakum. Filtrat hasil penyaringan yang
mengandung PHA yang terlarut dalam pelarut kloroform diuapkan dalam lemari asap untuk memperoleh PHA kering yang lebih murni.
2. Pembuatan Bioplastik a. Formulasi Bioplastik
i. Metode pembuatan bioplastik (modifikasi Akmaliah, 2003)
Proses pembuatan bioplastik dilakukan dengan teknik solution casting. Proses dimulai dengan pencampuran (blending) antara PHA–pelarut kloroform–pemlastis dimetil ftalat. Pencampuran dilakukan dengan cara pengadukan biasa sampai terbentuk larutan PHA-pelarut-pemlastis yang homogen. Kemudian larutan yang sudah homogen dituang pada cetakan (plat kaca). Diagram alir proses pembuatan bioplastik dapat dilihat pada Lampiran 3.
ii. Penentuan ukuran bioplastik
Jenis plastik yang akan dibuat pada penelitian ini adalah film bioplastik. Ukuran bioplastik ditentukan berdasarkan kebutuhan sampel untuk pengujian kuat tarik, yaitu berdasarkan ASTM D 882-97. ASTM D 882-97 merupakan standar metode pengujian kuat tarik lembaran plastik sangat tipis (ketebalan kurang dari 1 mm). Berdasarkan ASTM D 882-97, ukuran sampel uji mempunyai lebar minimal 0,5 cm dengan panjang bervariasi tergantung persen perpanjangan putus (İ). Apabila İ kurang dari 20% maka panjang sampel adalah 17,5 cm; İ antara 20-100% panjang sampel 15 cm; İ lebih dari 100%, panjang sampel 10 cm. Berdasarkan pertimbangan tersebut maka bioplastik dibuat pada cetakan dengan ukuran 4,5 x 19 cm.
iii. Penentuan jumlah kloroform
Menurut Lee (1996), untuk melarutkan satu bagian PHA diperlukan 20 bagian pelarut. Jumlah pelarut yang optimal akan ditentukan dengan cara melarutkan PHA pada kloroform dengan
iv. Penentuan jumlah PHA
Jumlah PHA yang digunakan disesuaikan dengan ketebalan bioplastik yang akan dihasilkan. Jumlah PHA yang optimal akan ditentukan dengan cara melarutkan PHA pada kloroform kemudian di tuang pada cetakan dan diukur ketebalannya. Perbandingan PHA-kloroform yang digunakan adalah perbandingan optimal yang dihasilkan pada tahap penentuan jumlah kloroform. Jumlah PHA yang optimal adalah jumlah PHA yang mampu menghasilkan larutan PHA yang mampu menutup permukaan cetakan dengan sempurna jika larutan tersebut dituang pada cetakan dan ketebalan bioplastik yang dihasilkan kurang dari 0,25 mm.
v. Penentuan jumlah pemlastis dimetil ftalat (DMF)
Konsentrasi pemlastis dihitung berdasarkan jumlah PHA yang digunakan. Pada penelitian ini akan diujikan konsentrasi pemlastis dimetil ftalat (DMF) mulai dari 0% (kontrol), 12,5%, 25%, 37,5%, dan 50% (b/b) dari jumlah PHA. Sebagai pembanding dibuatlah bioplastik dari PHB murni yang dibeli dari Sigma-Aldrich. Bioplastik pembanding dibuat tanpa pemlastis (0% DMF) dan dengan pemlastis pada konsentrasi terbaik hasil karakterisasi sifat mekanik bioplastik yang dibuat dengan PHA pati sagu.
b. Karakterisasi Bioplastik
i. Kuat tarik dan perpanjangan putus (ASTM D 882-97)
Pengukuran kuat tarik dilakukan dilakukan di Sentra Teknologi Polimer (STP) kawasan Puspitek Serpong. Alat yang digunakan adalah Universal Testing Machine (UTM) dengan merk Simadzu AGS-10KNG. Penggunaan ASTM D 882-92 karena sampel uji termasuk film plastik yang sangat tipis (thin plastic sheeting) dengan ketebalan kurang dari 0,1 mm. Sampel yang berbentuk lembaran dipotong dengan panjang 130 mm dan lebar 8 mm. Sebelum pengujian dilakukan, sampel dikondisikan dalamclimatic chamber pada suhu 23oC dan kelembaban 50% selama 48 jam.
Kondisi ruang uji: suhu 23,7oC dan kelembaban 60,0%. Pengujian dilakukan berdasarkan standar ASTM D 882-97 dengan kecepatan 500 mm/menit. Kuat tarik plastik (tensile strength) dapat dihitung dengan persamaan berikut :
IJ = Fmax / A Keterangan:
IJ = kuat tarik (MPa)
Fmax = tegangan maksimum (Kgf) A = luas penampang melintang (mm2) ii. Gugus fungsi
Analisa gugus fungsi dilakukan di Departemen Teknik Gas dan Petrokimia Fakultas Teknik Universitas Indonesia. Alat yang digunakan adalah Fourier Transform Infra-Red Spectroscopy (FTIR) dengan merk ATI Mattson. Sampel pengujian yang berbetuk lembaran dipotong melingkar dengan diameter 10 mm. iii. Sifat Termal (ASTM D3418-99)
Analisa sifat termal meliputi suhu pelelehan (melting point, Tm) dan suhu transisi kaca (glass transition temperature, Tg). Analisa dilakukan di Sentra Teknologi Polimer (STP) kawasan Puspitek Serpong. Alat yang digunakan adalah Differential Scanning Calorimetry (DSC) dengan merek Mettler Toledo. Sampel ditimbang sekitar 20 mg dimasukkan dalam crucible 40 µl. Pengujian dilakukan berdasarkan standar ASTM D 3418-99. Analisa dilakukan dengan temperature program dimulai dengan pemanasan sampel dari temperatur -90oC hingga 200oC. Kecepatan pemanasan adalah 10oC/menit. Sebagai purge gas digunakan gas nitrogen dengan kecepatan aliran 50 ml/menit.
iv. Derajat kristalinitas (Hahnet al., 1995)
Pengukuran derajat kristalinitas dilakukan dengan metode pendekatan. Metode ini didasarkan pada perubahan entalpi yang terjadi pada saat tercapainya suhu pelelehan yang terukur pada saat pengukuran suhu pelelahan dengan DSC. PHA dengan derajat kristalinitas 100% akan mempunyai perubahan entalpi sebesar 146 J/g. Dengan melakukan perbandingan perubahan entalpi sampel uji dan PHA dengan kristalinitas 100% maka akan dapat diketahui derajat kristalinitas sampel uji.
c. Analisa Data
Analisa data yang digunakan adalah statistika deskriptif. Statistika deskriptif adalah metode-metode yang berkaitan dengan pengumpulan dan penyajian suatu gugus data sehingga memberikan informasi yang berguna.
C. Tempat dan Waktu Penelitian
Penelitian dilaksanakan di Laboratorium Rekayasa Bioproses Pusat Penelitian Sumberdaya Hayati dan Bioteknologi, Institut Pertanian Bogor dan laboratorium di lingkungan Departemen Teknologi Industri Pertanian, Fakultas Teknologi Pertanian, Institut Pertanian Bogor. Karakterisasi PHA dilakukan di Sentra Teknologi Polimer Kawasan Puspitek Serpong dan Departemen Teknik Gas dan Petrokimia Fakultas Teknik Universitas Indonesia. Penelitian berlangsung selama delapan bulan yaitu mulai bulan Januari sampai Agustus 2006.
IV. HASIL DAN PEMBAHASAN
A. Persiapan Bahan Baku
Persiapan bahan baku merupakan tahap pertama dari penelitian ini. Pada tahap ini dilakukan produksi PHA hingga cukup digunakan untuk masuk pada tahap penelitian utama, yaitu tahap pembuatan bioplastik. Tahap persiapan bahan baku terdiri dari proses pembuatan hidrolisat pati sagu, kultivasi dan proses hilir PHA.
1. Pembuatan hidrolisat pati sagu
Sirup glukosa adalah cairan jernih dan kental dengan komponen utama glukosa dan diperoleh dari proses hidrolisis pati dengan cara kimia atau enzimatis (SNI 01-2978-1992). Sirup glukosa yang dibuat pada penelitian ini berasal dari pati sagu yang dihidrolisis secara enzimatis. Hidrolisat pati sagu (sirup glukosa) tersebut digunakan sebagai sumber karbon pada kultivasi PHA.
Pemilihan pati sagu sebagai bahan baku pembuatan sirup glukosa adalah untuk menurunkan biaya produksi PHA. Menurut Lefebvre et al. (1997), salah satu strategi penurunan biaya produksi PHA adalah melalui penggunaan substrat yang murah. Produksi sagu di Indonesia cukup besar namun pemanfaatannya masih relatif rendah. Menurut Abner dan Miftahorrahman (2002), Indonesia merupakan pemilik areal sagu terbesar di dunia, yaitu 1,128 juta ha atau 51,3% dari 2,201 juta ha areal sagu dunia. Produktivitas pati sagu kering mencapai 25 ton/ha/tahun namun pemanfaatannya hanya 10% dari potensi yang ada.
Pati merupakan homopolimer glukosa dengan ikatan Į-glikosidik sehingga harus dihidrolisis menjadi molekul yang lebih sederhana (glukosa) agar dapat digunakan sebagai sumber karbon bagi pertumbuhan bakteri. Proses hidrolisis pati sagu menjadi sirup glukosa dilakukan secara enzimatis. Selain itu pembuatan sirup glukosa juga dapat dilakukan dengan menggunakan asam. Namun metode hidrolisis dengan asam akan
menghasilkan DE (dextrose equivalent) yang lebih rendah dibanding hidrolisis secara enzimatis (Berghmans, 1981).
Proses pembuatan sirup glukosa dari pati sagu secara enzimatis terdiri dari dua tahap, yaitu tahap likuifikasi dan sakarifikasi. Pada tahap likuifikasi, pati sagu yang telah digelatinisasi ditambah enzim Į-amilase. Pada tahap ini enzim Į-amilase akan memecah ikatan Į-(1,4)-glikosidik di bagian dalam rantai polisakarida secara acak menghasilkan oligosakarida yang mengandung 6-7 maltosa. Tahap sakarifikasi bertujuan untuk memecah oligosakarida hasil likuifikasi menjadi monosakarida yang siap digunakan oleh bakteri sebagai sumber karbon. Tahap sakarifikasi dilakukan dengan bantuan enzim amiloglukosidase (AMG).
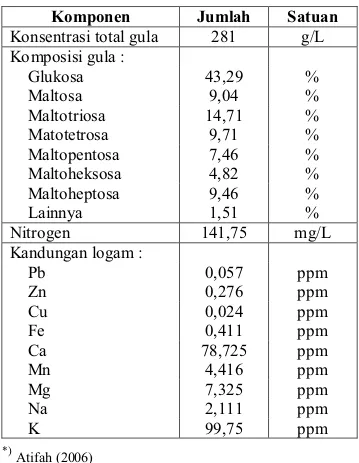
Karakteristik hidrolisat pati sagu yang dihasilkan sangat penting untuk diketahui. Karakteristik hidrolisat pati sagu akan berpengaruh terhadap komposisi media kutivasi. Kandungan gula, nitrogen, dan mineral pada hidrolisat pati sagu akan mempengaruhi perhitungan rasio C dan N serta kebutuhan mineral mikro untuk media yang akan digunakan pada kultivasi PHA. Karakteristik hidrolisat pati sagu yang dihasilkan dapat dilihat pada Tabel 4.
2. Kultivasi PHA
Kultivasi dilakukan dengan menggunakan bakteri Ralstonia eutropha. Kultivasi dilakukan pada bioreaktor kapasitas 13 liter volume kerja 10 liter dengan sistemfed-batch. Kultivasi sistemfed-batch mampu meningkatkan konsentrasi PHA dan rendemen PHA di dalam sel sebesar lebih dari dua kali lipat apabila dibandingkan dengan kultivasi sistem curah (Atifah, 2006).
Kultivasi dilakukan selama 96 jam. Agitasi yang digunakan sebesar 150 rpm dengan aerasi 0,2 vvm dan suhu 34oC. Pada kultivasi sistem fed-batch berarti ada pengumpanan. Pengumpanan dilakukan ketika konsentrasi sel mencapai maksimum dan konsentrasi gula dalam media hampir habis dikonsumsi mikroba, yaitu pada awal fase pertumbuhan stasioner. Fase pertumbuhan stasioner (ketika konsentrasi gula sisa dalam
media mendekati 1 g/L) mulai terjadi pada jam ke-48. Oleh karena itu pengumpanan dilakukan pada jam ke-48 (Atifah, 2006).
Tabel 4. Karakteristik hidrolisat pati sagu *)
Komponen Jumlah Satuan
Konsentrasi total gula 281 g/L Komposisi gula : Glukosa 43,29 % Maltosa 9,04 % Maltotriosa 14,71 % Matotetrosa 9,71 % Maltopentosa 7,46 % Maltoheksosa 4,82 % Maltoheptosa 9,46 % Lainnya 1,51 % Nitrogen 141,75 mg/L Kandungan logam : Pb 0,057 ppm Zn 0,276 ppm Cu 0,024 ppm Fe 0,411 ppm Ca 78,725 ppm Mn 4,416 ppm Mg 7,325 ppm Na 2,111 ppm K 99,75 ppm *) Atifah (2006)
Pada awal proses kultivasi pH diatur sebesar 6,9-7,0. Selama proses kultivasi nilai pH cenderung mengalami penurunan karena adanya sintesis asam hidroksialkanoat olehRalstonia eutropha. Nilai pH optimum 6,9-7,0 perlu dipertahankan dengan melakukan penambahan basa. Basa yang digunakan adalah NaOH 4 N (Atifah, 2006). Pengukuran nilai pH dan penambahan basa dapat dilakukan secara otomatis dengan memanfaatkan sensor pH dan pompa peristaltik yang terdapat pada bioreaktor.
Sumber karbon yang digunakan pada kultivasi ini adalah sirup glukosa (hidrolisat) pati sagu. Menurut Ayorinde et al. (1998), galur bakteri dan sumber karbon yang digunakan sangat berpengaruh terhadap PHA yang dihasilkan.Ralstonia eutropha dapat memproduksi PHB
menggunakan glukosa dan asam propionat. PHB dapat disintesa oleh Ralstonia eutropha jika salah satu elemen nutrisi seperti N, P, S, O atau Mg ada dalam jumlah terbatas namun sumber karbon ada dalam jumlah berlebih (Lee dan Choi, 2001).
Pada penelitian ini kultivasi dilakukan pada media yang mempunyai rasio C dan N sebesar 10:1 (Atifah, 2006). Nitrogen dijadikan sebagai nutrisi pembatas bagi pertumbuhanRalstonia eutropha dalam mensintesis PHB. Sumber nitrogen yang digunakan adalah (NH4)2HPO4. Perhitungan besarnya (NH4)2HPO4 yang perlu ditambahkan pada saat formulasi media didasarkan pada total gula sirup glukosa. Total gula pada media fermentasi adalah 30g/L. Konsentrasi C yang terdapat pada sirup glukosa (C6H12O6) adalah 40% nilai total gula atau sebesar 12g/L sehingga konsentrasi N yang diperlukan adalah 1,2 g/L. Selain C dan N, media yang digunakan juga mengandung sumber K, P, dan Mg. Sumber K dan P adalah K2HPO4 dan KH2PO4 dengan konsentrasi sebesar 5,8 g/L dan 3,8 g/L. Sedangkan sumber Mg adalah MgSO4 dengan konsentrasi sebesar 10 ml/L.
Umpan yang digunakan pada kultivasi fed-batch adalah sirup glukosa pati sagu. Atifah (2006) telah melakukan kultivasi fed-batch dengan perlakuan jenis umpan. Jenis umpan tersebut adalah sirup glukosa, sirup glukosa dengan MgSO4, sirup glukosa dengan (NH4)2HPO4 dan MgSO4, dan umpan berupa media lengkap. Pengumpanan dengan sirup glukosa saja tanpa penambahan kompenen lain menghasilkan rendemen PHA dalam sel lebih besar bila dibandingkan jenis umpan yang lain. 3. Proses hilir PHA
Setelah proses kultivasi selama 96 jam, PHA dipanen dan kemudian dilakukan proses hilir untuk memperoleh PHA dari biomassa sel. Proses hilir tersebut akan memisahkan PHA dari bahan-bahan pengotor seperti asam nukleat, protein, lemak maupun sisa media yang masih ada. Proses hilir dilakukan dalam dua tahap, yaitudigest dengan NaOH dan ekstraksi dengan pelarut.