Unsur-unsur transisi pada periode 4, terdiri dari scandium (Sc), titanium (Ti), vanadium (V), krom (Cr), mangan (Mn), besi (Fe), kobalt (Co), nikel (Ni), tembaga (Cu) dan seng (Zn). Sesuai dengan pengisian elektron pada subkulitnya, unsur ini termasuk unsur blok d, yaitu unsur-unsur dengan elektron valensi yang terletak pada subkulit d dalam konfigurasi elektronnya.
Unsur NomorAtom KonfigurasiElektron
Orbital
3d 4s
Skandium
(Sc) 21 (Ar) 3d1 4s2
Titanium (Ti) 22 (Ar) 3d2 4s2
Vanadium (V) 23 (Ar) 3d3 4s2
Krom (Cr) 24 (Ar) 3d5 4s1
Mangan (Mn) 25 (Ar) 3d5 4s2
Besi (Fe) 26 (Ar) 3d6 4s2
Kobalt (Co) 27 (Ar) 3d7 4s2
Nikel (Ni) 28 (Ar) 3d8 4s2
Tembaga (Cu) 29 (Ar) 3d10 4s1
Seng (Zn) 30 (Ar) 3d10 4s2
Uraian Materi
Konfigurasi elektron Cr bukan (Ar) 3d4 4s2 tetapi (Ar) 3d5 4s1. Demikian halnya dengan konfigurasi elektron Cu bukan (Ar) 3d9 4s2 tetapi (Ar) 3d10 4s1. Hal ini berkenaan dengan kestabilan orbitalnya, yaitu orbital-orbital d dan s stabil jika terisi penuh, bahkan 1/
2 penuh pun lebih stabil daripada orbital lain.
Unsur transisi mempunyai sifat- sifat khas yang membedakannya dari unsur golongan utama, antara lain:
1. Bersifat logam. Semua unsur transisi tergolong logam karena dengan titik leleh dan titik didih yang relatif tinggi ( unsur – unsur golongan utama ada yang tergolong logam, metaloid, dan logam).
2. Bersifat paramagnetik (sedikit tertarik ke dalam medan magnet).
3. Membentuk senyawa – senyawa yang berwarna (senyawa dari unsur logam golongan utama tidak berwarna).
4. Mempunyai beberapa tingkat oksidasi (unsur logam golongan utama umumnya hanya mempunyai sejenis tingkat oksidasi).
5. Membentuk berbagai macam ion kompleks (unsur logam golongan utama tidak banyak yang dapat membentuk ion kompleks).
Sifat-sifat khas unsur transisi dapat dijelaskan berdasarkan konfigurasi elekronnya. Secara terinci, sifat-sifat unsur transisi periode keempat dijelaskan sebagai berikut.
A. Sifat Fisis Unsur-unsur Transisi Periode Keempat
Simak kecenderungan sifat-sifat fisis unsur-unsur transisi periode keempat pada tabel 1 berikut,
Tabel 1. Beberapa Sifat Unsur Transisi Periode Keempat
Jari-jari atom (Å) 1.44 1.32 1.22 1.18 1.17 1.17 1.16 1.15 1.17 1.25
Jari-jari ion X2+(Å) - 1.00 0.93 0.87 0.81 0.75 0.79 0.83 0.87 0.88
Titik leleh (0C) 1541 1660 1890 1857 1224 1535 1495 1455 1083 420
Titik didih (0C) 2831 3287 3380 2672 1962 2750 2870 2732 2567 907
Massa jenis (g cm-3) 3 4.5 6 7.2 7.2 7.9 8.9 8.9 8.9 7.1
Kekerasan (skala Mohs)
- - - 9 5 4.5 - - 3 2.5
Energy ionisasi (kJ mol-1)
631 658 650 652 717 759 758 737 745 906
Keelektronegatifan 1.3 1.5 1.6 1.6 1.5 1.5 1.8 1.8 1.9 1.6
E0
red X2+(aq)(volt) - - -1.2 -0.91 -1.19 -0.44 -0.28 -0.25 +0.34 -0.76
E0
red X3+(aq)(volt) -2.1 -1.2 -0.86 -0.74 -0.28 -0.4 - - -
-Dari tabel sifat keperiodikan di atas, kita dapat simpulkan beberapa sifat atomik dan sifat fisis dari logam transisi :
1. Sifat Logam
Semua unsur transisi mempunyai sifat logam, sehingga berbeda dengan unsur-unsur utama yang dapat bersifat logam maupun non logam. Sifat itu disebabkan semua unsur transisi memiliki energi ionisasi yang rendah, yaitu kurang dari 1.000 kJ/mol (sehingga mudah membentuk ion positif ) dan keelektronegatifannya rendah yaitu kurang dari 2.
Ditinjau dari konfigurasi elektronnya, hal ini terjadi karena unsure transisi memiliki lebih banyak elektron tidak berpasangan. Elektron ini bebas bergerak pada kisi kristalnya sehingga dapat membentuk ikatan logam yang lebih kuat dibandingkan dengan unsure utama. Akibatnya, sifat kekerasan dan kerapatan logam-logam transisi menjadi lebih tinggi. Akibat lainnya, sifat penghantar listrik lebih baik dibandingkan dengan logam-logam utama.
tidak berpasangan dalam orbital, semakin kuat ikatan logamnya dan semakin tinggi titik lelehnya. Hal ini disebabkan orbital subkulit d pada unsure transisi banyak orbital yang kosong atau tersisi tidak penuh. Adanya orbital yang kosong memungkinkan atom-atom membentuk ikatan kovalen (tidak permanen) disamping ikatan logam. Orbital subkulit 3d pada seng terisi penuh sehingga titik lelehnya rendah. Bandingkan dengan unsure utama yang titik didih dan titik lelehnya juga relative rendah.
Jadi berdasarkan tabel (lihat titik lelehnya), kekuatan ikatan logam cenderung bertambah dari Sc ke V dan berkurang dari Cr ke Zn. Hal ini terjadi karena dari Sc ke V berdasarkan konfigurasi elektronnya semakin banyak elektron yang tidak berpasangan, akibatnya elektron-elektron itu akan bergerak bebas pada kisi kristalnya sehingga membentuk ikatan logam yang kuat. Sedangkan dari Cr ke Zn, elektron mulai berpasangan sehingga kekuatannya semakin berkurang.
Berdasarkan konfigurasi elektron valensinya terlihat bahwa seng tidak memiliki elektron tidak berpasangan. Hal ini mengakibatkan titik leleh seng paling rendah di antara unsur-unsur transisi periode empat
2. Jari-jari Atom
Nilai jari-jari atom cenderung berkurang dari Sc ke Ni, dan bertambah dari Ni ke Zn. Nilai jari-jari atom dipengaruhi oleh gaya tarik-menarik antara inti dan elektron. Pada logam transisi, elektron yang terlibat tidak hanya dari sub kulit terluar ns, tetapi juga dari subkulit sebelumnya yakni (n-1)d. Hal ini dikarenakan tingkat energi subkulit ns dan (n-1)d yang hampir sama. Penurunan jari-jari atom dari Sc ke Ni terjadi karena meski terdapat lebih banyak elektron di subkulit 3d, namun elektron-elektron ini terikat semakin kuat ke inti. Hal ini dikarenakan muatan inti yang bertambah positif dari kiri ke kanan. Akan tetapi, penurunan jari-jari dari Cr ke Ni tidak terlalu signifikan.
tolak menolak ini mampu mengimbangi gaya tarik menarik antara inti dan elektron-elektron. Sementara itu kenaikan jari-jari atom dari Cu ke Zn dikarenakan semua elektron di subkulit 3d telah berpasangan, sehingga gaya tolak menolak antar-elektron lebih besar.
3. Energi Ionisasi. Energi ionisasi cenderung bertambah dari Sc ke Zn. Walaupun terjadi sedikit fluktuatif, namun secara umum Ionization Energy (IE) meningkat dari Sc ke Zn. Hal ini terjadi karena, dalam upaya mencapai konfigurasi gas mulia, logam transisi akan melepas elektron-elektron di subkulit s dan d-nya. Karena jumlah elektron di subkulit d yang tergolong banyak, maka dibutuhkan energi yang lebih besar untuk melepas elektron-elektron tersebut, sehingaa kecenderungan nilai energi ionisaninya secara umum bertambah dari sc ke Zn.
4. Kekerasan berkurang dari Cr ke Zn. nilai kekerasan dari Cr ke Zn berkurang dapat dijelaskan dari kekuatan ikatan logam. Ingat ! (Semakin banyak elektron yang tidak berpasangan dalam orbital, semakin kuat ikatan logamnya). Jadi semakin ke kanan kekuatan ikatan logam semakin berkurang karena elektron cenderung berpasangan.
5. Titik leleh dan titik didih bertambah dari Sc ke V dan kemudian secara umum berkurang dari V ke Zn. Kecenderungan nilai titik leleh dan titik didih menunjukkan kekuatan ikatan logam yang meningkat dari Sc dan v dan kemudian berkurang dari v ke Zn.
6. Daya hantar listrik dan panas secara umum bertambah dari Sc ke Zn.
Daya hantar listrik dan panas pada logam dipengaruhi oleh muatan inti dan jumlah elektron valensi yang dapat bergerak bebas. Secara umum, logam transisi memiliki daya hantar listrik dan panas yang semakin baik dari Sc ke Zn. Hal ini dikarenakan jumlah elektron-elektron valensinya dapat bergerak bebas bertambah dari Sc ke Zn.
Unsur-unsur transisi memiliki sifat kimia yaitu kerektifan dan kelarutan. unsur transisi bereaksi lambat dengan air, oksigen dan halogen. Unsur-unsur transisi periode empat kurang reaktif dibanding alkali dan alkali tanah. Kereaktifan yang lemah mengakibatkan unsur transisi tahan terhadap korosi. Korosi terjadi apabila suatu unsur berekasi cepat dengan oksigen dan air. Sementara itu, sebagian besar transisi bersifat larut dalam asam mineral encer.
1. Kereaktifan
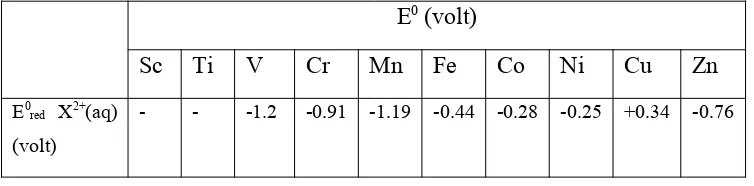
Kereaktifan unsur-unsur transisi periode keempat ditunjukkan dari nilai
Potensial reduksi standar (E0) pada tabel berikut.
Tabel 2. Nilai (E0) dari unsur-unsur transisi periode keempat E0 (volt)
Sc Ti V Cr Mn Fe Co Ni Cu Zn
E0
red X2+(aq)
(volt)
- - -1.2 -0.91 -1.19 -0.44 -0.28 -0.25 +0.34 -0.76
Dari tabel terlihat, secara umum nilai E0 negatif. Hal ini berarti unsur-unsur transisi ini mudah teroksidasi, berarti bersifat reaktif. Namun, kecenderungan ini secara umum berkurang dari kiri ke kanan karena nilai E0 yang bertambah besar. Sehingga kereaktifan cenderung semakin berkurang/rendah. Perkecualian adalah Cu yang memiliki nilai E0 positif yang menunjukkan Cu tidak mudah teroksidasi.
Kebanyakan logam transisi bersifat inert terhadap asam atau bereaksi lambat karena adanya lapisan oksida pelindung. Salah satu kasusnya adalah kromium ; unsur ini secara kimia sangat inert karena pada permukaannya terbentuk kromium(III) oksida, Cr2O3. Akibatnya, kromium biasa digunakan sebagai pelindung dan pelapis nonkorosif pada logam lain.
Unsure transisi periode keempat mempunyai sifat-sifat khas yang membedakannya dari unsure golongan utama. Sifat-sifat khas unsure transisi berkaitan dengan adanya sub kulit d yang terisi penuh.
1. Sifat Magnet
Perhatikanlah gambar cara mengukur kemagnetan suatu zat dibawah ini !
2. 3. 4.
5.
Berdasarkan sifat kemagnetannya, unsur-unsur transisi mempunyai sifat sebagai berikut.
1) Diamagnetik yaitu dapat ditolak oleh medan magnet.
Sifat ini dimiliki oleh atom, molekul, atau ion yang seluruh elektron pada orbitalnya berpasangan.
2) Paramagnetik yaitu sedikit dapat ditarik oleh medan magnet.
Sifat ini dimiliki oleh atom, molekul, atau ion yang memiliki elektron yang tidak berpasangan pada orbitalnya.
Unsur-unsur logam transisi pada umumnya memiliki elektron yang tidak berpasangan pada orbital-orbital d. dengan demikian, kebanyakan dari unsur-unsur dan senyawa logam transisi bersifat paramagnetic (tertarik oleh medan magnet) dan bukan bersifat diamagnetik (tidak tertarik oleh medan magnet). Sifat paramagnetik pada unsur-unsur transisi semakin kuat jika jumlah elektron yang tidak berpasangan pada orbitalnya semakin banyak.
Zat diagmanetik akan ditolak sedikit oleh medan magnet luar sehingga berat zat akan berkurang
Contoh:
1. Skandium dengan konfigurasi:
2. Besi dengan konfigurasi:
3. Seng dengan konfigurasi:
Logam transisi periode keempat yang bersifat paramagnetik antara lain Sc, Ti, V, Cr, dan Mn, sedangkan yang bersifat diamagnetik antara lain Cu dan Zn. Unsur Fe, Co, dan Ni terdapat sedikit keunikan pada sifat kemagnetannya yang disebut feromagnetik. Sifat unik yang dimiliki oleh unsur-unsur ini, meskipun logam feromagnetik ini sudah dijauhkan dari medan magnet, tetapi induksi magnet dari logam ini tidak ikut menghilang, melainkan tetap terkandung dalam logam itu. Hal ini sangat berbeda dari sifat logam paramagnetik yang segera kehilangan induksi magnet ketika dijauhkan dari medan magnet. Dengan demikian dapat dikatakian bahwa logam ferromagnetic dapat dijadikan magnet permanen, sedangkan logam paramagnetik hanya bersifat magnet jika berada di lingkungan suatu medan magnet.
2. Tingkat Oksidasi (Bilangan Oksidasi)
Tidak seperti golongan IA dan IIA yang hanya mempunyai tingkat oksidasi +1 dan +2, unsur-unsur logam transisi mempunyai beberapa tingkat
Bersifat diamagnetik (Ar)
4s2
3d10
↑↓ Bersifat
paramagnetik
3d1 4s2
(Ar)
3d6 4s2
(Ar) Bersifat
oksidasi. Perhatikanlah beberapa senyawa mangan (Mn) berikut, yaitu MnSO4, MnO2, K2MnO4, dan KMnO. Bilangan oksidasi mangan dalam senyawa-senyawa itu berturut-turut adalah +2, +4, +6, +7. Mengapa unsure transisi dapat membentuk senyawa dengan beberapa bilangan tingkat oksidasi ?
Adanya bilangan oksidasi lebih dari satu ini disebabkan mudahnya melepaskan elektron valensi (bersifat elektropositif), sehingga bilangan oksidasinya bertanda positif. Bilangan oksidasi maksimum yang dicapai suatu unsur transisi menyatakan jumlah elektron pada subkulit 3d dan 4s. Dengan demikian, energi ionisasi pertama, kedua dan seterusnya memiliki harga yang relatif lebih kecil dibanding unsur golongan utama.
Jumlah elektron tidak berpasangan unsur scandium = 1, titanium = 2, vanadium = 3, krom = 6, mangan = 5, besi = 6, kobalt = 3, nikel = 2, tembaga = 1 dan seng = 0. Semua elektron dari unsur scandium sampai mangan pada orbital d-nya tidak berpasangan sehingga elektrond-nya relative lebih mudah dilepaskan. Hal ini mengakibatkan atom-atomnya cenderung mencapai bilangan oksidasi maksimum. Pada unsur besi sampai seng, elektron pada orbital d-nya mulai berpasangan dan terisi penuh. Dengan demikian, unsur-unsur ini cenderung lebih sukar mencapai bilangan oksidasi maksimum.
Unsur scandium dan seng hanya memilik satu macam bilangan oksidasi. Bilangan oksidasi scandium = +3 karena melepaskan 3 elektron (2 elektron pada orbital 4s dan 1 elektron pada orbital 3d) untuk memiliki konfigurasi elektron stabil. Sementara itu, bilangan oksidasi seng = +2 karena dengan melepaskan 2 elektronnya saja (dari orbital 4s), seng telah mencapai kestabilan tanpa melepaskan elektron dari subkulit 3d.
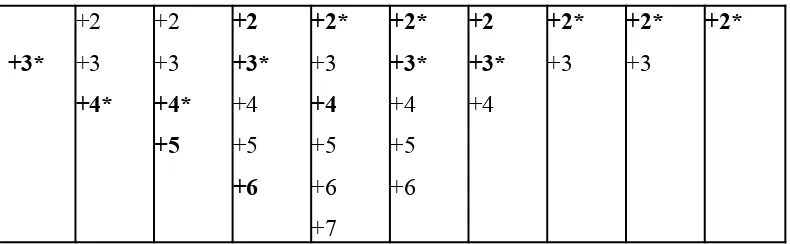
Tingkat oksidasi dari unsur-unsur transisi periode keempat diberikan pada Tabel 3.
Tabel 3. Tingkat Oksidasi Unsur Periode keempat
IIIB Sc
IVB Ti
VB V
VIB Cr
VIIB Mn
VIIIB IB
Cu
IIB Zn
Fe Co Ni
+3* +2 +3 +4* +2 +3 +4* +5 +2 +3* +4 +5 +6 +2* +3 +4 +5 +6 +7 +2* +3* +4 +5 +6 +2 +3* +4 +2* +3 +2* +3 +2*
Yang dicetak tebal adalah tingkat oksidasi biasa dan yang diberi bintang adalah tingkat oksidasi paling stabil.
3. Warna Senyawa unsur transisi periode keempat
Sebagian besar ion-ion logam transisi berwarna. Warna-warna khas dari ion logam dapat dilihat dalam tabel berikut.
Tabel 1. Warna-Warna Ion Logam Transisi
Unsur Ion Warna Unsur Ion Warna
Sc Sc3+ Tidak berwarna Mn
Mn2+ Mn3+ MnO4
-Merah muda Merah-coklat Coklat-ungu Ti Ti2+ Ti3+ Ti4+ Ungu Ungu-hijau Tidak berwarna Fe Fe2+ Fe3+ Hijau Jingga V V2+ V3+ VO2+ VO4
3-Ungu Hijau Biru Merah Co Co 2+ Co3+ Merah muda Biru Ni Ni 2+ Ni3+ Hijau Merah Cr Cr2+ Cr3+ CrO4 2-Cr2O7
2-Biru Hijau Kuning Jingga Cu Cu + Cu2+ Tidak berwarna Biru
Warna yang timbul dari ion-ion tersebut disebabkan oleh tingkat energi elektron pada unsur-unsur transisi hampir sama. Jadi, elektron-elektron dapat bergerak ke tingkat yang lebih tinggi dengan mengadsorpsi sinar tampak.
Dari tabel di atas, terlihat bahwa untuk ion Sc3+ , Ti4+, Cu+, dan Zn2+ tidak berwarna. Hal ini dapat dijelaskan berdasarkan konfigurasi elektron dari ion-ion tersebut. Pada konfigurasi ion Sc3+ (4s0 3d0) dan ion Ti4+ (4s0 3d0) tampak bahwa kedua ion tersebut tidak memiliki elektron pada subkulit 3d. Sementara itu, pada konfigurasi ion Cu+ (4s0 3d10) dan ion Zn2+ (4s0 3d10) tampak bahwa kedua ion tersebut subkulit 3d-nya terisi penuh. Jadi, yang menyebabkan senyawa dari ion-ion tersebut menjadi tidak berwarna karena adanya subkulit 3d yang kosong atau terisi penuh. Pada ion-ion yang berwarna, subkulit 3d-nya belum terisi penuh sehingga elektron-elektron pada subkulit 3d tersebut dapat menyerap energi cahaya. Energi tersebut menyebabkan elektron-elektron tereksitasi dan memancarkan energi cahaya dengan warna yang sesuai dengan warna cahaya yang dapat dipantulkannya pada saat kembali ke keadaan dasar.
5. Banyak di antaranya dapat membentuk ion kompleks
Ion kompleks adalah ion yang terdiri atas atom pusat dan ligan. Biasanya atom pusat merupakan logam transisi yang bersifat elektropositif dan dapat menyediakan orbital kosong sebagai tempat masuknya ligan. Contohnya ion besi (III) membentuk ion kompleks [Fe(CN)6].
6. Beberapa diantaranya dapat digunakan sebagai katalisator