ORTO DAN PARA
NITROFENOL
Tujuan
1. Mensintesis o-nitrofenol dan p-nitrofenol dari fenol
dan asam nitrat melalui nitrasi
2. Memisahkan o-nitrofenol dan p-nitrofenol dengan
metode distilasi uap
3. Memurnikan o-nitrofenol dan p-nitrofenol dengan
metode rekristalisasi
4. Menentukan kemurnian dari o-nitrofenol dan
p-nitrofenol dengan metode titik leleh
5. Menentukan rendemen dari o-nitrofenol dan
p-nitrofenol
Prinsip
Nitrasi
Nitrasi
• subtitusi elektrofilik NO2+terhadap cincin aromatik benzena
Distilasi
Uap
Distilasi
Uap
• proses pemisahan campuran
berdasarkan perbedaan tekanan uap
• Hukum Raoult
• tekanan uap parsial
sebanding dengan tekanan uap pelarut murni
dikalikan fraksi molnya.
• Perbedaan Titik Didih • Suhu pada saat
kesetimbangan di antara tekanan uap senyawa dan tekanan uap campuran.
metode pemurnian kristal dengan melarutkannya pada pelarut yang berbeda karakteristik kelarutannya dengan komponen target dan pengotor.
Rekristalisasi
Kecenderungan suatu zat untuk larut dalam pelarut yang memiliki kepolaran yang relatif sama.
Like Dissolve Like
Suhu pada saat kesetimbangan antara fase padat dan cairan
Titik Leleh
Pelarut Organik lebih larut dalam pelarut panas dibandingkan pelarut dingin
Perbedaan kelarutan senyawa organic pada pelarut panas
REAKSI
OH+
HO NO2 OH NO2 OH NO2Fenol Asam Nitrat
Pembentukan Ion
Nitrosonium
O
Pembentukan
o
-nitrofenol
OH+
O N+ O OH NO2 + OH NO2 + OH NO2 + O+ H NO2 H OH NO2 nitrofenol o 1)Pembentukan
p
-nitrofenol
OH+
O N+ O OH NO2 OH NO2 OH O2N H OH NO2 + + + nitrofenol p 2)Senyawa Aromatik
Persyaratan Untuk
Senyawa Aromatik
(Fessenden &
Fessenden, 1982) :
•
Siklik
•
Datar
•
Memiliki orbital
p
tegak lurus bidang
cincin
•
Aturan Huckel
•
Π = 4n+2
H
H
H
H
H
H
benzene
SUBSTITUSI AROMATIK NUKLEOFILIK
H E
+E+ Y– + H Y
Reaksi dalam mana suatu elektrofil disubstitusikan untuk satu atom hidrogen pada cincin aromatik (Fessenden & Fessenden, 1982)
Substitusi Aromatik
Nukleofilik
Substitusi Aromatik
Nukleofilik
Halogenasi Halogenasi H + + HBr FeBr3 Br2 Br•
Nitrasi
H + + H2O H2SO4 HONO2 NO2
Sulfonasi
Sulfonasi
H + + H2O heat HOSO2OH SO2OH•
Alkilasi – Friedel Crafts
H + + HCl AlCl3 C(CH3)3 (CH3)3CCl
•
Asilasi – Friedel Crafts
H + + HCl AlCl3 O CH3CH2CCl CCH2CH3 O
Substitusi Kedua
Suatu benzena
tersubstitusi
dapat mengalami
substitusi gugus
kedua
Suatu benzena
tersubstitusi
dapat mengalami
substitusi gugus
kedua
Posisi substituen
kedua tergantung
pada gugus
substituen
pertama yang
menempel pada
cincin benzen
(pengarah -o, -p
atau pengarah
-m)
Posisi substituen
kedua tergantung
pada gugus
substituen
pertama yang
menempel pada
cincin benzen
(pengarah -o, -p
atau pengarah
-m)
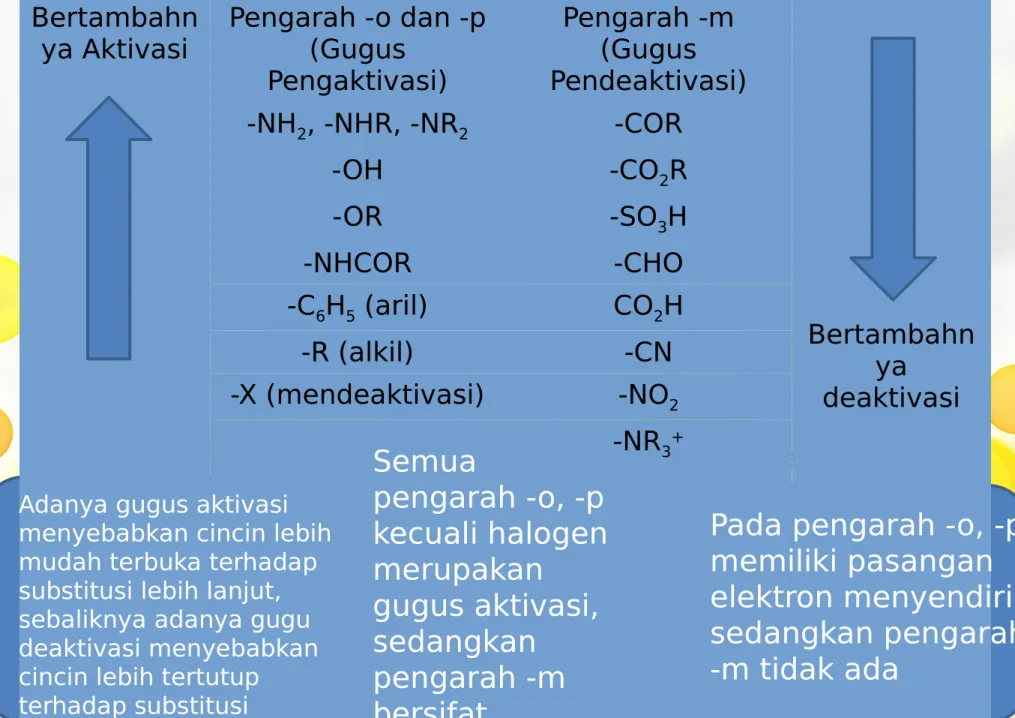
Tabel 10.6 Efek substituen pertama terhadap substitusi kedua
Bertambahn
ya Aktivasi Pengarah -o dan -p(Gugus Pengaktivasi) Pengarah -m (Gugus Pendeaktivasi) Bertambahn ya deaktivasi -NH2, -NHR, -NR2 -COR -OH -CO2R -OR -SO3H -NHCOR -CHO -C6H5 (aril) CO2H -R (alkil) -CN -X (mendeaktivasi) -NO2 -NR3+
Semua
pengarah -o, -p
kecuali halogen
merupakan
gugus aktivasi,
sedangkan
pengarah -m
bersifat
deaktivasi
Adanya gugus aktivasi menyebabkan cincin lebih mudah terbuka terhadap substitusi lebih lanjut, sebaliknya adanya gugu deaktivasi menyebabkan cincin lebih tertutup
terhadap substitusi
Pada pengarah -o, -p
memiliki pasangan
elektron menyendiri,
sedangkan pengarah
-m tidak ada
Contoh reaksi substitusi kedua :
Pengarah –o dan –p
Pengarah meta OH
+
HONO2 H 2 S O 4 OH NO2+
OH NO2 phenol 2-nitrophenol 4-nitrophenol NO2 H N O 3 H 2S O 4 NO2 NO2 nitrobenzene 1,3-dinitrobenzeneALAT DAN
BAHAN
ALA
T
Corong buchner Gelas Kimia Gelas Ukur Heating mantle Kaca arloji Klem Labu Erlenmeyer Penangas airPeralatan distilasi uap Statif
BAHAN
Akuades
Asam klorida
Asam nitrat
Fenol
Karbon aktif
n-heksana
Sifat fisik dan kimia
Asam nitrat (HNO3)
Titik didih : 121° C Titik leleh : -41 ° C
Cairan bening dan sedikit beruap,larut dalam air,korosif
Aquades (H2O) Mr : 18 Titik didih : 100 ° C Titik leleh : -Tidak berbau,tidak berwarna,berbentuk cairan,polar Fenol (C6H5OH) Mr : 94,11 Titik didih : 182 ° C Titik leleh : 42 ° C
Mudah larut dalam air,tidak berwarna Hexanes (C6H14) Mr : 86,18 Titik didih : 68 ° C Titik leleh : -95 ° C
Cairan tidak berwarna,larut dalam dietil eter dan aseton ,tidak larut dalam
air ,volatil Asam klorida (HCl) Titik didih : 108,58 ° C Titik leleh : -62,25 ° C Tidak berwarna,asam kuat,korosif,larut dalam air,berabau tajam
Asam Nitrat
30%Masukkan dalam tabung reaksi sebanyak 3,3 mL Masukkan termometer
Dinginkan di dalam penangas es (5-10˚C) Tambahkan fenol 80% perlahan 1 mL
Biarkan campuran pada suhu ruang selama 30 menit Lapisan semi solid
organikCuci dengan 10 mL air
Buang lapisan atas campuran Cuci dengan 2 x 10 mL air Dekantasi larutan
Lapisan Organik
Lapisan Air
Prosedur dan Pembahasan
Asam Nitrat pekat
Tambahkan akuades
pelarut dan donor proton yang akan bereaksi dengan HNO3, membentuk elektrofil NO2+
Penambahan fenol ke dalam campuran asam nitrat dan air dilakukan pada suhu yang rendah, sekitar 7oC,
karena:
1. Ea sebanding dengan suhu. Suhu yang tinggi akan menghasilkan p-nitrofenol sebagai produk utama.
2. Menghindari oksisdasi fenol karena asam nitrat yang akan menghasilkan ester nitrat.
3. Reaksi antara asam nitrat dengan fenol bersifat eksoterm dan dapat menimbulkan ledakan jika dilakukan pada suhu ruang.
Agar reaksi berjalan sempurna sehingga produk yang dihasilkan jumlahnya maksimal
Terbentuk dua lapisan: Atas : lapisan air
Bawah : lapisan organik
menghilangkan ion nitrat dan fenol yang tidak bereaksi membentuk produk
Lapisan
OrganikMasukkan dalam labu dasar bulat berisi 15 mL air Tambahkan batu didih
Distilasi Distilat kuning Residu hitam Tampung
Saring dengan corong buchner Kristal Tambahkan heksana Rekristalisasi Saring Filtrat Tambahkan 5 mL air Tambahkan 0,3 mL HCl Tambahkan 0,3 g karbon aktif Panaskan Campur Saring Filtrat coklat tua
Biarkan pada suhu ruang Dinginkan dalam penangas es Kristal o -nitrofenol Timbang Hitung rendemen Uji titik leleh
Hasil Dinginkan pada penangas es Kristal p -nitrofenolTimbang Hitung rendemen Uji titik leleh
Hasil
Produk orto dan para-nitrofenol dapat dipisahkan satu sama lain dengan metode distilasi uap. Hal ini disebabkan:
•Isomer orto tidak larut dalam air, namun terbawa uap air
•Selama proses distilasi, isomer orto tidak terurai
•Isomer orto memiliki tekanan uap yang tinggi pada suhu sekitar titik didih campuran, sedangkan tekanan uap isomer para lebih rendah dibandingkan isomer orto
•Isomer orto dan para memiliki massa molekul relatif tinggi
o-nitofenol bersifat volatil karena ikatan hidrogennya intramolekular dan menyebabkan terjadinya asosiasi disepanjang molekul
Pada saat distilasi yang perlu diperhatikan adalah :
•Jumlah air dalam labu didih adalah tiga perempat bagaian agar uap air cukup selama proses distilasi berlangsung.
•Penggunaan batu didih agar tidak terjadi bumping.
•Kondensor tidak dialiri air agar distilat o-nitrofenol tidak
mengkristal di dalam kondensor.
•Distilat ditampung di labu
Erlenmeyer dalam penangas es agar segera membentuk kristal.
n-heksana dipilih karena:
•Tidak bereaksi dengan kristal o-nitrofenol
•Volatile
•Titik didih lebih rendah (68,7oC) dari titik leleh Kristal
o-nitrofenol
Pada p-nitrofenol yang terjadi adalah ikatan hidrogen
intermolekular Kristal p-ortofenol tidak
terbentuk, karena
1. Lapisan organik yang masih menempel di dinding labu erlenmeyer dan dinding corong pisah sehingga mengurangi jumlah kristal para yang mungkin terbentuk.
2. Saat rekristalisasi, kondisi larutan tidak tepat jenuh sehingga kristal isomer sulit terbentuk.
3. Suhu sistem yang tidak dijaga antar 55-85˚C karena pada rentang suhu tersebut isomer para memiliki kelarutan yang cukup tinggi dalam air sehingga dapat dipisahkan ketika penyaringan. Menghilangkan pengotor OH N+ O O
-Ikatan Hidrogen Intramolekular
O H N+ O O- HO N+ O O
Mengapa rendemen yang terbentuk sedikit?
1. Terbentuknya polinitrasi dan oksidasi fenol sehingga reaksi menjadi tidak regioselektif
2. Masih banyak lapisan organik yang menempel di dinding labu
erlenmeyer dan di dinding corong pisah karena sifat lapisan organik yang berminyak sehingga menyulitkan pembilasan.
HASIL PENGAMATAN
ZAT PERLAKUAN HASIL
HNO3 70% • Diambil 15mL • Diencerkan dengan akuades hingga 35mL HNO3 30% HNO3 30% • Diambil 3,3mL • Dimasukan ke tabung reaksi • Disimpan dalam penangas es • Ditambah 1mL fenol T=50-100c Lapisan semisolid Lapisan semisolid • Dibiarkan pada suhu ruang • Ditambah 10mL air • Dipisahkan • Dicuci dengan 2x10mL air Larutan menjadi kehitaman Terbentuk 2 fase larutan Lapisan Organik
ZAT PERLAKUAN HASIL Lapisan Organik • Dimasukan ke labu dasar bulat, ditambah 15mL air dan batu didih • Didistilasi Distilat Kuning
Distilat Kuning • Ditampung dalam Erlenmeyer diatas penangas es Kristal kuning orto nitrofenol
Kristal kuning • Ditambahkan n-heksana • Direkristalisa si,disarng • Dikeringkan , ditimbang • Diukur titik lelehnya Kristal orto nitrofenol murni m=0,7456 g TL= 43,90 -49,40c
ZAT PERLAKUAN HASIL
Residu hitam • Ditambah 5mL air, 0,3mL HCl pekat, 0,3 g karbon aktif • Dipanaskan • Disaring dan didinginkan Tidak terbentuk para nitrofenol
PERHITUNGAN
• Pengenceran asam nitrat
(V1.N1)HNO3 70% =(V2.N2)HN03 30% V1. 70% = 35mL. 30%
V1 = 20mL
• Perhitungan konsentrasi HNO3 30% M= = = 6,6190 M
• Perhitungan konsentrasi fenol M= = 9,3508 M
Stoikiometri
Mol HNO3= M. V
• Mol fenol = M.V = 9,3508M. 1mL= 9,2508 mmol= 9,3508. 10-3 mol M 9,3508.10-3 21,8427.10-3 - -R 9,3508.10-3 9,3508.10-3 9,3508.10-3 9,3508.10-3 S - 12,4919.10-3 9,3508.10-3 9,3508.10-3 Massa ortonitrofenol • Teoritis: m= n.Mr = 9,3508.10-3mol. 139,11 g/mol = 1,3008g • Praktis: m= 0,7356g %rendemen= .100%= 56,55%
KESIMPULA
N
O- dan P- Nitrofenol dapat disintesis dari
fenol dan asam nitrat melalui reaksi nitrasi
O- dan P- Nitrofenol dapat dipisahkan
dengan metode distilasi
O- dan P- Nitrofenol dapat dimurnikan
dengan metode rekristalisasi
Kemurnian O- Nitrofenol dapat
ditentukan berdasarkan titik lelehnya yaitu 43,9-49,40c
rendemen dari O- Nitrofenol dapat
DAFTAR PUSTAKA
•
Fessenden, R. J. & Fessenden, J. S. 1982. Kimia
Organik. Diterjemahkan oleh A. H. Pudjaatmaka.
Erlangga. Jakarta
•