DETEKSI COXIELLA BURNETII PADA RUMINANSIA
(Detection of Coxiella burnetii in Ruminants)
HAPSARI MAHATMI1,AGUS SETIYONO2,RETNO DAMAYANTI SOEJOEDONO1danFACHRIYAN HASMI PASARIBU1
1
Fakultas Kedokteran Hewan, Universitas Udayana, Denpasar, Bali
2
Fakultas Kedokteran Hewan, Institut Pertanian Bogor, Bogor
ABSTRACT
The research of detection and characterization of Coxiella burnetii in ruminant have been done. Coxiella
burnetii is an obligate intracellular bacterium that causes Q fever in human and livestock, that is a worldwide
zoonosis. Among humans, C. burnetii is considered an occupational hazard and caused epidemics in abbatoir and livestock workers, scientific workers and pet owners. Nested-Polymerase Chain Reaction (Nested-PCR) was used to detect Coxiella burnetii, during 2004 to 2006. The first set of primers (OMP1 and OMP2) were used to detect the genomic sequences and the second set of primers (OMP3 and OMP4) were used to detect the conserved specific sequences. A total of 410 sample organs such as liver and lung from cattle (245 samples), sheep (105 samples) and goats (60 samples) from abbatoir in Bogor and Bali province were investigated. Positive results were obtained from 15 cattles of 410 large ruminant samples (3.66%), and 6 sheeps of 410 large ruminant samples (1.46%) and no positive result from goat. Interestingly, 3 of 15 positive cattle samples were origanated from Bali cattle. The evidence showed that Coxiella burnetii maybe widespread in Indonesia. This is the first report of detection of Coxiella burnetii from livestock in Indonesia.
Key Words: Q Fever, Coxiella burnetii, Zoonosis, Nested-PCR, Ruminant
ABSTRAK
Penelitian tentang deteksi Coxiella burnetii pada ruminansia telah dilakukan dari tahun 2004 sampai dengan 2006. Total sampel yang diperiksa sebanyak 410 ekor, terdiri dari 245 sapi, 105 domba dan 60 kambing yang berasal dari wilayah Bogor dan Bali. Deteksi C. burnetii dilakukan dengan metode Nested-polynerase chain reaction (Nested-PCR). Hasil pemeriksaan menunjukkan bahwa 15 ekor sapi (3,66%) dan 6 ekor domba(l,46%) positif terhadap DNA C. burnetii, sedangkan pada kambing dari Bali negatif (0%). Suatu hal yang menarik bahwa 3 dari 15 ekor sapi yang menunjukkan hasil positif merupakan sapi Bali yang berada di Bali. Hasil positif terhadap adanya sekuen DNA dari C. Burnetii, merupakan suatu peringatan bahwa mungkin tanpa diketahui sudah terjadi penyebaran Q Fever di Indonesia.
Kata Kunci: Q Fever, Coxiella burnetii, Zoonosis, Nested-PCR, Ruminansia
PENDAHULUAN
Coxiella burnetii, adalah bakteri penyebab Q fever, yaitu penyakit yang bersifat zoonosis,
bersifat obligat intraseluler pada inangnya dan tersebar sangat luas di dunia. Bakteri ini mempunyai daya tahan yang tinggi di alam, tahan pada pH rendah, serta tahan terhadap beberapa bahan kimia pembasmi bakteri, seperti lisol, 0,5% sodium hipoklorit dan radiasi sinar UV (MAURIN danRAOULT, 1999). Oleh karena itu beberapa negara mengkatagorikan Coxiella burnetii kedalam kelompok bakteri yang berpotensi sebagai senjata biologis seperti halnya bakteri Bacillus
anthracis. Pemerintah Amerika menempatkan Q fever sebagai bahan sarana bioterorisme
katagori B (CDC 2003; SESHASDRI et al., 2003).
Penyakit Q fever bersifat zoonosis yaitu dapat ditularkan dari hewan ke manusia atau sebaliknya. Hewan ternak yang dapat terserang adalah sapi, kambing, domba maupun ternak ruminansia lain dan hewan-hewan liar, hewan peliharaan bahkan unggas. Caplak dan bangsa serangga merupakan sumber penularan yang penting selain bangsa rodensia (HTWE et al., 1992).
Penularan dapat terjadi melalui kontak langsung dengan hewan terinfeksi, partikel
debu yang terkontaminasi agen penyebab, makanan, minuman, luka pada kulit dan transfusi darah pada manusia. Gejala pada hewan umumnya bersifat subklinis, sering ditandai dengan adanya penurunan nafsu makan, gangguan pernapasan dan gangguan reproduksi berupa abortus pada domba dan sapi (BACA danPARETSKY, 1983; FOURNIER et
al., 1998).
Q fever seringkali bersifat akut dan
menahun serta dapat menimbulkan kondisi yang fatal yaitu mengakibatkan kegagalan fungsi hati, radang tulang, radang otak, gangguan pada pembuluh darah dan yang kerap terjadi adalah peradangan jantung (endokarditis) yang berakibat kematian (STEIN danRAOULT,1992). Laporan HO et al. (1996), menyatakan adanya kasus pneumonia pada anak-anak di Jepang yang ternyata disebabkan oleh Q fever. Demikian juga hasil penelitian yang dilaporkan oleh MARRIE (2003). Penelitian terbaru yang dilaporkan oleh STEIN
et al. (2005) menjelaskan bahwa penularan Q fever secara aerosol dapat menimbulkan lesi
yang hebat pada paru-paru.
Q fever telah menjadi problem kesehatan
masyarakat di banyak negara seperti Amerika, Perancis, Inggris, Italia, Jerman, Spanyol, Kanada, Jepang, Australia, Thailand, Taiwan, Malaysia dan beberapa negara lain, di Asia Tenggara. Penelitian tentang Q fever sudah demikian maju, bahkan sekuensing genom dari
C. burnetii secara lengkap sudah dilakukan
(SESHADRI et al., 2003). Hal ini mengingat
C. burnetii mempunyai potensi untuk dipakai
sebagai senjata biologis (RAOULt et al., 2002). Hasil survei di Jepang pada tahun 1954 yang dilaporkan oleh Kitaoka dalam HTWE et
al. (1992) bahwa 2,5% dari sapi dan 1,7%
kambing yang diperiksa menunjukkan adanya antibodi terhadap C. burnetii. Data seroepidemiologi tahun 1991 menunjukkan peningkatan yaitu dari 562 ekor sapi ternyata 226 ekor positif (40%), dari 256 ekor kambing yang diperiksa 45% positif, sedangkan dari 632 ekor anjing 55% positif terhadap adanya antibodi terhadap C. burnetii (HTWE et al.,
1992). Menurut laporan SCRIMGEOUR et al. (2003), bahwa dari 102 pasien anak-anak di rumah sakit di Oman, ternyata 9,8% menunjukkan seropositif terhadap C. burnetii. Pemeriksaan terhadap 54 ekor domba yang berasal dari propinsi yang berbeda di Oman
ternyata 52% seropositif terhadap C. burnetii. Hal ini juga menunjukkan adanya hubungan antara kasus yang terjadi pada hewan dan pada manusia. Baru-baru ini SETIYONO et al.(2005) telah menetapkan kriteria baru untuk uji serologis terhadap Q fever. Sedangkan penggunaan PCR untuk deteksi C. burnetii juga telah dievaluasi oleh OGAWA et al. (2004).
Laporan World Health Organization
(WHO) berdasarkan pemeriksaan serologis menyatakan bahwa penyakit Q fever pertama kali ditemukan di Indonesia pada tahun 1937, dimana dari 188 serum sapi yang diperiksa ternyata positif mengandung antibodi terhadap
C. burnetii (KAPLAN dan BERTAGNA, 1955).
Penelitian selanjutnya yang pernah dilaporkan adalah studi seroepidemiologi tentang Q fever di Indonesia pada tahun 1978 (VAN PEENEN et
al., 1978). MIYASHITA et al. (2001)
menemukan adanya kasus pneumonia yang terbukti disebabkan oleh C. burnetii dari seorang penderita yang mempunyai riwayat pernah tinggal di Indonesia. Penelitian seroepidemiologi terhadap Spotted fever group
Rickettsia di Indonesia yang terbaru dilakukan
oleh RICHARD et al. (2003) di kepulauan Gag ternyata contoh positif mempunyai persentase berkisar antara 2,1 – 20,4%.
Penelitian yang lebih mendalam terhadap penyebab Q fever di Indonesia sampai saat ini belum pernah dilaporkan. Hal ini bukan karena tidak adanya kasus Q fever, tetapi lebih disebabkan oleh gejala klinis bentuk akut infeksi Q fever yang tidak begitu menciri, yaitu terjadinya pneumonia, keguguran ataupun kasus lain belum didiagnosa kearah adanya infeksi Q fever, sehingga kurang menjadi perhatian oleh masyarakat seperti halnya kasus akut avian influenza (AI) ataupun Severe Acute
Respiratory Syndrome (SARS). Padahal
dampak jangka panjangnya sangat membahayakan dan fatal bagi manusia. Selain itu jumlah impor ternak terutama sapi dari negara-negara yang pernah dan sedang mengalami problem Q fever masih sangat tinggi yaitu mencapai 350.000 ekor sampai semester pertama pada tahun 2005 ataupun dalam bentuk daging beku, dari Australia sebanyak 14.951 ton dan dari Amerika sebanyak 10.343 ton. Sehingga penelitian yang lebih mendalam tentang Q fever di Indonesia sangat perlu dilakukan.
MATERI DAN METODE Lokasi dan waktu penelitian
Penelitian dilakukan di laboratorium Terpadu Departemen Kitwan dan Kesmavet Fakultas Kedokteran Hewan Institut Pertanian Bogor. Penelitian dilakukan mulai Oktober 2004 sampai dengan September 2006.
Bahan dan peralatan
Contoh penelitian diperoleh dari rumah potong hewan Bogor dan Bali, peternakan domba dan kambing, dengan jumlah 410 contoh, terdiri dari 245 sapi potong: 175 ekor sapi Brahman Cross, 70 ekor sapi Bali, 105 domba dari wilayah Bogor dan 60 ekor kambing yang berasal dari Bali. Contoh yang diambil berupa organ internal (hati, dan jantung) dari tiap ekor dan jenis hewan yang dipotong.
Bahan penelitian yang digunakan adalah
proteinase K, Kit purifikasi DNA dari
Puregene, PUREGENE DNA Purification Kit ;
Solid tissue protocol (Gentra systems,
Minneapolis, Minnesota, USA). PCR mixture yang terdiri dari aquabidestilata, taq buffer, dNTP, primer OMP1 dan OMP2, OMP3 dan OMP 4, taq polymerase. C burnetii strain Nine Mile 2 ATCC (NM2), Tris Acetate EDTA dan beberapa bahan lain.
Peralatan yang digunakan adalah freezer -84oC cleanbench, mikropipet, tabung mikro untuk preparasi DNA, tabung mikro untuk preparasi PCR, vortex, mesin PCR, mesin elektroforesis, sentrifus, waterbath.
Ekstraksi DNA
Ekstraksi DNA dilakukan menurut metode HO et al. (1995) dengan memakai standart DNA purification Kit dari Puregene. Setiap contoh diambil kira-kira 0,05 gram lalu dihaluskan secara aseptis dan dimasukan ke dalam tabung mikro. Gerusan contoh kemudian ditambahkan cell lysis sol (Puregene), dihomogenisasi sampai terbentuk suspensi. Kemudian ditambah 1,5 µl proteinase K dan diinkubasi pada 65°C selama 1 jam. Setelah proses tersebut, didinginkan pada temperatur kamar lalu ditambahkan precipitation sol 100
µl, divortex. Kemudian disentrifugasi dengan kecepatan 15.000 x G selama 5 menit pada suhu 4°C. Supernatan hasil sentrifugasi diambil secara hati-hati dan dipindahkan ke dalam tabung mikro baru, diberi tanda dan ditambahkan 300 µl isopropanol, divortex 20 kali. Setelah itu contoh lalu disentrifugasi dengan kecepatan 15.000 x G selama 5 menit pada suhu 4°C. Supernatan dibuang, filtrat yang tersisa di dasar tabung merupakan pelet DNA ditambahkan etanol 70% untuk proses pencucian. Kemudian disentrifugasi 15.000 x G selama 5 menit pada suhu 5°C. Supernatan dibuang secara hati-hati, penguapan alkohol yang tersisa dilakukan dalam cleanbench selama 1 jam. Kemudian ditambahkan DNA
dehydration sol, diinkubasi selama 1 jam pada
temperatur 65°C. DNA yang diperoleh disimpan dalam temperatur 4°C dan siap untuk preparasi polymerase chain reaction (PCR).
Identifikasi DNA C. burnetii dengan metode PCR
Penggunaan metode PCR untuk mendeteksi adanya C. burnetii didasarkan pada penggunaan primer oligonukleotida spesifik dan Taq DNA
polimerase untuk menggandakan sejumlah
rangkaian DNA spesifik. PCR merupakan metode terkini yang dipercaya mempunyai nilai akurasi yang sangat tinggi pada serum dan sel lekosit manusia (ZHANG et al., 1998; OGAWA et al., 2004), tetapi belum pernah dilakukan pada jaringan padat seperti jantung dan hati. Metode PCR yang diterapkan pada penelitian ini berdasarkan standar yang dipakai di National Institute of Infectious Diseases (NIID) Jepang (SETIYONO et al., 2005).
First PCR
PCR dilakukan dengan membuat PCR
mixture yang terdiri 30 µl berisi 3 µl sampel
DNA, 30 ppmol dari tiap primer OMP 1 (5‘-AGT AGA AGC ATC CCA AGC ATT-G), dan OMP2 (TGC CTG CTA GCT GTA ACG ATT-G), 3 µl 10x PCR buffer, 3 µl campuran dNTP, 18,25 µl akuabidestilata bebas DNA, 0,15 µl Taq buffer (Takara Shizo, Shiga, Japan) dan 0,15 µl taq polimerase (Takara Shizo, Shiga, Japan). Kontrol positif digunakan C.
diamplifikasi pada mesin thermal cycler
(Perkin-Elmer Gene Amp PCR systems 9600)
dengan program 35 cycles, proses denaturasi pada 94°C selama 1 menit, annealing pada 54°C selama 1 menit dan ekstensi pada 72o
C selama 2 menit. Produk first PCR yang dihasilkan adalah sebesar 500 bp.
Nested PCR
Sepasang primer yang dipakai untuk nested PCR adalah OMP3:((5‘-GAA GCG CAA CAA GAA GAA CAC-3‘) dan OMP4: (5‘-TTG GAA GTT ATC ACG CAG TTG-3‘).yang dirancang dari susunan membran luar C.
Burnetii dengan berat 29 kDa, seperti yang
telah dilakukan oleh (ZHANG et al., 1998; OGAWA et al., 2004). Volume total adalah 30 µl yang berisi 3 µl DNA contoh (dari first PCR), 30 ppmol dari tiap primer, 3 µl, 10 x PCR buffer, 3 µl campuran dNTP, 18,25 µl akuabidestilata bebas DNA dan 0,15 µl Taq
buffer (Takara Shizo, Shiga, Japan).dan 0,15 µl taq polymerase (Takara Shizo, Shiga, Japan).
Amplifikasi dilakukan dengan menggunakan mesin thermal cycler (Perkin-Elmer Gene Amp
PCR systems 9600) dengan program 35 cycles.
Diawali dengan pemanasan 94°C selama 3 menit, proses denaturasi pada 94°C selama 1 menit, annealing pada 56°C selama 1 menit, ekstensi 72°C selama 1 menit 30 detik, dan ekstensi akhir pada 72°C selama 4 menit, fase pendinginan pada 4°C. Produk nested PCR adalah 437 bp.
Deteksi hasil amplifikasi
Setelah proses amplifikasi pada mesin PCR selesai maka untuk melihat hasil amplifikasi dilakukan elektroforesis dengan memakai agar agarose 1,5% dalam larutan Tris Acetate EDTA, dengan tegangan 100 Volt dan frekuensi 50 Hz dalam waktu sekitar 30 menit. Setelah proses elektroforesis selesai maka gel dimasukan ke dalam larutan ethydium bromide (60 µg/ml) selama 20 menit kemudian dilihat dibawah sinar UV (UV luminesence) dan difoto (MANIATIS et al., 1982).
HASIL DAN PEMBAHASAN
Seluruh contoh yang diuji dengan first PCR ternyata tidak ada yang menunjukkan pita yang spesifik terhadap strain referensi dengan produk 500 bp (Gambar 1). Menurut hasil penelitian RAOULT et al. (1999) menunjukkan bahwa PCR terhadap DNA C. burnetii pada sel lekosit (buffy coat) tidak memberikan hasil yang optimal. Meskipun hasil penelitian yang dilakukan oleh HO et al. (1995) menunjukkan hasil yang sebaliknya. Beberapa faktor penyebab adalah kemungkinan penggunaan primer yang berbeda dan jumlah C. burnetii tidak cukup banyak. Menurut RAOULT et al. (1995) 10 sel C. burnetii sudah mampu menunjukkan gejala klinis seperti temperatur tubuh yang meningkat pada penderita. Selain jumlah sel bakteri yang sedikit, debris sel sampel dapat menghambat reaksi dan sangat mempengaruhi hasil PCR (INNIS et al., 1990). Penelitian yang dilakukan oleh OGAWA et al. (2004), menunjukkan bahwa pada PCR dengan sepasang primer yang dipakai yaitu CB1 dan CB2 terhadap beberapa bakteri selain C.
burnetii menunjukkan adanya pita non spesifik.
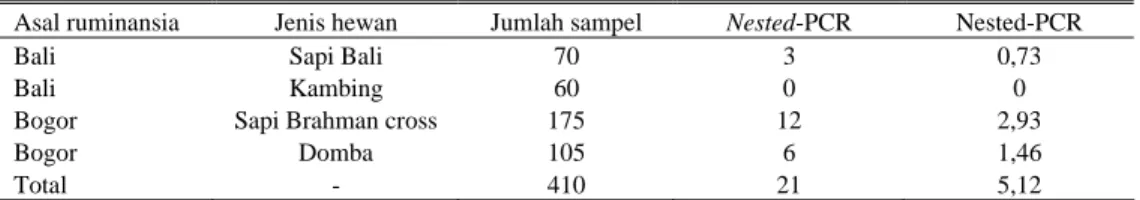
Uji nested-PCR dengan menggunakan primer OMP 3 dan OMP 4, dideteksi 3 dari 410 ekor ruminansia (0,73%) pada sapi Bali,
Brahman cross didapatkan 12 dari 410 ekor
ruminansia (2,93%) positif, dan pada domba yang berasal dari Bogor 6 dari 410 ekor ruminansia (1,46 %) positif, sedangkan kambing dari Bali negatif. Hasil nested-PCR terlihat dengan adanya pita yang terbentuk mempunyai kesamaan dengan pita dari kontrol positif dari C. burnetii (Gambar 2).
Pita dari kontrol C. burnetii memberikan gambaran pita yang lebih spesifik dibandingkan pada first PCR. Hal ini menunjukkan bahwa nested-PCR lebih sensitif. Penelitian OGAWA et al. (2004) menunjukkan bahwa nested-PCR pada deteksi C. burnetii adalah 10 kali lebih sensitif dibandingkan dengan PCR. Demikian juga deteksi C.
burnetii pada contoh yang berasal dari sel
lekosit manusia dengan metode nested-PCR memberikan hasil yang signifikan. Contoh dari sapi Bali menunjukkan adanya pita non spesifik, yang kemungkinan adalah sekuen DNA C. burnetii pada 290 bp yang merupakan
500 bp
Gambar 1. Hasil First PCR dari beberapa contoh yang diperiksa
Pada Gambar 1 memperlihatkan gambaran dari hasil elektroforesis dan pewarnaan dengan ethydium bromide. Pada lajur 1 adalah penanda DNA (100-1.000bp), lajur 2 adalah kontrol positif, C. burnetii strain Nine Mile, lajur 3 kontrol negatif, lajur 4 sampai 12 adalah contoh yang diperiksa
437 bp
Gambar 2. Hasil Nested-PCR dengan contoh berasal dari ruminansia
Deteksi C. burnetii dengan PCR menggunakan primer OMP3 dan OMP 4. Produk amplifikasi nested-PCR pada kontrol positif C. burnetii adalah 437 bp. Lajur 1 adalah penanda DNA 100-1000bp, lajur 2 adalah kontrol positif C. burnetii (437 bp), lajur 3 sampai 12 adalah contoh sapi Bali
bentuk varian atau strain yang berbeda. Menurut INNIS et al. (1990), terbentuknya pita non spesifik pada proses amplifikasi kemungkinan adalah adanya sekuen lain dari
C. burnetii yang tergandakan. Menurut
MAURIN dan RAOULT (1999), adanya strain C.
burnetii yang berbeda kemungkinan
disebabkan oleh perbedaan letak geografis suatu wilayah.
1 2 3 4 5 6 7 8 9 10 11 12
Deteksi C. Burnetii pada ruminansia
Hasil uji nested-PCR dari campuran hati dan jantung ruminansia (sapi, kambing dan domba, menunjukkan bahwa 12 dari 175 ekor sapi Brahman cross yang berasal dari Bogor menunjukkan hasil positif, 6 dari 105 ekor domba) yang berasal dari Bogor menunjukkan positif. Contoh yang diambil dari Bali meliputi sapi Bali menunjukkan hasil positif 3 dari 70 contoh sedangkan contoh kambing tidak ada yang positif dari 60 ekor kambing yang diperiksa (Tabel 1).
Deteksi C. burnetii pada sapi Brahman cross dan sapi Bali
Sapi Brahman cross yang diperiksa dalam penelitian ini menunjukkan 12 ekor (2,93%) positif C. burnetii. Hasil pemerikaan serologis pada penelitian terdahulu dengan metode
capillary tube agglutination yang telah
dilakukan oleh RUMAWAS (1976) menunjukkan 4 dari 323 ekor sapi positif (1,24%). Sedangkan HUMMEL (1976) mendapatkan bahwa 13,3% sapi di Tanzania menunjukkan seropositif terhadap C. burnetii. Penelitian yang dilakukan oleh HO et al. (1995), 8% sapi perah yang terlihat sehat ternyata menunjukkan seropositif terhadap C. burnetii. Sedangkan penelitian yang dilakukan oleh CAPUANO et al. (2001) pada sapi di daerah Irpinia Italia dengan metode pemeriksaan Indirect Fluorescence
Antibody (IFA) Test ternyata mempunyai
angka prevalensi yang lebih tinggi yaitu 14,4% dengan perincian sapi yang dipelihara secara dikandangkan mempunyai angka prevalensi 13,2%. Hal ini secara umum menunjukkan bahwa terdapat kecenderungan peningkatan seroprevalensi Q fever di beberapa wilayah yang berbeda di dunia.
Uji PCR untuk deteksi C. burnetii pada hewan di Indonesia belum pernah dilakukan sebelumnya, bahkan juga pada manusia.
Berdasarkan laporan seroepidemiologi Q fever di Indonesia bahwa tahun 1955 sudah ada laporan tentang kasus ini (KAPLAN dan BERTAGNA, 1955). Laporan terakhir oleh RICHARD et al. (2003), adanya seropositif pada 14,4% dari populasi masyarakat di pulau Gag memberikan gambaran akan pentingnya penelitian tentang Q fever di Indonesia.
Sapi Brahman cross adalah jenis sapi impor yang berasal dari Amerika dan Australia. Indonesia pada tahun 2005 telah mengimpor sebanyak 350.000 ekor dari Amerika dan hampir 500.000 ekor dari Australia. Negara-negara tersebut sampai saat ini masih belum terlepas dari masalah kasus Q fever, bahkan Amerika menempatkan Q fever sebagai salah satu mikroorganisme yang berpotensi sebagai senjata biologi (CDC, 2003). Adanya uji PCR positif terhadap C. burnetii sebagai menyebab
Q fever pada sapi Brahman cross merupakan
suatu peringatan untuk mulai mempertimbangkan kembali tentang kebijakan impor sapi maupun daging sapi dari negara tersebut.
Dari 70 ekor sapi Bali yang diperiksa ternyata 3 ekor positif terhadap adanya C.
burnetii. Sapi Bali merupakan plasma nutfah
yang dijaga kemurnian genetiknya dengan tidak memasukkan jenis atau strain sapi dari luar Bali. Oleh karena itu, dengan ditemukannya C. burnetii pada sapi Bali tersebut, merupakan suatu hal yang menarik untuk diteliti lebih lanjut, mengingat sangat sedikit data penunjang untuk dapat mengetahui bagaimana C. burnetii dapat menginfeksi sapi Bali. Penelitian EJERCITO et al. (1993) tentang prevalensi C. burnetii pada satwa liar terutama pada ruminansia liar di habitat aslinya yang teriisolasi menunjukkan seroprevalensi yang tinggi yaitu 69% pada rusa. Bagaimana hal tersebut bisa terjadi juga belum dapat dijelaskan, mengingat data penunjang yang sangat minim. Kemungkinan adalah melalui caplak dan kutu yang berpindah.
Tabel 1. Deteksi C. Burnetii pada ruminansia dengan metode Nested-PCR
Asal ruminansia Jenis hewan Jumlah sampel Nested-PCR Nested-PCR
Bali Sapi Bali 70 3 0,73
Bali Kambing 60 0 0
Bogor Sapi Brahman cross 175 12 2,93
Bogor Domba 105 6 1,46
Deteksi C. burnetii pada domba dan kambing
Hasil pengujian nested-PCR terhadap contoh dari 105 domba yang dipotong di wilayah Bogor menunjukkan 6 positif C.
burnetii, sedangkan pada 60 contoh kambing
yang diperiksa seluruhnya negatif. Penelitian Berri et al. (2001) menunjukkan bahwa pemeriksaaan serologis dengan Ezyme-Linked
Immunosorbent Assay (ELISA) pada domba
ditemukan 33% positif, sedangkan dengan IFA sebesar 44%. Jumlah sampel positif menggunakan metoda pemeriksaan serologis cenderung lebih tinggi dibandingkan dengan hasil pemeriksaan dengan metoda PCR. Hal ini kemungkinan disebabkan oleh keterpaparan hewan terhadap agen penyakit sudah berlangsung lama, sementara agen penyebabnya sendiri sudah tidak ada lagi di dalam tubuh hewan.
KESIMPULAN DAN SARAN
Berdasarkan hasil pemeriksaan dengan menggunakan metode nested-PCR maka telah dapat ditemukan adanya infeksi C. burnetii di Indonesia khususnya pada ruminansia (sapi, kambing dan domba ) dengan presentase sapi
Brahman cross 2,93%, sapi Bali 0,73%, domba
1,46% dan 0% pada kambing dari Bali.
Perlu dilakukan penelitian yang lebih mendalam tentang C. burnetii, meliputi pemetaan wilayah, penelitian tentang variasi genetik untuk nantinya dapat diupayakan penanganan yang tepat serta diagnosa cepat untuk penanggulangan penyebaran dan penularan pada manusia secara tepat dan cepat.
UCAPAN TERIMAKASIH
Penelitian ini dapat terlaksana atas pendanaan dari BPPS dan Hibah Bersaing XIV 2006. Ucapan terimakasih kepada berbagai pihak yang telah membantu terlaksananya penelitian ini.
DAFTAR PUSTAKA
BACA, O.G. and PARETSKY. 1983. Q fever and
Coxiella burnetii: A Model for host-parasite
interaction. Microbiol. Rev. 47(2): 127 – 149.
BERRI,M.,A.SOURIAU,M.CROSBY,D.CROCHET, P. LECHOPIER and A. RODOLAKIS. 2001. Relationships between the shedding of
Coxiella burnetii, clinical signs and serological
responses of 34 sheep. Vet. Record 148: 502 – 505.
CAPUANO,F.,M.C. LANDOLFI andD.M.MONETTI. 2001. Influence of three types of farm management on the seroprevalence of Q fever as assessed by an indirect immunoflurescence assay. Vet. Rec. 140 (22): 669.
CDC. Centers for Disease Control and Prevention. 2003. Q fever. Viral and Rikettsia Zoonoses Branch.. Atlanta, Georgia, USA. Last Review. 13 Juli 2003. pp. 1 – 5.
COLEMAN,S.,E.R.FISHER,D.HOWE.,D.J.MEAD and R.A. HEINZEN. 2004. Temporal Analysis of Coxiella Burnetii Morphological Differentiation. J. Bacteriol. 186(21): 7344 – 7353.
EJERCITO, C.L.A, L. CAI, K.K. HTWE, M. TAKI, Y. INOSHIMA, KONDO, C. KANO, S. ABE, K. SHIROTA, T. SUGITOMO, T. YAMAGUCHI, H. FUKUSHI, N. MINAMOTO, T. KINJO, E. ISOGAI and K. HIRAI. 1993. Serological Evidence of Coxiella burnetii Infection in Wild Animals in Japan. J. Wildlife Dis. 29(3): 481 – 484.
FOURNIER,P.E.,J.M.THOMAS andD.RAOULT. 1998. Diagnosis of Q fever. J. Clin. Microbiol. 36(7): 1823 – 1834.
HO, T., K.K.HTWE, N. YAMASAKI, G.O. ZHANG, M.OGAWA, T.YAMAGUCHI, HFUKUSHI and K.HIRAI. 1995. Isolation of Coxiella burnetii from catlle and ticks, and some Characteristics of the isolates in Japan. Microbiol. Immunol. 39(9): 663 – 671.
HTWE,K.K.,K.AMANO,Y.SUGIYAMA,K.YAGAMI, N. MINAMOTO, A.A. HASHIMOTO, T. YAMAGUCHI,H.FUKUSHI andK.HIRAI. 1992. Seroepidemiology of Coxiella burnetii in domestic and companion animals in Japan.
Vet. Record. (1992): 131490.
HUMMEL, P.H. 1976. Incidence in Tanzania of CF antibody to Coxiella burnetii in sera from man, cattle, sheep, goats and game. Vet. Rec. 98 (25): 501 – 505.
INNIS MA, D.H.GELFAND and T.J. WHITE. 1990. PCR Protocol. A Guide to Methods and Applications. Academic Press, San Diego, California pp. 3 – 39
KAPLAN, M.M. and P. BERTAGNA. 1955. The geographical distribution of Q fever. Bull.
MANIATIS,T.,E.F.FRITSCH and J.SAMBROOK. 1982. Molecular Cloning: A Laboratory Manual. First Edition Cold Spring Harbor Laboratory, New York pp. 161 – 168.
MARRIE, T.J. 2003. Coxiella burnetii pneumonia.
European Respiratory J. 21(4): 713.
MAURIN,M.andD.RAOULT. 1999. Q Fever. Clin.
Microbiol. Rev. 12 (4): 518 – 553.
MIYASHITA,N.,H.FUKANO,F.HARA,T.NAKAJIMA, Y.NIKI and T.MATSUSHIMA. 2001. A Case of
Coxiella burnetii pneumonia in an adult. Nihon Kokyuki Gakkai Zasshi. Jun; 39(6):
446.
OGAWA,M.,A.SETIYONO,K.SATO,Y.CAI,S.SHIGA andT.KISHIMOTO. 2004. Evaluation of PCR Assays currently used for Detection of
Coxiella burnetii in Japan. Southeast Asian J. Trop. Med. Public Health. 35(4): 151 – 154.
OGAWA, M., T. KAWAMOTO, A. KAWAMOTO, T. YAMASHITA, Y. UCHIDA, K. KATO and A.SETIYONO. 2003. Time course of the levels of antibodies to Coxiella burnetii and detection of C. burnetii-DNA in three imported cases of acute Q fever. J. Jpn. Infect.
Dis. 77: 127 – 132 (abstract).
RAOULT, D. 2002. Q Fever: Still a mysterious disease. Q. J. Med. 95: 491.
RICHARDS,A.,S.RATIWAYANTO,E.RAHARDJO,D.J. KELLY, G.A.DASCH, D.J.RYAUFF and M.J. BANGS. 2003. Serologic evidence of infection with Erlichiae and Spotted fever group Rickettsiae among residents of Gag island, Indonesia. Am. J. Trop. Med. Hyg. 68(4): 480 – 484.
RUMAWAS, I. 1976. Some zoonosis and the possibilities of Q fever in Indonesia. Conference of the Singapore Veterinary Association, October 22 – 24, 1976.
SCRIMGEOUR,E.M.,S.I.N.AL-ISMAILY,J.M.ROLAIN, H.S. AL-DHAHRY, H.S. EL-KHATIM and D. RAOULT. 2003. Q Fever in Human and Livestock Populations in Oman. Annals of the New York Academy of Sciences. 990: 221. SESHADRI,R.,I.T.PAULSEN,J.A.EISEN,T.D.READ,
K.E.NELSON,W.C.NELSON,N.L.WARD,H. TETTELIN,T.M.DAVIDSEN,M.J.BEANAN,R.T. DEBOY,S.C.DAUGHTERY,L.M.BRINKAC,R. MADUPU,R.J.DODSON,H.M.KHOURI,K.M. LEE,H.A.CARTY,D.SCANLAN,R.A.HEINZEN, H.A.THOMPSON, J.E.SAMUEL,C.M.FRASER andJ.F.HEIDELBERG. 2003. Complete genome sequence of the Q fever pathogen Coxiella
burnetii. PNAS. 100(9): 5455 – 5460.
SETIYONO, A., M. OGAWA, Y. CAI, S. SHIGA, T. KISHIMOTO and KURANE. 2005. New Criteria for Immunofluorescence Assay for Q fever Diagnosis in Japan. J. Clin. Microbiol. 43(11): 5555 – 5559.
STEIN, A., C. LOUVEAU, H. LEPIDI, F. RICCI, P. BAYLAC, B. DAVOUST and D. RAOULT. 2005. Q fever Pneumonia: virulence of
Coxiella burnetii pathovars in a murine model
aerosol infection. J. Infect. Immun. 73(4): 2469 – 2477.
VAN PEENEN, P.F., B.F. GUNDELFINGER and C. KUSHARJONO. 1978. Seroepidemiological evidence for occupational exposure to Q fever in Indonesia. J. Occup Med. 20(7): 488 – 489. ZHANG, G.Q., S.V. NGUYEN, T. HO, M. OGAWA,
A. HOTTA, T. YAMAGUCHI, H. FUKUSHI and K.HIRAI. 1998. Clinical evaluation of a new PCR assay for detection of Coxiella burnetii in human samples. J. Clin. Microbiol. 36: 77 – 80.