UJI ANGKA KAP (ALT), DAN IDE YANG DIPRODUK
Dia Me
U
APANG/KHAMIR (AKK), ANGKA LEMPE IDENTIFIKASISALMONELLA PADA JAM UKSI PENJUAL JAMU RACIK “X” DI YO
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm)
Program Studi Farmasi
Oleh:
Maria Dyah Kartika L.S. NIM: 108114103
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
2014
UJI ANGKA KAP (ALT), DAN IDE YANG DIPRODUK
Dia Me
U
i
APANG/KHAMIR (AKK), ANGKA LEMPE IDENTIFIKASISALMONELLA PADA JAM UKSI PENJUAL JAMU RACIK “X” DI YO
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm)
Program Studi Farmasi
Oleh:
Maria Dyah Kartika L.S. NIM: 108114103
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
2014
ii
iii
da
iv
PERSEMBAHAN
Kuperse Bapak, Ibu, Mbak Wid, Mbak T dan Teddy atas dukungan, semangat, kasih saya
Sahabat da
v
LEMBAR PERNYATAAN PERSETUJUAN
vi
vii PRAKATA
Puji syukur dan terima kasih penulis panjatkan kepada Tuhan Yesus Kristus atas segala berkat dan kasih-Nya sehingga penulis dapat menyelesaikan
skripsi dengan judul “Uji Angka Kapang/Khamir (AKK), Angka Lempeng Total (ALT), dan Identifikasi Salmonella pada Jamu Cekok yang Diproduksi Penjual
Jamu Racik “X” di Yogyakarta”. Skripsi ini merupakan karya ilmiah penulis
untuk memenuhi syarat memperoleh gelar sarjana farmasi (S.Farm) di Fakultas Farmasi Universitas Sanata Dharma.
Banyak kesulitan yang penulis hadapi dalam proses penyelesain skripsi ini. Akan tetapi, di tengah kesulitan tersebut, penulis mendapat dukungan, bimbingan, kritik dan saran dari berbagai pihak. Oleh sebab itu, pada kesempatan ini penulis mengucapkan banyak terima kasih kepada:
1. Bapak Ipang Djunarko, M.Sc., Apt. selaku Dekan Fakultas Farmasi Universitas Sanata Dharma.
2. Bapak Yohannes Dwiatmaka, M.Si. selaku dosen pembimbing atas kebijaksanaan, perhatian, dan kesabarannya dalam membimbing penyusunan skripsi ini.
3. Ibu Damiana Sapta Candrasari, M.Sc. selaku dosen penguji yang telah memberikan saran yang menjadikan penulisan skripsi menjadi lebih baik. 4. Ibu Dr. Erna Tri Wulandari, M.Si., Apt. selaku dosen penguji atas masukan
viii
5. Ibu Maria Dwi Budi Jumpowati, S.Si. yang selalu memberi bimbingan, dukungan, dan masukan dengan penuh kesabaran selama penyusunan skripsi, sehingga penulisan skripsi ini menjadi lebih baik.
6. Ibu Septi Widyastuti, S.Si, M.Kes, Bapak Jumakir, Bapak Setiyono, dan segenap anggota Balai Laboratorium Kesehatan Yogyakarta yang telah membimbing penulis selama penelitian.
7. Kedua orangtua penulis (Bapak Albertus Suradiyanto dan Ibu Sofia Susanna Sri Puryanti) dan ketiga kakak penulis (Mbak Wid, Mbak Tanti, dan Mas Sunu) yang telah memberikan semangat, doa, dan dukungan dana untuk penelitian ini.
8. Teman-teman seperjuangan dalam penelitian ini: Anas, Wulan, Ori, dan Ribka yang selalu memberi semangat, dukungan dan doa, serta saling mengingatkan.
9. Teddy dan Indah, tempat penulis berkeluh kesah, terima kasih atas dukungan, semangat, doa dan tawa yang kalian berikan.
10. Teman-teman angkatan 2010 khususnya FKK B ’10 yang selalu memberikan
semangat dalam penulisan skripsi ini.
11. Semua pihak yang tidak dapat penulis sebutkan satu persatu, yang telah membantu dalam kelancaran penulisan skripsi ini.
Penulis menyadari bahwa skripsi ini jauh dari sempurna. Segala kritik dan saran yang membangun sangat penulis harapkan demi sempurnanya skripsi ini. Semoga skripsi ini dapat bermanfaat dan memberi informasi bagi pembaca.
ix
1. Rimpang temulawak (Curcuma xanthorrhizaRoxb.)……….
2. Rimpang lempuyang gajah (Zingiber zerumbet)……….
x
3. Brotowali (Tinospora crispaL)………..
4. Rimpang temu hitam (Curcuma aeruginosaRoxb.)………...
5. Daun pepaya (Carica papaya)……….
B. Variabel Penelitian dan DefinisiOperasional………
1. Variabel penelitian………...
2. Definisi Operasional………
C.Bahan Penelitian………
D.Alat Penelitian………
E. Tata Cara Penelitian………..
1. Pemilihan dan pengumpulansampel jamu cekok………
2. Persiapan sampel……….
3. Homogenisasi sampel………..
4. Pengenceran sampel……….
5. Uji angka kapang/khamir……….
6. Uji angka lempeng total………..
7. UjiSalmonellapada cairan jamu cekok……….
xi
A.Penentuan dan Pemilihan Tempat Pengambilan Sampel………..
B.Pengambilan Sampel Jamu Cekok……….
C.Pengujian Angka Kapang/Khamir………
D.Pengujian Angka Lempeng Total………..
E. Identifikasi BakteriSalmonella………
1. Uji pengkayaan pada mediaSelenite Broth………
2. Isolasi Salmonelladari jamu cekok pada mediaSalmonella Shigella
Agar……….
3. IdentifikasiSalmonelladalam jamu cekok……….
F. Hasil IdentifikasiSalmonellapada Pengambilan Sampel Pertama………
G. Hasil IdentifikasiSalmonellapada Pengambilan Sampel Kedua..………
H. Hasil IdentifikasiSalmonellapada Pengambilan Sampel Ketiga………..
xii
DAFTAR TABEL
Halaman Tabel I. Hasil IdentifikasiSalmonella... 28 Tabel II. Hasil perhitungan AKK jamu cekok inkubasi 5
hari... 33 Tabel III. Hasil perhitungan ALT dalam jamu cekok waktu inkubasi 48
jam... 35 Tabel IV. Hasil uji identifikasi Salmonella pada pengambilan sampel
1... 48 Tabel V. Perbandingan karakteristik biokimiawi Pseudomonas dan
koloni 1 pada sampel 1... 49 Tabel VI. Hasil uji identifikasi Salmonella pada pengambilan sampel
2... 50 Tabel VII. Perbandingan karakteristik biokimiawiProteus dan koloni 1
pada sampel 2... 51 Tabel VIII. Perbandingan karakteristik biokimiawi Enterobacter dan
koloni 2 pada sampel 2... 52 Tabel IX. Hasil uji identifikasi Salmonella pada pengambilan sampel
3... 53 Tabel X. Perbandingan karakteristik biokimiawiProteus dan koloni 1
pada sampel 3... 54 Tabel XI Perbandingan karakteristik biokimiawi Pseudomonas dan
xiii
DAFTAR LAMPIRAN
Halaman Lampiran 1.
Lampiran 2.
Surat ijin penelitian di Balai Laboratorium Kesehatan Yogyakarta... Lampiran 6. Hasil perhitungan AKK dalam jamu cekok sampling 1, 2
dan 3 setelah inkubasi 5 hari... 69 Lampiran 7. Hasil pengujian ALT dalam jamu cekok sampling 1,
setelah inkubasi 48 jam... 72 Lampiran 8. Hasil pengujian ALT dalam jamu cekok sampling 2,
setelah inkubasi 48 jam... 73 Lampiran 9. Hasil pengujian ALT dalam jamu cekok sampling 3,
setelah inkubasi 48 jam... 74 Lampiran 10. Hasil perhitungan ALT dalam jamu cekok sampling 1, 2
xiv
Lampiran 11. Hasil uji pengkayaan sampel jamu cekok pada media
Selenite Broth... 77 Lampiran 12. Hasil uji identifikasi Salmonella dalam media selektif
Salmonella Shigella Agar... 78 Lampiran 13. Hasil uji identifikasi Salmonella pada pengambilan
sampel pertama... 79 Lampiran 14. Hasil uji identifikasi Salmonella pada pengambilan
sampel kedua... 80 Lampiran 15. Hasil uji identifikasi Salmonella pada pengambilan
xv INTISARI
Jamu cekok adalah jamu yang berkhasiat menambah nafsu makan anak, terbuat dari campuran rimpang temulawak (Curcuma xanthorrhiza Roxb.), rimpang lempuyang gajah (Zingiber zerumbet), brotowali (Tinospora crispa L), rimpang temu hitam (Curcuma aeruginosa Roxb.) dan daun pepaya (Carica papaya) yang diberikan kepada anak dengan cara mencekokkan cairan jamu ke dalam mulut.
Penelitian ini bertujuan untuk mengetahui Angka Kapang/Khamir, Angka Lempeng Total, dan keberadaan Salmonella dalam jamu cekok yang
diproduksi oleh penjual jamu racik “X” di Yogyakarta. Penjual jamu racik “X”
adalah penjual jamu cekok yang terkenal di Yogyakarta, usahanya sudah dikelola secara turun-temurun.
Penelitian ini merupakan penelitian non eksperimental dengan rancangan deskriptif eksploratif. Data yang diperoleh berupa angka kapang/khamir, angka lempeng total, dan keberadaan Salmonella. Tahapan penelitian yang dilakukan meliputi penentuan dan pemilihan tempat pengambilan sampel, pengambilan sampel jamu cekok, pengujian Angka Kapang/Khamir, pengujian Angka Lempeng Total, dan identifikasiSalmonellapada cairan jamu cekok.
Hasil penelitian menunjukkan Angka Kapang/Khamir dalam jamu cekok
yang diproduksi oleh penjual jamu racik ‘X’ di Yogyakarta adalah 5,0× 10
koloni/ml sampai dengan 1,3 × 10 koloni/ml dan Angka Lempeng Total 1,4
× 10 koloni/ml sampai dengan 2,0× 10 koloni/ml, serta tidak terdapat bakteri cemaranSalmonella.
xvi ABSTRACT
Jamu cekok is jamu which effective to increase appetite of child made from mixture of Curcuma xanthorrhiza Roxb., Zingiber zerumbet, Tinospora crispa L., Curcuma aeruginosa Roxb., and Carica papaya given to child by squeeze jamu to the mouth.
This research was aimed to count number of mold/yeast, total plate count, and identifySalmonella fromjamu cekok which is produced by “X” seller in Yogyakarta. “X” seller is a well known jamu cekok seller in Yogyakarta, whereas the business has been managed hereditary.
This research was a non-experimental study using descriptive explorative research design. The result of the data were number of mold/yeast, total plate count, and existence of Salmonella. The stages of research were determining and choosing the place to collect sample, collecting jamu cekok sample, examining number of mold/yeast, examining total plate count, and identifying Salmonellain jamu cekok.
The result of this research showed that number of mold/yeast in jamu cekok produced by “X” seller in Yogyakarta was 5,0× 10 coloni/ml until 1,3
× 10 coloni/ml, the total plate count was from 1,4 × 10 coloni/ml to 2,0
× 10 coloni/ml, andSalmonellawas found negative.
1 BAB I PENGANTAR
A. Latar Belakang
Indonesia adalah negara yang sangat kaya akan berbagai macam jenis tanaman yang bisa dimanfaatkan sebagai bahan obat. Walaupun saat ini sudah banyak beredar obat-obat dengan bahan kimia yang lebih praktis dan mudah didapat, masih banyak masyarakat Indonesia yang mengkonsumsi obat-obatan herbal, salah satunya jamu. Jamu adalah obat tradisional asli Indonesia yang sudah dipraktikkan selama berabad-abad. Kebiasaan minum jamu sudah menjadi budaya bagi masyarakat Indonesia, khususnya di daerah Jawa. Sekitar 75% dari 200 juta penduduk Indonesia mengkonsumsi jamu untuk mencegah atau mengobati penyakit dengan alasan bahan-bahannya masih alami dan tidak mengandung bahan kimia sehingga lebih aman (Torri, 2013).
ditekan sekecil mungkin karena meskipun mikroba yang tumbuh tidak membahayakan, tetapi kadang-kadang karena pengaruh sesuatu dapat menjadi mikroba yang membahayakan. Jumlah AKK yang melebihi batas menunjukkan kemunduran mutu obat tradisional dan ada jenis kapang tertentu yang dapat menghasilkan toksin seperti Aspergilus flavus yang dapat menghasilkan aflatoksin. Mikroba patogen yang sering dijumpai dalam obat tradisional dan perlu diwaspadai, antara lain Salmonella, Escherichia coli, Staphylococcus aureus,danPseudomonas aeruginosa(DepKes, 1994; BPOM, 2004).
Jamu bisa dikonsumsi oleh siapa saja dari anak-anak hingga orang dewasa. Jamu yang biasa dikonsumsi oleh anak-anak salah satunya adalah jamu cekok. Jamu cekok berkhasiat untuk menambah nafsu makan. Jamu ini disebut jamu cekok karena proses pemberiannya yaitu dengan cara dicekokkan ke dalam mulut anak. Ada satu penjual jamu cekok yang sangat terkenal di Yogyakarta, yaitu
penjual jamu racik “X” yang usahanya sudah dikelola secara turun temurun
mengenai aspek mikrobiologis dari jamu cekok dengan cara menghitung ALT, AKK dan mengidentifikasi bakteri patogen untuk melihat mutu serta keamanan jamu cekok yang diproduksi penjual jamu racik “X”.
Bakteri patogen yang akan diidentifikasi adalah Salmonella. Salmonella termasuk Enterobacteriaceae yang merupakan bakteri patogen bagi manusia dan hewan. Penyakit yang disebabkan oleh infeksi Salmonella disebut salmonelosis. Bayi, kaum lanjut usia dan orang yang mempunyai sistem kekebalan yang kurang baik beresiko menderita salmonelosis. Bakteri ini dapat masuk ke dalam tubuh melalui makanan dan minuman yang terkontaminasi. Manifestasi klinik salmonelosis terdiri atas beberapa sindrom, antara lain demam enterik (demam thypoid), gastroenteritis dan septisema. Angka kejadian demam thypoid di Indonesia sebesar 500/100.000 populasi (Radji, 2011; Yonathan, 2013).
1. Rumusan Masalah
a. Berapa AKK dan ALT jamu cekok dalam yang diproduksi oleh penjual
jamu racik “X”di Yogyakarta?
b. Adakah cemaran bakteri Salmonella dalam jamu cekok yang diproduksi oleh penjualjamu racik “X”di Yogyakarta?
2. Manfaat
a. Manfaat teoritis
b. Manfaat praktis
Penelitian ini diharapkan dapat memberikan informasi kepada penjual jamu serta masyarakat mengenai salah satu parameter kualitas dan keamanan jamu cekok dilihat dari AKK, ALT dan cemaran bakteri patogen Salmonella, serta mengetahui efek yang ditimbulkan, sehingga dapat meningkatkan taraf kesehatan masyarakat.
3. Keaslian Penelitian
Sejauh penelusuran pustaka dan jurnal yang dilakukan penulis, penelitian mengenai uji AKK, ALT dan identifikasi Salmonella pada jamu
cekok yang diproduksi penjual jamu racik “X” di Yogyakarta belum pernah dilakukan.
B. Tujuan 1. Tujuan Umum
Untuk mengetahui kualitas dan keamanan jamu cekok yang diproduksi
penjual jamu racik “X” di Yogyakarta berdasarkan AKK, ALT, dan
cemaranSalmonella. 2. Tujuan Khusus
a. Mengetahui AKK, ALT dalam jamu cekok yang diproduksi oleh penjual
jamu racik “X” di Yogyakarta.
b. Mengetahui keberadaan bakteri Salmonella dalam jamu cekok yang
5 BAB II
TINJAUAN PUSTAKA
A. Jamu Cekok
Jamu harus memenuhi kriteria aman sesuai dengan persyaratan yang ditetapkan, berkhasiat (dibuktikan berdasarkan data empiris) dan memenuhi persyaratan yang berlaku. Jamu termasuk dalam cairan obat dalam. Dalam KEPMENKES nomor 661/MENKES/SK/VII/1994, telah diatur tentang persyaratan yang harus dipenuhi cairan obat dalam termasuk dalam aspek mikrobiologi. Pada aspek mikrobiologi, cairan obat dalam tidak boleh mengandung AKK lebih dari 103 koloni/ml dan ALT lebih dari 104 koloni/ml, serta tidak boleh mengandung bakteri patogen terutama Escherichia coli, Salmonella, Staphylococcus aureus, dan Pseudomonas aeruginosa. ALT harus
ditekan sekecil mungkin karena meskipun mikroba yang tumbuh tidak membahayakan, tetapi kadang-kadang karena pengaruh sesuatu dapat menjadi mikroba yang membahayakan. AKK yang besar menunjukkan kemunduran mutu obat tradisional tersebut (DepKes, 1994). Mutu produk tergantung dari bahan awal, proses produksi, pengawasan mutu, bangunan, peralatan dan personalia yang menangani, sehingga pembuatan obat tradisional harus mengikuti pedoman Cara Pembuatan Obat Tradisional yang baik (CPOTB) yang sudah ditetapkan oleh BPOM. (BPOM 2004; BPOM, 2005).
xanthorrhizaRoxb.), rimpang lempuyang gajah (Zingiber zerumbet L.), brotowali (Tinospora crispa L.), rimpang temu hitam (Curcuma aeruginosa Roxb.), dan daun pepaya (Carica papaya L.). Cara pembuatannya adalah bahan-bahan tersebut kecuali brotowali ditumbuk, kemudian dikukus. Brotowali direbus secara terpisah. Jamu diolah pada pagi hari kemudian dipanaskan pada malam hari untuk dijual keesokan harinya. Ketika ada pembeli, bahan-bahan kukusan tersebut akan dicampur dalam air rebusan brotowali, kemudian diperas dan dicekokkan ke dalam mulut anak.
1. Rimpang Temulawak (Curcuma xanthorrhizaRoxb.)
Temulawak termasuk dalam famili Zingiberaceae, banyak ditemukan di hutan-hutan tropis, terutama di Indonesia. Kulit rimpang temulawak berwarna cokelat kemerahan dan daging rimpang berwarna orange tua atau kuning, panjangnya sampai 15 cm dan bergaris tengah 6 cm. Sepintas rimpang temulawak mirip dengan rimpang kunyit, tetapi berukuran lebih besar. Baunya harum dan rasanya pahit agak pedas (Nurmalina, 2012).
2. Rimpang Lempuyang gajah (Zingiber zerumbet)
Dibanding jenis lempuyang yang lain, rimpang lempuyang gajah memiliki ukuran paling besar. Apabila rimpangnya dibelah akan tampak daging buah yang berwarna kuning pucat. Rimpang lempuyang gajah berbau wangi, berasa pahit, namun kalah pedas dengan lempuyang wangi (Muhlizah, 2009).
Lempuyang gajah memiliki rasa pedas, tajam, dan bersifat hangat. Kandungan kimia yang terdapat dalam rimpang lempuyang gajah adalah alkaloid, camphiene, camphor dan monoterpenoid lainnya, gingerol, zingiberol, zingerone, sesquiterpenoid termasuk zerumbone dan zerumbone epoxide, oxalic acid, turunan kaempferol, dan flavonoid misalnya afzelin, flavonoid glikosida, minyak esensial, chlorogenic acid dan ferulic acid. Rimpang lempuyang gajah digunakan untuk mengobati kejang pada anak, sakit perut, diare, disentri, gangguan empedu, kencing batu, radang ginjal, penyakit kulit, dan bisul (Hariana, 2012).
3. Brotowali (Tinospora crispaL.)
Brotowali termasuk dalam famili Menispermaceae. Tumbuh liar di hutan atau ladang, termasuk tanaman perdu. Memiliki tinggi batang hingga 2,5 m dengan besar batang sebesar jari kelingking, berbintil-bintil rapat dan memiliki rasa yang pahit. Merupakan tumbuhan daun tunggal, bertangkai, dengan bentuk daun seperti jantung atau agak mirip seperti bulat telur, berujung lancip, dengan panjang 7-12 cm dan lebar 5-10 cm (Agoes, 2010a).
alat pernafasan bekerja dengan baik dan meningkatkan pertukaran zat sehingga menurunkan panas. Zat pahit yang dimiliki brotowali juga bermanfaat untuk menambah nafsu makan karena dapat mempercepat pengosongan lambung. Alkaloid berberin berguna untuk membunuh bakteri pada luka. Brotowali juga dapat dimanfaatkan sebagai obat luar, yaitu untuk pengobatan penyakit kudis dan luka sifilis (Latief, 2009; Agoes, 2010a).
4. Rimpang Temu hitam (Curcuma aeruginosaRoxb.)
Temu hitam, atau oleh masyakarat disebut temu ireng terdapat di Burma, Kamboja, Indochina, dan menyebar sampai ke pulau Jawa. Rimpangnya berukuran cukup besar dan bercabang-cabang. Jika rimpang tua dibelah, tampak lingkaran berwarna biru kehitaman di bagian luarnya. Rimpang temu hitam mempunyai aroma yang khas, rasanya pahit dan tajam. Rimpang temu hitam mengandung minyak atsiri, tanin, kurkumol, kurkumenol, isokurkumenol, kurzerenon, kurdion, kurkumalakton, germakron, dan kurkumin. Rimpangnya berkhasiat sebagai peluruh flatus (karminatif), peluruh dahak, antihelmintik, dan pembersih darah setelah melahirkan atau setelah haid. Kandungan kurkumin berkhasiat untuk meningkatkan nafsu makan (Agoes, 2010b).
5. Daun pepaya (Carica papaya)
yaitu sejenis alkaloid antihelmintik yang mampu melumpuhkan cacing keluar dari tubuh. Daun pepaya mengandung enzim papain, pseudokarpain, glikosida, karposida, dan saponin. Rasa pahit daun pepaya dapat merangsang nafsu makan (Latief, 2009; Agoes, 2010a).
B. Angka Kapang/Khamir (AKK)
Perhitungan AKK bertujuan untuk menghitung koloni kapang dan khamir yang terdapat dalam suatu sampel. Kapang adalah sekelompok mikroba yang tergolong dalam fungi dengan ciri khas memiliki filamen (miselium). Kapang termasuk mikroba yang penting dalam mikrobiologi pangan karena selain berperan penting dalam industri makanan, kapang juga banyak menjadi penyebab kerusakan pangan. Kapang adalah fungi multiseluler yang mempunyai filamen dan pertumbuhannya pada makanan mudah dilihat karena penampakannya yang berserabut seperti kapas. Pertumbuhannya mula-mula akan berwarna putih, tetapi jika spora telah timbul akan terbentuk berbagai warna tergantung dari jenis kapang (Fardiaz, 1992; Radji, 2010).
secara alamiah. Keracunan aflatoksin dapat terjadi karena mengkonsumsi bahan makanan yang tercemar toksin tersebut. Aflatoksin bersifat karsinogenik dan hepatotoksik tergantung pada lama dan tingkat paparan terhadap aflatoksin (Peraica, 1999; Yenny, 2006).
Khamir adalah fungi uniseluler yang mikroskopik, tidak membentuk percabangan permanen. Ukuran sel khamir bervariasi yaitu dengan panjang 1-5
μ m sampai 20-50 μ m, dan lebar 1-10 μ m. Bentuk khamir bermacam-macam yaitu bulat (spheroid), bulat telur (elips), seperti silinder, dan sebagainya. Khamir tidak mempunyai flagela sehingga tidak dapat bergerak aktif (Jutono, 1980; Fardiaz, 1992).
Prinsip uji AKK yaitu pertumbuhan kapang/khamir setelah cuplikan diinokulasikan pada media yang sesuai dan diinkubasi pada suhu 20-25°C dan diamati mulai hari ketiga sampai hari kelima. Media yang digunakan adalah Sabouraud Dextrose Agar (SDA) atau Potato Dextrose Agar (PDA). Setelah diinkubasi, kemudian dihitung koloni yang tumbuh dengan colony counter(Radji, 2010).
C. Angka Lempeng Total (ALT)
Metode ini digunakan untuk menetapkan angka bakteri aerob mesofil yaitu bakteri yang melakukan metabolisme dengan bantuan oksigen dan bakteri yang hidup di daerah suhu antara 15 - 55°C, dengan suhu optimum 25 - 40°C yang terdapat dalam suatu sampel (Radji, 2010).
Mikroorganisme memiliki habitat yang berbeda-beda untuk tumbuh, salah satunya adalah air. Air sangat dibutuhkan dalam kehidupan manusia antara lain untuk mandi, minum, keperluan rumah tangga, serta untuk industri. Keberadaan mikroorganisme patogen dalam air perlu diwaspadai. Bakteri yang memiliki habitat di air antara lain Salmonella, Shigella, Vibrio Cholerae, dan Escherichia coli. Apabila bakteri tersebut mengkontaminasi minuman atau makanan kemudian
termakan, maka dapat menimbulkan infeksi. Bakteri menghasilkan 2 jenis toksin yaitu endotoksin dan eksotoksin. Endotoksin dapat menimbulkan reaksi demam sedangkan eksotoksin tidak, namun eksotoksin bersifat sangat toksik dan dapat menimbulkan kematian (Radji, 2010).
pengenceran 10-1. Untuk obat tradisional yang mengandung pengawet, digunakan larutan letheen broth. Larutan letheen broth dapat menginaktifkan pengawet dalam sediaan. Setelah homogen, kemudian dipipet sebanyak 1 ml ke dalam tabung reaksi yang berisi 9 ml pengencer PDF sehingga didapatkan pengenceran 10-2, demikian seterusnya hingga didapatkan pengenceran 10-3, 10-4, 10-5 dan seterusnya. Dari setiap pengenceran kemudian dipipet 1 ml ke dalam cawan petri, dan ditambahkan media Plate Count Agar (PCA) cair. Cawan petri kemudian digoyangkan sampai tercampur rata. Setelah membeku, cawan petri diinkubasi pada suhu 35-37 ºC selama 24-48 jam dengan posisi terbalik (Radji, 2010).
D. Salmonella
Salmonella merupakan bakteri gram negatif, tidak berspora, tidak mempunyai simpai, tanpa fimbria, dan mempunyai flagel peritrik. Ukuran
1-3,5μ m × 0,5-0,8 μ m, besar koloni dalam media pembenihan rata-rata 2-4 mm. Salmonella tumbuh pada suasana aerob atau anaerob fakultatif, pada suhu 15-41ºC. Suhu pertumbuhan optimum 37,5ºC dengan pH media 6-8. Bakteri ini dapat tumbuh dengan cepat, dan mempunyai gerak positif, tidak meragi laktosa, sukrosa, membentuk asam, dan biasanya membentuk gas dari glukosa, maltosa, manitol, dan dekstrin. Salmonellamati pada suhu 56ºC dan pada keadaan kering, dan dapat bertahan hingga 4 minggu dalam air (Radji, 2011).
pencernaan dan terkadang menyebar lewat peredaran darah ke seluruh organ tubuh. InfeksiSalmonella dapat berupa infeksi yang dapat sembuh sendiri seperti gastroenteritis, namun juga dapat menjadi masalah serius apabila terjadi penyebaran sistematik seperti demam enterik. Orang yang terinfeksi akan mengalami gejala demam, diare, kram perut, pusing, dan rasa mual setelah 12-72 jam terinfeksi. Gejala tersebut dalam berlangsung selama 7 hari dan umumnya dapat sembuh tanpa perawatan dokter. Akan tetapi, beberapa penderita dapat mengalami diare yang parah sehingga harus dirawat di Rumah Saklit. Infeksi yang parah terutama terjadi pada anak-anak dan penderita yang mengalami sistem pertahanan tubuh yang lemah (Radji, 2011; NSW Goverment, 2013).
E. Media pertumbuhanSalmonella
Salmonella dapat tumbuh pada suasana anaerob fakultatif. Salmonella tidak dapat memfermentasikan laktosa dan sukrosa, tetapi dapat memfermentasikan glukosa, maltosa, dan manitol. Sebagian besar isolat Salmonelladari spesimen klinik membentuk H2S (Radji, 2009).
Media selektif yang digunakan untuk mengisolasiSalmonellaadalah: 1. Selenite Broth
dalam media ini ditandai dengan adanya kekeruhan pada media Selenite Broth (Bridson, 1998).
2. Salmonella Shigella Agar
Salmonella Shigella Agar (SSA) adalah media selektif yang digunakan untuk mengisolasi Salmonella dan beberapa spesiesShigella yang berasal dari spesimen klinik seperti urin, darah, feses maupun yang berasal dari makanan. Media SSA mengandung pepton, laktosa, natrium sitrat, natrium tiosulfat, besi (III) sitrat, brilliant green, natural red dan bile salt.Salmonella yang tumbuh dalam media SSA berupa koloni transparan, biasanya terdapat bintik hitam ditengah koloni tersebut, sedangkan Shigella berupa koloni transparan, tidak terdapat bintik hitam di tengah (Bridson, 1998).
3. Brilliant Green Agar
Brilliant Green Agar merupakan media selektif yang digunakan untuk mengisolasi Salmonella kecuali Salmonella Thypi. Media ini mengandung ekstrak yeast, laktosa, sukrosa, sodium chloride, phenol red, brilliant green dan agar. Karakteristik koloni Salmonella pada media ini adalah berwarna merah muda hingga merah atau bening hingga buram dengan lingkaran merah muda sampai merah (Bridson, 1998; Radji, 2010).
F. Keterangan Empiris
Penelitian ini dilakukan untuk mengetahui nilai AKK, ALT dan keberadaan bakteri Salmonella dalam jamu cekok yang diproduksi penjual jamu
16 BAB III
METODOLOGI PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini merupakan penelitian non eksperimental dengan rancangan deskriptif eksploratif, yaitu mendeskripsikan AKK, ALT, dan keberadaan Salmonelladalam jamu cekok.
B. Variabel Penelitian dan Definisi Operasional 1. Variabel penelitian
a. Variabel bebas: waktu produksi jamu cekok.
b. Variabel tergantung: AKK, ALT, dan keberadaanSalmonella.
c. Variabel pengacau terkendali: media pertumbuhan yaitu PDA dan PCA, suhu inkubasi 35ºC untuk uji ALT dan 25ºC untuk uji AKK, waktu inkubasi 24-48 jam untuk uji ALT dan 5-7 hari untuk uji AKK. Media pengkayaan (Selenite Broth), media isolasi (SSA), media identifikasi (media glukosa, laktosa, manitol, maltosa sakarosa, danSulphur Indol Motility(SIM), media simmons sitratagar, nutrien agar), suhu inkubasi (37ºC) dan waktu inkubasi (24 jam).
2. Definisi operasional
a. Jamu cekok adalah jamu yang diberikan kepada anak-anak dengan cara memeras jamu dengan kain dan dicekokkan ke dalam mulutnya. Bahan yang digunakan adalah temulawak, rimpang lempuyang gajah, brotowali, rimpang temu hitam, dan daun pepaya.
b. Angka Kapang/Khamir adalah suatu uji cemaran mikroba yang dilakukan dengan menghitung jumlah kapang dan atau khamir yang terdapat dalam jamu cekok dengan metode dan analisis hasil sesuai dengan PPOMN (2006).
c. Angka Lempeng Total adalah suatu uji cemaran mikroba yang dilakukan dengan menghitung jumlah bakteri aerob mesofil yang terdapat dalam jamu cekok dengan metode dan analisis hasil sesuai dengan PPOMN (2006). d. Uji Salmonella dilakukan untuk menetapkan keberadaan Salmonella dalam
cairan jamu cekok dengan melihat pertumbuhannya pada media selektif dan media identifikasi dengan metode sesuai dengan PPOMN (2006).
C. Bahan Penelitian
1. Cairan jamu cekok yang diperoleh dari penjual“X”di Yogyakarta.
maltosa, media sakarosa, media SIM (Oxoid), media Simmons citrateAgar (Oxoid),Nutrien Agar(Oxoid).
3. Kloramfenikol (Bratako Chemika), PDF (Oxoid), aquadest steril, etanol 70%, dan Kovacs (Merck).
4. Bakteri baku sebagai standar pembanding adalah Salmonella typhi ATCC 14028.
D. Alat Penelitian
Autoklaf (model: KT-40 No.108049 Midorigaoka Japan), inkubator (WTC binder), oven, Bunsen, pipet tetes, mikropipet (Iwaki), tabung reaksi (Pyrex), cawan petri, pipet volume, Beaker glass (Pyrex), gelas ukur (Pyrex), Erlenmeyer (Pyrex), jarum ose,stomacher(Seward), plastik steril.
E. Tata Cara Penelitian 1. Pemilihan dan pengumpulan sampel jamu cekok
Sampel diambil dari penjual jamu racik “X” sebanyak 3 kali. Pengambilan sampel dilakukan setiap hari Senin antara pukul 6:30-7:30 pagi. Jamu cekok yang dijual penjual jamu racik “X” kemudian dipindahkan ke dalam botol steril dan dibawa ke laboratorium dengan menggunakan cool box yang didalamnya terdapatice pack.
2. Persiapan sampel
3. Homogenisasi sampel
Secara aseptis, ambil 25 ml jamu cekok, dimasukkan ke dalam plastik steril kemudian ditambahkan 225 ml larutan pengencer PDF sehingga diperoleh pengenceran 1:10 (10-1). Kemudian dihomogenisasi menggunakan stomacherdengan kecepatan 300 rpm selama 30 detik.
4. Pengenceran sampel
Tabung reaksi sebanyak 8 buah disiapkan (4 untuk pengujian AKK dan 4 untuk pengujian ALT) dan diisi dengan 9 ml PDF. Satu mililiter pengenceran 10-1 dari hasil homogenisasi pada penyiapan sampel dipipet dan dimasukkan ke dalam tabung pertama yang telah berisi PDF hingga diperoleh pengenceran 10-2 dan dikocok sampai homogen dengan vortex. Kemudian dibuat pengenceran sampai 10-5untuk pengujian AKK dan ALT.
5. Uji Angka Kapang/Khamir
a. Pembuatan larutan kloramfenikol 1%. Sebanyak 1 gram kloramfenikol ditimbang, kemudian dilarutkan dalam 100 ml aquadest steril.
Sedangkan untuk uji sterilitas pengencer dilakukan dengan menuangkan media PDA dan 1 ml pengencer (PDF) lalu biarkan memadat.
Seluruh cawan petri diinkubasi secara terbalik pada suhu 25ºC selama 5 hari. Setelah 5 hari inkubasi, dicatat jumlah koloni kapang/khamir yang tumbuh.
6. Uji Angka Lempeng Total (ALT)
Satu milliliter dari masing-masing pengenceran sampel dipipet dan dituangkan pada cawan petri. Ke dalam tiap cawan petri dituangkan ± 15 ml media PCA (45º ± 1º) kemudian segera cawan petri digoyang sambil diputar agar suspensi sampel tersebar merata kemudian dibuat duplo. Kemudian dilakukan pula uji kontrol untuk mengetahui sterilitas media dan pengencer. Untuk uji sterilitas media dilakukan dengan menuangkan media PCA dalam suatu cawan petri dan biarkan memadat. Sedangkan untuk uji sterilitas pengencer dilakukan dengan menuangkan media PCA dan 1 ml pengencer (PDF) lalu biarkan memadat.
Seluruh cawan petri diinkubasi pada suhu 35ºC selama 24 hingga 48 jam dengan posisi terbalik, jumlah koloni yang tumbuh diamati dan dihitung.
7. Uji Salmonellapada cairan jamucekok
yang sama dilakukan terhadap kontrol positif berupa kultur murni Salmonella thypiATCC 14028. Hasil dari pengujian dibandingkan dengan hasil pertumbuhannya berdasarkan kekeruhan.
b. PenanamanSalmonella pada media selektif SSA. Dari biakan pengkayaan diisolasikan 1 sengkelit pada permukaan SSA dengan cara streak (4 kuadran), diinkubasi pada suhu 37ºC selama 24 jam. Prosedur yang sama dilakukan terhadap kontrol positif, yaitu kultur murni Salmonella thypi ATCC 14028. Hasil dari pengujian dibandingkan dengan hasil pertumbuhannya berdasarkan morfologi koloni yang tumbuh. Keberadaan Salmonella ditunjukkan dengan adanya koloni transparan, biasanya terdapat bintik hitam ditengah koloni tersebut.
c. Uji konfirmasi (Uji biokimia) Salmonella dalam jamu cekok. Satu koloni spesifik pada SSA dipilih dan digoreskan pada permukaan media Nutrient Agar (NA) kemudian dilakukan uji fermentasi gula-gula, uji sulfur, indol, motilitas, dan sitrat. Prosedur yang sama dilakukan terhadap kontrol positif, yaitu kultur murni Salmonella typhi ATCC 14028. Hasil dari pengujian dibandingkan dengan hasil pertumbuhannya berdasarkan perubahan warna yang terjadi.
1) Uji fermentasi gula-gula a) Uji fermentasi glukosa
dengan adanya perubahan warna media dari orange kemerahan menjadi kuning.
b) Uji fermentasi laktosa
Satu sengkelit biakan SSA diinokulasikan pada media laktosa dan diinkubasi pada suhu 37ºC selama 24 jam. Hasil positif ditandai dengan adanya perubahan warna media dari orange kemerahan menjadi kuning.
c) Uji fermentasi manitol
Satu sengkelit biakan SSA diinokulasikan pada media manitol dan diinkubasi pada suhu 37ºC selama 24 jam. Hasil positif ditandai dengan adanya perubahan warna media dari orange kemerahan menjadi kuning.
d) Uji fermentasi maltosa
Satu sengkelit biakan SSA diinokulasikan pada media maltosa dan diinkubasi pada suhu 37ºC selama 24 jam. Hasil positif ditandai dengan adanya perubahan warna media dari orange kemerahan menjadi kuning.
e) Uji fermentasi sakarosa
2) Uji sulfur
Satu sengkelit biakan SSA diinokulasikan pada media SIM dan diinkubasi pada suhu 37ºC selama 24 jam. Adanya warna hitam di sepanjang bekas inokulasi menunjukan hasil yang positif.
3) Uji indol
Satu sengkelit biakan SSA diinokulasikan pada media SIM dengan cara ditusuk dan diinkubasi pada suhu 37ºC selama 24 jam. Ke dalam biakan ditambahkan 1 ml pereaksi indol (kovacs), dikocok dan diamkan beberapa menit. Warna merah cherry yang berbentuk cincin pada permukaan biakan menunjukkan reaksi indol positif.
4) Uji motilitas
Satu sengkelit biakan SSA diinokulasikan pada media SIM dengan cara ditusuk dan diinkubasi pada suhu 37ºC selama 24 jam. Apabila pertumbuhan mikroba tidak hanya di bekas tusukan menunjukkan hasil positif.
5) Uji sitrat
F. Analisis Hasil 1. Uji angka kapang/khamir
Cara menganalisis hasil pengujian sesuai dengan PPOMN (2006), yaitu: Cawan petri yang menunjukkan jumlah koloni antara 10-150 dari satu pengenceran dipilih dan dihitung jumlah koloni dari kedua cawan lalu dikalikan dengan faktor pengencerannya. Bila pada cawan petri dari dua tingkat pengenceran yang berurutan menunjukkan jumlah antara 10-150, maka dihitung jumlah koloni dan dikalikan faktor pengenceran, kemudian diambil angka rata-rata. Hasil dinyatakan sebagai AKK dalam tiap gram atau mL sampel.
Untuk beberapa kemungkinan lain yang berbeda dari pernyataan di atas, maka diikuti petunjuk sebagai berikut:
1) Bila hanya salah satu di antara kedua cawan petri dari pengenceran yang sama menunjukkan jumlah antara 10-150 koloni, dihitung jumlah koloni dari kedua cawan dan dikalikan dengan faktor pengenceran.
angka kapang/khamir dalam tiap gram sampel. Misal pada pengenceran 10-2 diperoleh 6 koloni dan pengenceran 10-3 diperoleh 10 koloni, maka angka kapang/khamir adalah:
6 + 10
2 × 10 = 8 × 10
3) Bila dari seluruh cawan petri tidak ada satupun yang menunjukkan jumlah antara 10-150 koloni, maka dicatat angka sebenarnya dari tingkat pengenceran terendah dan dihitung sebagai Angka Kapang/Khamir perkiraan.
4) Bila tidak ada pertumbuan pada semua cawan dan bukan disebabkan karena faktor inhibitor, maka angka kapang dan khamir dilaporkan sebagai kurang dari satu dikalikan faktor pengenceran terendah (< 1× faktor pengenceran terendah) (PPOMN, 2006).
2. Uji Angka Lempeng Total
Cara menganalisis hasil pengujian sesuai dengan PPOMN (2006), yaitu: a. Pilih cawan petri dari satu pengenceran yang menunjukkan jumlah koloni
antara 25-250 setiap cawan. Dihitung semua koloni dalam cawan petri dengan menggunakan alat penghitung koloni (colony counter). Dihitung rata-rata jumlah koloni dan dikalikan dengan faktor pengenceran dan dinyatakan hasilnya sebagai jumlah bakteri per mL atau gram.
c. Jika hasil dari 2 pengenceran jumlahnya berturut-turut terletak antara 25-250 koloni, diitung jumlah koloni dari masing-masing pengenceran seperti yang disebut pada butir a dan b di atas, dan dihitung jumlah rata-rata jumlah koloni dari kedua pengenceran tersebut. Jika jumlah yang tertinggi lebih besar dari dua kali jumlah yang terkecil, dinyatakan jumlah yang terkecil sebagai jumlah bakteri per gram.
d. Jika rata-rata jumlah koloni masing-masing petri tidak terletak antara 25 dan 250 koloni, dihitung jumlah koloni seperti pada butir a dan b di atas dan dinyatakan sebagai jumlah bakteri per gram.
e. Jumlah koloni dari semua pengenceran lebih dari 250 koloni, maka setiap dua cawan petri dengan pengenceran tertinggi dibagi dalam 2, 4, atau 8 sektor. Dihitung jumlah koloni dalam satu bagian atau lebih. Untuk mendapatkan jumlah koloni dalam satu cawan petri, dihitung rata-rata jumlah koloni dan kalikan dengan faktor pembagi dan pengenceran. Dinyatakan sebagai jumlah bakteri perkiraan per gram.
f. Jika dalam 1/8 bagian cawan petri terdapat lebih dari 200 koloni, maka jumlah koloni yang di dapat = 8 × 200 (1600). Dikalikan dengan faktor pengenceran dan dinyatakan hasilnya sebagai jumlah bakteri perkiraan permililiter atau gram lebih besar dari jumlah yang di dapat (> 1600×faktor pengenceran).
h. Mengitung koloni perambat (spreader) Ada 3 macam perambatan pada koloni, yaitu: 1) Merupakan rantai yang tidak terpisah-pisah
2) Perambatan yang terjadi di antara dasar cawan petri dan pembenihan 3) Perambatan yang terjadi pada pinggir atau permukaan pembenihan
Kalau terjadi hanya 1 perambatan (seperti rantai) maka koloni dianggap 1. Tetapi bila 1 atau lebih rantai terbentuk dan yang berasal dari sumber yang terpisah-pisah, maka tiap sumber dihitung sebagai 1 koloni. Bila point 2 dan 3 terjadi maka sebaiknya pemeriksaan diulangi karena koloni dalam keadaan semacam ini agak sukar dihitung.
i. Cara menghitung dan membulatkan angka
Dalam melaporkan jumlah koloni atau jumlah koloni perkiraan hanya 2 angka penting yang digunakan, yaitu angka yang pertama dan kedua (dimulai dari kiri), sedangkan angka yang ketiga diganti dengan 0 apabila kurang dari 5 dan apabila 5 atau lebih dijadikan 1 yang ditambahkan pada angka yang kedua
Contoh: 523.000 dilaporkan sebagai 520.000 (5,2 × 105)
3. Identifikasi BakteriSalmonella
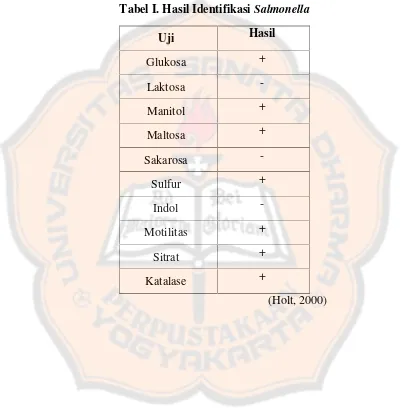
Salmonella dinyatakan terdapat pada sampel jamu cekok apabila memenuhi kriteria hasil uji identifikasi (Tabel I).
Tabel I. Hasil IdentifikasiSalmonella
Uji Hasil
Glukosa +
Laktosa
-Manitol +
Maltosa +
Sakarosa
-Sulfur +
Indol
-Motilitas +
Sitrat +
Katalase +
29 BAB IV
HASIL DAN PEMBAHASAN
Jamu cekok adalah salah satu obat tradisional yang biasa dikonsumsi oleh anak-anak. Jamu yang dikonsumsi dengan cara dicekokkan atau dimasukkan secara paksa ke dalam mulut anak dengan menggunakan kain ini telah turun temurun dipercaya sebagai penambah nafsu makan.
Jamu cekok merupakan contoh cairan obat dalam yang pemasarannya tidak memerlukan izin edar, sesuai dengan PERMENKES nomor 007 tahun 2012. Karena tidak perlu memiliki izin edar, maka dari segi keamanan belum terjamin. Salah satu produsen jamu cekok yang cukup terkenal di Yogyakarta adalah
penjual ‘X’. Menurut survei, penjual ‘X’ membuat jamu pada pagi hari kemudian dipanaskan pada malam hari untuk dijual keesokan harinya. Pemanasan jamu dilakukan dengan cara dikukus dan direbus. Pemanasan pada suhu 75ºC atau lebih dapat membunuh bakteri. Selain itu, pemanasan dapat mengurangi kadar air sehingga dapat mengurangi kemungkinan pertumbuhan bakteri, kapang serta
khamir (Aryani, 2006; U.S. Department of Healt, 2014). Penjual ‘X’ membuka
infeksi. Selain itu, bakteri dapat menghasilkan toksin yaitu endotoksin dan eksotoksin yang dapat mengakibatkan demam pada tubuh, hingga kematian. Apalagi jamu ini dikonsumsi oleh anak-anak yang sistem kekebalan tubuhnya belum sempurna, sehingga perlu dilakukan evaluasi terhadap keamanan dari jamu cekok tersebut, salah satunya dari segi mikrobiologi, yaitu AKK, ALT, dan identifikasi bakteri patogen salah satunyaSalmonella.
A. Penentuan dan Pemilihan Tempat Pengambilan Sampel
Penelitian dalam aspek mikrobiologis jamu cekok diawali dengan penentuan dan pemilihan tempat pengambilan sampel. Peneliti memilih penjual
jamu racik ‘X’ karena penjual jamu racik ‘X’ adalah penjual jamu cekok yang
terkenal di Yogyakarta dan letaknya yang berada di pusat kota, strategis untuk dikunjungi banyak orang dari berbagai daerah. Menurut hasil survei dan wawancara, beberapa pembeli sudah melewati beberapa generasi (turun-temurun
berlangganan kepada penjual “X”).
B. Pengambilan Sampel Jamu Cekok
Pengambilan sampel dilakukan tiga kali dengan jarak 1 minggu setiap pengambilan sampel. Hal ini dilakukan untuk melihat pengaruh kualitas bahan baku pembuatan jamu cekok terhadap AKK, ALT, dan keberadaan bakteri Salmonella karena menurut survei yang kami lakukan, penjual jamu racik ‘X’
ramai didatangi pembeli pada jam tersebut. Sampel jamu cekok dimasukkan ke dalam botol steril, kemudian dibawa ke laboratorium dengan menggunakan cool box yang di dalamnya telah berisi ice pack. Botol steril yang dimaksud adalah botol yang sudah disterilisasi terlebih dahulu dengan autoklaf. Cool box yang berisi ice pack digunakan untuk mengurangi pertumbuhan bakteri dan pencemaran dari udara selama perjalanan ke laboratorium. Perlakuan tersebut dilakukan supaya hasil yang diperoleh (AKK, ALT, dan keberadaan Salmonella) benar-benar dapat menggambarkan cemaran yang didapat dari tempat pengambilan sampel. Menurut Cappucino (2008), kapang dan khamir tumbuh optimum pada suhu 25ºC, sedangkan bakteri aerob mesofil tumbuh optimum pada suhu 37ºC.
C. Pengujian Angka Kapang/Khamir (AKK)
Pengujian AKK dilakukan dengan menginokulasi sampel jamu cekok yang telah dihomogenisasi dan diencerkan pada media PDA dengan cara Pour plate dan diinkubasi pada suhu 20-25°C.
10-1 jumlah koloni yang tumbuh terlalu padat sehingga dengan adanya pengenceran diharapkan jumlah koloni pada pengenceran selanjutnya dapat dihitung. Pengenceran dibuat sampai pada pengenceran 10-5. Pengenceran dilakukan secara aseptis di dekat nyala api Bunsen untuk mengurangi kontaminasi dari udara.
Media agar yang digunakan pada pengujian ini adalah PDA yang mengandung ekstrakpotato,glucosedan agar dengan pH 5,6±0,2 (Bridson, 1998). Media ini direkomendasikan untuk menumbuhkan dan menghitung kapang dan khamir dalambutter dan produk makanan lainnya. Menurut Radji (2010), kapang dan khamir dapat tumbuh pada rentang pH pertumbuhan bakteri (6,5-7,5), namun pertumbuhan optimumnya berada pada pH 5-6, sehingga media yang digunakan cocok untuk pertumbuhan kapang dan khamir. Dalam media agar juga ditambahkan kloramfenikol sebagai agen antimikroba yang dapat menghambat pertumbuhan bakteri sehingga pengamatan pada pertumbuhan kapang atau khamir lebih mudah untuk dilakukan. Kloramfenikol adalah antibiotik yang mempunyai spektrum aktivitas antibakteri yang relatif luas. Kloramfenikol bekerja terhadap bakteri intra maupun ekstraseluler secara bakteriostatik. Kloramfenikol bekerja menghambat sintesis protein bakteri (Wattimena, 1991).
baik untuk pertumbuhan kapang dan khamir. Inkubasi terbalik dilakukan agar uap air yang terbentuk selama proses inkubasi tidak menetes pada media dan mempengaruhi pertumbuhan mikroba. Untuk mengetahui sterilitas media dan pelarut serta mengetahui keaseptisan dalam bekerja digunakan kontrol media (PDA) dan kontrol pelarut (PDF).
Pertumbuhan kapang mudah dilihat karena penampakannya yang berserabut seperti kapas. Pertumbuhannya mula-mula akan berwarna putih, tetapi jika spora telah timbul akan terbentuk berbagai warna tergantung dari jenis kapang. Sedangkan khamir berbentuk bulat (spheroid), bulat telur (elips) atau seperti silinder (Fardiaz, 1992).
Setelah diinkubasi selama 5 hari, pada pengenceran 10-1 hingga 10-5 ditumbuhi koloni dengan ciri-ciri berbentuk bulat dan berwarna putih. Koloni yang tumbuh tampak seperti koloni khamir. Tumbuhnya koloni khamir bukan berasal dari pelarut maupun cara kerja pada saat pengujian AKK karena kontrol media dan pelarut tidak ditumbuhi koloni khamir (Lampiran 3). Koloni yang tumbuh kemudian dihitung dan dianalisis hasilnya sesuai dengan PPOMN (2006).
Tabel II. Hasil perhitungan AKK jamu cekok inkubasi 5 hari
Pengambilan Sampel AKK (Koloni/ml)
1 1,3×106
2 5,0× 10
3 5,4×105
Hasil yang didapatkan (Tabel II) menunjukkan angka kapang/khamir dalam
nomor 661/MENKES/SK/VII/1994, AKK dalam cairan obat dalam seharusnya tidak boleh lebih dari 103 koloni/ml. Khamir sering dijumpai pada daun, bunga, tanah, dan air. Cemaran ini mungkin didapatkan dari tanah karena bahan baku jamu yang digunakan kebanyakan adalah rimpang. Rimpang adalah bagian tanaman seperti umbi akar yang berada di bawah tanah (Schneiter, 2004; TPC,2012). Lingkungan tanah di sekitar akar tanaman akan memungkinkan mikroorganisme tumbuh karena adanya nutrisi yang dapat memenuhi pertumbuhan mikroorganisme maupun untuk tanaman (Atlas, 1998). Pencucian bahan baku yang kurang bersih juga dapat menjadi pemicu cemaran kapang/khamir.
Dari hasil tersebut dapat disimpulkan bahwa AKK jamu cekok yang
diproduksi penjual jamu racik “X” di Yogyakarta melebihi ketentuan yang
berlaku. Sehingga perlu diwaspadai dan dilakukan penelitian lebih lanjut karena apabila yang tumbuh merupakan koloni jamur yang patogen maka dapat membahayakan bagi kesehatan tubuh. Salah satu khamir yang bersifat patogen adalah Candida albicans yang dapat menyebabkan infeksi mulut (sariawan). Salah satu contoh kapang yang bersifat patogen adalah Aspergillus flavus yang dapat memproduksi mikotoksin yang disebut aflatoksin. Aflatoksin bersifat karsinogen dan hepatotoksik (Jawetz, 1995; Yenny, 2006).
D. Pengujian Angka Lempeng Total (ALT)
dengan cara pour plate, kemudian diinkubasi pada suhu 35-37°C selama 48 jam. Media PCA mengandung tryptone, ekstrak yeast, glukosa dan agar dengan pH 7,0±0,2. Menurut Radji (2010), bakteri tumbuh optimum pada pH 6,5-7,5. Untuk mengetahui sterilitas media dan pelarut serta mengetahui keaseptisan dalam bekerja digunakan kontrol media (PCA) dan kontrol pelarut (PDF).
Setelah diinkubasi selama 48 jam, pada pengenceran 10-1-10-5 tampak koloni bakteri tumbuh pada media. Tumbuhnya koloni bakteri bukan berasal dari pelarut maupun cara kerja pada saat pengujian ALT karena kontrol media dan pelarut tidak ditumbuhi koloni bakteri (Lampiran 7). Koloni bakteri yang tumbuh kemudian dihitung dan dianalisis hasilnya sesuai dengan PPOMN (2006).
Tabel III. Hasil perhitungan ALT dalam jamu cekok waktu inkubasi 48 jam
Pengambilan Sampel ALT (Koloni/ml)
1 1,6× 10
2 1,4× 10
3 2,0× 10
memproduksi 2 macam toksin yaitu eksotoksin dan endotoksin. Endotoksin dapat menimbulkan reaksi demam sedangkan eksotoksin bersifat sangat toksik dan dapat menyebabkan kematian (Radji, 2010).
Pertumbuhan bakteri yang cukup banyak tersebut kemungkinan didapatkan dari bahan-bahan yang digunakan, air yang tercemar, proses pembuatan, alat-alat yang digunakan dan proses penjualan. Bahan-bahan yang digunakan sebagian besar berupa rimpang sehingga memungkinkan kontaminasi dari tanah. Bakteri patogen yang terdapat dalam tanah antara lain Clostridium tetani, Clostridium perfringens, Clostridium botulinum, dan Bacillus anthracis
(Radji, 2010).
Penjual jamu racik ‘X’ mengolah bahan-bahan pada pagi hari, kemudian direbus pada malam hari untuk dijual keesokan harinya, tanpa adanya pemanasan
kembali selama penjualan. Penjual jamu racik ‘X’ mengatakan bahwa jamu tidak
akan enak apabila diminum dalam kondisi panas, padahal tanpa adanya pemanasan kembali, kemungkinan tumbuhnya bakteri menjadi semakin besar. Sanitasi yang kurang baik serta peralatan yang hanya dibilas dengan air setelah digunakan juga dapat menjadi pemicu adanya cemaran mikroba. Bakteri yang terdapat dalam air antara lain Salmonella, Shigella, Vibrio cholera, dan Escherichia coli(Radji, 2010).
E. Identifikasi BakteriSalmonella
1. Uji pengkayaan pada mediaSelenite Broth
Tahap pengkayaan dalam identifikasi Salmonella bertujuan untuk menumbuhkan bakteri pada media pengkaya. Jumlah bakteri biasanya sangat sedikit dan hampir tidak berkembang jika ada mikroorganisme lain yang tumbuh dengan lebih baik. Media pengkayaan digunakan untuk mengisolasi bakteri yang berjumlah sangat sedikit (Radji, 2010). Media pengkayaan yang digunakan dalam penelitian ini adalah Selenite broth yang mengandung peptone, laktosa, sodium biselenite dan sodium fosfat dengan pH 7,1±0,2 (Bridson, 1998).
Sampel jamu cekok diambil 1 ml dengan pipet kemudian dimasukkan ke dalam tabung reaksi yang berisi 9 ml Selenite Broth secara aseptis, kemudian diinkubasi selama 24 jam pada suhu 37°C. Selain perlakuan pada sampel, peneliti juga membuat kontrol positif. Kontrol positif dibuat dengan cara menginokulasikan kultur murni Salmonella thypi ATCC 14028 pada media Selenite Broth. Salmonella thypi ATCC 14028 adalah Salmonella Enterica subspesies enterica serotype thypimurium (ATCC, 2014). Setelah diinkubasi selama 24 jam, kontrol positif berwarna agak lebih keruh, dan sampel berwarna orange tua keruh. Hal ini sesuai dengan Bridson (1998) yang mengatakan bahwa adanya kekeruhan menunjukkan hasil positif.
2. IsolasiSalmonelladari jamu cekok pada media SSA
spesies Shigella dari produk makanan maupun specimen klinik seperti feses, urine, maupun darah. SSA mengandung pepton, laktosa, sodium sitrat, natrium tiosulfat, besi (III) sitrat, brilliant green, neutral red, dan bile salt yang berfungsi sebagai nutrisi untuk pertumbuhan Salmonella. Brilliant green, bile salt dan sodium sitrat berfungsi untuk menghambat pertumbuhan bakteri gram positif,neutral red sebagai indikator pH, laktosa berperan sebagai fermentable carbohydrate dimana koloni bakteri yang memfermentasikan laktosa akan berwarna merah muda dan yang tidak memfermentasikan laktosa akan berwarna putih sampai tidak berwarna. Tiosulfat berfungsi sebagai indikator adanya produksi H2S dimana koloni bakteri yang memproduksi H2S akan tampak warna hitam di tengah koloni. Koloni yang tumbuh pada media SSA yaitu Salmonella thypi ATCC 14028 dengan karakteristik berbentuk bulat, berwarna jernih dengan titik hitam di tengahnya dan Shigella sonnei ATCC 25931 dengan karakteristik berbentuk bulat dan berwarna jernih (Bridson, 1998).
Setelah diinkubasi selama 24 jam, pada kontrol tumbuh koloni dengan karakteristik berbentuk bulat, berwarna putih dengan warna hitam keabu-abuan di tengah koloni. KarakteristikSalmonella thypiATCC 14028 pada media SSA yaitu berbentuk bulat, berwarna jernih dengan titik hitam di tengahnya (Bridson, 1998). Sedangkan pada sampel ditumbuhi beberapa koloni dengan karakteristik yang berbeda-beda. Berikut adalah karakteristik koloni yang ditemukan pada ketiga sampel yang ditumbuhkan pada media SSA:
a. Sampel 1:
1) Koloni 1: berbentuk bulat, tepi bulat, berwarna putih.
2) Koloni 2: berbentuk bulat, tepi bulat, berwarna merah muda. b. Sampel 2
1) Koloni 1: berbentuk bulat, tepi bulat, berwarna putih dengan titik hitam di tengah koloni.
2) Koloni 2: berbentuk bulat, tepi bulat, berwarna putih.
3) Koloni 3: berbentuk bulat, tepi bulat, berwarna merah muda. c. Sampel 3
1) Koloni 1: berbentuk bulat, tepi bulat, berwarna putih dengan titik hitam di tengah koloni.
2) Koloni 2: berbentuk bulat, tepi bulat, berwarna putih.
3) Koloni 3: berbentuk bulat, tepi bulat, berwarna merah muda.
3. Uji biokimiawi
Uji biokimiawi bertujuan untuk menegaskan apakah koloni yang tumbuh pada media SSA benar Salmonellaatau bukan. Koloni yang mirip dengan ciri-ciri Salmonella diambil satu sengkelit dan diinokulasikan pada media glukosa, laktosa, manitol, maltosa dan sakarosa untuk uji fermentasi gula-gula, pada media SIM untuk uji motilitas, sulfur, dan indol, dan pada media Simmons Sitrat untuk uji sitrat. Pada sampel 1 tidak ada koloni yang mirip dengan karakteristik Salmonella, oleh karena itu yang diidentifikasi adalah koloni 1 yang karakteristiknya mendekati karakteristik Salmonella. Pada sampel 2 dan 3 yang diidentifikasi adalah koloni 1 dan 2.
Setelah diinokulasikan, tabung reaksi kemudian diinkubasi pada suhu 37ºC selama 24 jam.
a. Uji fermentasi karbohidrat
tabung dan mendesak cairan di dalam tabung, sehingga akan terlihat adanya gelembung udara (Lay, 1994).
Karbohidrat yang sering dipakai dalam uji biokimiawi untuk mengidentifikasi bakteri adalah glukosa, laktosa, manitol, maltosa, dan sakarosa (Lay, 1994).
1) Uji fermentasi glukosa
Uji ini bertujuan untuk mengetahui apakah bakteri dapat memfermentasikan glukosa atau tidak. Pengujian dilakukan dengan mengambil satu sengkelit koloni dari media SSA dan diinokulasikan pada media glukosa, kemudian diinkubasikan selama 24 jam pada suhu 37ºC. Perubahan warna media menjadi kuning menunjukkan adanya fermentasi glukosa.
Setelah diinkubasi selama 24 jam didapatkan hasil positif pada kontrol positif, sampel 2 (koloni 1 dan 2), dan sampel 3 (koloni 1) ditandai dengan adanya perubahan warna media dari merah menjadi kuning. Bakteri yang tumbuh pada sampel 1 dan sampel 3 (koloni 2) menunjukkan hasil negatif, dapat dilihat dari warna media yang tidak mengalami perubahan warna, hal ini menunjukkan bahwa bakteri tersebut tidak memfermentasikan glukosa. Menurut Balows (1998), Salmonellamembentuk asam dan gas dari glukosa.
2) Uji fermentasi laktosa
mengambil satu sengkelit koloni dari media SSA dan diinokulasikan pada media laktosa, kemudian diinkubasikan selama 24 jam pada suhu 37ºC. Setelah diinkubasi, didapatkan hasil pada kontrol positif, sampel 1, sampel 2 (koloni 1 dan 2), dan sampel 3 (koloni 1 dan 2) tidak terjadi perubahan warna media menjadi kuning. Hal ini menunjukkan bahwa kontrol positif dan bakteri yang tumbuh pada sampel tidak memfermentasikan laktosa. Radji (2010) mengatakan bahwaSalmonellatidak memfermentasikan laktosa.
3) Uji fermentasi manitol
4) Uji fermentasi maltosa
Uji ini bertujuan untuk mengetahui apakah bakteri dapat memfermentasikan maltosa atau tidak. Pengujian dilakukan dengan mengambil satu sengkelit koloni dari media SSA dan diinokulasikan pada media maltosa, kemudian diinkubasikan selama 24 jam pada suhu 37ºC. Setelah diinkubasi, pada kontrol positif, sampel 2 (koloni 1 dan 2), dan sampel 3 (koloni 1) menunjukkan hasil positif, ditandai dengan adanya perubahan warna media dari merah menjadi kuning yang menunjukkan bahwa bakteri memfermentasi maltosa. Sedangkan bakteri yang tumbuh pada sampel 1 dan sampel 3 (koloni 2) menunjukkan hasil negatif, ditandai dengan tidak adanya perubahan warna, menunjukkan bahwa bakteri tersebut tidak memfermentasikan maltosa. Radji (2010) mengatakan bahwa Salmonella memfermentasikan maltosa.
5) Uji fermentasi sakarosa
sampel 2 (koloni 1 dan 2) dan sampel 3 (koloni 1) menunjukkan hasil positif, ditandai dengan adanya perubahan warna media dari merah menjadi kuning, menunjukkan bahwa bakteri memfermentasikan sakarosa. Radji (2010) mengatakan bahwa Salmonella tidak memfermentasikan sakarosa.
b. Uji sulfur
Uji ini dilakukan untuk melihat kemampuan mikroba menghasilkan hydrogen sulfide (H2S) dari substansi seperti inorganik sulfur atau sulfur yang terkandung dalam asam amino (Cappucino, 2008). Pengujian ini dilakukan dengan cara mengambil satu sengkelit biakan dari media SSA kemudian diinokulasikan pada media SIM kemudian diinkubasi selama 24 jam pada suhu 37°C. Media SIM mengandung peptone dan sodium thiosulfate sebagai subtract sulfur, ferrous sulfate (FeSO4) sebagai indikator H2S yang akan membentuk warna hitam apabila terdapat H2S. Hasil positif ditunjukkan dengan adanya warna hitam di sepanjang bekas inokulasi (Cappucino, 2008).
menunjukkan bahwa bakteri tidak membentuk H2S. Balows (1998) mengatakan bahwaSalmonellabiasanya membentuk H2S.
c. Uji indol
Uji ini dilakukan untuk melihat kemampuan mikroba dalam menggunakan triptofan sebagai sumber karbon dan menghasilkan indol. Triptofan adalah asam amino esensial yang dapat mengalami oksidasi oleh beberapa bakteri. Konversi dari triptofan menjadi produk metabolik diperantai oleh enzim tryptophanase. Kemampuan untuk menghidrolisis triptofan dengan memproduksi indol tidak dimiliki oleh semua bakteri sehingga ini dapat digunakan untuk identifikasi (Lay, 1994; Cappucino, 2008).
Media yang digunakan adalah SIM yang mengandung substrat triptofan. Uji ini dilakukan dengan mengambil satu sengkelit koloni bakteri dari media SSA, kemudian diinokulasikan pada media SIM dan diinkubasi selama 24 jam pada suhu 37ºC. Produksi indol dapat dideteksi
dengan penambahan reagen Kovac’s setelah diikubasi selama 24 jam.
Hasil positif ditunjukkan dengan terbentuknya cincin berwarna merah
setelah ditetesi reagen Kovac’s, hal ini terjadi karena indol akan
membentuk kompleks dengan p-dimethylaminobenzaldehyde dari reagen dan menghasilkan warna merah cherry.
Setelah diinkubasi selama 24 jam dan ditetesi reagen Kovac’s,
dan 2) menunjukkan hasil negatif, ditandai dengan tidak terbentuknya
cincin berwarna merah cherry setelah ditetesi reagen Kovac’s,
menunjukkan bahwa bakteri tidak menghasilkan indol. Sedangkan bakteri yang tumbuh pada sampel 2 (koloni 1) menunjukkan hasil positif, ditandai dengan adanya cincin merah cherry setelah ditetesi reagen Kovac’s,
menunjukkan bahwa bakteri membentuk indol. Balows (1998) yang mengatakan bahwaSalmonellajarang sekali membentuk indol.
d. Uji motilitas
e. Uji sitrat
Uji sitrat digunakan untuk melihat kemampuan mikroorganisame untuk menggunakan sitrat sebagai satu-satunya sumber energi. Media yang digunakan adalahSimmon’s citrateagaryang berisi Na sitrat sebagai satu-satunya sumber karbon, NH+4 sebagai sumber N dan brom thymol blue sebagai indikator pH (Lay, 1994). Pengujian ini dilakukan dengan cara mengambil satu sengkelit biakan dari media SSA kemudian menginokulasikan pada mediaSimmon’s citrate agar kemudian diinkubasi selama 24 jam pada suhu 37ºC.
Hasil positif akan ditunjukkan dengan adanya perubahan warna media dari hijau menjadi biru. Apabila bakteri dapat menggunakan sitrat, maka asam akan dihilangkan dari media, sehingga menyebabkan peningkatan pH dan mengubah warna medium (Lay, 1994). Setelah diinkubasi, pada kontrol positif, sampel 1, sampel 2 (koloni 1 dan 2), dan sampel 3 (koloni 1 dan 2) menunjukkan hasil positif, ditandai dengan adanya perubahan warna media dari hijau menjadi biru, menunjukkan bahwa bakteri menggunakan sitrat sebagai sumber energi. Balows (1998) mengatakan bahwaSalmonellamenggunakan sitrat sebagai sumber energi.
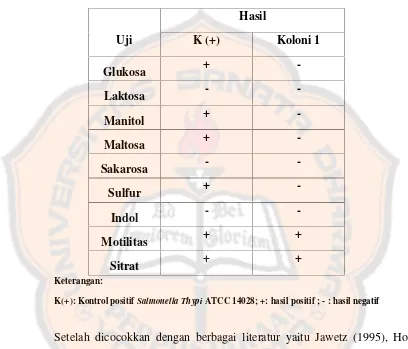
F. Hasil IdentifikasiSalmonellapada Pengambilan Sampel 1
biokimiawi pada sampel pertama dapat dilihat pada Tabel IV. Hasil menunjukkan bahwa koloni tersebut bukan koloniSalmonella.
Tabel IV. Hasil identifikasiSalmonellapada pengambilan sampel 1
Uji
K(+): Kontrol positifSalmonella ThypiATCC 14028; +: hasil positif ; - : hasil negatif
Tabel V. Perbandingan karakteristik biokimiawiPseudomonasdan koloni 1 pada sampel 1
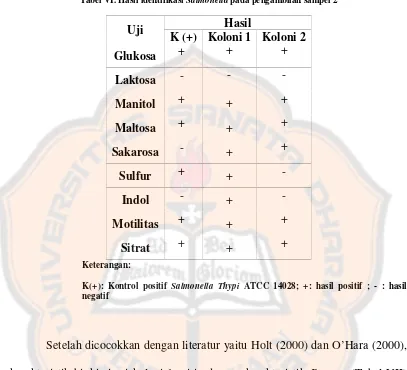
G. Hasil IdentifikasiSalmonellapada Pengambilan Sampel 2
Tabel VI. Hasil identifikasiSalmonellapada pengambilan sampel 2
Uji Hasil
K (+) Koloni 1 Koloni 2
Glukosa + + +
Laktosa - -
-Manitol + + +
Maltosa + + +
Sakarosa - + +
Sulfur + +
-Indol - +
-Motilitas + + +
Sitrat + + +
Keterangan:
K(+): Kontrol positif Salmonella Thypi ATCC 14028; +: hasil positif ; - : hasil negatif
Setelah dicocokkan dengan literatur yaitu Holt (2000) dan O’Hara (2000),
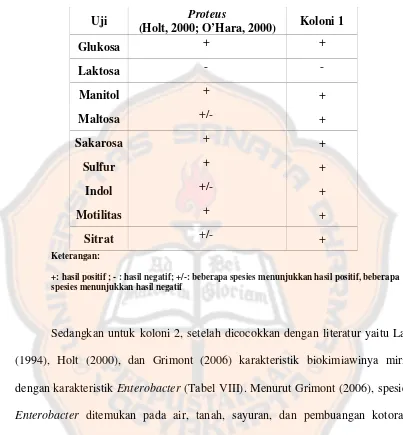
Tabel VII. Perbandingan karakteristik biokimiawiProteusdan koloni 1 pada sampel 2
Uji Proteus
(Holt, 2000; O’Hara, 2000) Koloni 1
Glukosa + +
Laktosa -
-Manitol + +
Maltosa +/- +
Sakarosa + +
Sulfur + +
Indol +/- +
Motilitas + +
Sitrat +/- +
Keterangan:
+: hasil positif ; - : hasil negatif; +/-: beberapa spesies menunjukkan hasil positif, beberapa spesies menunjukkan hasil negatif
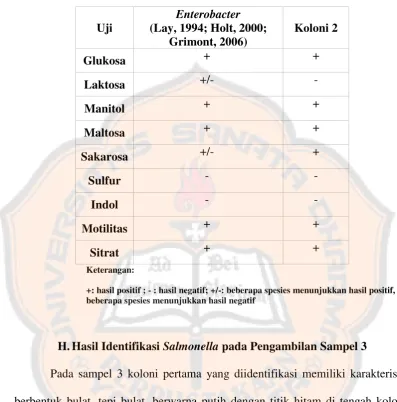
Tabel VIII. Perbandingan karakteristik biokimiawiEnterobacterdan koloni 2 pada sampel 2
+: hasil positif ; - : hasil negatif; +/-: beberapa spesies menunjukkan hasil positif, beberapa spesies menunjukkan hasil negatif
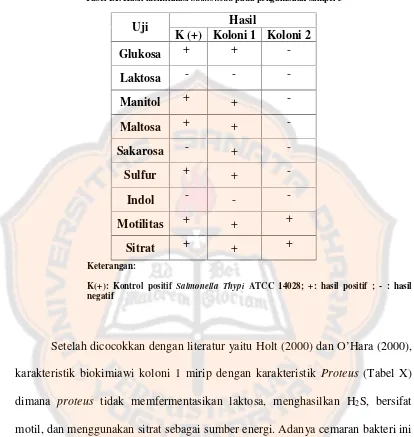
H. Hasil IdentifikasiSalmonellapada Pengambilan Sampel 3
Tabel IX. Hasil identifikasiSalmonellapada pengambilan sampel 3
Uji Hasil
K (+) Koloni 1 Koloni 2
Glukosa + +
-Laktosa - -
-Manitol + +
-Maltosa + +
-Sakarosa - +
-Sulfur + +
-Indol - -
-Motilitas + + +
Sitrat + + +
Keterangan:
K(+): Kontrol positif Salmonella Thypi ATCC 14028; +: hasil positif ; - : hasil negatif
Setelah dicocokkan dengan literatur yaitu Holt (2000) dan O’Hara (2000),
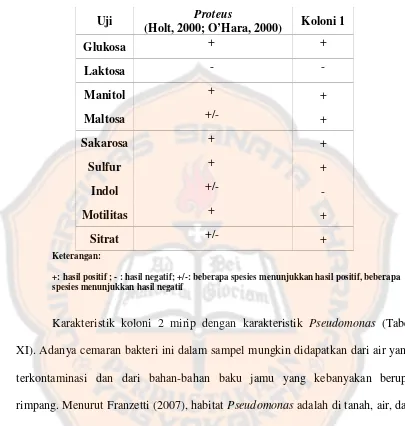
Tabel X. Perbandingan karakteristik biokimiawiProteusdan koloni 1 pada sampel 3
Uji Proteus
(Holt, 2000; O’Hara, 2000) Koloni 1
Glukosa + +
Laktosa -
-Manitol + +
Maltosa +/- +
Sakarosa + +
Sulfur + +
Indol +/-
-Motilitas + +
Sitrat +/- +
Keterangan:
+: hasil positif ; - : hasil negatif; +/-: beberapa spesies menunjukkan hasil positif, beberapa spesies menunjukkan hasil negatif
Tabel XI. Perbandingan karakteristik biokimiawiPseudomonasdan koloni 2 pada sampel 3
+: hasil positif ; - : hasil negatif; +/-: beberapa spesies menunjukkan hasil positif, beberapa spesies menunjukkan hasil negatif
Dari hasil identifikasi pada pengambilan sampel pertama, kedua, dan
ketiga, dapat disimpulkan bahwa jamu cekok yang diproduksi penjual “X” tidak
satu bakteri dari kelompok Pseudomonas, yaitu Pseudomonas aeruginosa, dapat menghasilkan eksotoksin yang dapat menyebabkan nekrosis jaringan. Pseudomonas aeruginosa juga dapat menyebabkan infeksi pada luka dan infeksi saluran kemih (Jawetz, 1995; Grimont, 2006).
Tumbuhnya bakteri-bakteri tersebut dalam media SSA mungkin karena ada beberapa komposisi yang dapat digunakan sebagai nutrisi untuk tumbuh. Unsur penting yang dibutuhkan untuk pertumbuhan mikroorganisme antara lain karbon, nitrogen, sulphur, dan sumber energi (protein, karbohidrat, dan lemak) (Radji, 2010). Dalam SSA mengandung pepton dan ‘lab lemco’ powder. Yang dimaksud dengan ‘lab lemco’ powder adalah ekstrak daging yang dibuat dari bahan baku khusus yang telah dikeringkan menjadi bubuk halus yang dapat meningkatkan pertumbuhan banyak bakteri (Bridson, 1998). Pepton adalah protein dari jaringan hewan atau tumbuhan yang telah mengalami proses hidrolisis dan atau telah mengalami pemutusan ikatan menjadi asam amino dan peptida sebagai sumber nitrogen bagi mikroorganisme (Wijayanti, 2009).
Komposisi SSA memiliki kesamaan dengan produk Oxoid yang lain yaitu SSA modified. Perbedaan SSA dan SSA modified hanya pada jumlah Bile salt. Menurut Bridson (1998), bakteriProteus dapat tumbuh pada media SSAmodified dengan ciri-ciri koloni berwarna transparan dengan titik abu-abu hingga hitam ditengahnya. Dengan adanya kesamaan komposisi antara SSA modifieddan SSA, maka kemungkinan besar bakteriProteusjuga dapat tumbuh pada media SSA.
MacConkey agarsama-sama mengandung bile salt, pepton, dan laktosa, sehingga ada kemungkinanPseudomonasdapat tumbuh pada media SSA (Bridson, 1998).
58 BAB V
KESIMPULAN DAN SARAN
A. Kesimpulan
1. AKK dalam jamu cekok yang diproduksi oleh penjual jamu racik ‘X’ di
Yogyakarta adalah 5,0× 10 koloni/ml sampai dengan 1,3 × 10 koloni/ml dan ALT 1,4× 10 koloni/ml sampai dengan 2,0× 10 koloni/ml.
2. Tidak terdapat bakteri Salmonella dalam jamu cekok yang diproduksi oleh
penjual jamu racik ‘X’ di Yogyakarta.
B. Saran
1. Dapat dilakuan penelitian lebih lanjut mengenai mikroba patogen lain yaitu Proteus,Enterobacter, danPseudomonas.
2. Dapat dilakukan penelitian lebih lanjut mengenai uji mikrobiologi pada saat sebelum dan setelah pemanasan bahan untuk melihat efektivitas pemanasan. 3. Dilakukan pembinaan terhadap penjual jamu racik ‘X’ dan penjual jamu