29.33 29 29.67 29.67 28.67 28 28.2 28.4 28.6 28.8 29 29.2 29.4 29.6 29.8 1 2 3 4 5 Stasiun Pengamatan
Rata-rata Nilai Suhu
IV. HASIL DAN PEMBAHASAN
4.1. Kondisi Perairan Secara Fisika-Kimia Air
Dari hasil pengukuran telah diperoleh data tentang parameter fisika-kimia air di perairan Waduk Cirata, antara lain:
4.1.1. Suhu (oC)
Suhu merupakan salah satu parameter kualitas air yang penting, karena dapat mempengaruhi parameter fisika dan kimia lainnya. Di samping itu, suhu merupakan faktor langsung yang mempengaruhi laju pertumbuhan dan derajat kelangsungan hidup, serta meningkatnya laju metabolisme. Suhu perairan merupakan parameter fisika yang mempengaruhi sebaran organisme akuatik, reaksi kimia, dan laju reaksi.
Hasil pengukuran suhu yang dilakukan di lima stasiun pengamatan dengan tiga ulangan menunjukkan bahwa rata-rata suhu di perairan Waduk Cirata menurut stasiun pengamatan berkisar antara 28,67 – 29,67 oC (Gambar 3), sedangkan menurut ulangan berkisar antara 28,6 – 29,6 oC.
Gambar 3 Rata-rata suhu (oC) pada setiap stasiun pengamatan
Gambar 3 menunjukkan bahwa suhu tertinggi terdapat di dua stasiun yaitu 2 dan 3 (29,67 oC) dan terendah terdapat di stasiun 1 (28,67 oC). Pada waktu penelitian terjadi musim peralihan, yaitu: musim kemarau ke penghujan (Pebruari
- Maret), tetapi musimnya tidak menentu dan intensitas penyinaran matahari relatif masih tinggi bahkan disertai oleh angin, sehingga akan mempengaruhi suhu di perairan Waduk Cirata. Intensitas penyinaran dan kondisi permukaan perairan yang tenang akan menyebabkan penyerapan panas ke dalam air lebih tinggi, sehingga suhu air menjadi maksimum. Dalam suatu perairan apabila suhu mengalami peningkatan maka akan menyebabkan peningkatan kecepatan metabolisme dan respirasi organisme, serta peningkatan konsumsi oksigen. Di samping itu peningkatan suhu perairan dapat menyebabkan penurunan kelarutan gas dalam air, misalnya gas O2, CO2, N2, CH4, dan sebagainya (Haslam, 1995
dalam Effendi, 2003).
Rata-rata suhu perairan yang diperoleh selama pengukuran mempunyai nilai yang berfluktuasi, hal ini kemungkinan dipengaruhi oleh kondisi setiap stasiun yang berbeda, seperti: topografi, ketinggian, kekeruhan, sinar matahari, dan lain-lain. Suhu suatu badan air dipengaruhi oleh musim, lintang (latitude), ketinggian dari permukaan laut (altitude), sirkulasi udara, penutupan awan, dan aliran air serta kedalaman badan air. Suhu perairan dipengaruhi oleh komposisi substrat, kekeruhan, air hujan, luas permukaan yang langsung mendapat sinar matahari, dan air limpahan (Perkins, 1974).
Nilai suhu yang diperoleh pada setiap stasiun pengamatan di Waduk Cirata masih dalam toleransi untuk kehidupan biota air pada umumnya. Kebanyakan organisme akuatik memiliki suhu optimum berkisar antara 20 - 30 oC. Biota air (beberapa jenis molluska) memiliki suhu optimum sekitar 30 oC. Sedangkan Kinne (1972) dalam Emiyarti (2004), menyatakan bahwa kisaran suhu kritis (menyebabkan kematian) bagi kehidupan makrozoobentos, yaitu: antara 35-40 oC.
4.1.2. Kekeruhan
Kekeruhan menggambarkan sifat optik air yang ditentukan berdasarkan banyaknya cahaya yang diserap dan dipancarkan oleh bahan-bahan yang terdapat dalam air. Pada perairan yang tergenang (lentik), misalnya waduk atau danau, kekeruhan lebih banyak disebabkan oleh bahan tersuspensi yang berupa koloid dan partikel-partikel halus, sedangkan pada sungai yang sedang banjir lebih banyak disebabkan oleh bahan-bahan tersuspensi yang berukuran lebih besar,
4.08 12.62 27 9.96 4.12 0 5 10 15 20 25 30 1 2 3 4 5 Stasiun Pengamatan R a ta -ra ta N ila i K e k e ru h a n (N T U )
misalnya: berupa lapisan permukaan tanah yang terbawa oleh aliran air pada saat hujan.
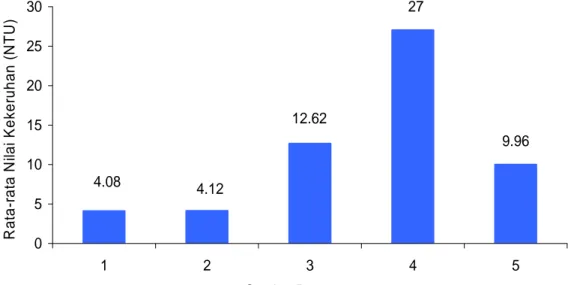
Berdasarkan hasil pengukuran menunjukkan bahwa rata-rata kekeruhan pada setiap stasiun pengamatan berkisar antara 4,08 – 27 NTU (Gambar 4) sedangkan menurut ulangan berkisar antara 8,4 – 15,18 NTU.
Gambar 4 Rata-rata kekeruhan pada setiap stasiun pengamatan
Gambar 4 menunjukkan bahwa di stasiun 4 memiliki nilai kekeruhan yang tertinggi (27 NTU) dan kekeruhan terendah di stasiun 1 (4,08 NTU). Tingginya kekeruhan yang terjadi di stasiun 4 disebabkan karena curah hujan yang cukup tinggi (debit air sungai meningkat), sehingga terjadi erosi. Erosi tersebut berasal dari daerah permukiman penduduk, pertanian, dan industri yang membawa partikel-partikel baik berupa bahan organik maupun bahan anorganik yang mengalir masuk ke perairan Waduk Cirata.
Faktor yang mempengaruhi tingginya kekeruhan di stasiun tersebut, yaitu: (1) tingginya curah hujan pada waktu pengambilan sampel ulangan 2 dibanding dengan stasiun lainnya, sehingga dapat menyebabkan terjadinya erosi. Pada waktu pengambilan sampel di stasiun 4 ulangan 2 terjadi perubahan warna air (keruh), dibanding pengambilan sampel ulangan 1 dan 3, (2) berasal dari pembuangan air Waduk Saguling (outlet). Stasiun 4 merupakan DAS Citarum yang menjadi salah satu sumber air Waduk Cirata dan bagian atasnya terdapat Waduk Saguling, sedangkan stasiun 1 merupakan pintu masuk air Waduk Cirata menuju turbin
(depan DAM), kondisi daerah sekitarnya bergunung-gunung dan terdapat sedikit kegiatan pertanian, serta tidak terdapat permukiman penduduk.
Kekeruhan air disebabkan karena air mengandung begitu banyak partikel bahan yang tersuspensi, sehingga merubah bentuk tampilan menjadi berwarna yang berlumpur dan kotor. Kekeruhan dapat disebabkan oleh bahan-bahan tersuspensi yang bervariasi dari ukuran koloid sampai dispersi kasar, tergantung dari derajat turbulensinya. Tingkat kekeruhan air di perairan mempengaruhi tingkat kedalaman pencahayaan matahari, semakin air keruh semakin menghambat sinar matahari yang masuk ke dalam air, oleh karena itu, apabila cahaya matahari berkurang masuk ke dalam air maka mahluk hidup dalam air akan terganggu, khususnya mahluk yang berada di kedalaman tertentu (Hardjojo dan Djokosetiyanto, 2005). Suatu perairan yang mempunyai kekeruhan yang tinggi cenderung mempunyai suhu yang lebih tinggi, hal ini dikarenakan sebahagian dari bahan tersuspensi menyerap panas.
4.1.3. Alkalinitas
Alkalinitas secara umum menunjukkan konsentrasi basa atau bahan yang mampu menetralisir kemasaman dalam air. Secara khusus, alkalinitas sering disebut sebagai besaran yang menunjukkan kapasitas pembufferan dari ion bikarbonat (HCO3-), dan sampai tahap tertentu ion karbonat (CO32-) dan
hidroksida (OH-) dalam air. Ketiga ion tersebut di dalam air akan bereaksi dengan ion hidrogen sehingga menurunkan kemasaman dan menaikkan pH. Alkalinitas biasanya dinyatakan dalam satuan atau setara dengan ppm (mg/l) kalsium karbonat (CaCO3).
Alkalinitas perairan berkaitan dengan gambaran kandungan karbonat dari batuan dan tanah yang dilewati oleh air serta sedimen dasar perairan. Alkalinitas dihasilkan dari karbondioksida dan air yang dapat melarutkan sedimen batuan karbonat menjadi bikarbonat. Perairan yang mempunyai kadar bikarbonat yang tinggi disebabkan oleh ionisasi asam karbonat, terutama pada perairan yang banyak mengandung karbondioksida (kadar CO2 mengalamisaturasi atau jenuh).
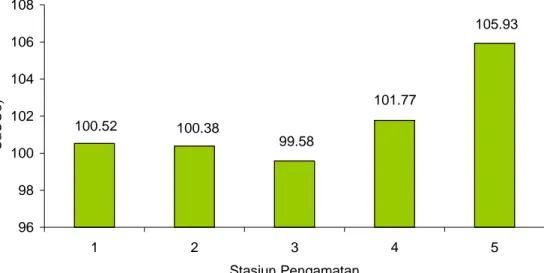
Berdasarkan hasil pengukuran alkalinitas diperoleh kisaran rata-rata antara 99,58 - 105,93 mg/l CaCO3. Stasiun yang mempunyai nilai alkalinitas yang tinggi,
105.93 101.77 99.58 100.38 100.52 96 98 100 102 104 106 108 1 2 3 4 5 Stasiun Pengamatan Ra ta -ra ta Ni lai A lka lini ta s (m g /l Ca CO 3)
yaitu stasiun 5 (105,93 mg/l CaCO3) dan terendah stasiun 3 (99,58 mg/l CaCO3) .
Untuk lebih jelasnya hasil pengukuran rata-rata nilai alkalinitas di setiap stasiun pengamatan dapat dilihat pada Gambar 5.
Gambar 5 Rata-rata nilai alkalinitas di setiap stasiun pengamatan
Air dengan kandungan kalsium karbonat lebih dari 100 ppm disebut sebagai alkalin, sedangkan air dengan kandungan kurang dari 100 ppm disebut sebagai lunak atau tingkat alkalinitas sedang (Hardjojo dan Djokosetiyanto, 2005). Kalsium karbonat merupakan senyawa yang memberi konstribusi terbesar terhadap nilai alkalinitas dan kesadahan di perairan tawar. Senyawa tersebut terdapat di dalam tanah dalam jumlah yang berlimpah sehingga kadarnya di perairan tawar cukup tinggi. Kelarutan kalsium karbonat menurun dengan meningkatnya suhu dan meningkat dengan keberadaan karbondioksida. Kalsium karbonat bereaksi dengan karbondioksida membentuk kalsium bikarbonat [Ca(HCO3)2] yang memiliki daya larut lebih tinggi dibandingkan dengan kalsium
karbonat (CaCO3) (Colel, 983 dalam Effendi, 2003).
Nilai alkalinitas yang baik berkisar antara 30 - 500 mg/l CaCO3 (Effendi,
2003). Pada umumnya lingkungan yang baik bagi kehidupan ikan adalah dengan nilai alkalinitas di atas 20 ppm.
4.1.4. Nilai pH
Nilai pH merupakan suatu pernyataan dari konsentrasi ion hidrogen (H+) di dalam air. Besarnya dinyatakan dalam minus logaritma dari konsentrasi ion H.
7.43 7.5 7.4 7.4 7.7 7.25 7.3 7.35 7.4 7.45 7.5 7.55 7.6 7.65 7.7 7.75 1 2 3 4 5 Stasiun Pengamatan Rata-rata Ni la i p H
Nilai pH menunjukkan derajat keasaman atau kebasaan suatu perairan. Nilai pH suatu perairan memiliki ciri yang khusus yaitu adanya keseimbangan antara asam dan basa dalam air dan yang diukur adalah ion hidrogen. pH sangat penting sebagai parameter kualitas air karena dapat mengontrol tipe dan laju kecepatan reaksi beberapa bahan di dalam air. Besaran pH berkisar dari 0 (sangat asam) sampai dengan 14 (sangat basa/alkalis). Nilai pH kurang dari 7 menunjukkan lingkungan yang masam, nilai di atas 7 menunjukkan lingkungan yang basa (alkalin), dan nilai 7 di sebut pH netral.
Hasil pengukuran nilai pH di setiap stasiun pengamatan mempunyai rata-rata berkisar antara 7,4 – 7,7 (Gambar 6), sedangkan rata-rata-rata-rata nilai pH menurut ulangan pengamatan berkisar antara 6,98– 7,8.
Gambar 6 Rata-rata nilai pH pada setiap stasiun pengamatan
Gambar 6 menunjukkan bahwa stasiun 2 (7,7) mempunyai nilai pH yang tinggi dan nilai pH terendah terdapat di stasiun 1 dan 3 (7,4). Nilai rata-rata pH di setiap stasiun pengamatan cenderung bersifat netral dan nilai pH tidak terlalu bervariasi atau nilainya hampir sama. Hal ini menunjukkan bahwa perairan Waduk Cirata mempunyai nilai pH yang cenderung bersifat netral dan hal ini juga erat kaitannya dengan lokasi di sekitar waduk cirata yang berbatu-batu dan bersubstrat pasir khususnya di stasiun 2 (nilai pH-nya tertinggi). Fluktuasi pH air sangat ditentukan oleh alkalinitas air tersebut. Apabila alkalinitasnya tinggi maka air tersebut akan mudah mengembalikan pH-nya ke nilai semula.
Pada suatu perairan nilai pH ditentukan oleh interaksi berbagai zat dalam air. Jadi semakin banyak air sebagai pelarut akibat hujan, maka pengaruh untuk nilai pH air yang ditimbulkan oleh interaksi berbagai zat dalam air tersebut semakin kecil. Dampak yang ditimbulkan apabila kondisi perairan yang bersifat sangat asam maupun sangat basa akan membahayakan kelangsungan hidup organisme karena akan menyebabkan terjadinya gangguan metabolisme dan respirasi dan suatu perairan yang mempunyai nilai pH tinggi akan menyebabkan keseimbangan antara amonium dan amonia dalam air terganggu. Kenaikan pH di atas netral akan meningkatkan konsentrasi amonia yang juga bersifat toksik bagi organisme. Nilai pH yang ideal bagi kehidupan organisme air pada umum berkisar antara 7 sampai 8,5 (Barus, 2001).
Nilai pH di perairan Waduk Cirata di setiap stasiun pengamatan sesuai dengan kriteria mutu air peruntukannya untuk budidaya ikan berdasarkan kriteria mutu air kelas 2 dan 3, yaitu sekitar 6 – 9 (PP. No. 82 Tahun 2001).
4.1.5. Amonia (NH3)
Amonia di perairan merupakan hasil proses pembusukan bahan organik oleh bakteri serta hasil penguraian protein dan kotoran hewan. Sumber lain amonia di perairan, yaitu: (1) reduksi gas nitrogen yang berasal dari proses difusi udara atmosfir, (2) limbah industri [proses produksi urea, produksi bahan kimia (asam nitrat, amonium fosfat, amonium nitrat dan amonium sulfat), industri pulp and paper], dan (3) limbah domestik.
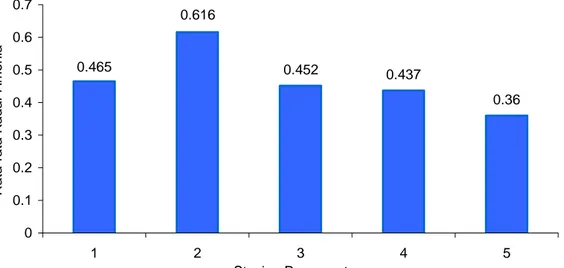
Hasil pengukuran amonia (NH3) yang dilakukan pada setiap stasiun
pengamatan mempunyai nilai rata-rata berkisar antara 0,36 - 0,616 mg/l (Gambar 7), sedangkan nilai rata-rata menurut ulangan berkisar antara 0,183 - 0,782 mg/l. Nilai amonia yang tertinggi terdapat di stasiun 2 sekitar 0,616 mg/l dan terendah terdapat di stasiun 5 sekitar 0,36 mg/l.
Tingginya atau bervariasinya nilai amonia tersebut disebabkan karena banyaknya masukan limbah baik limbah organik maupun limbah bahan anorganik yang masuk ke sungai dan akhirnya terbawa oleh aliran air yang masuk ke Waduk Cirata. Pada stasiun 2 (muara Sungai Cikundul) tersebut disekitarnya terdapat
0.36 0.437 0.452 0.616 0.465 0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 1 2 3 4 5 Stasiun Pengamatan R a ta -ra ta Kadar Amon ia
permukiman penduduk dan kegiatan pertanian (sawah), sehingga kemungkinan besar tingginya nilai amonia banyak bersumber dari kegiatan tersebut.
Gambar 7 Rata-rata kadar amonia (NH3) di setiap stasiun pengamatan
Konsentrasi amonia yang tinggi dapat merupakan indikasi adanya pencemaran bahan organik yang berasal dari limbah domestik, industri, dan limpasan (run-off) pupuk pada pertanian. Toksisitas amonia terhadap organisme akuatik akan meningkat jika terjadi penurunan kadar oksigen terlarut, pH, dan suhu. Amonia yang terukur di perairan berupa amonia total (NH3 dan NH4+).
Amonia bebas (NH3) yang tidak terionisasi bersifat toksik terhadap organisme
akuatik, serdangkan amonium (NH4+) dapat terionisasi. Pada pH 7 atau kurang,
sebagian besar amonia akan mengalami ionisasi. Sebaliknya, pada pH lebih besar dari 7, amonia tak terionisasi yang bersifat toksik.
Sumber lain keberadaan amonia, yaitu: sisa-sisa pakan dan feses ikan yang berasal dari Keramba Jaring Apung (KJA) yang terdapat di sekitar stasiun pengamatan. Dengan terjadinya penumpukan bahan organik tersebut di dasar perairan maka menyebabkan terjadinya proses dekomposisi oleh mikroorganisme sehingga menghasilkan amonia yang cukup tinggi dan jumlahnya semakin lama semakin meningkat di perairan. Menurut Boyd (1982), keberadaan amonia di perairan merupakan hasil proses dekomposisi dari bahan organik yang banyak mengandung senyawa nitrogen oleh mikroba, ekresi organisme, reduksi nitrit oleh bakteri, dan kegiatan pemupukan.
0.436 0.422 0.548 0.57 0.0914 0 0.1 0.2 0.3 0.4 0.5 0.6 1 2 3 4 5 Stasiun Pengamatan R at a-rat a K adar N it rat
Menurut McNeely et al. (1979 dalam Effendi 2003) bahwa konsentrasi amonia pada perairan alami biasanya kurang dari 0,1 mg/l, selanjutnya dikemukakan bahwa konsentrasi amonia bebas lebih dari 0,2 mg/l bersifat toksik pada beberapa jenis ikan. Sedangkan Boyd (1982) menyatakan konsentrasi amonia yang bersifat toksik bagi sebagian besar biota perairan berkisar 0.6 - 2.0 mg/l. Jika dibandingkan dengan baku mutu air yang direkomendasikan PP. No. 82 Tahun 2001 (khusus kelas 1) maka nilai amonia di stasiun 2 sudah melewati ambang batas baku mutu.
4.1.6. Nitrat (NO3-)
Nitrat (NO3-) adalah bentuk senyawa nitrogen yang merupakan sebuah
senyawa stabil. Nitrat merupakan salah satu senyawa penting untuk sintesis protein tumbuhan dan hewan, akan tetapi nitrat pada konsentrasi yang tinggi dapat menstimulasi pertumbuhan ganggang yang tidak terbatas. Hasil pengukuran nitrat di setiap stasiun pengamatan mempunyai rata-rata berkisar antara 0,0914 - 0,57 mg/l (Gambar 8), sedangkan nilai rata-rata ulangan pada masing - masing stasiun berkisar antara 0,171- 0,59 mg/l.
Gambar 8 Rata-rata nilai nitrat (NO3-) di setiap stasiun pengamatan
Gambar 8 menunjukkan bahwa kadar nitrat tertinggi terdapat di stasiun 2 dan terendah di stasiun 1. Tingginya kadar nitrat tersebut berasal dari aktivitas manusia, baik dari kegiatan pertanian (sawah dan bercocok tanam) yang terdapat di sekitar sungai atau Waduk Cirata, maupun kegiatan permukiman. Salah satu sumber yang menyebabkan tingginya nilai nitrat yang diperoleh di duga berasal
dari kegiatan pertanian (sawah) yang menggunakan pupuk yang terdapat di sekitar Sungai Cigundul (stasiun 2), sedangkan rendahnya nilai nitrat yang diperoleh di stasiun 1, erat kaitannya dengan sumber nitrat yang terdapat di sekitar stasiun tersebut kurang. Pada suatu perairan yang menerima limpasan air dari daerah pertanian yang banyak mengandung pupuk kadar nitrat dapat mencapai 1.000 mg/l (Effendi, 2003).
Kadar nitrat di perairan yang tidak tercemar biasanya lebih tinggi dari pada kadar amonia. Kadar nitrat pada perairan alami hampir tidak pernah lebih dari 0,1 mg/l, sedangkan lebih dari 5 mg/l menggambarkan terjadinya pencemaran antropogenik yang berasal dari aktivitas manusia dan kotoran hewan (Effendi, 2003). Dari kadar nitrat yang diperoleh selama penelitian masih dibawah baku mutu menurut PP. No. 82 Tahun 2001 berdasarkan kriteria kelas 2 dan 3 untuk budidaya ikan (0,57 < 10 dan 20 mg/l).
4.1.7. Nitrit (NO2-)
Pada perairan alami nitrit biasanya ditemukan dalam jumlah yang sangat sedikit dibandingkan dengan nitrat, karena bersifat tidak stabil dengan keberadaan oksigen atau nitrit biasanya tidak dapat bertahan lama dalam perairan dan merupakan keadaan sementara proses oksidasi antara amonia dan nitrat. Pada suatu perairan kadar nitrit relatif kecil karena segera dioksidasi menjadi nitrat. Perairan alami mengandung nitrit sekitar 0,001 mg/l dan sebaiknya tidak melebihi 0,06 mg/l.
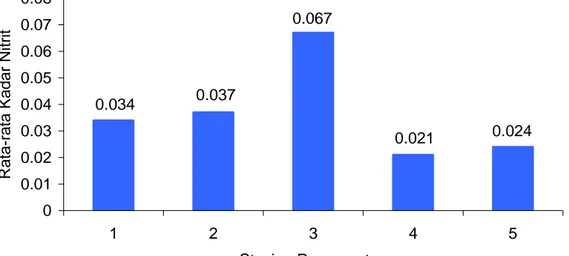
Hasil pengukuran kadar nitrit di setiap stasiun pengamatan mempunyai nilai rata berkisar antara 0,021 – 0,067 mg/l (Gambar 9), sedangkan nilai rata-rata pengukuran nitrit menurut ulangan berkisar antara 0.021-0.06 mg/l. Gambar 9 menunjukkan bahwa kadar nitrit yang tinggi terdapat di stasiun 3 (0.067) dan terendah di stasiun 4 (0.021), sedangkan stasiun 1, 2, dan 5 masing-masing 0.034, 0.037, dan 0.024 mg/l.
Tingginya keberadaan kadar nitrit di stasiun 3 (Sungai Cisokan) berasal dari kegiatan manusia (seperti: permukiman (perkotaan), pertanian, dan industri) yang berada, baik di sekitar stasiun tersebut maupun di sepanjang aliran sungai, sehingga dapat menjadi sumber keberadaan nitrit di perairan Waduk Cirata.
0.024 0.021 0.034 0.037 0.067 0 0.01 0.02 0.03 0.04 0.05 0.06 0.07 0.08 1 2 3 4 5 Stasiun Pengamatan Rata-rata Kadar Ni trit
Sedangkan rendahnya kadar nitrit di stasiun 4, hal ini erat kaitannya dengan sumber nitrit atau berkaitan erat dengan sifat nitrit (NO2) yang tidak stabil,
sehingga ada kemungkinan sebahagian nitrit telah teroksidasi menjadi nitrat (NO3)
karena kandungan oksigen terlarut yang mendukung proses oksidasi tersebut. yang terdapat di sekitar stasiun tersebut.
Berdasarkan kisaran kadar nitrit yang diperoleh selama penelitian masih dalam kisaran Nilai Ambang Baku Mutu menurut PP. No. 82 Tahun 2001 dengan kriteria air berdasarkan kelas 2 dan 3 untuk kegiatan budidaya ikan.
Gambar 9 Rata- rata kadar nitrit di setiap stasiun pengamatan
Untuk lebih jelasnya, data parameter fisika-kimia air berdasarkan stasiun dan ulangan selama penelitian disajikan pada Lampiran 1.
4.1.8. Kandungan Logam Berat Dalam Air, Sedimen, dan Makrozoobentos 4.1.8.1. Timbal (Pb)
Secara alamiah, Timbal (Pb) dapat masuk ke dalam perairan melalui pengkristalan Pb di udara dengan bantuan air hujan. Di samping itu, korosifikasi dari batuan mineral akibat angin juga merupakan salah satu jalur Pb masuk dalam badan air. Logam Pb yang masuk ke dalam perairan sebagai dampak dari aktifitas kehidupan manusia, diantaranya: air limbah dari industri yang berkaitan dengan logam Pb (industri baterai, cat, dan barang-barang elektronik), air buangan dari pertambangan bijih timah hitam.
0.0121 0.014 0.017 0.013 0.0213 0 0.005 0.01 0.015 0.02 0.025 1 2 3 4 5 Stasiun Pengamatan Ka ndun gan Pb di Ai r (mg/ l) 0 0.005 0.01 0.015 0.02 0.025 0.03 0.035 Stasiun Pengamatan K a ndu ngan Log am P b di A ir ( m g/ l) Ulangan ke 1 0.02 0.01 0.01 0.01 0.02 Ulangan ke 2 0.03 0.02 0.02 0.02 0.03 Ulangan ke 3 0.014 0.01 0.02 0.0133 0.0133 1 2 3 4 5
Berdasarkan hasil analisis di laboratorium, bahwa rata-rata kandungan logam Pb dalam air pada setiap stasiun pengamatan berkisar antara 0,0121 -0,0213 mg/l (Gambar 10), sedangkan menurut ulangan berkisar antara 0,014 - 0,024 mg/l (Gambar 11).
Gambar 10 Rata-rata kandungan logam Pb dalam air pada setiap stasiun pengamatan
Gambar 11 Kandungan logam Pb dalam air menurut ulangan pengamatan
Gambar 10 menunjukkan bahwa terdapat perbedaan kandungan logam Pb dalam air pada setiap stasiun pengamatan, dimana stasiun 1 mempunyai nilai rata-rata tertinggi sekitar 0,0213 mg/l dan terendah di stasiun 5 sekitar 0,0121 mg/l. Tingginya kandungan logam Pb dalam air, disebabkan karena di stasiun tersebut
terletak disekitar pintu masuk air Waduk Cirata menuju turbin (depan DAM). Jadi air yang masuk ke Waduk Cirata yang berasal dari DAS dan Sub DAS yang mengalir (bermuara) ke waduk tersebut akan membawa limbah logam berat (berasal dari limbah industri, domestik, dan pertanian) dan pada akhirnya akan terkumpul di depan DAM. Hal tersebut berkaitan dengan curah hujan yang tinggi, sehingga debit air waduk dan sungai meningkat.
Sumber lain tingginya kandungan logam Pb diduga bersumber dari bongkar muat barang atau mobilisasi lalu lintas perairan (perahu) yang membawa bibit ikan atau pakan di Waduk Cirata yang menggunakan Bahan Bakar Minyak (BBM). Di samping itu, dipengaruhi karena tingginya curah hujan yang mengakibatkan naiknya debit air sungai (Sub DAS Cisokan) yang membawa limbah perkotaan dan limbah industri masuk ke perairan Waduk Cirata dan pada akhirnya akan mengendap di dasar perairan.
Sedangkan Gambar 11 menunjukkan bahwa nilai kandungan logam Pb dalam air menurut ulangan pengamatan mempunyai nilai yang berfluktuasi, dimana pada ulangan ke 2 mengalami peningkatan kandungan logam Pb dalam air pada setiap stasiun pengamatan dibanding ulangan ke 1, tetapi pada ulangan ke 3 pada stasiun 1, 2, 4, dan 5 mengalami penurunan kandungan logam Pb dalam air. Hal tersebut kemungkinan dipengaruhi karena pada waktu pengambilan sampel terjadi peralihan musim, yaitu musim kemarau ke penghujan (bulan pebruari), sehingga debit air sungai dan waduk mengalami peningkatan.
Secara keseluruhan di kelima stasiun pengamatan terlihat bahwa pada pengambilan sampel ulangan ke 2 mengalami peningkatan kandungan logam Pb dalam air dibanding dengan ulangan 1 dan 3. Pada pengambilan sampel ulangan ke 2 sudah masuk musim penghujan, sehingga sumber logam berat khususnya Pb dari limbah yang dihasilkan oleh aktivitas manusia di darat, seperti pertanian, permukiman, dan industri akan masuk ke sungai bersamaan dengan meningkatnya debit air sungai yang bermuara ke Waduk Cirata dan akan mengalami pengadukan air sehingga logam Pb di sedimen yang mengendap selama musim kemarau akan terlepas dari sedimen serta pada akhirnya logam Pb dalam air akan terakumulasi atau mengendap kembali di dasar perairan.
Menurut Philips (1980) dalam Fitriati (2004), diperkirakan konstribusi manusia dalam pencemaran logam berat dapat berupa limbah perkotaan, industri, pertambangan, dan pertanian. Bryan (1976) menyatakan bahwa sumber logam berat yang paling besar adalah berasal dari kegiatan manusia, baik di darat maupun di laut. Hal tersebut disebabkan karena senyawa atau unsur logam berat sangat banyak dimanfaatkan dalam industri, baik sebagai bahan baku, katalis, fungisida, maupun aditif. Sedangkan menurut Darmono (1995), bahwa pada air tawar logam yang terkandung di dalamnya biasanya dari buangan air limbah, erosi, dan dari udara secara langsung.
Timbal masuk ke perairan melalui pengendapan, jatuhan debu yang mengendap Pb yaitu hasil pembakaran bensin yang mengandung timbal tetraetil, erosi, dan limbah industri (Saeni, 1989). Senyawa Pb dalam bentuk organik lebih beracun dibandingkan dengan bentuk anorganik. Menurut Haldstead (1972), unsur Pb bersifat kronis dan akumulatif dalam tumbuhan dan hewan air. Keadaan perairan yang berubah-ubah, misalnya perubahan suhu, pH, intensitas, jumlah dan jenis bahan bahan pencemar dapat mengganggu bentuk logam berat yang ada. Oleh sebab itu, logam berat di dalam air selalu berubah-ubah dari waktu ke waktu, dan berbeda dari satu lokasi ke lokasi lainnya.
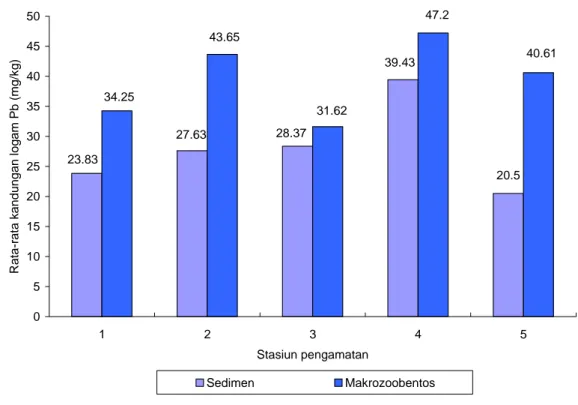
Hasil pengukuran kandungan logam Pb dalam sedimen dan makrozoobentos masing-masing mempunyai rata-rata berkisara antara 20,5 - 39,43 mg/kg dan 31,62 - 47,2 mg/kg (Gambar 12), sedangkan menurut ulangan berkisar antara 19,54 - 42,4 mg/kg dan 3,3 - 111,6 mg/kg (Gambar 13 dan 14).
Gambar 12 menunjukkan bahwa kandungan logam Pb dalam sedimen pada setiap stasiun pengamatan mempunyai nilai yang bervariasi, dimana stasiun 4 mempunyai rata-rata sekitar 39,43 mg/kg dan terendah di stasiun 5 sekitar 20,5 mg/kg. Sedangkan rata-rata kandungan logam Pb di makrozoobentos di setiap stasiun pengamatan sangat bervariasi, dimana nilai rata-rata Pb tertinggi di stasiun 4 sekitar 47,2 mg/kg dan terendah di stasiun 3 sekitar 31,62 mg/kg.
20.5 39.43 28.37 27.63 23.83 40.61 47.2 31.62 34.25 43.65 0 5 10 15 20 25 30 35 40 45 50 1 2 3 4 5 Stasiun pengamatan R a ta -rat a ka nd ung an l oga m P b (mg/ k g ) Sedimen Makrozoobentos
Gambar 12 Rata-rata kandungan logam Pb dalam sedimen dan makrozoobentos pada setiap stasiun pengamatan
Secara umum berdasarkan Gambar 10 dan 12, menunjukkan bahwa terjadi peningkatan kandungan logam Pb dalam air, sedimen, dan makrozoobentos selama penelitian atau semakin tinggi kandungan logam Pb dalam air juga semakin tinggi kandungan Pb dalam sedimen dan makrozoobentos pada setiap stasiun pengamatan. Hal tersebut menandakan bahwa absorbsi (penyerapan) jenis logam berat khususnya Pb oleh makrozoobentos di stasiun tersebut tinggi dan berkorelasi positif dengan kandungan logam berat Pb dalam air, sedimen dengan makrozoobentos atau kandungan logam berat di makrozoobentos lebih tinggi dibandingkan dengan kandungan logam Pb dalam sedimen dan air.
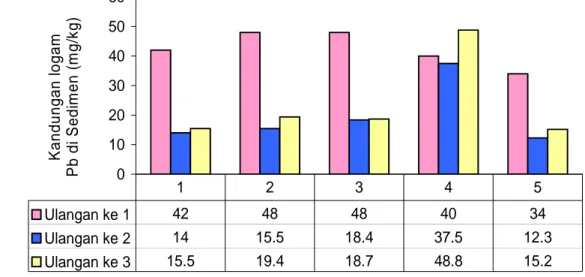
Kandungan logam Pb dalam sedimen dan makrozoobentos menurut ulangan di perairan Waduk Cirata dapat dilihat pada Gambar 13 dan 14. Gambar 13 menunjukkan bahwa kandungan logam berat Pb dalam sedimen menurut ulangan di kelima stasiun pengamatan mempunyai nilai yang bervariasi. Kandungan logam Pb dalam sedimen pada ulangan 1 lebih tinggi dibandingkan ulangan ke 2 dan mengalami peningkatan pada ulangan ke 3 di kelima stasiun pengamatan. Tingginya kandungan logam berat dalam sedimen diduga karena
0 10 20 30 40 50 60 Stasiun Pengamatan K a ndungan l ogam P b di S edi m en ( m g/ k g) Ulangan ke 1 42 48 48 40 34 Ulangan ke 2 14 15.5 18.4 37.5 12.3 Ulangan ke 3 15.5 19.4 18.7 48.8 15.2 1 2 3 4 5
telah terjadi pengendapan yang tinggi akibat masuknya logam berat ke sungai atau waduk yang terus menerus, baik dari limbah yang berasal dari darat, seperti limbah perkotaan dan tempat penimbunan sampah rumah tangga, maupun limbah transfortasi dan industri (Connel dan Miller, 2006).
Gambar 13 Kandungan logam Pb dalam sedimen menurut ulangan pengamatan Selanjutnya Gambar 13 juga menunjukkan bahwa kandungan logam Pb dalam sedimen menurut ulangan pengamatan mempunyai nilai yang sangat bervariasi. Kandungan logam berat dalam sedimen erat kaitanya dengan keberadaan logam berat dalam kolom air. Logam berat yang berada dalam kolom air akan mengalami proses penggabungan dengan senyawa-senyawa lain, baik yang berupa bahan organik maupun bahan anorganik, sehingga berat jenisnya menjadi lebih besar (berat) yang pada akhirnya akan cepat mengalami proses pengendapan atau sedimentasi di dasar perairan.
Kandungan logam berat yang ada di sedimen sangat dipengaruhi oleh musim. Menurut Bryan (1976), bahwa kandungan logam berat pada sedimen umumnya rendah pada musim kemarau dan tinggi pada musim penghujan. Penyebab tingginya kadar logam berat di sedimen pada musim penghujan kemungkinan disebabkan oleh tingginya laju erosi pada permukaan tanah yang terbawa ke dalam badan sungai, sehingga sedimen dalam sungai atau yang diduga mengandung logam berat akan terbawa oleh arus sungai menuju muara pada akhirnya terjadi proses sedimentasi. Pernyataan tersebut di atas sesuai dengan
hasil yang diperoleh selama penelitian, sebagaimana ditunjukkan pada stasiun 4 ulangan 3, dimana kandungan logam Pb dalam sedimen semakin tinggi pada musim penghujan. Hal tersebut juga dipengaruhi oleh sumber logam berat yang terdapat di setiap stasiun penelitian berbeda-beda.
Pada musim penghujan, lumpur yang ada di dasar perairan (sungai atau waduk) akan teraduk dan sebagian terbawa aliran air sungai yang membentuk endapan di sekitar muara Waduk Cirata. Dalam air sungai terdapat partikel - partikel koloid yang berasal dari batuan terkikis dan bagian tanah halus yang tersuspensi. Partikel-partikel tersebut mempunyai kemanpuan besar untuk mengabsorpsi ion-ion logam berat. Menurut Clark et al (1977), lumpur terbentuk pada saat koagulasi, yaitu bergabungnya partikel-partikel kecil berupa koloid menjadi partikel-partikel yang lebih besar. Apabila partikel-partikel tersebut melewati ukuran tertentu, maka terjadi pengendapan. Proses tersebut berlangsung terus menerus, sehingga lapisan lumpur semakin lama semakin tebal.
Menurut Laws (1981), bahwa logam berat mempunyai sifat mudah terikat dengan bahan terlarut, sehingga limbah yang berasal dari permukiman (rumah tangga) yang mengandung bahan organik akan bereaksi dan mengikat kation logam berat sehingga pada akhirnya mengendap di dasar perairan dan bersatu dengan sedimen. Hal tersebut mengakibatkan kandungan logam berat dalam sedimen jauh lebih tinggi dari pada di air, selanjutnya pada kondisi tertentu logam berat di sedimen akan terlepas kembali setelah beberap lama, sehingga dicapai suatu keseimbangan.
Untuk mengetahui tingkat pencemaran logam berat pada suatu perairan, maka dilakukan pengukuran kandungan logam dalam air dan sedimen (lumpur). Kedua media tersebut saling berinteraksi melalui proses: (1) fisika, proses ini mempengaruhi penyebaran bahan pencemar akibat adanya arus, perubahan suhu, pengadukan (turbulensi), dan hujan, (2) kimia, proses ini mempengaruhi adsorpsi logam berat pada sedimen, pengendapan, dan pertukaran ion. Kandungan logam berat dalam bentuk terlarut dipengaruhi oleh suhu, oksigen terlarut, dan laju aliran sungai (Sylvester, 1978 dalam Mokoagouw 2000).
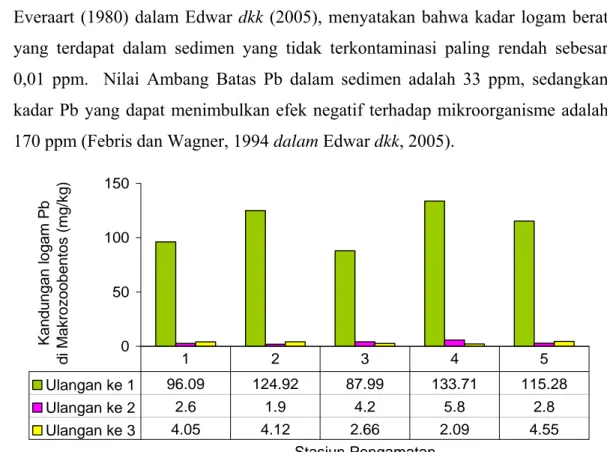
Kadar normal Pb dalam sedimen yang tidak terkontaminasi berkisar antara 10 – 70 ppm (Thayib dan Razak, 1981 dalam Edwar dkk, 2005). Sedangkan
0 50 100 150 Stasiun Pengamatan Kandu ngan logam Pb di Makro z oob ent os (mg/ kg) Ulangan ke 1 96.09 124.92 87.99 133.71 115.28 Ulangan ke 2 2.6 1.9 4.2 5.8 2.8 Ulangan ke 3 4.05 4.12 2.66 2.09 4.55 1 2 3 4 5
Everaart (1980) dalam Edwar dkk (2005), menyatakan bahwa kadar logam berat yang terdapat dalam sedimen yang tidak terkontaminasi paling rendah sebesar 0,01 ppm. Nilai Ambang Batas Pb dalam sedimen adalah 33 ppm, sedangkan kadar Pb yang dapat menimbulkan efek negatif terhadap mikroorganisme adalah 170 ppm (Febris dan Wagner, 1994 dalam Edwar dkk, 2005).
Gambar 14 Kandungan logam Pb dalam makrozoobentos menurut ulangan pengamatan
Gambar 14 menunjukkan bahwa kandungan logam Pb dalam makrozoobentos pada stasiun 4 ulangan 1 mempunyai kandungan yang tertinggi. Hal tersebut sesuai dengan pola kandungan Pb di sedimen. Kandungan logam Pb dalam makrozoobentos pada ulangan ke 1 mempunyai nilai yang sangat tinggi dibandingkan pengambilan sampel pada ulangan ke 2 dan ke 3 dan mengalami peningkatan kandungan logam Pb dalam makrozoobentos pada ulangan ke 3 di stasiun 1, 2, dan 5. Hal ini menandakan bahwa pada stasiun tersebut menunjukkan tingginya akumulasi logam Pb oleh makrozoobentos.
Kandungan logam Pb dalam makrozoobentos pada ulangan ke 2 dan 3 di kelima stasiun pengamatan mengalami penurunan yang sangat signifikan dibandingkan pengambilan sampel pada ulangan ke 1, hal tersebut diduga terjadinya proses pengenceran sebagai dampak dari naiknya debit air sungai dan waduk pada musim penghujan. Untuk lebih jelasnya data (debit air) total air masuk di perairan Waduk Cirata selama penelitian dapat lihat pada Lampiran 2.
Di samping itu, dampak naiknya debit air sungai dan waduk pada musim penghujan, yaitu:
1. Mempengaruhi tempat atau stasiun pengambilan sampel yang telah ditentukan dan pada pengambilan sampel ke 2 titik stasiun telah berubah mengarah ke pinggir waduk atau muara sungai. Hal tersebut dilakukan karena naiknya debit air sungai atau waduk, sehingga mempengaruhi keberadaan makrozoobentos yang ditemukan pada pengambilan pertama.
2. Titik atau stasiun pengambilan sampel ke 2 dan 3 kemungkinan baru terendam air dan jenis makrozoobentos yang terdapat juga baru, sehingga mempengaruhi kandungan logam berat yang terdapat dalam sedimen dan makrozoobentos.
Dengan berubahnya titik atau stasiun pengambilan sampel, maka akan mempengaruhi keberadaan makrozoobentos dan kandungan logam berat yang terdapat di makrozoobentos. Hal ini terbukti setelah dilakukan analisis kandungan logam berat di makrozoobentos antar ulangan mengalami penurunan yang tajam. Akumulasi biologis dapat terjadi melalui absorpsi langsung terhadap logam berat yang terdapat dalam air, sehingga organisme yang hidup pada perairan tercemar logam berat khususnya makrozoobentos, di dalam jaringan tubuhnya akan terakumulasi logam berat yang tinggi. Hal tersebut dipengaruhi oleh cara hidup makrozoobentos yang relatif pergerakannya sangat lambat dan cenderung menetap di dasar perairan.
Kecendrungan makrozoobentos untuk menyimpan atau mengakumulasi jenis logam berat khususnya Pb dapat berlangsung dalam jangka waktu yang lama yakni bisa berlangsung selama hidupnya. Hal ini juga dipengaruhi oleh proses fisiologis dalam tubuh makrozoobentos. Pada proses metabolisme tubuhnya akan mengolah atau mentransformasi setiap bahan racun (logam berat) yang masuk, sehingga akan mempengaruhi daya racun atau toksisitas bahan tersebut. Jenis logam berat yang mengalami biotransformasi dan tidak dapat diekresikan oleh tubuh umumnya akan tersimpan dalam organ-organ tertentu seperti ginjal, hepatopankreas dan organ-organ lainnya.
Logam berat di perairan dapat menyebar secara horizontal dan vertikal, sehingga terdistribusi dalam badan air dan sebagian akan di serap oleh biota air.
Setiap biota air mempunyai kemanpuan menyerap logam berat yang berbeda-beda. Pada umumnya logam berat yang terdapat dalam biota air melalui absorpsi, rantai makanan, dan insang, tergantung dari jenis biotanya. Umumnya bentos mengambil logam berat melalui makanan yang terakumulasi logam. Makanannya tersebut dihancurkan dalam usus, kemudian diserap oleh darah.
Keberadaan jenis logam-logam lain dalam kolom perairan dapat menyebabkan logam-logam tersebut menjadi sinergis dan antagonis. Logam berat bersifat antagonis, apabila terjadi persenyawaan dengan pasangannya maka daya racun yang ada pada logam tersebut akan berkurang atau semakin kecil, sedangkan bersifat sinergis, apabila bertemu pasanganya dan membentuk suatu persenyawaan dapat berubah fungsi menjadi racun yang sangat berbahaya atau daya racunya berlipat ganda. Hasil penelitian oleh Ahsanullah et al, (1981 dalam Darmono 2001) bahwa pada udang laut yang dipelihara dengan memberikan logam tembaga (Cu), Seng (Zn), dan Kadmium (Cd) dalam air menyebutkan, antara lain: apabila logam Cd dan Zn dicampur, ternyata akumulasi kedua logam tersebut terus meningkat, apabila Zn dicampur dengan Cu maka akumulasi Cu terhambat dan Zn tetap meningkat, apabila Cd dicampur dengan Cu maka Cu akumulasi terhambat dan Cd terus meningkat. Apabila ketiga logam tersebut (Cd, Cu, dan Zn) dicampur, ternyata akumulasi Cd dalam jaringan tetap tidak terpengaruh dan terus meningkat, dan akumulasi Cu dan Zn hampir seimbang.
Menurut Darmono (1995), faktor konsentrasi logam tergantung pada ukuran organisme. Selanjutnya dikatakan bahwa larva kerang dalam masa perkembangan dan pertumbuhan untuk menjadi dewasa akan menjadi terhambat karena pengaruh toksisistas logam dalam konsentrasi subletal (kronis). Stadium larva (fase pelagik) dari jenis kerang (bivalva, moluska, dan oister) biasanya peka terhadap pengaruh pencemaran logam dari pada masa dewasa. Jenis kerang dapat mengakumulasi logam berat sebagaimana hewan air lainnya (ikan dan udang). Derajat akumulasi logam berat pada jenis kerang lebih besar dari hewan lainnya, karena sifatnya yang menetap, lambat untuk dapat menghindari diri dari pengaruh pencemaran, dan mempunyai toleransi yang tinggi terhadap konsentrasi logam tertentu (Darmono, 2001).
Sebagai perbandingan hasil penelitian Triastutiningrum dan Oginawati (2005), menyebutkan bahwa tingkat akumulasi atau peningkatan jumlah logam di dalam tubuh ikan lebih rendah dari pada peningkatan berat badan ikan, sehingga konsentrasi logam di dalam tubuh ikan mengalami kecenderungan menurun. Hal ini dapat disebabkan karena adanya mekanisme di dalam tubuh ikan untuk mengekskresikan sebagian logam berat yang berasal dari pakan yang dimakan, terutama melalui feces.
Selanjutnya menurut Clearwater (2002) dalam Triastutiningrum dan Oginawati (2005), oleh karena uptake dan ekskresi terjadi secara terus menerus di dalam tubuh ikan, berbagai mekanisme depurasi untuk mengekskresikan logam menjadi sangat penting dalam menentukan keseluruhan jumlah logam yang tertahan di dalam tubuh ikan. Salah satu mekanisme ekskresi primer yang terjadi seiring dengan akumulasi logam pada sel-sel usus adalah dimana logam-logam tersebut secara periodik mengelupas menuju ke usus bagian lumen kemudian mengikuti perputaran proses normal yang terjadi, jaringan ini kemudian mengekskresikan melalui feces. Usus dapat secara aktif mengekskresikan logam seperti kadmium (Cd), Merkuri (Hg), dan Timah hitam (Pb) dari selaput lendir.
Hasil pengamatan di lapangan mengenai keberadaan makrozoobentos di perairan Waduk Cirata, ternyata makrozoobentos baru ditemukan pada ke dalaman kurang 10 meter. Kedalaman air mempengaruhi kelimpahan dan distribusi makrozoobentos. Dasar perairan yang kedalaman airnya berbeda akan dihuni oleh makrozoobentos yang berbeda pula, sehingga terjadi stratifikasi komunitas menurut kedalaman. Pada perairan yang lebih dalam makrozoobentos mendapat tekanan fisiologis dan hidrostatis yang lebih besar. Karena itu makrozoobentos yang hidup di perairan yang dalam ini tidak banyak (Ardi, 2002).
Untuk lebih jelasnya, hasil pengukuran kandungan logam Pb dalam air, sedimen, dan makrozoobentos menurut stasiun dan ulangan di perairan Waduk Cirata dapat dilihat pada Lampiran 3.
4.1.8.2. Zeng (Zn)
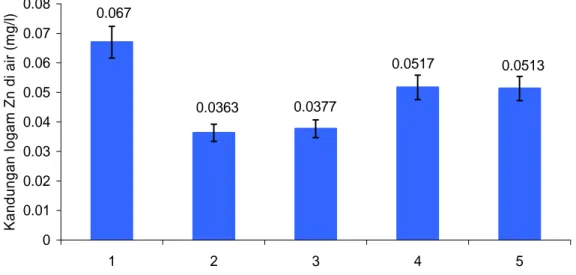
Berdasarkan hasil analisis di laboratorium, rata-rata kandungan logam Zn dalam air menurut stasiun pengamatan berkisar antara 0,0363 - 0,067 mg/l
0.0513 0.0517 0.0377 0.067 0.0363 0 0.01 0.02 0.03 0.04 0.05 0.06 0.07 0.08 1 2 3 4 5 Stasiun pengamatan Kan dun ga n l og am Zn d i ai r ( m g/ l) 0 0.02 0.04 0.06 0.08 0.1 0.12 K andu ngan l ogam Z n dal am ai r ( m g/ l) Stasiun pengamatan Ulangan ke 1 0.028 0.028 0.021 0.027 0.025 Ulangan ke 2 0.101 0.013 0.03 0.07 0.069 Ulangan ke 3 0.072 0.068 0.0062 0.058 0.06 1 2 3 4 5
(Gambar 15), sedangkan menurut ulangan berkisar antara 0,03 - 0,06 mg/l (Gambar 16).
Gambar 15 Rata-rata kandungan logam Zn pada air di setiap stasiun pengamatan Gambar 15 menunjukkan bahwa rata-rata kandungan logam Zn yang terdapat dalam air di setiap stasiun pengamatan bervariasi, dimana stasiun 1 mempunyai rata-rata yang tertinggi sekitar 0,067 mg/l dan terendah di stasiun 2 sekitar 0,0363 mg/l. Sedangkan kandungan logam Zn menurut ulangan dapat dilihat pada Gambar 16.
0 20 40 60 80 100 120 Stasiun pengamatan R at a-rat a k an dun gan l o ga m Z n ( m g/ k g) sedimen 86.67 91 77.67 111 73.34 makrozoobentos 12.56 11.79 13.83 13.14 17.85 1 2 3 4 5
Gambar 16 menunjukkan bahwa kandungan logam Zn menurut ulangan mempunyai nilai yang bervariasi, dimana pengambilan sampel pada ulangan 2 mengalami peningkatan dibanding ulangan 1 dan 3 di setiap stasiun pengamatan kecuali stasiun 2 pada ulangan ke 2 mengalami penurunan, selanjutnya mengalami peningkatan lagi pada ulangan ke 3 di setiap stasiun pengamatan kecuali stasiun 3 pada ulangan ke 3 kandungan logam Zn dalam air mengalami penurunan.
Kandungan logam Zn dalam air yang di peroleh sudah melewati Ambang Baku Mutu air berdasarkan kriteria kelas 2 dan 3 untuk kegiatan pembudidayaan ikan air tawar (PP. No. 82 Tahun 2001).
Sedangkan rata-rata kandungan logam Zn dalam sedimen dan makrozoobentos masingmasing berkisar antara 73,34 111 mg/kg dan 11,79 -17,85 (Gambar 17) dan menurut ulangan pengamatan berkisar antara 76,2 - 99 mg/kg dan 2,4 - 35,818 mg/kg.
Gambar 17 Rata-rata kandungan logam Zn dalam sedimen dan Makrozoobentos di setiap stasiun pengamatan
Gambar 17 menunjukkan bahwa nilai kandungan logam Zn dalam sedimen dan makrozoobentos mempunyai nilai yang bervariasi, dimana rata-rata kandungan logam Zn dalam sedimen tertinggi di stasiun 4 sekitar 111 mg/kg) dan terendah di stasiun 5 sekitar 73,34 mg/kg. Tingginya kandungan logam Zn di stasiun 4 (muara Sungai Cisokan) disebabkan karena meningkatnya konstribusi kegiatan manusia seperti permukiman (domestik), industri, pertanian, dan
0 50 100 150 Stasiun pengamatan Ka ndun gan l og am Z n d i Se di me n ( mg/ kg ) Ulangan ke 1 106 107 89 107 86 Ulangan ke 2 74 75 74 103 55 Ulangan ke 3 80 91 70 123 79 1 2 3 4 5 0 10 20 30 40 50 Stasiun Pengamatan K a n dungan l ogam Zn di M akr ozoob ent o s ( m g /kg) Ulangan ke1 35.02 30.01 35.71 34.36 44 Ulangan ke 2 1 4 4.2 2.1 5 Ulangan ke 3 1.66 1.35 1.58 2.96 4.55 1 2 3 4 5
transfortasi (perahu) yang mulai padat di Sungai Cisokan yang membawa bibit, pakan, dan hasil panen ikan di Waduk Cirata. Sedangkan kandungan logam Zn dalam makrozoobentos tertinggi di stasiun 5 sekitar 17,85 mg/kg dan terendah di stasiun 2 sekitar 11,79 mg/kg. Dari Gambar 17 juga menunjukkan bahwa kandungan logam Zn dalam makrozoobentos lebih kecil dibandingkan dalam sedimen.
Sedangkan kandungan logam Zn dalam sedimen dan makrozoobentos menurut ulangan pengamatan dapat dilihat pada Gambar 18 dan 19.
Gambar 18 Kandungan logam Zn di sedimen menurut ulangan pengamatan
Gambar 19 Kandungan logam Zn dalam makrozoobentos menurut ulangan pengamatan
Gambar 18 menunjukkan bahwa kandungan logam Zn dalam sedimen mempunyai nilai yang bervariasi, dimana pada ulangan ke 2 mengalami penurunan dibanding ulangan ke 1 di setiap stasiun pengamatan dan mengalami peningkatan pada ulangan ke 3 kecuali stasiun 3 pada ulangan ke 3 kandungan logam Zn mengalami penurunan. Kadar normal logam Zn dalam sedimen yang tidak terkontaminasi berkisar antara 20 - 150 ppm (Thayib dan Razak, 1981 dalam Edwar dkk, 2005). Sedangkan Nilai Ambang Batas Zn dalam sedimen adalah <120 ppm (Gray, 1996 dalam Edwar dkk, 2005). Dengan demikian kandungan Zn dalam sedimen yang diperoleh di Waduk Cirata masih rendah (belum tercemar), apabila dibandingkan dengan Nilai Ambang Batas kadar Zn yang dikemukakan oleh Gray.
Sedangkan Gambar 19 menunjukkan bahwa terjadi penurunan kandungan logam Zn dalam makrozoobentos secara nyata pada ulangan 2 dan 3 dibanding pada ulangan ke 1, hal tersebut menunjukkan terjadinya penurunan penyerapan atau pengambilan logam Zn oleh makrozoobentos akibat meningkatnya debit air sungai dan waduk pada musim penghujan (terjadi pengenceran) dan sebaliknya pada musim kemarau terjadi peningkatan penyerapan Zn oleh makrozoobentos sebagai akibat meningkatnya metabolisme pada musim kemarau, sebagaimana diperlihatkan pada ulangan 1 di setiap stasiun pengamatan.
Untuk lebih jelasnya, hasil pengukuran kandungan logam Zn dalam air, sedimen, dan makrozoobentos menurut stasiun dan ulangan di perairan Waduk Cirata dapat dilihat pada Lampiran 4.
4.2. Kondisi Perairan Secara Biologi
Hewan bentos hidup relatif menetap, sehingga baik digunakan sebagai petunjuk kualitas lingkungan, karena selalu kontak dengan limbah yang masuk ke habitatnya. Kelompok hewan tersebut dapat lebih mencerminkan adanya perubahan faktor-faktor lingkungan dari waktu ke waktu, karena hewan bentos terus menerus terdedah oleh air yang kualitasnya berubah-ubah (Oey et a1, 1978). Di antara hewan bentos yang relatif mudah diidentifikasi dan peka terhadap perubahan lingkungan perairan adalah jenis-jenis yang termasuk dalam
kelompok invertebrata makro. Kelompok ini lebih dikenal dengan makrozoobentos (Rosenberg dan Resh, 1993 dalam Ardi, 2002).
Makrozoobentos mempunyai peranan yang sangat penting dalam siklus nutrien di dasar perairan. Montagna et al, (1989) dalam Ardi (2002), menyatakan bahwa dalam ekosistem perairan, makrozoobentos berperan sebagai salah satu mata rantai penghubung dalam aliran energi dan siklus dari alga planktonik sampai konsumen tingkat tinggi. Makrozoobentos membantu mempercepat proses dekomposisi materi organik. Hewan bentos, terutama yang bersifat herbivor dan detritivor, dapat menghancurkan makrofit akuatik yang hidup maupun yang mati dan serasah yang masuk ke dalam perairan menjadi potongan-potongan yang lebih kecil, sehingga mempermudah mikroba untuk menguraikannya menjadi nutrien bagi produsen perairan.
Struktur komunitas makrozoobentos dipengaruhi berbagai faktor lingkungan abiotik dan biotik. Secara abiotik, faktor lingkungan yang mempengaruhi keberadaan makrozoobentos adalah faktor fisika-kimia lingkungan perairan, diantaranya: penetrasi cahaya yang berpengaruh terhadap suhu air, substrat dasar, kandungan unsur kimia seperti oksigen terlarut dan kandungan ion hidrogen (pH), dan nutrien. Sedangkan secara biologis, diantaranya interaksi spesies serta pola siklus hidup dari masing-masing spesies dalam komunitas.
Perubahan struktur komunitas sebagai akibat perubahan yang terjadi dalam kualitas lingkungan perairan karena berlangsungnya pencemaran. Model yang umum digunakan untuk mengetahui adanya perubahan struktur komunitas makrozoobentos adalah dengan menggunakan indeks keanekaragaman jenis, keseragaman populasi, dan dominansi jenis.
Dari hasil identifikasi jenis makrozoobentos telah diperoleh data tentang komposisi relatif dan kelimpahan, indeks keanekaragaman (H|), keseragaman jenis (E), dan dominansi jenis (C) di perairan Waduk Cirata.
4.2.1. Komposisi Relatif dan Kepadatan Makrozoobentos
Jenis makrozoobentos yang ditemukan di lima stasiun pengamatan adalah sebanyak 21 spesies yang termasuk dalam 7 kelas dengan perincian yaitu:
masing-Gastropoda 38% Diptera 14% Odonata 14% Oligochaeta 14% Pelecypoda 10% Coleoptera 5% Lepidoptera 5%
masing 3 spesies, Pelecypoda 2 spesies, serta Coleoptera dan Lepidoptera masing-masing 1 spesies.
Komposisi relatif dari masing-masing kelas makrozoobentos yang ditemukan di perairan Waduk Cirata adalah kelas Gastropoda (38 %), kelas
Oligochaeta, Diptera dan Odonata masing-masing (14 %), kelas Pelecypoda (10
%), dan kelas Coleoptera dan Lepidoptera (5 %). Untuk lebih jelasnya, komposisi makrozoobentos yang terdapat di Waduk Cirata dapat dilihat pada Gambar 20.
Gambar 20 Komposisi relatif kelas makrozoobentos di perairan Waduk Cirata Berdasarkan Gambar 20, terlihat bahwa komposisi makrozoobentos terbanyak yang terdapat di Waduk Cirata, yaitu: kelas Gastropoda terutama dari jenis Melanoides sp, Bellaminya sp, Pomacea sp, dan Anentome sp, sedangkan kelas makrozoobentos yang mempunyai komposis yang sedikit adalah kelas Coleoptera dan Lepidoptera. Sedangkan hasil identifikasi makrozoobentos pada setiap stasiun pengamatan diperoleh rata-rata kepadatan berkisar antara 65,4 - 325,4 (individu/m2) (Gambar 21), sedangkan kepadatan makrozoobentos berdasarkan ulangan yang terdapat di Waduk Cirata terbanyak di ulangan ke 3 stasiun 1 dan terkecil ulangan 2 stasiun 3 (Gambar 22).
0 200 400 600 800 1000 Stasiun Pengamatan K epadat a n M ak roz oob ent os ( indi v /m 2 ) Ulangan ke 1 121 86 60 59 55 Ulangan ke 2 37 57 30 90 65 Ulangan ke 3 818 93 118 179 76 1 2 3 4 5 65.4 109.4 69.4 78.7 325.4 0 50 100 150 200 250 300 350 1 2 3 4 5 Stasiun Pengamatan Ra ta-rat a kep adat an makroz oobe nt os (indi vi du/ m2)
Gambar 21 Rata-rata kepadatan makrozoobentos pada setiap stasiun pengamatan
Gambar 22 Kepadatan makrozoobentos menurut ulangan pengamatan
Dari hasil identifikasi komposisi jenis makrozoobentos yang terdapat di Waduk Cirata ternyata yang terbanyak adalah jenis Melanoides sp dari kelas gastropoda. Melanoides sp merupakan organisme yang distribusinya relatif luas dan mudah beradaptasi dengan kondisi lingkungan habitatnya dan bahkan manpu hidup di perairan terpolusi. Apabila dilihat dari kepekaannya terhadap pencemaran, maka Melanoides sp merupakan organisme fakultatif (dapat bertahan hidup pada lingkungan yang relatif mengandung bahan organik).
Gambar 21 menunjukkan bahwa ternyata nilai rata-rata kepadatan di kelima stasiun tersebut sangat bervariasi dan nilai rata-rata kepadatan yang
tertinggi terdapat di stasiun 1 (325,4 individu/m2) dan terendah di stasiun 5 (65,4 individu/m2). Jenis makrozoobentos yang mempunyai kepadatan terbanyak adalah dari kelas Gastropoda. Tingginya kepadatan atau banyaknya jenis makrozoobentos dari kelas Gastropoda yang mendominasi stasiun pengamatan tersebut dibandingkan dengan kelas makrozoobentos yang lainnya berhubungan erat dengan sifat dari kebanyakan organisme dari kelas Gastrpoda yang menyukai tempat yang berlumpur dan pasir dengan kandungan bahan organik yang tinggi. Menurut Pennak (1978) bahwa kebanyakan spesies dari gastropoda menyukai perairan dengan substrat pasir atau lumpur dengan kedalaman yang relatif dangkal.
Hasil penelitian yang dilakukan oleh Lismana (2006) menyebutkan bahwa secara keseluruhan klasifikasi butiran sedimen di Waduk Cirata, khususnya pada stasiun 1 (Depan DAM dan outlet) di Waduk Cirata adalah berpasir sedang, sehingga sesuai dengan substrat kebanyakan jenis makrozoobentos dari kelas gastropoda. Jenis gastropoda yang mendominasi stasiun 1 adalah Melanoides sp,
Belamnya sp, Pomacea sp, dan Anentome sp. Untuk lebih jelasnya jumlah jenis
makrozoobentos dari kelas Gastropda dapat dilhat pada Lampiran 5.
Melanoides sp merupakan spesies yang ditemukan hampir di setiap stasiun
dan mempunyai kemampuan hidup pada substrat berpasir dan lumpur. Menurut Jutting (1956) Melanoides sp merupakan organisme yang penyebarannya relatif luas dan mudah beradaptasi dengan kondisi lingkungan habitatnya, bahkan mampu hidup di perairan yang terpolusi.
Gambar 22 menunjukkan bahwa kepadatan makrozoobentos pada setiap ulangan pengamatan terbanyak di stasiun 1 ulangan ke 3 yang nilainya sangat bervariasi dibandingkan dengan ulangan 1 dan 2 sedangkan rata-rata kepadatan berkisar antara 55,8- 256,8 indiv/m2. Dari Gambar tersebut juga menunjukkan bahwa pengambilan sampel pada ulangan ke 3 di kelima stasiun pengamatan mempunyai nilai yang tinggi dibanding dengan ulangan 1 dan 2. Selanjutnya menunjukkan bahwa pada ulangan 2 di stasiun 1 dan 3 kepadatan makrozoobentos mulai menurun tetapi meningkat lagi di ulangan 3, sedangkan stasiun 2, 4, dan 5 kepadatannya meningkat dari ulangan 1 sampai 3.
Pada waktu pengambilan sampel ulangan ke 3 debit air sungai dan waduk sudah tinggi (masuk musim penghujan). Hasil pengamatan dilapangan pada waktu pengambilan sampel ke 3 stasiun 1, makrozoobentos dari jenis gastropoda menempel dipinggir bendungan, pintu keluar air waduk menuju turbin, dan pintu pembuangan air Waduk Cirata, padahal pengambilan sampel sebelumnya (pengamatan 1 dan 2) tidak ditemukan jenis makrozoobentos tersebut menempel. Hal tersebut terjadi karena pada waktu pengambilan sampel turun hujan, sehingga kemungkinan dipengaruhi oleh parameter kualitas air, terutama suhu, cahaya matahari, pH air, dan pH sedimen. Jika pH air dan pH sedimen rendah maka jenis Gastropoda akan bergerak menghindar ke tempat lain dan juga berpengaruh terhadap kelarutan oksigen di air dan sedimen.
4.2.2. Indeks Keanekaragaman (H|) dan Keseragaman Jenis (E)
Keanekaragaman jenis disebut juga keheterogenan jenis, merupakan ciri yang unik untuk menggambarkan struktur komunitas di dalam organisasi kehidupan. Suatu komunitas dikatakan mempunyai keanekaragaman jenis tinggi, jika kelimpahan masing-masing jenis tinggi dan sebaliknya keanekaragaman jenis rendah jika hanya terdapat beberapa jenis yang melimpah. Indeks keanekaragaman jenis (H|) menggambarkan keadaan populasi organisme secara matematis, untuk mempermudah dalam menganalisa informasi-informasi jumlah individu masing-masing jenis dalam suatu komunitas. Di antara indeks keanekaragaman jenis adalah indeks keanekaragaman Shannon - Wiener.
Indeks keanekaragaman dan keseragaman jenis makrozoobentos sering digunakan untuk menduga kondisi suatu lingkungan perairan. Dengan melihat besarnya nilai ke dua indeks ini dapat diduga tingkat kestabilan suatu lingkungan perairan. Apabila nilai kedua indeks ini tinggi, maka dapat dikatakan bahwa lingkungan perairan tersebut masih baik.
Berdasarkan hasil perhitungan indeks keanekaragaman pada setiap stasiun pengamatan di Waduk Cirata diperoleh nilai rata-rata berkisar antara 1,18 – 1,83 (Gambar 23). Nilai indeks keanekaragaman yang tinggi terdapat di stasiun 3 dan terendah di stasiun 5. Sedangkan hasil perhitungan keseragaman jenis diperoleh nilai rata-rata berkisar antara 0,527 – 0,683 dan stasiun yang mempunyai rata-rata
1.18 1.593 1.83 1.583 1.813 0 0.2 0.4 0.6 0.8 1 1.2 1.4 1.6 1.8 2 1 2 3 4 5 Stasiun Pengamatan In deks Keane karaga m a n Mak ro z oob ent os (H' ) 0.533 0.597 0.583 0.527 0.683 0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 1 2 3 4 5 Stasiun Pengamatan Ra ta -rat a I ndek s Kes e ragaman Makroz oobe nt os (E)
keseragaman tinggi, yaitu 2 (0.683) serta yang terendah terdapat di stasiun 1 (0.527) (Gambar 24).
Gambar 23 Rata-rata indeks keanekaragaman jenis di setiap stasiun pengamatan
Gambar 24 Rata-rata indeks keseragaman makrozoobentos pada setiap stasiun pengamatan
Gambar 23 menunjukkan bahwa rata-rata nilai keanekaragaman yang diperoleh di kelima stasiun pengamatan bervariasi dan nilai indeks keanekaragaman di setiap stasiun pengamatan rendah. Dari Gambar tersebut juga terlihat bahwa stasiun 2 dan 3 rata-rata indeks keanekaragamannya hampir sama, yaitu sekitar 1,813 dan 1,83 serta stasiun 1 dan 4 (1,583 dan 1,593). Tingginya nilai keanekargaman di stasiun 3 (1,83) menandakan bahwa makrozoobentos yang
ditemukan di stasiun tersebut mempunyai keheterogenan yang tinggi dan sebaliknya di stasiun 5 (1,18) mempunyai keheterogenan rendah, tetapi secara keseluruhan nilai indeks keanekaragaman yang diperoleh di Waduk Cirata selama pengamatan termasuk kisaran H| < 3,32 (1.83 <H| < 3,32), artinya keanekaragaman
makrozoobentos yang diperoleh rendah, penyebaran setiap spesies rendah dan stabilitas komunitas rendah.
Berdasarkan nilai indeks keanekaragaman jenis makrozoobentos yang dihitung berdasarkan formulasi Shannon-Wiener, dapat ditentukan beberapa kualitas air. Wilhm (1975) menyatakan bahwa air yang tercemar berat, indeks keragaman jenis makrozoobentosnya kecil dari satu. Jika berkisar antara satu dan tiga, maka air tersebut setengah tercemar. Air bersih, indeks keragaman makrozoobentosnya besar dari tiga. Staub et al dalam Wilhm (1975) menyatakan bahwa berdasarkan indeks keanekaragaman makrozoobentos, kualitas air dapat dikelompokkan atas: tercemar berat (0 < H| <1), tercemar sedang (1 < H| <2),
tercemar ringan (2 < H| <3) dan tercemar sangat ringan (3 <H| < 4,5). Kisaran
nilai H| tersebut merupakan bagian dari penilaian kualitas air yang dilakukan
secara terpadu dengan faktor fisika kimia air. Sedangkan Lee et al. (1978) menyatakan bahwa nilai indeks keanekaragaman (H) pada perairan tercemar berat (H| < 1), tercemar sedang (1,0 - 1,5), tercemar ringan (1,6 - 2,0), dan tidak
tercemar (H| > 2,0).
Dari hasil indeks keanekaragaman (H|) makrozoobentos dan penilaian kualitas air yang di peroleh tersebut, dapat dikatakan bahwa perairan Waduk Cirata sudah mengalami tekanan ekologis dan penurunan kualitas perairan, dimana nilai indeks keanekaragamannya rendah. Jadi perairan ini sudah tidak stabil. Tidak stabilnya komunitas makrozoobentos di perairan tersebut, juga ditunjukkan oleh nilai indeks keseragaman jenis (E) yang rendah yaitu berkisar antara 0,527 - 0,683 (Gambar 24). Sebaran nilai indeks keseragaman jenis rata-rata tidak menunjukkan variasi yang besar antara stasiun.
Berdasarkan nilai indeks keanekaragaman dan keseragaman tersebut, maka kondisi perairan Waduk Cirata sudah mengalami tekanan ekologis, hal ini diakibatkan karena adanya aktivitas manusia baik di sekitar waduk maupun sungai sebagai inlet air Waduk Cirata. Aktivitas manusia seperti industri, permukiman,
0.58 0.367 0.467 0.363 0.483 0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 1 2 3 4 5 Stasiun Pengamatan Rat a -r at a I n deks Dom inan s i M a kr ozoobe nt os (C)
perikanan, dan pertanian telah memberikan dampak yang berarti terhadap lingkungan perairan Waduk Cirata. Dengan rendahnya indeks keanekaragaman dan keseragaman makrozoobentos tersebut, berarti pula sudah ada spesies tertentu yang mendominasi komunitas makrozoobentos yang terdapat di perairan Waduk Cirata.
Di samping itu, butiran atau kandungan sedimen dapat berhubungan dengan keanekaragaman jenis makrozoobentos. Menurut Marsambuana dan Gunarto (2004), bahwa kandungan pasir (80 %), liat (2 %), dan debu (18 %) dengan bahan organik 17,1 % memperlihatkan hubungan yang cenderung lebih kuat dengan keanekaragaman jenis (keanekaragamannya tinggi) dibandingkan dengan dominansi makrozoobentos.
4.2.3. Dominansi Jenis (C)
Nilai indeks dominansi yang tinggi menandakan ada spesies tertentu yang mendominasi komunitas makrozoobentos, sebaliknya nilai dominansi yang rendah menunjukkan tidak terjadinya dominansi oleh spesies tertentu. Nilai indeks dominan (C) mempunyai kisaran antara 0 - 1. Semakin mendekati nilai 1, berarti semakin tinggi tingkat dominansi oleh spesies tertentu. Berdasarkan hasil perhitungan nilai indeks dominansi makrozoobentos di kelima stasiun, maka diperoleh rata-rata berkisar antara 0,363 – 0,58 (Gambar 25).
Gambar 25 Rata-rata indeks dominansi makrozoobentos pada setiap stasiun pengamatan
Gambar 25 menunjukkan bahwa nilai diminansi di kelima stasiun pengamatan berfluktuasi, sedangkan nilai dominansi yang tinggi terdapat di stasiun 5 (0,58) dan terendah di stasiun 2 (0,363). Tingginya indeks dominansi yang terdapat di stasiun 5, diduga dipengaruhi oleh aktivitas manusia yang dominan, seperti industri dan permukiman yang terdapat di sekitar Sungai Citarum dan limbah dari Waduk Saguling serta masuknya air lindih dari tempat pembuangan sampah (TPS) pada waktu musim penghujan. Sedangkan rendahnya nilai dominansi di stasiun 2 menggambarkan bahwa konstribusi aktivitas manusia seperti pertanian, permukiman, dan industri di stasiun tersebut tidak mempengaruhi komposisi makrozoobentos.
Nilai rata-rata dominansi makrozoobentos yang diperoleh pada setiap stasiun pengamatan, terlihat bahwa di perairan Waduk Cirata terdapat dominansi spesies tertentu. Hal ini juga menunjukkan bahwa kondisi perairan tersebut tidak stabil, yaitu adanya tekanan ekologis akibat bahan-bahan pencemar yang masuk ke perairan Waduk Cirata. Hal yang lain juga dilihat dari nilai indeks keanekaragaman (H|) dan keseragaman (E) yang rendah.
Pada perairan yang tercemar, hanya organisme tertentu yang dapat bertahan hidup, sementara jenis yang lainnya tidak mampu bertahan (mati), sehingga perkembangan populasi organisme yang hidup sangat tinggi. Hal ini disebabkan oleh tidak adanya saingan, baik untuk mendapatkan makanan maupun memanfaatkan ruang oleh jenis lain. Oleh karena itu jenis tersebut akan mendominasi makrozoobentos di perairan Waduk Cirata.
Untuk lebih jelasnya hasil identifikasi jenis makrozoobentos yang diperoleh di perairan Waduk Cirata dapat dilihat pada Lampiran 6.
4.3. Keterkaitan Antara Parameter
4.3.1. Hubungan Kandungan Logam Pb dan Zn Dalam Air Dengan Sedimen Untuk mengetahui keterkaitan antara kandungan logam berat Pb dan Zn dalam air dengan kandungan logam berat di sedimen, maka dilakukan uji korelasi dan regresi. Berdasarkan hasil uji korelasi antara kandungan logam Pb dan Zn dalam air dengan konsentrasi logam berat dalam sedimen memperlihatkan adanya korelasi positif dan negatif antara kandungan logam berat yang diamati. Korelasi
antara kandungan logam Pb dalam air dengan sedimen pada setiap stasiun pengamatan mempunyai hubungan berkisar antara 19,0 % - 1,000 dan korelasi kandungan logam Zn mempunyai hubungan berkisar antara -97,4 % - 33,4 %
Untuk lebih jelasnya hasil korelasi dan regresi antara kandungan logam Pb di air dengan sedimen berdasarkan stasiun pengamatan dapat dilihat pada Tabel 7. Tabel 7 Hasil analisis korelasi dan regresi antara logam Pb dan Zn dalam air (x)
dengan sedimen (y)
Stasiun Logam Regresi R2 Korelasi
1 y = -369.9x + 31.724 0.036 -0,190 2 y = -1820x + 51.9 0.3506 -0,592 3 Timbal (Pb) y = -2945x + 77.45 0.9999 -1,000** 4 y = -460.07x + 48.74 0.156 -0,395 5 y = -329.11x + 27.444 0.0551 -0,235 1 y = -450.78x + 116.87 0.9488 -0,974 2 y = 148.45x + 85.606 0.696 0,264 3 Zeng (Zn) y = 278.6x + 72.355 0.1117 0,334 4 y = 28.436x + 109.53 0.0036 0,060 5 y = -562.92x + 102.23 0.6478 -0,805 Keterangan: **) nyata pada taraf kepercayaan 99 % (p< 0,01)
Tabel 7 menunjukkan bahwa hanya terdapat satu hubungan yang signifikan (p<0,01), yaitu antara kandungan logam berat Pb dalam air dengan kandungan logam Pb dalam sedimen (stasiun 3) yang mempunyai nilai korelasi -1,000 pada taraf kepercayaan 99 %, sedangkan hasil persamaan regresi yang diperoleh, yaitu: y = -2945x + 77,45 dan koefisien determinasinya tinggi, yaitu sebesar 99,9 %. Hubungan tersebut adalah regresi negatif yang berarti bahwa makin tinggi kandungan logam Pb dalam sedimen pada stasiun 3 maka makin rendah kandungan logam Pb dalam air.
Stasiun 3 (sub DAS Cibalagung) merupakan salah satu inlet air Waduk Cirata, dimana stasiun tersebut terdapat kegiatan atau aktivitas manusia yang sangat padat, seperti: bongkar muat barang yang mengangkut bibit atau hasil panen ikan dan pakan ikan yang menggunakan alat transfortasi, baik transfortasi darat maupun air, dimana alat transfortasi tersebut (mobil, perahu) menggunakan bahan bakar mobil. Hal tersebut kemungkinan besar salah satu sumber penyebab
terdapatnya logam berat khususnya Pb di perairan Waduk Cirata. Sumber lainnya yaitu: dari kegiatan domestik, industri, dan pertanian.
Sungai Cibalagung merupakan salah satu sub DAS yang membelah kabupaten Cianjur yang bermuara ke perairan Waduk Cirata, sehingga kemungkinan besar limbah yang dihasilkan dari kegiatan manusia, seperti limbah permukiman (perkotaan), industri dan pertanian (pesitisida) yang masuk atau dibuang ke sungai tersebut, baik dengan sengaja maupun terbawa aliran air pada waktu musim hujan akan menjadi sumber terdapatnya logam berat di sungai dan Waduk Cirata.
Pada dasarnya, kandungan logam dalam air mempengaruhi keberadaan logam yang ada dalam sedimen dan sebaliknya. Namun, karena logam mudah terlarut dalam air membentuk endapan, maka kandungan logam dalam sedimen menjadi lebih lebih tinggi (Benes et al, 1985 dalam Kusumahadi 1998). Keadaan ini terus berlangsung sesuai dengan kandungan logam yang ada di perairan, sehingga keseimbangan antara logam dalam air dengan sedimen agak sulit terjadi. Hal ini ditunjukkan dengan nilai korelasi negatif yang diperoleh di Waduk Cirata antara logam Pb dalam air dengan sedimen.
Limbah logam berat yang masuk ke badan air akan mengalami pengendapan, pengenceran, dispersi, dan selanjutnya di absorpsi oleh organisme-organisme yang hidup di perairan tersebut. Hal tersebut memberikan gambaran bahwa sebagian logam berat akan mengendap di dasar sebagai sedimen dan sebagian pula berada di badan air walaupun dalam jumlah yang relatif kecil. Logam berat seperti Pb di dalam perairan relatif lebih tahan lama karena sifatnya yang lebih stabil terutama yang terdapat dalam sedimen.
Proses pengendapan logam berat seperti Pb dan Zn di dasar perairan (sedimen) diakibatkan oleh sifat logam berat yang mudah berikatan dengan bahan-bahan organik terlarut. Di samping itu, logam berat yang terdapat di kolom air akan mengalami proses penggabungan dengan senyawa-senyawa lain, baik yang berupa bahan organik maupun bahan anorganik, sehingga berat jenisnya menjadi lebih besar yang akan mempengaruhi laju proses pengendapan atau sedimentasi.
Kandungan logam berat dalam air selalu berubah sedangkan logam berat dalam sedimen akan bertambah dari waktu ke waktu, di antaranya di pengaruhi oleh pH dan suhu. Sedimen dapat juga digunakan sebagai indikator pencemaran logam berat pada suatu perairan, karena partikel-partikel koloid banyak mengikat logam berat yang masuk ke badan air. Beberapa logam yang berikatan dengan sedimen dan partikel yang mengendap, kemudian kembali ke dalam air dan diikuti remobilisasi dan difusi ke atas (Bryan, 1976). Sedangkan Langston dan Bryan (1992) mengatakan bahwa kandungan logam dalam sedimen biasanya mencapai 3 - 5 kali lebih tinggi dari kandungan logam dalam air.
Togwel (1979) dalam Haeruddin (2006), mengatakan bahwa kandungan logam berat pada sedimen tidak saja ditentukan oleh proses pelapukan batuan, tetapi juga dipengaruhi oleh kandungan bahan organik sedimen, komposisi mineral, serta ukuran (partikel) endapan sedimen tersebut. Sedimen yang berukuran lebih halus (clay dengan diameter < 20 mikron) mampu menyerap bahan pencemar dalam jumlah yang lebih besar dibanding sedimen berukuran besar. Sedimen halus memiliki persentase bahan organik yang lebih tinggi dari pada sedimen besar, hal tersebut berkaitan dengan lingkungan tenang, sehingga memungkinkan pengendapan sedimen lempung dan lanau yang diikuti oleh akumulasi bahan organik ke dasar perairan (Wood, 1987).
Hasil analisis regresi hubungan kandungan logam Pb dan Zn dalam air dengan sedimen dapat dilihat pada Lampiran 7.
4.3.2. Hubungan Kandungan Logam Pb dan Zn Dalam Air Dengan Makrozoobentos.
Berdasarkan hasil uji korelasi antara kandungan logam Pb dan Zn dalam air dengan makrozoobentos, memperlihatkan adanya korelasi negatif serta nilai yang bervariasi. Hasil uji korelasi antara kandungan logam Pb dalam air dengan makrozoobentos mempunyai hubungan berkisar antara -12,7 %-1,000, sedangkan korelasi kandungan logam Zn berkisar antara -97,9 %-20,7 %. Dari Tabel 9 menunjukkan bahwa terdapat hubungan yang signifikan (p<0,05) antara kandungan logam berat Pb dalam air dengan kandungan logam berat Pb dalam makrozoobentos pada stasiun 3 dengan nilai koefisien korelasi (r) = -1,000,
sedangkan nilai koefisien korelasi lainnya tidak nyata pada selang kepercayaan 95%. Untuk lebih jelasnya hasil korelasi dan regresi antara kandungan logam Pb dan Zn dalam air dengan makrozoobentos berdasarkan stasiun pengamatan dapat dilihat pada Tabel 8.
Tabel 8 Hasil korelasi dan regresi antara kandungan logam Pb dan Zn dalam air (x) dengan makrozoobentos (y).
Stasiun Logam Regresi R2 Korelasi
1 y = -213.010 x + 11.928 0.059 -0,244 2 y = -6262x + 127.140 0.264 -0,514 3 Timbal (Pb) y = -8456x + 127.550 1.000 -1,000* 4 y = -10839.575x +203.651 0.543 -0,737 5 y = -972.52x + 61.397 0.0161 -0,127 1. y = -489.815x + 45.375 0.856 -0,925 2. y = -185.98x + 18.544 0.1115 -0,334 3. Seng (Zn) y = 327.64x + 7.5831 0.043 0,207 4. y = -802.61x + 54.608 0.9386 -0,969 5. y = -953.948x + 66.819 0.959 -0,979 Keterangan: *) nyata pada taraf kepercayaan 95 % (p< 0,05)
Hasil uji korelasi kandungan logam Pb dan Zn dalam air dengan kandungan logam Pb dan Zn dalam makrozoobentos diperoleh bahwa hanya logam Pb yang berpengaruh secara nyata (p<0,05) dengan selang kepercayaan 95 % yang mempunyai nilai korelasi sebesar (r) -1,000 (nilai signifikansi 0.01) yang terdapat di stasiun 3, sedangkan stasiun yang lainnya tidak nyata dengan nilai masing-masing -0,244 (ST. 1), -0,514 (ST. 2), -0,737 (ST. 4), dan -0,127 (ST. 5). Selanjutnya hasil analisis regresi diperoleh persamaan, yaitu: y = -8456x + 127,550 dengan koefisien determinasinya (R2) yang tinggi sebesar 1,000.
Hubungan tersebut adalah regresi negatif yang berarti bahwa makin tinggi kandungan logam Pb dalam makrozoobentos pada stasiun 3 maka makin rendah kandungan logam berat Pb dalam air.
Sedangkan korelasi kandungan logam berat Zn dalam air dengan makrozoobentos tidak berpengaruh secara nyata, padahal nilai koefisien korelasi yang diperoleh juga besar sebagaimana yang terdapat di stasiun 1, 4, dan 5, yaitu: masing-masing -0,925, -0,969, dan -0,979. Hal ini kemungkinan erat kaitannya karena logam Zn termasuk logam esensial yang dibutuhkan oleh organisme dalam proses metabolisme, sehingga pada konsentrasi tertentu tidak berbahaya bagi
organisme tertentu. Sedangkan logam Pb termasuk logam yang tidak dibutuhkan oleh organisme dalam proses metabolisme walaupun dalam jumlah yang sangat sedikit.
Logam berat seperti Pb berasal dari alam secara alamiah, industri, kegiatan manusia, dan juga berasal dari udara yang turun pada saat musim hujan dan masuk ke dalam perairan melalui aliran sungai sehingga kandungan logam berat dalam perairan meningkat dan dalam waktu tertentu organisme air dapat mengakumulasi logam berat terutama pada bagian organ. Akumulasi biologis dapat terjadi melalui absorpsi langsung terhadap logam berat yang terdapat dalam air dan melalui rantai makanan. Akumulasi terjadi karena kecendrungan logam berat untuk membentuk senyawa kompleks dengan zat-zat organik yang terdapat dalam tubuh organisme (Sanusi dkk, 1985). Hal ini akan mengakibatkan kandungan logam berat dalam tubuh organisme lebih tinggi di bandingkan dengan logam berat dalam lingkungan. Dengan terjadinya akumulasi biologis, maka organisme yang hidup di perairan yang mempunyai kadar logam berat yang tinggi (tercemar) khususnya hewan bentos, di dalam jaringan tubuhnya akan terdapat kandungan logam berat yang tinggi pula. Hal ini disebabkan karena cara hidup bentos yang relatif rendah aktivitasnya dan cenderung menetap di dasar perairan, sehingga akan selalu terpapar terhadap logam berat yang ada di sekitarnya.
Dalam suatu perairan bioakumulasi logam berat ditentukan oleh adanya interaksi 3 faktor, yaitu: (1) faktor kontaminasi, berhubungan dengan kondisi paparannya secara langsung atau melalui jalur tropik (ekosistem), (2) faktor abiotik, berhubungan dengan karakter fisika-kimia kolom air dan sedimen, (3) faktor biotik, berhubungan dengan kekhasan struktur dan fungsi dari organisme hidup (Boudou dan Ribeyre dalam Boudou et al, 1998). Bioakumulasi logam berat dalam tubuh organisme dapat terjadi karena adanya sejenis protein (metalotionein) dalam tubuh organisme yang bersangkutan berfungsi sebagai pengikat logam berat. Unsur logam berat masuk ke dalam tubuh organisme melalui 3 cara, yaitu melalui rantai makanan, insang, dan difusi, kemudian diikat oleh protein pada sel. Sebagian besar logam berat yang terakumulasi dalam tubuh organisme masuk melalui rantai makanan dan sedikit yang masuk melalui air.