LEMBARAN SOAL
Mata Pelajaran
: Kimia
Sat. Pendidikan
: SMA
Kelas / Program
: X / INTI
PETUNJUK UMUM
1. Tulis nomor dan nama Anda pada lembar jawaban yang disediakan
2. Periksa dan bacalah soal dengan teliti sebelum Anda bekerja
3. Kerjakanlah soal anda pada lembar lembar jawaban
4. Gunakan waktu dengan efektif dan efisien
5. Periksalah pekerjaan anda sebelum diserahkan kepada Pengawas
Pilihlah Satu Jawaban yang Palin Tepat
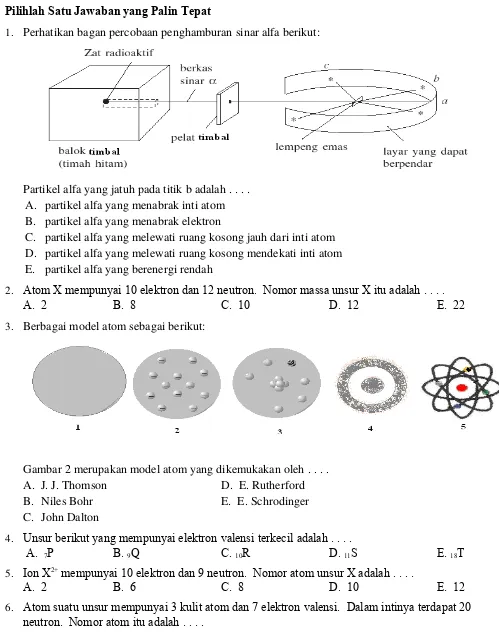
1.
Perhatikan bagan percobaan penghamburan sinar alfa berikut:
Partikel alfa yang jatuh pada titik b adalah . . . .
A. partikel alfa yang menabrak inti atom
B. partikel alfa yang menabrak elektron
C. partikel alfa yang melewati ruang kosong jauh dari inti atom
D. partikel alfa yang melewati ruang kosong mendekati inti atom
E. partikel alfa yang berenergi rendah
2.
Atom X mempunyai 10 elektron dan 12 neutron. Nomor massa unsur X itu adalah . . . .
A. 2
B. 8
C. 10
D. 12
E. 22
3.
Berbagai model atom sebagai berikut:
Gambar 2 merupakan model atom yang dikemukakan oleh . . . .
A. J. J. Thomson
D. E. Rutherford
B. Niles Bohr
E. E. Schrodinger
C. John Dalton
4.
Unsur berikut yang mempunyai elektron valensi terkecil adalah . . . .
A.
7P
B.
9Q
C.
10R
D.
11S
E.
18T
5.
Ion X
2+mempunyai 10 elektron dan 9 neutron. Nomor atom unsur X adalah . . . .
A. 2
B. 6
C. 8
D. 10
E. 12
A. 3
B. 7
C. 17
D. 20
E. 37
7.Diketahui nomor atom unsur X = 16 dan nomor massa 33. Maka dalam ion X
2–terdapat . . . .
A. 16 proton, 14 elektron dan 17 neutron
D. 16 proton, 18 elektron dan 17 neutron
B. 16 proton, 16 elektron dan 15 neutron
E. 14 proton, 16 elektron dan 17 neutron
C. 16 proton, 18 elektron dan 16 neutron
8.
Isotop suatu unsur mempunyai 21 neutron dan nomor massa 40. Elektron valensi unsur itu
adalah . .
A. 1
B. 2
C. 3
D. 6
E. 9
9.
Dalam suatu percobaan ditemukan tetes-tetes minyak dengan muatan sebesar 8 x 10
–20C, 1,6 x
10
–19C dan 3,2 x 10
–19C. Berdasarkan data tersebut dapat disimpulkan muatan elektron sebesar .
. . .
A.
8 x 10
–20C
C. 1,6 x 10
–19C
E, 4 x 10
–19C
B.
1,0 x 10
–19C
D. 3,2 x 10
–19C
10.
Sebuah atom terdiri dari 3 proton, 3 elektron dan 2 neutron.
Notasi yang benar untuk atom
tersebut adalah . . . . .
A. 2
X
3C.
3X
5E.
2X
5B. 3
X
2D.
2X
411.
Jumlah maksimum elektron yang dapat menempati kulit O adalah . . . .
A. 8
B. 10
C. 16
D. 32 E. 50
12.Partikel penyusun inti atom adalah . . . .
A. proton
C. proton dan neutron
E. neutron dan elektron
B. neutron
D. proton, elektron, dan neutron
13.
Konfigurasi elektron unsur X dengan nomor atom 33 adalah . . . .
A. 2 8 18 5
C. 2 18 18 8 5
E. 2 8 18 5 2
B. 2 8 10 8 5
D. 2 8 18 8 3
14.
Sistem periodik Mendeleyef disusun berdasarkan . . . .
A.
konfigurasi elektron
C. massa atom relatif dan kemiripan sifat
B.
kesamaan sifat
D. nomor atom dan kemiripan sifat
C.
massa atom relative
15.
Kelompok unsur berikut yng merupakan unsur segolongan adalah . . . .
A. Be, Mg, dan K
C. F, Cl, dan Ba
E. He, Ar dan Kr
B. Li, Sr, dan K
D. Be, C, dan N
16.
Di antara unsur berikut yang tergolong logam alkali tanah adalah . . . .
A. oksigen
B. natrium
C. berilium
D. bromin
E. Argon
17.Unsur dengan konfigurasi elektron: 2, 8, 18, 7 dalam sistem periodik terletak pada . . . .
A. periode 4 golongan VII A
D. periode 7 golongan IVB
B. periode 4 golongan VII B
E. periode 4 golongan IVA
C. periode 3 golongan VIIA
18.
Sifat yang mencerminkan kecenderungan suatu unsur menyerap elektron membentuk ion negatif
adalah . . .
A. afinitas elektron
C. energi ionisasi
E. titik leleh dan titik didih
B. jari-jari atom
D. kelektronegatifan
19.
Jika jari-jari atom unsur Li, Na, K, Be dan B secara acak (tidak berurutan) dalam angstrom(Å)
adalah: 2,01; 1,23; 1,57; 0,80; dan 0,89, maka jari-jari atom litium adalah . . . .
A. 2,03
C. 1,57
E. 1,23
20.
Posisi relatif unsur P, Q dan R dalam sistem periodik sperti pada gambar di samping. Jika energi
ionisasi unusur P = 500 kJ mol–1 dan unsur Q = 900 kJ mol–1, manakah dari yang berikut ini
yang paling mungkin merupakan energi ionisasi unsur R?
A. 400 kJ mol
–1D. 1000 kJ mol
–1B. 450 kJ mol
–1E. 1400 kJ mol
–1C. 700 kJ mol
–121.
Manakah dari kurva berikut yang benar untuk energi ionisasi unsur-unsur halogen?
Pergunakan daftar berikut untuk menjawab soal nomor 22 sampai 26 berikut:
22.
Konfigurasi elektron unsur R adalah . . . .
A.
2, 1
C. 2, 8, 8, 1
E. 2, 18, 8, 1
B.
2, 8, 1
D. 2, 8, 18, 1
23.
Unsur yang mempunyai keelektronegatifan terbesar adalah . . . .
A.
P
C. S
E. R
B.
Q
D. T
24.
Unsur paling mudah membentuk ion positif adalah . . . .
A.
P
C. S
E. R
B.
Q
D. T
25.
Unsur yang mempunyai energi ionisasi terkecil adalah . . . .
A.
P
C. S
E. R
B.
Q
D. T
26.
Unsur yang tergolong logam adalah . . . .
A.
P
C. P, R dan T
E. T, S, dan T
B.
P dan R
D. S dan Q
27.
Energi ionisasi unsur Li, B, N, C, dan Be secara acak adalah 520, 801, 899, 1086 dan 1402
kJ mol
1. Berdasarkan data tersebut, energi ionisasi B adalah . . . .
A. 520 kJ mol
1C. 801 kJ mol
1E. 899 kJ mol
1B. 1086 kJ mol
1D. 1402 kJ mol
128. Unsur P dan Q mempunyai konfigurasi elektron sebagai berikut:
P : 2, 8, 7 Q : 2, 8, 1
Manakah satu di antara pernyataan berikut yang benar tentang kedua unsur tersebut? A. unsur P dan Q terletak satu golongan dalam sistem periodik
B. unsur P mempunyai jari-jari atom lebih besar daripada unsur Q C. unsur P mempunyai energi ionisasi lebih besar daripada unsur Q D. unsur P lebih mudah membentuk ion positif daripada unsur Q E. unsur P tergolong logam sedangkan unsur Q tergolong non logam
29. Suatu unsur (X) terdapat dalam dua macam isotop, yaitu X-35 (25%) dan X-37 (75%). Massa
A. 35 C. 36 E. 37
31. Unsur A dan B mempunyai afinitas elektron berturut-turut 240 kJ molÐ1 dan Ð328 kJ molÐ1. Berarti . . . .
A. unsur A lebih mudah menyerap elektron daripada unsur B B. ion BÐ lebih stabil daripada atom B
C. ion AÐ lebih stabil daripada atom A
D. unsur A lebih bersifat nonlogam daripada B
E. unsur A lebih sukar melepas elektron daripada unsur B
32. Keelektronegatifan suatu unsur adalah sifat yang menyatakan . . . .
A. besarnya energi yang diperlukan untuk melepas 1 elektron pada pembentukan ion positif B. besarnya energi yang diperlukan untuk menyerap 1 elektron pada pembentukan ion negatif C. besarnya energi yang dibebaskan pada penyerapan 1 elektron membentuk ion negatif D. besarnya tendensi (kecenderungan) menarik elektron pada suatu ikatan
E. besarnya tendensi (kecenderungan) menarik elektron membentuk ion negatif
33. Titik cair dan titik didih unsur-unsur periode kedua . . . . A. naik secara beraturan sepanjang periode
B. naik bertahap sampai golongan IIIA kemudian turun drastis C. naik bertahap sampai golongan IVA kemudian turun teratur D. naik bertahap sampai golongan IVA kemudian turun drastis E. turun secara beraturan sepanjang periode
34. Energi ionisasi tingkat pertama hingga kelima dari suatu unsur (dalam kJ molÐ1)
adalah 801; 2427; 3660; 25.025; dan 32.826. Jumlah elektron valensi unsur tersebut adalah . .
A. 1 C. 3 E. 5
B. 2 D. 4
35. Unsur A dan B mempunyai afinitas elektron berturut-turut 240 kJ molÐ1 dan Ð328 kJ molÐ1. Berarti . . . .
A. unsur A lebih mudah menyerap elektron daripada unsur B B. ion BÐ lebih stabil daripada atom B
C. ion AÐ lebih stabil daripada atom A
D. unsur A lebih bersifat nonlogam daripada B
E. unsur A lebih sukar melepas elektron daripada unsur B
36. Kecenderungan unsur melepas elektronnya membentuk ion positif dicerminkan oleh . . . .
A. jari-jari atom D. titik didih
B. energi ionisasi E. keelektronegatifan
C. afinitas elektron
37. Unsur P dan Q mempunyai konfigurasi elektron sebagai berikut: P : 2, 8, 1 Q : 2, 8, 7
Manakah satu di antara pernyataan berikut yang tidak benar tentang kedua unsur tersebut?
A. unsur P dan Q terletak satu periode dalam sistem periodik panjang B. unsur P mempunyai jari-jari atom lebih besar daripada unsur Q C. unsur P mempunyai energi ionisasi lebih besar daripada unsur Q D. unsur P lebih mudah membentuk ion positif daripada unsur Q E. unsur Q lebih mudah membentuk ion negatif daripada unsur P
Manakah dari pernyataan berikut yang benar mengenai kedua unsur itu? A. Jari-jari atom unsur Y lebih besar daripada jari-jari atom unsur X B. energi ionisasi unsur X lebih besar daripada energi ionisasi unsur Y C. elektron valensi unsur X sama dengan elektron valensi unsur Y
D. keelektronegatifan unsur X lebih kecil daripada keelektronegatifan unsur Y E. daya tarik elektron unsur X lebih besar daripada daya tarik elektron unsur Y
39. Kelompok unsur yang mempunyai elektron valensi yang sama adalah . . . .
A. He, Ne, Ar, Xe D. O, F, Ne, Na
B. Be, Mg, Ca, Ba E. H, F, Cl, I
C. Li, Be, B, C
40. Unsur dengan nomor atom 50 dalam sistem periodik terletak pada . . . .
A. periode 4, golongan VA D. periode 4, golongan IVA
B. periode 5, golongan VA E. periode 5, golongan VIIA