SUHU DAN KALOR
Rafika Rahmatia*), Isma Ika Pratiwi, Muhammad Fathur Rahmat
Laboratorium Fisika Dasar, Program Studi Pendidikan Fisika 2014, Jurusan Fisika, Fakultas Matematika dan Ilmu Pengetahuan Alam,
Universitas Negeri Makassar
Abstrak
Telah dilakukan praktikum unit 1 yang berjudul “ Suhu dan Kalor”. Tujuan dilakukan praktikum ini adalah mahasiswa dapat memahami hubungan antara jumlah kalor dengan kenaikan suhu, mahasiswa dapat memahami hubungan antara massa zat dengan jumlah kalor, mahasiswa dapat merumuskan persamaan kalor, mahasiswa dapat menentukan kalor lebur es. Praktikum ini terdiri atas 3 kegiatan, yaitu kegiatan pertama: hubungan antara jumlah kalor (Q) dengan perubahan kenaikan suhu (ΔT), kegiatan kedua: hubungan antara massa zat cair (m) dengan jumlah kalor (Q), dan kegiatan ketiga menentukan kalor lebur es. Berdasarkan hasil praktikum diperoleh jumlah kalor berbanding lurus dengan kenaikan suhu (Q ̴ ∆T), massa zat berbanding lurus dengan jumlah kalor (Q ̴ m), persamaan kalor diperoleh Q ̴ m.∆T , agar setara dikalikan dengan konstanta (c) sehingga diperoleh persamaan matematis Q = m.c.∆T. Nilai kalor lebur es (Les)=│ 133,3 ± 0,6│102 kal/Kg.
Kata kunci: jumlah kalor, kalor lebur, kenaikan suhu, dan massa.
RUMUSAN MASALAH
1. Bagaimana hubungan antara jumlah kalor (Q) dengan kenaikan suhu (ΔT) ? 2. Bagaimana hubungan antara massa zat (m) dengan jumlah kalor (Q) ? 3. Bagaimana rumusan persamaan kalor ?
4. Bagaimana kalor lebur es yang digunakan dalam praktikum?
TUJUAN
1. Mahasiswa dapat memahami hubungan antara jumlah kalor (Q) dengan kenaikan suhu (ΔT).
2. Mahasiswa dapa memahami hubungan antara massa zat (m) dengan jumlah kalor (Q).
3. Mahasiswa dapat merumuskan persamaan kalor. 4. Mahasiswa dapat menentukan kalor lebur es.
METODOLOGI EKSPERIMEN Teori Singkat
menjadi panas dan mendidih melibatkan perpindahan kalor dari sumber kalor ke lingkungan sekitarnya. Sumber kalor adalah api,sehingga dapat dikatakan bahwa semakin besar nyala api,maka berarti makin besar kalor yyang dimiliki,atau semakin lama dipanaskan maka semakin banyak kalor yang dilepaskan. Akibat pemberian kalor tersebut,maka suhu air akan mengalami kenaikan dimana semakin lama dipanaskan maka semakin besar kenaikan suhu pada air. Dua wadah berisi air yang massanya berbeda,jika dipanaskan dengan waktu yang sama maka suhu yang terukur pada kedua wadah tersebut akan berbeda. Suhu air dalam wadah yang memiliki air yang massanya lebih kecil akan mengalami suhu yang lebih tinggi dibandingkan wadah yang berisi air lebih banyak. Sehingga dapat disimpulkan bahwa terdapat hubungan antara banyak kalor (Q), kenaikan suhu (∆T), dan massa air (m) (Herman, 2015: 1-2).
Temperatur (suhu) kita kenal sebagai ukuran panas atau dinginnya suatu benda. Secara lebih tepat,temperatur merupakan ukuran energi kinetik molekuler internal rata-rata sebuah benda. Bila sebuah benda dipanaskan atau didinginkan, sebagian dari sifat fisisnya berubah. Sebagai contoh, kebanyakan padatan dan cairan memuai bila dipanaskan. Gas bila diijinkan,juga akan memuai bila dipanaskan atau jika volumenya dijaga konstan (Tipler, 1991: 560-561).
Menurut Hallidai dan Resnik (1978: 722), kalor adalah sesuatu yang dipindahkan diantara sebuah sistem dan sekelilingnya sebagai akibat dari hanya perbedaan temperatur.
Alat dan Bahan
1. Termometer 1 buah
2. Kaki tiga + kasa asbes 1 buah
3. Lampu spritus 1 buah
4. Beacker gelas 1 buah
5. Stopwatch 1 buah
6. Statif + klem 1 buah
7. Gelas kimia ukuran sedang 1 buah
8. Gelas kimia ukuran besar 1 buah
10. Zat cair (air mineral) 11. Es batu
Identifikasi Variabel
Kegiatan 1.Hubungan jumlah kalor (Q) dengan perubahan kenaikan suhu (ΔT)
Variabel kontrol : volume, dan jenis zat cair Variabel manipulasi : jumlah kalor (Q)
Variabel respon : kenaikan suhu (ΔT)
Kegiatan 2. Hubungan massa zat cair (m) dengan jumlah kalor (Q)
Variabel kontrol : kenaikan suhu (ΔT) Variabel manipulasi : massa zat (m) Variabel respon : jumlah kalor (Q)
Kenaikan 3.Menentukan kalor lebur es
Variabel yang diukur: massa calorimeter beserta pengaduknaya, massa kalori meter + pengaduk + air panas, suhu air panas dan kalori meter, suhu es batu, suhu campuran, massa kalori meter + pengaduk + air panas + air ( es batu yang mencair).
Defenisi Operasional Variabel
Kegiatan 1.Hubungan jumlah kalor (Q) dengan perubahan kenaikan suhu (ΔT)
1. Volume adalah banyaknya volume zat cair (air) yang digunakan dalam kegiatan ini yang telah ditetapkan terlebih dahulu. pada praktiku ini digunakan volume air sebanyak 100 ml. satuan yang digunakan adalah ml. 2. Jenis zat cair adalah jenis zat yang digunakan. Jenis zat yang digunakan
adalah air.
3. Jumlah kalor (Q) adalah banyaknya kalor yang diperlukan untuk menaikkan suhu. Jumlah kalor dalam praktikum ini diasumsikan sebagai lama pemansan dengan satuan sekon. Selisih antara lama pemanasan pada data yang satu denagan data berikutnya adalah 30 sekon dan dimanipulasi sebnayak 6 kali. 4. Kenaikan suhu (ΔT) adalah selisih antara perubahan suhu setelah air
Kegiatan 2. Hubungan massa zat cair (m) dengan jumlah kalor (Q)
1. Kenaikan suhu (ΔT) adalah selisih antara perubahan suhu setelah air dipanaskan dengan suhu awal. Selisih suhu akhir dengan suhu awal ditetapkan 3 ℃. Satuan yang digunakan adalah ℃.
2. Massa zat (m) adalah massa air yang diperoleh dengan cara mengurangkan massa gelas kimia kosong dengan massa gelas kimia yang telah diisi dengan air yang ditimbang dengan menggunakan neraca 311 gram. Satuannya adalah gram.
3. Jumlah kalor (Q) adalah jumlah kalor yang diperlukan untuk menaikan 3 ℃ air yang dipanaskan. Jumlah kalor dalam kegiatan ini diasumsikan dengan lama pemanasan dengan satuan sekon.
Kenaikan 3.Menentukan kalor lebur es
1. Massa Kalorimeter beserta pengaduknaya adalah massa dari kalori meter dengan pengaduk yang ditimbang dengan menggunakan neraca 311 gram. Satuan yang digunakan adalah gram
2. Massa kalorimeter + pengaduk + air panas adalah massa calorimeter beserta pengaduk yang telah diisi dengan air panas yang diukur dengan menggunakan neraca 311 gram. Satuan yang digunakan adalah gram
3. Suhu air panas dan calorimeter adalah suhu air panas setelah dimasukkan ke dalam kalorimeter dan ditimbang. Satuan yang digunakan adalah ℃
4. Suhu es batu adalah suhu es batu saat di lemari es. Satuan yang digunakan adalah ℃.
5. Suhu campuran adalah suhu setelah es batu dimasukkan kedalam Kalorimeter yang terdapat air panas, dimana suhu tersebut diukur ketika es batu telah mencair. Satuan yang digunakan adalah ℃.
Prosedur Kerja
Kegiatan 1.Hubungan jumlah kalor (Q) dengan kenaikan suhu (ΔT)
1. Menuangkan air ke dalam gelas ukur secukupnya.
2. Mengukur suhu awal air dengan zat cair yang akan dipanaskan.
3. Memanaskan air tersebut diatas kaki tiga yang dilapisi dengan asbesdengan menggunakan pembakar spritus.
4. Mengamati penunjukan suhu pada selang waktu tertentu (digunakan selang waktu yang sama untuk setiap data).
5. Mencatat hasilnya pada tabel hasil pengamatan.
6. Melakukan kegiatan yang sama dengan suhu mula-mula yang berbeda. 7. Mencatat dalam tabel pengamatan waktu yang dibutuhkan setiap selang
kenaikan suhu.
Kegiatan 2. Menyelidiki hubungan rapat massa tali dengan kecepatan gelombang
1. Memasukkan air ke dalam gelas ukur sehingga menunjukkan volume tertentu, catat volume air yang digunakan (digunakan volume terkecil pada gelas ukur yang digunakan) dan perhatikan penunjukan suhu dengan termometer.
2. Menentukan suhu acuan (lebih besar dari suhu mula-mula sekitar 30 ℃) dan besar kenaikan suhu yang diinginkan.
3. Memanaskan air tersebut diatas kaki tiga yang dilapisi dengan asbes dengan menggunakan pembakar spritus.
4. Mengamati kenaikan suhu pada termometer dan menyalakan stopwatch tepat ketika termometer menunjukkan suhu acuan. Diukur waktu yang dibutuhkan untuk menaikkan suhu air sebesar nilai kenaikan suhu yang telah ditentukan. Dicatat hasilnya dalam tabel pengamatan.
5. Mengganti air yang digunakan, dan mengulangi langkah 3 dan 4 untuk volume air yang berbeda (lebih besar dari volume sebelumnya). Ulangi sampai memperoleh minimal 6 data.
Kegiatan 3. Menentukan kalor lebur es
2. Menimbang calorimeter kosong beserta pengaduknya.
3. Mengukur suhu es batu dandimasukan ke dalam calorimeterkemudian ditimbang untuk menetukan massa es batu.
4. Mengukur suhu air panas dan memasukkan air tersebut ke dalam calorimeter dengan cepat, menutup dan diaduk-aduk sejenak sampai semua es batu mencair. Mengukur suhu pada saat itu sebagai campuran kemudian menimbang massa campuran untuk menentukan massa air panas.
5. Mencatat hasilnya dalam tabel pengamatan.
HASIL EKSPERIMEN DAN ANALISIS DATA
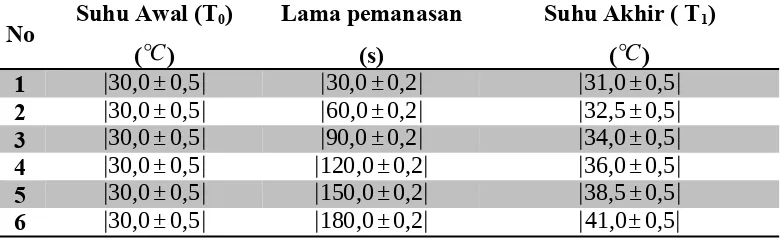
Kegiatan 1. Hubungan antara jumlah kalor (Q) dengan perubahan kenaikan suhu (ΔT)
Volume = 50 ml Jenis zat cair = Air
Tabel 1. Hubungan antara jumlah kalor (Q) dengan perubahan kenaikan suhu (ΔT)
Kegiatan 2. Hubungan rapat massa tali dengan kecepatan gelombang
Tabel 2. Hubungan antara massa zat cair (m) dengan jumlah kalor (Q)
No Jenis zat cair Massa Zat Cair
(gram) Tabel 3. Kalor lebur es
Pengukuran Hasil pengukuran
1. Massa calorimeter kosong beserta pengaduknya
2. Massa calorimeter + pengaduk + air panas 3. Suhu air panas dan kalori meter
4. Suhu es batu
6. Massa calorimeter + pengaduk + air panas + air (es batu yang mencair)
|55,0±0,5|℃
|196,130±0,005|gram
ANALISIS DATA
Kegiatan 1hubungan antara jumlah kalor dengan kenaikan suhu(∆T)
Tabel 4.Hubungan antara jumlah kalor (Q)dengan kenaikan suhu(∆T)
0 2 4 6 8 10 12 14
Grafik 1.. Hubungan antara jumlah kalor dengan kenaikan suhu (∆T) Lama pemanasan menunjukkan banyaknya jumlah kalor digunakan, sehingga dari grafik diketahui bahwa jumlah kalor berbanding lurus dengan kenaikan suhu (∆T). Maka :Q ~ ∆T
Kegiatan 2. Hubungan antara massa zat (m) dengan jumlah kalor (Q)
Diasumsikan lama pemanasan sebagai jumlah kalor (Q)
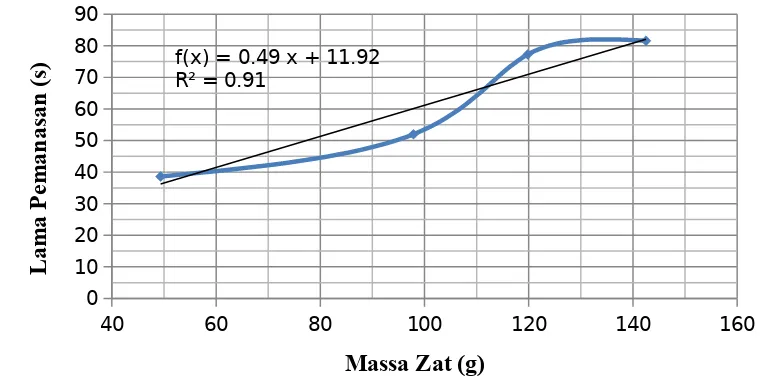
Tabel 4.Hubungan antara jumlah kalor (Q)dengan massa zat(m)
No Massa zat cair(gr) Lama pemanasan(s)
1 |49,34 ± 0,01| |38,6 ± 0,2|
2 |97,87 ± 0,01| |52,0 ± 0,2|
3 |119,85 ± 0,01| |77,3 ± 0,2|
40 60 80 100 120 140 160
Grafik 2. Hubungan antara jumlah kalor (Q) dengan massa zat (m)
Lama pemanasan menunjukkan banyaknya jumlah kalor digunakan, sehingga dari grafik diketahui bahwa jumlah kalor berbanding lurus dengan kenaikan suhu (∆T). Maka :Q ~ m
1. Berdasarkan hasil pembahasan pada kegiatan 1 dan 2, persamaan matematis dari persamaan jumlah kalor(Q),yaitu dari kegiatan 1 baik pada suhu awal 290C maupun pada 290C dapat dilihat pada grafik bahwa: Q ̴ ∆T. Sedangkan
pada kegiatan 2 dapat juga dilihat bahwa: Q ̴ m, sehingga dari kegiatan 1 dan 2 dapat dituliskan Q ̴ m.∆T dan untuk menyetarakan persamaan tersebut maka ditambahkan konstanta k yang merupakan kalor jenis zat,sehingga diperoleh persamaan secara matematis:
=M . θ . k (untuk menyetarakan ditambahkan konstanta)
M . L2T−2
=M . θ. L2T−2θ−1
M . L2T−2
Q=m. k . ∆ T (dimana konstanta tersebut sama dengan kalor jenis, c)
Q=m. c . ∆T
2. Satuan dari kalor jenis (menggunakan analisis dimensi) berdasarkan hasil percobaan.
Berdasarkan percobaan dari kegiatan 1 dan 2 didapatkan persamaan: Q = m.c.∆T
c = m. ∆ TQ c = M LM .θ2T−2 c = J/kgK
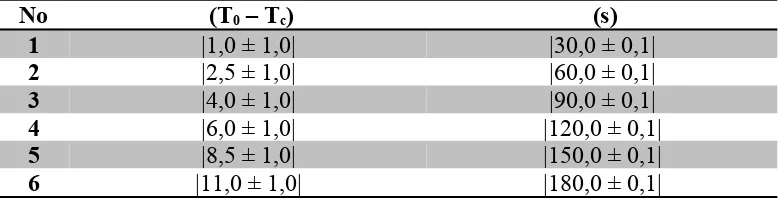
Kegiatan 3.Menentukan kalor lebur es
Massa kalorimeter kosong dan pengaduknya = │60,880 ± 0,005│ gram Massa air panas = │190,800 ± 0,005│gram - │60,800 ± 0,005│gram
= │130,000 ± 0,010│gram
Massa es batu = │196,130 ± 0,005│gram - │190,800 ± 0,005│gram = │5,330 ± 0,010│gram
a. Kalor untuk menaikkan 5,330 gram es dari -100C ke 00C
Q1 = mes × ces × ∆T
Q1 = 5,330 × 10-3 kg × 2100 J/kgoC × (0 – (10)oC
Q1 = 45,633 J/oC × 10 oC
Q1 = 111,93 J
Adapun ketidakpastian mutlak hasil perhitungan jumlah kalor 1 (Q1)
Q1 = mes × ces × ∆T
Karena ces bernilai konstan jadi,
Q1 = mes × ∆T
d Q1 =
|
∂ Q1
∂ mes
|
d mes +|
∂ Q1
∂∆T
|
d∆Td Q1
b. Kalor untuk menaikkan 5,3300 gram air 00C sampai suhu campuran (T c =
55,00C)
Q2 = mes × cair × ∆T
Q2 = 5,330 × 10-3 kg × 4200J/kgoC × (50,0 – 0) oC
Q2 = 1119,3 J
Adapun ketidakpastian mutlak hasil perhitungan jumlah kalor 2 (Q2)
∆ Q2 =
|
c. Kalor yang hilang dari 130,000 gram air dengan mendingin dari 62,00C
sampai suhu campuran(Tc = 55,0 0C)
Q3 = mair × cair × ∆T
Q3 = 130,000 × 10-3 kg × 4200 J/kgoC× (62,0 – 55,0) oC
Adapun ketidakpastian mutlak hasil perhitungan jumlah kalor 3 (Q3)
d. Kalor yang hilang dari kalorimeter dengan mendingin dari 62,00C sampai
suhu campuran(Tc = 55,0 0C)
Q4 = mkalorimeter × caluminium × ∆T
Q4 = 60,880× 10-3 kg × 900J/kgoC × (62,0 – 55,0) oC
Q4 = 383,544 J
Adapun ketidakpastian mutlak hasil pengukuran jumlah kalor 4 (Q4)
∆ Q4 =
|
5,330× 10-3 kg × L
PEMBAHASAN
Praktikum unit 1 dengan judul “Suhu dan Kalor” terdiri atas 3 kegiatan, yaitu kegiatan pertama, hubungan antara jumlah kalor dengan perubahan kenaikan suhu (ΔT). Dalam melakukan praktikum ini dilakukan pengambilan data sebanyak 6 kali dengan variabel manipulasinya adalah jumlah kalor (Q). Adapun lama pemanasan diasumsikan sebagai jumlah kalor. Hal ini dikarenakan kegiatan ini menggunakan massa yang sama besar untuk setiap data, sehingga semakin lama dipanaskan maka semakin banyak jumlah kalor yang dibutuhkan. Berdasarkan grafik 1 dan garfik 2 menggunakan massa zat cair dapat diketahui jumlah kalor berbanding lurus dengan kenaikan suhu (∆T), semakin besar jumlah kalor yang diberikan maka semakin besar kenaikan suhu, begitu pula sebaliknya. Pada kegiatan ini dimana kenaikan suhu yang tetap sebesar ∆T = 30C dapat
membuktikan bahwa jumlah kalor dengan kenaikan suhu berbanding lurus . secara matematis dapat dituliskan Q ~ ∆T.
Pada kegiatan kedua, hubungan antara massa zat cair (m) dengan jumlah kalor. Kenaikan suhu yang digunakan adalah ΔT = |3,0 ± 1,0| 0C, lama
pemanasan diasumsikan sebagai jumlah kalor dan massa yang digunakan dimanipulasi. Berdasarkan grafik diperoleh bahwa lama pemanasan berbanding lurus dengan massa zat cair, sehingga dapat dikatakan bahwa semakin banyak massa zat cair yang digunakan maka semakin lama waktu yang dibutuhkan untuk mencapai kenaikan suhu, dengan kata lain hubungan antara massa zat cair dengan jumlah kalor (Q) adalah berbanding lurus. Secara matematis hubungan tersebut dapat dituliskan Q ~ m.
Berdasarkan hasil analisis kegiatan 1 dan 2 diperoleh bahwa Q ̴ ∆T dan Q ̴ m sehingga dapat dirumuskan persamaan: Q ̴ m. ∆T, agar persamaan tersebut setara, maka persamaan tersebut dikalikan dengan konstanta (c) sehingga diperoleh persamaan matematis Q = m . c . ∆T. Konstanta (c) merupakan kalor jenis zat cair.
Kegiatan ketigan adalah menentukan kalor lebur es. Pada kegiatan ini
kalorimeter yang berisi air panas. Keadaan yang terjadi selanjutnya adalah serah terima energi. Berdasarkan rumus azas black maka diperoleh nilai kalor lebur es sebesar Les = 98 kal/gr atau Les = │133,3 ± 0,6│kal/kg. Adapaun menurut teori
nilai kalor lebur es Les = 80 kal/gr. Berdasarkan hal tersebut persen perbedaan
antara kedua data tersebut:
|
teoriteori−+praktikumpraktikum2
|
matematis dapat ditulis Q ∆ T2. Massa zat berbanding lurus dengan jumlah kalor, dimana secara matematis dapat ditulis m Q
3. Formulasi persamaan kalor yang diperoleh berdasarkan praktikum adalah
Q=mc ∆ T.
4. Kalor lebur yang diperoleh berdasarkan hasil praktikum adalah Les=│133,3 ±
0,6│kal/kg.
SARAN
Dalam melakukan praktikum ini sebaiknya praktikan teliti dan cekatan dalam memperhatikan penunjukan skala termometer dan neraca ohauss yang digunakan. Kepada asisten diharapkan memberikan pengawasan dan bimbingan yang lebih baik lagi. Hal ini dilakukan agar dalam melakukan praktikum, ketika praktikan menemui kesulitan praktikan dapat segera menanyakan kepada asisten pendamping sehingga praktikum dapat selesai tepat waktu.
DAFTAR PUSTAKA
Halliday,Resnik.1978.Fisika Jilid 1 Edisi Ketiga.Jakarta:Erlangga.