SUHU DAN KALOR
Nur’arizkah, Sukmawati, Susi Suryani Syam
PENDIDIKAN FISIKA 2015 Abstrak
Telah dilakukan suatu praktikum dengan judul suhu dan kalor. Kegiatan pertama percobaan ini bertujuan untuk mengetahui hubungan antara jumlah kalor dengan kenaikan suhu, kegiatan kedua bertujuan mengetahui hubungan massa zat dengan jumlah kalor. Sedangkan kegiatan ketiga bertujuan untuk menentukan kalor lebur es. Pada kegiatan pertama, digunakan dua suhu awal yakni │30,0 ± 0,5│°C dan │40,0 ± 0,5│°C, dan juga lama pemanasan yang berbeda, dengan data-data dari kedua variabel tersebut dibuat grafik hubungan yang menunjukkan bahwa jumlah kalor berbanding lurus dengan kenaikan suhu. Pada kegiatan kedua, hubungan massa zat cair dengan jumlah kalor dicari dengan membandingkan nilai massa dengan lama pemanasan dengan perbandingan yakni 0,046895 kg: 31,1 s; 0,068740 kg: 42,7 s; dan 0,085550 kg: 44,8 s. Dengan memasukkan perbandingan tersebut melalui grafik didapat hasil bahwa jumlah kalor berbanding lurus dengan massa zat. Sehingga jika dinyatakan dalam persamaan matematis dapat dituliskan Q = m c ΔT. Adapun satuan dari kalor jenis (c) ditentukan dengan analisis dimensi sehingga diperoleh hasil satuan dari kalor jenis yakni J/kg °C. Pada kegiatan ketiga dicari nilai dari kalor lebur es dengan menggunakan asas black, dengan hasil akhir kalir lebur es bernilai │0,34 ± 0,09│106 J/kg.
Kata kunci : kalor, suhu, massa, hubungan.
RUMUSAN MASALAH
1. Bagaimana hubungan antara jumlah kalor (Q) dengan kenaikan suhu (ΔT)? 2. Bagaimana hubungan antara massa zat (m) dengan jumlah kalor (Q)? 3. Bagaimana persamaan kalor (Q)?
4. Berapa kalor lebur es?
TUJUAN
1. Menyelidiki hubungan antara jumlah kalor (Q) dengan kenaikan suhu (ΔT). 2. Menyelidiki hubungan antara massa zat (m) dengan jumlah kalor (Q). 3. Merumuskan persamaan kalor (Q).
METODOLOGI EKSPERIMEN Teori Singkat
Air yang dipanaskan dalam panci akan mulai panas dan lama-kelamaan akan mendidih. Peristiwa ini sering dijumpai dalam keseharian. Proses air menjadi panas dan mendidih melibatkan perpindahan kalor dari sumber kalor ke lingkungan sekitarnya. Sumber kalor adalah api, sehingga dapat dikatakan bahwa semakin besar nyala api, maka berarti makin besar kalor yang dimiliki, atau semakin lama dipanaskan maka semakin banyak kalor yang dilepaskan. Akibat pemberian kalor tersebut, maka suhu air akan mengalami kenaikan dimana semakin lama dipanaskan maka semakin besar kenaikan
suhu pada air (Herman, 2015: 1).
Interaksi yang menyebabkan perpindahan suhu ini pada dasarnya adalah perpindahan energi dari satu bahan ke bahan yang lainnya. Perpindahan energi yang hanya terjadi karena perbedaan suhu disebut aliran panas atau perpindahan panas, dan energi yang dipindahkan disebut panas (heat) (Young, 2002:467).
Dua wadah berisi air yang massanya berbeda, jika dipanaskan dengan waktu yang sama maka suhu yang terukur pada kedua wadah tersebut akan berbeda. Suhu air dalam wadah yang memiki air yang massanya lebih kecil akan memilki suhu yang lebih tinggi dibanding wadah yang berisi air lebih banyak. Sehingga dapat disimpulkan bahwa terdapat hubungan antara banyak kalor (Q), kenaikan suhu (ΔT) dan massa air (m). Segelas air panas yang dicampurkan dengan segelas air dingin, akan terasa hangat. Hal disebabkan oleh karena adanya perpindahan kalor dari air panas ke air dingin. Itulah sebabnya suhu air panas turun dan suhu air dingin naik setelah keduanya bercampur. Pada proses pencampuran tersebut, kalor yang dilepaskan air panas diserap oleh air dingin. Jadi banyaknya kalor yang dilepaskan sama dengan banyaknya kalor yang diserap. Pernyataan ini disebut Azaz Black yang secara matematis dapat dituliskan;
Qlepas = Qserap ... (1)
energi panas Q yang dibutuhkan untuk menaikkan temperatur suatu zat adalah sebanding dengan perubahan temperatur dan massa zat itu (Tipler, 1998:598)
Q = C ΔT = m c ΔT ...(2)
Dengan C merupakan kapasitas panas zat, yang didefinisikan sebagai energi panas yang dibutuhkan untk menaikkan temperatur suatu zat dengan satu derajat. Panas jenis c adalah kapasistas panas per satuan massa (Tipler, 1998:599):
c = C
m ...(3) Satuan energi panas historis, kalori mula-mula didefinisikan sebagai jumlah energi panas yang dibutuhkan untuk menaikkan temperatur satu gram air satu derajat Celcius (atau satu Kelvin karena derajat Celcius dan Kelvin besarnya sama). Selanjutnya kilokalori ialah banyaknya energi panas yang dibutuhkan untuk menaikkan temperatur satu kilogram air dengan satu derajat Celcius (“Kalori” sebenarnya adalah kilokalori). Kalori sekarang didefinisikan dengan menyatakan dalam satuan SI untuk panas, yaitu Joule (Tipler, 1998:599):
1 kal = 4,184 J
Dari definisi awal kalori, panas jenis air adalah(Tipler, 1998:599) cair = 1 kal/g°C = 1 kkal/kg°C
= 1 kkal/kg.K = 4,184 kJ/kg.K
Nilai-nilai untuk kalor lebur dan penguapan disebut juga kalor laten. Kalor penguapan dan lebur juga mengacu pada jumlah kalor yang dilepaskan oleh zat ketika berubah dari gas ke cair, atau dari cair ke padat. Tentu saja kalor yang terlibat dalam perubahan fase tidak hanya bergantung pada kalor laten, tetapi juga pada massa total zat tersebut. Sehingga (Douglas, 2001: 497 – 498).
Q = m L ...(4)
Dimana L adalah kalor laten proses dan zat tertentu, m adalah massa zat dan Q adalah kalor yang dibutuhkan atau dikeluarkan selama perubahan fase.
melingkupi kedua kemungkinan dan mencakupi jenis perubahan fasa lainnya, kita tuliskan
Q = ± mL ...(5)
Tanda plus (panas masuk) dipakai ketika bahan melebur; tanda minus (panas keluar) dipakai saat membeku panas peleburan berbeda untuk bahan yang berlainan, dan juga bervariasi terhadap tekanan.
Alat dan Bahan
1. Alat
a. Termometer batang 2 buah
b. Kaki tiga + kasa asbes 1 set
c. Pembakar spiritus 1 buah
d. Stopwatch 1 buah
e. Statif + klem 1 set
f. Gelas kimia 100 ml 1 buah
g. Gelas kimia 250 ml 1 buah
h. Neraca ohauss 311 gram 1 buah
i. Alat tulis menulis
2. Bahan
a. Korek api
b. Spiritus
c. Air
d. Es batu
Identifikasi Variabel
Kegiatan 1
1. Variabel manipulasi : suhu awal (°C) dan lama pemanasan (s) 2. Variable respon : suhu akhir (°C)
Kegiatan 2
1. Variable manipulasi : massa zat cair (kg) 2. Variable respon : lama pemanasan (s)
3. Variable kontrol : kenaikan suhu (°C) dan jenis zat cair
Kegiatan 3
1. Massa kalorimeter (kg) 2. Massa air panas (kg) 3. Massa es batu (kg) 4. Suhu air panas (°C) 5. Suhu es batu (°C) 6. Suhu campuran (°C)
Definisi Operasional Variabel
Kegiatan 1
1. Variabel manipulasi : suhu awal (°C) dan lama pemanasan (s)
a. Suhu awal adalah derajat panas dinginnya air yang diukur sebelum dipanaskan. Alat yang digunakan untuk mengukur suhu awal yakni termometer dengan hasil akhir menggunakan derajat celcius (°C) sebagai satuannya.
b. Lama pemanasan adalah banyaknya waktu yang digunakan ketika memanaskan air. Alat yang digunakan untuk mengukur waktu pemanasan yakni stopwatch dengan sekon (s) sebagai satuan akhirnya. Lama pemanasan di asumsikan sama dengan jumlah kalor (Q).
2. Variabel respon : suhu akhir (°C)
a. Suhu akhir adalah derajat panas dinginnya air sesudah dipanaskan dalam selang waktu yang telah ditentukan. Alat ukur suhu untuk variabel ini yakni termometer dengan celcius sebagai satuan akhirnya.
3. Variabel kontrol : volume (ml) dan jenis zat cair
b. Jenis zat cair adalah jenis cairan yang akan dipanaskan, dimana dalam percobaan ini air merupakan jenis zat cair yang digunakan.
Kegiatan 2
1. Variabel manipulasi : massa zat cair (kg)
a. Massa zat cair adalah ukuran massa air yang diukur setelah dipanaskan. Alat ukur yang digunakan untuk mengukur massa air yakni neraca ohauss 311 gram dengan kilogram sebagai satun akhir hasil pengukuran.
2. Variabel respon : lama pemanasan (s)
a. Lama pemanasan adalah banyaknya waktu yang digunakan ketika memanaskan air. Alat yang digunakan untuk mengukur waktu pemanasan yakni stopwatch dengan sekon (s) sebagai satuan akhirnya. Lama pemanasan di asumsikan sama dengan jumlah kalor (Q).
3. Variabel kontrol : kenaikan suhu (°C) dan jenis zat cair
a. Kenaikan suhu (°C) adalah selisih derajat panas dinginnya zat cair sebelum dan sesudah dipanaskan. Alat ukur yang digunakan yakni termometer dengan celcius merupakan satuan akhirnya.
b. Jenis zat cair adalah jenis cairan yang akan dipanaskan, dimana dalam percobaan ini air merupakan jenis zat cair yang digunakan.
Kegiatan 3
1. Massa kalorimeter (kg)
Massa kalorimeter adalah ukuran massa dari kalorimeter kosong beserta pengaduknya. Alat ukur yang digunakan adalah neraca ohauss 311 gram dengan menggunakan kilogram sebagai satuan akhirnya.
2. Massa air panas (kg)
Massa air panas adalah ukuran massa air yang sudah dipanaskan terlebih dahulu yang diperoleh dengan menimbang kalorimeter yang berisi air panas dan pengaduknya menggunakan neraca ohauss 311 gram, yang kemudian dikurangkan dengan massa kalorimeter kosong dengan pengaduknya. Hasil akhirnya menggukan satuan kilogram.
Massa es batu adalah ukuran massa es yang dihitung setelah dilelehkan dalam air panas yang berada dalam kalorimeter yang ditimbang dengan menggunakan neraca ohauss 311 gram, yang kemudian dikurangkan dengan massa air kalorimeter yang berisi air panas dan pengaduknya. Kilogram merupakan satuan akhir dari variabel ini.
4. Suhu air panas (°C)
Suhu air panas adalah derajat panas dari air yang sudah dipanaskan terlebih dahulu dan dimasukkan ke dalam kalorimeter, alat ukur yang digunakan adalah termometer dengan celcius sebagai satuan akhirnya.
5. Suhu es batu (°C)
Suhu es batu adalah derajat dinginnya es yang diukur ketika es masih berada didalam pendingin kulkas, alat ukur yang digunakan yakni termometer dengan celcius sebagai satuan akhirnya.
6. Suhu campuran (°C)
Suhu campuran adalah derajat panas dinginnya air setelah es batu dilelehkan didalam air panas yang berada dalam kalorimeter. Alat ukur yang digunakan adalah termometer dengan celcius merupakan satuan akhirnya.
Prosedur Kerja
Kegiatan 1. Hubungan antara jumlah kalir (Q) dengan kenaikan suhu (ΔT).
1. Menuangkan air ke dalam gelas ukur sebanyak 100 ml.
2. Mengukur suhu awal air dengan zat cair yang akan dipanaskan.
3. Memanaskan air tersebut diatas kaki tiga yang dilapisi dengan asbes dengan
menggunakan pembakar spiritus.
4. Mengamati penunjukan suhu pada selang waktu tertentu (menggunakan selang
waktu yang sama untuk setiap data), mencatat hasilnya pada tabel hasil pengamatan.
5. Melakukan kegiatan yang sama dengan suhu mula-mula yang berbeda.
6. Mencatat waktu yang dibutuhkan ke dalam tabel pengamatan untuk setiap
selang kenaikan suhu.
1. Memasukkan air ke dalam gelas ukur sehingga menunjukkan volume tertentu, mencatat volume air yang digunakan (menggunakan volume terkecil pada gelas ukur yang digunakan) dan memperhatikan penunjukan suhu dengan termometer.
2. Menentukan suhu acuan (lebih besar dari suhu mula-mula sekitar 3°C) dan
besar kenaikan suhu yang diinginkan.
3. Memanaskan air tersebut diatas kaki tiga yang dilapisi dengan asbes dengan
menggunakan pembakar spiritus.
4. Mengamati kenaikan suhu pada termometer dan menyalakan stopwatch tepat
ketika termometer menunjukkan suhu acuan. Mengukur waktu yang dibutuhkan untuk menaikkan suhu air sebesar nilai kenaikan suhu yang telah ditentukan. Mencatat hasilnya dalam tabel pengamatan.
5. Mengganti volume air yang digunakan, dan mengulangi langkah ke 3 dan ke
4. Mengganti volume air yang digunakan sampai diperoleh 5 data.
Kegiatan 3. Gaya magnet (Fm) sebagai fungsi kuat medan magnetik (B).
1. Memanaskan air dalam gelas kimia 250 ml sebanyak 100 ml sampai suhunya
mencapai 80 derajat celcius.
2. Menimbang kalorimeter kosong beserta pengaduknya.
3. Mengukur suhu air panas degan menuangkan air panas ke dalam kalorimeter
dengan cepat, dan menimbangnya untuk menentukan massa air panas
4. Mengukur suhu es batu dan memasukkan es batu ke dalam kalorimeter dan
aduk sampai semua es batu mencair. mengukur suhu pada saat itu sebagai suhu campuran kemudian menimbang kalorimeter untuk menentukan massa campuran.
HASIL EKSPERIMEN DAN ANALISIS DATA Hasil Pengamatan
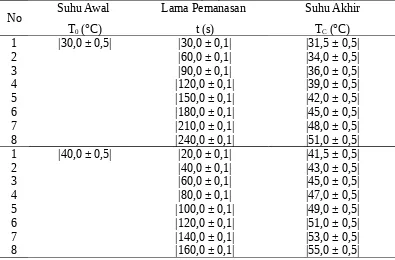
Kegiatan 1. Hubungan antara jumlah kalor (Q) dengan perubahan kenaikan suhu (ΔT)
Volume = |100 ± 1| ml Jenis Zat Cair = Air
Tabel 1. Hubungan antara jumlah kalor (Q) dengan perubahan kenaikan suhu (ΔT)
No Suhu Awal T0 (°C)
Lama Pemanasan t (s)
Suhu Akhir TC (°C)
1 |30,0 ± 0,5| |30,0 ± 0,1| |31,5 ± 0,5|
2 |60,0 ± 0,1| |34,0 ± 0,5|
3 |90,0 ± 0,1| |36,0 ± 0,5|
4 |120,0 ± 0,1| |39,0 ± 0,5|
5 |150,0 ± 0,1| |42,0 ± 0,5|
6 |180,0 ± 0,1| |45,0 ± 0,5|
7 |210,0 ± 0,1| |48,0 ± 0,5|
8 |240,0 ± 0,1| |51,0 ± 0,5|
1 |40,0 ± 0,5| |20,0 ± 0,1| |41,5 ± 0,5|
2 |40,0 ± 0,1| |43,0 ± 0,5|
3 |60,0 ± 0,1| |45,0 ± 0,5|
4 |80,0 ± 0,1| |47,0 ± 0,5|
5 |100,0 ± 0,1| |49,0 ± 0,5|
6 |120,0 ± 0,1| |51,0 ± 0,5|
7 |140,0 ± 0,1| |53,0 ± 0,5|
Kegiatan 2. Hubungan antara massa zat cair (m) dengan jumlah kalor (Q)
ΔT = |3,00 ± 1| °C
Tabel 2. Hubungan massa zat cair (m) dengan jumlah kalor (Q) No Jenis Zat Cair Massa Zat Cair (g) Lama Pemanasan (s)
1 Air |46,895 ± 0,005| |31,1 ± 0,1|
2 |68,740 ± 0,005| |42,7 ± 0,1|
3 |85,550 ± 0,005| |44,8 ± 0,1|
4 |112,740 ± 0,005| |63,1 ± 0,1|
5 |136,680 ± 0,005| |58,3 ± 0,1|
Kegiatan 3. Menentukan kalor lebur es
Tabel 3. Hasil pengukuran
No Pengukuran Hasil Pengukuran
1 Massa kalorimeter kosong beserta
pengaduknya |62,400 ± 0,005| g
2 Massa kalorimeter + pengaduk + air
panas |157,455 ± 0,005| g
3 Suhu air panas dan kalorimeter |64,0 ± 0,5|°C
4 Suhu es batu |-12,0 ± 0,5|°C
5 Suhu campuran |56,9 ± 0,5|°C
6 Massa kalorimeter + pengaduk + air
panas + air (es batu yang mencair) |162,705 ± 0,005| g
ANALISIS DATA Kegiatan 1
Lama pemanasan diasumsikan sebagai jumlah kalor (Q)
Suhu Awal │30,0 ± 0,5│°C
1. Kenaikan suhu (ΔT) a. Data 1
∆ T1 =
(
TC - T0)
= (31,5 - 30,0) = 1,5℃KR =∆ ∆T1 ∆T1
×100% = 1
1,5 ×100% = 67% = 2 AB
ΔT1 = │ ΔT1 ± ΔΔT1│= │1,5 ± 1,0│°C b. Data 2
KR =∆ ∆T8
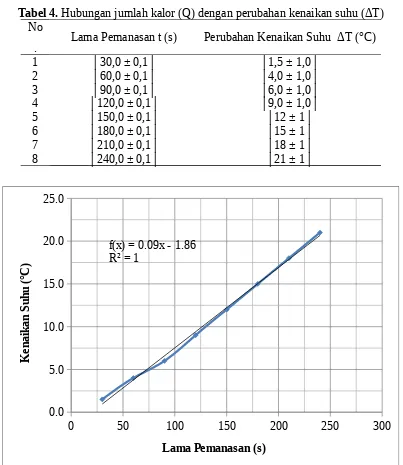
Tabel 4. Hubungan jumlah kalor (Q) dengan perubahan kenaikan suhu (ΔT) No
. Lama Pemanasan t (s) Perubahan Kenaikan Suhu ΔT (°C)
1 │30,0 ± 0,1│ │1,5 ± 1,0│
Grafik 1. Hubungan jumlah kalor (Q) dengan kenaikan suhu (ΔT)
Suhu Awal │40,0 ± 0,5│°C
KR =∆ ∆T7
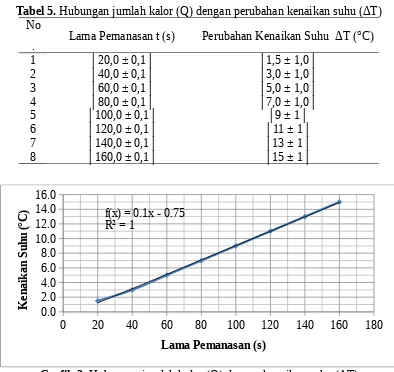
Tabel 5. Hubungan jumlah kalor (Q) dengan perubahan kenaikan suhu (ΔT) No
. Lama Pemanasan t (s) Perubahan Kenaikan Suhu ΔT (°C)
1 │20,0 ± 0,1│ │1,5 ± 1,0│
Grafik 2. Hubungan jumlah kalor (Q) dengan kenaikan suhu (ΔT)
Kegiatan 2
1. Grafik hubungan
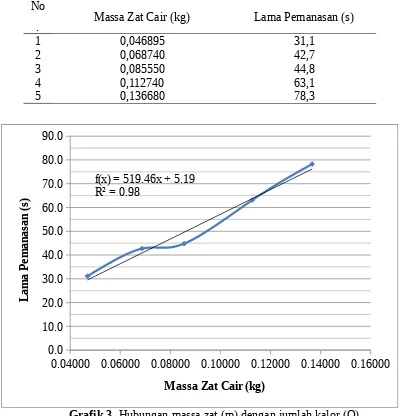
No
. Massa Zat Cair (kg) Lama Pemanasan (s)
1 0,046895 31,1
2 0,068740 42,7
3 0,085550 44,8
4 0,112740 63,1
5 0,136680 78,3
0.04000 0.06000 0.08000 0.10000 0.12000 0.14000 0.16000 0.0
Grafik 3. Hubungan massa zat (m) dengan jumlah kalor (Q) Dari grafik 1 dan 2, dimana lama pemanasan diasumsikan sama dengan jumlah kalor atau t = Q, dapat diketahui bahwa:
Q ~ ΔT
Maksudnya, kalor dapat menaikkan atau menurunkan suhu. Semakin besar kenaikan suhu maka kalor yang diterima semakin banyak. Semakin kecil kenaikan suhu maka kalor yang diterima semakin sedikit. Maka hubungan kalor (Q) berbanding lurus atau sebanding dengan kenaikan suhu (∆ T) jika massa (m) dan kalor jenis zat (c) tetap. Dengan demikian salah satu faktor yang memengaruhi jumlah kalor (Q) yakni perubahan kenaikan suhu (ΔT).
Q ~ m
Maksudnya, Semakin besar massa zat (m) maka kalor (Q) yang diterima semakin banyak. Semakin kecil massa zat (m) maka kalor (Q) yang diterima semakin sedikit. Maka hubungan kalor (Q) berbanding lurus atau sebanding dengan massa zat (m) jika kenaikan suhu (∆ T) dan kalor jenis zat (c) tetap. Dengan demikian faktor lain yang memengaruhi jumlah kalor (Q) adalah massa zat (m).
Dari kedua hubungan di atas, dapat di rumuskan persamaan matematis dari jumlah kalor yakni:
Q ~ ΔT m Q = ΔT × m
Adapun dalam penyetaraannya dibutuhkan suatu konstanta yang dalam persamaan ini menggunakan c yakni kalor jenis dari zat/bahan. Sehingga persamaan akhir untuk jumlah kalor yakni:
Q = m × c × ΔT
Adapun penentuan dari satuan kalor jenis (c) dapat diperoleh dengan menggunakan analisis dimensi dari persamaan matematis jumlah kalor (Q) di atas sebagai berikut.
Q = m × c × ΔT
c = Q m × ∆T
c = kg m 2
s-2 kg × °C
c = M L 2
T-2 Mθ
c = J Kg ℃
Kegiatan 3
Massa kalorimeter kosong dan pengaduknya = │62,400 ± 0,005│ gram
= │95,055 ± 0,01│gram
Massa es batu = │162,705 ± 0,005│gram - │157,455 ± 0,005│gram
= │5,25 ± 0,01│gram
1. Kalor untuk menaikkan 5,25 gram es dari -12 oC sampai 0 oC.
Q1 = mes × ces × ∆T
Q1 = 5,25 × 10-3 kg × 2100 J/kgoC × (0 – (12)oC
Q1 = 11,025 J/oC × 12 oC
Q1 = 132,3 J
Adapun ketidakpastian mutlak hasil perhitungan jumlah kalor 1 (Q1)
Q1 = mes × ces × ∆T
Karena ces bernilai konstan, jadi,
Q1 = mes × ∆T
d Q1 =
|
∂ Q1∂ mes
|
d mes +|
∂ Q1 ∂∆T|
d∆T d Q1 =|∆T|d mes +|
mes|
d∆Td Q1 Q1 =
|
∆T
Q1
|
d mes +|
mes Q1|
d∆Td Q1 Q1 =
|
d mes mes
|
+|
d∆T ∆T
|
∆ Q1Q1 =
|
∆ mes mes|
+|
∆Q 1 =
|
∆ mes mes +∆∆T ∆T
|
Q1∆Q 1 =
|
0,01 × 10 -3 kg 5,25 × 10 -3 kg +1 ℃
12 ℃
|
132,3 J ∆Q 1 =|0,0019 + 0,083|132,3 J∆Q1 = 0,0849 × 132,3 J
∆Q1 = 11,232 J
KR =∆ Q1 Q1
× 100 % = 11,232 J
132,3 × 100 % = 8,5 % (2 AB)
Q1 = │Q1 ± ∆Q1 │= │0,13 ± 0,01│103 J
2. Kalor untuk menaikkan 5,25 gram air dari 0 oC sampai suhu campuran (Tc = 56,9 oC).
Q2 = mes × cair × ∆T
Q2 = 5,25 × 10-3 kg × 4200 J/kgoC × (56,9 – 0) oC
Q2 = 22,05 J/oC × 56,9 oC
Q2 = 1254,645 J
Adapun ketidakpastian mutlak hasil perhitungan jumlah kalor 2 (Q2)
∆ Q2 =
|
∆ mes mes +∆∆T ∆T
|
Q2∆ Q2 =
|
0,01× 10 -3 kg 5,25 × 10-3 kg +1 ℃
∆Q2 = 0,0199 × 1256,645 J
∆Q2 = 25,00 J
KR =∆ Q2 Q2
× 100 % = 25,00 J
1256,645 J × 100 % = 1,9 % (3 AB)
Q2 = │Q2 ± ∆Q2 │= │1,26 ± 0,02│103 J
3. Kalor yang hilang dari 95,055 gram air dengan mendingin dari 64,0 oC sampai suhu campuran (Tc = 56,9 oC).
Q3 = mair × cair × ∆T
Q3 = 95,055 × 10-3 kg × 4200 J/kgoC × (64,0 – 56,9) oC
Q3 = 399,231 J/oC × 7,1oC
Q3 = 2834,54 J
Adapun ketidakpastian mutlak hasil perhitungan jumlah kalor 3 (Q3)
∆ Q3 =
|
∆ mair mair +∆∆T ∆T
|
Q3∆ Q3 =
|
0,01 × 10 -3 kg 95,055 × 10 -3 kg +1 ℃
7,1 ℃
|
2834,54 J ∆ Q3 =|
0,0001 + 0,141|
2834,54 J∆Q3 = 0,1411 × 2834,54 J
∆Q3 = 399,95 J
KR =∆ Q3 Q3
× 100 % = 399,95 J
2834,54 kal × 100 % = 14 % (2 Angka Berarti)
4. Kalor yang hilang dari kalorimeter dengan mendingin dari 64,0 oC sampai suhu campuran (Tc = 56,9oC).
Q4 = mkalorimeter × caluminium × ∆T
Q4 = 62,400 × 10-3 kg × 900 J/kgoC × (64,0 – 56,9) oC
Q4 = 56,16 J/oC × 7,1 oC
Q4 = 398,736 J
Adapun ketidakpastian mutlak hasil pengukuran jumlah kalor 4 (Q4)
∆ Q4 =
|
∆ mkalorimetermkalorimeter +
∆∆T ∆T
|
Q4∆ Q4 =
|
0,01 × 10 -3 kg 62,4× 10 -3 kg +1 ℃
7,1 ℃
|
398,736 J ∆ Q4=|0,00016 + 0,141 |398,736 J∆Q4 = 0,14116 × 398,736 J
∆Q4 = 56,286 J
KR =∆ Q4 Q4
× 100 % = 56,286 J
398,736 J × 100 % = 14 % (2 AB)
Q4 = │Q4 ± ∆Q4│= │0,40 ± 0,06│J
Dalam menentukan kalor lebur es kita menggunakan azas black, yaitu:
Qterima = Qlepas
Q1 + Qes-air + Q2 = Q3 + Q4
Q1 + mes × Les+ Q2 = Q3 + Q4
5,25 × 10-3 kg × Les + 1390 J = 3200 J
Jadi, ketidakpastian mutlak dari kalor lebur es di atas yaitu:
∆L es =
|
400 J menyelidiki hubungan jumlah kalor denga kenaikan suhu. Kegiatan kedua adalah menyelidiki hubungan jumlah kalor dengan massa zat. Sedangkan kegiatan ketiga adalah menentukan kalor lebur es.data perubahan kenaikan suhu untuk suhu awal sebesar │30,0 ± 0,5│°C yang diperoleh untuk masing-masing data secara berurutan yaitu │1,5 ± 1,0│°C; │4,0 ± 1,0│°C; │6,0 ± 1,0│°C; │9,0 ± 1,0│°C; │12 ± 1│°C; │15 ± 1│°C; │18 ± 1│°C; dan │2,1 ± 1,0│°C. Perubahan kenaikan suhu tersebut dibandingkan dengan lama pemanasan yang diasumsikan jumlahnya sama dengan jumlah kalor, dengan data-data secara berurutan yakni: │30,0 ± 0,1│ s; │60,0 ± 0,1│ s; │90,0 ± 0,1│ s; │120,0 ± 0,1│ s; │150,0 ± 0,1│ s; │180,0 ± 0,1│ s; │210,0 ± 0,1│ s; dan │240,0 ± 0,1│ s. Dari grafik diperoleh hasil bahwa jumlah kalor berbanding lurus dengan kenaikan suhu.
Untuk lebih membuktikan hal yang diperoleh pada suhu awal sebelumnya, maka dibuat perbandingan kedua dengan suhu awal dan selang lama pemanasan yang berbeda. Data untuk perubahan kenaikan suhu untuk suhu awal │40,0 ± 0,5│°C secara berurutan yakni: │1,5 ± 1,0│°C; │3,0 ± 1,0│°C; │5,0 ± 1,0│°C; │7,0 ± 1,0│°C; │9 ± 1│°C; │11 ± 1│°C; │13 ± 1│°C; dan│15 ± 1│°C. Adapun lama pemanasan yang digunakan secara berurutan yakni: │20,0 ± 0,1│s; │40,0 ± 0,1│s; │60,0 ± 0,1│s; │80,0 ± 0,1│s; │100,0 ± 0,1│s; │120,0 ± 0,1│s; │140,0 ± 0,1│s; dan │160,0 ± 0,1│s. Dengan membandingkan perubahan kenaikan suhu dengan lama pemanasan melalui grafik, ternyata grafik membentuk garis linear maka dinyatakan bahwa kenaikan suhu berbanding lurus dengan jumlah kalor atau dapat dinyatakan:
Q ∆ T
Q=∆T
Dapat ditarik kesimpulan bahwa kedua variabel ini berbanding lurus. Maksudnya semakin banyak kalor yang diterima maka semakin besar pula kenaikan suhu pada zat cair, begitupula sebaliknya.
zat berbanding lurus dengan jumlah kalor, maksudnya semakin besar massa zat yang digunakan, maka semakin besar pula jumlah kalor yang diterima, begitupula sebaliknya. Peryataan ini dapat dituliskan sebagai:
Q m
Q=m
Jika persamaan gaya magnetik ini dihubungkan dengan persamaan yang didapatkan dari kegiatan pertama dan kedua, maka dapat dirumuskan persamaan kecepatan rambat gelombang yakni:
Q ∆ T Q m Maka
Q=m ∆ T
Dengan c sebagai konstanta maka Q=m c ∆ T
Adapun pada kegiatan pertama dan kedua ini juga dicari satuan dari kalor jenis (c). Dengan melakukan analisis dimensi maka didapatlah satuan dari kalor jenis itu sendiri yakni:
c = J/kg°C
Pada kegiatan ketiga yang dilakukan adalah menentukan kalor lebur es. Adapun cara penentuannya yakni dengan menggunakan Asas Black yang menyatakan bahwa jumlah kalor yang diterima sama dengan jumlah kalor yang di lepaskan. Dalam hal ini kalor lebur es termasuk dalam zat cair yang menerima kalor, sama dengan keadaan ketika es dilelehkan dari suhu awalnya hingga nol derajat yang disebut (Q1), sama pula dengan keadaan ketika es yang sudah mencair memanas hingga suhu campuran (Q2), namun berbeda dengan air yang mendingin setelah dilelehkan es didalamnya (Q3), dan keadaan ketika kalorimeter mendingin akibat hal yang serupa dengan Q3 (Q4). Dengan menerapkan asas black tersebut maka diperolehlah hasil kalor lebur es sebesar │0,34 ± 0,09│106 J/kg.
1. Hubungan antara jumlah kalor (Q) dengan kenaikan suhu (ΔT) adalah berbanding lurus, semakin banyak kalor yang diterima maka kenaikan suhu akan semakin besar, begitupula sebaliknya.
2. Hubungan antara massa zat (m) dengan jumlah kalor (Q) adalah berbanding lurus, semakin banyak jumlah zat maka jumlah kalor yang diterima juga semakin besar, begitupula sebaliknya.
3. Persamaan matematis dari pecobaan suhu dan kalor ini diperoleh dengan mencari hubungan jumlah kalor (Q) dengan kenaikan suhu (ΔT) dan jumlah kalor (Q) dengan massa zat (m), yang secara keseluruhan berbanding lurus. Sehingga dapat dituiskan sebagai:
Q=m c ΔT
4. Kalor lebur es yang diperoleh berdasarkan percobaan ini dapat dituliskan sebagai berikut.
Les = │Les ± ∆Les│= │0,34 ± 0,09│106 J/kg
Saran
Sebaiknya praktikan meningkatkan ketelitiannya sehingga dalam melakukan percobaan tidak terjadi kesalahan yang berakibat fatal. Sama halnya dalam melakukan prosedur kerja diharapkan lebih konsentrasi sehingga tidak perlu mengulang-ulang dalam memperoleh data seperti praktikan sebelumnya.
Adapun kepada kakak asisten untuk lebih memperhatikan praktikan agar kesalahan yang bisa terjadi lebih diminimalkan dan percobaan dapat berlangsung lancar.
Kepada laboran diharapkan agar alat dan bahan yang digunakan dapat diganti jika memang sudah tidak dapat digunakan dan lebih dilengkapi agar kesalahan kalibrasi dapat dihindari.
DAFTAR RUJUKAN
Giancoli, Douglas C. 2001. Fisika (Edisi 5 Jilid 1), terjemahan Dra. Yuhilza Hanum, M.Eng., dkk. Jakarta:Erlangga
Tipler, Paul A. 1998. Fisika untuk Sains dan Teknik (Edisi 3 Jilid 1), terjemahan Dr. Lea Prasetio, M.Sc, dkk. Jakarta: Erlangga