VI. PEMBAHASAN
Protein merupakan suatu zat makanan yang amat penting bagi tubuh, karena zat ini di samping berfungsi sebagai bahan bakar dalam tubuh juga berfungsi sebagai zat pembangun dan pengatur (Winarno, 1992). Protein adalah senyawa organik kompleks yang mengandung asam amino yang terikat satu sama lain melalui ikatan peptida. Protein mengandung atom karbon, oksigen, nitrogen, dan sulfur. Kandungan protein dalam bahan pangan bervariasi, baik dalam jumlah maupun jenisnya. Bahan pangan hewani, leguminose, dan serealia umumnya mengandung protein yang tinggi (Kusnandar, 2010). Meskipun kandungan protein dalam jaringan tanaman kurang dari 1 % dari berat bahan segar, namun mempunyai peranan penting yaitu sebagai unsur struktural membran sel dan sebagai biokatalisator (Tranggono, 1990).
Protein merupakan salah satu makromolekul yang penting dalam bahan pangan. Oleh karena itu, disamping perlu memahami struktur protein dan peranannya dalam produk pangan, baik sebagai sumber gizi maupun karena sifat fungsionalnya, maka perlu diketahui juga bagaimana cara penetapan (analisisnya). Analisis protein penting untuk keperluan pelabelan gizi, mengetahui sifat fungsional dan penentuan sifat biologis protein. Analisis protein juga perlu dilakukan untuk mengetahui kandungan total protein dari suatu bahan pangan, jumlah protein tertentu dalam suatu campuran, kandungan protein hasil dari suatu isolasi dan purifikasi protein, kandungan non-protein nitrogen, komposisi asam amino dan nilai gizi protein (Andarwulan, 2011).
Analisis protein cukup kompleks disebabkan terdapat komponen-komponen pangan lain yang memiliki sifat fisika-kimia yang mirip yang dapat memengaruhi pengukuran. Sebagai gambaran, nitrogen bukan hanya terdapat pada protein, tetapi juga pada komponen non-protein, seperti asam amino bebas, peptida berukuran kecil, asam nukleat, fosfolipid, gula amin, porfirin, dan beberapa vitamin, alkaloid, asam urat, urea, dan ion amonium. Dengan demikian, total nitrogen organik dari bahan pangan bukan hanya berasal dari protein, tetapi juga ada sebagian kecil dari komponen-komponen non-protein yang mengandung nitrogen yang ikut terukur. Tergantung pada metode analisis yang digunakan,
komponen pangan lainnya, seperti lipid dan karbohidrat, dapat memengaruhi hasil analisis pangan (Andarwulan, 2011).
Terdapat banyak metode analisis penetapan protein yang telah dikembangkan. Prinsip dasar dari penetapan protein ini berbeda-beda. Ada penetapan protein yang berdasarkan pada pengukuran kadar nitrogen total, ikatan peptide, asam amino aromatik, kapasitas pengikatan zat warna, sifat absorpsi sinar ultraviolet oleh protein dan sifat light scattering. Di dalam memilih metode analisis mana yang akan digunakan, perlu mempertimbangkan jenis contoh yang akan dianalisis, tujuan analisis, faktor sensitivitas, akurasi, ketelitian, kecepatan dan biaya analisis. Disamping itu, terdapat prosedur analisis untuk penetapan sifat fungsional protein, seperti mengukur kemampuan protein dalam mengikat air, membentuk gel, mengikat lemak sebagai emulsifier, membentuk buih, dan sebagainya (Andarwulan, 2011).
Kadar protein bahan dan produk pangan dapat ditentukan dengan berbagai jenis metode analisis. Diantara metode analisis protein yang sering digunakan adalah metode Kjeldahl, metode Biuret, metode Lowry, metode pengikatan zat warna dan metode titrasi formol (Andarwulan, 2011).
Pada praktikum kali ini dilakukannya penetapan kadar protein dengan menggunakan metode Kjeldahl dan metode Biuret.
6.1 Penentuan Kadar Protein Metode Kjeldahl
Metode Kjeldahl yang telah dikembangkan untuk menganalisis contoh protein dengan kandungan protein sangat kecil (mikrogram). Cara Kjeldahl digunakan untuk menganalisis kadar protein kasar dalam bahan makanan secara tidak langsung, karena yang dianalisis dengan cara ini adalah kadar nitrogennya. Akan tetapi secara teknis hal ini sulit sekali dilakukan dan mengingat jumlah kandungan senyawa lain selain protein dalam bahan biasanya sangat sedikit, maka penentuan jumlah N total ini tetap dilakukan untuk mewakili jumlah protein yang ada. Dasar perhitungan penentuan protein menurut Kjeldahl ini adalah penelitian dan pengamatan yang menyatakan bahwa umumnya protein alamiah mengandung unsur N rata-rata 16% (dalam protein murni). Untuk senyawa-senyawa protein tertentu yang telah diketahui kadar unsur N-nya, maka angka yang lebih tepat dapat dipakai (Sudarmadji, 2010). Oleh karena itu, untuk mengubah dari kadar
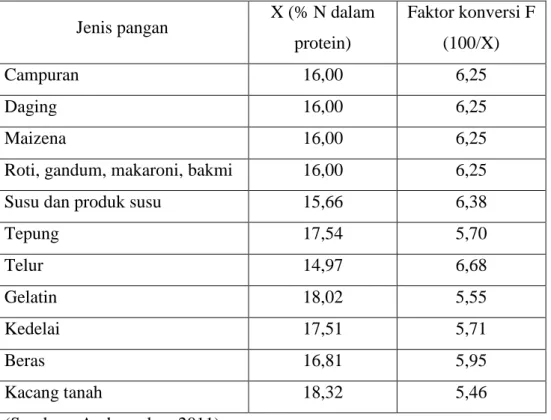
nitrogen ke dalam kadar protein, digunakan angka konversi sebesar 100/16 atau 6,25. Namun demikian, untuk beberapa jenis bahan pangan faktor konversi yang digunakan berbeda (tabel 5.1).
Tabel 6.1.1 Faktor yang Digunakan untuk Konversi Nitrogen menjadi Protein Jenis pangan X (% N dalam
protein) Faktor konversi F (100/X) Campuran 16,00 6,25 Daging 16,00 6,25 Maizena 16,00 6,25
Roti, gandum, makaroni, bakmi 16,00 6,25
Susu dan produk susu 15,66 6,38
Tepung 17,54 5,70 Telur 14,97 6,68 Gelatin 18,02 5,55 Kedelai 17,51 5,71 Beras 16,81 5,95 Kacang tanah 18,32 5,46 (Sumber : Andarwulan, 2011)
Dalam penetapan protein metode Kjeldahl, contoh yang akan dianalisis harus dihancurkan (destruksi) dahulu secara sempurna sehingga seluruh karbon dan hidrogen teroksidasi dan nitrogen diubah menjadi amonium sulfat. Proses penghancuran ini dilakukan dengan menambahkan asam kuat pekat (asam sulfat) ke dalam contoh dan proses pemanasan pada suhu tinggi sehingga dihasilkan larutan berwarna jernih yang mengandung amonium sulfat. Untuk mempercepat proses penghancuran ini, ditambahkan juga katalisator. Selanjutnya didistilasi, distilat ditampung ke dalam beaker yang berisi larutan asam borat. Ion borat ini kemudian dititrasi dengan menggunakan asam standar. Hasil yang diperoleh merupakan kandungan protein kasar. Dalam analisis juga diperlukan contoh blanko yang akan digunakan sebagai faktor koreksi dalam perhitungan kadar protein (Andarwulan, 2011). Prosedur Kjeldahl dapat dibagi menjadi 3 tahapan, yaitu :
1. Tahap penghancuran (destruksi) 2. Netralisasi dan distilasi
3. Titrasi
Pada praktikum kali ini sampel yang akan ditentukan kadar proteinnya adalah Beras kacang merah, beras kacang hijau, kopi arabika, kornet dan susu UHT. Pertama hal yang harus dilakukan pada praktikum kali ini yaitu fasa destruksi. Pada fasa destruksi ini timbang sampel sebanyak ± 0,1 gram, kemudian masukkan dalam labu Kjeldahl. Tambahkan 0,9 gram K2SO4, 0,4 g HgO, dan 2 ml H2SO4, didihkan sampai cairan menjadi jernih. Penambahan asam sulfat pekat ini untuk memanaskan sampel sehingga terjadi destruksi menjadi unsur-unsurnya. Elemen karbon, hidrogen teroksidasi menjadi CO, CO2 dan H2O, sedangkan nitrogennya (N) akan berubah menjadi (NH4)2SO4. Tahap ini sangat penting, karena akan membebaskan nitrogen dari contoh. Penambahan HgO yaitu agar proses penghancuran ini berjalan sempurna dan berjalan cepat, sedangkan penambahan K2SO4 sebagai katalisator dapat menaikkan titik didih asam sulfat, sehingga destruksi berjalan cepat. Setiap 1 gram K2SO4 dapat menaikkan titik didih 3 °C. Suhu destruksi berkisar antara 370 - 410 °C. Reaksi yang terjadi selama proses destruksi adalah sebagai berikut :
HgO + H2SO4 HgSO4 + H2O
2HgSO4 Hg2SO4 + SO2 + 2On
Hg2SO4 + 2H2SO4 2HgSO4 + 2H2O + SO2
(CHON) + On + H2SO4 CO2 + H2O + (NH4)2SO4
Proses destruksi sudah selesai apabila larutan menjadi berwarna hijau bening. Agar analisa lebih tepat, maka pada tahap destruksi ini dilakukan pula perlakuan blanko yaitu untuk koreksi adanya senyawa N yang berasal dari reagensia yang digunakan.
Gambar 6.1.2 Rangkaian alat untuk proses destruksi pada penetapan protein metode Kjeldahl
(Sumber : Andarwulan, 2011)
Setelah dilakukannya destruksi, lalu dilakukannya netralisasi dan destilasi. Pertama bilas dengan akuades untuk memastikan bahwa tidak ada larutan hasil destruksi yang tertinggal, masukkan dalam alat destilasi. Pada alat destilasi dibawah kondensor kemudian dipasang erlenmeyer yang berisi 15 ml larutan H3BO3 3% dan 3 tetes indikator metil merah. Tambahkan 10 ml NaOH ke dalam alat destilasi, lalu dilakukan distilasi sehingga tertampung dalam alat kira-kira 150 ml destilat dalam erlenmeyer. Setelah tertampung sekitar 150 ml, dilakukannya uji lakmus. Apabila warna tidak berubah, maka proses destilasi telah selesai. Pada tahap destilasi, penambahan NaOH digunakan menetralkan asam sulfat. Dengan adanya larutan NaOH ini , maka ammonium sulfat dipecah menjadi gas amoniak (NH3). Melalui proses destilasi, gas amoniak ini kemudian akan menguap dan ditangkap oleh asam borat (H3BO3) membentuk NH4H2BO3.
Reaksi yang terjadi selama proses netralisasi dan destilasi adalah sebagai berikut : (NH4)2SO4 + 2 NaOH Na2SO4 + 2 H2O + 2 NH3
2 NH3 + 2 H3BO3 2 NH4H2BO3
Tahap selanjutnya dilakukannya titrasi dengan menggunakan HCl 0,01 N hingga terjadi perubahan warna menjadi merah muda bening sehingga asam borat terlepas kembali dan terbentuk amonium klorida. Jumlah asam klorida yang digunakan untuk titrasi setara dengan jumlah gas NH3 yang dibebaskan dari proses distilasi. Dengan prinsip stokiometri, maka akan diperoleh kesetaraan 1 mol HCL = 1 mol N = 14 g N. Reaksi yang terjadi selama proses titrasi sebagai berikut :
2 NH4H2BO3 + 2 HCl 2 NH4Cl + 2 H3BO3
Penggabungan tahap reaksi selama proses distilasi dan titrasi, persamaan tersebut dapat disederhanakan menjadi :
2 NH3 + 2 HCl 2 NH4Cl
Penetapan yang sama juga dilakukan untuk blanko yang akan digunakan sebagai faktor koreksi dalam perhitungan. Perhitungan yang digunakan adalah sebagai berikut : ( ) ( ) Keterangan : N HCl = 0,02 N Ar N = 14,007 ( )
Keterangan : faktor konversi = 100/ (% N dalam protein contoh). Faktor konversi tergantung dari jenis contoh dan dapat menggunakan informasi pada tabel 6.1.
Berdasarkan hasil percobaan yang dilakukan, didapatkan hasil sebagai berikut. Data di atas menunjukkan bahwa yang memiliki kadar protein paling besar pada kopi arabika (kelompok 8)sebesar 13,44% sedangkan yang paling kecil pada susu UHT (kelompok 5) sebesar 2,93%. Kacang-kacangan mempunyai kandungan protein 2,9 – 8,2 % dari berat bahan segarnya dan sebagian besar protein ini dalam bentuk simpanan, sehingga hasil pengamatan untuk beras kacang merah dan hijau sudah sesuai dengan literature. Kedelai seringkali mempunyai kandungan protein lebih dari 40 % atas dasar berat bahan keringnya. Menurut literatur kadar protein yang paling besar berbeda dengan hasil percobaan. Kadar protein yang paling besar yaitu pada kacang kedelai.
Dari hasil perhitungan menunjukkan bahwa terjadi variasi antara kadar protein sampel hasil perhitungan pada praktikum ada yang tidak terlalu jauh berbeda, namun ada juga yang tidak sesuai dengan literatur. Ada beberapa faktor yang mempengaruhi yaitu jenis sampel yang digunakan memungkinkan berbeda
dengan sampel yang digunakan oleh Tabel Komposisi Pangan Indonesia (TKPI). Angka yang dihasilkan dari pengamatan dengan literatur sangat berbeda kontaminasi dari bahan lain pada peralatan dimana peralatan tersebut mengandung N sehingga total N yang di analisis bukan dari sampel saja tapi juga dari kontaminan serta ketidaktelitian praktikan yang membuat hasil akhirnya menjadi berbeda. Hasil akhir titrasi yang terlalu pekat atau melebihi volume merupakan salah satu faktor berbedanya hasil dengan literatur. Selain itu pada metode Kjeldhal nitrogen yang dihitung merupakan nitrogen total pada bahan sehingga sumber nitrogen yang bukan berasal dari protein juga ikut terhitung. Kadar protein yang ditentukan berdasarkan cara Kjeldahl ini disebut sebagai kadar protein kasar (crude protein) karena terikut senyawaan N bukan protein, misalnya urea, asam nukleat, ammonia, nitrat, nitrit, asam amino, amida, purin, dan pirimidin (Sudarmadji dkk., 1996). Hal tersebut merupakan salah satu kekurangan dari metode Kjeldhal. Kelebihan metode Kjeldhal adalah bisa diterapkan pada semua bahan pangan, relatif sederhana, dan murah.
Kelebihan dari metode Kjeldahl ini dapat digunakan untuk analisis protein semua jenis bahan pangan. Prosedur penetapannya tidak membutuhkan biaya mahal dan hasilnya cukup akurat. Salah satu kelemahan dari metode Kjeldahl adalah metode ini mengukur bukan hanya nitrogen pada protein, tetapi juga nitrogen dalam protein menjadi sangat penting untuk digunakan sebagai faktor konversi dalam perhitungan.
6.2 Penentuan Kadar Protein Metode Biuret
Metode Biuret merupakan salah satu cara yang terbaik untuk menentukan kadar protein suatu larutan. Dalam larutan basa, Cu2+ akan membentuk kompleks dengan ikatan peptida suatu protein, sehingga menghasilkan warna ungu yang dapat didentifikasi dengan spektrofotometer pada panjang gelombang 520 nm. Absorbansi ini berbanding langsung dengan kosentrasi protein dan tidak tergantung jenis protein karena seluruh protein pada dasarnya mempunyai jumlah ikatan peptida yang sama persatuan berat.
Sebelum praktikum dilakukan sebaiknya dilakukan dulu preparasi sampel. Sampel yang digunakan pada praktikum kali ini seharusnya berbentuk cair, apabila padat maka harus diberi beberapa perlakuan terlebih dahulu. Sampel harus
diblender dan dihancurkan, lalu ditambahkan air lalu saring dan disentrifuge supernatant (soluble protein), perhatikan faktor pengencerannya. Jika cairan sudah berupa larutan protein maka persiapan selanjutnya cukup dengan pengenceran secukupnya.
Namun apabila campuran masih keruh, maka harus ditambahkan 1 ml TCA 10%, TCA berfungsi untuk menghilangkan zat-zat pengotor yang dapat mengganggu reaksi, terutama fenol atau gula. Setelah itu disentifuge dan TCA dapat mendenaturasi protein yang mengendap. Lalu tambahkan 2 ml etil eter yang berfungsi untuk menghilangkan sisa-sisa TCA yang ada pada endapan protein. Setelah itu disentrifuge kembali dan dilakukan prosedur selanjutnya untuk melakukan penentuan kadar protein dengan menggunakan pereaksi biuret.
Pada praktikum kali ini sampel yang digunakan adalah telur puyuh, telur bebek, susu steril, susu pasteurisasi, sari kacang hijau, telur ayam kampung, telur ayam negeri, susu UHT, yoghurt, dan sari kacang kedelai. Setelah itu ditambahkan 6 ml pereaksi biuret. Setelah itu gojok-gojok dan diamkan pada suhu kamar selama 10 menit (warna ungu), lalu ukur absorbansinya pada 540 nm. Hitung kadar protein dalam sampel dengan kurva standar. Setelah itu masukkan kembali sampel albumin 0,5 ml kedalam 6 tabung reaksi yang masing-masing ditambahkan larautan protein standar atau BSA sebanyak 0,1 ml, 0,2 ml, 0,4 ml, 0,6 ml, 0,8 ml dan 1 ml. Pemilihan standard protein merupakan penentu keberhasilan analisis kuantitatif. Bovine Serum Albumin (BSA) adalah protein yang umum digunakan sebagai standard dalam penetapan kadar protein. BSA banyak dipilih karena tingkat kemurniannya yang tinggi dan harganya relatif murah. Selain keenam tabung reaksi tersebut juga harus dibuat blanko, yaitu tabung reaksi yang hanya berisi larutan protein standar/ BSA dan air yang berfungsi sebagai standar. Blanko berwarna biru muda dan semakin banyak jumlah yang dimasukkan kedalam sampel, maka warna larutan akan semakin menjadi tua. Setelah itu masing-masing tabung reaksi dimasukkan air sebanyak 4 ml dan 6 ml pereaksi biuret, lalu campur merata. Setelah itu simpan tabung reaksi pada suhu kamar selama 30 menit, seharusnya lebih baik disimpan pada suhu 37° C agar reaksi yang terjadi bisa lebih cepat. Pada perlakuan ini terjadi reaksi albumin dengan perekasi biuret membentuk senyawa kompleks yang
berwarna ungu. Reaksi yang terjadi adalah ikatan peptida pada protein berekasi dengan Cu2+ dalam alkalinitas untuk membentuk warna ungu dengan absorbansi maximum λ=540 nm asam amino dan ion-ion Cu2+
dari senyawa kompleks berwarna biru. Metode ini tepat untuk produk tepung-tepungan, gandum, darah, dan anggur. Berikut ini adalah reaksinya:
Protein + (CuSO4++NaOH 20 %) biru lembayung/ungu.
Setelah terbentuk warna ungu sempurna ukur absorbansinya 540 nm dan buat kurva. Namun pada metode ini ada hal-hal yang mengganggu percobaan ini diantaranya adalah adanya urea (mengandung gugus -CO-NH-) dan gula preduksi yang bereaksi dengan Cu2+.
Metode penentuan kadar protein dengan menggunakan pereaksi biuret hampir sama dengan penentuan kadar protein dengan metode lowry, sama-sama menggunakan CuSO4 hanya saja reagennya berbeda. Pada lowry harus ditambahkan asam fosfomolibdat dan asam fosfotungstat yang akan direduksi oleh tiroksin dan triptofan yang membentuk warna biru dengan absorbansi 650 nm. Namun lowry mempunyai kelamahan yang sangat fatal. Kelemahannya terletak pada tiroksin dan triptofan yang menjadi dasar untuk menentukan kandungan protein pada makanan, namun pada dasarnya triptofan dan tiroksin bisa tidak sesuai dengan kadungan protein yang ada pada beberapa jenis produk pangan dan mengacaukan hasil akhir.
Dari hasil juga bisa diketahui bahwa nilai a yang didapat sebesar 0,0218, nilai b adalah 0,0013 sehingga di dapat nilai y = 00,0218 x + 0,0013. Jika nilai r yang didapat adalah satu atau mendekati satu maka nilai yang didapat sudah cukup akurat. Dari literatur yang ada, nilai protein yang terkandung dalam albumin putih telur adalah sebanyak 10 – 12 %.
VII. KESIMPULAN
Dalam praktikum kali ini dapat diambil beberapa kesimpulan
Faktor yang menyebabkan ketidaktepatan hasil pengamatan dengan literatur adalah kontaminasi dari bahan lain pada peralatan dimana yang mengandung N, hasil akhir titrasi yang terlalu pekat atau melebihi volume, dan berbagai kesalahan praktikan lainnya.
Kelebihan dari metode Kjeldahl ini dapat digunakan untuk analisis protein semua jenis bahan pangan. Prosedur penetapannya tidak membutuhkan biaya mahal dan hasilnya cukup akurat.
Kelemahan dari metode Kjeldahl adalah metode ini mengukur bukan hanya nitrogen pada protein, tetapi juga nitrogen dalam protein menjadi sangat penting untuk digunakan sebagai faktor konversi dalam perhitungan.
Metode penentuan kadar protein dengan menggunakan pereaksi biuret hampir sama dengan penentuan kadar protein dengan metode lowry, sama-sama menggunakan CuSO4 hanya saja reagennya berbeda.
Dalam larutan basa, Cu2+
akan membentuk kompleks dengan ikatan peptida suatu protein, sehingga menghasilkan warna ungu yang dapat didentifikasi dengan spektrofotometer pada panjang gelombang 520 nm. Reaksi yang terjadi adalah ikatan peptida pada protein berekasi dengan
Cu2+ dalam alkalinitas untuk membentuk warna ungu dengan absorbansi maximum λ=540 nm asam amino dan ion-ion Cu2+
dari senyawa kompleks berwarna biru.
DAFTAR PUSTAKA
Andarwulan, Nuri. 2011. Analisis Pangan. Penerbit : Dian Rakyat, Jakarta.
Buckle KA et.al. 2007. Ilmu Pangan. Purnomo H, Adiono, penerjemah. Terjemahan dari Food Science. Jakarta: UI Press.
Dennison, C., 2002, A Guide to Protein Isolation, Kluwer Academic Publishers, New York.
K. Mahmud, Mien dkk. 2008. Tabel Komposisi Pangan Indonesia (TKPI). Penerbit PT Elex Media Komputindo, Jakarta.
Kusnandar, Feri. 2010. Kimia Pangan Komponen Makro. Penerbit : Dian Rakyat, Jakarta.
Poedjiadi, Anna & Titin Supriyatin. 2006. Dasar-Dasar Biokimia edisi revisi. UI Press:Jakarta
Romanoff, Romanoff. 1963. The Avian Eds. NY: John Wiley&Sons.
Sudarmaji, Bambang Haryono, & Suhardi. 1996. Analisa Bahan Makanan dan
Pertanian.Liberty:Yogyakarta
Sudarmadji, Slamet. 2010. Analis Bahan Makanan dan Pertanian. Penerbit : Liberty, Jakarta.
Tranggono, Setiaji B., Suhardi, Sudarmanto, Y. Marsono, Agnes Murdianti, Indah S.U., dan Suparmo. Biokimia Pangan. Pusat Antar Universitas Pangan dan gizi, UGM.
Winarno, F.G. 1992. Kimia Pangan dan Gizi. Penerbit : PT Gramedia Pustaka Utama, Jakarta.