BAB III
TINJAUAN PT. KIMIA FARMA (Persero) Tbk.
3.1 Tinjauan Umum PT. Kimia Farma (Persero) Tbk. 3.1.1 Sejarah Perusahaan
PT. Kimia Farma (Persero) Tbk. Plant Medan adalah unit produksi yang memproduksi obat-obatan. Distribusi obat-obatan PT. Kimia Farma (Persero) Tbk. Plant Medan dikelola oleh Unit Logistik Sentral yang ada di Jakarta. PT. Kimia Farma (Persero) Tbk. Plant Medan yang merupakan Badan Usaha Milik Negara (BUMN) dibentuk sebagai Perusahaan pada tanggal 16 Agustus 1971. Sejak berdiri hingga sekarang ini, PT.Kimia Farma (Persero) Tbk telah mengalami beberapa perubahan yaitu:
A. Periode I (1957-1959)
Periode ini adalah periode dimana pemerintah melaksanakan nasionalisasi perusahaan farmasi milik bangsa Belanda yang ada di Indonesia. Program nasionalisasi ini dikoordinasi oleh Badan Pengambil Alihan Perusahaan Farmasi (BAPPHAR). Adapun perusahaan farmasi milik Belanda tersebut yaitu: 1. NV. Rathkamp dan NV Bavosta di Jakarta.
2. NV. Bandoengsche Kinine Fabriek di Bandung. 3. NV. Ordeniming Iodium Watudakon di Mojokerto. 4. NV. Industri Tella di Surabaya.
5. CV. Apotek Malang di Malang.
B. Periode II (1960-1968)
Periode ini adalah periode pembentukan Perusahaan Negara Farmasi (PNF) dari perusahaan-perusahaan farmasi milik Belanda yang telah dinasionalisasikan sebelumnya. Pembentukan PNF ini berdasarkan PP Nomor 60/1961 dibawah koordinasi Badan Pimpinan Umum Farmasi Negara sebagai peleburan BAPPHAR yang bernaung dibawah Departemen Kesehatan.
Perusahaan-perusahaan yang didirikan adalah: 1. PNF. Radja Farma (ex. Rathkamp) di Jakarta. 2. PNF.Nurani Farma (ex. Van Gorkom) di Jakarta. 3. PNF. Nakula Farma (ex. Bavosta) di Jakarta. 4. PNF. Bhinneka Kina Farma di Bandung
5. PNF. Sari Husana (ex. Sari Delle) di Yogyakarta. 6. PNF. Kasa Husada (ex. Varbanstaffen) di Surabaya. 7. PNF. Biofarma (ex. Pasteur Institute) di Bandung. C. Periode III (1969-1970)
Untuk meningkatkan efisiensi setiap BUMN, dikeluarkan Instruksi Presiden Nomor 17/1967 sehingga Departemen Kesehatan melebur perusahaan-perusahaan milik negara tersebut ke dalam perusahaan-perusahaan Negara Farmasi dan Alat-alat Kesehatan Bhinneka Kimia Farma, PNF Kasa Husada di Surabaya diubah menjadi perusahaan umum dan perusahaan daerah, kemudian PNF Sari Husada di Yogyakarta berdiri sendiri sebagai anak perusahaan.
D. Periode IV (1971-2001)
Farmasi dan Alat-alat Kesehatan Bhinneka Kimia Farma setelah melalui proses audit dinyatakan lulus untuk menjadi Perseroan Terbatas (PT) yang selanjutnya disahkan pada tanggal 16 Agustus 1971 sebagai PT. Kimia Farma (Persero) dengan Akta Notaris dan diumumkan dalam lembaran berita negara.
E. Periode V (2001-sekarang)
Pada periode ini tepatnya tanggal 28 Juni 2001 PT. Kimia Farma (Persero) menjadi perusahaan terbuka (Tbk) dengan nama PT. Kimia Farma (Persero) Tbk. dimana untuk privatisasi tahap I saham yang lepas adalah sebanyak 9% dengan rincian 3% untuk program Kepemilikan Saham Karyawan dan Manajemen (KSKM) PT. Kimia Farma, dan sebanyak 6% untuk masyarakat umum.
Kimia Farma Tbk. adalah Badan Usaha Milik Negara (BUMN) yang dipimpin oleh Direktur Utama yang membawahi empat direktur, yaitu Direktur Umum dan Personalia, Direktur Pemasaran, Direktur Keuangan, dan Direktur Produksi. Pada tanggal 4 Januari 2003, PT. Kimia Farma Tbk. Melepas divisi Apotek dan PBF menjadi dua anak perusahaan, yaitu Apotek Kimia Farma menjadi PT. Kimia Farma Apotek dan PBF Kimia Farma menjadi PT.Kimia Farma Trading and Distribution (Kimia Farma, 2013).
3.1.2 Visi dan Misi Perusahaan A. Visi perusahaan
B. Misi perusahaan
Menghasilkan pertumbuhan nilai korporasi melalui usaha di bidang-bidang:
1. Industri kimia dan farmasi dengan basis penelitian dan pengembangan produk yang inovatif.
2. Perdagangan dan jaringan distribusi.
3. Pelayanan kesehatan yang berbasis jaringan retail farmasi dan jaringan pelayanan kesehatan lainnya.
4. Pengelolaan aset-aset yang dikaitkan dengan pengembangan usaha perusahaan.
3.1.3 Struktur Organisasi
PT. Kimia Farma dipimpin oleh seorang Direktur Utama sebagai pimpinan tertinggi yang bertugas memimpin seluruh direktorat yang bersifat operasional (produksi dan pemasaran) maupun yang bersifat penunjang (keuangan dan umum) dan bertanggung jawab kepada dewan komisaris. Direktur utama dibantu oleh 4 direksi yaitu:
1. Direktur Produksi dan Supply Chain
Meliputi: Plant Jakarta, Plant Bandung, Plant Watudakon Surabaya, Plant Medan, Plant Semarang, unit logistik sentral, riset pengembangan dan pengadaan.
2. Direktur Pengembangan Bisnis
3. Direktur Keuangan
Meliputi: keuangan corporate, akutansi corporate, anggaran dan investasi serta teknologi informasi.
4. Direktur Umum dan Human Capital
Meliputi: Sumber Daya Manusia, aset dan properti, pengadaan dan umum corporate.
3.1.4 Production Plant
A. Plant Jakarta, DKI Jakarta
Satu-satunya pabrik di Indonesia yang ditugaskan pemerintah untuk memproduksi obat golongan narkotika dan memproduksi ARV lini I & II. Memperoleh sertifikat Cara Pembuatan Obat yang Baik (CPOB), ISO-9001, dan mendapat rating “A” dari Badan POM. Mendapatkan Proper Biru dalam pengolahan limbah dari KLH dan penghargaan Gubernur DKI untuk Ketaatan & Kinerja Pengelolaan Lingkungan.
B. Plant Bandung, Jawa Barat
C. Plant Semarang, Jawa Tengah
Khusus memproduksi minyak jarak, minyak nabati, dan kosmetika (bedak).Telah menerapkan sistem manajemen mutu ISO-9001 dan mendapatkan sertifikat Cara Pembuatan Kosmetika yang Baik (CPKB).
D. Plant Watudakon, Jombang, Jawa Timur
Satu-satunya pabrik pengolah tambang iodium di Indonesia.Telah mendapatkan sertifikat CPOB serta ISO-9001 dan ISO 14001. Memproduksi bahan baku ferro sulfat sebagai bahan utama pembuatan tablet besi untuk obat penambah darah, serta kapsul lunak “yodiol”. Juga memproduksi obat dalam sediaan tablet, tablet salut, salep, sirup, dan cairan obat luar/dalam.
E. Plant Tanjung Morawa, Sumatera Utara
Memasok kebutuhan obat di wilayah Sumatera. Mendapatkan sertifikat Cara Pembuatan Obat yang Baik (CPOB) serta mendapat rating “A” untuk sertifikasi dari Badan POM. PT. Kimia Farma (Persero) Tbk Plant Medan telah mendapatkan sertifikat ISO 9001:2008 mengenai Sistem Manajemen Mutu untuk Pembuatan Produk Farmasi yang mulai berlaku sejak tanggal 7 Januari 2011 sampai 17 Januari 2017.
Dengan adanya Surat Keputusan Direksi Nomor 14/DIR/VI/2004 pada tanggal 14 Juni 2004 maka PT. Kimia Farma (Persero) cabang Medan berubah menjadi PT. Kimia Farma (Persero) Tbk. Plant Medan. Distribusi obat-obatan dikelola oleh Unit Logistik Sentral (ULS) yang berada di Jakarta.Unit Logistik Sentral (ULS) ini nantinya yang mendistribusikannya melalui PT. Kimia Farma
3.1.5 Produk-produk
Produk-produk yang dihasilkan perusahaan ini adalah: 1. Produk Ethical.
2. Produk Over The Counter (OTC). 3. Produk Generik Berlogo.
4. Produk lisensi dari beberapa perusahaan asing yaitu: Sankyo (Jepang),
Heinrich (Jerman), dan Solvay Duphar (Belanda).
5. Produk kontrasepsi.
6. Produk-produk penugasan pemerintah (narkotika). 7. Produk Fitofarmaka.
3.2 Tinjauan Khusus PT. Kimia Farma (Persero) Tbk. Plant Medan 3.2.1 Personalia
Personalia pada PT. Kimia Farma (Persero) Tbk. Plant Medan per Januari 2014 berjumlah 56 orang yang berstatus pegawai tetap dan 33 orang pegawai tidak tetap. Susunan pegawai tetap menurut tingkat pendidikan yaitu apoteker 5 orang, sarjana (S1) 10 orang, sarjana muda (D3) 12 orang, SAA 3 orang, SMA 35 orang, SMP 7 orang dan SD 16 orang.
PT. Kimia Farma (Persero) Tbk. Plant Medan dipimpin oleh seorang Plant
Manager yang membawahi:
• Bagian Perencanaan Produksi dan Pengendalian Inventori, terdiri dari:
- Supervisor Pengendalian Bahan dan Proses Produksi
Nissan
• Bagian Produksi, yang terdiri dari :
- Supervisor Pengolahan Krim dan Pengemasan Krim
- Supervisor Pengemasan Sekunder
- Supervisor Pengolahan Tablet dan Kapsul
• Bagian Pemastian Mutu, yang terdiri dari :
- Supervisor Sistem Mutu
• Supervisor Pengawasan Mutu
• Supervisor Pembelian
• Supervisor Teknik dan Pemeliharaan
• Supervisor Umum dan Sumber Daya Manusia
• Supervisor Akuntansi dan Keuangan 3.2.2 Letak dan Lokasi
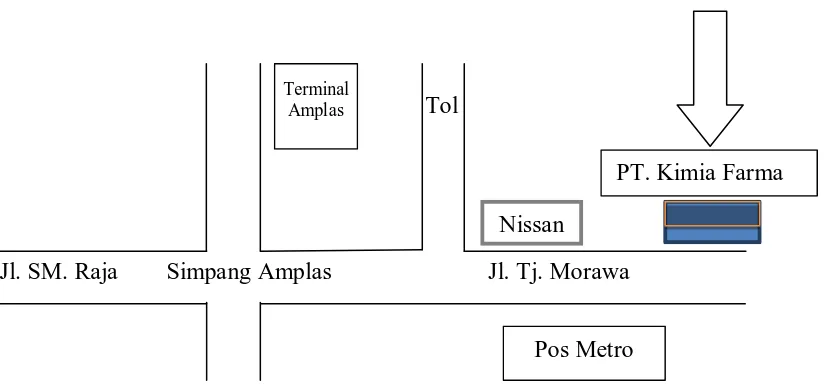
PT. Kimia Farma (Persero) Tbk. Plant Medan terletak di Jalan Raya Tanjung Morawa Km. 9 No. 59, Medan. Denah lokasi PT. Kimia Farma (Persero) Tbk. Plant Medan ditunjukkan pada Gambar 3 berikut ini.
Tol
Jl. SM. Raja Simpang Amplas Jl. Tj. Morawa
Gambar 3 Denah Lokasi PT. Kimia Farma Plant Medan
PT. Kimia Farma Terminal
Amplas
3.2.3 Bangunan dan Fasilitas
PT. Kimia Farma (Persero) Tbk. Plant Medan terletak di Jalan Raya Tanjung Morawa Km. 9 No.59, Medan, dengan luas 19.000 m2
a. Ruang perkantoran
yang terdiri dari fasilitas:
b. Ruang laboratorium pengawasan mutu c. Ruang produksi
d. Ruang pengemasan
e. Ruang penyimpanan bahan baku f. Ruang penyimpanan bahan kemas g. Ruang penyimpanan etiket
h. Ruang penyimpanan obat jadi
i. Ruang penolakan bahan baku, bahan kemas dan obat jadi
j. Bangunan penunjang seperti tempat pencucian, dapur, klinik, mushola, bengkel dan tempat olahraga.
Ruang produksi PT. Kimia Farma (Persero) Tbk. Plant Medan telah dibuat sesuai dengan persyaratan CPOB dimana aliran proses dirancang mengalir sehingga menghindari kontaminasi selama proses produksi. Lantai, dinding dan langit-langit memiliki permukaaan licin dan tidak terdapat sambungan dilapisi dengan epoksi. Area produksi untuk masing–masing bentuk sediaan terletak secara terpisah.
Utilitas penunjang seperti Sistem Tata Udara menggunakan Air Handling
System (AHS) yang dibagi menjadi 3 zona Air Handling Unit sistem resirkulasi
loop system dan sistem udara tekan (air compressor) yang dilengkapi air dryer,
oil and solid filter.
PT. Kimia Farma Plant (Persero) Tbk. Plant Medan juga memiliki gudang penyimpanan yang dilengkapi AC untuk menjaga suhu dan kelembaban ruangan. Ada pun ruangan di gudang penyimpanan antara lain:
1. Ruang karantina bahan baku. Ruang penimbangan Ruang sampling 2. Ruang bahan baku
Ruang bahan baku I Ruang bahan baku II 3. Ruang bahan kemas
Ruang bahan kemas I Ruang bahan kemas II 4. Ruang produk jadi
Ruang produk jadi I Ruang produk jadi II 5. Ruang reject
3.2.4 Perencanaan Produksi dan Pengendalian Inventory (PPPI) Tugas dan fungsi dari PPPI yaitu :
1. Merencanakan dan menghitung kebutuhan bahan produksi 2. Membuat rencana produksi
5. Melakukan stock opname setiap akhir triwulan
Dasar perencanaan adalah pesanan marketing kantor pusat di Jakarta per triwulan. PPPI menghitung kebutuhan bahan baku dan kemasan yang dibutuhkan dengan memperhatikan stok bahan yang ada persediaan gudang, stok produksi ruahan atau produk setengah jadi dan stok produk jadi sehingga diketahui bahan yang akan dipesan, selanjutnya PPPI mengeluarkan Surat Permintaan Pembelian Bahan (SPPB) ditujukan kepada supervisor pembelian.
Pembelian membuat pesanan ke pengadaan kantor pusat di Jakarta atau pengadaan langsung dari supplier di Medan. Bagian pembelian akan memilih pemasok yang paling murah tetapi memenuhi spesifikasi bahan yang diminta.
Barang pesanan yang datang diterima oleh bagian penyimpanan diarea penerimaan barang di sini dilakukan pemeriksaan kebersihan wadah barang, kecocokan nomor pesanan, jumlah, spesifikasi bahan yang diminta sesuai arsip pesanan. Bahan tersebut kemudian disimpan di area karantina dan diberi label status label kuning.
Selanjutnya petugas penyimpanan membuat surat permohonan periksa ke bagian pengawasan mutu untuk melakukan sampling dan pemeriksaan terhadap bahan tersebut. Bila barang tersebut memenuhi spesifikasi akan diberi label hijau disertai Hasil Pemeriksaan Laboratorium (HPL), jika tidak memenuhi spesifikasi diberi label merah dan HPL serta dikembalikan ke pihak pemasok.
Pengeluaran Bahan Baku (SPPBB) dan bahan pengemasan (SPPBK). SPK dibuat rangkap 4 dengan distribusi ke produksi, penyimpanan, laboratorium dan arsip.
Obat jadi yang selesai dikemas kemudian dikirim ke gudang penyimpanan obat jadi setelah finished pack analysis oleh petugas pemastian mutu. Obat jadi tersebut akan dikirimkan oleh PPPI ke Unit Logistik Sentral (ULS) Jakarta.
Tiap akhir bulan dilakukan penyesuaian stok bahan yang ada penyimpanan antara kartu stok dengan data komputer PPPI, sedangkan pada tiap akhir triwulan akan dilakukan stock opname.
3.2.5 Produksi
Produksi adalah semua kegiatan pembuatan mulai dari penerimaan bahan awal, pengolahan sampai menghasilkan obat jadi. Kegiatan produksi ini dilakukan di area tertutup dan tidak berhubungan langsung dengan bagian gudang ataupun perkantoran.
Tugas dari bagian produksi PT. Kimia Farma (Persero) Tbk. Plant Medan:
1. Melaksanakan pembuatan obat sesuai dengan surat perintah kerja (SPK) dari bagian PPPI, mulai dari permintaan bahan baku ke gudang, penimbangan, pengolahan, pengemasan, sampai pengiriman obat jadi ke gudang obat jadi sesuai dengan prosedur yang tertulis pada prosedur tetap (Protap).
2. Melaksanakan dokumentasi atas semua tindakan yang dilakukan selama proses pengolahan dan pengemasan dengan berpedoman pada Protap.
bersih, penutup kepala, mulut, dan mendesinfeksi tangan dengan desinfektan yang tersedia sebelum memakai sarung tangan. Juga dilakukan pemeriksaan oleh bagian pengawasa mutu meliputi kebersihan alat dan ruangan (line clearance) yaitu :
- Pemeriksaan kebersihan dan kesiapan alat/mesin
• Label kalibrasi
• Label alat/mesin sudah dibersihkan
- Kebersihan dan kesiapan ruangan
• Tidak ada produk sebelumnya
• Label ruangan sudah dibersihkan
- Kesesuaian dokumen
Hal-hal yang harus diperhatikan sebelum memulai kegiatan produksi:
1. Ruang produksi harus tetap terjaga kebersihan, di mana kegiatan pembersihan dilakukan tiap pagi sebelum dimulai kegitan produksi dan sore hari sesudah selesai kegitan produksi dan juga tidak ada sisa produk, label dari produk sebelumnya di ruang produksi.
2. Peralatan yang digunakan dipastikan selalu dalam keadaan bersih sebelum dan sesudah dilakukan kegiatan produksi.
3. Suhu dan kelembaban serta tekanan ruangan produksi telah sesuai dengan kualifikasi ruangan.
4. Ruangan produksi harus mendapat penerangan dan pertukaran udara yang cukup agar kegiatan produksi berjalan lancar.
6. Dokumen produksi (CPB) harus selalu mengikuti produk yang diolah.
Pengambilan bahan ke penyimpanan menggunakan CPB dan Surat perintah pengeluaran bahan baku dan bahan pengemas (SPPBB/SPPBK), petugas melakukan penimbangan dan menyerahan bahan sesuai dengan yang ditulis pada SPPBB/SPPBK tersebut.
Selama produksi berlangsung pelaksana produksi mencatat setiap tahapan produksi dalam Catatan Pengolahan Bets atau Catatan Pengemasan Bets serta setiap kendala yang ditemui selama produksi harus selalu dicatat yang bertujuan untuk dokumentasi produksi, sehingga bila terjadi kekeliruan ataupun kesalahan pada proses produksi, dapat segera diketahui pada proses mana kesalahan tersebut terjadi dan diambil tindakan untuk mengatasi permasalahan tersebut.
Laporan proses produksi membuat nama sediaan, nomor bets, besar bets, tahapan proses, operator, tanggal, jam, hasil, pengawasan yang berguna untuk mengetahui berapa lama waktu yang dibutuhkan untuk menghasilkan suatu bets sediaan. Laporan proses produksi ini diisi oleh petugas yang melakukan suatu tahapan proses produksi dan diketahui oleh supervisor produksi.
Obat yang telah selesai diproduksi akan dilakukan pengemasan primer dibagian produksi yang selanjutnya diserahkan kebagian pengemasan melalui
pass box untuk dilakukan pengemasan sekunder sampai dihasilkan obat jadi. Obat
jadi yang telah dikemas, ditimbang bobotnya dan dicatat selanjutnya dibuat permohonan periksa kebagian pemastian mutu untuk dilakukan finished pack
analysis. Obat jadi yang lulus pemeriksaan selanjutnya diserahkan ke gudang
Area produksi PT. Kimia Farma (Persero) Tbk. Plant Medan terdiri dari: 1. Area Produksi Krim
Area ini telah memperoleh sertifikat CPOB. Area produksi ini terdiri dari beberapa ruangan dimana setiap ruangan diatur suhu, kelembaban dan tekanan udara dan pertukaran udara perjam sesuai dengan kualifikasi ruangan yang disyaratkan dalam CPOB dengan Air Handling System (AHS).
Adapun ruangan yang termasuk area produksi krim terdiri dari: a. Ruang penimbangan bahan.
Fungsi untuk menimbang bahan baku dan bahan tambahan sesuai dengan SPPB. Pada ruangan ini dilengkapi beberapa timbangan digital yang terkalibrasi, dilengkapi dust collector, Tekanan udara didesain negatif dari ruangan koridor. Ruang penimbangan ini dipakai untuk menimbang bahan sediaan krim, tablet dan kapsul.
b. Ruang penyimpanan bahan baku sisa penimbangan.
Bahan baku sisa penimbangan tidak dibolehkan dikembalikan ke ruang penyimpanan tapi harus ditempatkan dalam area penyimpanan khusus di area produksi. Tekanan udara ruang penyimpanan bahan baku sisa penimbangan didesain negatif dari ruangan koridor.
c. Ruang staging untuk bahan baku setelah penimbangan.
d. Ruang pencampuran krim.
Berfungsi untuk pembuatan massa krim, pada ruangan ini dilengakapi dengan mesin vacuum homogenizer kapasitas 120 kg, tangki double
jacket kapasitas 100 liter dan oil tank kapasitas 40 kg, ruangan dilengkapi
dust collector. Setiap tahapan dilakukan in process control meliput i
pemeriksaan pemerian, pH, stabilitas, homogenitas dan pemeriksaan kadar zat berkhasiat massa krim. Tekanan udara ruang pencampuran krim didesain negatif dari ruangan koridor.
e. Ruang karantina produk antara.
Untuk penyimpanan sementara produk antara menunggu pemeriksaan mutu oleh pengawasan mutu. Tekanan udara ruang karantina produk antara negatif dibanding koridor
f. Ruang pengisian krim I.
Berfungsi untuk pengisian massa krim kedalam tube. Dilengkapi dengan mesin pengisian krim Elemech dengan kapasitas 3500 tube/jam dan timbangan digital untuk in process control. Tekanan udara ruang pengisian krim didesain positif dari ruangan koridor
g. Ruang pengisian krim II
dan simpangan baku relatif. Apabila memenuhi spesifikasi maka pengisian boleh dilanjutkan
h. Ruang karantina produk ruahan
Pada ruang ini disimpan produk ruahan untuk menunggu pemeriksaan laboratorium yang meliputi: pemerian, bobot rata-rata, simpangan baku relatif dan kadar zat berkhasiat. Produk ruahan yang telah selesai diperiksa oleh bagian pengemasan melalui pass box untuk dilakukan pengemasan sekunder.
2. Area Produksi Tablet
Area produksi ini telah memiliki sertifikat CPOB produksi tablet. Area produksi tablet terletak terpisah dari area produksi krim dan kapsul untuk menghindari terjadinya pencemaran silang. Pada area produksi tablet juga terdapat beberapa ruangan dimana setiap ruangan diatur suhu, kelembaban dan tekanan udara dan pertukaran udara perjam sesuai dengan kualifikasi ruangan yang disyaratkan dalam CPOB dengan Air Handling System (AHS). Adapun ruangan pada area produksi tablet terdiri dari :
a. Ruang granulasi
b. Ruang staging granul kering
Massa granul yang telah dikeringkan disimpan di ruang staging. Tekanan udara ruang staging granul kering didesain negatif dari ruangan koridor. c. Ruang pengayakan granul
Untuk mengubah granul kasar menjadi granul halus yang seragam sesuai spesifikasi produk. Massa granul yang telah dikeringkan dan telah memenuhi spesifikasi kemudian diayak dengan communiting fitz mill, ruangan dilengkapi dust collector. Tekanan udara ruang pengayakan granul didesain negatif dari ruangan koridor.
d. Ruang pencampuran akhir
Berfungsi untuk penambahan bahan pelicin, pengkilat dan bahan penghancur luar atau bahan perasa. Massa granul yang telah diayak dicampur dengan bahan pelicin, pengkilat dan bahan penghancur luar atau bahan perasa dimasukkan ke dalam alat V-mixer. Ruangan dilengkapi dust collector. Tekanan udara ruang pencampuran akhir didesain negatif dari ruangan koridor.
e. Ruang karantina produk antara tablet
Tempat penyimpanan sementara massa cetak (produk antara) menunggu pemeriksaan IPC meliputi: pemerian, LOD, kadar zat berkhasiat. Tekanan udara ruang karantina produk antara tablet didesain negatif dari ruangan koridor.
f. Ruang pencetakan tablet
inprocess control oleh operator. Ruangan dilengkapi dust collector,
untuk menghisap debu selama pencetakan. Setiap 15 menit operator harus memeriksa keseragaman bobot. Pada awal pencetakan tablet bagian pengawasan melakukan pemeriksaan/pengujian terhadap hasil pencetakan yang meliputi: pemerian, keseragaman bobot, friabilitas, waktu hancur, dan kekerasan tablet. Apabila memenuhi spesifikasi maka pencetakan boleh dilanjutkan. Tekanan udara ruang cetak tablet didesain negatif dari ruangan koridor.
g. Ruang sortir tablet
Tablet yang dihasilkan disortir dari debu dan juga bentuk tablet yang tidak bagus/pecah. Ruangan dilengkapi dust collector. Tekanan udara ruang sortir tablet didesain negatif dari ruangan koridor.
h. Ruang karantina produk ruahan tablet
Tempat penyimpanan sementara produk ruahan menunggu pemeriksaan IPC meliputi: pemerian, keseragaman bobot, friabilitas, waktu hancur, kekerasan tablet, kadar zat aktif dan disolusi. Tekanan udara ruang karantina produk ruahan tablet didesain negatif dari ruangan koridor. i. Ruang penyetripan
Tablet yang telah diluluskan oleh bagian pengawasan mutu dilakukan penyetripan. Ruang ini dilengkapi mesin strip, mesin Ink Jet Print untuk penandaan, dan alat pemeriksaan kebocoran strip. Ruangan dilengkapi
dust collector. Setiap 15 menit operator memeriksa kebocoran hasil
stripping dan kerapian penandaan. Tekanan udara ruang penyetripan
j. Ruang counting
Tablet yang telah diluluskan oleh bagian pengawasan mutu dibawa keruang counting dan dikemas dalam kantok plastik. Ruang ini dilengkapi mesin counting. Ruangan dilengkapi dust collector. Setiap 15 menit operator memeriksa kebenaran hasil counting. Tekanan udara ruang counting didesain negatif dari ruangan koridor.
3. Area Produksi Kapsul
Area produksi ini telah memiliki sertifikat CPOB produksi kapsul. Sediaan kapsul yang produksi oleh PT. Kimia Farma (Persero) Tbk. Plant Medan adalah kloramfenikol kapsul. Seperti area produksi krim dan tablet, area produksi kapsul juga terletak terpisah untuk menghindari terjadinya mix up. Pada area produksi kapsul juga terdapat beberapa ruangan dimana setiap ruangan tersebut telah diatur suhu, kelembaban dan tekanan udara dan pertukaran udara perjam sesuai dengan kualifikasi ruangan yang disyaratkan dalam CPOB dengan Air Handling System (AHS).
Adapun ruangan pada unit kapsul terdiri dari : a. Ruang pengeringan
Berfungsi untuk pengeringan bahan pengisi, dilengkapi oven pengering,
dust collector. Tekanan udara ruang pengeringan didesain negatif dari
ruangan koridor. b. Ruang pencampuran
negatif. Setelah homogen, massa dilakukan pemeriksaan oleh pengawasan mutu dan kemudian dipindahkan ruang karantina produk antara.
c. Ruang karantina produk antara kapsul
Untuk penempatan sementara produk antara menunggu pemeriksaan pengawasan mutu. Tekanan udara ruang karantina produk antara kapsul didesain negatif dari ruangan koridor.
d. Ruang pengisian kapsul
Berfungsi untuk pengisian massa kapsul kedalam cangkang kapsul. Diruang ini terdapat mesin filling kapsul dilengkapi dengan timbangan
digital untuk in process control selama pengisian oleh operator. Juga
dilengkapi dust collector. Setiap 15 menit dilakukan pemeriksaan keseragaman bobot oleh operator. Pada awal pengisian kapsul bagian pengawasan mutu melakukan pemeriksaan/pengujian terhadap hasil pengisian kapsul yang meliputi: pemerian, keseragaman bobot, dan waktu hancur. Apabila memenuhi spesifikasi maka pengisian kapsul boleh dilanjutkan. Tekanan udara ruang pengisian kapsul didesain negatif dari ruangan koridor.
e. Ruang seleksi kapsul
f. Ruang pengemasan primer
Kapsul yang telah diluluskan oleh bagian pemastian mutu disetrip atau dikemas dalam botol kemasan 100 di ruang pengemas primer.
4. Area Pengemasan Sekunder
Semua produk yang telah dikemas primer kemudian dikirim ke pengemasan sekunder melalui pass box yang menghubungkan antara jalur produksi dengan jalur pengemasan sekunder.
Sebelum memulai pengemasan, dilakukan pemeriksaan oleh bagian pengawasan mutu meliputi kebersihan jalur pengemasan atau line clearance yaitu :
- Pemeriksaan kesesuaian produk yang dikemas dengan kemasannya.
- Pemeriksaan kebenaran penulisan penomoran batch, tanggal kadaluarsa
- Pembersihan jalur pengemasan dari sisa bahan kemasan batch sebelumnya.
Setelah pengemasan, dilaksanakan pemeriksaan:
- Kesesuaian jumlah dalam kotaknya dengan cara ditimbang
- Kerapian pengemasan.
Selesai pengemasan petugas membuat permohonan pemeriksaan finished
pack analysis kepada bagian pemastian mutu. Sediaan obat jadi yang telah
dikemas dan diluluskan oleh bagian pemastian mutu selanjutnya dikirim ke gudang penyimpanan.
3.2.6 Pengawasan Selama Proses (In Process Control)
spesifikasi. Laboratorium pengujian IPC terletak di area produksi. Pengawasan ini dilakukan dengan cara mengambil contoh dan mengadakan pemeriksaan dan pengujian terhadap produk yang dihasilkan pada tahap-tahap tertentu dari proses pengolahan.
Pengawasan dalam proses pengolahan dilaksanakan oleh 2 pihak, yaitu:
1. Bagian produksi, yang menjamin bahwa mesin dan peralatan produksi serta
proses yang digunakan akan menghasilkan produk yang memenuhi spesifikasi yang ditetapkan.
2. Bagian pengawasan mutu, yang meyakinkan bahwa produk yang dihasilkan
pada tahap tertentu telah memenuhi spesifikasi yang ditetapkan sebelum dilanjutkan proses berikutnya. Bagian pengawasan mutu menentukan apakah tahap lanjutan dari proses pengolahan dapat dilaksanakan berdasarkan hasil pengujian yang dilakukan.
Pengawasan dalam proses pengolahan (IPC) oleh pengawasan mutu meliputi pengujian parameter kualitas antara lain:
1. Tablet:
- Massa tablet meliputi pemeriksaan pemerian, kadar air (LOD), kadar bahan aktif.
- Tablet meliputi pemeriksaan pemerian, kadar air, bobot rata-rata, bobot satuan, kekerasan, friabilitas, waktu hancur, kadar bahan aktif dan disolusi.
2. Kapsul:
- Kapsul meliputi pemeriksaan pemerian, bobot rata-rata, waktu hancur, kadar bahan aktif dan disolusi.
3. Krim:
- Basis krim meliputi pemeriksaan pemerian, pH, bobot rata-rata, stabilitas, dan homogenitas
- Massa krim meliputi pemeriksaan pemerian, pH, homogenitas, stabilitas dan kadar bahan aktif.
- Krim meliputi pemeriksaan pemeriaan, bobot rata-rata, simpangan baku relatif, pH, homogenitas, kadar zat berkhasial
3.2.7 Pengawasan Mutu
Tanggung jawab bagian pengawasan mutu antara lain:
1. Memeriksa bahan awal memenuhi spesifikasi yang ditetapkan untuk identitas, kekuatan, kemurnian, kualitas, dan keamanan.
2. Memeriksa setiap tahapan produksi obat telah dilaksanakan sesuai prosedur yang ditetapkan.
3. Memeriksa semua pengawasan selama proses dan pemeriksaan selama proses dan pemeriksaan laboratorium terhadap suatu bets obat telah dilaksanakan dan bets tersebut memilki spesifikasi yang ditetapkan sebelum didistribusi. 4. Memastikan suatu bets obat memenuhi persyaratan mutunya selama waktu
peredaran yang ditetapkan.
Sarana Pemeriksaan Laboratorium Plant Medan antara lain:
- HPLC 2 unit
- Spektrofotometer 1 unit
- Dissolution tester 2 unit
- Desintegration tester 1 unit
- Friabilation tester 1 unit.
- Moisture analyzer 2 unit
- Karl Fischer 1 unit
- Sieve analyze
- Melting Point
- Alat COD
- Alat BOD
- Coloni Counter
- Biologycal Sefty Cabbin
- Alat Laboratorium, dll
3.2.8 Pemeriksaan Mutu Bahan Baku dan Bahan Pengemas
Bahan baku dan bahan pengemas datang dari pemasok ke bagian gudang, kemudian petugas laboratorium melakukan sampling dan pemeriksaan terhadap: 1. Bahan baku dan bahan tambahan
a. Pemeriksaan organoleptis, meliputi bentuk, warna, bau dan rasa.
b. Pemeriksaan kimia, meliputi pemeriksaan kualitatif, kuantitatif dan pH. c. Pemeriksaan fisika, meliputi titik lebur, kelarutan dan berat jenis. 2. Bahan Pengemas
b. Pemeriksaan etiket, meliputi ukuran, kebenaran tulisan dan lambang, desain dan warna
3.2.9 Pemastian Mutu
Tanggung jawab bagian pemastian mutu antara lain:
1. Pengkajian semua dokumen yang digunakan dalam produksi pengemasan termasuk penyimpangan yang terjadi dalam produks i.
2. Memastikan pemeriksaan sudah dilakukan dengan metoda analisa yang benar dan telah tervalidasi.
3. Memastikan produksi sudah dilakukan dengan prosedur yang tervalidasi. 4. Memastikan obat yang diproduksi aman selama dalam masa edarnya.
5. Memastikan semua mesin, sarana penunjang beroperasi menghasil produk sesuai spesifikasi dan telah terkualifikasi.
Bagian pemastian mutu telah melaksanakan validasi proses dan validasi metoda analisa untuk semua produk, untuk alat ukur telah dikalibrasi sesuai jadwal dan mesin telah dikualifikasi. Dokumentasi produksi telah dilaksanakan sejak kedatangan bahan sampai produk jadi.
Sarana Penunjang Pemastian Mutu Plant Medan antara lain:
- Climatic chamber 2 unit
- Standar kalibrasi massa, termometer.
3.2.10 Pengolahan Limbah A.Pengolahan Limbah Cair
Gambar 4. Denah bak pengolahan limbah cair PT. Kimia Farma (Persero) Tbk.
Plant Medan
Keterangan: A = Saluran masuk E = Bak Aerasi I B = Bak Penampungan F = Bak Aerasi II C = Mesin Pompa G = Bak Sedimentasi D = Bak Netralisasi H = Bak Biokontrol
Sumber limbah cair berasal dari air cucian di ruang produksi dan air cucian alat-alat di laboratorium.
Proses pengolahan limbah cair, yaitu:
1. Limbah cair yang dikeluarkan ditampung dalam bak penampungan (B) selanjutnya dipompakan dengan mesin pompa (C) ke bak netralisasi (D)
A
B
D E
F G
2. Pada bak netralisasi (D) kalau perlu ditambahkan air kapur untuk menetralkan limbah cair yang dikeluarkan. Selanjutnya limbah cair yang telah netral dialirkan ke bak aerasi (E)
3. Pada bak aerasi I (E) dilakukan aerasi dengan menggunakan aerator yang bertujuan untuk menginjeksikan oksigen ke dalam bak tersebut supaya oksigen yang diinjeksikan tersebut dapat melakukan penguraian bahan-bahan organik yang terdapat dalam limbah cair tersebut .
4. Dari bak aerasi I (E) limbah akan mengalir ke bak aerasi II (F) secara over
flow dan dilakukan proses yang sama dengan bak aerasi (E)
5. Dari bak aerasi (F) limbah mengalir ke bak sedimentasi (G), limbah cair diendapkan dan selanjutnya mengalir ke bak biokontrol (H).
6. Pada bak biokontrol, dilakukan pengujian terhadap hasil pengolahan limbah cair tersebut berupa nilai BOD (Biological Oxygen Demand) dan COD (Chemical Oxygen Demand) TSS, TDS, pH secara periodik.
7. Dari bak biokontrol limbah cair dibuang ke saluran pembuangan.
Selain pemeriksaan internal oleh perusahaan, limbah cair diperiksa tiap bulan oleh Balai Teknik Kesehatan Lingkungan dan Pengendalian Penyakit (BTKLPP) Kelas I Medan, dengan contoh uji air limbah penampungan awal dan air limbah bio control, dengan parameter pH, BOD, COD, dan TTS. Dimana hasil pengujian terlampir dalam Lampiran 6 dan 7, halaman 75 dan 76.
B. Pengolahan Limbah Padat
Sumber limbah padat berasal dari:
2. Debu yang berasal dari vacuum cleaner yang digunakan untuk membersihkan ruang produksi dan alat produksi.
3. Wadah, etiket yang rusak dari bagian pengemasan. Untuk tube sebelum dimusnahkan digunting terlebih dahulu.
4. Bahan-bahan yang tidak memenuhi spesifikasi ataupun yang telah rusak yang berasal dari bagian gudang.
Semua limbah padat tersebut dibakar oleh petugas dan sisa pembakaran tersebut dibuang ke tempat pembuangan akhir (TPA).
C. Pengolahan Limbah Suara
Pencemaran suara atau kebisingan dan/atau getaran adalah masuknya suara dan/atau getaran yang tidak diinginkan ke dalam lingkungan sehingga kualitas lingkungan menurun atau tidak sesuai dengan peruntukkannya. Limbah suara dan getaran dihasilkan antara lain oleh suara dan getaran dari mesin pabrik, genset.
Upaya pengelolaan lingkungan adalah dengan mengunakan pelindung telinga yaitu berupa ear plugs dan ear muffs.
D. Pengelolaan limbah udara
Pencemaran udara adalah masuknya gas dan senyawa asing ke dalam udara sehingga menyebabkan kualitas udara menurun atau membahayakan kehidupan makhluk hidup atau tidak sesuai lagi dengan peruntukkannya.
Limbah udara di industri farmasi dihasilkan antara lain oleh: 1. Debu selama proses produksi
1. Lemari asam dilengkapi dengan exhaust fan dan cerobong ± 6 meter dilengkapi dengan adsorben.
2. Debu disekitar mesin produksi dipasang penyedot debu dan dust colector unit, yang dilengkapi filter sebelum dibuang.
3. Asap dari genset dibuat cerobong asap ± 6 meter. 3.2.11 Administrasi dan Keuangan
Keuangan di PT. Kimia Farma (Persero) Tbk. dipusatkan ke kantor pusat yang ada di Jakarta. Oleh sebab itu, untuk membayar gaji karyawan ataupun pembayaran faktur masuk atas pembelian bahan-bahan baku harus dibuat surat permohonan uang ke Jakarta.
Setelah dilakukan pemesanan bahan baku oleh bagian pembelian ke pemasok, maka pemasok akan mengirimkan bahan baku tersebut disertai faktur masuk. Pembelian bahan baku tersebut dicatatkan kedalam buku pembelian. Pembayaran faktur tersebut ada 2 cara, yaitu:
1. Secara tunai, dibagi atas 2 macam yaitu:
a. Untuk pembelian dalam jumlah sedikit (<5 juta), pembayaran dilakukan dengan uang kas, dan dicatat ke dalam buku kas.
b. Untuk pembelian dalam jumlah banyak (>5 juta), pembayaran dilakukan dengan cek atau giro, dan dicatatkan ke dalam buku bank.
Pembayaran secara tunai juga berlaku untuk biaya pemeliharaan mesin. 2. Secara Kredit.
Produk jadi akan dikirimkan ke Unit Logistik Sentral di Jakarta dengan membuka faktur keluar (Nota Penyerahan Intern/NPI). PT. Kimia Farma (Persero) Tbk. Plant Medan tidak dapat melakukan penjualan ke pihak luar, tetapi diperbolehkan mengirimkan produk jadi tersebut ke PBF di Medan dan sekitarnya dengan faktur atas nama Unit Logistik Sentral Jakarta untuk menghemat biaya transportasi. Pembayaran atas penjualan (pelunasan faktur) diterima oleh kantor pusat Jakarta dan dicatatkan ke dalam buku penjualan.
Setiap pembelian dan penjualan barang akan dikenai pajak, begitu juga dengan industri farmasi. Setiap pembelian bahan-bahan baku dicatat dalam buku pembelian dikenai Pajak Pertambahan Nilai (PPN) yang tersebut PPN masukkan dalam dicatat dalam buku PPN masukan setiap penjualan obat jadi dicatat dalam buku penjualan dikenal PPN keluaran dan dicatat dalam buku PPN keluaran.
BAB IV PEMBAHASAN 4.1 Manajemen Mutu
PT. Kimia Farma telah menerapkan sistem manajemen mutu, tersedia kebijakan mutu, sasaran mutu sampai ke struktur paling bawah yang menjadi komitmen pegawai, pemasok dan distributor. Sasaran mutu disosialisasikan dan dituangkan dalam rencana mutu yang harus dipenuhi serta uraian pekerjaan yang jelas, dan dituangkan dalam prosedur sistem mutu, prosedur tetap dan formulir.
4.2 Aspek Personalia
PT. Kimia Farma (Persero) Tbk. Plant Medan memiliki personalia sebanyak 56 orang pegawai tetap dan 33 orang pegawai tidak tetap dengan berbagai tingkat pendidikan, keterampilan, dan kemampuan sesuai dengan bidang tugasnya masing-masing, semua dilatih pada bidang tugasnya masing masing dan latihan penyegaran serta on the job training ditempat kerja.
PT. Kimia Farma (Persero) Tbk. Plant Medan memiliki Apoteker penanggung jawab produksi, Apoteker penanggung jawab pengawasan mutu dan apoteker penanggung jawab pemastian mutu sesuai aturan CPOB.
4.3 Aspek Bangunan dan Peralatan
udara awal dan saringan udara akhir, sistem pengolahan air, konstruksi bangunan yang kokoh dan kedap air.
PT. Kimia Farma (Persero) Tbk. Plant Medan terletak dipinggir jalan Raya Tanjung Morawa Km. 9 No. 59, Medan. Di sekitar pabrik terdapat pabrik lainnya yang memungkinkan untuk terjadinya pencemaran, seperti pabrik pakan ternak, pabrik biskuit, dan pabrik karet. Untuk menghindari terjadinya pencemaran dari pabrik tersebut, maka PT. Kimia Farma (Persero) Tbk. Plant Medan telah dilengkapi dengan sistem tata udara (AHS) dengan menggunakan AC sentral yang dilengkapi saringan udara awal dan saringan udara akhir. Sistem ini terdapat di ruangan kelas E, dimana terdiri dari Pre-filter, Medium Filter dan HEPA Filter.
Pengolahan Air yang terdapat di PT. Kimia Farma (Persero) Tbk. Plant Medan dialirkan secara langsung ke ruangan-ruangan dengan menggunakan
Looping System. Setiap jam dapat dihasilkan 100 liter air yang telah dimurnikan,
dan telah dapat memenuhi kebutuhan produksi.
Pengolahan air dilakukan dengan beberapa tahapan, dimana air dikumpulkan terlebih dahulu pada bak penampungan, selanjutnya disaring melalui
filter 25µ, selanjutnya melalui Penyaringan Pasir (Sand Filter), guna menyaring
murni selanjutnya melewati filter 5µ, 1µ dan 0.2µ kemudian ditampung pada tabung penampungan akhir yang berkapasitas 500 liter.
Dari Aspek bangunan telah mempunyai konstruksi yang kuat, lantai, dinding dan plafond dilapisi epoksi sehingga tidak menyerap air. Tata udara telah dibangun baru dan telah dikualifikasi dan memenuhi persyaratan CPOB untuk ruangan kelas III atau kelas 100.000, seperti suhu, kelembaban, perbedaan tekanan ruang produksi dengan koridor dan pertukaran udara perjam serta pemeriksaan partikel dan mikroba telah sesuai dengan kualifikasi yang ditentukan CPOB serta dilengkapi dengan sarana Laboratorium mikrobiologi dengan kelas kebersihan kelas I.
Gudang terdiri dari gudang bahan baku, gudang bahan pengemas dan gudang obat jadi. Di gudang bahan baku terdapat penerimaan barang, ruangan karantina dan ruangan penyimpanan, juga sudah tersedia ruangan sampling, ruang barang reject (penolakan) untuk bahan baku, bahan kemasan dan obat jadi.
Penimbangan bahan dilakukan di ruang kelas III atau zona abu, dilengkapi dustcollector, Air Handling System, dan bahan yang ditimbang tidak menggunakan kemasan asli serta melewati ruang penyangga.
validasi, yang meliputi Validasi Proses (Proses Produksi dan Pengemasan), Validasi Metode Analisa dan hingga Validasi Pembersihan.
4.4 Sanitasi dan Higiene
Pembersihan peralatan dan ruangan produksi dilaksanakan sebelum dan sesudah proses produksi dilaksanakan sehingga pencemaran silang dapat dihindari. Pencemaran kimiawi dapat juga dihindarkan dengan cara menggunakan alat penghisap debu yang dilengkapi dengan saringan udara balik.
Semua karyawan diharuskan untuk melaksanakan higiene perorangan dan mengganti pakaiannya dengan pakaian kerja dan diwajibkan memakai pelindung diri, seperti tutup kepala, tutup mulut, sarung tangan dan sepatu kerja. Sebelum memasuki ruang produksi harus melewati ruang antara. Untuk karyawan yang bersentuhan langsung dengan bahan obat diharuskan menggunakan masker dan sarung tangan. Ketentuan ini juga berlaku untuk tamu yang berkunjung ke lingkungan proses produksi.
4.5 Aspek Produksi
PT. Kimia Farma (Persero) Tbk. Plant Medan memproduksi sediaan tablet, kapsul, salep dan krim dan dari hasil resertifikasi oleh BPOM telah mendapat sertifikat untuk produk tablet, kapsul dan krim.
- Produksi dilaksanakan oleh tenaga yang telah dilatih dan diberikan penyegaran CPOB secara rutin.
- Selama pengolahan dilakukan In Process Control (IPC) baik oleh operator produksi ataupun oleh petugas laboratorium.
- Produksi dilaksanakan dengan mesin produksi yang telah dikualifikasi.
- Semua kegiatan pembuatan obat mulai dari penimbangan, pengolahan, pengemasan, pengendalian dan evaluasi, diarsipkan pada dokumen produksi.
Obat yang telah selesai diproduksi dan dilakukan pengemasan primer dari Bagian Produksi dikirimkan melalui Kotak Hantar (Passing Box) ke Bagian Pengemasan Sekunder, untuk dikemas. Pada bagian Pengemasan Sekunder ini, kemasan karton ada yang masih dilakukan Pelabelan (Labelling) secara manual, dan ada yang telah diproses secara komputerisasi. Demikian pula untuk proses Pencetakan (Printing) terhadap Nomor Bets (Batch), Kode Produksi dan Tanggal Kadaluarsa ada yang masih dilakukan Pencetakan (Printing) secara manual, dan ada yang telah dicetak secara komputerisasi.
4.6 Aspek Pengawasan Mutu
4.7 Inspeksi Diri dan Audit Mutu
Pada PT. Kimia Farma (Persero) Tbk. Plant Medan terdapat program inspeksi diri dan audit mutu. Dimana program ini dilakukan 2 kali dalam setahun sesuai dengan kebijakan yang telah ditetapkan. Program ini dilakukan secara berkala guna untuk menilai kesesuaian segala aspek yang berkaitan dengan Cara Pembuatan Obat yang Baik (CPOB) dan juga untuk menjamin kualitas produk yang dihasilkan oleh PT. Kimia Farma (Persero) Tbk. Plant Medan.
4.8 Dokumentasi
Semua catatan diarsip dalam sistem dokumentasi dan harus disimpan sesuai waktu yang telah ditetapkan.Sistem dokumentasi Plant Medan terdiri dari:
- Kebijakan mutu
- Sasaran Mutu
- Prosedur sistem mutu
- Prosedur Tetap
- Formulir
4.9 Kualifikasi dan Validasi
4.10 Aspek Pengolahan Limbah
BAB V
KESIMPULAN DAN SARAN 5.1 Kesimpulan
- Tugas dan fungsi apoteker di industri farmasi yakni di bagian produksi, bidang pemastian mutu, pengawasan mutu.
- PT. Kimia Farma (Persero) Tbk. Plant Medan telah menerapkan Cara Pembuatan Obat yang Baik (CPOB) dalam pelaksanaan kegiatan dan telah memiliki sertifikat CPOB untuk produk tablet, kapsul dan krim. Serta telah melaksanakan pengolahan limbah, Sistem Tata Udara dan Sistem Pengolahan Air telah sesuai CPOB.
5.1 Saran
- Dalam sistem pengolahan limbah padat, diharapkan menggunakan
incenerator.