LAPORAN PRAKTIKUM
KIMIA ANORGANIK I
Nama : Agusra Authority (08101003053) Minaria (08101003021)
Ulya Farida (08101003059) Weny Novyanza (08101003029) Kelompok : II (Dua)
PERCOBAAN: PEMBUATAN KALIUM NITRAT
LABORATORIUM KIMIA ANORGANIK
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SRIWIJAYA
LAPORAN PRAKTIKUM KIMIA ANORGANIK I
I. NOMOR PERCOBAAN : I
II. NAMA PERCOBAAN : Pembuatan Kalium Nitrat
III. TUJUAN PERCOBAAN : Mempelajari pembuatan garam kalium nitrat hasil reaksi antara natrium nitrat dengan kalium klorida dan mempelajari pemisahan garam tersebut dari hasil samping berupa natrium klorida berdasarkan perbedaan kelarutan.
IV. DASAR TEORI
Senyawa kimia asam nitrat (H N O3) adalah sejenis cairan korosif yang tak
berwarna, dan merupakan asam beracun yang dapat menyebabkan luka bakar. Larutan asam nitrat dengan kandungan asam nitrat lebih dari 86% disebut sebagai asam nitrat berasap, dan dapat dibagi menjadi dua jenis asam, yaitu asam nitrat berasap putih dan asam nitrat berasap merah
Asam nitrat adalah larutan asam kuat yang mempunyai nilai pKa sebesar -2. Di dalam air, asam ini terdisosiasi menjadi ion-ionnya, yaitu ion nitrat NO3− dan ion
hidronium (H3O+). Garam dari asam nitrat disebut sebagai garam nitrat (contohnya
seperti kalsium nitrat atau barium nitrat). Dalam temperatur ruangan, asam nitrat berbentuk uap berwarna merah atau kuning
Asam nitrat murni (100%) merupakan cairan tak berwarna dengan berat jenis 1.522 kg/m³. Ia membeku pada suhu -42 °C, membentuk kristal-kristal putih, dan mendidih pada 83 °C. Ketika mendidih pada suhu kamar, terdapat dekomposisi (penguraian) sebagian dengan pembentukan nitrogen dioksida sesudah reaksi:
4HNO3 → 2H2O + 4NO2 + O2 (72 °C)
yang berarti bahwa asam nitrat anhidrat sebaiknya disimpan di bawah 0 °C untuk menghindari penguraian. Nitrogen dioksida (NO2) tetap larut dalam asam nitrat yang
membuatnya berwarna kuning, atau merah pada suhu yang lebih tinggi. Manakala asam murni cenderung mengeluarkan asap putih ketika terpapar ke udara, asam dengan nitrogen dioksida terlarut mengeluarkan uap berwarna coklat
kemerah-merahan, yang membuatnya dijuluki "asam berasap merah" atau "asan nitrat berasap". Asam nitrat berasap juga dirujuk sebagai asam nitrat 16 molar (bentuk paling pekat asam nitrat pada temperatur dan tekanan standar).
(anonym.2011).
Natrium dan senyawanya sangat penting, logamnya sebagai aliasi Na-Pb, dipakai untuk membuat tetraalkil-Pb, dan banyak kegunaan industri yang lain. Baik Na+ maupun K+ penting secara fisiologis dalam hewan dan tanaman, sel-sel dapat
membedakan Na+ dan K+ mungkin dengan beberapa jenis mekanisme
pengompleksan.
Dalam kristal ionik, seperti logam halida, oksida, dan sulfida, kation dan anion disusun bergantian, dan padatannya diikat oleh ikatan elektrostatik. Banyak logam halida melarut dalam pelarut polar misalnya NaCl melarut dalam air, sementara logam oksida dan sulfida, yang mengandung kontribusi ikatan kovalen yang signifikan, biasanya tidak larut bahkan di pelarut yang paling polar sekalipun. Struktur dasar kristal ion adalah ion yang lebih besar (biasanya anion) membentuk susunan terjejal dan ion yang lebih kecil (biasanya kation) masuk kedalam lubang oktahedral atau tetrahedral di antara anion. Kristal ionik diklasifikasikan kedalam beberapa tipe struktur berdasarkan jenis kation dan anion yang terlibat dan jari-jari ionnya. Setiap tipe struktur disebut dengan nama senyawa khasnya, jadi struktur garam dapur tidak hanya merepresentasikan struktur NaCl tetapi juga senyawa lainnya.
Pada umumnya kita tidak mengetahui komposisi dari larutan sampel yang akan dianalisis, sehingga sulit untuk membuat larutan standar yang mempunyai komposisi ionik yang sarna dengan larutan contoh. Untuk mengatasi hal ini dibuat suatu metoda yang disebut sebagai metoda kekuatan ion tetap. Metoda ini dilakukan dengan cara mencampurkan suatu larutan yang mempunyai kekuatan ion cukup tinggi ke dalam larutan standar dan ke dalam larutan contoh. Dengan demikian perbedaan kedua ion dari kedua larutan yang mempunyai konsentrasi yang berbeda dapat diabaikan sehingga kekuatan ion menjadi konstan. Ujung simetri dari pola geometris molekul-molekul adalah salah satu dari kumpulan yang luar biasa atau sama dengan
kristal yang mana telah didefinisikan sebagai keadaan yang biasa (umum) untuk semua sifat-sifatnya tapi tak lebih dari sebuah/suatu indikasi. Dasar pokok persoalan prinsip ini adalah simetri dari struktural kristal dalam prakteknya adalah kedua posisi simetri dan intensitas dari sinar X atau difraksi spektrum neutron.
Kalium nitrat merupakan sumber alami mineral nitrogen. Senyawa ini tergolong senyawa nitrat dengan rumus kimia KNO3. Kalium nitrat merupakan
komponen bubuk hitam teroksidasi (disuplai oksigen). Sebelum fiksasi industri nitrogen skala besar (proses Haber), sumber utama Kalium nitrat ialah deposit yang mengkristalisasikan dari dinding gua atau mengalirkan bahan organik yang membusuk. Tumpukan kotoran juga sumber umum yang utama: amonia dari dekomposisi urea dan zat nitrogen lainnya akan melalui oksidasi bakteri untuk memproduksi nitrat.
Pada umumnya campuran digolongkan sebagai materi heterogen, artinya tidak seluruh materi ini mempunyai sifat yang sama. Akan tetapi, ada suatu campuran yang partikel-partikel tidak dapat dibedakan dengan mata biasa. Campuran tersebut dinamakan larutan. Oleh karenanya, larutan dianggap sebagai materi homogen walaupun keadaan yang sesungguhnya tidak homogen benar. Oleh karena proses pembentukan campuran merupakan proses fisis, maka partikel-partikel pembentuk campuran mudah dipisahkan kembali secara fisis. Pemisahan tersebut berdasarkan perbedaan sifat fisis dari partikel-partikel pembentuk campuran yang dapat dilakukan dengan berbagai cara.
Sebagai mana asam pada umumnya, asam nitrat bereaksi dengan alkali, oksida basa, dan karbonat untuk membentuk garam, seperti amonium nitrat. Karena memiliki sifat mengoksidasi, asam nitrat pada umumnya tidak menyumbangkan protonnya (yakni, ia tidak membebaskan hidrogen) pada reaksi dengan logam dan garam yang dihasilkan biasanya berada dalam keadaan teroksidasi yang lebih tinggi.Karenanya, perkaratan (korosi) tingkat berat bisa terjadi. Perkaratan bisa dicegah dengan penggunaan logam ataupun aloi anti karat yang tepat.
Sebagai sebuah oksidator yang kuat, asam nitrat bereaksi dengan hebat dengan sebagian besar bahan-bahan organik dan reaksinya dapat bersifat eksplosif.
Produk akhirnya bisa bervariasi tergantung pada konsentrasi asam, suhu, serta reduktor. Reaksi dapat terjadi dengan semua logam kecuali deret logam mulia dan aloi tertentu. Karakteristik ini membuat asam nitrat menjadi agen yang umumnya digunakan dalam uji asam. Sebagai kaidah yang umum, reaksi oksidasi utamanya terjadi dengan asam pekat, memfavoritkan pembentukan nitrogen dioksida (NO2).
(Muttaqin Hasyim.2009).
Senyawa kimia kalium nitrat merupakan sumber alami mineral nitrogen. Senyawa ini tergolong senyawa nitrat dengan rumus kimia K N O3 Merupakan
komponen bubuk hitam teroksidasi (disuplai oksigen). Sebelum fiksasi industri nitrogen skala besar (proses Haber), sumber utama Kalium nitrat ialah deposit yang mengkristalisasikan dari dinding gua atau mengalirkan bahan organik yang membusuk. Tumpukan kotoran juga sumber umum yang utama: amonia dari dekomposisi urea dan zat nitrogen lainnya akan melalui oksidasi bakteri untuk memproduksi nitrat.
Salah satu penerapan yang paling berguna dari kalium nitrat ialah dalam produksi asam sendawa, dengan menambahkan asam sulfat larutan encer kalium nitrat, menghasilkan asam sendawa dan kalium sulfat yang terpisah melalui distilasi fraksional. yang terkonsentrasi pada Kalium nitrat juga digunakan sebagai pupuk, sebagai model bahan pembakar rocket, dan dalam beberapa petasan seperti bom asap, pada yang mana campuran dengan gula memproduksi jelaga asap 600 kali dari volumnya sendiri. Dalam proses pengawetan makanan, kalium nitrat merupakan komposisi umum dari daging yang diasinkan.
(Rihin. 2010)
Untuk mengetahui kemurnian dari kalium nitrat dan natrium klorida, maka dilakukan uji nyala, uji ion klorida, dan uji ion nitrat.
Pada uji nyala digunakan HCl untuk mensterilkan kawat platina dari kotoran. Kristal ada yang menghasilkan nyala kuning dan adapula yang menghasilkan nyala ungu. Nyala kuning berasal dari ion Na+ sedangkan nyala ungu berasal dari ion K+.
Perbandingan warna yang dihasilkan disebabkan karena adanya energy tertentu dari nyala api yang diserap oleh electron-elektron dalam atau logam hingg terjadi eksitasi
dan kembalinya electron-elektron ke peringkat dasar dan membebaskan energy nyala yang khas.
Pada pengujian klorida, Kristal diencerkan dengan aquades kemudian ditambahkan dengan HNO3 dan AgNO3. Larutan HNO3 digunakan sebagai katalisator.
Adapun persamaan reaksinya yaitu:
NaCl + AgNO3 HNO3 NaNO3 + AgCl
Pada pengujian ion nitrat, Kristal terlebih dahulu dilarutkan kemudian ditambahkan FeSO4 dan H2SO4. Menurut teori adanya ion nitrat ditunjukkan dengan adanya cincin
coklat pada Kristal. (Nur Intan.2010).
V. ALAT DAN BAHAN a. Alat yang digunakan :
- gelas beker 400 ml 2 buah - erlenmenyer 600 ml 1 buah
- corong gelas 1 buah
- corong penguapan 1 buah b. Bahan kimia yang di butuhkan :
- kalium klorida - natrium nitrat
VI. PROSEDUR PERCOBAAN 1. Pembuatan Kalium Nitrat
Keduanya dilarutkan dengan
Setelah larut keduanya dicampurkan
Diuapkan hingga volum larutan berkurang.
15 gr KCl dan 17 gr NaNO3
Air panas 50 mL
Disaring dalam keadaan panas lalu diuapkan kembali hingga volume menjadi lebih sedikit.
Didinginkan dan disaring kembali.
2. Pemurnian Kristal kalium nitrat
Masing-masing dilarutkan dalam:
Lalu didinginkan dan disaring
Yang diperoleh dari hasil penyaringan ditimbang dan
dihitung rendemennya. Larutan
Larutan
15 gr KCl dan 17 gr NaNO3
50 ml air
VII. TUGAS PENDAHULUAN
1. Sebutkan faktor-faktor yang mempengaruhi besarnya kelarutan garam-garam ion?jelaskan?
Jawab:
-suhu: semakin tinggi suhu maka kelarutan semakin cepat
-luas permukaan: semakin luas permukaan maka kelarutan semakin cepat -pasangan ion senama
-pasangan ion asing
-konsentrasi:semakin besar konsentrasi maka kelarutan semakin cepat -berat molekul: semakin besar maka kelarutan semakin cepat
2. Dalam pelarut air ,mengapa kalium nitrat memiliki kelarutan lebih besar dari pada natrium klorida?jelaskan?
Jawab:
Karena daya larut NaCl lebih kecil maka penguapan NaCl terkristal sedangkan KNO3 tetap akan larut ,jadi pemisahan garam tersebut dari hasil
samping NaCl berdasarkan perbedaan kelarutan.
3. Dengan menggunakan bantuan kurva hubungan antara kelarutan kalium nitrat dan natrium nitrat dengan temperatur ? bagaimana cara memisahkan campuran kedua garam tersebut?
Sifat kelarutan yang jauh berbeda dari kedua garam tersebut pada kondisi tertentu.Dimana daya larut yang lebih kecil adalah NaCl sehingga penguapan NaCl mengkristal sedangkan KNO3 tetap dalam larutan. Dengan cara larutan
Kristal yang telah dihasilkan dan telah dipanaskan lalu di dinginkan ,disaring dan ditimbang lalu di hitung remendemennya
VIII. DATA HASIL PENGAMATAN
W NaNO3 = 5,2 gram
W KCl = 5 gram
W kertas saring = 0,9 gram W kertas+KNO3 = 6,5 gram
IX. REAKSI DAN PERHITUNGAN - Reaksi :
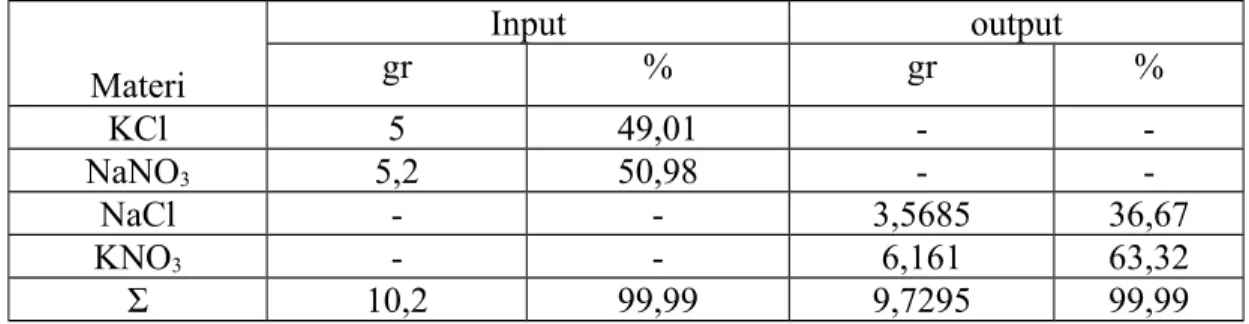
KCl + NaNO3 KNO3 + NaCl
- Perhitungan : 1 Secara teori a. Input : n KCl =
=
=
0,067 gr n NaNO3 = = = 0,061 gr b. Output :n larutan ( mol larutan ) = n terkecil dari n KCl dengan NaNO3 = 0,061 mol
W KNO3 = n larutan x BM KNO3
= 0,061 mol x 101 gr/mol = 6,161 gr
W NaCl terbentuk = n larutan x BM NaCl = 0,061 mol x 58,5 gr/mol = 3,5685 gr
Tabel 1. Material balance
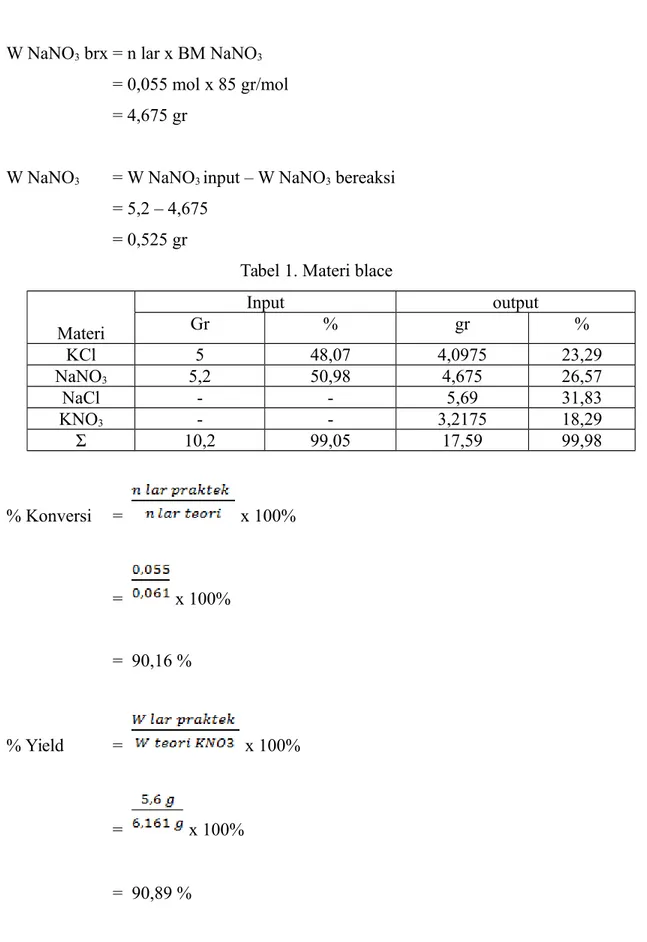
Materi Input output gr % gr % KCl 5 49,01 - -NaNO3 5,2 50,98 - -NaCl - - 3,5685 36,67 KNO3 - - 6,161 63,32 Σ 10,2 99,99 9,7295 99,99 2. Secara praktek a. input : n KCl = = = 0,067 mol
n NaNO3 = = = 0,061 mol b. Output n KNO3 = = = 0,055 mol
n Lar = n KNO3 = 0,055 mol
W NaCl = n lar x BM NaCl = 0,055 x 58,5 = 3,2175 gr WKCl brx = n lar x BM KCl
= 0,055 x 74,5 = 4,0975 gr
W KCl sisa = W KCl input – W KCl bereaktan = 5 – 4,0975
W NaNO3 brx = n lar x BM NaNO3
= 0,055 mol x 85 gr/mol = 4,675 gr
W NaNO3 = W NaNO3 input – W NaNO3 bereaksi
= 5,2 – 4,675 = 0,525 gr
Tabel 1. Materi blace Materi Input output Gr % gr % KCl 5 48,07 4,0975 23,29 NaNO3 5,2 50,98 4,675 26,57 NaCl - - 5,69 31,83 KNO3 - - 3,2175 18,29 Σ 10,2 99,05 17,59 99,98 % Konversi = x 100% = x 100% = 90,16 % % Yield = x 100% = x 100% = 90,89 %
% Kesalahan = x 100%
= x 100%
= 9,10 %
X. PEMBAHASAN
Pada percobaan kali ini keompok kami membahas mengenai pembuatan kalium nitrat. Adapun tujuan percobaannya untuk mempelajari pembuatan garam kalium nitrat hasil reaksi antara natrium nitrat dengan kalium klorida serta mempelajari pemisahan garam tersebut dari hasil samping berupa natrium klorida berdasarkan perbedaan kelarutan.
Reaksi pembuatan kalium nitrat merupakan reaksi yang reversible atau reaksi bolak – balik. Yang artinya antara laju pembentukan produk serta laju reaktan itu seimbang. Selain itu pada kesetimbangan jumlah mol reaktan sama dengan jumlah mol produk yang dihasilkan. Dalam percobaan ini,untuk melarutkan sempurna antara kalium klorida dan natrium nitrat digunakan air panas. Penggunaan air panas
ditunjukkan untuk mempercepat proses kelarutan kareana kalium klorida dan natrium nitrat termasuk kedalam yang sedikit sukar larut di dalam pelarut air.
Untuk menghilangkan kelebihan air,maka dilakukan penguapan dengan cara pemanasan terhadap larutan itu hingga volumenya berkurang dari volume awal. Pemanasan pertama digunakan untuk mengikat pengotor dan menguapkan natrium nitrat. Kemudian kami saring larutan itu dalam keadaan masih panas sehingga pengotor akan tersaring pada kertas saring. Karena penyaringan pertama berfungsi untuk mengikat kotoran. Kemudian filtrate dari hasil penyaringan pertama yang di dapat di uapkan lagi dengan proses pemanasan kedua. Pemanasan kedua berfungsi untuk menghilangkan pengotor. Pemanasan ini dilakukan hingga volume awal sedikit berkurang. Kemudian larutan tersebut disaring selagi panas. Penyaringan yang kedua berfungsi untuk membentuk endapan yang berupa kristal. Namun sebelum penyaringan kedua,kertas saring itu di timbang terlebih dahulu. Hal ini dilakukan agar kita bisa mengetahui hasil kristal yang kita peroleh dari percobaan tersebut.
Proses ini dinamakan rekristalisasi. Rekristalisasi memiliki pengertian sebagai proses pemurnian suatu zat yang terbentuk kristal berdasarkan pada perbedaan daya larut antara zat yang dimurnikan dengan kotoran suatu pelarut tertentu. Factor – factor yang mempengaruhi kelarutan ada bermacam – macam. Yang pertama suhu atau temperature,semakin besar suhu maka kelarutan suatu larutan akan semakin besar. Yang kedua luas permukaan,semakin kecil luas permukaan suatu zat terlarut maka kelarutannya akan semakin besar. Yang ketiga konsentrasi zat terlarut dan pelarut,bila konsentrasi zat terlarutnya besar maka kelarutannya kecil begitupun sebaliknya apabila konsentrasi zat pelarutnya besar maka kelarutannya akan besar. Yang keempat ion senama,apabila ada ion senama dalam suatu larutan maka kelarutannya akan semakin kecil karena adanya kompetensi antara zat – zat di dalam larutan tersebut. Yang kelima ion asing,apabila ada ion asing dalam suatu larutan maka kelarutannya akan semakin besar.
Endapan terbentuk jika larutan lewat jenuh,yang artinya nilai hasil kali konsentrasi ion – ion di dalam larutan tersebut lebih besar dari nilai ketetapan hasil
kali kelarutannya atau disebut nilai Ksp. Dalam percobaan ini,digunakan analisa kualitatif dan analisa kuantitatif. Analisa kualitatif merupakan analisa kimia yang didasarkan pada pengamatan jenis suatu zat. Analisa kuantitatif merupakan analisa kimia yang digunakan untuk \mengetahui berapa banyak jumlah zat dalam satu campuran atau zat tunggal. Dalam percobaan ini,analisa kualitatif digunakan untuk mengamati terbentuknya kristal garam,sedangkan analisa kuantitatif didasarkan pada perhitungan dari berat garam KNO3 yang di dapat.
XI. KESIMPULAN
1. Garam terbentuk dari reaksi antara basa kation dan asam anion.
2. Reaksi pembuatan KNO3 berupa reaksi reversible antara kalium klorida dan
natrium nitrat dengan hasil samping garam natrium klorida. 3. KNO3 yang didapat berbentuk seperti kristal jarum
4. Rekristalisasi berfungsi untuk memurnikan kembali kristal.
DAFTAR PUSTAKA
Anonim. 2011. Nitrat ( online ). http://id.wikipedia.org/wiki/asam-nitrat.html. Diakses pada tanggal 05 Desember 2011 pukul 20 : 00 WIB.
Hasyim,Muttaqin. 2009. Manfaat Kalium Nitrat ( online ).
http://muttaqinhasyim.wordpress.com/2009/05/14/manfaat-kalium-nitrat.html.
Diakses pada tanggal 05 Desember 2011 pukul 20 : 00 WIB.
Intan, Nur. 2010. Pembuatan Kalium Nitrat dan Natrium Klorida ( online ).
http://arhintan271.wordpress.com/2010/06/27/pembuatan-kalium-nitrat-dan-natrium-klorida . Diakses pada tanggal 05 Desember 2011 pukul 20 : 00 WIB.
Rihin. 2010. Pembuatan Kalium Nitrat ( online ).
http://rihin.blogspot.com/2010/05/pembuatan-kalium-nitrat.html . Diakses
Pembuatan kalium Nitrat
Senyawa kimia asam nitrat (H N O3) adalah sejenis cairan korosif yang tak
berwarna, dan merupakan asam beracun yang dapat menyebabkan luka bakar. Larutan asam nitrat dengan kandungan asam nitrat lebih dari 86% disebut sebagai asam nitrat berasap, dan dapat dibagi menjadi dua jenis asam, yaitu asam nitrat berasap putih dan asam nitrat berasap merah Asam nitrat adalah larutan asam kuat yang mempunyai nilai pKa sebesar -2. Di dalam air, asam ini terdisosiasi menjadi ion-ionnya, yaitu ion nitrat NO3− dan ion hidronium (H3O+). Garam dari asam nitrat
disebut sebagai garam nitrat (contohnya seperti kalsium nitrat atau barium nitrat). Dalam temperatur ruangan, asam nitrat berbentuk uap berwarna merah atau kuning Asam nitrat murni (100%) merupakan cairan tak berwarna dengan berat jenis 1.522 kg/m³. Ia membeku pada suhu -42 °C, membentuk kristal-kristal putih, dan mendidih pada 83 °C. Ketika mendidih pada suhu kamar, terdapat dekomposisi (penguraian) sebagian dengan pembentukan nitrogen dioksida sesudah reaksi:
4HNO3 → 2H2O + 4NO2 + O2 (72 °C)
yang berarti bahwa asam nitrat anhidrat sebaiknya disimpan di bawah 0 °C untuk menghindari penguraian. Nitrogen dioksida (NO2) tetap larut dalam asam nitrat yang
membuatnya berwarna kuning, atau merah pada suhu yang lebih tinggi. Manakala asam murni cenderung mengeluarkan asap putih ketika terpapar ke udara, asam dengan nitrogen dioksida terlarut mengeluarkan uap berwarna coklat kemerah-merahan, yang membuatnya dijuluki "asam berasap merah" atau "asan nitrat berasap". Asam nitrat berasap juga dirujuk sebagai asam nitrat 16 molar (bentuk paling pekat asam nitrat pada temperatur dan tekanan standar)
(anonym. http://id.wikipedia.org/wiki/asam-nitrat.html)
Sebagai mana asam pada umumnya, asam nitrat bereaksi dengan alkali, oksida basa, dan karbonat untuk membentuk garam, seperti amonium nitrat. Karena memiliki sifat mengoksidasi, asam nitrat pada umumnya tidak menyumbangkan protonnya (yakni, ia tidak membebaskan hidrogen) pada reaksi dengan logam dan garam yang dihasilkan biasanya berada dalam keadaan teroksidasi yang lebih tinggi.Karenanya, perkaratan (korosi) tingkat berat bisa terjadi. Perkaratan bisa
dicegah dengan penggunaan logam ataupun aloi anti karat yang tepat. Sebagai sebuah oksidator yang kuat, asam nitrat bereaksi dengan hebat dengan sebagian besar bahan-bahan organik dan reaksinya dapat bersifat eksplosif. Produk akhirnya bisa bervariasi tergantung pada konsentrasi asam, suhu, serta reduktor. Reaksi dapat terjadi dengan semua logam kecuali deret logam mulia dan aloi tertentu. Karakteristik ini membuat asam nitrat menjadi agen yang umumnya digunakan dalam uji asam. Sebagai kaidah yang umum, reaksi oksidasi utamanya terjadi dengan asam pekat, memfavoritkan pembentukan nitrogen dioksida (NO2).
(Hadi Muttaqin. http://muttaqinhasyim.wordpress.com/2009/05/14/manfaat-kalium-nitrat.html)
Senyawa kimia kalium nitrat merupakan sumber alami mineral nitrogen. Senyawa ini tergolong senyawa nitrat dengan rumus kimia K N O3 Merupakan
komponen bubuk hitam teroksidasi (disuplai oksigen). Sebelum fiksasi industri nitrogen skala besar (proses Haber), sumber utama Kalium nitrat ialah deposit yang mengkristalisasikan dari dinding gua atau mengalirkan bahan organik yang membusuk. Tumpukan kotoran juga sumber umum yang utama: amonia dari dekomposisi urea dan zat nitrogen lainnya akan melalui oksidasi bakteri untuk memproduksi nitrat. Salah satu penerapan yang paling berguna dari kalium nitrat ialah dalam produksi asam sendawa, dengan menambahkan asam sulfat larutan encer kalium nitrat, menghasilkan asam sendawa dan kalium sulfat yang terpisah melalui distilasi fraksional. yang terkonsentrasi pada
Kalium nitrat juga digunakan sebagai pupuk, sebagai model bahan pembakar rocket, dan dalam beberapa petasan seperti bom asap, pada yang mana campuran dengan gula memproduksi jelaga asap 600 kali dari volumnya sendiri. Dalam proses pengawetan makanan, kalium nitrat merupakan komposisi umum dari daging yang diasinkan.
Untuk mengetahui kemurnian dari kalium nitrat dan natrium klorida, maka dilakukan uji nyala, uji ion klorida, dan uji ion nitrat.
Pada uji nyala digunakan HCl untuk mensterilkan kawat platina dari kotoran. Kristal ada yang menghasilkan nyala kuning dan adapula yang menghasilkan nyala ungu. Nyala kuning berasal dari ion Na= sedangkan nyala ungu berasal dari ion K=.
perbandingan warna yang dihasilkan disebabkan karena adanya energy tertentu dari nyala api yang diserap oleh electron-elektron dalam atau logam hingg terjadi eksitasi dan kembalinya electron-elektron ke peringkat dasar dan membebaskan energy nyala yang khas.
Pada pengujian klorida, Kristal diencerkan dengan aquades kemudian ditambahkan dengan HNO3 dan AgNO3. Larutan HNO3 digunakan sebagai katalisator. Adapun
persamaan reaksinya yaitu:
NaCl + AgNO3HNO3 NaNO3 + AgCl
Pada pengujian ion nitrat, Kristal terlebih dahulu dilarutkan kemudian ditambahkan FeSO4 dan H2SO4. Menurut teori adanya ion nitrat ditunjukkan dengan adanya cincin
coklat pada Kristal.
(Nur Intan. http://arhintan271.wordpress.com/2010/06/27/pembuatan-kalium-nitrat-dan-natrium-klorida)