Laporan Praktikum Hari/tanggal: Selasa/17-09-2013
Biokimia Waktu : 11.00-12.40 WIB
PJP : Puspa Julistia Puspita, S. Si, M.Sc
Asisten : 1. Resti Siti Muthmainah, S. Si 2. Lusianawati, S. Si
KARBOHIDRAT II
Kelompok 7 Muthia Irhamna J3L112030 Diah Ayuning T. J3L112092 Lusy Andestiana J3L112152
PROGRAM KEAHLIAN ANALISIS KIMIA PROGRAM DIPLOMA
INSTITUT PERTANIAN BOGOR BOGOR
PENDAHULUAN
Karbohidrat dapat diklasifikasikan menjadi dua kelompok besar yaitu karbohidrat sederhana (monosakarida) dan karbohidrat kompleks (disakarida, oligosakarida, polisakarida). Monosakarida adalah suatu karbohidrat yang tidak dapat dihidrolisis menjadi molekul yang lebih sederhana lagi. Monosakarida dapat diklasifikasikan, apakah mengandung gugus ketosa atau aldosa. Awalan aldo dan keto menunjukkan jenis gugus aldehida atau keton di dalam suatu sakarida, sedangkan akhiran –osa menunjukkan karbohidrat (Riswiyanto, 2009).
Polisakarida adalah karbohidrat yang jika dihidrolisis menghasilkan lebih dari 6 gugus monosakarida. Contohnya yaitu: Glikogen, Amilum, Selulosa dan Dextrin. Berdasarkan fungsinya polisakarida dibagi menjadi polisakarida sebagai bahan bakar (glikogen dan amilim) dan polisdakarida sebagai struktural (dextran, kitin dan selulosa) (Suhara, 2009). Polisakarida yang digunakan dalam praktikum ini adalah bermacam – macam tepung seperti tepung pati, agar – agar, dan gum arab. Sedangkan untuk monosakarida dan disakaridanya digunakan glukosa, fruktosa, sukrosa, laktosa, dan maltosa.
Amilum atau dalam bahasa sehari – hari disebut pati terdapat pada umbi, daun, batang, dan biji – bijian. Amilum terdiri atas dua macam polisakarida yang kedua – duanya adalah polimer dari glukosa, yaitu amilosa (kira – kira 20-80%) sisanya amilopektin. (Poedjiadi dan Supriyanti, 2006).
Agar- agar merupakan komoditi yang sudah lama ada dan dikenal di Indonesia. Kata agar – agar sendii berasal dari bahasa melayu yang artinya rumput laut. Bahan baku yang digunakan pada pembuatan agar – agar adalah rumput laut
Gracilaria spp, NaOCl, NaOH, dan HCl (Winarno, 1990).
Uji kualitatif yang dapat dilakukan pada karbohidrat adalah uji Selliwanoff, uji Osazon, uji Tauber, dan uji Iod. Pada uji Osazon, yang mendasarinya adalah pemanasan karbohidrat yang memiliki gugus aldehida atao keton bersama fenilhidrazin berlebihan akan membentuk hidrazon atau osazon. Osazon yang terbentuk mempunyai bentuk kristal dan titik lebur yang spesifik. Sedangkan pada uji Tauber adalah reaksi positif terhadap pentosa dan negatif terhadap heksosa. Reagen tauber terdiri dari larutan 4% benzidin dalam asam asetat glacial. Reaksi pentosa dihidrolisis oleh asam asetat glacial menjadi furfural. Furfural yang terbentuk akan bereaksi dengan 4% benzidin membentuk kompleks senyawa berwarna merah anggur. Arabinosa termasuk pentosa (aldopentosa) sehingga memberi reaksi positif terhadap reagen Tauber, sedang glukosa dan fruktosa termasuk heksosa sehingga reaksinya negative (Bintang, 2010). Namun pada praktikum kali ini hanya dilakukan uji Selliwanoff dan uji Iod.
TUJUAN
Praktikum bertujuan mengamati struktur beberapa karbohidrat melalui sifat reaksinya dengan reagen uji Selliwanoff dan uji Iod.
METODE
Pada praktikum bahan – bahan yang digunakan adalah glukosa 1%, fruktosa 1%, sukrosa 1%, laktosa 1%, maltose 1%, pati 1%, pereaksi Selliwanof, larutan iod encer, arabinose, gum arab, tepung pati, tepung agar – agar, dan larutan pati. Sedangkan alat – alat yang digunakan adalah penangas air, tabung rekasi, papan uji, dan alat – alat gelas.
Uji yang kedua adalah uji Iod. Tepung bahan uji dimasukkan sedikit ke dalam papan uji. Larutan iod encer ditambahkan satu tetes. Lalu dicampurkan dengan rata
HASIL DAN PEMBAHASAN
Prinsip reaksi uji Selliwanoff tergantung pada pembentukan 4-hidroksi-metil-furfural dan reaksi dengan resorsinol (1,3-dihidroksi benzena) untuk
Bahan Uji Hasil Pengamatan (+/-) Perubahan warna larutan
Glukosa - Tak berwarna
Gambar 1. Hasil uji Selliwanoff pada A (pati), B (maltosa), C (sukrosa), D (laktosa), E (fruktosa), dan F (glukosa).
begitu juga sukrosa yang merupakan disakarida dari glukosa dan fruktosa. Penyebab terjadinya kesalahan ini adalah pereaksi Selliwanoff yang digunakan tidak dalam keadaan segar, sedangkan pereaksi ini harus selalu dibuat segar, dan tidak dapat disimpan untuk digunakan pada hari berikutnya. Pereaksi Selliwanoff tebuat dari resorsinol dalam HCl 1:2.
Warna merah yang terbentuk merupakan hasil kondensasi dari resorsinol yang sebelumnya didahului dengan pembentukan hidroksimetik furfural yang berasal dari konversi fruktosa oleh HCl pekat, kemudian menghasilkan asam levulinat dan hidroksimetik furfural ( Bintang, 2010). Reaksi yang terjadi adalah sebagai berikut
Gambar 2. Reaksi pada uji Selliwanof (Sumardjo 2006)
Uji Selliwanoff ini bertujuan untuk membedakan gula aldose dan ketosa. Ketosa dibedakan dari aldosa karena adanya gugus fungsi keton atau aldehida pada gula tersebut. Fungsi pemanasan yang dilakukan adalah karena uji ini didasarkan pada fakta ketika dipanaskan, yaitu ketosa lebih cepat terdehidrasi daripada aldosa.
Pada uji Iod, didapatkan hasil positif pada polisakarida yang mengandung amilum yaitu tepung pati dan larutan pati sesuai dengan Tabel 2 berdasarkan hasil praktikum.
Tabel 2 Hasil Uji Iod
Bahan Uji Hasil Pengamatan (+/-) Perubahan warna larutan
Tepung pati + Biru
Tepung gum arab - Jingga
Tepung agar – agar - Coklat
Pati menujukkan hasil yang positif pada uji iod (lihat Gambar 3). Pati dapat dipisahkan oleh macam-macam pelarut dan teknik pengendapan menjadi dua bagian yaitu amilosa dan amilopektin. Amilosa 20% dari unit penyusun pati, unit-unit glukosa (50-300) membentuk rantai lurus yang berikatan menurut ikatan 1.4 yang berbentuk heliks dalam larutan, karena adanya ikatan dengan konfigurasi alfa pada setiap unit glukosa. Bentuk ini dengan enam unit glukosa per putaran heliks menyebabkan amilosa membentuk kompleks dengan macam-macam molekul kecil yang dapat masuk ke dalam kumparannya. Larutan iod yang terbuat dari kalium iodida yang didalamnya terlarut I2. Iodin tersebut yang dapat masuk
ke kumparan heliks dan membentuk kompleks berwarna biru. Pati yang membentuk kompleks berwarna biru tua merupakan contoh dari pembentukan kompleks tersebut. Sedangkan gum arab dan agar-agar menunjukan hasil yang negatif pada uji iod karena tidak tersusun dari amilosa.
Larutan pati akan bereaksi dengan iod membentuk warna biru, karena iod masuk ke dalam kumparan molekul pati. Senyawa ini hanya stabil dalam larutan dingin. Pada pemanasan, warna biru akan hilang karena molekul pati meregang, sehingga iod lepas dari kumparan pati, tetapi akan kembali menjadi biru bila didinginkan (Bintang, 2010).
Gambar 3. Hasil uji Iod pada A (tepung pati), B (tepung gum arab), C (tepung agar-agar), D (larutan pati)
D C
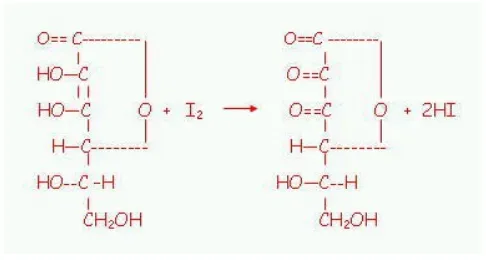
Gambar 4. Reaksi uji Iod (Sumardjo 2006)
SIMPULAN
Berdasarkan hasil percobaan dapat disimpulkan bahwa semua bahan uji negative pada uji Selliwanof yang seharusnya positif untuk fruktosa dan sukrosa. Pati positif untuk uji iod baik pada tepung pati maupun larutan pati.
DAFTAR PUSTAKA
Bintang, Maria. 2010. Biokimia Teknik Penelitian. Bogor: Erlangga.
Gaonkar, A. G. 1995. Inggredient Interactions Effects on Food Quality. Marcell Dekker, Inc., New York
Poedjiadi, Anna dan Supriyanti, Titin. 2006. Dasar – Dasar Biokimia. Bandung: UI – PRESS.
Riswiyanto. 2009. Kimia Organik. Jakarta: Erlangga.
Suhara. 2009. Dasar – Dasar Biokomia. Bandung: Prima Press.
Sumardjo, Damin. 2006. Pengantar Kimia: Buku Panduan Kuliah Mahasiswa Kedokteran dan Program Strata I Fakultas Bioeksakta. Jakarta: Penerbit Buku Kedokteran EGC.
Winarno, G.F. 2004. Kimia Pangan dan Gizi. Jakarta: Gramedia.