PRAKTIKUM BIOKIMIA I
IDENTIFIKASI
SENYAWA KARBOHIDRAT
FINAL MUDRAWAN (4143331010)
KIMIA EKS DIK A 2014
ABSTRAK
Karbohidrat adalah polihidroksi aldehida atau keton dengan rumus empirik (CH2O)n, dapat diubah menjadi aldehida dan keton dengan cara hidrolisis. Metode untuk uji kualitatif karbohidrat adalah uji Molish untuk mengetahui adanya karbohidrat dengan menghasilkan warna cincin ungu, uji Barfoed untuk mengetahui adanya gula monosakarida pereduksi dengan menghasilkan warna orange, uji Benedict untuk mengetahui gula pereduksi dengan warna merah bata, dan uji selliwanof untuk mengetahui adanya gula ketosa dengan menghasilkan warna merah. Dari hasil pengujian yang telah dilakukan, pada uji Molish semua sampel mengandung karbohidrat dengan memberikan hasil (+). Pada uji Barfoed maltosa dan amilum memberikan hasil (-) sehingga maltosa dan amilum bukan termasuk gula monosakarida pereduksi. Pada uji Seliwanof hanya fruktosa dan sukrosa yang memberikan hasil (+), karena kedua sampel tersebut mengandung gugus keton. Pada uji benedict hanya amilum yang memberikan hasil (-), karena amilum merupakan polisakarida dan bukan termasuk gula pereduksi.
KATA PENGANTAR
Segala puji skita ucapkan kepada Tuhan Yang Maha Esa yang senantiasa menyertai dan memberikan kasihNya yang tak berbatas bagi seluruh makhluk ciptaanNya. Hanya oleh kehendakNya pula makalah ini, dapat diselesaikan dengan waktu yang telah di tentukan.
Semoga makalah ini dapat bermanfaat bagi kita semua dan dengan adanya penyusunan makalah seperti ini, pembaca dapat belajar dengan baik dan benar mengenai identifikasi ataupun uji reaksi terhadap karbohidrat
Penulis menyadari bahwa masih banyak kekurangan dan kesalahan dalam pengerjaan makalah ini. Penulis juga mengharapkan kritik dan saran yang bersifat membangun dan untuk kemajuan pengetahuan terutama untuk dalam hal pelajaran kimia, sehingga diharapkan dapat memberikan pedoman untuk mempebelajaran serta dapat memberikan petunjuk penulisan yang teratur dan tersusun rapi tanpa ada unsur kesengajaan yang sama dari pihak lainnya.
Akhir kata, penulis berharap semoga makalah ini dapat memberikan manfaat bagi penulis sendiri maupun bagi pembaca nya agar dapat memperluas pengetahuan kita semua.
Medan, Mei 2016
Penulis
DAFTAR ISI
ABSTRAK ...i
KATA PENGANTAR...ii
DAFTAR ISI... iii
DAFTAR GAMBAR...v
DAFTAR TABEL ...vi
BAB I PENDAHULUAN...1
1.1. Pengertian Karbohidrat...1
1.2. Perumusan Masalah...2
1.3. Tujuan ...2
BAB II PEMBAHASAN...3
2.4. Karbohidrat ...3
2.5. Jenis Jenis Karbohidrat ...3
2.2.1. Gula sederhana (monosakarida) ...3
2.2.2. Oligosakarida ...3
2.2.3. Polisakarida ...4
2.6. Contoh Karbohidrat ...4
2.6.1. Sukrosa ...4
2.6.2. Maltosa ...4
2.6.3. Laktosa ...5
2.6.4. Heksosa ...5
2.6.5. Hemiselulosa ...5
2.6.6. Pati...5
2.7. Karbohidrat Polimer Tinggi ...6
2.7.1. Karbohidrat polimer yang sangat tinggi...6
2.7.2. Karbohidrat polimer tinggi...7
2.8. Uji karbohidrat ...7
2.8.1. Uji Benedict...8
2.8.2. Uji Barfoed ...8
2.8.3. Uji Molisch...9
2.8.4. Uji Selliwanof ...11
2.8.5. Uji Bial ...12
2.8.6. Uji Iodium ...13
2.9. Identifikasi Karbohidrat...13
2.9.1. Uji untuk karbohidrat, disakarida dan monosakarida dalam kertas tisu dan faunated dan defaunated cacing tanah...13
2.9.2. Uji gula pada nanas ...14
2.9.3. Identifikasi karbohidrat pada kentang ...15
2.9.4. Identifikasi karbohidrat pada ubi ganyong...15
2.9.5. Pengaruh pelarut dalam ekstraksi terhadap hasil uji karbohidrat...16
BAB III KESIMPULAN...18
DAFTAR PUSTAKA...19
DAFTAR GAMBAR
Gambar 2.1 Butir-butir pati, salah satu jenis karbohidrat cadangan makanan pati tumbuhan,
dilihat dengan mikroskop cahaya...6
Gambar 2.2 Reaksi umum uji Benedict ...8
Gambar 2.3 Hasil Uji Benedict negatif (kiri) dan positif (kanan) ...8
Gambar 2.4 Reaksi umum uji Barfoed ...9
Gambar 2.5 Hasil uji Barfoed negatif (kiri) dan positif (kanan)...9
Gambar 2.6. Reaksi umum uji Molisch ...10
Gambar 2.7 Pembentukan senyawa kompleks biru uji Molisch...10
Gambar 2.8 Hasil uji Molisch negatif (kiri) dan positif (kanan) ...10
Gambar 2.9 Reaksi uji Selliwanof ...11
Gambar 2.10 Hasil uji Selliwanof negatif (kiri) dan uji positif (kanan) ...11
Gambar 2.11 Reaksi uji Bial ...12
Gambar 2.12 Hasil uji Bial negatif (kiri dan tengah) dan positif (kanan) ...12
Gambar 2.13 Pembentukan kompleks biru iod amilum...13
Gambar 2.14 Hasil uji Benedict tepung dan pati umbi ganyong ...15
Gambar 2.15 Hasil uji karbohidrat yang diekstraksi dengan berbagai pelarut ...16
DAFTAR TABEL
Tabel 2.1 Hasil uji selliawanof ...11
Tabel 2.2 Hasil uji orsinol bial...12
Tabel 2.3 Reaksi dari kertas tisu dan pelet feses dari faunated dan defaunated cacing tanah untuk uji karbohidrat yang berbeda ...14
Tabel 2.4 Hasil uji dengan gula pada nanas dengan tiga reagen ...14
Tabel 2.5 Hasil tes umum untuk polisakarida...15
Tabel 2.6 Ringkasan dari uji atau reaksi di praktikum biokimia ...17
BAB I
PENDAHULUAN
1.1. Pengertian Karbohidrat
Karbohidrat merupakan sumber energi utama bagi tubuh manusia, yang menyediakan 4 kalori (kJ) energi pangan pergram. Karbohidrat juga mempunyai peranan penting dalammenentukan karakteristik bahan makanan, misalnya, rasa, warna, tekstur, dan lain-lain.
Sedangkan dalam tubuh, karbohidrat berguna untuk mencegah timbulnya ketois, pemecahan tubuh protein yang berlebihan, kehilangan mineral, dan berguna untuk membantu metabolisme lemak dan protein. Dalam tubuh manusia karbohidrat dapat dibentuk dari beberapa asam amino dan sebagian lemak. Tetapi sebagian besar karbohidrat diperoleh dari bahan makanan yang dimakan sehari-hari, terutama bahan makanan yang berasal dari tumbuh-tumbuhan. Pada tanaman karbohidrat dibentuk dari reaksi CO2 dan H2O dengan bantuan sinar matahari melalui proses fotosintesis dalam sel tanaman yang berklorofil (Winarno, 2004).
Karbohidrat adalah zat organik utama yang terdapat dalam tumbuh-tumbuhan dan biasanya mewakili 50 sampai 75 persen dari jumlah bahan kering dalam bahan makanan ternak. Karbohidrat sebagian besar terdapat dalam biji, buah dan akar tumbuhan. Zat tersebut terbentuk oleh proses fotosintesis, yang melibatkan kegiatan sinar matahari terhadap hijauan daun. Hijauan daun merupakan zat fotosintetik aktif pada tumbuh-tumbuhan. Zat tersebut merupakan molekul yang rumit dengan suatu struktur yang serupa dengan struktur hemoglobin, yang terdapat dalam darah hewan. Hijauan daun mengandung magnesium serta hemoglobin mengandung besi. Lebih terperinci lagi, karbohidrat dibentuk dari air (H2O) berasal dari tanah, karbondioksida (CO2) berasal dari udara dan energi berasal dari matahari.
Suatu reaksi kimiawi sederhana yang memperlihatkan suatu karbohidrat (glukosa) disintesis oleh fotosintesis dalam tumbuh-tumbuhan adalah :
6CO2+ 6H2O + 673 calC6H12O6+ 6O2
Karbohidrat bersama seyawa lemak dan protein memegang peranan dasar bagi kehidupan di bumi. Karbohidrat merupakan bahan makanan penting dalam sumber tenaga yang terdapat dalam tumbuhan dan hewan. Selain itu karbohidrat juga menjadi komponen stuktur penting pada mahluk hidup dalam bentuk serat (fiber), seperti selulosa, pektim, serta lignin. Karbohidrat menyediakan kebutuhan dasar yang diperlukan tubuh (Sumardjo, 2009).
1.2. Perumusan Masalah
Dari persoalan di atas, rumusan masalahnya adalah:
1. Bagaimana cara mengetahui adanya karbohidrat dalam sampel?
2. Bagaimana karakteristik pati/amilum melalui uji iodium?
3. Bagaimana kehadiran gugus aldehid atau keton bebas pada karbohidrat yang dapat mereduksi ion-ion logam tertentu (cu dan ag)/ gula reduksi?
4. Apa perbedaan antara monosakarida dan disakarida?
5. Apa bukti adanya gugus ketosa (fruktosa)?
1.3. Tujuan
Adapun tujuan melakukan praktikum uji kabohidrat, yaitu sebagai berikut :
1. Mengidentifikasi adanya karbohidrat dalam sampel,
2. Menentukan karakteristik pati/amilum melalui uji iodium,
3. Membuktikan kehadiran gugs aldehid atau keton bebas pada karbohidrat yang dapat mereduksi ion-ion logam tertentu (Cu dan Ag)/ gula reduksi,
4. Membedakan antara monosakarida dan disakarida, dan
5. Membuktikan adanya gugus ketosa (fruktosa)
BAB II PEMBAHASAN
2.1. Karbohidrat
Secara biokimia, karbohidrat adalah polihidroksil-aldehida atau polihidroksil-keton, atau senyawa yang menghasilkan senyawa-senyawa ini bila dihidrolisis. Karbohidrat mengandung gugus fungsi karbonil (sebagai aldehida atau keton) dan banyak gugus hidroksil.
Pada awalnya, istilah karbohidrat digunakan untuk golongan senyawa yang mempunyai rumus (CH2O)n, yaitu senyawa-senyawa yang n atom karbonnya tampak terhidrasi oleh n molekul air. Namun, terdapat pula karbohidrat yang tidak memiliki rumus demikian dan ada pula yang mengandung nitrogen, fosforus, atau sulfur. (https://id.wikipedia.org/)
Dalam kondisi rendah karbohidrat, tidak seperti orang-orang kelaparan, konsentrasi glukosa tetap dipertahankan meskipun kurangnya asupan karbohidrat. Pemeliharaan dari konsentrasi glukosa dan kurangnya pemecahan protein endogen merupakan perbedaan penting antara kelaparan dan asupan karbohidrat sangat rendah. (Westman et al., 2007:277) 2.2. Jenis Jenis Karbohidrat
Gula sederhana (monosakarida) 2.2.1.
Monosakarida yaitu senyawa yang mengandung enam atau lima atom karbon.
Monosakarida tidak terhidroilisis menjadi lebih sederhana lagi, tetapi hasil dari hidrolisis dari tiga golongan yang lain. Monosakarida merupakan senyawa yang tidak berwarna, mempunyai rasa manis dan berbentuk kristal dan larut dalam air. Salah satu jenis monosakarida yang penting adalah glukosa atau gula yang memiliki enam atom karbon, dengan rumus kimia yaitu C Glukosa merupakan monosakarida yang paling umum dan senyawa organik yang paling banyak terdapat di alam.
Oligosakarida 2.2.2.
Oligosakarida yaitu senyawa yang berisi dua atau lebih gula sederhana yang dihubungkan oleh pembentukan asetal antara gugus aldehid atau keton dengan gugus hidroksil. Jika dua gula sederhana digabung akan menjadi disakarida, tiga gula sederhana digabung menjadi trisakarida. Ikatan penghubung bersama - sama gula ini disebut glikosida.
Senyawa ini juga larut dalam air, sedikit larut dalam alkohol dan tidak larut dalam eter.
Ikatan glikosida dapat terhidrolisis oleh asam encer menghasilkan komponen monosakarida.
Disakarida yang banyak terdapat di alam adalah sukrosa, laktosa dan maltosa.
Polisakarida 2.2.3.
Polisakarida yaitu senyawa yang terdirir atas banyak ikatan gula sederhana yang dihubungkan dalam ikatan glikosida. Polisakarida meliputi : pati, selulosa dan dekstrin, merupakan substansi yang amorph yang sebagian tidak larut dalam air dan tidak berasa (Hamidjojo, 2005).
2.3.Contoh Karbohidrat 2.3.1. Sukrosa
Sukrosa mengandung glukosa dan fruktosa. Sukrosa ditemukan dalam tebu. Sukrosa adalah non gula pereduksi. Formula sukrosa C12H22O11. Sukrosa dihidrolisis oleh sukrase menjadi fruktosa dan glukosa. Tanaman membentuk sukrosa dan hewan lainnya tidak bisa membuat sukrosa. Hal ini secara alami ditemukan pada tanaman. Nenas dan aprikot merupakan sumber utama dari sukrosa. Sukrosa dihidrolisis menjadi glukosa dan fruktosa.
Lebih dari konsumsi sukrosa memiliki efek yang merugikan kesehatan seperti karies gigi.
Karies gigi, bakteri mulut mengubah gula menjadi asam yang menyerang enamel gigi. Lebih dari konsumsi sukrosa juga berhubungan dengan sindrom metabolik seperti diabetes mellitus.
Sebuah studi yang dilakukan pada tikus di mana tikus diberi makan diet yang mengandung dua pertiga dari sukrosa, di tingkat trigliserida mulai meningkat dan kemudian pada resistensi insulin dikembangkan. Pada tikus penelitian lain diberi makan diet kaya sukrosa yang dikembangkan hipertrigliseridemia, hiperglikemia dan resistensi insulin.
2.3.2. Maltosa
2.3.3. Laktosa
Ini juga disebut gula susu. Laktosa adalah disakarida yang ditemukan dalam susu.
Laktosa adalah molekul gula besar yang terdiri dari dua molekul gula yang lebih kecil, glukosa dan galaktosa. Laktosa dihidrolisis oleh laktase di usus. Intoleransi laktosa adalah ketika seseorang memiliki kesulitan atau tidak dapat mencerna susu karena kurangnya laktase. Anak-anak yang diduga intoleransi laktosa dapat dinilai secara klinis oleh eliminasi laktosa diet atau dengan tes termasuk non-invasif pengujian napas hidrogen atau invasif penentuan biopsi usus laktase (dan disaccharidase lainnya) konsentrasi. Manajemen mencakup penggunaan produk laktase-diperlakukan susu atau suplemen laktase lisan, pembatasan makanan yang mengandung laktosa, eliminasi orordairy. (Asif, 2011:002)
2.3.4. Heksosa
Heksosa, baik sebagai monomer (misalnya, glukosa) atau polimer (misalnya selulosa dan amilosa), adalah karbohidrat yang paling umum dikonsumsi oleh ruminansia karena serat dan pati dalam diet ruminansia. Selulosa adalah polisakarida paling melimpah di dinding sel tumbuhan dan menganugerahkan kekuatan struktural untuk tanaman. Amilosa dan amilopektin membentuk dua polisakarida penyimpanan yang paling melimpah di jaringan tanaman.
2.3.5. Hemiselulosa
Hemiselulosa biasanya sebuah heteropolimer terdiri dari arabinose dan xylose dengan jumlah yang lebih kecil dari glukosa, galaktosa dan rhamnose. (Pinder, 2012:715)
2.3.6. Pati
Dalam pati terdapat dua bagian, yaitu bagian yang larut dalam air disebut amilosa (10- 20%), dan bagian yang tak larut dalam air disebut amilopektin (80-90%). Amilosa dan amilopektin mempunyai rumus empiris (C6H10O5), dan bila dihidrolisis menunjukkan adanya sifat-sifat karbonil, dan pati tersusun atas satuan-satuan maltosa. Bila pati yang terdapat dalam sel dihidrolisis oleh enzim maka pati akan pecah menjadi bagian yang lebih kecil disebut dekstrin, sehingga diperoleh maltosa. Salah satu polisakarida yang terdapat dalam tanaman disebut inulin yang bila dihidrolisis akan memberikan warna kuning akan menghasilkan fruktosa dan sejumlah kecil dari glukosa (Sastrohamidjojo, 2005). Pati tidak larut dalam air dan dalam analisis pati, memberikan warna biru dengan iodium. Hasil hidrolisis pati/amilum adalah glukosa (Manatar dkk., 2012:89). Dalam proses hidrolisis rantai
polisakarida tersebut dipecah menjadi monosakarida-monosakarida. Hidrolisis adalah pemecahan suatu senyawa menggunakan air. Hidrolisis dengan larutan asam biasanya menggunakan larutan asam encer, dimana kecepatan reaksinya sebanding dengan konsentrasi asam (Mastuti & Dwi, 2010:23).
Kadar glukosa dan ethanol pada hasil fermentasi onggok yang dihidrolisa dengan asam klorida, asam sulfat, dan asam oksalat dengan konsentrasi asam, jumlah ragi, dan waktu fermentasi hasil optimasi. Kadar glukosa untuk onggok yang dihidrolisis dengan asam sulfat adalah 23,88%, asam klorida 23,73%, sedangkan asam oksalat 20,43%, karena pada proses hidrolisis (pemanasan), asam oksalat akan terurai menjadi H2O dan CO2 (Yusrin & Ana, 2010:24).
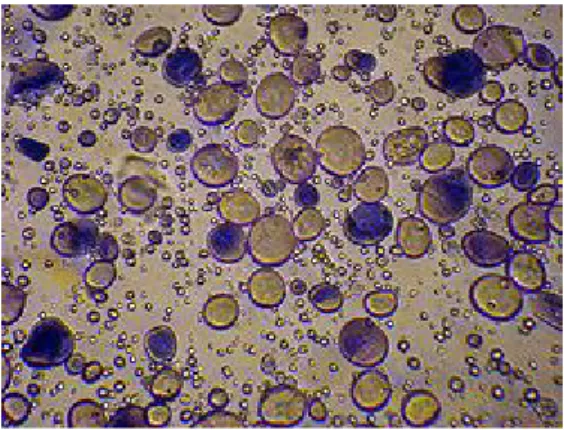
Gambar 2.1 Butir-butir pati, salah satu jenis karbohidrat cadangan makanan pati tumbuhan, dilihat dengan mikroskop cahaya
(https://id.wikipedia.org/wiki/Karbohidrat) 2.4. Karbohidrat Polimer Tinggi
2.4.1. Karbohidrat polimer yang sangat tinggi
Karbohidrat polimer yang sangat tinggi seperti selulosa, mannan, atau xylan, yang
2.4.2. Karbohidrat polimer tinggi
karbohidrat polimer tinggi, polisakarida diendapkan dengan larutan tembaga alkali terdiri dari mannan dan galactan. Biasanya glucan sedikit juga hadir. Dalam kasus biasanya panggang kopi arabika polisakarida con tains sekitar 94% mannan dan 6% galactan sementara ro busta kopi mengandung 88% mannan dan 10-12% galaktan. Biasanya kurang dari 0,5% glukan. Angka-angka ini hanya berlaku untuk isi polisakarida endapan. (Arya &
Jagan 2007:63) 2.5. Uji karbohidrat
Analisis kualitatif karbohidrat umumnya didasarkan atas reaksi- reaksi warna yang dipengaruhi oleh produk- produk hasil penguraian gula dalam asam-asam kuat dengan berbagai senyawa organik, sifat mereduksi dari gugus karbonil dan sifat oksidasi dari gugusan hidroksil yang berdekatan. Reaksi dengan asam-asam kuat seperti asam sulfat, hidroklorat dan fosfat pada karbohidrat menghasilkan pembentukan produk terurai yang berwarna. Beberapa analisis kualitatif karbohidrat yang sering dilakukan adalah uji Molish, uji Seliwanof, uji Antrone, dan uji Fenol (Andarwulan et al., 2011).
Analisis kuantitatif karbohidrat dalam suatu bahan yaitu dengan cara kimiawi, cara fisik, cara enzimatik atau biokimiawi dan cara kromatografi. Penentuan karbohidrat yang termasuk polisakarida maupun oligosakarida memerlukan perlakuan pendahuluan yaitu dihidrolisa terlebih dahulu sehingga diperoleh monosakarida. Penentuan karbohidrat dengan cara kromatografi adalah dengan mengisolasi dan mengidentifikasi karbohidrat dalam suatu campuran. Isolasi karbohidrat ini berdasarkan prinsip pemisahan suatu campuran berdasarkan atas perbedaan distribusi rationya pada fase diam dan fase gerak (Sudarmaji, 2004 ).
Untuk mengidentifikasi adanya polisakarida dapat digunakan kromatografi lapis tipis dengan cara menghidrolisis terlebih dahulu dengan asam. Hal ini dikarenakan polisakarida perlu diderivatisasi agar dapat terlihat pada lempeng kromatografi dan sulit larut dalam metanol. Karbohidrat terikat kuat pada fase diam sehingga fase gerak yang digunakan harus sangat polar. Fase gerak yang sering digunakan adalah butanol:piridin:air (Kaminska et al., 2009:42).
2.5.1. Uji Benedict
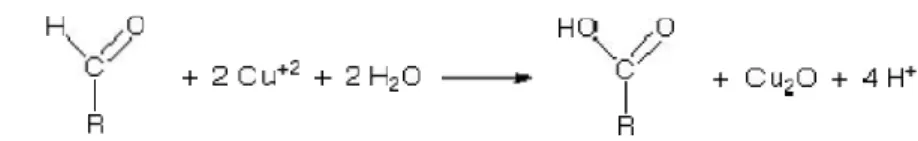
Uji Benedict bertujuan untuk mengetahui adanya gula pereduksi dalam larutan sampel. Prinsip dari uji ini adalah gugus aldehid atau keton bebas pada gula reduksi yang terkandung dalam sampel mereduksi ion Cu2+ dari CuSO4.5H2O dalam suasana alkalis menjadi Cu+ yang mengendap menjadi Cu2O. Suasana alkalis diperoleh dari Na2CO3dan Na sitrat yang terdapat pada reagen Benedict. Pada uji ini menghasilkan endapan merah bata yang menandakan adanya gula pereduksi pada sampel. Endapan yang terbentuk dapat berwarna hijau, kuning atau merah bata tergantung pada konsentrasi gula reduksinya.
semakin berwarna merah bata maka gula reduksinya semakin banyak (Kusbandari, 2015).
Gambar 2.2 Reaksi umum uji Benedict (http://www.harpercollege.edu/tm- ps/chm/100/dgodambe/thedisk/carbo/bened/benedict.htm)
Gambar 2.3 Hasil Uji Benedict negatif (kiri) dan positif (kanan)
(http://www.harpercollege.edu/tm-ps/chm/100/dgodambe/the
Gambar 2.4 Reaksi umum uji Barfoed (http://www.harpercollege.edu/tm- ps/chm/100/dgodambe/thedisk/carbo/barf/barfoed.htm)
Gambar 2.5 Hasil uji Barfoed negatif (kiri) dan positif (kanan)
(http://www.harpercollege.edu/tm-ps/chm/100/dgodambe/the disk/carbo/barf/barfoed.htm)
2.5.3. Uji Molisch
Uji Molisch ini adalah tes kimia sensitif untuk kehadiran karbohidrat, berdasarkan dehidrasi karbohidrat oleh asam sulfat atau asam klorida untuk menghasilkan aldehida, yang mengembun dengan dua molekul fenol (biasanya α- naftol, meskipun fenol lainnya (misalnya resorsinol, timol) juga memberikan produk berwarna), menghasilkan senyawa merah- atau ungu berwarna. Gula reduksi dioksidasi oleh ion tembaga dalam larutan untuk membentuk asam karboksilat dan endapan kemerahan tembaga (I) oksida dalam waktu tiga menit.
Mengurangi disakarida menjalani reaksi yang sama, tetapi melakukannya pada tingkat lebih lambat. (Anonymmous, 2014)
Gambar 2.6. Reaksi umum uji Molisch (http://www.harpercollege.edu/tm ps/chm/100/dgodambe/thedisk/carbo/molisch/molisch.htm)
Gambar 2.7 Pembentukan senyawa kompleks biru uji Molisch (Anonymmous, 2014)
2.5.4. Uji Selliwanof
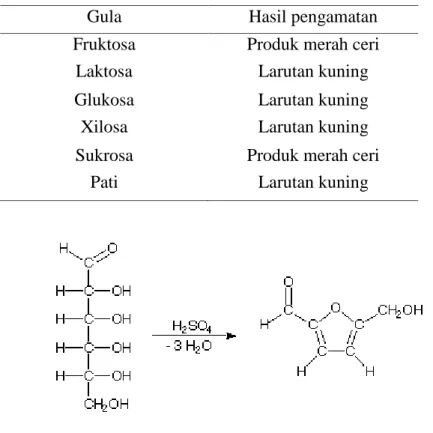
Uji Seliwanoff digunakan untuk ketohesksosa. Reagen Ini terdiri dari resorsinol (C6H4(OH)) dalam 6M HCl. Konsentrasi asam klorida memungkinkan ketosa mengalami dehidrasi dibandingkan aldoses dan lebih lanjut membentuk produk merah ceri. Ketose mengandung senyawa dapat menghasilkan hasil yang positif, Fruktose dan sukrosa adalah ketosa sementara laktosa, glukosa, xilosa, dan galaktosa adalah aldosa.
Tabel 2.1 Hasil uji Selliawanof (Caragay et al., 2013).
Gambar 2.9 Reaksi uji Selliwanof (http://www.harpercollege.edu/tm- ps/chm/100/dgodambe/thedisk/carbo/seli/seli.htm)
Gambar 2.10 Hasil uji Selliwanof negatif (kiri) dan uji positif (kanan) (http://www.harpercollege.edu/tm-ps/chm/100/dgodambe/the disk/carbo/seli/seli.htm)
Gula Hasil pengamatan
Fruktosa Produk merah ceri
Laktosa Larutan kuning
Glukosa Larutan kuning
Xilosa Larutan kuning
Sukrosa Produk merah ceri
Pati Larutan kuning
2.5.5. Uji Bial
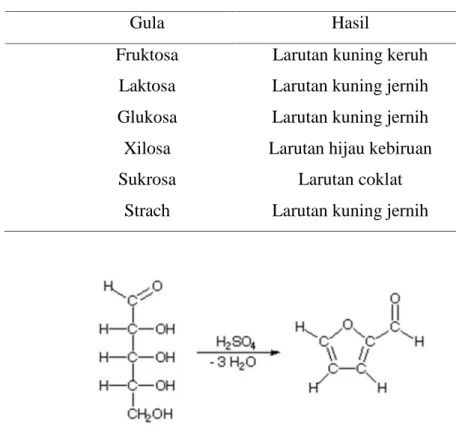
Tes Orsinol Bial menunjukkan hasil yang positif untuk pentosa dan digunakan untuk membedakan pentosa dari heksosa. Reagen Bial terdiri dari orsinol, konsentrasi. (asam klorida) HCl, dan (ferric chloride) FeCl. Pentosa diperbolehkan untuk dehidrasi unggul untuk furfural yang mengembun orsinol dan ferric ion membentuk solusi hijau biru.
Tabel 2.2. Hasil uji Orsinol Bial (Caragay et al., 2013).
Gambar 2.11 Reaksi uji Bial (http://www.harpercollege.edu/tm- ps/chm/100/dgodambe/thedisk/carbo/bial/bials.htm)
Gula Hasil
Fruktosa Larutan kuning keruh Laktosa Larutan kuning jernih Glukosa Larutan kuning jernih Xilosa Larutan hijau kebiruan
Sukrosa Larutan coklat
Strach Larutan kuning jernih
2.5.6. Uji Iodium
Amilosa dalam pati bertanggung jawab untuk pembentukan warna biru di hadapan yodium. Molekul Iodium berada dalam kumparan amilosa. Iodium sangat tidak larut dalam air, oleh karena reagen Iodium dibuat dengan melarutkan Iodium dalam air dengan kalium iodida. Hal ini membuat triiodida kompleks ion linear dengan larut. Ion ion triiodida tergelincir ke dalam kumparan pati yang menyebabkan warna hitam biru intens.
Gambar 2.13 Pembentukan kompleks biru iod amilum
(www.elmhurst.edu/vchembook/548strachiodine.html) 2.6. Identifikasi Karbohidrat
2.6.1. Uji untuk karbohidrat, disakarida dan monosakarida dalam kertas tisu dan faunated dan defaunated cacing tanah
Dari tes untuk karbohidrat, disakarida dan monosakarida dalam kertas tisu dan florated dan defaunated cacing tanah, uji Molisch ini menunjukkan adanya karbohidrat di kedua kertas tisu segar dan egested. Hasil negatif dari uji Benedict ditambah dengan hasil positif dari uji Barfoed ini menunjukkan bahwa kertas tisu tersebut tertelan telah dicerna luar disakarida ke level monosakarida. Uji Seliwanoff juga menegaskan bahwa produk pemecahan adalah fruktosa monosakarida (Tabel 2.3).
Tabel 2.3 Reaksi dari kertas tisu dan pelet feses dari faunated dan defaunated cacing tanah untuk uji karbohidrat yang berbeda (Aladesida et al., 2013).
Uji Kertas tisu Egested matter by
faunated earthworms
Egested matter by defaunated earthworms
Molisch positif positif positif
Benedict negatif negatif negatif
Barfoed positif positif positif
Selliwanof positif positif positif
Hasil ini menunjukkan bahwa karbohidrat hadir di kedua kertas tisu segar dan egested. Hasil positif dari Barfoed dan Seliwanoff tes pada kertas tisu egested dari kedua cacing tanah faunated dan defaunated menunjukkan bahwa meskipun berkemih dari mikroflora usus dalam cacing tanah defaunated, mereka masih mampu memecah selulosa menjadi monosakarida dan khusus untuk fruktosa sebanyak cacing tanah faunated. Hal ini menunjukkan bahwa selulosa yang diproduksi di cacing tanah ini adalah dari baik endogen dan eksogen sumber. Tes yodium pada bahan egested negatif, menunjukkan bahwa selulosa tidak dikonversi dengan pati (Aladesida et al., 2013).
2.6.2. Uji gula pada nanas
Tiga reagen yang berguna untuk karakterisasi gula adalah reagen Benedicts, Reagen Phenylhydrazine dan Selliwanoff. Hasil sebagai berikut diperoleh ketika pengujian terhadap sampel yang disebutkan di atas gula.
Tabel 2.4 Hasil uji dengan gula pada nanas dengan tiga reagen (Okonkwo et al., 2012)
Reagen dan uji Pengamatan
2.6.3. Identifikasi karbohidrat pada kentang
Uji Molisch adalah tes umum untuk karbohidrat. Hasil positif adalah interfase violet yang disebabkan oleh dehidrasi karbohidrat oleh asam sulfat untuk menghasilkan aldehida, yang kemudian mengembun dengan dua molekul fenol (α-naftol) untuk membentuk produk
berwarna ungu. Pati yang diekstrak dari kentang menghasilkan hasil positif ini.
Tabel 2.5 Hasil Tes Umum untuk polisakarida (Caragay et al., 2013).
Uji Hasil
Uji Molisch Cincin ungu (+)
Raksi Iodium Warna merah (+)
2.6.4. Identifikasi karbohidrat pada ubi ganyong
Pada uji ini menghasilkan endapan merah bata yang menandakan adanya gula pereduksi pada sampel. Endapan yang terbentuk dapat berwarna hijau, kuning atau merah bata tergantung pada konsentrasi gula reduksinya. semakin berwarna merah bata maka gula reduksinya semakin banyak. Terlihat bahwa pati ganyong yang sudah dihidrolisis berwarna merah bata dibandingkan tepung, hal ini menandakan bahwa pati yang terhidrolisis mengandung gula reduksi yang lebih banyak.
glukosa sukrosa fruktosa maltosa manosa
tepung tepung ganyong pati pati ganyong
ganyong hasil hidrolisis ganyong hasil hidrolisis
Gambar 2.14 Hasil uji Benedict tepung dan pati umbi ganyong (Kusbandari, 2015) sampel
standart
2.6.5. Pengaruh pelarut dalam ekstraksi terhadap hasil uji karbohidrat
Tes untuk karbohidrat menunjukkan adanya jumlah yang sangat rendah karbohidrat di petroleum eter dibandingkan dengan ekstrak lainnya. Namun, tes Fehling negatif hanya dalam petroleum eter dan uji Barfoed adalah negatif baik dalam kasus petroleum eter dan ekstrak kloroform menunjukkan tidak adanya gula pereduksi. Tes Seliwanoff ini menunjukkan adanya gula keto di semua ekstrak menunjukkan jumlah rendah di ekstrak petroleum eter.(Roopalatha & Vijay, 2013).
Tabel 2.6 Ringkasan dari uji atau reaksi di praktikum biokimia (http://site.iugaza.edu.ps/).
Seny awa
Reaksi Uji Hasil uji positif untuk
contoh Pengamatan
dan warna
K A R B O H I D R A T
Uji Molisch’s Karbohidrat Semua karbohidrat Cincin ungu (violet)
Uji Anthron Karbohidrat Semua karbohidrat Kehijauan atau hijau kebiruan
Uji Benedict's Gula pereduksi Semua
mono/disakarida kecuali sukrosa
Endapan merah Uji Barfoed's Reaksi dengan
monosakarida lebih cepat dibanding disakarida
semua monosakarida Endapan merah
Uji asam pikrat Gula pereduksi Semua
mono/disakarida kecuali sukrosa
Merah
Phenyl Hydrazine Reaction
Gula pereduksi Semua
mono/disakarida kecuali sukrosa
Kristal kuning
Uji Bial's (Orcinol)
Pentosa Xilosa , Aribinosa , Ribosa
Hijau kebiruan Uji Anilin Asetat Pentosa Xilosa , Aribinosa ,
Ribos
Bright red color Uji Seliwanoff's
(Resorcinol)
Ketosa dan disakarida yang
mengandung ketosa
Fruktosa , Sukrosa Merah ceri
Uji iodium ploisakarida pati , Dekstrin , Glikogen , selulosa
-Biru dengan pati
-Biru kemerahan / Ungu dengan dekstrin
-Merah dengan glikogen -Tidak berwarna dengan selulosa
Mucic Acid Test Galaktosa dan gula yang menghasilkan galaktosa saat dihidrolisis
-Galaktosa -laktosa
Raffinosa setelah hidrolisis
Kristal putih berpasir
BAB III KESIMPULAN
1. Adanya karobohidrat dalam sampel dapat diketahui dengan terbentuknya cincin berwarna ungu sampel yang di uji dengan pereaksi Molisch.
2. Dalam uji iodium, pati/amilum akan menghasilkan warna biru (kompleks biru iod amilum).
3. Gula reduksi pada suatu karbohidrat dapat dibuktikan dengan terbentuknya endapan berwarna merah bata pada dedak, jagung, maltosa, fruktosa, glukosa. Sedangkan pada amilum dan sukrosa berwana biru.
4. Monosakarida dan disakarida dapat dibedakan dengan terbentuknya endapan merah bata pada monosakarida sedangkan pada disakarida tidak terbentuk endapan merah bata dengan uji Barfoed.
5. Pada pengujian ketosa dengan uji Seliwanoff dibuktikan dengan terbentuknya senyawa kompleks berwarna merah orange pada fruktosa dan sukrosa sehingga mengandung ketosa.
DAFTAR PUSTAKA
Aladesida, A.A., Owa, S.O., Dedeke, G.A., Osho, B.A. & Adewoyin, O.A. 2013. Cellulase Sources in the Eudrilid Earthworm, Eudrilus Eugeniae. J. Chem. Bio. Phy. Sci., 3(3):1829- 1834.
Andarwulan, N., Kusnandar, F & Herawati, D. 2011. Analisis Pangan. Dian Rakyat. Jakarta.
Anonymous, 2014. Molisch's Test. https://en.wikipedia.org/wiki/Molisch's test
Arya, Meenakshi & L J.M. Rao. 2007. An Impression of Coffe Carbohydrates. Cri. Rev. In Food Sci. Nutr., 47(1):51-67.
Asif, H. M., M. Akram, T. Saeed, M.I. Khan, N. Akhtar, R. ur Rehman, et al. 2011.
Carbohydrates . Int. Res. J. Biochemistry and Bioinformatics, 1(1):001-005.
Caragay, C.A., et al. 2013. Isolation, Hydrolysis and Color Reactions of Starch from Potato.
PH BIOCHEM, Manila.
Hamidjojo, H.S. 2005. Kimia Organik. Gadjah Mada University Press. Yogyakarta.
http://www.harpercollege.edu/tm-ps/chm/100/dgodambe/thedisk/carbo/barf/barfoed.htm http://www.harpercollege.edu/tm-ps/chm/100/dgodambe/thedisk/carbo/bene/benedict.htm http://www.harpercollege.edu/tm-ps/chm/100/dgodambe/thedisk/carbo/bial/bials.htm
http://www.harpercollege.edu/tm-ps/chm/100/dgodambe/thedisk/carbo/molisch/molisch.htm http://www.harpercollege.edu/tm-ps/chm/100/dgodambe/thedisk/carbo/seli/seli.htm
https://id.wikipedia.org/wiki/Karbohidrat
Kaminska, A.S., Matysik, G., Kosior, M.W., Donica, H., & Sowa, I. 2009. Thin Layer Chromatography Of Sugars In Plant Material. Annales Universitatis Mariaecurie Sklodowska, 22(42).
Kusbandari, Aprilia. 2015. Analisis Kualitatif Kandungan Sakarida Dalam Tepung Dan Pati Umbi Ganyong (Canna edulis Ker.) Pharmaҫiana, 5(1):35-42.
Manatar J.E., J. Pontoh, M.R.J. Runtuwene. 2012. Analisis Kandungan Pati Dalam Batang Tanaman Aren (Arenga pinnata). Jurnal Ilmiah Sains, 12(2):89-92.
Mastuti, Endang & Dwi Ardiana S. 2010. Pengaruh Variasi Temperatur Dan Konsentrasi Katalis Pada Kinetika Reaksi Hidrolisis Tepung Kulit Ketela Pohon. Ekuilibrium, 9(1):23 27.
Okonkwo S.I., Ogbuneke R.U., & Uyo B.K. 2012. Elucidation of Sugar in Edible Fruit– Pineapple (Ananas Comosus). J. Chem. Sci., 2(1), 20-24.
Pinder, R. S., J.A. Patterson, C.A.O’bryan, P.G. Crandall, & S.C. Ricke. 2012. Dietary Fiber Content Influences Soluble Carbohydrate Levels in Ruminal Fluids.Journal of
Environmental Science and Health, 47:710–717.
Roopalatha, U.C. & V.M. Nair. 2013. The Phytochemical Screening Of The Pericarp Of Fruits Of Terminalia Chebula Retz. Int. J. Pharm. Bio. Sci., 4(3):550-559.
Sastrohamidjojo. H., 2005. Kimia Organik, Stereokimia, Karbohidrat, Lemak, dan Protein.
Gadjah Mada University Press. Yogyakarta.
Sudarmadji, S., Haryono, B., & Suhardi. 2004. Analisa Bahan Makanan dan Pertanian.
Liberty. Yogyakarta.
Westman, E. C., R.D. Feinman, J.C. Mavropoulos, M.C. Vernon, J.S. Volek, J.A. Wortman, et al. 2007. Low-Carbohydrate Nutrition And Metabolism. Am. J. Clin. Nutr., 86:276–84.
Winarno, F.G. 2004. Kimia Pangan dan Gizi. Gramedia. Jakarta.
www.elmhurst.edu/vchembook/548strachiodine.html
Yusrin & Ana H.M. 2010. Proses Hidrolisis Onggok Dengan Variasi Asam Pada Pembuatan Ethanol. Prosiding semninar nasional unimus (http://jurnal.unimus.ac.id).